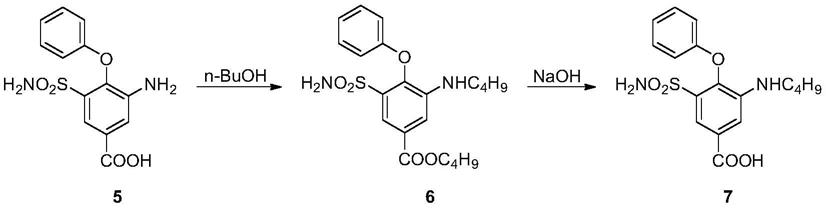
一种虫草真菌新种及其分离鉴定方法
1.本发明生物材料样品保藏单位名称为:中国科学院微生物研究所,保藏单位地址为:北京市朝阳区北辰西路1号院3号,保藏日期为:2021年08月09日,保藏编号为:cgmcc no.23076,分类命名为:虫草菌cordyceps sp.。
技术领域
2.本发明涉及虫草菌分离鉴定技术领域,特别涉及一种虫草真菌新种及其分离鉴定方法。
背景技术:
3.我国有着丰富的虫草资源,中国已报道虫草130多种,但还有很多未被发现或记录,如冬虫夏草(c.sinensis)、蛹虫草(c.militaris)和蝉棒束孢(isaria tenuipes)等是几种常见的虫草属真菌[黄罗冬,马玉凤,王玥等.细虫草资源研究现状及开发利用进展[j].食用菌学报,2019,26(02):141
‑
151.梁宗琦.中国真菌志.第三十二卷.虫草属[m].北京:科学出版社.2007:1
‑
190]。虫草因其寄主种类和子座形态具有一定差异,而具有复杂的形态特征。因此根据虫草的形态特征可以初步对虫草进行分类鉴定,同时在鉴定虫草时,形态鉴定也较其它方式更方便快捷[贺瑞红.拟黑虫草形态学、遗传分化及区系真菌多样性研究[d].山西大学,硕士论文,2019.07.]。但是,正因为虫草形态特征的复杂,所以仅依靠传统形态学方法难以准确进行鉴定及正确分类。
[0004]
目前,形态学鉴定结合分子生物学鉴定的方法广泛应用于虫草属真菌的物种鉴定中。6个基因序列片段进行系统发育分析,对物种的鉴定更准确。虫草属真菌的物种鉴定及分类地位对其活性成分、药理作用和产品开发等相关研究具有重要意义(sung gh,hywel
‑
jones nl,sung jm,et al.phylogenetic classification of cordyceps and the clavicipitaceous fungi[j].sudies in mycol,2007,57(01):5
‑
59.陈自宏.兰坪虫草生物学研究[d].云南大学,博士论文,2013,12
‑
21.)。
[0005]
虫草属真菌因含有多种活性成分,如虫草素、多糖、超氧化物歧化酶、虫草酸、麦角甾醇、蛋白质、类黄酮、氨基酸等,故具有重要的食药用价值和研究开发潜力。相关研究表明,虫草酸(d
‑
甘露醇)具有抗肿瘤、利尿、抗氧化、促进新陈代谢等积极作用,可预防与治疗脑血栓、脑出血、心肌梗塞等疾病[万琴,刘向阳,王松涛.蛹虫草液体发酵及其应用的研究进展[j].食品与发酵科技,2017,53(1):88
‑
91,114.];黄酮类化合物具有抗氧化、调节免疫系统等能力,并可以通过消除自由基、诱导某些细胞凋亡和调节免疫系统等方式达到抗肿瘤作用[王薇.虫草its序列分子进化分析及其复合营营养液的体外细胞作用研究[d].西南交通大学,硕士论文,2012,19
‑
25.];虫草多糖对抗氧化、抗衰老和维持肠道形态等具有积极作用。
[0006]
由于野生虫草资源有限,人工栽培虫草具有时间长、易退化、难以掌握栽培技术等特点,无法获得大量的生物活性物质,难以满足当前市场需求。通过液体培养的方式,既可以提高生产效率,又可以提高产量,在快速获取大量菌丝体的同时也可以从菌丝体和发酵
液中提取各种生物活性物质[liu,a.
‑
j.,and zhang,y.
‑
m.structural properties of polysaccharides from cultivated fruit bodies and mycelium of cordyceps militaris,carbohydrate polymers,2016,142:63
‑
72.冉茂芳.蛹虫草液体发酵及其活性提取物对小鼠肠道和生理的影响研究[d].重庆大学,硕士论文,2019,3.]。研究发现,一些虫草真菌的发酵菌丝体与真菌子实体具有相似的药理作用,并已广泛应用于各种食品保健品中。
技术实现要素:
[0007]
本发明所要解决的技术问题:本发明利用形态学和分子生物学方法(its、tef
‑
1序列)对虫草属三种野生虫草真菌进行系统发育分析,准确鉴定物种,在此基础上对三种虫草液体培养菌丝体中的虫草酸、黄酮、多糖和氨基酸含量以及自由基清除率进行比对。
[0008]
为解决上述技术问题,本发明提供以下的技术方案:
[0009]
一种虫草真菌新种,所述虫草真菌新种为虫草菌(cordyceps sp.)ch01,保藏单位地址为:北京市朝阳区北辰西路1号院3号,保藏日期为:2021年08月09日,保藏编号为:cgmcc no.23076。
[0010]
一种虫草真菌新种的分离方法,步骤如下:
[0011]
(1)采集虫草子实体及虫体,使用锡纸包裹采集样品放于采集盒中;在45℃烘箱中烘干,干燥后样品连同标签放入塑封袋保存;
[0012]
(2)采用组织分离法分离出采集样品的虫体内菌丝:利用流水冲洗新鲜虫体表面数次,除去表面泥土,再用75%酒精对虫体表面初步消毒;在无菌条件下,用刀片切开虫体表面,使用镊子尖端镊取虫体内部少许菌丝,并迅速接种于pda固体培养基中,将培养基放置于28℃的培养箱中倒置培养,隔天观察一次,及时处理被杂菌污染的平板;菌丝初生长时,利用平板划线法将无污染的菌丝转接到新的pda培养基中进一步培养;将纯化后的菌丝接种至pda斜面试管中,置于
‑
20℃冰箱内保存。
[0013]
一种上述虫草真菌新种的鉴定方法,其特征在于:具体步骤如下:
[0014]
(1)形态学鉴定:观察并详细记录虫草样品的宏观形态特征,包括子座长度,可育部颜色、形状、长度、直径,菌柄颜色、长度、直径,寄主类型,参照《中国大型菌物资源图鉴》初步鉴定至属或种;记录所分离出菌株的菌落特征,包括形态、颜色和质地;
[0015]
(2)分子鉴定:
[0016]
a、提取虫草样品的基因组dna;
[0017]
b、以基因组dna为模板pcr扩增its和tef
‑
1序列;
[0018]
c、pcr产物测序所得结果在seqman进行拼接,在genbank中对拼接后的序列进行比对分析。所述pcr扩增的引物序列为:
[0019]
引物名称引物序列its1
‑
f/its45'
‑
cttggtcatttagaggaagtaa
‑
3'/5'
‑
tcctccgcttattgatatgc
‑
3'tef1
‑
983f/tef1
‑
2218r5'
‑
gcyccygghcaycgtgayttyat
‑
3'/5'
‑
atgacaccracrgcracrgtytg
‑
3'
[0020]
所述比对分析具体方法为:序列排序使用mafftv.6在线进行,在geneious v.7.0.6中用gblocks将空格、内含子和不清楚的序列鉴定和移除;系统发育树共采用83条序列进行最大相似性和贝叶斯分析,5条序列来自采集样品,77条序列下载自genbank。系统
发育树分析采用tolypocladium inflatum和t.cylindrosporum两条序列作为外类群,最大相似性分析利用raxml v8.2.12中软件中gtrgamma核基因模型进行;利用mrbayes v3.1软件完成贝叶斯分析;用figtree v1.4.2软件打开系统发育树并用ai进行编辑。
[0021]
本发明获得的有益效果:
[0022]
本发明运用形态和分子相结合的方法准确分离鉴定出三株野生虫草菌株,其中hgf01、xj46分别是柱状虫草和蝉花,ch01是新种,并在此基础上进行液体培养菌丝体中虫草酸、黄酮和多糖成分检测。三种虫草菌丝体中均含有虫草酸、黄酮和多糖成分,ch01中的虫草酸、黄酮和多糖成分含量与柱状虫草和蝉花相当,不具有显著性差异,具有与柱状虫草和蝉花相同的保健食用价值。再次基础上ch01菌丝中的部分氨基酸种类的含量显著高于柱状虫草和蝉花,且自由基的清除率在一定浓度下显著高于柱状虫草和蝉花,具有较好的氧化功效。
附图说明
[0023]
图1为甘露醇标准液标准曲线。
[0024]
图2为芦丁标准液标准曲线。
[0025]
图3为葡萄糖标准品标准曲线。
[0026]
图4为虫草子实体对比图;其中,a):野生柱状虫草hgf01;b):野生ch01;c):野生蝉花xj46;比例尺为1.0cm。
[0027]
图5为虫草菌固体培养菌落对比图。其中,d):柱状虫草固体培养菌落;e):ch01固体培养菌落;f):蝉花固体培养菌落;比例尺为1.0cm。
[0028]
图6为虫草菌液体培养菌丝体对比图。其中,左图g):柱状虫草液体培养菌丝体;中图h):ch01液体培养菌丝体;右图i):蝉花液体培养菌丝体;比例尺为1.0cm。
[0029]
图7为三种虫草属真菌及其相关种6个序列最大相似性和贝叶斯发育树;
[0030]
其中,支持率左边的数值表示最大相似性大于70%的数值,右边的数值表示贝叶斯分析大于0.85的数值,比例尺代表每个位点核苷酸变化的期望值。
[0031]
图8为液体培养三种虫草的菌丝体对dpph的清除作用统计图。
[0032]
图9为扩增反应产物的琼脂糖凝胶电泳检测结果图。
具体实施方式
[0033]
下面通过对实施例的描述,对本发明的具体实施方式作进一步详细的说明,以帮助本领域的技术人员对本发明的发明构思、技术方案有更完整、准确和深入的理解。
[0034]
实施例1:
[0035]
1.虫草样品的获得:
[0036]
野生新鲜虫草样品(编号为xj46、hgf01和ch01),分别采自浙江省仙居县、黄山猴谷和大别山鹞落坪。仙居县位于浙江。其丘陵山地占据1612km2,年平均气温18.3℃,7月份平均气温28.5℃,植物种类丰富。黄山猴谷位于安徽省黄山市,处于亚热带季风气候区。由于山体海拔高,山谷深,南北坡差异大,地形复杂,形成了湿度较大、降水较多的气候特点。7
‑
10月份平均温度为25℃。大别山鹞落坪自然保护区位于安徽省西部,植物区系十分复杂,森林覆盖率高。
[0037]
2.实验方法
[0038]
2.1样品采集与记录
[0039]
采集时间在2018年和2019年间7月
‑
10月,在林间发现虫草后,拍照记录形态特征和生境,小心挖出虫草子实体及虫体,使用锡纸包裹采集样品放于采集盒中,带回实验室。当天观察并描述记录其更为详细的子座和寄主形态学特征。描述并记录完毕的样品,取部分置变色硅胶中干燥(用于分子鉴定),其余部分在45℃烘箱中烘干,干燥后样品连同标签放入塑封袋保存。
[0040]
2.2菌丝分离、纯化及菌种保藏
[0041]
采用组织分离法分离出采集样品的虫体内菌丝。利用流水冲洗新鲜虫体表面数次,除去表面泥土,再用75%酒精对虫体表面初步消毒。在无菌条件下,用刀片切开虫体表面,使用镊子尖端镊取虫体内部少许菌丝,并迅速接种于pda固体培养基中,将培养基放置于28℃的培养箱中倒置培养,隔天观察一次,及时处理被杂菌污染的平板。菌丝初生长时,利用平板划线法将无污染的菌丝转接到新的pda培养基中进一步培养。采将纯化后的菌丝接种至pda斜面试管中,置于
‑
20℃冰箱内保存。
[0042]
2.3形态学鉴定
[0043]
观察并详细记录虫草样品的宏观形态特征:子座长度,可育部颜色、形状、长度、直径,菌柄颜色、长度、直径,寄主类型,参照《中国大型菌物资源图鉴》初步鉴定至属或种。记录所分离出菌株的菌落特征,包括形态、颜色和质地等,大小描述以均值
±
标准差(最小值
‑
最大值)表示。
[0044]
2.4分子鉴定
[0045]
2.4.1 dna提取
[0046]
根据形态特征对样品的子实体及其所分离出的菌株进行了初步分类和鉴定,然后通过its、tef
‑
1序列在分子水平上进行进一步鉴定。纯化的虫草菌丝体dna则利用真菌基因组提取试剂盒进行提取。取适量纯化后的菌丝体于1.5ml无菌离心管中,加入液氮并用研磨棒充分研磨后根据郭梁等人的方法步骤提取dna。
[0047]
2.4.2 pcr扩增
[0048]
pcr扩增反应体系包括taq pcr master mix、上下游引物(its1
‑
f/its4、tef1
‑
983f/tef1
‑
2218r)、sterilized ddh2o、模板。引物序列如表所示,pcr扩增反应条件:94℃变性4min,然后连续35循环,94℃变性40s,(50℃)退火40s,72℃延伸150s。对于primerits1
‑
f和its4引物,94℃变性3min,然后连续35循环,95℃变性30s,(52℃)退火1min,72℃延伸1min,循环结束后72℃延伸10min。扩增反应产物利用琼脂糖凝胶电泳进行检测(如图9),将所得序列送滁州通用测序公司进行双向测序。
[0049]
表2
‑
1引物名称与序列
[0050]
引物名称引物序列its1
‑
f/its45'
‑
cttggtcatttagaggaagtaa
‑
3'/5'
‑
tcctccgcttattgatatgc
‑
3'tef1
‑
983f/tef1
‑
2218r5'
‑
gcyccygghcaycgtgayttyat
‑
3'/5'
‑
atgacaccracrgcracrgtytg
‑
3'ns1/ns45
’‑
gtagtcatatgcttgtctc
‑3’
/5
’‑
cttccgtcaattcctttaag
‑3’
[0051]
2.4.3 dna序列比对分析与系统发育树构建
[0052]
测序所得结果在seqman进行拼接(结果见表2
‑
2),在genbank中对拼接后的序列进
行比对分析。序列排序使用mafftv.6在线进行,在geneious v.7.0.6中用gblocks将空格、内含子和不清楚的序列鉴定和移除。系统发育树共采用83条序列进行最大相似性和贝叶斯分析,5条序列来自本实验采集样品,77条序列下载自genbank。系统发育树分析采用tolypocladium inflatum和t.cylindrosporum两条序列作为外类群,最大相似性分析(ml)利用raxml v8.2.12中软件中gtrgamma核基因模型进行。利用mrbayes v3.1软件完成贝叶斯分析[方媛.云南丝膜菌书真菌分子系统发育研究.云南大学,硕士论文,2019:1
‑
96.]。用figtree v1.4.2软件打开系统发育树并用ai进行编辑。
[0053]
表2
‑
2 pcr产物测序拼接后的序列结果
[0054]
[0055][0056]
2.5液体培养
[0057]
在无菌条件下,将纯化后的三种虫草菌丝从pda固体培养基接种于液体培养瓶中(250ml),23℃条件下150r/min培养7d,每种虫草各设置三个重复。培养得到的菌丝体经过清洗、过滤和60℃烘干后,充分研磨成粉状。
[0058]
2.6有效成分研究
[0059]
2.6.1待测样品制备
[0060]
待测虫草酸的样品溶液:使用热水提取法提取虫草酸。准确称取0.20g虫草干燥菌丝体粉末,加入16ml蒸馏水,沸水浴2h,抽滤留滤液,后用蒸馏水定容至100ml。
[0061]
待测黄酮的样品溶液:通过超声波提取法提取三种虫草菌丝体中的总黄酮。准确称量0.20g虫草菌丝体粉末,以12ml 85%乙醇为溶剂,超声波提取(30℃,30min),抽滤留滤液,用85%乙醇定容至100ml。
[0062]
待测多糖的样品溶液:多糖提取同虫草酸提取方法相同,使用热水提取法提取。精密称取各虫草菌丝体粉末0.20g,沸水浴浸提2h,过滤保留滤液,滤液加4倍体积乙醇,置于4℃冰箱中静置12h,将沉淀物置于60℃烘箱中烘干后用蒸馏水溶解(活性炭脱色),定容至100ml。
[0063]
2.6.2标准曲线制作
[0064]
甘露醇标准曲线制作:参照邵颖,李文,王陶.蛹拟青霉发酵菌丝体中虫草酸的提取与测定[j].食品工业科技,2012,33(01).制作标准曲线的方法,绘制标准曲线(如图1所示)。
[0065]
芦丁标准曲线制作:参照葛琦.金蝉花成分分析及多糖抗氧化活性研究[d].江苏大学,硕士论文,2019:13
‑
18.,制作标准曲线的方法,绘制标准曲线(如图2所示)。
[0066]
葡萄糖标准曲线制作:参照刘城移,郝心怡,林沛霖等.1株野生蝉虫草的鉴定及其胞内和胞外多糖抗肝癌活性比较[j].西北农林科技大学学报(自然科学版),2020,48(12):117
‑
126.的方法配制葡萄糖标准溶液,绘制标准曲线(如图3所示)。
[0067]
2.6.3虫草酸、黄酮和多糖测定
[0068]
采用分光光度法、硝酸铝比色法和硫酸
‑
蒽酮法分别测定三种虫草待测样品中的虫草酸、黄酮和多糖含量,并依据标准曲线计算菌丝体虫草酸、黄酮和多糖含量。
[0069]
2.6.4统计分析
[0070]
利用statistica统计软件对测定出的虫草酸、黄酮和多糖含量进行基础分析,包括平均值和标准差(sd)。对上述三种成分进行基础分析后使用one
‑
way anvoa
‑
tukey hsd分析虫草酸、黄酮和多糖含量在三种虫草菌丝体之间是否具有显著性差异及三种虫草菌丝体中虫草酸、黄酮和多糖含量是否具有显著性差异。
[0071]
3.1物种鉴定
[0072]
3.1.1子实体及菌落特征
[0073]
hgf01为虫草属真菌,无明显子座特征,菌体覆盖整个蜘蛛表面,孢子为粉状紫色,寄主为蜘蛛,近似为椭圆形,长轴长5.0cm,短轴长3.86cm(图4
‑
a)。hgf01固体培养菌落初期为白色毛绒状菌丝,后期菌落中央逐渐长出淡紫色粉状孢子,菌落背面呈白色、平展状(图5
‑
d)。ch01子实体总长度1.96
±
0.73cm(1.14
‑
2.71cm)(不包括寄主长度),呈圆柱形,淡黄色,寄主为鳞翅目昆虫茧(图4
‑
b)。ch01固体培养菌落初期为白色毛绒状菌丝,后期菌丝明显伸长且为橙黄色,菌落背面为深黄色,较为平展(图5
‑
e)。xj46子实体由蝉蛹头部长出。子实体总长度2.38
±
1.13cm(1.14
‑
3.86cm),寄主为蝉蛹(图4
‑
c)。xj46固体培养菌落初期为纯净白色绒毛状菌丝,后期有淡黄色孢子散落,菌落背面无褶皱(图5
‑
f)。三种虫草菌液体培养的培养瓶中长出大小0.5
‑
2.8cm的菌丝团,密度适中且分布均匀(如图6所示)。
[0074]
3.1.2分子鉴定
[0075]
表3
‑
1用于系统发育树构建的种名及genbank号
[0076]
[0077]
[0078][0079]
its和tef
‑
1序列在ncbi数据库中比对结果和基于its和tef
‑
1序列所建立的系统发育树结果(如图7所示)显示,hgf01与c.cylindrica lc008212 its序列和c.cylindrica lc008347 tef
‑
1序列相似度分别为100%,99%。hgf01与c.cylindrica聚为一支,最大相似性分析支持率为100%,贝叶斯分析为1;xj46与c.cicadae kf740422 its和c.cicadae mk770632 tef
‑
1序列相似度均为100%。xj46与c.subtenuipes聚为一支,最大相似性分析支持率为100%,贝叶斯分析为1;hgf01和xj46序列比对结果与发育树结果一致。ch01与c.takamontana mf361939 its序列和c.tenuipes mh521911tef
‑
1序列相似度分别为99%,100%。然而,ch01单独聚为一支,最大相似性分析支持率为90%,贝叶斯分析为0.961,且与本实验样品及c.takamontana距离较远。根据形态学和分子鉴定以及系统发育树综合结果,可以确定xj46是蝉花,hgf01是柱状虫草,ch01是虫草属新种。
[0080]
3.2三种虫草成分含量及其差异
[0081]
表3
‑
2三种虫草属真菌虫草酸、黄酮和多糖含量及其显著性差异
[0082]
[0083][0084]
注:成分含量以平均值
±
sd表示;*表示p<0.05,差异性显著;**示p<0.01,差异性极显著
[0085]
分别以虫草酸、黄酮和多糖为因子,分析三种虫草成分含量及其显著性差异。在虫草酸含量上,柱状虫草(0.52mg/g)、蝉花(0.63mg/g)和ch01(0.82mg/g)三者之间均不存在显著性差异。ch01虫草酸含量高于柱状虫草和蝉花,但三者虫草酸含量均小于1mg/g。黄酮含量检测数据显示,柱状虫草、蝉花和ch01新种三者之间均不存在显著性差异,ch01新种(0.05mg/g)高于柱状虫草(0.04mg/g)和蝉花(0.02mg/g),并且ch01的黄酮含量约是蝉花的2倍。在多糖含量上,蝉花与ch01之间存在显著性差异(p<0.01,df=6.00),而柱状虫草与ch01和蝉花均不具有统计学差异。蝉花多糖含量(56.09mg/g)显著高于ch01(27.22mg/g),且蝉花的多糖含量约为ch01的2倍。柱状虫草的多糖含量为44.40mg/g(表3
‑
2)。
[0086]
3.3三种虫草氨基酸组成和含量
[0087]
利用氨基酸自动分析仪检测出三种虫草菌丝体内所含氨基酸均为十七种,柱形虫草、蝉花、ch01菌丝体中的天冬氨酸、苏氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、缬氨酸、异亮氨酸、亮氨酸、络氨酸、苯丙氨酸、组氨酸、色氨酸及精氨酸十四种氨基酸之间无统计学差异,而半胱氨酸、甲硫氨酸及赖氨酸三种氨基酸之间存在差异。半胱氨酸上,ch01菌株与柱形虫草和蝉花之间存在显著性差异(p<0.05),蝉花与柱形虫草之间不存在显著性差异。ch01菌株(0.583%)的半胱氨酸含量显著高于柱形虫草(0.097%)和蝉花(0.068%),其中ch01菌株约为柱形虫草的6倍,为蝉花的9倍。柱形虫草中的甲硫氨酸含量(0.287%)显著高于蝉花(0.030%)(p<0.05),而ch01菌株(0.121%)与柱形虫草和蝉花均不具有统计学差异。在赖氨酸的含量上,蝉花(55.813%)与ch01菌株(1.382%)和柱形虫草(1.112%)之间均存在极显著性差异(p<0.01),而ch01菌株与柱形虫草之间不存在统计学差异。其中蝉花的赖氨酸含量显著高于ch01菌株和柱形虫草,约为二者的55倍(表3
‑
3,表3
‑
4)。
[0088]
表3
‑
3蝉花、ch01菌株、柱形虫草三种菌丝体内17种氨基酸的平均含量(%)
[0089][0090]
表3
‑
4蝉花、ch01菌株、柱形虫草三种菌丝体内17种氨基酸的显著性差异
[0091]
[0092]
[0093][0094]
注:*表示p<0.05,显著性差异;**表示p<0.001,极显著性差异。
[0095]
3.4三种虫草的dpph清除能力
[0096]
按照参考文献:朱蕴兰,陈宏伟,陈安徽等.蛹拟青霉发酵金针菇菇柄过程中主要活性物质及抗氧化活性的动态变化[j].食品研究与开发,2020,41(04):19
‑
26.的方法,测得虫草dpph清除率,重复实验三次,取平均值。测得液体培养三种虫草的菌丝体对dpph的清
除作用,以浓度为横坐标、清除率为纵坐标建立如图8曲线。从图8中可看出,蝉花在浓度小于0.24mg/ml时,随着虫草菌丝体菌粉溶液浓度的升高,dpph的清除率呈下降趋势;在浓度为0.24mg/ml时达到清除率的极小值19.56%;在浓度大于0.24mg/ml时,清除率随浓度的升高呈逐渐增大的趋势。柱形虫草在0.08~0.24mg/ml浓度内,dpph的清除率随虫草菌丝体浓度的升高而减小,达到极小值18.47%;在0.24~0.32mg/ml浓度内,清除率随浓度升高而增大;在0.32~0.40mg/ml浓度内,清除率随浓度升高而减小。ch01菌株在0.08~0.16mg/ml,dpph的清除率随虫草菌丝体浓度的升高而减小,达极小值18.66%;在0.16~0.24mg/ml浓度内,清除率随浓度的升高而增大;在0.24~0.32mg/ml浓度内,清除率随浓度升高而减小;在0.32~0.40mg/ml浓度内,清除率随浓度的升高而增大。
[0097]
4.1三种虫草的形态和分子物种鉴定
[0098]
本发明基于形态学和分子生物学的方法对三种野生虫草属真菌进行准确鉴定,鉴定结果表明,形态学鉴定与分子鉴定结果基本吻合,准确鉴定出xj46和hgf01分别是蝉花和柱状虫草。hgf01的采集样品和分离出的菌落特征均与柱状虫草无性型紫色野村菌(nomuraea atypicola)特征描述一致。xj46子实体及菌落特征与已鉴定的蝉花特征描述相一致。由于此次研究所采集到的ch01子实体宏观特征不明显,通过宏观形态鉴定仅鉴定至虫草属,并不能准确鉴定出具体种。形态学鉴定虽然显示出一定局限性,但是对于样品采集及菌落培养仍具有一定意义。分子鉴定中序列比对结果显示,本研究所测得序列在ncbi数据库中均能找到相同或相似的序列。其中,ch01与c.takamontana mf361939 its序列相似度达99%,在tef
‑
1α序列比对上,与c.tenuipes mh521911相似度达100%。然而,基于its和tef
‑
1α序列所建立的系统发育树中显示,ch01单独聚为一支,最大相似性分析支持率为90%,贝叶斯分析为0.961,且与c.takamontana距离较远。综合形态学和分子鉴定结果,可以鉴定出xj46是蝉花,hgf01是柱状虫草,ch01是新种。
[0099]
4.2三种虫草的活性成分
[0100]
在相同液体培养条件下,对三种虫草液体培养菌丝体中虫草酸、黄酮和多糖成分进行检测,结果显示,三种虫草液体培养菌丝体中均含有虫草酸、黄酮和多糖成分。柱状虫草(0.52mg/g)、蝉花(0.63mg/g)和ch01(0.82mg/g)三者之间在虫草酸含量上均不存在显著性差异。柱状虫草、ch01和蝉花三者之间在虫草酸和黄酮含量上均没有显著差异,蝉花与柱状虫草在多糖含量上没有显著性差异。系统发育树显示ch01与蝉花亲缘关系较近,因此ch01和蝉花相似,具有良好的药理作用。柱状虫草和ch01同样具有食药用价值。
[0101]
4.3三种虫草的氨基酸含量
[0102]
本文运用氨基酸自动分析仪检测出液体培养所得柱形虫草、ch01菌株及蝉花的菌丝体中含17种氨基酸。检测结果可得半胱氨酸含量上,ch01菌株明显高于蝉花和柱形虫草;在赖氨酸含量上,蝉花显著高于柱形虫草和ch01菌株,其他14种氨基酸均无统计学差异,且与其他有记录的虫草氨基酸含量也不同。
[0103]
4.4三种虫草的自由基清除能力
[0104]
由图8可看出,三种虫草的菌丝体浓度在0.08~0.32mg/ml内,dpph的清除率相差较小。在0.08mg/ml、0.24mg/ml及0.40mg/ml浓度时,ch01菌株的dpph的清除率明显高于柱形虫草和蝉花。综合整个实验浓度可得出:在相同的虫草菌丝体浓度时,ch01菌株的dpph清除率最高。另外ch01菌株的半抑制浓度ic50为1.641,显著高于蝉花和柱形虫草。
[0105]
以上实施例仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明保护范围之内;本发明未涉及的技术均可通过现有技术加以实现。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。