1.本发明属于分子生物学技术领域,具体而言,涉及一组基于荧光毛细管电泳检测技术的猕猴桃性别特异性分子标记引物及其应用。
背景技术:
2.猕猴桃产业的发展源于二十世纪初,而我国猕猴桃产业发展始于上世纪七十年代末期。早期栽培种植的品种主要来自于中华猕猴桃变种(actinidia chinensis planch.var. chinensis)和美味猕猴桃变种(a.chinensis planch.var.deliciosa),它们也是目前国内外猕猴桃商业栽培的主要种。
3.猕猴桃属植物的花类型为完全花,其中大多为功能性雌雄异株,表现为雌花的雄蕊败育不产生有活力的花粉,雄花的雌蕊败育不形成胚珠。在栽培上,不仅需要雌株作为结果树,还需要配制特定雄株作为授粉树。在杂交育种中,雌雄株选育的目标性状差异很大,导致亲本和群体后代往往不可兼容,需要对杂交后代中不符合性状的雌株或雄株予以剔除。然而,雄性或雌性后代无法在童期被甄别,需3
‑
5年生长至开花才被淘汰,期间大量人力、物力和地力被无效投入。因此,如能开发出用于猕猴桃幼苗早期性别鉴定的标记或方法,将会节约大量育种成本,并极大加速育种进程。
4.长期以来,国内外大量研究人员通过不同的技术手段开展了一些尝试,包括传统的形态学、生理学等手段。有学者尝试通过植株外部形态等找寻了猕猴桃雌雄性别间的差异(郑涵予等,2018;刘文等,2011)。李旭等基于生理生化和形态特征开展了雌雄性别的鉴定(李旭等,2014);陈晓玲等利用同工酶分析法进行雌雄性别的鉴定(陈晓玲等, 2004),但这些结果易受环境因素影响,准确性普遍较低。与形态和生理方法不同,dna 分子标记是不同基因组中特异性差异dna的直观反映,它以个体间核苷酸序列变异为基础,利用其可以检测出生物个体之间核苷酸序列上的差异,为雌雄异株植物早期性别鉴定提供了新的途径,具有遗传性状稳定,操作简单,成本经济等优点,近些年来在果树上发展应用较快。目前,已有多种关于猕猴桃属植物性别鉴定分子标记被开发,用于猕猴桃种质资源的鉴定。例如,gill等通过bsa(集团分离分析法,bμlked segregantanalysis)定位,利用中华猕猴桃实生群体开发了两个scar(sequence characterizedamplified region)标记(gill gp,1998),其中,smx为雌性特异性标记,smy1为雄性特异性标记。经测试,smx仅能鉴定3个群体中的1个群体的性别,而无法用于另外2 个群体,而smy1的鉴定准确率约为85%,能够较有效区分中华猕猴桃的性别(张坤等,2020)。在山梨猕猴桃(a.rufa)和中华猕猴桃的种间杂交f1代群体中,张琼等利用高通量测序技术开发出几对ssr(simple sequence repeats,简单重复序列)标记a001、 a002和a003(zhang q et al,2015),这类标记的有效性在该f1代群体中得到验证。其中,a001为雌性特异性标记,在该f1代中另外3份山梨猕猴桃种质资源中均可鉴别雌雄性别;a002和a003被报道在雌性个体和雄性个体中分别扩增出大小不同的差异性片段,可用于鉴定植株性别。然而,测试发现仅有使用a003或者将a001和a002配合使
用才可以鉴定研究中所用到的所有中华猕猴桃和山梨猕猴桃植株的性别。除此之外,张琼等还申请了在猕猴桃商业品种中申请了一个多个种内通用的性别鉴定分子标记,其能够在雄性品种中扩增出一个442bp的特异性条带,但我们对该引物进行检测后发现,它在中华猕猴桃和美味猕猴桃中的扩增效率需要进一步优化(张琼等,2020)。
5.除中华猕猴桃和美味猕猴桃之外,软枣猕猴桃(a.arguta)性别标记的研究也有报道 (李旭等,2016),但相关研究中并未发现具有性别特异性的条带,得到的多态性条件不够稳定,且对这些多态性条带进行聚类分析后发现,本方法的最佳性别匹配率仅能达到 70%。齐秀娟等(2019)通过bsa等方法等开发了一对性别早期鉴定分子标记,对95 份已知软枣猕猴桃进行性别鉴定后发现,其准确率地可达94.7%,能够应用于软枣猕猴桃材料的性别鉴定。
6.利用分子标记进行辅助选择育种和品种鉴定是目前果树生产和育种工作的热点方向,使得近年来相关检测技术也得到了长足的发展。其中,与传统的聚丙烯酰胺凝胶电泳相比较,荧光毛细管电泳检测技术因具有高效、准确、自动化等诸多优点,在小麦、玉米、白菜等多种植物分子标记中实现了应用。通过检索国内外现有技术,虽然已有从分子标记方面关于猕猴桃性别早期鉴定的研究报道,但是其操作步骤涉及page凝胶制胶、电泳、银染等过程,十分繁琐,技术门槛和检测成本均很高,实用性较差,并且现有检测准确率不高。
7.鉴于此,针对中华和美味系猕猴桃等具有栽培应用的种,开发一种通用性强、操作简单、重复性好、准确性高的的分子标记引物,有效识别猕猴桃野生资源、杂交群体的性别分离位点,并将其应用到现有的猕猴桃杂交育种和品种鉴定工作中,可能是提高育种效率、缩短育种周期和降低育种成本的一种有效方法。
技术实现要素:
8.鉴于现有技术的不足,本发明的目的在于提供一组可用于荧光毛细管电泳检测技术的猕猴桃性别特异性分子标记引物及其应用。
9.为了实现上述技术目的,本发明人通过对中华猕猴桃
‘
红阳’的全基因组数据及雌、雄样本的花器官转录组数据的差异表达序列进行比较,通过基因注释和同源定位的方法找到性别决定的2个不同区段。结合自身多年来的分子标记研究经验,在猕猴桃雌、雄样本差异区段设计多对特异性引物来筛选雌雄性别鉴定的特异标记。通过标记定位,小样本多引物筛选,大群体验证。最终,每个区段上各发现了一对效果较好的引物。本发明人利用设计合成的引物,对中华猕猴桃、美味猕猴桃、软枣猕猴桃和毛花猕猴桃(a. eriantha)中425份雌、雄样本进行pcr扩增,最终筛选得到2段序列上差异分子标记,并验证了2对通用性好的猕猴桃性别特异性分子标记引物。
10.具体地,本发明提供的一组用于猕猴桃种质资源性别鉴定的通用分子标记引物,它包括ms1或ms2。其中:ms1上游引物的核苷酸序列为actcgccttcccactctctt,如序列表中seq id no:1所示,ms1下游引物的核苷酸序列为 aacaatgtccaacccaaagc,如序列表中seq id no:2所示;ms2上游引物的核苷酸序列为atacgaagtttgaatcggtgattcgtc,如序列表中seq id no:3所示, ms2下游引物的核苷酸序列为ttgatgttgagttggtggaga,如序列表中seq idno:4所示。
11.另外,本发明用于猕猴桃种质资源性别鉴定的通用分子标记引物,适用于目前中
华猕猴桃、美味猕猴桃、软枣猕猴桃及毛花猕猴桃等商业化栽培猕猴桃品种,以及上述猕猴桃商业品种的变种内野生种质资源以及它们的杂交群体后代。同时,本发明还提供了 pcr反应与检测体系的内参引物its引物,来降低因部分样品质样较差导致的实验误差。 its上游引物的核苷酸序列为caacggatatctcggctctc,如序列表中seq id no:5 所示,its下游引物的核苷酸序列为aagcacaacaggacgcaac,如序列表中seq idno:6所示。通过加入its引物,本发明的分子标记引物还可用于荧光毛细管电泳检测平台,从而大幅度提高检测效率。
12.本发明还提供了一种用于猕猴桃种质资源性别鉴定的试剂盒,该试剂盒包括上述引物ms1或/和ms2。
13.本发明还提供了上述的引物在猕猴桃种质资源的性别鉴定中的应用。其中,所述的猕猴桃种质资源包括猕猴桃的商业品种(中华猕猴桃、美味猕猴桃、软枣猕猴桃、毛花猕猴桃)、野生品种和杂交品种。该分子标记引物特别高效地适用于中华猕猴桃与美味猕猴桃中野生种质资源、杂交群体和品种的性别鉴定。
14.本发明还提供了一种鉴定猕猴桃种质资源性别的方法,该方法包括:获取待检测猕猴桃样品的dna,使用上述引物进行pcr扩增,将扩增产物进行电泳检测并凝胶成像判断,判断依据为:如果未能出现清晰可见的条带,其样品为雌性猕猴桃;如果出现清晰可见的条带,其为雄性猕猴桃。其中ms1扩增产物长度为318bp,ms2扩增产物长度为 305bp。
15.进一步优选地,如上所述鉴定猕猴桃种质资源性别的方法,其中pcr扩增的体系为: 2
×
taq pcr master mix 5.0μl,基因组dna 1.0μl,10pmol/μl的上游引物0.5μl, 10pmol/μl的下游引物0.5μl,ddh2o 3.0μl;pcr扩增的程序为:95℃预变性5min; 95℃变性30s,58℃退火30s,72℃延伸30s,10个循环;接着95℃变性30s,52℃退火30s,72℃延伸30s,25个循环;最后72℃延伸20min。
16.本发明还提供了一种基于荧光毛细管电泳鉴定猕猴桃种质资源性别的方法,该方法包括如下步骤:
17.(1)引物合成:合成上述的ms1、ms2和its引物,并在ms1、ms2和its引物的5’端增加了荧光基团,合成相应的三对荧光引物;
18.(2)dna的提取:提取待测猕猴桃种质资源样本中的基因组dna;
19.(3)pcr扩增:以所述基因组dna为模板,使用三对荧光引物进行pcr扩增;
20.(4)扩增产物检测与分析:将扩增产物使用荧光毛细管电泳检测分型平台进行检测分析判断,判断依据为:如果检测到1个峰,其样品为雌性猕猴桃;如果检测到3个峰,其为雄性猕猴桃;极个别情况下检测出现2个峰,判定为雄性猕猴桃。
21.进一步优选地,如上基于荧光毛细管电泳鉴定猕猴桃种质资源性别的方法,其中的荧光基团选自fam、hex、ned和pet的任意一种。
22.进一步优选地,如上基于荧光毛细管电泳鉴定猕猴桃种质资源性别的方法,其中pcr 扩增的体系为:2
×
taq pcr master mix 5.0μl,基因组dna 1.0μl,10pmol/μl的上游引物0.5μl,10pmol/μl的下游引物0.5μl,ddh2o 3.0μl,三对荧光引物 (ms1:ms2:its)的体积比为2:2:1;pcr扩增的程序为:95℃预变性5min;95℃变性30s,52
‑
62℃退火30s,72℃延伸30s,10个循环,每个循环下降1℃;接着95℃变性30s,52℃退火30s,72℃延伸30s,25个循环;最后72℃延伸20min。
23.与现有技术相比,本发明提供的的猕猴桃性别分子标记引物具有如下优点和进步
性:
24.(1)单一性别特异性分子标记的应用即可高效鉴定出雌雄性别,在不同群体内验证的准确性高达96.7%,优于以往报道的多种类型的分子标记。
25.(2)两对性别特异性标记的通用性好,它们不仅适用于猕猴桃野生种质资源,也适用于现有的种质资源,在杂交后代内也可以做到高效鉴别。
26.(3)本发明所用到的引物基于荧光毛细管电泳检测平台,较传统聚丙烯酰胺凝胶或琼脂糖凝胶的分子标记的检测速度更快,且检测通量更高。
27.(4)本发明进一步将3对引物整合起来,建立了多重pcr反应体系,实现了在同一个pcr反应体系中即可扩增出3个位点,其中包含2个雄性特异性位点及1个基因组dna内参its的位点,并在荧光毛细管电泳检测中同时检出,这极大提高了检测系统本身的可靠性,并降低了检测成本。
附图说明
28.图1:部分样品的基因组dna检测结果。
29.图2:引物ms1与ms2在31个样品中的扩增结果。
30.图3:雌性样本中4对引物的扩增结果比较。
31.图4:雄性样本中4对引物的扩增结果比较。
32.图5:对照引物在不同条件下的扩增电泳图。
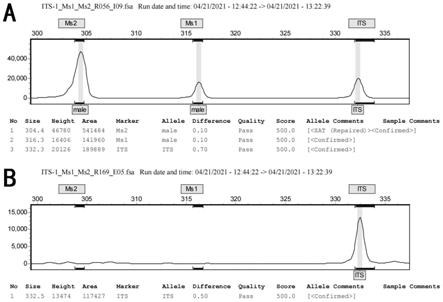
33.图6:雌雄样本的荧光毛细管电泳检测结果。其中,a为雄性样本的检测峰,b为雌性样本的检测峰。
具体实施方式
34.以下实施例进一步描述本发明方法的实施过程和有益效果,实施例仅用于例证的目的,不限制本发明的范围,同时本领域普通技术人员根据本发明所做的显而易见的改变也包含在本发明范围之内。
35.实施例1:猕猴桃性别特异性序列的调取与标记引物开发
36.本实施例以武汉市农业科学院猕猴桃种质资源圃中收集的猕猴桃植株为材料,进行性别特异性标记的开发。
37.申请人通过cnbi数据库下载到中华猕猴桃
‘
红阳’的全基因组数据,及雌、雄样本的花器官转录组数据,通过差异表达序列比较及基因同源定位的方法,确定性别决定区段,结合基因结构注释结果,找到雌雄性差异的基因组与转录组片段。对于筛选出的两段特异性序列,我们在猕猴桃雄性样本的基因组区域设计pcr引物,扩增出不同雄性样本相应的基因组序列,筛选扩增片段的保守性区域,进而开发出雌雄性别鉴定的特异标记。
38.具体方法是:在猕猴桃雌雄转录组差异片段上设计10对pcr扩增引物,对中华猕猴桃、美味猕猴桃、软枣猕猴桃中共31份已知性别的雌(17份)、雄(14份)样本提取基因组dna后,分别进行了pcr扩增。对扩增成功的pcr产物进行胶回收、纯化和测序工作,测序后对不同样本的差异片段扩增结果进行比较分析,找到2个区域中相对保守的位点。针对相应的保守位点来开发引物,从中筛选出条带单一且符合性别分离的分子标记,最终我们得到2对雄性特异性引物的效果最好,将它们分别命名为ms1 和ms2。
39.与此同时,我们设计了一对its引物作为pcr反应及后续荧光毛细管反应的内参引物。所用三对引物的序列表1如下:
40.表1性别标记所用到的引物序列
[0041][0042]
使用ms1及ms2对31份猕猴桃基因组进行pcr扩增。其流程在于:
[0043]
(1)猕猴桃基因组dna的提取与检测
[0044]
选取新鲜幼嫩的猕猴桃叶片,将其研磨后,使用磁珠法基因组dna提取试剂盒提取其基因组dna。取2μl dna样本添加2μl 6
×
loading buffer;使用1%琼脂糖凝胶进行电泳检测,按从左到右顺序依次点样,凝胶的每行点样孔最少点1个dnamarker 作为参照;电泳跑完后,将胶块放入凝胶成像分析仪中进行凝胶成像,保存成像胶图,保证其浓度和质量满足下游实验的需求(图1为不同样品dna提取的结果)。
[0045]
(2)引物合成与pcr扩增
[0046]
在得到合格的dna后,由武汉擎科生物工程有限公司合成pcr所用引物,并进行 pcr扩增。其中,pcr扩增体系和pcr程序按表2所示。
[0047]
表2:pcr扩增体系及程序
[0048][0049]
(3)分子标记有效性的检测
[0050]
对所有pcr的31个样本进行琼脂糖电泳检测,发现对所有的雌性样本(1
‑
17, 32
‑
48),ms1和ms2引物均未能扩增出清晰可见的条带。对几乎所有雄性样本(18
‑
31, 49
‑
62)来说,ms1和ms2引物大多能够扩增出一条清晰的条带,符合引物设计的预期。仅有一个ms2引物的雄性样本在52泳道的结果不如预期(图2)。此结果表明,ms1 和ms2引物能够有效区分中华猕猴桃内种质资源、品种和杂交后代的性别,均可用于猕猴桃性别的鉴定。
[0051]
随后,我们依据此方法,对包括中华猕猴桃、美味猕猴桃、软枣猕猴桃野生资源、栽培品种和中华猕猴桃杂交后代材料进行了大批量的检测,共检测样本425份。其中,符合根据ms1及ms2判读性别分离的样品共有398份,总体鉴定准确性达到93.65%。
[0052]
实施例2 ms1、ms2与已有分子标记的应用效果比较
[0053]
(1)引物来源
[0054]
将我们开发出的分子与猕猴桃属内已有的性别早期鉴定分子标记进行比较。选取 ms1及ms2和张琼等报道的(张琼等,2020,cn111394495a)及齐秀娟等报道的(齐秀娟等,2019,cn109609686a)共四个标记引物作为对比。根据它们提供的引物序列合成相应的引物。
[0055]
(2)四个标记对比结果
[0056]
我们利用参考文献中给出的pcr体系,将上述2种分子标记(其中齐秀娟等记为marker1,张琼等开发的记为marker2)与我们开发的2对分子标记(ms1、ms2)在同样的条件下进行电泳检测比较,分别选取96份雌性中华猕猴桃样本与83份雄性中华猕猴桃样品作为对比材料,pcr扩增产物采用1.2%琼脂糖凝胶电泳,电泳时按每一个样品 marker1、marker2、ms1和ms2的顺序进行点样。以每个标记能否产生产物中所对应的多态性条带清晰、长度一致为合适退火温度的检测依据。电泳检测结果表明,齐秀娟等报道的marker1引物在供试样本中有较好的扩增性,条带清晰,但与性别分离不一致。张琼等开发marker2标记在我们的几乎所有样品中未能扩增出单一清晰的条件。使用新开发的ms1及ms2引物,在上述179个对比样品中,实现了较好的雌雄分型效果。其中,所有96份雌性样品中,ms1及ms2引物均未扩增出条带(图3)。在83份雄性样本中,76个样本中ms1及ms2引物均出现了清晰的特异性条带(图4)。在上述179 个样本中,ms1及ms2引物的检测准确性是一致的,均可达到96.65%(6个雄性样本未检出)。因使用张琼等报道的引物,在几乎所有样本中均未扩增出清晰可见的条带。对此,我们优化了该pcr反应的条件,使用我们随机选择的8个中华猕猴桃和美味猕猴桃样本作为pcr模板,在不同退火温度下(50℃、52℃、55℃、58℃、60℃、62℃) 分别进行了扩增,结果仍未观察到清晰单一的条带出现(图5)。这表明该分子标记引物在中华和美味猕猴桃中进行pcr扩增的难度较大,无法简易地对供试雌雄样本分型,不能满足本研究所要达到的标记简单易用的设计要求。
[0057]
实施例3特异性分子标记的转化与荧光毛细管检测分子标记体系的建立
[0058]
(1)多重pcr体系的建立
[0059]
在ms1、ms2和its引物的5’端增加了fam荧光基团,合成相应的3对fam荧光引物,将3对引物混合进一个pcr反应中,调整引物反应的退火温度及引物配比,构建多重pcr反应体系,实现了在同一个反应体系中即可扩增3个位点,且最终产物的得率相当,下表是我们优化后得到的pcr扩增体系。
[0060]
表3:pcr扩增体系及程序
ms1和ms2s扩增序列为雄性特有序列,应该是所有雄性样本都能检测到,所有雌性样本都检测不到。对应到荧光毛细管电泳检测上时,应是雄性样本可以检测到3个峰,雌性样本只能检测到its的峰,如图6所示。如果遇到its无条带,则说明dna质量差或反应体系存在系统问题,需要排除样本和反应体系的问题后重新检测。在个别样本的检测中,我们会遇到its有带,且ms1或ms2只有其中一条有带的情况,这种情况下,我们将其判读为雄性样本。
[0072]
通过上述流程,最终我们筛选得到2个可用的猕猴桃性别鉴定荧光分子标记,并成功建立起了一套简洁高效的检测体系。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。