作为抗癌化合物的核苷酸的三磷酸氨基磷酸酯的盐
1.本发明提供了对治疗癌症,例如白血病有用的化合物。这些化合物包括三磷酸氨基磷酸酯(triphosphate phosphoramidate)的盐。本发明还提供了所述化合物的配方和所述化合物的用途。
背景技术:
2.核苷类药物已经成为治疗人类疾病的有力工具。特别是在癌症治疗中,核苷类药物如吉西他滨、氯法拉滨、阿糖胞苷、克拉屈滨和氟达拉滨的使用非常广泛。
3.然而,所有核苷类药物的有效性都可能受到固有和获得性耐药机制的限制。
4.提高核苷类药物疗效的一种方法是作为单磷酸氨基磷酸酯(monophosphate phosphoramidate)给药。单磷酸氨基磷酸酯是单磷酸化核苷酸的前药,已被证明在抗病毒和肿瘤领域是特别有效的治疗剂。这些化合物似乎避免了许多限制母体核苷效用的耐药机制(例如,参见
‘
application of protide technology to gemcitabine:a successful approach to overcome the key cancer resistance mechanisms leads to a new agent(nuc
‑
1031)in clinical development’;slusarczyk et al;j.med.chem.;2014,57,1531
‑
1542;mcguigan et al.;phosphoramidate protides of the anticancer agent fudr successfully deliver the preformed bioactive monophosphate in cells and confer advantage over the parent nucleoside;j.med.chem.;2011,54,7247
‑
7258;和vande voorde et al.;the cytostatic activity of nuc
‑
3073,a phosphoramidate prodrug of5
‑
fluoro
‑
2'
‑
deoxyuridine,is independent of activation by thymidine kinase and insensitive to degradation by phosphorolytic enzymes;biochem.pharmacol.;2011,82,441
‑
452;wo2005/012327;wo2006/100439;wo2012/117246和wo2016/083830)。一种示例性的单磷酸氨基磷酸酯是nuc
‑
1031,它是吉西他滨的单磷酸氨基磷酸酯:
[0005][0006]
虽然单磷酸氨基磷酸酯策略已被证明对某些核苷非常有效,但它对其他核苷类药物的效果不佳。因此,需要找到进一步增强核苷药物分子的方法。
[0007]
单磷酸氨基磷酸酯在水性溶剂中的溶解性也很差,这使得给药具有挑战性。
[0008]
本发明某些实施方案的目的是提供一种治疗剂,它在使用时对预防或治疗癌症具有治疗效果。
[0009]
本发明某些实施方案的目的是提供一种治疗剂,该治疗剂在使用时比母体核苷或相应的单磷酸氨基磷酸酯在预防或治疗癌症方面具有更大的疗效。
[0010]
本发明某些实施方案的目的是提供一种治疗剂,它比相应的单磷酸氨基磷酸酯更方便施用。
[0011]
本发明的某些实施方案解决了一些或所有上述目的。
技术实现要素:
[0012]
在本发明的第一方面,提供了一种式(i)的化合物,或其药学上可接受的盐:
[0013][0014]
其中
[0015]
r1在每次出现时独立地选自:c1‑
c
24
‑
烷基、c3‑
c
24
‑
烯基、c3‑
c
24
‑
炔基、c0‑
c4‑
亚烷基
‑
c3‑
c8‑
环烷基和c0‑
c4‑
亚烷基
‑
芳基;
[0016]
r2和r3在每次出现时各自独立地选自h、c1‑
c6烷基和c1‑
c3亚烷基
‑
r7;或者r2和r3与它们所连接的原子一起形成3元至6元环烷基或杂环烷基基团;
[0017]
r4在每次出现时独立地是h或c1‑
c4‑
烷基;
[0018]
或者r4、选自r2和r3的一个基团和它们所连接的原子可以形成3元至6元杂环烷基基团;
[0019]
r5在每次出现时独立地选自芳基、5元、6元、9元或10元杂芳基、c3‑
c8‑
环烷基、3元至7元杂环烷基、c1‑
c3‑
亚烷基
‑
r
5a
和c1‑
c8‑
烷基;所述芳基任选地与c6‑
c8‑
环烷基稠合;
[0020]
r
5a
在每次出现时独立地选自芳基、5元、6元、9元或10元杂芳基、c3‑
c8‑
环烷基、3元至7元杂环烷基,所述芳基任选地与c6‑
c8‑
环烷基稠合;
[0021]
r6独立地选自:
[0022][0022][0023]
r7在每次出现时独立地选自芳基、咪唑、吲哚、sr
a
、or
a
、co2r
a
、co2nr
a
r
a
、nr
a
r
b
和nh(=nh)nh2;
[0024]
r8独立地选自h和
[0025]
[0026]
r9独立地选自h和me;
[0027]
z1和z2各自独立地选自o和s;
[0028]
y独立地选自h、f、cl和ome;
[0029]
x在每次出现时选自h和药学上可接受的阳离子;条件是在至少一次出现时x是药学上可接受的阳离子;
[0030]
其中,任何芳基是苯基或萘基;
[0031]
其中,在r1、r2、r3、r4、r5或r7中的任何一个是烷基、环烷基、杂环烷基、芳基或杂芳基的情况下,该烷基、环烷基、杂环烷基、芳基或杂芳基基团任选地被选自以下的1至4个取代基取代:卤素、硝基、氰基、nr
a
r
a
、nr
a
s(o)2r
a
、nr
a
c(o)r
a
、nr
a
conr
a
r
a
、nr
a
co2r
a
、or
a
;sr
a
、sor
a
、so3r
a
、so2r
a
、so2nr
a
r
a
、co2r
a
、c(o)r
a
、conr
a
r
a
、cr
a
r
a
nr
a
r
a
、c1‑
c4‑
烷基、c2‑
c4‑
烯基、c2‑
c4‑
炔基和c1‑
c4‑
卤代烷基;
[0032]
其中r
a
在每次出现时独立地选自:h和c1‑
c4烷基;并且r
b
在每次出现时独立地选自:h、c1‑
c4‑
烷基和c(o)
‑
c1‑
c4‑
烷基。
[0033]
本发明人发现,式(i)的氨基磷酸化三磷酸酯对一系列的癌细胞系,包括实体瘤和血液病癌细胞系有良好的活性。在某些情况下,式(i)的三磷酸酯比相应的单磷酸氨基磷酸酯的活性更高。
[0034]
为免生疑问,如果x是药学上可接受的阳离子;与之相关的氧将被去质子化,即它将是一个拥有单一负电荷的阴离子。
[0035]
本发明人发现,三磷酸氨基磷酸酯的至少一个磷酸基的去质子化提供了高稳定性。本发明的化合物的离子性质也意味着它们比相应的单磷酸氨基磷酸酯更易溶于水。
[0036]
将单磷酸氨基磷酸酯转化为相应的单磷酸核苷酸需要一些酶的作用,包括羧酸酯酶的酯裂解,及磷酰胺酶型酶(phosphoramidase
‑
type enzyme)从单磷酸核苷酸中裂解所得氨基酸。本发明的三磷酸氨基磷酸酯是较大的分子,具有不同的形状,它们是离子型的,使人怀疑它们是否会以与单磷酸氨基磷酸酯相同的方式与相关的酶发生作用,从而转化为三磷酸核苷酸。尽管如此,式(i)的三磷酸氨基磷酸酯在细胞中仍有活性。
[0037]
在实施方案中,式(i)的化合物是式(ii)的化合物:
[0038][0039]
氯法拉宾的三磷酸氨基磷酸酯,如式(ii)的那些,对一些癌症细胞系,包括血液学细胞系,比相应的单磷酸氨基磷酸酯更有活性。
[0040]
在实施方案中,式(i)的化合物是式(iii)的化合物:
[0041][0042]
在实施方案中,式(i)的化合物是式(iv)的化合物:
[0043][0044]
在实施方案中,式(i)的化合物是式(v)的化合物:
[0045][0046]
在实施方案中,式(i)的化合物是式(vi)的化合物:
[0047][0048]
在实施方案中,式(i)的化合物是式(vii)的化合物:
[0049][0050]
在这些实施方案中,r1、r2、r3、r5和x可以在两次出现时相同。在实施方案中,式(i)的化合物是式(viii)的化合物:
[0051][0052]
在实施方案中,式(i)的化合物是式(ix)的化合物:
[0053][0054]
在实施方案中,式(i)的化合物是式(x)的化合物:
[0055][0056]
以下声明适用于式(i)至(x)中任何一个的化合物。这些陈述是独立且可互换的。换句话说,以下陈述中任意一个所描述的任意特征可以(在化学上允许的情况下)与一个或多个以下其他陈述所描述的特征组合。特别地,当本说明书中举例说明或解释一种化合物
时,以任意一般性水平表示的描述该化合物特征的以下陈述中的任意两个或更多个,可以组合以便表示在本说明书中构成本发明公开内容的一部分的主题。
[0057]
r1在每次出现时可以独立地选自:c1‑
c
24
‑
烷基、c3‑
c
24
‑
烯基、c3‑
c
24
‑
炔基、c0‑
c4‑
亚烷基
‑
c3‑
c6‑
环烷基和c0‑
c4‑
亚烷基
‑
芳基。
[0058]
r1在每次出现时可以独立地选自:c1‑
c
24
‑
烷基、c0‑
c4‑
亚烷基
‑
c3‑
c8‑
环烷基和ch2‑
芳基。r1在每次出现时可以独立地选自:c1‑
c
10
‑
烷基、c4‑
c6‑
环烷基和苄基。r1在每次出现时可以独立地选自:c1‑
c8‑
烷基、c6‑
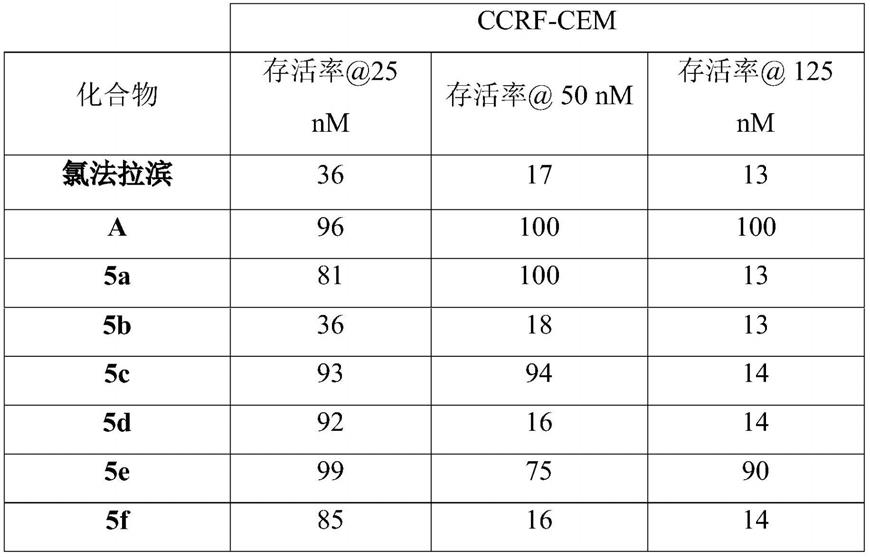
环烷基和苄基。
[0059]
r1可以是c1‑
c8烷基。
[0060]
r1可以选择包括三个或更多个碳原子。r1可以选择包括五个或更多个碳原子。r1因此可以选择包括六个或更多个碳原子。r1优选选择只包括碳原子和氢原子。r1可以选自c5‑
c7‑
环烷基,c5‑
c8‑
烷基和苄基,任选地其中所述基团是未取代的。r1可以是未取代的苄基。r1可以是新戊基。r1可以是乙基。
[0061]
r3可以是h。r3可以是c1‑
c4烷基。r3可以是甲基。r2可以选自c1‑
c6‑
烷基和c1‑
c3‑
亚烷基
‑
r7。r2可以是c1‑
c3‑
亚烷基
‑
r7,r7可以是sr
a
,且r
a
可以是c1‑
烷基。r2可以是c1‑
c4‑
烷基。r2可以选自甲基和异丙基。r2可以是甲基。r2可以是h。
[0062]
r4优选为h。
[0063]
r4、选自r2和r3的一个基团和它们所连接的原子可以形成3元至6元杂环烷基基团。r4、选自r2和r3的一个基团和它们所连接的原子可以不形成3元至6元杂环烷基基团;r2和r3在每次出现时可以各自独立地选自h、c1‑
c6‑
烷基和c1‑
c3‑
亚烷基
‑
r7;或者r2和r3与它们所连接的原子一起形成3元至6元杂环烷基;且r4在每次出现时独立地是h或c1‑
c4‑
烷基。
[0064]
r5可以是取代的或未取代的苯基,它可以任选地与c6‑
c8‑
环烷基环,例如环己烷环稠合。r5可以是取代的或未取代的苯基。r5可以是取代的或未取代的萘基(例如1
‑
萘基)。优选地,r5选自未取代的苯基或未取代的萘基(例如1
‑
萘基)。因此,r5可以是未取代的苯基。或者,r5可以是未取代的萘基(例如1
‑
萘基)。r5可以是c1‑
c6‑
烷基,例如乙基。
[0065]
r6可以独立地选自:
[0066][0067]
r6可以是
[0068][0069]
r6可以是
[0070][0071]
r6可以是
[0072][0073]
r6可以是
[0074][0075]
r6可以是
[0076]
y可以是h。y可以是f。y可以是cl。y可以是ome。
[0077]
r8可以是h。r8可以是z2可以是s。z2可以是o。
[0078]
当r8为r1、r2、r3、r5、x和z2在两次出现时可以是相同的。
[0079]
当r8为x在两次单独出现时为药学上可接受的阳离子。因此,每个三磷酸酯基团上至少有一个去质子化的氧。
[0080]
r6可以是
[0081][0082]
r6可以是
[0083][0084]
r6可以是
[0085][0086]
r6可以是
[0087][0088]
r6可以是r9可以是h。r9可以是me。
[0089]
式(i)的化合物可以选自:
[0090]
[0091]
[0092][0093]
x在每次出现时可以是药学上可接受的阳离子。x在每次出现时可以是相同的药学上可接受的阳离子。
[0094]
可以的是,x在一次出现时是h,且在一次出现时是药学上可接受的阳离子。当该化合物包括两个三磷酸酯基团时,可以每个三磷酸酯基团包括一个x是h和一个x是药学上可接受的阳离子。
[0095]
x可以是金属阳离子,也可以是铵阳离子。x可以是金属阳离子,例如碱或碱土金属的阳离子。x可以是铵阳离子,例如三烷基铵阳离子或氮杂环的铵阳离子。说明性的阳离子包括衍生自铝、精氨酸、苄星青霉素(benzathine)、钙、胆碱、二乙胺、二乙醇胺、甘氨酸、赖氨酸、镁、葡甲胺、乙醇胺(olamine)、钾、钠、氨丁三醇、三乙胺和锌阳离子的那些。x可以是三乙胺阳离子。
[0096]
本发明化合物包含键合至or5的磷原子(γ)
‑
磷的手性中心。该化合物可以作为磷酸酯非对映异构体的混合物存在,作为磷原子上的(s)
‑
差向异构体以基本上非对映异构体纯的形式存在,或作为磷原子上的(r)
‑
差向异构体以基本上非对映异构体纯的形式存在。对于本发明的目的,“基本上非对映异构体纯的”定义为非对映异构体纯度大于约90%。如果以基本上非对映异构体纯的形式存在,则该化合物可具有大于95%、98%、99%或甚至99.5%的非对映异构体纯度。或者,该化合物可以作为磷酸酯非对映异构体的混合物存在。
[0097]
化合物的(r)
‑
和/或(s)
‑
差向异构体可以通过色谱法例如hplc,任选地使用手性柱,以基本上非对映异构体纯的形式获得。或者,化合物的(r)
‑
和/或(s)
‑
差向异构体可以通过从适当的溶剂或溶剂体系中结晶而以基本上非对映异构体纯的形式获得。
[0098]
根据本发明的第二方面,提供了用于治疗方法的式(i)的化合物,或其药学上可接受的盐。
[0099]
根据本发明的第三方面,提供了用于预防或治疗癌症的式(i)的化合物,或其药学
上可接受的盐。
[0100]
根据本发明的第四方面,提供了式(i)的化合物,或其药学上可接受的盐,在制备用于预防或治疗癌症的药物中的用途。
[0101]
根据本发明的第五方面,提供了一种预防或治疗癌症的方法,包括向需要这种治疗的患者施用有效剂量的式(i)的化合物,或其药学上可接受的盐。
[0102]
关于本发明的第三、第四和第五方面中的每一方面,本发明的实施方案包括癌症,该癌症选自但不限于由以下组成的组:胰腺癌、膀胱癌、其他尿路上皮癌(例如输尿管和肾盂癌)、胃肠癌(也称为消化道的癌症,包括:食道癌、胃癌(gastric cancer)、胃癌(stomach cancer)、肠癌、小肠癌、结肠癌、结直肠癌、黏液性阑尾、杯状细胞类癌、肝癌、胆道癌、胆囊癌、肛门癌和直肠癌)、肺癌、肾(或肾脏)癌、胆癌、前列腺癌、胆管癌、神经内分泌癌、肉瘤、淋巴瘤、胸腺癌、多形性胶质母细胞瘤、最初起源未知的癌症、间皮瘤、肾上腺癌、睾丸癌、中枢神经系统癌症、基底细胞癌、鲍氏疾病(bowens disease)、其他皮肤癌症(如恶性黑素瘤、梅克尔细胞肿瘤和罕见的阑尾肿瘤)、眼部表面鳞状肿瘤、生殖细胞肿瘤、白血病、多发性骨髓瘤、肺癌、肝癌、乳腺癌、头颈癌、神经母细胞瘤、甲状腺癌、口腔鳞状细胞癌、泌尿膀胱癌、leydig细胞肿瘤和妇科癌症(包括卵巢癌、输卵管癌、腹膜癌、子宫内膜癌、子宫癌和宫颈癌,包括上皮宫颈癌)。
[0103]
在某些实施方案中,癌症是白血病或淋巴瘤。
[0104]
癌症可以是白血病。
[0105]
白血病主要有四种类型,取决于它们是慢性还是急性,是骨髓性还是淋巴性的。它们是:急性髓细胞白血病(aml)、急性淋巴细胞白血病(all)、慢性骨髓性白血病(cml)和慢性淋巴细胞白血病(cll)。
[0106]
这些混合也是已知的;例如双型急性白血病(bal;这是aml和all的混合)。
[0107]
在具体实施方案中,白血病选自由以下组成的组:急性髓细胞白血病(aml)、急性淋巴细胞白血病(all)、慢性骨髓性白血病(cml)、慢性淋巴细胞白血病(cll)和双型急性白血病(bal;这是aml和all的混合)。
[0108]
慢性淋巴细胞白血病(cll)包括以下亚型:b细胞cll(b
‑
cll)、b细胞前淋巴细胞白血病(pll)和t细胞慢性前淋巴细胞白血病(t
‑
pll)以及几个在基因水平上有所不同的亚型。
[0109]
急性淋巴细胞白血病(all)包括以下亚型:前体b细胞all(b
‑
all)、前体t细胞all(t
‑
all)、伯基特型all和费城染色体阳性(bcr
‑
abl融合)all。
[0110]
急性髓细胞白血病(aml)包括以下亚型:骨髓性白血病、单核细胞白血病和急性早幼粒细胞白血病(apl)。
[0111]
慢性骨髓性白血病(cml)包括以下亚型:慢性粒细胞白血病(cgl)(cgl)、青少年cml(jcml)、慢性中性粒细胞白血病(cnl)、慢性髓单核细胞白血病(cmml)和非典型cml(acml)。
[0112]
在具体实施方案中,上述cll、all、aml和cml的任何亚型都适合用本发明的化合物或含有它们的药物组合物进行治疗。
[0113]
其他可被视为处于这四大类之外的白血病形式包括:红细胞白血病,产生于红细胞前体;以及进入血液的淋巴瘤。
[0114]
癌症可能是淋巴瘤,例如实体淋巴瘤。
[0115]
淋巴瘤有两种主要类型:霍奇金淋巴瘤和非霍奇金淋巴瘤。在这两种类型中,又有各种亚型。
[0116]
在具体实施方案中,淋巴瘤选自由以下组成的组:霍奇金淋巴瘤和非霍奇金淋巴瘤。
[0117]
在具体实施方案中,淋巴瘤选自由以下组成的组:burkitt淋巴瘤(bl)、套细胞淋巴瘤(mcl)、滤泡型淋巴瘤(fl)、小淋巴细胞性淋巴瘤(sll)惰性b细胞非霍奇金淋巴瘤、组织细胞性淋巴肉瘤(也称为免疫母细胞性淋巴瘤;ibl)和弥漫性大b细胞淋巴瘤(dlbcl)包括活化细胞型弥漫性大b细胞淋巴瘤(activated
‑
cell like diffuse large b
‑
cell lymphoma,dlbcl
‑
abc)和生殖中心b细胞型弥漫性大b细胞淋巴瘤(germinal center b
‑
cell like diffuse large b
‑
cell lymphoma,dlbcl
‑
gcb)。
[0118]
在某些实施方案中,癌症是胃肠道癌症,且可以选自由以下组成的组:食道癌、胃癌(gastric cancer)、胃癌(stomach cancer)、肠癌、小肠癌、结肠癌、结直肠癌、黏液性阑尾、杯状细胞类癌、肝癌、胆道癌、胆囊癌、肛门癌和直肠癌。
[0119]
在某些实施方案中,癌症是是妇科来源的,且可以选自由以下组成的组:子宫癌、输卵管癌、子宫内膜癌、卵巢癌、腹膜癌和子宫颈癌。合适地,卵巢癌可以是上皮性卵巢癌。合适地,腹膜癌可以是原发性腹膜癌。
[0120]
特别地,癌症可以选自,但不限于胰腺癌、肺癌、膀胱癌、乳腺癌、胆道癌、淋巴瘤、白血病、胃肠癌和妇科癌症。
[0121]
已经发现,本发明的化合物即使在缺氧条件下也能保持活性。与缺氧特别相关的癌症是胰腺癌和肾(或肾脏)癌。
[0122]
癌症可能是复发的。癌症可能是转移性的。癌症可能先前未得到治疗。
[0123]
该癌症可能是先前已经接受治疗但已经证明对先前治疗无反应的难治性癌症。或者,该癌症患者可能不耐受先前的治疗,例如,可能出现副作用,使患者不耐受用所施用的剂进行进一步治疗。
[0124]
根据本发明的第六方面,提供了一种药物组合物,包括式(i)的化合物,或其药学上可接受的盐,以及至少一种药学上可接受的赋形剂。药物组合物可用于预防或治疗癌症,例如上述的一种癌症或一组癌症。
具体实施方式
[0125]
术语“盐水”意指氯化钠水溶液。本发明的盐水溶液通常是无菌的,并且通常具有适合用于肠胃外施用的浓度。合适的浓度为多达2w/v%或多达1w/v%。了优化同渗容摩,可以在本发明的制剂中使用不同浓度的盐水,例如0.9%或0.45%。
[0126]
本发明的制剂可用于治疗人体。它们可用于治疗动物体。
[0127]
本发明制剂中的化合物可以以药学上可接受的盐的形式获得、储存和/或施用。合适的药学上可接受的盐包括但不限于药学上可接受的无机酸的盐,无机酸例如盐酸、硫酸、磷酸、硝酸、碳酸、硼酸、氨基磺酸和氢溴酸,或药学上可接受的有机酸的盐,有机酸例如乙酸、丙酸、丁酸、酒石酸、马来酸、羟基马来酸、富马酸、苹果酸、柠檬酸、乳酸、粘酸、葡萄糖酸、苯甲酸、琥珀酸、草酸、苯乙酸、甲磺酸、甲苯磺酸、苯磺酸、水杨酸、磺胺酸、天冬氨酸、谷
氨酸、依地酸、硬脂酸、棕榈酸、油酸、月桂酸、泛酸、单宁酸、抗坏血酸和戊酸。合适的碱盐由形成无毒盐的碱形成。实例包括铝盐、精氨酸盐、苄星青霉素(benzathine)盐、钙盐、胆碱盐、二乙胺盐、二乙醇胺盐(diolamine)、甘氨酸盐、赖氨酸盐、镁盐、葡甲胺盐、乙醇胺盐(olamine)、钾盐、钠盐、氨丁三醇(tromethamine)盐和锌盐。也可以形成酸和碱的半盐,例如半硫酸盐、半草酸盐和半钙盐。
[0128]
对于本发明的上述制剂,施用剂量当然将随所用化合物、精确施用方式、所需治疗和所示病症而变化。预期本发明化合物的剂量水平、给药频率和治疗持续时间根据制剂和临床适应症、患者的年龄和共患疾病(co
‑
morbid medical condition)而不同。根据众所周知的医学原理,本发明化合物用于治疗目的的剂量大小将根据病况的性质和严重性、动物或患者的年龄和性别以及施用途径而自然变化。
[0129]
药物制剂通常采用组合物的形式,其中活性化合物或其药学上可接受的盐与药学上可接受的佐剂、稀释剂或载体联合。本发明制剂中的一种这样的药学上可接受的佐剂、稀释剂或载体是极性非质子溶剂。用于选择和制备合适的药物制剂的常规方法在例如“pharmaceuticals
‑
the science of dosage form designs”,m.e.aulton,churchill livingstone,1988中有所描述。
[0130]
该制剂可适用于局部施用(例如皮肤或膀胱)、口服施用或肠胃外施用(例如静脉内施用)。
[0131]
用于本发明药物制剂的任意溶剂应该是药物级的,这意味着它们的杂质谱使得它们适合于对人施用(例如静脉内施用)。
[0132]
对于口服施用,本发明的制剂可包含与佐剂或载体混合的活性化合物,佐剂或载体例如乳糖,蔗糖,山梨糖醇,甘露糖醇;淀粉,例如马铃薯淀粉,玉米淀粉或支链淀粉;纤维素衍生物;粘合剂,例如明胶或聚乙烯吡咯烷酮;和/或润滑剂,例如硬脂酸镁,硬脂酸钙,聚乙二醇,蜡,石蜡等,然后压制成片剂。如果需要对片剂包衣,可以用浓缩糖溶液对如上所述制备的核心进行包衣,浓缩糖溶液可以含有例如阿拉伯树胶、明胶、滑石粉和二氧化钛。或者,可以用溶解在易挥发有机溶剂中的合适的聚合物对片剂包衣。
[0133]
为了制备软明胶胶囊,可以将活性化合物与例如植物油或聚乙二醇混合。硬明胶胶囊可以含有化合物颗粒,使用上述片剂的赋形剂。还可以将活性化合物的液体或半固体制剂填充到硬明胶胶囊中。
[0134]
用于口服应用的液体制剂可以是糖浆剂或混悬剂的形式,例如含有本发明化合物的溶液,其余为糖和乙醇、水、甘油和丙二醇的混合物。任选地,这样的液体制剂可以含有着色剂、调味剂、甜味剂(例如糖精)、防腐剂和/或作为增稠剂的羧甲基纤维素或本领域技术人员已知的其他赋形剂。
[0135]
制剂可以是肠胃外(例如静脉内)施用。对于肠胃外(例如静脉内)施用,活性化合物可以作为无菌水溶液或油溶液施用。优选地,活性化合物作为无菌水溶液施用。水溶液可进一步包括至少一种表面活性剂和/或有机溶剂。示例性的有机溶剂包括二甲基乙酰胺、乙醇、乙二醇、n
‑
甲基
‑
吡咯烷酮、二甲基亚砜、二甲基甲酰胺和异丙醇。示例性的表面活性剂包括聚乙氧基化脂肪酸和脂肪酸酯及其混合物。合适的表面活性剂包括聚乙氧基化蓖麻油(例如以商品名elp出售的);或聚乙氧基化硬脂酸(例如以商品名或
hs15出售的);或聚乙氧基化的(例如聚氧乙烯(20))脱水山梨糖醇单油酸酯(例如以商品名聚山梨酯80(polysorbate 80)或吐温80(80)出售的)。
[0136]
本发明的药物组合物将优选包含0.05至99%w(重量%)的本发明化合物,更优选0.05至80%w的本发明化合物,更优选0.10至70%w的本发明化合物,甚至更优选0.10至50%w的本发明化合物,所有重量百分比均基于总组合物。
[0137]
已经显示环糊精在药物递送中得到广泛应用(rasheed等人,sci.pharm.,2008,76,567
‑
598)。环糊精是一族环状低聚糖。它们充当“分子笼(molecular cage)”,其包封药物分子并改变那些药物分子的性质,例如溶解度。环糊精包含(α
‑
1,4)
‑
连接的α
‑
d
‑
吡喃葡萄糖单元。环糊精可含有6、7或8个吡喃葡萄糖单元(分别称为α
‑
、β
‑
和γ
‑
环糊精)。药物制剂中使用的环糊精通常是β
‑
环糊精。羟基侧基可以用c1‑
c6取代的或未取代的烷基烷基化。环糊精的实例是α
‑
环糊精,β
‑
环糊精,γ
‑
环糊精,2
‑
羟丙基
‑
β
‑
环糊精(hp
‑
β
‑
cd),磺丁基醚β
‑
环糊精钠盐,部分甲基化的β
‑
环糊精。本发明的制剂还可包含至少一种环糊精。
[0138]
术语c
m
‑
c
n
是指具有m至n个碳原子的基团。
[0139]
术语“烷基”是指直链或支链烃基。烷基是单价的。例如,c1‑
c6‑
烷基可以指甲基、乙基、正丙基、异丙基、正丁基、仲丁基、叔丁基、正戊基和正己基。烷基优选是未取代的。
[0140]
术语“亚烷基”是指直链烃链。亚烷基是二价的。例如,c1‑
亚烷基可以指ch2基团。c2‑
亚烷基可以指
‑
ch2ch2‑
基团。亚烷基优选是未取代的。
[0141]
术语“卤代烷基”是指被至少一个卤原子取代的烃链,卤原子在每次出现时独立地选自:氟、氯、溴和碘。卤素原子可以存在于烃链上的任何位置。例如,c1‑
c4‑
卤代烷基可以指氯甲基,氟甲基,三氟甲基,氯乙基例如1
‑
氯甲基和2
‑
氯乙基,三氯乙基例如1,2,2
‑
三氯乙基、2,2,2
‑
三氯乙基,氟乙基例如1
‑
氟甲基和2
‑
氟乙基,三氟乙基例如1,2,2
‑
三氟乙基和2,2,2
‑
三氟乙基,氯丙基,三氯丙基,氟丙基,三氟丙基。卤代烷基可以是氟代烷基,即被至少一个氟原子取代的烃链。
[0142]
术语“烯基”是指含有至少一个碳
‑
碳双键的支链或直链烃链。双键可以以e或z异构体的形式存在。双键可以在烃链的任何可能的位置。例如,“c2‑
c4‑
烯基”可以指乙烯基、烯丙基和丁烯基。烯基优选是未取代的。
[0143]
术语“炔基”是指含有至少一个碳
‑
碳三键的支链或直链烃链。三键可以在烃链的任何可能的位置。例如,“c2‑
c6‑
炔基”可以指乙炔基、丙炔基、丁炔基。炔基优选是未取代的。
[0144]
术语“环烷基”是指含有3、4、5或6个碳原子的饱和烃环系。例如,“3元至6元环烷基”可以指环丙基、环丁基、环戊基、环己基。环烷基优选是未取代的。
[0145]
术语“杂环烷基”可以指在环系统中包含1或2个独立地选自o、s和n的杂原子的饱和或部分饱和的单环基团(换句话说,形成环系统的1或2个原子选自o、s和n)。杂环烷基的实例包括:哌啶,哌嗪,吗啉,硫代吗啉,吡咯烷,四氢呋喃,四氢噻吩,四氢吡喃,二氢吡喃,二恶烷,吖庚因。杂环烷基优选是未取代的或取代的。
[0146]
本发明包括式(i)
‑
(x)的化合物的互变异构体,如果互变异构是可能的。
[0147]
本发明还包括所有药学上可接受的同位素标记形式的化合物的制剂,其中一个或多个原子被具有相同原子序数的原子取代,但原子质量或质量数不同于自然界中通常存在的主要同位素的原子质量或质量数。
[0148]
适用于包含在本发明的化合物中的同位素的实例包括氢的同位素,例如2h和3h,碳
的同位素,例如
11
c、
13
c和
14
c,氯的同位素,例如
36
cl,氟的同位素,例如
18
f,碘的同位素,例如
123
i和
125
i,氮的同位素,例如
13
n和
15
n,氧的同位素,例如
15
o、
17
o和
18
o,磷的同位素,例如
32
p,和硫的同位素,例如
35
s。
[0149]
某些同位素标记的化合物,例如掺入放射性同位素的那些,可用于药物和/或底物组织分布研究。鉴于其易于掺入和现成的检测手段,放射性同位素氚(即3h)和碳
‑
14(即
14
c)和
18
f特别适用于此目的。
[0150]
由于代谢稳定性更强,用更重的同位素例如氘(即2h)取代,可以提供某些治疗益处,例如,体内半衰期延长或剂量需求降低,并且因此在一些情况下可能是优选的。
[0151]
同位素标记的化合物通常可以通过本领域技术人员已知的常规技术或通过与所述方法类似的方法使用合适的同位素标记的试剂代替先前使用的未标记的试剂来制备。
[0152]
除了本发明的制剂之外,用于治疗癌症(包括淋巴瘤或白血病)的治疗方法或制剂可以包括常规手术或放疗或化疗。这种化疗可包括施用一种或多种其他活性剂。
[0153]
当另外的活性剂作为本发明的治疗方法的一部分施用时,这种组合治疗可以通过同时、相继或分开施用治疗的各个组分来实现。此类组合产品使用上文所述的治疗有效剂量范围内的本发明化合物和其批准剂量范围内的一种或多种其他药物活性剂。
[0154]
因此,本发明的药剂制剂可包含另一种活性剂。
[0155]
所述一种或多种其他活性剂可以是以下类别的抗肿瘤剂中的一种或多种:
[0156]
(i)抗增殖/抗肿瘤药物及其组合,例如烷化剂(例如环磷酰胺,氮芥,苯达莫司汀(bendamustin),美法仑(melphalan),苯丁酸氮芥(chlorambucil),白消安(busulphan),替莫唑胺(temozolamide)和亚硝基脲);抗代谢药(例如,吉西他滨和叶酸拮抗剂如氟嘧啶如5
‑
氟尿嘧啶和替加氟(tegafur),雷替曲塞(raltitrexed),甲氨蝶呤(methotrexate),培美曲塞(pemetrexed),阿糖胞苷(cytosine arabinoside)和羟基脲);抗生素(例如蒽环类药物(anthracyclines)如阿霉素(adriamycin),博莱霉素(bleomycin),多柔比星,道诺霉素(daunomycin),表柔比星(epirubicin),伊达比星(idarubicin),丝裂霉素
‑
c,放线菌素和光神霉素(mithramycin));抗有丝分裂剂(例如长春花生物碱如长春新碱(vincristine),长春花碱(vinblastine),长春地辛(vindesine)和长春瑞滨(vinorelbine)以及紫杉烷类如紫杉酚和泰索帝(taxotere)和polo激酶(polokinase)抑制剂);蛋白酶体抑制剂,例如卡非佐米(carfilzomib)和硼替佐米(bortezomib);干扰素疗法;和拓扑异构酶抑制剂(例如表鬼臼毒素如依托泊苷(etoposide)和替尼泊苷(teniposide),安吖啶(amsacrine),拓扑替康,米托蒽醌(mitoxantrone)和喜树碱(camptothecin));
[0157]
(ii)细胞生长抑制剂(cytostatic agent),例如抗雌激素药(例如他莫昔芬(tamoxifen),氟维司群(fulvestrant),托瑞米芬(toremifene),雷洛昔芬(raloxifene),屈洛昔芬(droloxifene)和吲哚昔芬(iodoxyfene)),抗雄激素药(例如比卡鲁胺(bicalutamide),氟他胺(flutamide),尼鲁米特(nilutamide)和醋酸环丙孕酮(cyproterone acetate)),lhrh拮抗剂或lhrh激动剂(例如戈舍瑞林(goserelin),亮丙瑞林(leuprorelin)和布舍瑞林(buserelin)),孕激素(例如醋酸甲地孕酮(megestrol acetate)),芳香酶抑制剂(例如阿那曲唑(anastrozole),来曲唑(letrozole),伏氯唑(vorazole)和依西美坦(exemestane))和5α
‑
还原酶抑制剂如非那甾胺(finasteride);
[0158]
(iii)抗侵入剂,例如达沙替尼和博舒替尼(ski
‑
606)和金属蛋白酶抑制剂、尿激
酶型纤溶酶原激活剂受体功能抑制剂或肝素酶抗体;
[0159]
(iv)生长因子功能抑制剂:例如,这样的抑制剂包括生长因子抗体和生长因子受体抗体,例如,抗erbb2抗体曲妥珠单抗(trastuzumab)[herceptintm],抗egfr抗体帕尼单抗(panitumumab),抗erbb1抗体西妥昔单抗(cetuximab),酪氨酸激酶抑制剂,例如表皮生长因子家族抑制剂(例如egfr家族酪氨酸激酶抑制剂,如吉非替尼(gefitinib),厄洛替尼(erlotinib)和6
‑
丙烯酰氨基
‑
n
‑
(3
‑
氯
‑4‑
氟苯基)
‑7‑
(3
‑
吗啉代丙氧基)
‑
喹唑啉
‑4‑
胺(ci 1033),erbb2酪氨酸激酶抑制剂如拉帕替尼(lapatinib));肝细胞生长因子家族抑制剂;胰岛素生长因子家族抑制剂;细胞凋亡调控蛋白质的调节剂(例如bcl
‑
2抑制剂);血小板衍生的生长因子家族抑制剂,例如伊马替尼(imatinib)和/或尼罗替尼(nilotinib)(amn107);丝氨酸/苏氨酸激酶抑制剂(例如ras/raf信号传导抑制剂如法呢基转移酶抑制剂,例如索拉非尼(sorafenib),替吡法尼(tipifarnib)和洛那法尼(lonafarnib)),通过mek和/或akt激酶的细胞信号传导抑制剂,c
‑
kit抑制剂,abl激酶抑制剂,pi3激酶抑制剂,pit3激酶抑制剂,csf
‑
1r激酶抑制剂,igf受体,激酶抑制剂;极光激酶抑制剂和细胞周期蛋白依赖性激酶抑制剂,例如cdk2和/或cdk4抑制剂;
[0160]
(v)抗血管生成剂,例如抑制血管内皮生长因子作用的那些抗血管生成剂,例如抗血管内皮细胞生长因子抗体贝伐单抗(avastin
tm
);沙利度胺;来那度胺;以及例如,vegf受体酪氨酸激酶抑制剂例如凡德他尼、瓦他拉尼、舒尼替尼、阿西替尼和帕唑帕尼;
[0161]
(vi)基因治疗方法,包括例如替代异常基因的方法,例如异常p53或异常brca1或brca2;
[0162]
(vii)免疫疗法,包括例如过继细胞转移,如car t细胞疗法;抗体疗法,例如阿仑单抗(alemtuzumab),利妥昔单抗(rituximab),替伊莫单抗(ibritumomab tiuxetan)和奥法木单抗(ofatumumab);干扰素如干扰素α;白细胞介素例如il
‑
2(阿地白介素(aldesleukin));白细胞介素抑制剂,例如irak4抑制剂;癌症疫苗,包括预防性和治疗性疫苗,如hpv疫苗,例如gardasil,cervarix,oncophage和sipuleucel
‑
t(provenge);和toll样受体调节剂,例如tlr
‑
7或tlr
‑
9激动剂;
[0163]
(viii)细胞毒性剂,例如氟达拉滨(fludarabine)(福达华(fludara)),克拉屈滨(cladribine),喷司他丁(pentostatin)(nipenttm);
[0164]
(ix)类固醇如皮质类固醇,包括糖皮质激素和盐皮质激素,例如阿氯米松、阿氯米松双丙酸酯、醛固酮、安西奈德、倍氯米松、倍氯米松双丙酸酯、倍他米松、倍他米松双丙酸酯、倍他米松磷酸钠、倍他米松戊酸酯、布地奈德、氯倍他松、氯倍他松丁酸酯、氯倍他索丙酸酯、氯泼尼醇、可的松、醋酸可的松、可的伐唑、去氧皮质酮、地奈德、去羟米松、地塞米松、地塞米松磷酸钠、地塞米松异烟酸酯、二氟可龙、氟氯洛龙、氟米松、氟尼缩松、氟轻松、氟轻松安奈德、醋酸氟轻松、氟考丁酯、氟可的松、氟可龙、氟可龙己酸酯、氟可龙新戊酸酯、氟米龙、氟泼尼定、氟泼尼定乙酸酯、氟氢缩松、氟替卡松、氟替卡松丙酸酯、哈西奈德、氢化可的松、氢化可的松乙酸酯、氢化可的松丁酸酯、氢化可的松醋丙酯、氢化可的松丁丙酸酯、氢化可的松戊酸酯、艾可米松、醋丁艾可米松、甲泼尼松、甲泼尼龙、莫米松帕拉米松、糠酸莫米他松一水合物、泼尼卡酯、泼尼松龙、泼尼松、替可的松、替可的松新戊酸酯、曲安奈德、醋酸曲安奈德、曲安奈德醇及其各自药学上可接受的衍生物。可以使用类固醇的组合,例如本段中提及的两种或更多种类固醇的组合;
[0165]
(x)靶向疗法,例如pi3kd抑制剂,例如idelalisib和perifosine;或检查点抑制剂化合物,包括抗pd
‑
1、抗pd
‑
l1和抗ctla4分子,例如nivolumab、pembrolizumab、pidilizumab、atezolizumab、durvalumab和avelumab。
[0166]
所述一种或多种其他活性剂也可以是抗生素。
[0167]
贯穿本说明书的描述部分和权利要求,词语“包含”和“含有”以及它们的变化意指“包括但不限于”,并且它们并不旨在(并且并不)排除其他部分、添加剂、组分、整数或步骤。贯穿本说明书的描述和权利要求,除非上下文另有要求,否则单数涵盖复数。具体地说,当使用不定冠词时,除非上下文另有要求,否则本说明书应被理解为考虑到复数以及单数。
[0168]
结合本发明的具体方面、实施方案或者实施例一起描述的特征、整数、特性、化合物、化学部分或基团应被理解为可适用于本文所描述的任何其他方面、实施方案或实施例,除非与之不相容。在本说明书中所披露的所有特征(包括任何所附权利要求书、摘要以及附图)和/或如此披露的任何方法或过程的所有步骤可以按任何组合的形式组合,这类特征和/或步骤中的至少一些相互排斥的组合除外。本发明并不限于任何前述实施方案的细节。本发明扩展到本说明书(包括任何所附权利要求书、摘要以及附图)中所披露的特征的任何新颖特征或任何新颖组合,或扩展到如此披露的任何方法或过程的步骤的任何新颖步骤或任何新颖组合。
[0169]
读者的关注点是针对与本说明书同时或在本说明书之前与本技术结合提交并且与本说明书一起开放以供公众检验的所有论文和文献,并且所有这类论文和文献的内容以引用的方式并入本文。
[0170]
实施例
[0171]
在整个说明书中,这些缩略语具有以下含义。
[0172]
aq水性ms质谱bz苯甲酰基nmr核磁共振cdi羰基二咪唑np1
‑
萘基dcm二氯甲烷py吡啶dmfn,n
‑
二甲基甲酰胺rt室温dmso二甲基亚砜tbaf四正丁基氟化铵dmtr4,4
‑
二甲氧基三苯基甲基tbdmscl叔丁基二甲基氯硅烷ec
50
半最大有效浓度teab三乙基碳酸氢铵缓冲液eq.当量tfa三氟乙酸hplc高压液相色谱t
r
保留时间h小时ts对甲苯磺酰基ic
50
半最大抑制浓度
ꢀꢀ
[0173]
合成三磷酸氨基磷酸酯的一般程序
[0174]
本发明的化合物可以根据一般方案a来制备。核苷部分r6上的任何羟基和/或氨基都可以用保护基团保护,该保护基团可以在合成结束时去除。
[0175][0176]
方案a
[0177]
实施例
[0178]
本发明的某些化合物可以根据或类似于方案1
‑
6来制备。
[0179][0180]
方案1
[0181][0182]
方案2
[0183][0184]
方案3
[0185][0186]
方案4
[0187][0188]
方案5
[0189][0190]
方案6
[0191]
制备二磷酸酯和三磷酸氨基磷酸酯前药(5a
‑
f、9b、16a和20a)的一般程序
[0192]
在一个5ml的圆底烧瓶中,向核苷的5'
‑
对甲苯磺酸酯(0.44mmol)在干燥乙腈中的1.3m溶液中加入三(四正丁基铵)氢焦磷酸盐(0.66mmol),并在室温和氩气环境下将该混合物搅拌48小时。完成后,在旋转蒸发仪上减压除去溶剂,将残余物溶于去离子水(1ml)。(四正丁基铵)阳离子通过dowex 50wx8柱(100
‑
200目,12当量,h
或nh
4
形式),用3柱体积的去离子水洗脱,以交换质子。在真空下除去溶剂,粗制的产品用于下一步,无需进一步纯化。在氩气环境下,将粗制的核苷5'
‑
二磷酸酯(1mmol)在1,4
‑
二噁烷/乙腈或dmf的1:1混合物(20ml)中的混合物在室温(rt)下搅拌,并滴加溶于无水乙腈或dmf中的适当的氯磷酸酯4a
‑
f(1.0
‑
1.2当量)。将得到的反应混合物在rt下搅拌18小时。将粗制的混合物在减压下蒸发,残余物溶于0.1m teab,并用dcm洗涤。蒸发水相后,将粗产物在biotage isolera one上纯化(c18 snap ultra 30,60,120g滤芯,梯度为:0.1m teab在乙腈中作为洗脱液,从100至0%,在45min内)或通过hplc在半制剂柱上纯化(varian pursuit xrs 5c18,150x21.22mm,使用梯度:0.1m teab在乙腈中,从90%至0%,在35min内)。
[0193]
(2s)
‑
苄基(2s)
‑
苄基2
‑
(((((((((2r,3r,4s,5r)
‑5‑
(6
‑
氨基
‑2‑
氯
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲氧基)(羟基)磷酰基)氧基)(羟基)磷酰基)氧基)(苯氧基)磷酰基)氨基)丙酸酯,二
‑
三乙基铵盐(5a).
[0194]
[0195]
按照一般程序制备,从((2r,3r,4s,5r)
‑5‑
(6
‑
氨基
‑2‑
氯
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲基4
‑
甲基苯磺酸酯(2)(250mg,0.56mmol)开始,(四丁基铵)氢焦磷酸盐(740mg,0.82mmol)的ch3cn(0.6ml)溶液进行第一步,然后用粗二磷酸酯(126mg,0.27mmol)、三乙胺(0.81mmol,0.11ml)和芳氧基氯磷酸酯(aryloxyphosphorochloridate)4a(0.27mmol,96mg)的ch3cn/1,4
‑
二噁烷混合物(8ml)溶液在纯化后得到<10mg的所需化合物5a(<1%)。1h nmr(500mhz,cd3od):δ
h 8.21(d,j
hf
=1.9hz,1h,h
‑
8),7.22
–
7.13(m,10h,ar
‑
h),6.29(dd,j=4.3j
h
‑
f
=15.2,1h,h
‑1’
),6.28(dd,j=4.3j
h
‑
f
=14.85hz,1h,h
‑1’
),5.09
–
4.97(m,3h,h
‑2’
,och2ph),4.52(ddd,j=3.7和4.7hz,j
h
‑
f
=18.3,1h,h
‑3’
),4.26
–
4.14(m,3h,h
‑5’
)4.07
–
4.00(m,h
‑4’
和
‑
chnh),3.00(q,12h,
‑
nch2ch3),1.34(d,j=7.5hz,1.5h,ch3),1.23(d,j=7.6hz,1.5h,ch3),1.17(t,j=7.3hz,18h,
‑
nch2ch3).
31
p nmr(202mhz,cd3od):δ
p
‑
7.55(d,j
p
‑
p
=17.8hz,0.5p),
‑
8.16(d,j
p
‑
p
=17.8,0.5p),
‑
11.64(d,j
p
‑
p
=21.00hz,1p),
‑
24.31
–
(
‑
24.50)(m,1p).
19
f nmr(470mhz,cd3od):δ
f
‑
199.75,
‑
199.78。反向hplc,洗脱梯度:ch3cn的0.1m teab缓冲液ph=7.4,从10/90至100/0,在30min内,1ml/min,λ=270nm,其中t
r
=14.17min。
[0196]
(2s)
‑
苄基2
‑
(((((((((2r,3r,4s,5r)
‑5‑
(6
‑
氨基
‑2‑
氯
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲氧基)(羟基)磷酰基)氧基)(羟基)磷酰基)氧基)(萘
‑1‑
基氧基)磷酰基)氨基)丙酸酯二
‑
三乙基铵盐(5b).
[0197][0198]
按照一般程序制备,从((2r,3r,4s,5r)
‑5‑
(6
‑
氨基
‑2‑
氯
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲基4
‑
甲基苯磺酸酯(2)(315mg,0.69mmol)开始,(四丁基铵)氢焦磷酸盐(932mg,1.04mmol)的ch3cn(0.75ml)溶液进行第一步,然后用粗二磷酸酯(330mg,0.43mmol)、三乙胺(1.3mmol,0.2ml)和芳氧基氯磷酸酯4b(0.52mmol,210mg)的dmf(7ml)溶液在纯化后得到<15mg的所需化合物5b(<1%)。1h nmr(500mhz,cd3od):δ
h 8.26
–
8.19(m,2h,h
‑
8,ar
‑
h),7.63
–
7.69(m,1h,ar
‑
h),7.55
–
7.48(m,2h,ar
‑
h),7.39
–
7.35(m,1h,ar
‑
h),7.29
–
7.22(m,1h,ar
‑
h),7.15
–
7.11(m,5h,ar
‑
h),6.25(dd,j=4.3j
h
‑
f
=15.09,1h,h
‑1’
),5.01(dd,j=3.9hz,7.hz,j
h
‑
f
=52.1hz,1h,h
‑2’
),4.90
–
4.81(m,2h,
‑
och2ph),4.53
–
4.48(m,1h,h
‑3’
),4.26
–
4.00(m,4h,h
‑5’
,h
‑4’
和nhchch3),3.04(q,12h,2x(nch2ch3)3),1.33(d,j=7.5hz,1.5h,ch3),1.18(d,j=7.6hz,1.5h,ch3),1.15(t,j=7.3hz,18h,2x(nch2ch3)3).
31
p nmr(202mhz,cd3od):δ
p
‑
7.17(d,j
p
‑
p
=17.8hz,0.5p),
‑
7.92(d,j
p
‑
p
=17.8hz,0.5p),
‑
11.40(d,j
p
‑
p
=19.8hz,0.5p),
‑
11.44(d,j
p
‑
p
=20.2hz,0.5p),
‑
23.89
–
(
‑
24.16)(m,1p).
19
f nmr(470mhz,cd3od):δ
f
‑
199.83,
‑
199.85。反向hplc,洗脱梯度:ch3cn在0.1m teab缓冲液中,ph=7.4,从10/90至100/0,在30分钟内,1ml/min,λ=270nm,其中tr=
13.55min。
[0199]
(2s)
‑
异丙基2
‑
(((((((((2r,3r,4s,5r)
‑5‑
(6
‑
氨基
‑2‑
氯
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲氧基)(羟基)磷酰基)氧基)(羟基)磷酰基)氧基)(苯氧基)磷酰基)氨基)丙酸酯二
‑
三乙基铵盐(5c).
[0200][0201]
按照一般程序制备,从((2r,3r,4s,5r)
‑5‑
(6
‑
氨基
‑2‑
氯
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲基4
‑
甲基苯磺酸酯(2)(315mg,0.7mmol)开始,(四丁基铵)氢焦磷酸盐(932mg,1.04mmol)的ch3cn(0.75ml)溶液进行第一步,然后用粗二磷酸酯(330mg,0.45mmol)、三乙胺(1.3mmol,0.2ml)和芳氧基氯磷酸酯4c(0.68mmol,158mg)的dmf(7ml)溶液在纯化后得到<10mg的所需化合物5c(<1%)1h nmr(500mhz,cd3od):δ
h 8.23(d,j
hf
=1.9hz,1h,h
‑
8),7.26
–
7.00(m,5h,ar
‑
h),6.31(dd,j=4.3hz,j
h
‑
f
=15.2hz,1h,h
‑1’
),5.05(dd,j=3.9hz,4.4hz,j
h
‑
f
=52.1hz,1h,h
‑2’
),4.86
–
4.80(m,1h,och(ch3)2),4.57
–
4.51(m,1h,h
‑3’
),4.25
–
4.15(m,3h,h
‑5’
)4.07
–
4.04(m,1h,h
‑4’
),3.97
–
3.89(m,1h,nhchch3),2.84(q,12h,2x(nch2ch3)3),1.33(d,j=7.5hz,1.5h,ch3),1.22(d,j=7.6hz,1.5h,ch3),1.12
–
1.07(m,24h,nhch(ch3)2,2x(nch2ch3)3).
31
p nmr(202mhz,cd3od):δ
p
‑
7.10(d,j
p
‑
p
=17.8hz,0.5p),
‑
7.6(d,j
p
‑
p
=17.8hz,0.5p),
‑
11.41(d,j
p
‑
p
=20.85hz,1p),
‑
11.45(d,j
p
‑
p
=20.85hz,1p),
‑
23.67
–
(
‑
23.65)(m,1p).
[0202]
(2s)
‑
甲基2
‑
(((((((((2r,3r,4s,5r)
‑5‑
(6
‑
氨基
‑2‑
氯
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲氧基)(羟基)磷酰基)氧基)(羟基)磷酰基)氧基)(苯氧基)磷酰基)氨基)
‑4‑
(甲基硫基)丁酸酯二
‑
三乙基铵盐(5d).
[0203][0204]
按照一般程序制备,从((2r,3r,4s,5r)
‑5‑
(6
‑
氨基
‑2‑
氯
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲基4
‑
甲基苯磺酸酯(2)(315mg,0.7mmol)开始,(四丁基铵)氢焦磷酸盐(932mg,1.05mmol)的ch3cn(0.75ml)溶液进行第一步,然后用粗二磷酸酯(345mg,0.45mmol)、三乙胺(1.3mmol,0.2ml)和芳氧基氯磷酸酯4d(0.54mmol,182mg)的dmf(7ml)溶液在纯化后得到<10mg的所需化合物5d(<1%)。1h nmr(500mhz,cd3od):δ
h 8.34(d,j
hf
=
2.0hz,1h,h
‑
8),7.35
–
7.32(m,2h,ar
‑
h),7.28
–
7.24(m,1h,ar
‑
h),7.21
–
7.19(m,1h,ar
‑
h),7.17
–
7.14(m,1h,ar
‑
h),6.42(dd,j=4.0hz,j
h
‑
f
=15.0hz,1h,h
‑1’
),5.17(dt,j=3.0hz,j
h
‑
f
=52.0hz,1h,h
‑2’
),4.64(dt,j=3.5hz,j
h
‑
f
=18.0hz,1h,h
‑3’
),4.39
–
4.28(m,2h,h
‑5’
),4.20
–
4.12(m,h
‑4’
,nhch),3.64,3.63(2 x s,3h,och3),3.00(q,12h,2x(nch2ch3)3),2.49
–
2.38(m,2h,nhchch2ch2sch3),2.05
–
1.81(m,5h,nhchch2ch2sch3),1.17(t,j=7.3hz,18h,2x(nch2ch3)3).
31
p nmr(202mhz,cd3od):δ
p
‑
7.65(d,j
p
‑
p
=19.40hz,1p),
‑
11.69(d,j
p
‑
p
=20.6hz,0.5p),
‑
11.75(d,j
p
‑
p
=20.6hz,0.5p),
‑
24.44
–
(
‑
24.69)(m,1p).
[0205]
(2s)
‑
环己基2
‑
(((((((((2r,3r,4s,5r)
‑5‑
(6
‑
氨基
‑2‑
氯
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲氧基)(羟基)磷酰基)氧基)(羟基)磷酰基)氧基)(苯氧基)磷酰基)氨基)
‑3‑
甲基丁酸酯二
‑
三乙基铵盐(5e).
[0206][0207]
按照一般程序制备,从((2r,3r,4s,5r)
‑5‑
(6
‑
氨基
‑2‑
氯
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲基4
‑
甲基苯磺酸酯(2)(315mg,0.7mmol)开始,(四丁基铵)氢焦磷酸盐(932mg,1.05mmol)的ch3cn(0.75ml)溶液进行第一步,然后用粗二磷酸酯(345mg,0.45mmol)、三乙胺(1.3mmol,0.2ml)和芳氧基氯磷酸酯4e(0.54mmol,202mg)的dmf(7ml)溶液在纯化后得到<10mg的所需化合物5e(<1%)。1h nmr(500mhz,cd3od):δ
h 8.19(表观t,j
h
‑
f
=2.0hz,1h,h
‑
8),7.21
–
7.14(m,3h,ar
‑
h),7.03
–
6.96(m,2h,ar
‑
h),6.41(dd,j=4.5hz,j
h
‑
f
=15.0hz,1h,h
‑1’
),5.15(dt,j=3.0hz,j
h
‑
f
=52.0hz,1h,h
‑2’
),4.76
–
4.57(m,1h,och
‑
环己基),4.69
–
4.63(m,1h,h
‑3’
),4.25
–
4.12(m,2h,h
‑5’
),4.02
–
4.00(m,1h,h
‑4’
),3.66(dd,j=10hz,5.0hz,0.5h,nhchch(ch3)2),3.59(dd,j=10hz,5.0hz,0.5h,nhchch(ch3)2),3.00(q,12h,2x(nch2ch3)3),1.94
–
1.82(m,1h,nhchch(ch3)2),1.71
–
1.67(m,1h,ch
2a
‑
环己基),1.63
–
1.54(m,3h,1h,ch
2b
‑
环己基),1.40
–
1.19(m,6h,3 x ch2‑
环己基),0.86(表观t,j=7.0hz,3h,nhchch(ch3)2),0.75(d,j=7.0hz,1.5h,nhchch(ch3)2),0.71(d,j=7.0hz,1.5h,nhchch(ch3)2),1.17(t,j=7.3hz,18h,2x(nch2ch3)3).
31
p nmr(202mhz,cd3od):δp
‑
6.90(d,j
p
‑
p
=19.60hz,0.5p),
‑
7.17(d,j
p
‑
p
=19.60hz,0.5p),
‑
11.66(d,j
p
‑
p
=21.0hz,0.5p),
‑
11.68(d,j
p
‑
p
=21.0hz,0.5p),
‑
24.32
–
(
‑
24.58)(m,1p).
[0208]
(2s)
‑
新戊基2
‑
(((((((((2r,3r,4s,5r)
‑5‑
(6
‑
氨基
‑2‑
氯
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲氧基)(羟基)磷酰基)氧基)(羟基)磷酰基)氧基)(苯氧基)磷酰基)氨基)
‑3‑
苯基丙酸酯二
‑
三乙基铵盐(5f).
[0209][0210]
按照一般程序制备,从((2r,3r,4s,5r)
‑5‑
(6
‑
氨基
‑2‑
氯
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲基4
‑
甲基苯磺酸酯(2)(315mg,0.7mmol)开始,(四丁基铵)氢焦磷酸盐(932mg,1.05mmol)的ch3cn(0.75ml)溶液进行第一步,然后用粗二磷酸酯(345mg,0.45mmol)、三乙胺(1.3mmol,0.2ml)和芳氧基氯磷酸酯4f(0.54mmol,221mg)的dmf(7ml)溶液在纯化后得到<10mg的所需化合物5f(<1%)。1h nmr(500mhz,cd3od):δ
h 8.33(d j
h
‑
f
=2.0hz,0.5h,h
‑
8),8.32(d j
h
‑
f
=2.0hz,0.5h,h
‑
8),7.35
–
7.13(m,10h,ar
‑
h),6.40(dd,j=4.3j
h
‑
f
=14.85hz,1h,h
‑1’
),5.16(dt,j=3.5hz,j
h
‑
f
=52.1hz,1h,h
‑2’
),4.67
–
4.60(m,1h,h
‑3’
),4.37
–
4.09(m,5h,h
‑5’
,h
‑4’
,och2(ch3)3),3.30
–
3.21(m,1h,nhch2ph),3.00(q,12h,2x(nch2ch3)3),1.17(m,27h,och2(ch3)3,2x(nch2ch3)3).
31
p nmr(202mhz,cd3od):δ
p
‑
5.50(d,j
p
‑
p
=19.60hz,0.5p),
‑
5.48(d,j
p
‑
p
=19.60hz,0.5p),
‑
11.67(d,j
p
‑
p
=21.0hz,0.5p),
‑
11.66(d,j
p
‑
p
=21.0hz,0.5p),
‑
24.28
–
(
‑
24.50)(m,1p).
[0211]
(2s)
‑
苄基2
‑
(((((((((2r,3s,5r)
‑5‑
(5
‑
氟
‑
2,4
‑
二氧代
‑
3,4
‑
二氢嘧啶
‑
1(2h)
‑
基)
‑3‑
羟基四氢呋喃
‑2‑
基)甲氧基)(羟基)磷酰基)氧基)(羟基)磷酰基)氧基)(萘
‑1‑
基氧基)磷酰基)氨基)丙酸酯二
‑
三乙基铵盐(9b).
[0212][0213]
按照一般程序制备,从((2r,3s,5r)
‑5‑
(5
‑
氟
‑
2,4
‑
二氧代
‑
3,4
‑
二氢嘧啶
‑
1(2h)
‑
基)
‑3‑
羟基四氢呋喃
‑2‑
基)甲基4
‑
甲基苯磺酸酯(7)(1g,2.50mmol)开始,(四丁基铵)氢焦磷酸盐(2.7g,3mmol)的ch3cn(2.7ml)溶液进行第一步,然后用粗二磷酸酯(600mg,1.3mmol)、三乙胺(3.9mmol,7ml)和芳氧基氯磷酸酯6b(1.3mmol,513mg)的dmf(10ml)溶液在纯化后得到<10mg的所需化合物9b(<1%)。1h nmr(500mhz,cd3od):δ
h 8.24
–
8.22(m,1h,ar
‑
h),7.92(d,j
h
‑
f
=6.7hz,1h,h
‑
6),7.75
–
7.72(m,1h,ar
‑
h),7.56
–
7.50(m,2h,ar
‑
h),7.41
–
7.38(m,1h,ar
‑
h),7.31
–
7.24(m,1h,ar
‑
h),7.17
–
7.10(m,5h,ar
‑
h),6.13
–
6.08(m,1h,h
‑1’
),4.92
–
4.83(m,2h,
‑
och2ph),4.45
–
4.42(m,1h,h
‑3’
),4.16
–
4.02(m,3h,h
‑5’
nhchch3),3.89
–
3.87(m,1h,h
‑4’
),3.04(q,6h,2x(nch2ch3)3),1.33(d,j=7.5hz,1.5h,
ch3),1.19(d,j=7.6hz,1.5h,ch3),1.18(t,j=7.3hz,9h,2x(nch2ch3)3).
31
p nmr(202mhz,cd3od):δ
p
‑
6.93(d,j
p
‑
p
=17.8hz,0.5p),
‑
7.59(d,j
p
‑
p
=17.8hz,0.5p),
‑
11.22(d,j
p
‑
p
=19.3hz,0.5p),
‑
11.33(d,j
p
‑
p
=21.2hz,0.5p),
‑
23.37
–
(
‑
23.63)(m,1p).
19
f nmr(470mhz,cd3od):δ
f
‑
167.28,
‑
167.29。反向hplc,洗脱梯度:ch3cn在0.1m teab缓冲液中,ph=7.4,从10/90至100/0,在30分钟内,1ml/min,λ=270nm,其中tr=12.97min。
[0214]
(2s)
‑
苄基2
‑
(((((((((2r,3r,5r)
‑5‑
(4
‑
氨基
‑2‑
氧代嘧啶
‑
1(2h)
‑
基)
‑
4,4
‑
二氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲氧基)(羟基)磷酰基)氧基)(羟基)磷酰基)氧基)(苯氧基)磷酰基)氨基)丙酸酯二
‑
三乙基铵盐(16a).
[0215][0216]
按照一般程序制备,从((2r,3r,5r)
‑5‑
(4
‑
氨基
‑2‑
氧代嘧啶
‑
1(2h)
‑
基)
‑
4,4
‑
二氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲基
‑4‑
甲基苯磺酸酯(14)(95mg,0.23mmol)开始,(四丁基铵)氢焦磷酸盐(308mg,0.34mmol)的ch3cn(0.3ml)溶液进行第一步,然后用粗二磷酸酯(96mg,0.23mmol)、三乙胺(0.66mmol,0.9ml)和芳氧基氯磷酸酯4a(0.23mmol,92mg)的dmf(3ml)溶液在纯化后得到<10mg的所需化合物16a(<1%)。1h nmr(500mhz,cd3od):δ
h 7.79(d,j=7.5hz,0.5h,h
‑
6),7.78(d,j=7.5hz,0.5h,h
‑
6),7.23
–
7.16(m,10h,ar
‑
h),6.13
–
6.07(m,1h,h
‑1’
),5.89(d,j=7.5hz,0.5h,h
‑
5),5.85(d,j=7.5hz,0.5h,h
‑
5),5.04
–
4.96(m,2h,och2ph),4.34
‑
4.18(m,3h,h
‑5’
,h
‑3’
),4.06
–
4.00(m,1h,chnhch3),3.87
–
3.84(m,1h,h
‑4’
),3.07(q,6h,2x(nch2ch3)3),1.34(d,j=7.6hz,1.5h,ch3),1.24(d,j=7.6hz,1.5h,ch3),1.18(t,j=7.3hz,9h,2x(nch2ch3)3).
31
p nmr(202mhz,cd3od):δ
p
‑
7.16(d,j
p
‑
p
=17.5hz,0.5p),
–
7.64(d,j
p
‑
p
=17.5hz,0.5p),
‑
11.22(d,j
p
‑
p
=18.34hz,0.5p),
‑
11.36(d,j
p
‑
p
=18.34hz,0.5p),
‑
23.40
–
(
‑
23.59)(m,1p).
19
f nmr(470mhz,cd3od):δ
f
‑
119.6(d,j
f
‑
f
=240.21hz,0.5f),
‑
119.2(d,j
f
‑
f
=240hz,0.5f),
‑
120.31(d,j
f
‑
f
=241.74hz,f)。反向hplc,洗脱梯度:ch3cn的0.1m teab缓冲液ph=7.4,从10/90至100/0,在30min内,1ml/min,λ=263nm,其中t
r
=12.10min(88%)。
[0217]
(2s)
‑
苄基2
‑
(((((((((2r,3s,5r)
‑5‑
(6
‑
氨基
‑2‑
氯
‑
9h
‑
嘌呤
‑9‑
基)
‑3‑
羟基四氢呋喃
‑2‑
基)甲氧基)(羟基)磷酰基)氧基)(羟基)磷酰基)氧基)(苯氧基)磷酰基)氨基)丙酸酯二
‑
三乙基铵盐(20a).
[0218][0219]
按照一般程序制备,从((2r,3s,5r)
‑5‑
(6
‑
氨基
‑2‑
氯
‑
9h
‑
嘌呤
‑9‑
基)
‑3‑
羟基四氢呋喃
‑2‑
基)甲基4
‑
甲基苯磺酸酯(18)(210mg,0.50mmol)开始,(四丁基铵)氢焦磷酸盐(700mg,0.77mmol)的ch3cn(0.8ml)溶液进行第一步,然后用粗二磷酸酯(164mg,0.33mmol)、三乙胺(0.99mmol,0.13ml)和芳氧基氯磷酸酯4a(0.39mmol,140mg)的dmf(8ml)溶液在纯化后得到<10mg的所需化合物20a(<1%)。1h nmr(500mhz,cd3od):δ
h 8.48(s,1h,h
‑
8),7.33
–
7.27(m,9h,ar
‑
h),7.14
–
7.11(m,1h,ar
‑
h),6.41(t,j=6.6hz,1h,h
‑1’
),6.28(t,j=6.6hz,1h,h
‑1’
),5.11(s,1h,och2ph),5.10(s,1h,och2ph),4.52(m,1h,h
‑3’
),4.26
–
4.14(m,4h,h
‑5’
,h
‑4’
,nhchch3),2.79(q,12h,2x(nch2ch3)3),2.75
‑
2.62(m,1h,h
‑2’
),2.46
–
2.09(m,1h,h
‑2’
),1.46(d,j=7.5hz,1.5h,ch3),1.35(d,j=7.6hz,1.5h,ch3),1.14(t,j=7.3hz,18h,2x(nch2ch3)3).
31
p nmr(202mhz,cd3od):δ
p
‑
7.57(d,j
p
‑
p
=18.7hz,0.5p),
‑
8.17(d,j
p
‑
p
=18.2hz,0.5p),
‑
11.79(d,j
p
‑
p
=20.6hz,0.5p),
‑
11.83(d,j
p
‑
p
=20.2hz,0.5p),
‑
24.31
–
(
‑
24.50)(m,1p).
[0220]
制备(2s)
‑
苄基2
‑
(((((((((2s,4r,5r)
‑5‑
(6
‑
氨基
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
羟基四氢呋喃
‑2‑
基)甲氧基)(羟基)磷酰基)氧基)(羟基)磷酰基)氧基)(苯氧基)磷酰基)氨基)丙酸酯二
‑
三乙基铵盐(27a)的一般程序.
[0221][0222]9‑
((2r,3r,5s)
‑3‑
((叔丁基二甲基甲硅烷基)氧基)
‑5‑
(((叔丁基二甲基甲硅烷基)氧基)甲基)四氢呋喃
‑2‑
基)
‑
9h
‑
嘌呤
‑6‑
胺(22).
[0223][0224]
将3'
‑
脱氧腺苷(21)(1.13g,4.5mmol)溶于dmf(50ml),并向烧瓶中加入tbdmscl(2.03g,13.5mmol)和咪唑(1.84g,27mmol)。将混合物在室温下搅拌了16小时。反应混合物用chcl3(20ml)稀释,用nh4cl(饱和溶液,20ml x 3)洗涤有机相。将有机相在na2so4上干燥,过滤并蒸发,得到22,为粘性固体(1.56g,72%)。1h nmr(500mhz,cdcl3)δ
h 8.36(s,1h,h
‑
8),8.34(s,1h,h
‑
2),6.03(d,j=1.2hz,1h,h
‑1’
),5.54(br s,2h,nh2),4.66
–
4.63(m,1h,h
‑2’
),4.61
–
4.55(m,1h,h
‑4’
),4.14(dd,j=11.7hz,2.7hz,1h,h
‑5’
),3.80(dd,j=11.7hz,2.7hz,1h,h
‑5’
),2.32
–
2.25(m,1h,h
‑3’
),1.91
–
1.85(m,1h,h
‑3’
),0.97(s,9h,tert
‑
but),0.92(s,9h,tert
‑
but),0.17(s,3h,ch3),0.16(s,3h,ch3),0.15(s,3h,ch3),0.10(s,3h,ch3).
[0225]
((2s,4r,5r)
‑5‑
(6
‑
氨基
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
((叔丁基二甲基甲硅烷基)氧基)四氢呋喃
‑2‑
基)甲基二
‑
叔丁基磷酸酯(23).
[0226][0227]
将化合物22(1.56g,3.25mmol)溶于四氢呋喃(2ml)并冷却到0℃。滴加tfa的水溶液(1ml,1/1v/v),并在0℃下将混合物搅拌5小时。溶液在真空下蒸发,并通过biotage isolera one(30g zip滤芯kp sil,60ml/min,梯度洗脱系统2
‑
20%ch3oh/ch2cl
2 10cv,20%5cv)纯化粗品,得到白色泡沫状的23(1.16g,98%)。
[0228]1h nmr(500mhz,cdcl3)δ
h 8.45(s,1h,h
‑
8),7.97(s,1h,h
‑
2),6.29(br s,2h,nh2),5.74(d,j=6.0hz,1h,h
‑1’
),5.19
–
5.12(m,1h,h
‑2’
),4.65
–
4.60(m,1h,h
‑4’
),4.11(dd,j=13.0hz,1.5hz,1h,h
‑5’
),3.67(dd,j=12.5hz,1.5hz,1h,h
‑5’
),2.72
–
2.62(m,1h,h
‑3’
),2.37
–
2.26(m,1h,h
‑3’
),1.48(d,j=7.0hz,1h,oh
‑5’
),0.91(s,9h,tert
‑
but),0.00(s,3h,ch3),
‑
0.12(s,3h,ch3).
[0229]
((2s,4r,5r)
‑5‑
(6
‑
氨基
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
((叔丁基二甲基甲硅烷基)氧基)四氢呋喃
‑2‑
基)甲基二
‑
叔丁基磷酸酯(24).
[0230][0231]
在氩气下,向化合物23(0.960g,2.63mmol)在干燥的ch2cl2(35ml)中的溶液中加入5
‑
苯基
‑
1h
‑
四唑(0.770g,5.26mmol),然后滴加n,n
‑
二
‑
叔丁基二异丙基磷酰胺(1.25ml,3.95mmol)。搅拌4小时后,将混合物冷却至0℃,滴加et3n(1.37ml,9.86mmol),然后再滴加30%h2o2(1.24ml,14.24mmol)。在同一温度下搅拌2小时后,加入nahco3的饱和溶液,搅拌20分钟后,两相分离。有机相用na2so4干燥,过滤并蒸发,得到粗品,用biotage isolera one(snap ultra 100梯度洗脱系统5/85/10ch3oh/丙酮/ch2cl2,从0到8%的甲醇)纯化,得到白色泡沫状的24(0.340g,24%)。1h nmr(500mhz,cd3od)δ
h 8.34(s,1h,h
‑
8),8.24(s,1h,h
‑
2),6.00(d,j=2.5hz,1h,h
‑1’
),4.88
–
4.82(m,1h,h
‑2’
),4.67
–
4.66(m,1h,h
‑4’
),4.19
–
4.14(m,1h,ch
2b
‑5’
),2.39
–
234(m,1h,h
‑3’
),2.14
–
2.10(m,1h,h
‑3’
),1.49(s,9h,oc(ch3)3),1.48(s,9h,oc(ch3)3),0.86(s,9h,sic(ch3)3),0.00(s,3h,ch3),
‑
0.12(s,3h,ch3).
31
p nmr(202mhz,cd3od):
‑
10.34(1p)
[0232]
双(三乙基铵)单(((2s,4r,5r)
‑5‑
(6
‑
氨基
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
羟基四氢呋喃
‑2‑
基)甲基磷酸氢)(25).
[0233][0234]
在0℃下,向化合物24(0.340g,1.03mmol)在h2o(12ml)中的溶液中滴加tfa(6ml)。在0℃下搅拌18小时后,蒸发溶剂,用水(10ml)吸收残余物,用etoac(2x5ml)洗涤,并在压力下除去溶剂,得到白色固体25(0.200g,99%)。1h nmr(500mhz,cd3od)δ
h 8.56(s,1h,h
‑
8),8.40(s,1h,h
‑
2),6.10(d,j=2.5hz,1h,h
‑1’
),4.78
–
4.69(m,2h,h
‑2’
,h
‑4’
),4.38
–
4.34(m,1h,ch
2a
‑5’
),4.18
–
4.12(m,1h,ch
2b
‑5’
),2.43
–
2.39(m,1h,h
‑3’
),2.15
–
2.11(m,1h,h
‑3’
),
31
p nmr(202mhz,cd3od):0.046(1p).
[0235]
三乙基铵((2s,4r,5r)
‑5‑
(6
‑
氨基
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
羟基四氢呋喃
‑2‑
基)甲基二磷酸酯(26).
[0236][0237]
在氩气下,向化合物25(0.100g,0.30mmol)在干燥dmf(2ml)中的溶液中加入三丁胺(0.072ml,0.30mmol),所得悬浮液在rt下搅拌30分钟。在压力下除去溶剂,将残余物溶于dmf(3ml)。向该溶液中加入cdi(0.243,1.5mmol),反应在rt下搅拌4小时,然后加入meoh(0.097ml,2.4mmol),再搅拌20分钟。向该溶液中加入0.5m的磷酸三正丁基铵的dmf溶液(12ml,6mmol),并在氩气下在室温下搅拌反应过夜。在真空下除去溶剂,得到残留物,将其重新溶解于h2o中,并用ch2cl2洗涤。去除溶剂,将残余物溶于去离子水(1ml)。(三正丁基铵)阳离子通过dowex 50wx8柱(100
‑
200目,12当量,h 形式),用3个柱体积的去离子水洗脱,以交换质子。在真空下除去溶剂,将粗品用于下一步,无需进一步纯化,通过isolera biotage isolera one(c18 snap ultra 120g滤芯,梯度为:1m teab在乙腈中作为洗脱液,从100到0%,在40分钟内)纯化,得到白色泡沫状的26(0.030g,14%)。1h nmr(500mhz,cd3od)δ
h 8.25(s,1h,h
‑
8),8.21(s,1h,h
‑
2),6.02(d,j=2.5hz,1h,h
‑1’
),4.71
–
4.69(m,1h,h
‑2’
),4.66
–
4.64(m,1h,h
‑4’
),4.23
–
4.18(m,1h,ch
2b
‑5’
),3.00(q,j=7.5hz,18h,3x(nch2ch3)3),2.49
–
244(m,1h,h
‑3’
),2.17
–
2.12(m,1h,h
‑3’
),1.23(t,j=7.5hz,27h,3x(nch2ch3)3).
31
pnmr(202mhz,cd3od):
‑
9.63(d,j=22.0hz,1p),
‑
10.81(d,j=22.0hz,1p)
[0238]
(2s)
‑
苄基2
‑
(((((((((2s,4r,5r)
‑5‑
(6
‑
氨基
‑
9h
‑
嘌呤
‑9‑
基)
‑4‑
羟基四氢呋喃
‑2‑
基)甲氧基)(羟基)磷酰基)氧基)(羟基)磷酰基)氧基)(苯氧基)磷酰基)氨基)丙酸酯二
‑
三乙基铵盐(27a).
[0239]
向26(30mg,0.04mmol)在dmf(1.5ml)中的混合物中加入氯磷酸酯4a(22mg,0.006mmol,1.5当量)在dmf(0.5ml)中的溶液,随后加入三乙胺(0.02ml,0.12mmol,3当量)。将所得的混合物搅拌过夜后,在真空下除去溶剂,用h2o吸收残余物,并用二氯甲烷洗涤。减压蒸发水相,残余物用biotage isolera反相纯化,得到27a(6mg,15%)。1h nmr(500mhz,cd3od):δ
h 8.39(s,1h,h
‑
8),8.08(s,1h,h
‑
2),6.89(d,j=3.5hz,1h,h
‑1’
),5.88(d,j=3.5hz,1h,h
‑1’
),7.35
–
7.16(m,10h,ar
‑
h),4.99
–
4.97(m,2h,och2ph),4.55
–
4.48(m,2h,h
‑2’
,ch
2a
‑5’
),4.23
–
4.18(m,1h,ch
2a
‑5’
),4.12
–
4.00(m,2h,h
‑4’
,nhchch3),3.00(q,12h,2x(nch2ch3)3),2.34
–
2.22(m,2h,ch
2a
‑3’
),2.01
–
1.99(m,2h,ch
2a
‑3’
),1.35(d,j=7.5hz,1.5h,nhchch3),1.22(d,j=7.6hz,1.5h,nhchch3),1.17(t,j=7.3hz,18h,2x(nch2ch3)3).
31
p nmr(202mhz,cd3od):δ
p
‑
7.46(d,j
p
‑
p
=20.2hz,0.5p),
‑
8.12(d,j
p
‑
p
=20.2,0.5p),
‑
11.48(d,j
p
‑
p
=21.3hz,1p),
‑
24.16
–
(
‑
24.35)(m,1p).
[0240]
制备(2s)
‑
苄基2
‑
(((((((((2r,3s,4s,5r)
‑5‑
(4
‑
氨基
‑2‑
氧代嘧啶
‑
1(2h)
‑
基)
‑
3,4
‑
二羟基四氢呋喃
‑2‑
基)甲氧基)(羟基)磷酰基)氧基)(羟基)磷酰基)氧基)(苯氧基)磷酰基)氨基)丙酸酯二
‑
三乙基铵盐(35a)的一般程序.
[0241][0242]
(2r,3s,4r,5r)
‑2‑
(4
‑
苯甲酰胺基
‑2‑
氧代嘧啶
‑
1(2h)
‑
基)
‑4‑
羟基
‑5‑
((对甲苯磺酰基氧基)甲基)四氢呋喃
‑3‑
基苯甲酸酯(32).
[0243][0244]
将(2r,3s,4r,5r)
‑2‑
(4
‑
苯甲酰胺基
‑2‑
氧代嘧啶
‑
1(2h)
‑
基)
‑4‑
羟基
‑5‑
(羟基甲基)四氢呋喃
‑3‑
基苯甲酸酯(31)(1.12g,2.48mmol)溶于干燥的吡啶(7ml),在0℃加入对甲苯磺酰氯(520mg,2.73mmol)。将混合物在室温下搅拌了16小时。将反应混合物蒸发。将粗品溶于chcl3(20ml),有机层用水(3x20ml)洗涤。有机层在na2so4上干燥,过滤并蒸发,得到粗的残余物,在biotage isolera上纯化,得到32,为白色固体(727mg,48%)。1h nmr(500mhz,cd3od):δ
h
7.96
–
7.94(m,2h,ar
‑
h),7.83
–
7.79(m,4h,ar
‑
h,h
‑
6),7.66
–
7.61(m,2h,ar
‑
h),7.56
–
7.53(m,2h,ar
‑
h),7.48
–
7.42(m,2h,ar
‑
h),6.41(d,j=4.5hz,h
‑
5),6.64(dd,j=2.5hz,4.0hz,1h,h
‑1’
),4.46
–
4.30(m,5h,h
‑2’
,h
‑5’
,h
‑4’
,h
‑3’
),2.46(m,3h,ch3).
[0245]
((2r,3r,4s,5r)
‑5‑
(4
‑
苯甲酰胺基
‑2‑
氧代嘧啶
‑
1(2h)
‑
基)
‑4‑
(苯甲酰基氧基)
‑3‑
羟基四氢呋喃
‑2‑
基)甲基二磷酸酯铵盐(33).
[0246][0247]
根据一般程序制备,从(32)(720mg,1.19mmol)、三(四正丁基铵)氢焦磷酸盐(1.60g,1.78mmol)在ch3cn(0.75ml)中开始,得到粗二磷酸酯33(153mg,0.25mmol),用于下一步骤,无需进一步纯化。
31
p nmr(202mhz,cd3od):
‑
9.67(d,j=22.7hz,1p),
‑
10.66(d,j=22.7hz,1p)。
[0248]
((2r,3s,4s,5r)
‑5‑
(4
‑
氨基
‑2‑
氧代嘧啶
‑
1(2h)
‑
基)
‑
3,4
‑
二羟基四氢呋喃
‑2‑
基)甲基二磷酸酯三乙基铵盐(34).
[0249][0250]
将粗二磷酸酯(33)(153mg,0.25mmol)悬浮在7n nh3在meoh中的溶液中(0.7ml,5.0mmol),在rt下搅拌5小时。反应完成后,蒸发反应混合物,粗残余物通过isolera biotage isolera one纯化(c18 snap ultra 30g滤芯,梯度为:0.1m teab在乙腈中作为洗脱液,从100到0%,在30分钟内),得到34,为白色固体(40mg,32%)。1h nmr(500mhz,cd3od)δ
h 7.95(d,j=7.0hz,1h,h
‑
6),6.22(d,j=5.5hz,1h,h
‑1’
),5.91(d,j=7.3hz,1h,h
‑
5),4.25
–
4.23(m,1h,h
‑2’
),4.21
–
4.19(m,1h,h
‑3’
),4.12
–
4.09(m,1h,h
‑4’
),4.04
–
4.01(m,2h,h
‑5’
),3.00(q,j=7.5hz,18h,3x(nch2ch3)3),1.23(t,j=7.5hz,27h,3x(nch2ch3)3).
31
p nmr(202mhz,cd3od):
‑
9.63(d,j=22.0hz,1p),
‑
10.81(d,j=22.0hz,1p)
[0251]
(2s)
‑
苄基2
‑
(((((((((2r,3s,4s,5r)
‑5‑
(4
‑
氨基
‑2‑
氧代嘧啶
‑
1(2h)
‑
基)
‑
3,4
‑
二羟基四氢呋喃
‑2‑
基)甲氧基)(羟基)磷酰基)氧基)(羟基)磷酰基)氧基)(苯氧基)磷酰基)氨基)丙酸酯二
‑
三乙基铵盐(35a).
[0252]
根据一般程序步骤2制备,从粗二磷酸酯34(40mg,0.056mmol)、三乙胺(0.16mmol,0.03ml)和芳氧基氯磷酸酯4a(0.056mmol,20mg)在dmf(7ml)中开始,纯化后得到<10mg的所需化合物35a(<1%)。1h nmr(500mhz,cd3od):δ
h 7.90(d,j=7.5hz,1h,h
‑
6),7.30
–
7.27(m,9h,ar
‑
h),7.17
–
7.12(m,1h,ar
‑
h),6.22(d,j=4.5hz,1h,h
‑1’
),5.91(d,j=7.5hz,0.5h,h
‑
5),5.90(d,j=7.5hz,0.5h,h
‑
5),5.13,5.09(ab系统表观2 x s,2h,och2ph),4.35
–
4.23(m,4h,h
‑3’
,h
‑4’
,2 x h
‑5’
),4.19
–
4.13(m,1h,nhchch3),4.05
–
4.02(m,1h,h
‑2’
),3.00(q,12h,2x(nch2ch3)3),1.47(d,j=5.5hz,1.5h,nhchch3),1.36(d,j=5.5hz,1.5h,nhchch3),1.17(t,j=7.3hz,18h,2x(nch2ch3)3).
31
pnmr(202mhz,cd3od):δ
p
‑
7.53(d,j
p
‑
p
=18.90hz,0.5p),
‑
8.27(d,j
p
‑
p
=18.90hz,0.5p),
‑
11.66(d,j
p
‑
p
=20.60hz,1p),
‑
24.46
–
(
‑
24.68)(m,1p)。
[0253]
实施例a:体外细胞毒性分析
[0254]
使用以下测定法测定本发明的化合物在不同实体瘤和血液恶性肿瘤阵列中的细胞毒活性。
[0255]
实体瘤和血液学恶性肿瘤测定。
[0256]
使用celltiterglo(ctg,promega
‑
g7573)测定法进行体外活力测定以评估化合物对所选细胞系的细胞活力超过72h的影响。测试一式两份进行,在9个点用化合物处理,在~72h内,在96孔板中,3.16倍滴定。化合物起始浓度为198μm。在96孔板中使用celltiterglo进行细胞活力测定。化合物处理72h,标准生长条件,重复。将化合物溶解至40mm,100%解冻。将化合物在解冻的dmso中以3.16倍连续稀释,并温热至37℃,然后溶解于培养基(2μl 200μl)中。将化合物溶解在培养基中后,将含有化合物的培养基在培养箱中温热至37℃,然后将培养基中的化合物加入到细胞板(50μl 50μl)中,一式两份。化合物的最终浓度为198μm至19.8nm。检查所有化合物溶解度并再次记录,然后立即将板转移到co2组织培养箱中并孵育3天。dmso终浓度为0.5%。
[0257]
母体核苷药物作为对照进行测试,示例性的单磷酸氨基磷酸酯a也是如此:
[0258][0259]
测试了以下细胞系,并参见下表1:
[0260]
表1
[0261][0262]
这一筛选的结果见下文表2:
[0263]
表2
[0264]
[0265][0266][0267]
对于许多细胞系,化合物5a比相应的单磷酸氨基磷酸酯更有活性。
[0268]
实施例b:核苷类似物氯法拉滨和protides在急性白血病和淋巴瘤细胞系模型中的疗效评估
[0269]
比较了氯法拉滨和代表不同类别氯法拉滨protides(单磷酸酯、二磷酸酯和三磷酸酯分子)的3种不同化合物的疗效(通过ic
50
评估)。
[0270]
还评估了几种三磷酸酯候选物与氯法拉滨和单磷酸酯的疗效。
[0271]
测试的癌细胞系为急性淋巴细胞白血病(all)、急性骨髓性白血病(aml)和淋巴瘤:ccrf
‑
cem(all)、hl60(aml)、kg1(aml)、oci
‑
aml3(aml)和rl(淋巴瘤),在rpmi
‑
1640培养基中悬浮生长,补充有10%fbs血清和1%青链霉素,除了对于kg1细胞系,fbs为20%。
[0272]
母体核苷药物作为对照进行测试,示例性的单磷酸氨基磷酸酯a和示例性的二磷酸氨基磷酸酯b也是如此:
[0273]
[0274]
如下表3所示,将化合物溶解在二甲基亚砜中至10mm的储备浓度。
[0275]
表3
[0276][0277][0278]
对于所有实验,将细胞以10,000个细胞/孔的密度在50μl培养基中铺在96孔板上。在培养基中制备从原液浓度到工作溶液的稀释液;以所需浓度的两倍加入,每孔加入50μl(这达到了下面结果中描述的最终浓度)。对照组未接受50μl的普通培养基。66小时后,每孔加入10μl的刃天青(稀释1:10)。然后将细胞培养达6小时。处理72小时后,进行细胞毒性试验(alamarbluetm
–
刃天青染料)以确定细胞存活。用biohit800平板阅读器扫描平板,用excel和graphpad棱镜分析数据。
[0279]
5种不同细胞系中氯法拉滨、a(单磷酸酯)、b(二磷酸酯)和5a(三磷酸酯)ic
50
的比较。
[0280]
用每种化合物的系列稀释(范围从6nm到6.3μm)处理细胞,结果代表杀死每种细胞系50%细胞的浓度,也称为半最大抑制浓度(ic
50
)。较低的ic
50
表明在这些实验室条件下效力更大。结果如下表4所示。
[0281]
表4
[0282]
[0283]
二磷酸酯和三磷酸酯显示出疗效。b和5a的ic
50
与母体核苷类似物处于相同的可比范围内(高出1.1至2倍)。在所有测试的细胞系中,a的ic
50
最高(比氯法拉滨高2.2至7.2倍)。对于每种细胞系,氯法拉滨的ic
50
低于其他化合物。
[0284]
两种细胞系中针对氯法拉滨多种三磷酸酯的筛选。
[0285]
氯法拉滨、a、5a、5b、5c、5d、5e和5f针对ccrf
‑
cem和oci
‑
aml3细胞进行测试。数据表示为细胞暴露于不同浓度的细胞存活率的百分比,而不是仅从两个或三个数据点计算正式的ic
50
。
[0286]
结果如下表5所示。
[0287]
表5
[0288][0289][0290]
两种细胞系的数据显示,某些三磷酸酯化合物(特别是5b、5d和5f)的疗效优于a,
并且疗效与氯法拉滨相对相似。
[0291]
这些数据表明(1)几种三磷酸酯化合物(代表不同的分子家族)在杀死癌细胞系方面的效率与它们相关的核苷类似物相当,并且(2)在所有情况下都优于单磷酸酯protide a。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。