磺酰脲化合物、制备方法及其应用
1.本技术要求2021年8月16日提交的申请号为202110935522.0的中国专利申请的优先权,其全部内容通过引用整体并入本文。
技术领域
2.本发明属于药物化学和化学合成领域,具体而言,本发明涉及磺酰脲化合物、制备方法及其应用。
背景技术:
3.心力衰竭(heart failure)简称心衰,是指由于心脏的收缩功能和(或)舒张功能发生障碍,导致静脉系统血液淤积,动脉系统血液灌注不足,从而引起心脏循环障碍。心肌与心脏的收缩和舒展功能密切相关,各种原因引起的心肌损伤均有可能导致心力衰竭发生,其中炎症是心肌受损的重要原因之一。
4.环氧二十碳三烯酸(epoxyeicosatrienoic acids,eets)是花生四烯酸在cyp450酶作用下生成的一类功能性小分子。花生四烯酸是生物体内分布最广、含量最丰富的一种多不饱和必需脂肪酸,可经过cyp450途径生成4种不同的eets异构体,即5,6-eet、8,9-eet、11,12-eet、14,15-eet,它们统称为eets。eets在人体内具有多种调节作用,例如eets能够增加钠-氢的逆向转运活性、降低环氧酶(cox)活性以及促进钙从细胞内存储释放等。
5.eets不稳定,可以被可溶性表氧化物水解酶(soluble epoxide hydrolase,seh)水解为弱生物活性的二羟基二十碳三烯酸(dhet),dhet能够被迅速排出体外。cyp表氧化酶-eets-seh代谢通路对人体中多种关键途径具有调控作用。研究表明,seh抑制剂能够逆转内皮功能障碍、调节血压、抗炎、减少中风和癫痫的发生、增强胰岛素作用、镇痛和减少心肌受损等。用于高血压和糖尿病治疗的seh抑制剂研究十分广泛。
6.鉴于此,特提出本发明。
技术实现要素:
7.本发明的首要目的在于提供如下通式i所示磺酰脲类化合物、其立体异构体或药学上可接受的盐。
8.本发明的第二目的在于提供该磺酰脲类化合物的制备方法。
9.本发明的第三目的在于该磺酰脲类化合物作为seh抑制剂在预防和/或治疗心力衰竭的药物方面的应用。
10.为了完成上述目的,采用的技术方案为:
11.本发明提出一种如式i所示的磺酰脲化合物、其立体异构体或药学上可接受的盐
[0012][0013]
进一步地,本发明的式i磺酰脲化合物选自式ia、式ib所示的化合物:
[0014][0015]
本发明还提出式ia所示的化合物的制备方法,其为以下两种方法之一:
[0016]
方法1:
[0017][0018]
方法2:
[0019][0020]
本发明还提出式ib所示的化合物的制备方法,如下所示:
[0021][0022]
本发明还提供一种药物组合物,其包含选自上述磺酰脲化合物及其立体异构体、药学上可接受的盐中的一种或多种。
[0023]
本发明还提供一种可溶性表氧化物水解酶抑制剂,其包含选自上述磺酰脲化合物及其立体异构体、药学上可接受的盐中的一种或多种,或者包含上述药物组合物。
[0024]
本发明还提出上述磺酰脲化合物、其立体异构体或药学上可接受的盐或者上述药物组合物的应用,所述应用选自:在制备用于抑制可溶性表氧化物水解酶的活性的药物中的应用,在制备用于升高环氧二十碳三烯酸(eets)水平的药物中的应用,在制备用于减轻炎症反应的药物中的应用,以及在制备用于预防和/或治疗心力衰竭的药物中的应用。
[0025]
本发明还提供了磺酰脲类药物在制备预防和/或治疗心力衰竭的药物中的应用,所述磺酰脲类药物选自格列美脲、格列齐特、格列喹酮、格列本脲、格列吡嗪、妥拉磺脲、托拉塞米和乙酸己脲。
[0026]
本发明的技术方案至少具有以下技术效果:
[0027]
本发明的化合物具有可溶性表氧化物水解酶(seh)抑制活性,能升高环氧二十碳三烯酸(eets)水平,进而减轻炎症反应,可用于心力衰竭的预防与治疗。
[0028]
本发明的制备方法具有步骤简单、收率高且原料易得的技术优势。
附图说明
[0029]
图1为化合物i-1对seh酶的抑制效应的示意图,其中,*代表与对照组相比p<0.05,
#
代表与auda组相比p<0.05;
[0030]
图2为化合物i-4对seh酶活性抑制效应的示意图;其中,*代表与对照组相比p<0.05;
[0031]
图3为化合物i-23对seh酶活性抑制效应的示意图;其中,*代表与对照组相比p<0.05;
[0032]
图4为格列美脲对seh酶活性的抑制效应的示意图,其中,*代表与对照组相比p<0.05,**代表与对照组相比p<0.01,***代表与对照组相比p<0.001,##代表与auda组相比p<0.01,###代表与auda组相比p<0.001;
[0033]
图5为化合物i-1对pe诱导的心肌细胞重塑的抑制效应的示意图;*代表与对照组比p<0.05,
#
代表与pe组相比p<0.05,##代表与pe组相比p<0.01;
[0034]
图6为化合物i-4对pe诱导的心肌细胞重塑的抑制效应的示意图;其中,*代表与对照组比p<0.05,#代表与pe组相比p<0.05;
[0035]
图7为化合物i-23对pe诱导的心肌细胞重塑的抑制效应的示意图;其中,*代表与对照组比p<0.05,#代表与pe组相比p<0.05,##代表与pe组相比p<0.01;
[0036]
图8为格列美脲对pe诱导的心肌细胞重塑的抑制效应的示意图;*代表p<0.05,***代表p<0.001;
[0037]
图9为化合物i-1对心功能受损的抑制效应的示意图;其中,*代表与对照组比较p<0.05,**代表与对照组比较p<0.01,#代表与tac组比较p<0.05,##代表与tac组比较p<0.01;
[0038]
图10为化合物i-1对心肌肥厚的抑制效应的he染色图;
[0039]
图11为化合物i-1对心肌纤维化的抑制效应的天狼猩红染色图;
[0040]
图12为化合物i-1对bnp表达增加的抑制效应的示意图;其中,*代表与对照组比较p<0.05,**代表与对照组比较p<0.01,##代表与tac组比较p<0.01;
[0041]
图13为化合物i-23对心功能受损的抑制效应的示意图;其中,*代表与对照组比较p<0.05,**代表与对照组比较p<0.01,#代表与tac组比较p<0.05,##代表与tac组比较p<0.01;
[0042]
图14为化合物i-23对心肌肥厚的抑制效应的he染色图;
[0043]
图15为化合物i-23对心肌纤维化的抑制效应的天狼猩红染色图;
[0044]
图16为格列美脲对慢性心力衰竭小鼠心脏中seh活性增加的抑制作用;其中,&&代表与对照组相比p<0.01,*代表与tac组相比p<0.05,**代表与tac组相比p<0.01;
[0045]
图17为格列美脲对慢性心力衰竭小鼠心脏心功能受损的抑制作用;其中,*代表p<0.05,**代表p<0.01,***代表p<0.001;
[0046]
图18为格列美脲对慢性心力衰竭小鼠心肌肥厚的抑制作用的he染色图;
[0047]
图19为格列美脲对慢性心力衰竭小鼠心肌肥厚的抑制作用统计图;其中,**代表p<0.01;
[0048]
图20为格列美脲对慢性心力衰竭小鼠心脏的抑制效应的天狼猩红染色图;
[0049]
图21为格列美脲对慢性心力衰竭小鼠心脏的抑制效应的天狼猩红染色统计图;其
中,*代表p<0.05,**代表p<0.01,***代表p<0.001;
[0050]
图22为化合物i-23及恩格列净对慢性心衰小鼠心脏肥大的逆转作用的心脏大体图;
[0051]
图23为化合物i-23及恩格列净对慢性心衰小鼠心脏肥大的逆转作用的心重/胫骨长(hw/tl);其中***代表与对照组相比,p<0.001,#代表与tac组相比,p<0.05;
[0052]
图24为化合物i-23及恩格列净对慢性心衰小鼠心功能受损的逆转作用的效应示意图;其中***代表与对照组相比,p<0.001,###代表与tac组相比,p<0.001,#代表与tac组相比,p<0.05;
[0053]
图25为化合物i-23及恩格列净对慢性心衰小鼠心肌肥厚逆转作用的he染色图;
[0054]
图26为化合物i-23及恩格列净对慢性心衰小鼠心肌肥厚逆转作用的统计图;其中***代表与对照组相比,p<0.001,###代表与tac组相比,p<0.001;
[0055]
图27为化合物i-23及恩格列净对慢性心衰小鼠心肌纤维化的逆转作用的天狼猩红染色图;
[0056]
图28为化合物i-23及恩格列净对bnp表达增加的抑制效应的示意图;其中,***代表与对照组比较p<0.001,#代表与tac组比较p<0.05,##代表与tac组比较p<0.01。
具体实施方式
[0057]
为了更好的说明本发明,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本发明同样可以实施。
[0058]
基团定义
[0059]
术语“c1~c6烷基”表示直链或支链的含有1-6个碳原子的烷基。例如,包含但不限于甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、异戊基、己基等。
[0060]
术语“c3~c7环烷基”表示含有3-7个碳原子的环状烷基,包括但不限于环丙基、甲基环丙基、乙基环丙基、二甲基环丙基、环丁基、甲基环丁基、乙基环丁基、环戊基、环己基等。
[0061]
术语“c4~c8含n杂环基”表示环上含有4-8个碳原子和至少一个氮原子的饱和或不饱和的非芳香性杂环基,包括但不限于
[0062]
术语“c3~c6环烷基并吡咯烷基”包括但不限包括但不限
[0063]
术语“c2~c6链烯基”表示具有2-6个碳原子的直链或支链烯基,例如,包含但不限于,丙烯基、异丙烯基、丁烯基、异丁烯基、叔丁烯基、戊烯基、异戊烯基、己烯基等。
[0064]
术语“c2~c6链烯基取代的c1~c2烷基”表示用上述“c2~c6链烯基”取代的c1~c2烷基,例如,包含但不限于,烯丙基等。
[0065]
术语“c1~c6酰基”表示具有1-6个碳原子的酰基,例如,包括但不限于,甲酰基、乙
酰基、丙酰基、异丙酰基、丁酰基、异丁酰基、叔丁酰基、戊酰基、异戊酰基、新戊酰基、己酰基、叔己酰基等。
[0066]
术语“c1~c6烷氧基”表示直链、支链或环状的含有1-6个碳原子的烷氧基。例如,包含但不限于甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、异丁氧基、叔丁氧基、戊氧基、异戊氧基、环戊氧基、己氧基、环己氧基等。
[0067]
术语“c1~c6亚烷基”表示具有1-6个碳原子的亚烷基,例如,包括但不限于,亚甲基、甲基取代的亚甲基、乙基取代的亚甲基、丙基取代的亚甲基、亚乙基、甲基取代的亚乙基、乙基取代的亚乙基、亚丙基、甲基取代的亚丙基、乙基取代的亚丙基、亚戊基、亚己基等。
[0068]
术语“芳基”表示具有芳香环结构性质的取代基,优选为“c6~c14芳基”,其表示具有6-14个碳原子的芳基。例如,包含但不限于苯基、取代的苯基、萘基、取代的萘基、蒽基等。
[0069]
术语“杂芳基”是指具有5-14个环原子的单环或多环基团,每个环含有4-6个原子,其中有一个或多个选自n、o或s的杂原子,其余为碳。“杂芳基”具有一定的芳香性。本文优选杂芳基为“c2~c9杂芳基”,其表示具有2-9个碳原子的杂芳基,例如包括但不限于,呋喃基、取代的呋喃基、苯并呋喃基、取代的苯并呋喃基、噻吩基、取代的噻吩基、苯并噻吩基、取代的苯并噻吩基、吲哚基、取代的吲哚基、异吲哚基、取代的异吲哚基、吡咯基、取代的吡咯基、噻唑基、取代的噻唑基、噁唑基、取代的噁唑基、吡唑基、取代的吡唑基、咪唑基、取代的咪唑基、吡喃基、取代的吡喃基、哒嗪基、取代的哒嗪基、吡嗪基、取代的吡嗪基、嘧啶基、取代的嘧啶基、吡啶基、取代的吡啶基、喹啉基、取代的喹啉基、异喹啉基、咔唑基、取代的咔唑基等。
[0070]
术语“卤素”选自氟、氯、溴、碘。
[0071]
术语“卤代”包括单卤代、多卤代或全卤代,即一个、多个或全部氢原子被卤素取代。
[0072]
术语“取代”是指基团上的一个或多个氢原子被一个或多个取代基取代。
[0073]
术语“5~6元内酰胺环”是指环上包含酰胺基的具有5-6个环原子的饱和或不饱和的非芳香性杂环基,包括但不限于其中环上的氢原子可被取代基取代。
[0074]
本发明一方面涉及一种如式i所示的磺酰脲化合物、其立体异构体或药学上可接受的盐:
[0075][0076]
其中,
[0077]
r1为h,
[0078]
r2选自-(ch2)2nhcora取代的c6~c
14
芳基;
[0079]
ra选自取代的5~6元内酰胺环,所述取代的取代基为选自c1~c6烷基中的一个或多个;
[0080]
r3选自取代的c3~c7环烷基,取代的取代基选自-c(=o)xrb、-(ch2)morc,
[0081]
x选自-nh-或-o-;
[0082]
rb选自c1~c6烷基、c1~c6酰基、r
b1
选自c1~c6亚烷基,r
b2
选自c3~c7环烷基;
[0083]
rc选自c1~c6烷基、卤代c1~c6烷基、c3~c7环烷基、c3~c6链烯基、c1~c6酰基、-co(ch2)nnrdre、rd和re各自独立地选自h、c1~c6烷基、c3~c7环烷基、取代或未取代的c6~c
14
芳基,或rd和re和与其相连的n原子形成取代或未取代的吡咯烷基、哌啶基或哌嗪基;取代的取代基选自c1~c6烷基、卤代c1~c6烷基、-oh、卤素、c1~c6烷氧基、卤代c1~c6烷氧基或-cn;
[0084]rp1
、r
p2
、r
p3
、r
p4
各自独立地选自c1~c6烷基;
[0085]
m和n各自独立地为0~5的整数,例如0、1、2、3、4、5;
[0086]
或者
[0087]
r1选自c1~c6烷基、c3~c6环烷基和c2~c6链烯基取代的c1~c2烷基,
[0088]
r2选自取代的c6~c
14
芳基、取代的5~14元杂芳基,所述取代的取代基选自c1~c6烷基、c1~c6酰基、-(ch2)qrf、-(ch2)qnhcorg,q为2~4的整数;
[0089]
rf为取代的异喹啉二酮基,rg为取代的c6~c
14
芳基、取代的5~14元杂芳基、取代的5~6元内酰胺环,所述取代的取代基为选自c1~c6烷基、卤代c1~c6烷基、c1~c6烷氧基、卤代c1~c6烷氧基、-oh、卤素、-cn中的一个或多个;
[0090]
r3选自取代或未取代的c1~c6烷基、取代或未取代的c3~c7环烷基、取代或未取代的4~8元含n杂环基、取代或未取代的c3~c6环烷基并吡咯烷基、所述取代的取代基选自c1~c4烷基、-c(=o)xrh、-(ch2)mori;
[0091]
x为nh或o;
[0092]
rh为h、c1~c6烷基、c1~c6酰基或r
b1
选自c1~c6亚烷基;r
b2
选自c3~c7环烷基;
[0093]ri
为h、c1~c6烷基、卤代c1~c6烷基、c3~c7环烷基、c3~c6链烯基、c1~c6酰基、-co(ch2)nnrare、r
p1
、r
p2
、r
p3
、r
p4
各自独立地选自c1~c6烷基;
[0094]
rd和re各自独立地选自h、c1~c6烷基、c3~c7环烷基、取代或未取代的c6~c
14
芳
基;或rd和re和与其相连的n原子形成取代或未取代的吡咯烷基、哌啶基或哌嗪基;取代的取代基选自c1~c6烷基、卤代c1~c6烷基、-oh、卤素、c1~c6烷氧基、卤代c1~c6烷氧基或-cn;
[0095]rp1
、r
p2
、r
p3
、r
p4
各自独立地选自c1~c6烷基;
[0096]
m和n各自独立地为0~5的整数,例如0、1、2、3、4、5。
[0097]
本发明的磺酰脲化合物可作为seh抑制剂,对seh酶具有很强的抑制活性,部分化合物ic
50
可低于1微摩尔。
[0098]
在一个实施方式中,本发明式i的磺酰脲化合物可选自如下式ia和ib所示的化合物。
[0099][0100]
其中,
[0101]r11
为c1~c6烷基;r
13
选自-c(=o)xrb、-(ch2)morc;
[0102]
x、rb、re和m的定义如上所述。
[0103]
在一些实施方式中,rb选自c1~c3烷基、c1~c3酰基、
[0104]
在一些实施方式中,rc选自c1~c3烷基、c3~c6环烷基、c1~c3酰基、-co(ch2)nnrdre、其中rd、re和n的定义如上所述。
[0105]
在一些实施方式中,rd和re各自独立地选自h、c1~c3烷基、c3~c6环烷基、取代或未取代的苯基,或rd和re和与其相连的n原子形成取代或未取代的吡咯烷基、哌啶基或哌嗪基;取代的取代基选自c1~c3烷基、卤代c1~c3烷基、-oh、卤素、c1~c3烷氧基、卤代c1~c3烷氧基或-cn。
[0106][0107]
其中,
[0108]r21
为c1~c6烷基、c3~c6环烷基或c2~c6链烯基取代的c1~c2烷基;
[0109]r22
为c1~c6烷基、c1~c6酰基、-(ch2)qrf、-(ch2)qnhcorg,q为2~4的整数;
[0110]r23
为c1~c6烷基、c3~c6环烷基、4-8元含n杂环基、环戊基并吡咯烷基、取代的环己基,取代的取代基选自c1~c4烷基、-c(=o)xrh、-(ch2)mori;
[0111]
其中,x、rf、rg、rh、ri的定义如上所述。
[0112]
在一些实施方式中,rh选自c1~c3烷基、c1~c3酰基、
[0113]
在一些实施方式中,ri选自c1~c3烷基、c3~c6环烷基、c1~c3酰基、-co(ch2)nnrdre、其中rd、re和n的定义如上所述。
[0114]
在一些实施方式中,rd和re各自独立地选自h、c1~c3烷基、c3~c6环烷基、取代或未取代的苯基,或rd和re和与其相连的n原子形成取代或未取代的吡咯烷基、哌啶基或哌嗪基;取代的取代基选自c1~c3烷基、卤代c1~c3烷基、-oh、卤素、c1~c3烷氧基、卤代c1~c3烷氧基或-cn。
[0115]
在一些实施方式中,式ib所示的化合物选自式ib1-ib7所示的化合物。
[0116][0117]
其中,
[0118]r21
为c1~c6烷基、c3~c6环烷基或c2~c6链烯基取代的c1~c2烷基;
[0119]r32
为c1~c6烷基;
[0120]r33
选自c1~c4烷基、-c(=o)xrh、-(ch2)mori;
[0121]
x为nh或o;
[0122]
rh为h、c1~c3烷基或
[0123]ri
为h、c1~c6烷基、卤代c1~c6烷基、c3~c6环烷基、c3~c6链烯基、c1~c6酰基、-co(ch2)nnrdre、
[0124]
rd和re各自独立地选自h、c1~c3烷基、c3~c6环烷基或取代或未取代的c6~c
14
芳基,或rd和re和与其相连的n原子形成取代或未取代的吡咯烷基、哌啶基或哌嗪基;所述取代的取代基选自c1~c3烷基、卤代c1~c3烷基、-oh、卤素、c1~c6烷氧基、卤代c1~c3烷氧基或-cn;
[0125]
m和n各自独立地为0~5的整数,例如0、1、2、3、4、5。
[0126][0127]
其中,
[0128]r21
为c1~c6烷基、c3~c6环烷基或c2~c6链烯基取代的c1~c2烷基;
[0129]r42
为c1~c6烷基。
[0130][0131]
其中,
[0132]
r’各自独立地为c1~c6烷基或c1~c6烷氧基;p为1~4的整数,例如1、2、3或4;
[0133]r21
为c1~c6烷基、c3~c6环烷基或c2~c6链烯基取代的c1~c2烷基;
[0134]r33
选自氢、c1~c4烷基、-c(=o)xrh、-(ch2)mori;
[0135]
x为nh或o;
[0136]
rh为h、c1~c3烷基或
[0137]ri
为h、c1~c6烷基、卤代c1~c6烷基、c3~c6环烷基、c3~c6链烯基、c1~c6酰基、-co(ch2)nnrdre、
[0138]
rd和re各自独立地选自h、c1~c3烷基、c3~c6环烷基、取代或未取代的c6~c
14
芳基,或rd和re和与其相连的n原子形成取代或未取代的吡咯烷基、哌啶基或哌嗪基;所述取代的取代基选自c1~c3烷基、卤代c1~c3烷基、-oh、卤素、c1~c6烷氧基、卤代c1~c3烷氧基或-cn;
[0139]
m和n各自独立地为0~5的整数,例如0、1、2、3、4、5。
[0140][0141]
其中,
[0142]r21
为c1~c6烷基、c3~c6环烷基或c2~c6链烯基取代的c1~c2烷基;
[0143]r33
选自氢、c1~c4烷基、-c(=o)xrh、-(ch2)mori;
[0144]
x为nh或o;
[0145]
rh为h、c1~c3烷基或
[0146]ri
为h、c1~c6烷基、卤代c1~c6烷基、c3~c6环烷基、c3~c6链烯基、c1~c6酰基、-co(ch2)nnrdre、
[0147]
rd和re各自独立地选自h、c1~c3烷基、c3~c6环烷基、取代或未取代的c6~c
14
芳基,或rd和re和与其相连的n原子形成取代或未取代的吡咯烷基、哌啶基或哌嗪基;所述取代的取代基选自c1~c3烷基、卤代c1~c3烷基、-oh、卤素、c1~c6烷氧基、卤代c1~c3烷氧基或-cn;
[0148]
m和n各自独立地为0~5的整数,例如0、1、2、3、4、5;
[0149]r43
为c1~c6烷基;
[0150]r44
为卤素。
[0151][0152]
其中,
[0153]r21
为c1~c6烷基、c3~c6环烷基或c2~c6链烯基取代的c1~c2烷基;
[0154]r45
为c1~c6烷基、-(ch2)qnhcorg,rg为取代的5~14元杂芳基,q为2~4的整数;杂芳基优选异恶唑基。
[0155][0156]
其中,
[0157]r21
为c1~c6烷基、c3~c6环烷基或c2~c6链烯基取代的c1~c2烷基;
[0158]r46
为c1~c6烷基;
[0159][0160]
其中,
[0161]r21
为c1~c6烷基、c3~c6环烷基或c2~c6链烯基取代的c1~c2烷基;
[0162]r47
为c1~c6烷基。
[0163]
在一些实施方式中,本发明的式i所示的磺酰脲化合物选自以下化合物:
[0164]
[0165]
[0166][0167]
在一些实施方式中,本发明的磺酰脲化合物、其立体异构体或药学上可接受的盐可以以结晶水合物或溶剂合物的形式存在。这些结晶水合物或溶剂合物也包括在本发明的范围内。
[0168]
在获知本发明化合物的结构的基础上,本领域技术人员可以采用本领域中已知的反应设计并合成本发明的化合物。因此,对于合成本发明化合物的具体制备方法不做特别限制,只要能够得到本发明的化合物即可。
[0169]
在一些实施方式中,本发明式ia所示化合物可以采用以下两种方法之一进行制备:
[0170]
方法1:
[0171][0172]
式v所示化合物与式vi所示化合物通过亲核取代反应得到式ia所示化合物;
[0173]
方法2:
[0174][0175]
式vii所示化合物与式v所示化合物通过亲核取代反应得到式viii所示化合物,式viii化合物通过酯化反应、酰化反应、醚化反应或磷酸酯化反应得到式ia化合物。
[0176]
其中,r
13a
选自-cooh、-(ch2)moh,r
11
、r
13
和m的定义如上所述。
[0177]
在一些实施方式中,式v所示化合物的制备方法为:
[0178][0179]
将式iv化合物经酰化反应制备成式v所示的磺酰氨甲酸酯,
[0180]
其中,r
11
的定义如上所述。
[0181]
在一些实施方式中,可通过将式iv化合物与氯甲酸乙酯在有机溶剂中进行酰化反应制备成式v所示的磺酰氨甲酸酯,反应温度优选为冰浴温度,有机溶剂优选二氯甲烷。
[0182]
在一些实施方式中,式v所示化合物与式vi所示化合物可以在有机溶剂中进行亲核取代反应,反应在惰性气体氮气或氩气的保护下进行,有机溶剂优选甲苯,反应条件温度优选回流温度。
[0183]
在一些实施方式中,本发明式ib所示化合物可以采用如下方法进行制备:
[0184][0185]
将式ix化合物与r
21-i通过烃基化反应得到通式ib化合物,
[0186]
其中,r
21
、r
22
和r
23
的定义如上所述。
[0187]
在一些实施方式中,式ix化合物的采用以下方法之一制备而成:
[0188]
方法a:
[0189][0190]
式x化合物经酰化反应制备成式xi所示的磺酰氨甲酸酯,式xi所示化合物与式xii化合物通过亲核取代反应得到式ix所示化合物;
[0191]
方法b:
[0192][0193]
式x化合物经酰化反应制备成如式xi所示的磺酰氨甲酸酯,式xi所示化合物与式xiv所示化合物通过亲核取代反应得到式xv所示化合物;式xv所示化合物通过酯化反应、酰胺化反应、醚化反应、磷酸酯化反应得到式ix所示化合物,
[0194]
其中,r
23a
为取代的环己基,取代基选自-cooh和-(ch2)moh,r
22
、r
23
和m的定义如上所述。
[0195]
在一些实施方式中,上述烃基化反应可采用r
21-i与式ix化合物在碳酸钾存在下、以有机溶剂为溶剂进行反应,在冰浴温度下,将r
21-i逐滴加入到溶有ix的有机溶剂中,滴加完毕后,将体系升至室温,tlc检测反应完全后加入水和乙酸乙酯,分液后,水洗有机相,有机相浓缩后硅胶柱层析纯化,有机溶剂优选dmf。
[0196]
本发明另一方面提供一种药物组合物,其包含选自上述磺酰脲化合物、其立体异构体、药学上可接受的盐中的一种或多种。药物组合物还可以包括一种或者多种药学上可接收的辅料、稀释剂、载体、赋形剂或佐剂。
[0197]
经实验证实,本发明的化合物具有可溶性表氧化物水解酶(seh)抑制活性,能升高环氧二十碳三烯酸(eets)水平,进而减轻炎症反应,进而可用于预防和/或治疗心力衰竭。
[0198]
因此,本发明再一方面提供一种可溶性表氧化物水解酶抑制剂,其包含选自上述磺酰脲化合物、其立体异构体、药学上可接受的盐中的一种或多种,或者包含上述药物组合物。
[0199]
本发明还提供上述磺酰脲化合物或其立体异构体、药学上可接受的盐或者上述药物组合物的应用,所述应用选自:在制备用于抑制可溶性表氧化物水解酶的活性的药物中的应用,在制备用于升高环氧二十碳三烯酸(eets)水平的药物中的应用,在制备用于减轻炎症反应的药物中的应用,以及在制备用于预防和/或治疗心力衰竭的药物中的应用。
[0200]
本发明还提供上述磺酰脲化合物或其立体异构体、药学上可接受的盐或者上述药物组合物,其用于抑制可溶性表氧化物水解酶的活性,用于升高环氧二十碳三烯酸(eets)水平,用于减轻炎症反应,或者用于预防和/或治疗心力衰竭。
[0201]
本发明还提供用于抑制可溶性表氧化物水解酶的活性的方法,用于升高环氧二十碳三烯酸(eets)水平的方法,用于减轻炎症反应的方法,或者用于预防和/或治疗心力衰竭的方法,所述方法包括,向需要上述处理的对象施用有效量的上述磺酰脲化合物或其立体异构体、药学上可接受的盐或者上述药物组合物。
[0202]
本发明还提供了磺酰脲类药物在制备预防和/或治疗心力衰竭的药物中的应用,所述磺酰脲类药物选自格列美脲、格列齐特、格列喹酮、格列本脲、格列吡嗪、妥拉磺脲、托拉塞米和乙酸己脲。
[0203]
本发明还提供了一种预防和/或治疗心力衰竭的方法,所述方法包括,向需要上述处理的对象施用有效量的磺酰脲类药物,所述磺酰脲类药物选自格列美脲、格列齐特、格列喹酮、格列本脲、格列吡嗪、妥拉磺脲、托拉塞米和乙酸己脲。
[0204][0205]
实施例
[0206]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。在一些实施例中,对于本领域技术人员熟知的原料、元件、方法、手段等未作详细描述,以便于凸显本发明的主旨。
[0207][0208]
下列实施例进一步解释了本发明的化合物及中间体的合成方法,但并不限制本发明的范围。
[0209]1h nmr在bruker-400或bruker-500上完成,低分辨质谱在thermo fisher finnigan ltq质谱仪上完成。本发明所用的试剂及原料若无特殊说明,均为市售原料。
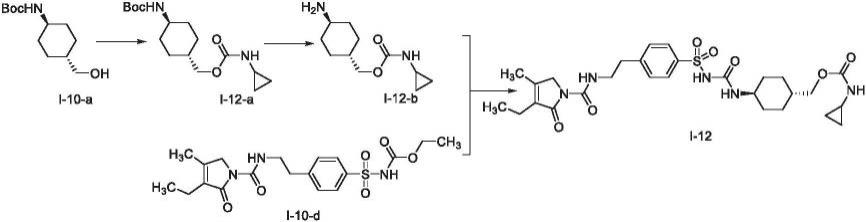
[0210]
实施例1
[0211][0212]
将200mg i-1-a、56mg碳酸钾和2mln,n-二甲基甲酰胺(dmf)加入到25ml三口瓶中,0℃条件下将55mg碘甲烷滴加至反应液中,升温至25℃反应1h。将2ml水和10ml乙酸乙酯加入反应液中,分层,有机相水洗三次(2ml
×
3),浓缩有机相通过柱层析法进行纯化,得到105mg化合物i-1,为白色固体,收率51.0%。1h nmr(dmso-d6,500mhz):8.37(t,1h),7.79(d,2h),7.50(d,2h),7.23(d,1h),4.17(s,2h),3.51(q,2h),3.05(s,3h),2.92(t,2h),2.19(q,2h),2.02(s,3h),1.73(d,2h),1.64(d,2h),1.28(m,2h),0.98(t,3h),0.92(m,2h),0.85(d,3h).esi-ms m/z 505.3(m h)
.
[0213]
实施例2
[0214][0215]
按照实施例1中相同的方法,不同之处在于以i-2-a代替i-1-a,得到化合物i-2,收率65.3%。1h nmr(cdcl3,500mhz):7.75(m,2h),7.69(d,1h),7.49(m,2h),7.37(d,1h),7.22(m,2h),4.27(m,2h),3.91(s,3h),3.12(s,3h),3.05(m,2h),1.91(m,1h),1.74(dt,2h),1.65(s,3h),1.63(m,1h),1.55(s,6h),1.42-1.24(m,6h).esi-ms m/z 542.2(m h)
.
[0216]
实施例3
[0217][0218]
按照实施例1中相同的方法,不同之处在于以i-3-a代替i-1-a,得到化合物i-3,收率72.3%。1h nmr(cdcl3,500mhz):8.19(d,1h),7.83(s,1h),7.79(d,2h),7.45(d,2h),7.41(dd,1h),7.23(d,1h),6.90(d,1h),3.81(s,3h),3.77(q,2h),3.14(s,3h),3.05(t,2h),1.78(m,3h),1.30(m,6h).esi-ms m/z 508.2(m h)
.
[0219]
实施例4
[0220][0221]
按照实施例1中相同的方法,不同之处在于以i-4-a代替i-1-a,得到化合物i-4,收率61.6%。1h nmr(cdcl3,500mhz):7.96(s,1h),7.72(d,2h),7.36(d,2h),3.23(d,2h),3.13(s,2h),2.66(d,2h),2.46(m,5h),1.68-1.50(m,6h).esi-ms m/z 338.4(m h)
.
[0222]
实施例5
[0223][0224]
按照实施例1中相同的方法,不同之处在于以i-5-a代替i-1-a,得到化合物i-5,收率58%,esi-ms m/z 339.1(m h)
.
[0225]
实施例6
[0226][0227]
按照实施例1中相同的方法,不同之处在于以烯丙基溴代替碘甲烷,得到化合物i-6,收率43%,esi-ms m/z 531.3(m h)
.
[0228]
实施例7
[0229][0230]
按照实施例1中相同的方法,不同之处在于以i-7-a代替i-1-a、异丙基溴代替碘甲烷,得到化合物i-7,收率53%,esi-ms m/z 366.2(m h)
.
[0231]
实施例8
[0232][0233]
按照实施例1中相同的方法,不同之处在于以环丙基溴代替碘甲烷,得到化合物i-8,收率52%,esi-ms m/z 531.2(m h)
.
[0234]
实施例9
[0235][0236]
将i-9-a(1.1g,2.18mmol)溶于20mldmf中,加入咪唑(0.75g,10.92mmol),将叔丁基二苯基氯硅烷(tbdpscl)(0.6ml,2.29mmol)滴加进去,搅拌过夜,tlc监测原料转化完毕,加入乙酸乙酯稀释,有机相水洗,食盐水洗,无水硫酸钠干燥,过滤浓缩得i-9-b,未经进一步纯化直接用于下一步。
[0237]
按照实施例1中相同的方法,不同之处在于以i-9-b代替i-1-a,得到化合物i-9-c。
[0238]
将i-9-c(0.2g,0.26mmo1)溶于四氢呋喃中,滴加入1.5ml浓盐酸,室温下搅拌5h,tlc监测原料转化完毕,加入二氯甲烷稀释,有机相食盐水洗,无水硫酸钠干燥,过滤浓缩,纯化得到i-9,收率54%,esi-ms m/z 521.2(m h)
.
[0239]
实施例10
[0240][0241]
第一步:将i-10-a(143mg,0.62mmol)悬浮于二氯甲烷(dcm)中,加入3eq三乙胺,室温下滴加入2.5eq异氰酸乙酯,室温下(10~18℃)过夜反应,tlc监测原料转化完毕,加乙酸乙酯(ea)稀释,有机相稀盐酸(14ml 1n盐酸稀释至80ml)洗,食盐水洗,干燥过滤浓缩得白色固体i-10-b(180mg,0.6mmol)。
[0242]
第二步:将i-10-b(180mg,0.6mmol)溶于dcm中,室温下滴加入三氟乙酸10eq,加毕室温搅拌3h。浓缩掉大部分三氟乙酸,残液加dcm稀释,加入碳酸氢钠水溶液调ph至弱碱性,分出有机相,水相再用dcm反复萃取多次,合并有机相,干燥过滤浓缩得i-10-c。
[0243]
第三步:将i-10-d(2g,5.70mmol)悬浮于30ml二氯甲烷中,加入三乙胺(1.98ml,14.2mmol),置于冰浴下,滴加入氯甲酸乙酯(810μl,8.54mmol),加毕,缓慢升温至室温,7h后tlc监测反应完毕。100ml二氯甲烷稀释,有机相稀盐酸(14ml 1n盐酸稀释至80ml)洗,食盐水洗,无水硫酸钠干燥,浓缩得粗品,加入8ml丙酮,回流搅拌2h,再于室温下搅拌2h,过滤,烘干得白色固体i-10-e。
[0244]
第四步:将i-10-c(50mg,0.25mmol)与1-10-e(105mg,0.25mmol)混合于少量甲苯中,氮气置换,回流5h,体系浓缩,丙酮打浆后得i-10,共95mg。1h nmr(400mhz,dmso-d6)δ10.35(s,1h),8.37(t,j=5.8hz,1h),7.87-7.73(m,2h),7.46(d,j=8.2hz,2h),7.02(d,j=6.1hz,1h),6.31(d,j=7.7hz,1h),4.17(s,2h),3.71(d,j=6.5hz,2h),3.50(q,j=6.8hz,2h),3.19(dd,j=7.7,3.8hz,0h),2.97(qd,j=7.2,5.6hz,2h),2.90(t,j=7.2hz,
2h),2.18(q,j=7.5hz,2h),2.01(s,3h),1.69(dd,j=28.0,12.3hz,4h),1.45(s,1h),1.16-1.04(m,2h),0.98(td,j=7.4,2.8hz,7h).esi-ms m/z 578.3(m h)
.
[0245]
实施例11
[0246][0247]
按照实施例1中相同的方法,不同之处在于以i-10代替i-1-a,得到化合物i-11,收率57%。esi-ms m/z 592.3(m h)
.
[0248]
实施例12
[0249][0250]
按照实施例10中相同的方法,不同之处在于:第一步以异氰酸环丙酯代替异氰酸乙酯,最终得到化合物i-12,收率为52%。esi-ms m/z 590.3(m h)
。
[0251]
实施例13
[0252][0253]
按照实施例10中相同的方法,不同之处在于:第一步以4-三氟甲氧基苯基异氰酸酯代替异氰酸乙酯,最终得到化合物i-13。最后一步收率为62%。1h nmr(500mhz,dmso-d6)δ10.37(s,1h),9.82(s,1h),8.37(t,j=5.8hz,1h),7.81(d,j=8.4hz,2h),7.54(d,j=8.9hz,2h),7.46(d,j=8.4hz,2h),7.28(d,j=8.6hz,2h),6.34(d,j=7.7hz,1h),4.17(s,2h),3.89(d,j=6.5hz,2h),3.53-3.46(m,2h),3.27-3.16(m,1h),2.90(t,j=7.2hz,2h),2.18(q,j=7.5hz,2h),2.00(s,3h),1.74(td,j=14.7,3.7hz,4h),1.60-1.49(m,1h),1.12(qd,j=12.7,3.7hz,2h),1.07-0.88(m,5h).esi-ms m/z 710.2(m h)
。
[0254]
实施例14
[0255][0256]
将1.1eq n,n-二甲基甘氨酸与1.2eq 1-乙基-3-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edci.hcl)及催化量的4-二甲氨基吡啶(dmap)混合于少量dmf中,搅拌5min,一次性
加入i-9-a(50mg,1eq),室温下搅拌过夜,加ea稀释,有机相氯化铵水溶液洗,食盐水洗,干燥,浓缩,硅胶柱层析,得i-14,收率为67%。1h nmr(400mhz,dmso-d6)δ10.54(s,1h),10.21(s,1h),8.38(t,j=5.8hz,1h),7.81(d,j=8.1hz,2h),7.45(d,j=8.1hz,2h),6.63(d,j=7.7hz,1h),4.20(s,2h),4.17(s,2h),3.99(d,j=6.3hz,2h),3.49(q,j=6.8hz,2h),3.22(d,j=10.4hz,1h),2.90(t,j=7.2hz,2h),2.82(s,6h),2.19(q,j=7.5hz,2h),2.01(s,3h),1.78-1.64(m,4h),1.56(s,1h),1.08(ddd,j=31.6,13.7,6.9hz,3h),0.98(t,j=7.5hz,4h).esi-ms m/z 592.5(m h)
。
[0257]
实施例15
[0258][0259]
按照实施例1中相同的方法,不同之处在于:以i-14代替i-1-a,得到化合物i-15,收率57%。esi-ms m/z 606.3(m h)
.
[0260]
实施例16
[0261][0262]
按照实施例14中相同的方法,不同之处在于:以2-哌啶基乙酸代替n,n-二甲基甘氨酸,得到化合物i-16,收率49%。esi-ms m/z 632.5(m h)
.
[0263]
实施例17
[0264][0265]
将i-17-b与1.1eq的i-17-a溶于dmf,2eq的碳酸钾加入到体系中,室温反应1小时后,tlc显示反应完全,体系加水ea萃取多次,ea相水洗、饱和食盐水洗,无水硫酸钠干燥后过滤旋干,柱层析得到化合物i-17,收率32%。esi-ms m/z 691.3(m h)
.
[0266]
实施例18
[0267][0268]
i-10-e(100mg,0.2mmol,1eq)溶于dcm(2ml),2,6-二甲基吡啶(46.6λl,0.4mmol,2.0eq)逐滴加入后,反应液降温至-30℃,i-18-a(1.5eq)溶于dcm中加入体系后升温至室
温,tlc监测反应完全,反应液倒入水(10ml)中,二氯甲烷(15ml
×
3)萃取,分层,有机相依次使用0.5m稀盐酸(10ml)、饱和碳酸氢钠(10ml)、饱和食盐水(10ml)洗涤,无水硫酸钠干燥,过滤拌样旋干后柱层析得化合物i-18,收率20%,白色固体。esi-ms m/z 819.3(m h)
.
[0269]
实施例19
[0270][0271]
按照实施例18中相同的方法,不同之处在于:以i-19-a代替i-18-a,得到化合物i-19,收率19%。esi-ms m/z 776.3(m h)
.
[0272]
实施例20
[0273][0274]
按照实施例1中相同的方法,不同之处在于:以i-17代替i-1-a,得到化合物i-20,收率28%。esi-ms m/z 705.4(m h)
.
[0275]
实施例21
[0276][0277]
按照实施例1中相同的方法,不同之处在于:以i-18代替i-1-a,得到化合物i-21,收率22%。esi-ms m/z 847.5(m h)
.
[0278]
实施例22
[0279][0280]
按照实施例1中相同的方法,不同之处在于:以i-19代替i-1-a,得到化合物i-22,收率19%。esi-ms m/z 790.5(m h)
.
[0281]
实施例23
[0282][0283]
将i-9-a(0.14g,0.27mmol)悬浮于二氯甲烷中,室温下加入n,n-二异丙基乙基胺(dipea)(96μl,0.55mmol)和dmap(4mg,0.03mmol),再滴加乙酸酐(39μl,0.41mmol),搅拌过夜,tlc监测原料转化完毕,加二氯甲烷稀释,有机相稀盐酸洗,食盐水洗,无水硫酸钠干燥,过滤浓缩得粗品若干,于适量丙酮中重结晶,过滤烘干得到白色固体i-23(85mg,0.16mmol),收率57%。1h nmr(500mhz,dmso-d6)δ10.35(s,1h),8.37(t,j=5.8hz,1h),7.81(d,j=8.0hz,2h),7.46(d,j=8.0hz,2h),6.33(d,j=7.8hz,1h),4.17(s,2h),3.79(d,j=6.6hz,2h),3.50(q,j=6.7hz,2h),3.25-3.16(m,1h),2.90(t,j=7.2hz,2h),2.18(q,j=7.5hz,2h),2.01(s,3h),1.99(s,3h),1.77-1.70(m,2h),1.66(d,j=13.0hz,2h),1.50(s,0h),1.16-1.05(m,2h),0.97(t,j=7.4hz,4h).esi-ms m/z 571.3(m na)
[0284]
实施例24
[0285][0286]
按照实施例1中相同的方法,不同之处在于:以i-23代替i-1-a,得到化合物i-24,收率48%。esi-ms m/z 585.3(m na)
.
[0287]
实施例25
[0288][0289]
按照实施例10中相同的方法,不同之处在于:第一步用碘甲烷代替异氰酸乙酯得到i-25-a,最终得到化合物i-25,收率78%。esi-ms m/z 521.2(m na)
.
[0290]
实施例26
[0291][0292]
第一步:将原料i-26-a(2.5g,13.92mmol)悬浮于20ml甲醇中,滴加入浓硫酸
(275mg,2.8mmo1),60℃反应过夜,旋掉溶剂,大量白色固体形成,加入15ml丙酮打浆,过滤,烘干得白色固体i-26-b(2.33g,12.01mmo1),收率86%。
[0293]
第二步:按照实施例10中第四步相同的方法,将i-26-b与i-10-e反应,最终得到化合物i-26。收率72%,1h nmr(500mhz,dmso-d6)δ10.37(s,1h),8.37(t,j=5.8hz,1h),7.86-7.74(m,1h),7.46(d,j=8.5hz,1h),6.35(d,j=7.7hz,1h),4.17(s,1h),3.56(s,2h),3.52-3.47(m,1h),3.22(dt,j=7.7,3.9hz,0h),2.90(t,j=7.2hz,1h),2.27-2.13(m,2h),2.08(s,1h),2.01(s,1h),1.89-1.81(m,1h),1.73(dd,j=12.8,3.6hz,1h),1.31(qd,j=13.2,3.4hz,1h),1.20-1.08(m,1h),0.97(t,j=7.5hz,2h).esi-ms m/z 535.4(m h)
.
[0294]
实施例27
[0295][0296]
第一步:按照实施例1中相同的方法,不同之处在于:以1-26代替i-1-a,得到化合物i-27-a,收率48%。
[0297]
第二步:将i-27-a(55mg,0.1mmol)悬浮于1ml四氢呋喃,氢氧化锂一水合物(0.12mmol)溶于0.1ml水后加入体系,随后加入0.1ml甲醇,回流3小时后旋掉溶剂后加水,用1m盐酸调ph,小心加入1.2ml1 m盐酸后析出大量固体,过滤得到化合物i-27,收率48%。esi-ms m/z 557.2(m na)
.
[0298]
实施例28
[0299][0300]
按照实施例26的合成方法,不同之处在于:第一步用异丙醇替代甲醇,最终得到化合物i-28,收率65%。esi-ms m/z 563.3(m h)
.
[0301]
实施例29
[0302][0303]
按照实施例10中第四步相同的方法,不同之处在于:以i-29-a替代i-10-c,最终得到化合物i-29,收率58%。esi-ms m/z 534.5(m h)
.
[0304]
实施例30
[0305][0306]
按照实施例10中第四步相同的方法,不同之处在于:以i-30-a替代i-10-c、以i-30-b代替i-10-e,最终得到化合物i-30,收率38%。esi-ms m/z 549.2(m h)
.
[0307]
实施例31
[0308][0309]
按照实施例10中第四步相同的方法,不同之处在于:以i-31-a替代i-10-c,最终得到化合物i-31,收率42%。esi-ms m/z 536.2(m h)
.
[0310]
实施例32
[0311][0312]
按照实施例1中相同的方法,不同之处在于:以i-32-a代替i-1-a,得到化合物i-32,收率25%。esi-ms m/z 460.2(m h)
.
[0313]
实施例33
[0314][0315]
按照实施例1中相同的方法,不同之处在于:以i-33-a代替i-1-a,得到化合物i-33,收率35%。esi-ms m/z 326.2(m h)
.
[0316]
实施例34
[0317][0318]
第一步:按照实施例10中第四步相同的方法,不同之处在于:以i-34-a替换i-10-c,得到化合物i-34-b。
[0319]
第二步:按照实施例1中相同的方法,不同之处在于:以i-34-b代替i-1-a,得到化合i-34,收率35%。esi-ms m/z 519.3(m h)
.
[0320]
实施例35
[0321][0322]
按照实施例1中相同的方法,不同之处在于:以i-35-a代替i-1-a,得到化合物i-35,收率33%。esi-ms m/z 464.2(m h)
.
[0323]
实施例36
[0324][0325]
按照实施例1中相同的方法,不同之处在于:以i-36-a代替i-1-a,得到化合物i-36,收率38%。esi-ms m/z 381.1(m h)
.
[0326]
实施例37
[0327][0328]
按照实施例1中相同的方法,不同之处在于以碘乙烷代替碘甲烷,得到化合物i-37,收率39%。1h nmr(400mhz,dmso-d6)δ8.35(t,j=5.8hz,1h),7.84-7.74(m,2h),7.53-7.45(m,2h),7.27(d,j=7.7hz,1h),4.15(s,2h),3.60(q,j=7.0hz,2h),3.57-3.46(m,2h),3.36(dt,j=7.8,3.9hz,0h),2.91(t,j=7.1hz,2h),2.18(q,j=7.5hz,2h),2.01(s,3h),1.73(dd,j=13.0,3.8hz,2h),1.67-1.59(m,2h),1.25(qd,j=12.7,3.4hz,3h),1.05(t,j=7.0hz,3h),0.97(t,j=7.5hz,3h),0.92(dd,j=12.0,3.1hz,1h),0.84(d,j=
6.5hz,3h).esi-ms m/z 518.8(m h)
.
[0329]
实施例38
[0330][0331]
按照实施例1中相同的方法,不同之处在于以2-碘代丙烷代替碘乙烷,得到化合物i-38,收率21.3%。esi-ms m/z 533.5(m h)
.
[0332]
实施例39
[0333][0334]
按照实施例23中相同的方法,不同之处在于以丙酸酐代替乙酸酐,得到化合物i-39,收率42%。esi-ms m/z 563.2(m h)
.
[0335]
实施例40
[0336][0337]
按照实施例1中相同的方法,不同之处在于:以i-39代替i-1-a,得到化合物i-40,收率38%。esi-ms m/z 599.3(m na)
.
[0338]
实施例41
[0339][0340]
按照实施例23中相同的方法,不同之处在于以异丁酸酐代替乙酸酐,得到化合物i-41,收率35%。esi-ms m/z 577.2(m h)
.
[0341]
实施例42
[0342][0343]
按照实施例1中相同的方法,不同之处在于:以1-41代替i-1-a,得到化合物i-42,收率41%。esi-ms m/z 591.3(m h)
.
[0344]
实施例43
[0345][0346]
按照实施例23中相同的方法,不同之处在于以特戊酸酐代替乙酸酐,得到化合物i-43,收率37%。esi-ms m/z 591.3(m h)
.
[0347]
实施例44
[0348][0349]
按照实施例1中相同的方法,不同之处在于:以i-43代替i-1-a,得到化合物i-44,收率45%。esi-ms m/z 605.3(m h)
.
[0350]
实验例1化合物seh酶抑制活性试验
[0351]
seh assay buffer购自cayman chemical;seh(人源重组)酶购自cayman chemical;seh底物(substrate)为购自cayman chemical;20%dmso化合物工作液如下配制:二甲基亚砜与水按1∶4的体积比混合,摇匀即可。
[0352]
实验方法:
[0353]
冰上解冻seh assay buffer(10
×
),seh酶(人源重组),seh底物(substrate);
[0354]
将seh assay buffer(10
×
)用去离子水配置成1
×
seh assay buffer;取12μl seh酶,加入588μl 1x assay buffer进行50倍稀释,得到seh酶工作液;取180μl 1x assay buffer到对应孔中;取5μl/孔seh酶工作液到对应孔;取5μl/孔20%dmso化合物工作液到对应孔中,同时设空白孔和加入等量dmso的阴性对照;1000rpm离心1分钟,放置25℃孵育30分钟;结束孵育后,取5μl/孔底物到96孔板中,1000rpm离心1分钟;25℃孵育15分钟后读取发射波长320nm和发射波长460nm处的荧光值。
[0355]
酶抑制率计算:
[0356]
抑制率(%)=100-(荧光强度(样品)-荧光强度(空白))/(荧光强度(阴性对照)-荧光强度(空白))
×
100%
[0357]
实验结果如表1所示,a表示ic
50
小于200nm,b表示ic
50
介于200nm~1μm之间,c表示ic
50
介于1μm~10μm之间,d表示ic
50
介于10μm~100μm之间。
[0358]
表1.化合物seh酶抑制活性
[0359]
化合物编号抑制活性化合物编号抑制活性i-1ci-23ci-2ai-24ci-3ai-25bi-4ci-26ci-5bi-27di-6ci-28bi-7ci-29ci-8ci-30di-9bi-31ci-10bi-32ci-11ai-33ci-12bi-34ci-13ci-35ci-14di-36c
i-15bi-37ci-16bi-38ci-17di-39ci-18di-40ci-19di-41ci-20di-42ci-21di-43ci-22di-44c
[0360]
实验例2化合物活性测定
[0361]
使用本发明的化合物i-1、i-4和i-23以及格列美脲进行测定,阳性对照为12-(3-金刚烷-1-基-脲基)-十二烷酸(auda)。
[0362]
生物材料来源:人源心肌细胞系ac16购自美国atcc,对苯肾上腺素(phenylephrine,pe)购自sigma公司,auda购自cayman公司。
[0363]
(1)心肌细胞中seh的抑制试验
[0364]
细胞干预方式:化合物溶于dmso溶媒中,本发明化合物的工作浓度分别为0.1μm、1μm和10μm,格列美脲的工作浓度分别为0.1μm、1μm和10μm,auda的工作浓度为1μm;干预时间为24小时。
[0365]
seh活性检测:采用detroit r&d公司的elisa检测试剂盒(biotarget 14,15-eet/dhet elisa kit),按照试剂盒说明书进行实验。
[0366]
实验:干预24小时后,收集心肌细胞,进行上述检测。
[0367]
实验结果如图1、2、3、4所示,其中图1显示化合物i-1对seh酶的抑制效应,图2显示化合物i-4对seh酶的抑制效应,图3显示化合物i-23对seh酶的抑制效应,图4显示格列美脲对seh酶的抑制效应。
[0368]
由图1、2、3可知,与对照组相比,本发明的化合物i-1、i-4和i-23显著地增加了eets的含量,而减少了dhet的含量,提示化合物i-1、i-4和i-23抑制了心肌细胞中seh的活性。
[0369]
由图4可知,格列美脲对seh酶活性有明显的抑制作用,且随浓度升高抑制作用增强。
[0370]
(2)对pe诱导的心肌损伤抑制作用
[0371]
细胞干预方式:pe溶于消毒的去离子水中,工作浓度为100μm;化合物溶于dmso溶媒中,本发明化合物的工作浓度分别为0.1μm,0.5μm,1μm,格列美脲工作浓度为10μm,auda的工作浓度为1μm;干预时间为24小时。
[0372]
心室重塑生物标志物mpa检测:使用invitrogen公司的trizol试剂提取总rna,接着使用takara公司的逆转录试剂盒获得cdna,最后采用特异性的引物扩增相关基因的mpa含量。
[0373]
实验结果:干预24小时后,收集心肌细胞,进行上述检测。
[0374]
结果如图5、6、7、8所示,其中图5显示化合物i-1对pe诱导的心肌细胞重塑的抑制效应,图6显示化合物i-4对pe诱导的心肌细胞重塑的抑制效应,图7显示化合物i-23对pe诱导的心肌细胞重塑的抑制效应,图8显示格列美脲对pe诱导的心肌细胞重塑的抑制效应。
[0375]
由图5、6、7、8可知,与对照组相比,pe诱导的bnp表达增加,提示心肌细胞发生了重塑,而本发明化合物i-1、i-4和i-23以及格列美脲可以抑制这一效应。
[0376]
(3)体内抗心衰作用
[0377]
小鼠模型制备:12周龄雄性c57bl/6小鼠购自江苏集萃药康生物股份有限公司,饲养于华中科技大学同济医学院spf级动物房。小鼠在动物房适应一周后开始予以胸主动脉缩窄术,作为tac组。另有一组小鼠予以开胸处理,不结扎胸主动脉,作为手术对照(sham)组。同时使用auda作为阳性对照。
[0378]
小鼠心脏超声检测:使用visual sonics inc.公司的vevo 2100小动物超声进行心脏超声检测。主要测量指标包括:心率(hr)、左心室射血分数(lvef)、左心室短轴缩短率(lvfs)、左心室舒张期或收缩期室间隔厚度(lvidd和lvids)、左心室后壁厚度(lvpwd和lvpws)。
[0379]
小鼠心脏血流动力学检测:使用millar instrμment powerlab公司的millar压力-容积系统进行。将动物麻醉至适当深度后,在颈部做正中切口,分离右颈总动脉,结扎其远心端,夹闭近心端,用显微剪在动脉上做v形切口,插入微导管,直至左心室,经过传导系统记录信号,以获得心率(hr)、左室舒张末压(ped)、左室收缩末压(pes)、左室压力最大下降速度(-dp/dtmin)和左室压力最大上升速率( dp/dtmax)等血流动力学数据。
[0380]
组织学检测:心肌组织放入包埋框中在中性甲醛溶液中浸泡固定,脱水,石蜡包埋,将蜡块上切片机切成厚度为4μm的切片。he染色观察心肌大体观,天狼猩红染色观察心肌纤维化。
[0381]
心室重塑生物标志物mrna检测:使用invitrogen公司的trizol试剂提取总rna,接着使用takara公司的逆转录试剂盒获得cdna,最后采用特异性的引物扩增相关基因的mrna含量。
[0382]
实验:tac术后两周行心脏超声检测,选取心功能无差异的24只tac小鼠,随机分为模型组(tac)及治疗组(tac 化合物),模型组无其他干预,治疗组予以每天灌胃(本技术化合物i-1和i-230.2mg/kg及0.4mg/kg,格列美脲1.2mg/kg),八周后,即慢性心力衰竭期处死动物,收集组织标本,进行上述检测。
[0383]
结果如图9-21所示,其中,图9-12显示化合物i-1的结果,图13-15显示化合物i-23的结果,图16-21显示格列美脲的结果(其中sham表示假手术组)。
[0384]
由图9和13可知,与对照组相比,tac手术使得慢性心力衰竭小鼠心脏射血分数ef值,fs值和dp/dt明显降低,提示心功能受损,而化合物i-1和i-23可以抑制这一效应。由图16可知,对照组相比,tac手术使得慢性心力衰竭小鼠心脏中seh活性增加,而格列美脲可以抑制这一效应。由图17可知,tac手术使得慢性心力衰竭小鼠心脏射血分数ef值和dp/dt明显降低,提示心功能受损,而格列美脲可以抑制这一效应。
[0385]
如图10、14、18、19可知,he染色显示tac手术使得慢性心力衰竭小鼠心肌细胞横截面积增大,提示心肌肥厚,而化合物i-1、i-23和格列美脲可以抑制这一效应。
[0386]
如图11、15、20、21可知,tac手术使得慢性心力衰竭小鼠心脏天狼猩红染色阳性面积增加,提示发生心肌纤维化,而化合物i-1、i-23和格列美脲可以抑制这一效应。
[0387]
如图12可知,tac手术使得小鼠心肌细胞bnp表达增加,提示心肌细胞发生了重塑,而化合物i-1可以抑制这一效应。
[0388]
实验:tac术后两周行心脏超声检测,选取心功能无差异的24只tac小鼠,随机分为模型组(tac)及治疗组(tac 化合物),模型组无其他干预,治疗组予以每天灌胃给药(i-230.44mg/kg或恩格列净10mg/kg),八周后,即慢性心力衰竭期处死动物,收集组织标本,进行上述检测。
[0389]
本实验为检测化合物i-23与恩格列净对于慢性心衰改善效应的比较。
[0390]
由图22和23可知,化合物i-23和恩格列净对慢性心衰小鼠心脏肥大具有逆转作用,且化合物i-23与恩格列净效应相当。
[0391]
由图24可知,与对照组相比,tac手术使得慢性心力衰竭小鼠心脏射血分数ef值、fs值、收缩期左室内径lvids和dp/dt明显降低,提示心功能受损,而化合物i-23和恩格列净可以抑制这一效应,且化合物i-23与恩格列净效应相当。
[0392]
如图25和26可知,he染色显示tac手术使得慢性心力衰竭小鼠心肌细胞横截面积增大,提示心肌肥厚,而化合物i-23和恩格列净均可改善这一效应。
[0393]
如图27可知,tac手术使得慢性心力衰竭小鼠心脏天狼猩红染色阳性面积增加,提示发生心肌纤维化,而化合物i-23和恩格列净可以抑制这一效应。
[0394]
如图28可知,tac手术使得小鼠心肌细胞bnp表达增加,提示心肌细胞发生了重塑,而化合物i-23及恩格列净可以抑制这一效应。
[0395]
在所列举的实验例中未特别注明的auda给药浓度均为1μm。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。