1.本发明涉及荧光染料技术领域,具体涉及一种背景荧光低、水溶性好,粘性敏感性高、分子结构可调的荧光染料及其制备方法和用途。
背景技术:
2.细胞粘度是影响物质扩散速率的重要参数之一,通过影响物质的移动性,对物质的运输、信号传导、识别及生物大分子的相互作用有着极大的影响。同时细胞内粘度的改变与粥样硬化、糖尿病、阿尔茨海默病及肿瘤的发生有一定的关系,是这些疾病潜在的指示指标。因此,检测细胞内的粘度具有非常重要的意义。荧光方法由于具有灵敏、即时、原位、可视等独特优势是测试细胞内微观粘度的一种重要手段。不同于宏观大体积粘稠流体的粘度的测定可以使用转子粘度计,落球粘度计等仪器,细胞内粘度的测定一般采用基于分子转子的荧光探针。分子转子是一类特殊的荧光分子,其在激发态非辐射跃迁损失的能量随粘度的改变而变化,粘度或周围刚性的增加会阻碍分子转子的扭曲,分子转子非辐射跃迁损失的能量会减少,具体的表现为分子转子的荧光强度升高。所以分子转子的荧光强度就可以直接反映细胞内微环境的粘度。
3.粘度响应的分子转子荧光分子除了检测细胞内的微粘度之外,他还常常被用于荧光激活点亮型探针(fluorogenic probe)的设计。这主要是因为当分子转子荧光分子和蛋白、核酸或其他的生物分子结合后限制了它的扭曲转动(等同于黏性的增加),荧光被点亮,而没有结合的分子处于扭曲状态不发荧光,则实现了对生物分子的低背景,高特异性的荧光点亮。对于生物体中低丰度的生物分子的荧光造影在保证高的信噪比的同时要求更低的背景。如应用广泛的噻唑橙染料在标记大分子蛋白和trna时有好的信噪比,但也表现出了比较强的背景荧光,在标记一些丰度低的小的生物分子时受到比较严重的限制。所以发展低背景,粘度响应敏感,信噪比高的荧光染料分子极其重要,将会在更多的领域里有更加广泛的应用。
4.各类荧光探针背景高原因主要有:一是常亮型的荧光探针因为本身荧光无法淬灭的问题导致强的荧光背景,如香豆素,荧光素,罗丹明这类传统的荧光染料,他们本身在水里发出明亮的荧光,当和靶标物质结合后必须要进行清洗才能成像,但往往因为没法彻底清洗的原因造成强的背景荧光。二是淬灭型的荧光探针因为淬灭不彻底导致的背景荧光,如罗丹明用典型的淬灭基团利用pet、fret淬灭荧光后成像rna因为淬灭不彻底导致了强的背景荧光。三是环境响应型荧光探针因为水溶性差而亲脂导致的背景荧光。环境响应型的荧光分子本身在水里不发荧光,当与靶标结合后荧光被点亮,但荧光探针如果水溶性太差因为相似相容的原理就会和细胞膜结构结合,从而也能激活一些荧光,造成背景的问题。所以作为粘度响应型的荧光探针,要解决背景荧光的问题,改善探针的水溶性是一个很关键的因素。
5.荧光染料作为荧光探针之于荧光蛋白而言最大的优势在于小分子荧光染料结构可调,从而波长可调以实现对生物分子不同颜色的标记。虽说小分子荧光探针的结构可调,
但很多在有机合成上需要很多步骤,很多的分子合成产率也不高,所以付出了比较高的代价。再者是作为荧光染料,长波长具有明显的优势,但现有的染料的结构中,长波长的分子一般具有比较大的共轭,大的共轭一般意味着化合物的水溶性比较差,则会导致背景荧光的问题。如果只改变染料分子上的一个化学元素就可以使波长发生明显的改变,并且可以使波长向长波长移动,那么就可以保证荧光分子结构小的同时使波长变长,这就可以保证染料分子水溶性的同时实现染料分子的长波长化,这对于生物成像将有十分重大的意义。
技术实现要素:
6.本发明的目的在于提供一种具有种背景荧光低、水溶性好,粘度响应敏感、波长可调的荧光染料。
7.本发明一方面,提供一种荧光染料,包括电子供体部分d、共轭体系e和电子受体部分a,所述荧光染料如式(i)
[0008][0009]
电子供体部分-d为(x1)(x2)n-,x1、x2独立地选自氢、烷基、或改性烷基,x1,x2任选相互连接,与n原子一起形成脂杂环;
[0010]
共轭体系e为选自亚芳香环、亚芳香杂环中的至少一种共轭连接而形成,其中共轭体系e所含的各氢原子任选独立地被烷基取代;
[0011]
电子供体部分d-中的x1、x2任选独立地和n原子一起与共轭体系e形成脂杂环;
[0012]
电子受体部分任选形成下式(i-1)环状结构:
[0013][0014]
其中,
[0015]
r1独立地选自-o-、-s-、和-(nra)-,其中ra选自氢、或烷基;
[0016]
r2独立地选自=o、=s、和=nh;
[0017]
r3独立地选自=o、=s、=nh;
[0018]
x独立地选自氢、烷基或改性烷基;
[0019]
其中,所述“烷基”为c
1-c
30
的直链或支链的烷基;优选地,为c
1-c
10
直链或支链烷基;优选地,为c
1-c7直链或支链烷基;优选地,为c
1-c5直链或支链烷基;优选地,选自甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、仲丁基、正戊基,1-甲基丁基、2-甲基丁基、3-甲基丁基、异戊基、1-乙基丙基、新戊基、正己基、1-甲基戊基、2-甲基戊基、3-甲基戊基、
异己基、1,1-二甲基丁基、2,2-二甲基丁基、3,3-二甲基丁基、1,2-二甲基丁基、1,3-二甲基丁基、2,3-二甲基丁基、2-乙基丁基、正庚基、2-甲基己基、3-甲基己基、2,2-二甲基戊基、3,3-二甲基戊基、2,3-二甲基戊基、2,4-二甲基戊基、3-乙基戊基或2,2,3-三甲基丁基;
[0020]
所述“改性烷基”为烷基的任意碳原子被选自卤原子、-o-、-oh、-co-、-so
2-、-(s=o)-、伯氨基、仲氨基、叔氨基、中的至少一种基团置换所得的基团,所述改性烷基具有1~30个碳原子(可选地,所述改性烷基具有1~12个碳原子;可选地,所述改性烷基具有1~10个碳原子;可选地,所述改性烷基具有1~8个碳原子;可选地,所述改性烷基具有1~5个碳原子;可选地,所述改性烷基具有1~2个碳原子),
[0021]
所述的碳原子被置换,是指碳原子或碳原子与其上的氢原子一起被相应的基团置换;
[0022]
所述“脂杂环”为环上含有选自n、o、或s中的至少一种杂原子的饱和或不饱和的4~10元单环或多环脂杂环,所述脂杂环上含有s原子时,其为-s-、-so-或-so
2-;所述脂杂环任选被烷基取代;
[0023]
所述“亚芳香环”为6~13元单环或稠合双环或稠合多环的亚芳香基团;
[0024]
所述“亚芳香杂环”为环上含有选自n、o、s或si中的至少一种杂原子的5~12元单环或稠合双环或稠合多环的亚杂芳香基团;
[0025]
所述“卤原子”各自独立地选自f、cl、br、i;
[0026]
所述“伯胺基”为rnh2基团;
[0027]
所述“仲胺基”为rnhr'基团;
[0028]
所述“叔胺基”为rnr'r”基团;
[0029]
各个r、r'、r”各自独立地为单键、烷基、亚烷基、改性烷基或改性亚烷基;
[0030]
所述“亚烷基”为c
1-c
10
直链或支链亚烷基,可选为c
1-c6支链或支链亚烷基;
[0031]
所述“改性亚烷基”为c
1-c
10
(可选为c
1-c6)烷基或亚烷基的任意碳原子被选自-o-、-oh、-co-、-cs-、-(s=o)-中一种基团置换所得的基团;所述的碳原子被置换,是指碳原子或碳原子与其上的氢原子一起被相应的基团置换;
[0032]
可选地,所述改性烷基或改性亚烷基各自独立地为含有选自-oh、-o-、-nh2、乙二醇单元(-(ch2ch2o)n-)、c1~c8烷基、c1~c8卤代烷基(优选c2~c6卤代烷基)、c1~c8烷基羧基(优选c2~c6烷基羧基)-so
2-nh-、卤原子、氰基、硝基中至少一种基团的基团,其中,n为1~30,更优选为1~10;更优选为1~2;
[0033]
可选地,所述c1~c8烷基为甲基、乙基、丙基、异丙基,所述c1~c8烷氧基为甲氧基、乙氧基、丙氧基、异丙氧基,所述c1~c8酰基氧基为乙酰氧基、乙基、丙基、异丙基,所述c1~c8卤代烷基为三氟甲基、氯甲基、溴甲基;
[0034]
可选地,所述脂杂环选自吗啉、硫代吗啉,四氢吡啶;
[0035]
可选地,x1和x2各自独立地被1个或多个选自羟基、氰基、卤原子、羧基的基团取代的c
1-10
直链或支链烷基;
[0036]
可选地,所述共轭体系e选自下式(i-2-1)-(i-2-20)中的结构:
[0037][0038][0039]
或者,所述共轭体系e与(x1)(x2)n-形成如下(i-3-1)-(i-3-4)所示的脂杂环:
[0040][0041]
可选地,所述电子受体a部分为选自下式(i-4-1)-(i-4-43)中的一种:
[0042][0043][0044]
可选地,所述荧光染料式(i)选自下式化合物:
[0045]
[0046][0047]
本发明的第二个方面是提供制备上述的荧光染料的方法,其特征在于,包括将式(a)化合物与式(b)化合物反应生成式(i)所示荧光染料的合成反应步骤:
[0048][0049]
本发明的第三个方面是提供上述的荧光染料在粘度测试、蛋白荧光标记、核酸荧光标记、蛋白定量或检测、或者核酸定量或检测中的用途。
[0050]
本发明的第四个方面是提供上述的荧光染料在制备粘度测试、蛋白荧光标记、核酸荧光标记、蛋白定量或检测、或者核酸定量或检测试剂中的用途。
[0051]
本发明的第五个方面提供一种荧光激活点亮型探针,其特征在于,包括上述荧光
染料。
[0052]
本发明的第六个方面提供上述的荧光激活点亮型探针在蛋白荧光标记、核酸荧光标记、蛋白定量或检测、或者核酸定量或检测中的用途。
[0053]
本发明的第七个方面提供上述的荧光激活点亮型探针在制备蛋白荧光标记、核酸荧光标记、蛋白定量或检测、或者核酸定量或检测试剂中的用途。
[0054]
本发明所得荧光染料具有长波长发射(最长发射波长达800nm)。它的荧光强度随环境粘度的增大而增强,荧光强度的对数和溶剂粘度的对数关系具有很好的线性关系,荧光强度与粘度的关系符合霍夫曼方程,并且具有较高斜率,其对粘度反应灵敏,激活倍数高并且对极性变化反应不灵敏。
[0055]
本发明所得荧光染料可用于测定样品的粘度,例如适用于微观粘度的测试。根据另一方面的具体实施方案,所得荧光染料可与对应的抗体、适配体或淀粉样蛋白等特异性结合,或者通过配体或抑制剂与蛋白标签或酶键合,获得系列荧光激活点亮型探针,用于蛋白、酶或核酸的荧光标记、定量或监测。
附图说明:
[0056]
图1为染料dye7(1
×
10-5
m)在不同粘度条件下荧光发射强度图;
[0057]
图2为染料dye7(1
×
10-5
m)粘度条件与荧光强度的线性关系图;
[0058]
图3为染料dye9(1
×
10-5
m)在不同粘度条件下荧光发射强度图;
[0059]
图4为染料dye9(1
×
10-5
m)粘度条件与荧光强度的线性关系图;
[0060]
图5为染料dye12(1
×
10-5
m)在不同粘度条件下荧光发射强度图;
[0061]
图6为染料dye12(1
×
10-5
m)粘度条件与荧光强度的线性关系图;
[0062]
图7为染料dye25(1
×
10-5
m)在不同粘度条件下荧光发射强度图;
[0063]
图8为染料dye25(1
×
10-5
m)粘度条件与荧光强度的线性关系图;
[0064]
图9为染料dye40(1
×
10-5
m)在不同粘度条件下荧光发射强度图;
[0065]
图10为染料dye40(1
×
10-5
m)粘度条件与荧光强度的线性关系图;
[0066]
图11为染料dye7(1
×
10-5
m)在不同极性条件下荧光发射强度图;
[0067]
图12为染料dye9(1
×
10-5
m)在不同极性条件下荧光发射强度图;
[0068]
图13为染料dye12(1
×
10-5
m)在不同极性条件下荧光发射强度图;
[0069]
图14为染料dye25(1
×
10-5
m)在不同极性条件下荧光发射强度图;
[0070]
图15为染料dye40(1
×
10-5
m)在不同极性条件下荧光发射强度图;
[0071]
图16为染料dye5,dye6的发射光谱对比图;
[0072]
图17为染料dye11,dye12,dye14的发射光谱对比图;
[0073]
图18为染料dye12,dye13的发射光谱对比图;
[0074]
图19为染料dye39的发射光谱;
[0075]
图20为染料dye42的发射光谱;
[0076]
图21为染料dye1和dye48在pbs溶液中的本底荧光对比图;
[0077]
图22为染料dye22和dye49在pbs溶液中的本底荧光对比图;
[0078]
图23为染料dye40和dye50在pbs溶液中的本底荧光对比图;
[0079]
图24为染料dye9,dye10和dye47在pbs溶液中的本底荧光对比图;
[0080]
图25为染料dye1,dye12,dye25,dye41用于细胞中标记适配体的图;
[0081]
图26为染料dye3结合rna适配体的流式细胞图;
[0082]
图27为染料dye13结合rna适配体的流式细胞图;
[0083]
图28为染料dye21结合rna适配体的流式细胞图;
[0084]
图29为染料dye34结合rna适配体的流式细胞图;
[0085]
图30为染料dye50结合rna适配体的流式细胞图;
具体实施方式
[0086]
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于对本发明进行示例性说明,并不用于限制本发明。
[0087][0088]
化合物1
[0089]
5-溴噻吩-2甲醛(0.5g.2.6mmol)和2-甲氨基乙醇(0.78g,10.4mmol)溶于10ml水中,ar保护条件下油浴加热100℃,反应过夜,反应结束,冷却至室温,二氯甲烷萃取3遍,饱和食盐水洗,无水硫酸钠干燥,旋干有机相,残余物进行柱层析,得到化合物10.4g,产率84%。1h nmr(400mhz,dmso-d6)δ9.40(s,1h),7.65(d,j=4.5hz,1h),6.12(d,j=4.5hz,1h),3.62(q,j=5.5hz,2h),3.47(t,j=5.6hz,2h),3.09(s,3h).
[0090]
dye1
[0091][0092]
化合物1(0.2g,1.08mmol)和3-甲基噻唑烷-2,4-二酮(0.13g,1.30mmol)溶于50ml无水乙醇中,加入催化量哌啶,ar保护条件下油浴加热90℃,反应3h,反应结束,冷却至室温,体系有大量固体析出,过滤,滤饼用冷乙醇洗两次,真空烘干,即得黄色化合物dye10.2g,产率71.4%。1h nmr(400mhz,dmso-d6)δ7.71(s,1h),7.43(d,j=4.4hz,1h),6.15(d,j=4.4hz,1h),3.62(q,j=5.5hz,2h),3.46(t,j=5.6hz,2h),3.20(s,3),3.09(s,3h).
[0093]
化合物2
[0094][0095]
化合物2的合成步骤参照化合物1的合成方法,产率为50%。1h nmr(400mhz,dmso-d6)δ9.70(s,1h),6.82(s,1h),3.62(q,j=5.5hz,2h),3.47(t,j=5.6hz,2h),3.09(s,3h).
[0096]
dye2
[0097][0098]
dye2的合成步骤参照dye1的合成方法,产率76%。1h nmr(400mhz,dmso-d6)δ9.70(s,1h),6.82(s,1h),4.10(q,j=7.0hz 4h),3.62(q,j=5.5hz,2h),3.47(t,j=5.6hz,2h),3.09(s,3h),1.2(t,j=7.1hz 3h).
[0099]
化合物3
[0100][0101]
苯并吗啉(0.30g,2mmol)溶于20ml dmf,加入碳酸铯(0.78g,2.4mmol),碘甲烷(0.31g,2.2mmol),ar保护条件下65℃油浴加热,反应4h,反应完毕,冷却至室温,体系倒入50ml水中,二氯甲烷萃取3次
×
50ml,合并有机相,旋转蒸干溶剂,柱色谱分离得产物0.290g,产率90.6%。1h nmr(400mhz,dmso-d6)δ6.98
–
6.94(m,1h),6.94
–
6.88(m,1h),6.67(dd,j=8.1,1.2hz,1h),6.57(td,j=7.5,1.2hz,1h),3.38
–
3.32(m,2h),3.05
–
2.80(m,2h),2.69(s,3h).
[0102]
三口烧瓶中加入10mldmf置于冰浴中冷却5min,滴加0.2ml三氯氧磷,冰浴条件下搅拌1h,上述化合物溶于dmf中,滴加到体系中,ar保护和冰浴条件下搅拌0.5h,体系缓慢升至室温,继续搅拌5h,反应完毕,加入饱和碳酸钠溶液调ph=10.0,室温条件下搅拌过夜,次日分出有机相,水相用二氯甲烷50ml萃取三次,合并有机相,饱和食盐水洗涤两次,有机相用无水硫酸钠干燥,旋转蒸干溶剂,残余物柱色谱分离得黄色固体0.25g,产率74%。1h nmr(400mhz,dmso-d6)δ10.26(s,1h)6.98
–
6.94(m,1h),6.94
–
6.88(m,1h),6.57(td,j=7.5,1.2hz,1h),3.38
–
3.32(m,2h),3.05
–
2.80(m,2h),2.69(s,3h).
[0103]
dye3
[0104][0105]
dye3
[0106]
dye3的合成步骤参照dye1的合成方法,产率82%。1h nmr(400mhz,dmso-d6)δ11.71(s,1h),11.56(s,1h),6.98
–
6.94(m,1h),6.94
–
6.88(m,1h),6.65(s,1h),6.57(td,j=7.5,1.2hz,1h),3.38
–
3.32(m,2h),3.05
–
2.80(m,2h),2.69(s,3h).
[0107]
dye4
[0108][0109]
dye4的合成方法参照dye1的合成步骤,产率70%。1h nmr(400mhz,dmso-d6)δ13.81(s,1h),6.98
–
6.94(m,1h),6.94
–
6.88(m,1h),6.65(s,1h),6.57(td,j=7.5,1.2hz,1h),3.38
–
3.32(m,2h),3.05
–
2.80(m,2h),2.69(s,3h).
[0110]
化合物4
[0111][0112]
化合物4的合成方法参照化合物3的合成方法,产率56%。1h nmr(400mhz,dmso-d6)δ10.11(s,1h)6.98
–
6.94(m,1h),6.94
–
6.88(m,1h),6.57(td,j=7.5,1.2hz,1h),3.57
–
3.42(m,2h),3.13
–
3.00(m,2h),2.87(s,3h).
[0113]
dye5
[0114][0115]
dye5参照dye1的合成方法,产率65.8%。1h nmr(400mhz,dmso-d6)δ11.75(s,1h),7.42(s,1h),7.38
–
7.15(m,2h),6.82(d,j=8.7hz,1h),3.76
–
3.57(m,2h),3.13
–
3.05(m,2h),3.03(s,3h).
[0116]
dye6
[0117][0118]
dye6参照dye1的合成方法,产率75.8%。1h nmr(400mhz,dmso-d6)δ13.15(s,1h),7.42(s,1h),7.38
–
7.15(m,2h),6.82(d,j=8.7hz,1h),3.76
–
3.57(m,2h),3.13
–
3.05(m,2h),3.03(s,3h).
[0119][0120]
化合物5参照化合物3的合成方法,产率65.7%。1h nmr(400mhz,dmso-d6)δ10.21(s,1h),7.33(dd,j=8.8,2.2hz,1h),7.15(d,j=2.2hz,1h),6.63(d,j=8.8hz,1h),5.47
(d,j=1.5hz,1h),2.87(s,3h),1.96(d,j=1.4hz,3h),1.34(s,6h).
[0121][0122]
dye参照dye1的合成方法,产率84.2%。1h nmr(400mhz,dmso-d6)δ13.86(s,1h),7.41(s,1h),7.33(dd,j=8.8,2.2hz,1h),7.15(d,j=2.2hz,1h),6.63(d,j=8.8hz,1h),5.47(d,j=1.5hz,1h),2.87(s,3h),1.96(d,j=1.4hz,3h),1.34(s,6h).
[0123]
dye8
[0124][0125]
dye8参照dye1的合成方法,产率80.3%。1h nmr(400mhz,dmso-d6)δ7.41(s,1h),7.33(dd,j=8.8,2.2hz,1h),7.15(d,j=2.2hz,1h),6.63(d,j=8.8hz,1h),5.47(d,j=1.5hz,1h),4.40(m,2h),2.87(s,3h),2.61(m,2h)1.96(d,j=1.4hz,3h),1.34(s,6h).
[0126]
化合物6
[0127][0128]
化合物6参照化合物3的合成方法,产率60.7%。1h nmr(400mhz,dmso-d6)δ10.25(s,1h),6.95(s,2h),3.25(dd,j=6.6,4.9hz,4h),2.68(t,j=6.3hz,4h),2.05
–
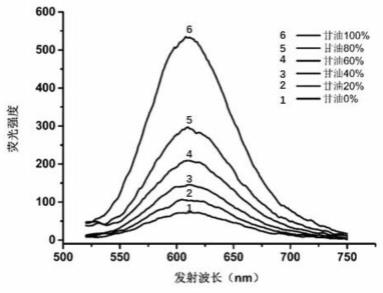
1.57(m,4h).
[0129]
dye9
[0130][0131]
dye9参照dye1的合成方法,产率88.6%。1h nmr(400mhz,dmso-d6)δ12.21(s,1h),7.31(s,1h),6.95(s,2h),3.25(dd,j=6.6,4.9hz,4h),2.68(t,j=6.3hz,4h),2.05
–
1.57(m,4h).
[0132]
dye10
[0133][0134]
dye10参照dye1的合成方法,产率82.4%。1h nmr(400mhz,dmso-d6)δ19.21(s,1h),7.31(s,1h),6.95(s,2h),3.25(dd,j=6.6,4.9hz,4h),2.68(t,j=6.3hz,4h),2.05
–
1.57(m,4h).
[0135]
化合物7、8
[0136][0137]
化合物7:
[0138]
2-溴并二噻吩(0.438g,2mmol)溶于15mln-甲基-n-羟乙基胺,加入铜粉(6.4mg,0.01mmol),碘化亚铜(19mg,0.01mmol),磷酸三钾(0.850g,4mmol),ar保护条件下80℃油浴加热过夜,反应完毕,冷却至室温,体系倒入50ml水中,二氯甲烷萃取3次
×
50ml,合并有机相,旋转蒸干溶剂,柱色谱分离得黄色产物0.362g,产率85%。1h-nmr(400mhz,cdcl3):δ=7.92(s,1h),7.63(d,1h,j=5.2hz),7.31(d,1h,j=5.2hz),3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.10(s,3h)。
[0139]
化合物8:
[0140]
化合物8(0.426g,2mmol)溶于50ml无水二氯甲烷中,加入1ml三乙胺,冰浴条件下缓慢滴加醋酸酐(0.3ml,3mmol),滴加完毕,体系缓慢升至室温,搅拌3h,反应完毕,加水100ml,分出有机相,水相用二氯甲烷50ml二氯甲烷萃取两次,合并有机相,无水硫酸钠干燥,旋转蒸干溶剂,残余物无需进一步纯化,直接用于下一步。
[0141]
上述残余物溶于50ml二氯甲烷中,加入二甲基甲酰胺5ml,冰浴条件下加入三氯氧磷2ml,ar保护条件下搅拌0.5h,体系缓慢升至室温,继续搅拌5h,反应完毕,加入饱和碳酸钠溶液调ph=10.0,室温条件下搅拌过夜,次日分出有机相,水相用二氯甲烷50ml萃取三次,合并有机相,饱和食盐水洗涤两次,有机相用无水硫酸钠干燥,旋转蒸干溶剂,残余物柱色谱分离得黄色固体0.285g,产率59%。1h-nmr(400mhz,cdcl3):δ=10.01(s,1h),7.92(s,1h),7.63(s,1h)3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.10(s,3h)。
[0142]
dye11
[0143][0144]
dye11参照dye1的合成方法,产率78.4%。1h-nmr(400mhz,cdcl3):δ=12.01(s,1h),7.57(s,1h),7.92(s,1h),7.63(s,1h)3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.10(s,3h)。
[0145][0146]
dye12参照dye1的合成方法,产率78.3%。1h-nmr(400mhz,cdcl3):δ=13.25(s,1h),7.57(s,1h),7.92(s,1h),7.63(s,1h)3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.10(s,3h)。
[0147]
dye13
[0148][0149]
dye13参照dye1的合成方法,产率87.1%。1h-nmr(400mhz,cdcl3):δ=11.35(s,1h),11.25(s,1h),7.87(s,1h),7.92(s,1h),7.63(s,1h)3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.10(s,3h)。
[0150]
dye14
[0151][0152]
dye14参照dye1的合成方法,产率87.1%。1h-nmr(400mhz,cdcl3):δ=18.35(s,1h),6.87(s,1h),7.92(s,1h),7.63(s,1h)3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.10(s,3h)。
[0153]
dye15
[0154][0155]
dye15参照dye1的合成方法,产率84.7%。1h-nmr(400mhz,cdcl3):δ=7.42(s,1h),7.92(s,1h),7.63(s,1h)3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.34(s,3h),3.10(s,3h)。
[0156]
dye16
[0157][0158]
dye16参照dye1的合成方法,产率82.1%。1h-nmr(400mhz,cdcl3):δ=6.72(s,1h),7.92(s,1h),7.63(s,1h)3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.52(s,3h),3.10
(s,3h)。
[0159]
dye17
[0160][0161]
dye17参照dye1的合成方法,产率82.7%。1h-nmr(400mhz,cdcl3):δ=12.03(s,1h),11.41(s,1h)6.72(s,1h),7.92(s,1h),7.63(s,1h),4.40(m,2h),3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.52(s,3h),3.10(s,3h),2.62(m,2h).
[0162]
dye18
[0163][0164]
化合物9
[0165]
化合物9参照献(organic&biomolecular chemistry,7(1),142-154;2009)的合成方法合成。1h-nmr(400mhz,cdcl3):δ=10.05(s,1h),7.57(s,1h),7.92(s,1h),3.95(m,4h),3.45(m,8h),3.10(s,3h)。
[0166]
dye参照dye1的合成方法,产率52.3%。1h-nmr(400mhz,cdcl3):δ=8.02(s,1h),7.57(s,1h),7.92(s,1h),3.95(m,4h),3.45(m,8h),3.25(s,3h),3.10(s,3h)。
[0167]
dye19
[0168][0169]
化合物10
[0170]
化合物10参照文献(journal oforganic chemistry,83(15),8533-8542;2018)的方法合成,产率52.1%。1h-nmr(400mhz,cdcl3):δ=10.15(s,1h),7.57(s,1h),7.92(s,1h),3.10(s,3h)3.08(m,2h),1.58-1.43(m,18h)。
[0171]
dye19参照dye1的合成的方法合成,产率88.9%。1h-nmr(400mhz,cdcl3):δ=8.23(s,1h),7.57(s,1h),7.92(s,1h),3.25(s,3h),3.10(s,3h)3.08(m,2h),1.58-1.43(m,18h)。
[0172]
化合物11、12、13
[0173][0174]
化合物11
[0175]
噻吩并[3,2-b]噻吩(10g,71.31mmol)加入到250ml三口烧瓶中,加入120ml无水四氢呋喃溶解,置于-78℃下冷却,1.6m的正丁基锂49ml滴加到体系中,保持-78℃2h,关闭制冷,缓慢回到室温,搅拌过夜,反应完后,冰浴下加入40ml水淬灭反应,体系倒入200ml二氯甲烷中,萃取,水相用二氯甲烷萃取三次,有机相用无水硫酸钠干燥,旋干溶剂,残余物柱色谱分离得化合物10.7g。产率90%。1h nmr(400mhz,chloroform-d)δ9.97(s,1h),7.94(s,1h),7.70(d,j=5.3hz,1h),7.33(d,j=5.3hz,1h).
[0176]
化合物12
[0177]
化合物11(10g.59.5mmol)溶于120ml干燥的dmf和乙酸(1:1)的混合溶剂中,加入nbs(11.66g,65.5mmol),ar保护下油浴加热120℃回流过夜,反应完成后,乙酸乙酯和水萃取三遍,有机相合并干燥,旋干溶剂,剩余物柱层析得到11.2g产物,产率78%。1h nmr(400mhz,chloroform-d)δ10.01(s,1h),7.70(d,j=5.3hz,1h),7.33(d,j=5.3hz,1h).
[0178]
化合物13
[0179]
参照化合1的合成方法,产率85%。1h nmr(400mhz,dmso-d6)δ10.15(s,1h),7.87(s,1h),6.39(s,1h),3.85(t,4h,j=5.6hz),3.60(t,4h,j=5.6hz).
[0180]
dye20
[0181][0182]
dye20参照dye1的合成方法,产率81.2%。1h nmr(400mhz,dmso-d6)δ11.15(s,1h),7.64(s,1h),7.57(s,1h),6.59(s,1h),3.85(t,4h,j=5.6hz),3.60(t,4h,j=5.6hz).
[0183]
dye21
[0184][0185]
dye21参照dye1的合成方法,产率82.5%。1h nmr(400mhz,dmso-d6)δ11.35(s,1h),7.64(s,1h),7.57(s,1h),6.59(s,1h),3.85(t,4h,j=5.6hz),3.60(t,4h,j=5.6hz).
[0186]
化合物12、13
[0187][0188]
化合物14、15
[0189]
化合物14、15,参照化合物7、8的合成方法,产率50.4%。1h-nmr(400mhz,cdcl3):δ=9.92(s,1h),7.81(s,1h),7.68(d,j=9.0hz,1h),6.92(d,j=2.0hz,1h),6.82(d,j=9.1,2.3hz,1h),3.61(t,j=8.0hz,2h),3.34(t,j=8.0hz,2h),3.21(s,3h)。
[0190][0191]
dye22参照dye1的合成方法,产率90.1%。1h-nmr(400mhz,cdcl3):δ=12.31(s,1h),7.86(s,1h),7.81(s,1h),7.68(d,j=9.0hz,1h),6.92(d,j=2.0hz,1h),6.82(d,j=9.1,2.3hz,1h),3.61(t,j=8.0hz,2h),3.34(t,j=8.0hz,2h),3.21(s,3h)。
[0192]
dye23
[0193][0194]
化合物16
[0195]
化合物16参照文献(journal ofthe american chemical society,137(43),13768-13771;2015)的合成方法合成。1h-nmr(400mhz,cdcl3):δ=10.31(s,1h),7.81(s,1h),7.68(d,j=9.0hz,1h),6.92(d,j=2.0hz,1h),6.82(d,j=9.1,2.3hz,1h),3.61(t,j=8.0hz,2h),3.34(t,j=8.0hz,2h),3.21(s,3h),2.91(s,3h)。
[0196]
dye23参照dye1的合成方法,产率79.5%。1h-nmr(400mhz,cdcl3):δ=8.02(s,1h),7.81(s,1h),7.68(d,j=9.0hz,1h),6.92(d,j=2.0hz,1h),6.82(d,j=9.1,2.3hz,1h),3.61(t,j=8.0hz,2h),3.34(t,j=8.0hz,2h),3.21(s,3h),2.91(s,3h)。
[0197]
dye24
[0198][0199]
化合物17
[0200]
化合物17参照文献(journal oftheamerican chemical society,131(5),1766-1774;2009)的合成方法合成。1h-nmr(400mhz,cdcl3):δ=10.31(s,1h),7.81(s,1h),7.68(d,j=9.0hz,1h),6.92(d,j=2.0hz,1h),6.82(d,j=9.1,2.3hz,1h),3.61(t,j=8.0hz,2h),3.34(t,j=8.0hz,2h),3.21(s,3h),2.21(s,6h)。
[0201]
dye24参照dye1的合成方法,产率68.5%。1h-nmr(400mhz,cdcl3):δ=12.28(s,1h),8.31(s,1h),7.81(s,1h),7.68(d,j=9.0hz,1h),6.92(d,j=2.0hz,1h),6.82(d,j=9.1,2.3hz,1h),3.61(t,j=8.0hz,2h),3.34(t,j=8.0hz,2h),3.21(s,3h),2.21(s,6h)。
[0202]
化合物18
[0203][0204]
化合物18
[0205]
化合物18参照化合物15的合成方法。1h-nmr(400mhz,cdcl3):δ=10.58(s,1h),7.81(s,1h),7.68(d,j=9.0hz,1h),6.92(d,j=2.0hz,1h),6.82(d,j=9.1,2.3hz,1h),2.68(s,3h)。
[0206]
dye25
[0207][0208]
dye25参照dye1的合成方法,产率70.0%。1h-nmr(400mhz,cdcl3):δ=8.58(s,1h),7.81(s,1h),7.68(d,j=9.0hz,1h),6.92(d,j=2.0hz,1h),6.82(d,j=9.1,2.3hz,1h),3.21(s,3h),2.68(s,3h)。
[0209]
dye26
[0210][0211]
化合物19
[0212]
化合物19参照文献(organic letters,14(24),6366-6369;2012)的合成方法合成。1h-nmr(400mhz,cdcl3):δ=10.05(s,1h),7.98(s,1h),7.81(d,j=2.0hz,1h),7.68(d,j=9.0hz,1h),6.92(d,j=2.0hz,1h),6.82(d,j=9.1,2.3hz,1h),3.61(t,j=8.0hz,2h),3.34(t,j=8.0hz,2h),3.21(s,3h)。
[0213]
dye26参照dye17的合成方法,产率70.0%。1h-nmr(400mhz,cdcl3):δ=8.55(s,1h),7.98(s,1h),7.81(d,j=2.0hz,1h),7.68(d,j=9.0hz,1h),6.92(d,j=2.0hz,1h),6.82(d,j=9.1,2.3hz,1h),3.61(t,j=8.0hz,2h),3.34(t,j=8.0hz,2h),3.21(s,3h),3.10(s,1h)。
[0214][0215]
化合物20
[0216]
化合物20,参照化合物8的合成方法,产率30.4%。1h-nmr(400mhz,cdcl3):δ=9.92(s,1h),7.75(d,j=9.0hz,1h),6.52(d,j=2.0hz,1h),6.42(d,j=9.1,2.3hz,1h),3.61
(t,j=8.0hz,3h),3.34(t,j=8.0hz,3h),3.21(s,3h)。
[0217]
dye27
[0218][0219]
dye27参照dye1的合成方法,产率65.9%。1h-nmr(400mhz,cdcl3):δ=11.28(s,1h),7.84(s,1h),7.75(d,j=9.0hz,1h),6.52(d,j=2.0hz,1h),6.42(d,j=9.1,2.3hz,1h),3.61(t,j=8.0hz,3h),3.34(t,j=8.0hz,3h),3.21(s,3h)。
[0220][0221]
化合物21
[0222]
化合物21,参照化合物8的合成方法,产率30.4%。1h-nmr(400mhz,cdcl3):δ=9.92(s,1h),7.21(s,1h),7.68(d,j=9.0hz,1h),6.92(d,j=2.0hz,1h),6.82(d,j=9.1,2.3hz,1h),3.61(t,j=8.0hz,2h),3.34(t,j=8.0hz,2h),3.21(s,3h)。
[0223]
dye28
[0224][0225]
dye28参照dye1的合成方法,产率65.9%。1h-nmr(400mhz,cdcl3):δ=7.81(s,1h),7.68(d,j=9.0hz,1h),6.92(d,j=2.0hz,1h),6.82(d,j=9.1,2.3hz,1h),3.61(t,j=8.0hz,3h),3.60(q,j=5.5hz,2h),3.34(t,j=8.0hz,3h),3.21(s,3h),1.2(t,j=7.1hz 3h).
[0226][0227]
化合物22
[0228]
化合物22,参照化合物8的合成方法,产率30.4%。1h-nmr(400mhz,cdcl3):δ=9.92(s,1h),7.75(d,j=9.0hz,1h),6.52(d,j=2.0hz,1h),6.42(d,j=9.1,2.3hz,1h),3.61(t,j=8.0hz,3h),3.34(t,j=8.0hz,3h),3.21(s,3h)。
[0229]
dye29
[0230][0231]
dye29参照dye1的合成方法,产率55.1%。1h-nmr(400mhz,cdcl3):δ=7.75(d,j=9.0hz,1h),6.52(d,j=2.0hz,1h),6.42(d,j=9.1,2.3hz,1h),3.61(t,j=8.0hz,3h),3.34(t,j=8.0hz,3h),3.21(s,3h),3.10(s,3h).
[0232]
化合物23
[0233][0234]
化合物23
[0235]
化合物23,参照化合物11的合成方法,产率54.2%。1h-nmr(400mhz,cdcl3):δ=9.92(s,1h),7.81(s,1h),7.68(d,j=9.0hz,1h),6.92(d,j=2.0hz,1h),6.82(d,j=9.1,2.3hz,1h),3.21(s,6h).
[0236]
dye30
[0237][0238]
dye30参照化合物dye1的合成方法,产率45.2%。1h-nmr(400mhz,cdcl3):δ=8.01(s,1h),7.81(s,1h),7.68(d,j=9.0hz,1h),6.92(d,j=2.0hz,1h),6.82(d,j=9.1,2.3hz,1h),3.21(s,6h).
[0239]
化合物24
[0240][0241]
化合物24
[0242]
化合物24,参照化合物11的合成方法,产率58.2%。1h-nmr(400mhz,cdcl3):δ=9.91(s,1h),7.80(s,1h),7.65(d,j=9.1hz,1h),6.98(d,j=2.1hz,1h),6.85(d,j=9.0,2.3hz,1h),3.21(s,6h).
[0243]
dye31
[0244][0245]
dye31参照化合物dye1的合成方法,产率80.2%。1h-nmr(400mhz,cdcl3):δ=8.03(s,1h),7.80(s,1h),7.65(d,j=9.0hz,1h),6.98(d,j=2.0hz,1h),6.85(d,j=9.1,2.3hz,1h),4.44(m,2h),3.21(s,6h)2.62(m,2h).
[0246]
dye32
[0247][0248]
参照化合物dye1的合成方法,产率50.2%。1h-nmr(400mhz,cdcl3):δ=7.83(s,1h),7.80(s,1h),7.65(d,j=9.0hz,1h),6.98(d,j=2.0hz,1h),6.85(d,j=9.1,2.3hz,1h),3.21(s,6h).
[0249]
化合物25
[0250][0251]
化合物25
[0252]
化合物25,参照化合物11的合成方法,产率45.2%。1h-nmr(400mhz,cdcl3):δ=7.88(s,1h),7.65(d,j=9.1hz,1h),6.98(d,j=2.1hz,1h),6.85(d,j=9.0,2.3hz,1h),3.21(s,6h).
[0253]
dye33
[0254][0255]
dye33参照化合物dye1的合成方法,产率60.2%。1h-nmr(400mhz,cdcl3):δ=8.01(s,1h),7.65(d,j=9.1hz,1h),6.98(d,j=2.1hz,1h),6.85(d,j=9.0,2.3hz,1h),3.21(s,6h).
[0256]
dye34
[0257][0258]
化合物26:
[0259]
参照文献(chemistry-a european journal,22(30),10627-10637;2016)的方法合成。1h-nmr(400mhz,cdcl3):δ=9.92(s,1h),7.82(s,1h),7.71(m,1h),7.60(m,2h),6.78(s,2h),3.82(t,2h,j=5.6hz),3.54(t,2h,j=5.6hz),3.10(s,3h),1.42(s,6h)
[0260]
dye34参照化合物dye1的合成方法,产率50.8%。1h-nmr(400mhz,cdcl3):δ=11.21(s,1h),7.92(s,1h),7.82(s,1h),7.71(m,1h),7.60(m,2h),6.78(s,2h),3.82(t,2h,j=5.6hz),3.54(t,2h,j=5.6hz),3.10(s,3h),1.42(s,6h)
[0261]
dye35
[0262][0263]
dye35参照化合物dye1的合成方法,产率47.8%。1h-nmr(400mhz,cdcl3):δ=11.28(s,1h),7.84(s,1h),7.82(s,1h),7.71(m,1h),7.60(m,2h),6.78(s,2h),3.82(t,2h,j=5.6hz),3.54(t,2h,j=5.6hz),3.10(s,3h),1.42(s,6h)
[0264]
dye36
[0265][0266]
化合物27
[0267]
参照化合物26的合成的方法。1h nmr(400mhz,cdcl3):10.0(s,1h),8.0(s,1h),7.96
–
7.98(t,1h),7.89
–
7.90(t,1h),7.47
–
7.49(m,1h),3.82(t,2h,j=5.6hz),3.54(t,2h,j=5.6hz),3.10(s,3h),
[0268]
dye36参照化合物dye1的合成方法,产率49.7%。1h nmr(400mhz,cdcl3):11.28(s,1h),8.04(s,1h),8.0(s,1h),7.96
–
7.98(t,1h),7.89
–
7.90(t,1h),7.47
–
7.49(m,1h),3.82(t,2h,j=5.6hz),3.54(t,2h,j=5.6hz),3.10(s,3h),
[0269]
dye37
[0270][0271]
化合物28
[0272]
参照化合物26的合成的方法。1h-nmr(400mhz,cdcl3):δ=9.92(s,1h),7.82(s,
1h),7.71(s,1h),3.82(t,2h,j=5.6hz),3.54(t,2h,j=5.6hz),3.10(s,3h),1.50(s,6h)
[0273]
dye37参照化合物dye1的合成方法,产率59.6%。1h-nmr(400mhz,cdcl3):δ=10.28(s,1h),8.05(s,1h),7.82(s,1h),7.71(s,1h),3.82(t,2h,j=5.6hz),3.54(t,2h,j=5.6hz),3.10(s,3h),1.50(s,6h).
[0274]
dye38
[0275][0276]
化合物29
[0277]
参照化合物26的合成的方法。1h-nmr(400mhz,cdcl3):δ=9.92(s,1h),7.82(s,1h),7.71(s,1h),7.67(s,1h),7.50(s,1h),3.82(t,2h,j=5.6hz),3.54(t,2h,j=5.6hz),3.10(s,3h),1.50(s,6h)
[0278]
dye38参照化合物dye1的合成方法,产率49.6%。1h-nmr(400mhz,cdcl3):δ=11.01(s,1h),8.04(s,1h),7.82(s,1h),7.71(s,1h),7.67(s,1h),7.50(s,1h),3.82(t,2h,j=5.6hz),3.54(t,2h,j=5.6hz),3.10(s,3h),1.50(s,6h)
[0279]
dye39
[0280][0281]
化合物30
[0282]
参照文献(chemistry ofmaterials,31(21),8810-8819;2019)的合成方法得到。1h-nmr(400mhz,dmso-d6):δ=10.18(s,1h),7.48(s,1h),7.41(s,1h),7.32(m,2h),3.69(t,j=4.9hz,2h),3.12(t,j=4.9hz,2h),3.10(s,3h),1.48(s,6h)
[0283]
dye39参照化合物dye1的合成方法,产率58.2%。1h-nmr(400mhz,dmso-d6):δ=14.28(s,1h),7.95(s,1h),7.48(s,1h),7.41(s,1h),7.32(m,2h),3.69(t,j=4.9hz,2h),3.12(t,j=4.9hz,2h),3.10(s,3h),1.48(s,6h)
[0284]
dye40
[0285][0286]
dye40参照化合物dye1的合成方法,产率69.2%。1h-nmr(400mhz,dmso-d6):δ=7.95(s,1h),7.48(s,1h),7.41(s,1h),7.32(m,2h),3.69(t,j=4.9hz,2h),3.12(t,j=4.9hz,2h),3.21(s,3h),3.10(s,3h),1.48(s,6h)
[0287]
dye41
[0288][0289]
化合物32
[0290]
参照文献(journal oforganic chemistry,73(17),6587-6594;2008)的方法合成。1h-nmr(400mhz,dmso-d6):δ=10.18(s,1h),7.89(s,1h),7.18(s,1h),3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.10(s,3h),1.50(s,6h).
[0291]
dye41参照化合物dye1的合成方法,产率56.6%。1h-nmr(400mhz,dmso-d6):δ=12.58(s,1h),8.01(s,1h),7.89(s,1h),7.18(s,1h),3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.10(s,3h),1.50(s,6h).
[0292]
dye42
[0293][0294]
dye42参照化合物dye1的合成方法,产率38.2%。1h-nmr(400mhz,dmso-d6):δ=8.01(s,1h),7.89(s,1h),7.18(s,1h),3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.10(s,3h),1.50(s,6h).
[0295]
dye43
[0296][0297]
化合物33
[0298]
化合物33参照化合物26的合成方法合成。1h-nmr(400mhz,dmso-d6):δ=10.18(s,1h),7.89(s,1h),7.36(s,2h),7.18(s,1h),3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz)3.10(s,1h).
[0299]
dye43参照化合物dye1的合成方法,产率78.2%。1h-nmr(400mhz,dmso-d6):δ=12.09(s,1h),8.28(s,1h),7.89(s,1h),7.36(s,2h),7.18(s,1h),3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz)3.10(s,1h).
[0300]
dye44
[0301][0302]
化合物34:
[0303]
化合物34参照zhu,linyong et al,pct int.appl.,2019218876,21nov 2019.的
合成方法合成。1h-nmr(400mhz,cdcl3):δ=9.74(s,1h),7.76(d,1h),7.60(s,1h),7.03(d,1h),3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.10(s,3h),1.42(s,6h)。
[0304]
dye44参照化合物dye1的合成方法合成。1h-nmr(400mhz,cdcl3):δ=11.24(s,1h),8.02(s,1h),7.76(d,1h),7.60(s,1h),7.03(d,1h),3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.10(s,3h),1.42(s,6h)。
[0305]
dye45
[0306][0307]
dye45参照dye1的合成方法合成。1h-nmr(400mhz,cdcl3):δ=13.08(s,1h),8.05(s,1h),7.76(d,1h),7.60(s,1h),7.03(d,1h),3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.10(s,3h),1.42(s,6h)。
[0308]
dye46
[0309][0310]
dye46参照dye1的合成方法合成。1h-nmr(400mhz,cdcl3):δ=15.56(s,1h),8.08(s,1h),7.76(d,1h),7.60(s,1h),7.03(d,1h),3.85(t,2h,j=5.6hz),3.60(t,2h,j=5.6hz),3.10(s,3h),1.42(s,6h)。
[0311]
对比实施例
[0312]
dye47
[0313][0314]
dye47参照文献(european journal of organic chemistry,2011(25),4773-4787)的方法合成。1h nmr(400mhz,dmso-d6)δ19.21(s,1h),7.31(s,1h),6.95(s,2h),3.25(dd,j=6.6,4.9hz,4h),2.68(t,j=6.3hz,4h),2.05-1.57(m,4h).
[0315]
dye48
[0316][0317]
dye48参照文献(j.am.chem.soc.2020,142,17515-17523)的方法合成。1h-nmr(400mhz,chloroform-d)δ8.07(d,j=8.9hz,2h),7.11(s,1h),6.70(d,j=8.8hz,2h),4.29(s,3h),3.05(s,6h),2.31(s,3h).
[0318]
dye49
[0319][0320]
dye49参照文献(j.am.chem.soc.2020,142,17515-17523)的方法合成。1h-nmr(400mhz,chloroform-d)δ8.19(d,j=8.6hz,2h),7.97(d,j=15.6hz,1h),7.48(d,j=8.7,2h),7.12(s,1h),6.75(d,j=8.6,2h),6.70(d,j=8.6,2h),6.42(d,j=15.6hz,1h),4.45(s,2h),3.07(s,6h),3.05(s,6h),1.49(m,9h).
[0321]
dye50
[0322][0323]
dye50参照文献(angew.chem.int.ed.2020,59,2
–
10)的方法合成。1h-nmr(400mhz,dmso-d6)δ8.06(d,j=8.6hz,2h),6.79(d,j=8.6hz,2h),3.28(m,6h),1.81(s,6h).
[0324]
试验例1
[0325]
将实施例dye1-dye42制备的荧光染料(分子转子)分别溶于二甲基亚砜中,各自制得浓度为1
×
10-2
m的母液,将各母液分别加入甘油和甲醇中,混合均匀,各配制终浓度为1
×
10-5
m的溶液,根据荧光染料不同,依次用各荧光染料最大激发波长在相同条件下检测其荧光发射图谱,结果如表1所示,表明本发明荧光染料具有长波长发射荧光,并且对粘度变化响应灵敏。
[0326]
表1
[0327]
[0328][0329]
[0330]
试验例2
[0331]
将染料dye7,dye9,dyedye12,dye25,dye40分别加入以下粘度16.4cp(甘油的体积比值为0%)、29.8cp(甘油的体积比值为20%)、64.5cp(甘油的体积比值为40%)、143.5cp(甘油的体积比值为60%)、377.0cp(甘油的体积比值为80%)、946.0cp(甘油的体积比值为100%)的甘油和乙二醇的混合液,配制成终浓度为1
×
10-5
m的溶液,不同粘度条件下荧光发射光谱如图1、3、5、7、9所示,上述各分子转子发射波长分别为620nm、576nm、650nm、670nm、720nm。结果表明:相同浓度的荧光染料的荧光强度随环境粘度的增大荧光增强。荧光强度的对数和溶剂粘度的对数关系符合哈夫曼方程,具有很好的线性关系,并且具有较高斜率,如图2、4、6、8、10所示,证明上述染料对粘度反应灵敏,可以用于未知样品的粘度测试。
[0332]
将染料dye7,dye9,dye12,dye25,dye40分别溶入到不同极性的溶剂(甲苯、乙酸乙酯、甲醇、乙腈、二甲基亚砜)中测试时,荧光强度均很弱且不随溶剂的极性变化而变化,如图11、12、13、14、15所示。
[0333]
以上结果表明:本发明荧光染料对粘度环境具有较好的特异性,可以降低因为极性响应而引起的非特异性荧光。
[0334]
试验例3
[0335]
将染料dye5,dye6,dye11,dye12,dye13,dye14,dye39,dye42加入甘油中,配制成终浓度为1
×
10-5
m的溶液,用相对应的最大激发波长激发荧光染料,得到发射光谱,对其中一些发射光谱进行归一化。对比染料dye5,dye6的发射光谱,如图16,当拉电子部分的氧羰基变成硫羰基后波长增长大约50nm;对比染料dye11,dye12,dye14的发射光谱,如图17,说明这个增加波长的效应可以叠加;对比染料dye12和dye13的发射光谱,如图18,当拉电子部分的五元环上的硫变成氮原子后,波长减短20nm,这证明上述染料的发射波长可以很轻易的通过改变的结构上的一个原子来实现,这就可以在保证染料结构变化不大(水溶性和膜的渗透性变化不大)的情况下实现光谱可调,并且通过这种波长调节机制,可以将染料的最大发射波长达到800以上,如图19,20所示,这对于染料用于活体成像是非常有利的。
[0336]
试验例4
[0337]
染料dye1与dye48;dye22与dye49;dye40与dye50;dye9,dye10与dye47加入pbs中,配制成终浓度为1
×
10-5
m的溶液,用相对应的最大激发波长激发染料,检测他们在pbs中的荧光强度,以各组样品最大的荧光强度为100来进行归一化,分别如图21,22,23,24所示,结果表明,与文献中报道的荧光染料比较,本技术荧光染料具有特殊的拉电子基团结构部分,使本技术荧光染料具有更低的本底荧光。
[0338]
试验例5
[0339]
使用持续表达rna适配体(uugccauguguauguggguucgcccacauacucugaugauccgguguaguagguccgguguaguagguccgguguaguagguccgguguaguagguccuucgggaccggaagaauugaucucggccggaccggaagaauugaucucggccggaccggaagaauugaucucggccggaccggaagaauugaucucggccggaucauucauggcaa)的稳定细胞株(293t/17)和对照细胞(293t/17),在常规哺乳动物细胞培养条件下(37℃,5%二氧化碳,100%相对湿度),待其生长至细胞汇合度达90%后,将染料dye1,dye12,dye25,dye41终浓度为2um的细胞培养基替换原有细胞培养基孵育10min(37℃,5%二氧化碳,100%相对湿度),共聚焦显微镜使用染料对应波长进行观察,结合前染料基本不发荧光,结合后荧光被显著激活,并且化合物在细胞里也可以和蛋白质结合,如图25
所示,表达适配体的细胞发出明亮的荧光,没有表达适配体的细胞则没有荧光,这说明本发明的染料具有很好的细胞膜渗透性,可用于活细胞适配体的标记。
[0340]
试验例6
[0341]
使用持续表达rna适配体(uugccauguguauguggguucgcccacauacucugaugauccgguguaguagguccgguguaguagguccgguguaguagguccgguguaguagguccuucgggaccggaagaauugaucucggccggaccggaagaauugaucucggccggaccggaagaauugaucucggccggaccggaagaauugaucucggccggaucauucauggcaa)的稳定细胞株(293t/17)和对照细胞(293t/17),在常规哺乳动物细胞培养条件下(37℃,5%二氧化碳,100%相对湿度),待其生长至细胞汇合度达90%后,将细胞消化下来,800rpm离心,并使用含有1μm dye1,dye12,dye25,dye41分子的pbs重悬细胞并孵育5分钟后进行流式检测,检测结果可见如流式图26-29所示,dye3,dye13,dye21,dye34结合前染料本底很低,结合后荧光被显著激活并且染料在细胞里也可以和rna适配体结合发出明亮的荧光,基本上没有非特异性荧光激活,这说明本发明的荧光染料在细胞里具有很低的背景荧光和很低的非特异性荧光,可用于低丰度生物大分子如核酸的标记,而dye50具有明显的背景荧光,如图30所示,难以用于低丰度生物大分子如核酸的标记。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。