1.本发明涉及用于有机电子元件的化合物、使用所述化合物的有机电子元件及其电子装置。
背景技术:
2.通常,有机发光现象是指通过使用有机材料将电能转化为光能的现象。使用有机发光现象的有机电子元件通常具有包括阳极、阴极和插入其间的有机材料层的结构。在此,为了增加有机电子元件的效率和稳定性,有机材料层通常由多层结构构成,所述多层结构由不同材料构成,并且例如可以包括空穴注入层、空穴传输层、发射层、电子传输层、电子注入层等。
3.用作有机电子元件中的有机材料层的材料可以根据其功能分为发光材料和电荷传输材料,例如空穴注入材料、空穴传输材料、电子传输材料、电子注入材料等。并且发光材料可根据分子量分为高分子量类型和低分子量类型,并且根据发光机理,其可分为电子单重激发态衍生的荧光材料和电子三重激发态衍生的磷光材料。此外,发光材料可以根据发射颜色被分成蓝色、绿色和红色发光材料以及实现更好的自然颜色所必需的黄色和橙色发光材料。
4.然而,当仅使用一种材料作为发光材料时,由于分子间相互作用,最大发射波长移动到更长的波长,并且存在这样的问题:由于发射衰减效应,颜色纯度降低或装置效率减少,因此为了通过能量转移提高色纯度和提高发光效率,可以使用主体/掺杂剂体系作为发光材料。原理是,当在发射层中混合具有比形成发射层的主体的能带间隙更小的能带间隙的少量掺杂剂时,在发射层中产生的激子被传输到掺杂剂以高效发光。此时,由于主体的波长移动到掺杂剂的波长带,所以可以根据所使用的掺杂剂的类型获得具有所需波长的光。
5.当前,便携式显示器市场是大面积显示器,并且其尺寸在日益增加,因此,需要比现有便携式显示器所需的功耗更多的功耗。因此,对于具有有限电源(例如电池)的便携式显示器来说,功耗已经成为非常重要的因素,并且还必须解决效率和使用寿命的问题。
6.效率、使用寿命和驱动电压彼此相关,并且当效率增加时,驱动电压相对降低,并且随着驱动电压降低,由于驱动期间产生的焦耳加热导致的有机材料的结晶降低,因此,使用寿命趋于增加。然而,通过改善有机材料层不能简单地使效率最大化。这是因为,当各有机材料层之间的能级和t1值,以及材料的固有性质(迁移率、界面性质等)被最佳地组合时,可以同时实现长使用寿命和高效率。
7.因此,虽然延迟了金属氧化物从阳极电极(ito)进入有机层的渗透和扩散(这是缩短有机电子元件使用寿命的原因之一),但它应该具有在装置驱动期间产生的抗焦耳加热的稳定特性,并且oled装置主要通过沉积方法形成,并且有必要开发在沉积期间能够经受长时间的材料,即,具有强耐热性的材料。
8.换句话说,为了完全展现有机电子元件的优异特性,构成装置中的有机材料层的
材料,例如空穴注入材料、空穴传输材料、发光材料、电子传输材料、电子注入材料等,应优先由稳定且有效的材料支撑。然而,用于有机电子装置的稳定且有效的有机材料层材料还未充分地进行开发。因此,不断地需要开发新材料,特别是迫切需要开发用于发射层的主体材料。
技术实现要素:
9.为了解决上述背景技术的问题,本发明展示了一种具有新颖结构的化合物,并且当将该化合物应用于有机电子元件时,已经发现可以显著改善装置的驱动电压、效率、稳定性和使用寿命。
10.因此,本发明的目的是提供一种新化合物、使用该化合物的有机电子元件及其电子装置。
11.技术方案
12.本发明提供了由式(1)表示的化合物。
13.式(1)
[0014][0015]
在另一方面,本发明提供了包含由式(1)表示的化合物的有机电子元件及其电子装置。
[0016]
发明的效果
[0017]
通过使用根据本发明的化合物,可以实现装置的高发光效率、低驱动电压和高耐热性,并且可以极大地提高装置的颜色纯度和使用寿命。
附图说明
[0018]
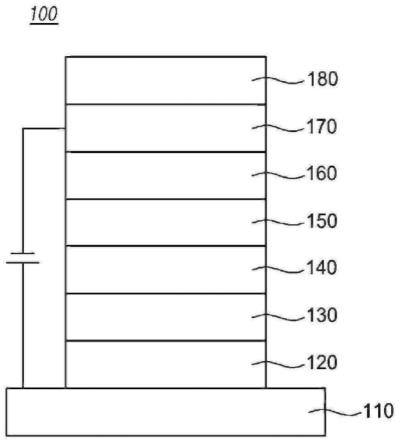
图1至图3是根据本发明的有机电致发光装置的示例性视图。
[0019]
图4显示了根据本发明方面的式。
具体实施方式
[0020]
在下文,将详细地描述本发明的一些实施方案。此外,在本发明的以下描述中,当在本文中并入已知功能和配置的详细描述可能使本发明的主题相当不清楚时,将省略该详细描述。
[0021]
此外,当描述本发明的组件时,本文可以使用诸如第一、第二、a、b、(a)、(b)等术
语。这些术语中的每一个不用于限定相应组件的实质、顺序或次序,而仅用于区分相应组件与其它组件。应注意,如果组件被描述为“连接”、“联接”或“连接”至另一个组件,则该组件可以直接连接或连接至其它组件,但另一个组件可以“连接”、“联接”或“连接”在各组件之间。
[0022]
如说明书和所附权利要求书中使用,除非另外说明,否则以下是如下术语的含义。
[0023]
除非另外说明,否则如本文使用的术语“卤代”或“卤素”包括氟、溴、氯或碘。
[0024]
除非另外说明,否则如本文使用的术语“烷基”或“烷基基团”具有单键,其具有1个至60个碳原子,并且意指饱和脂肪族官能团,包括直链烷基基团、支链烷基基团、环烷基基团(脂环族)、被烷基取代的环烷基基团或被环烷基取代的烷基基团。
[0025]
除非另外说明,否则如本文使用的术语“烯基”或“炔基”具有双键或叁键,其具有2个至60个碳原子,但不限于此,并且包括直链或支链基团。
[0026]
除非另外说明,否则如本文使用的术语“环烷基”意指形成具有3个至60个碳原子的环的烷基,但不限于此。
[0027]
除非另外说明,否则如本文使用的术语“烷氧基基团”、“烷氧基”或“烷基氧基基团”意指连接至烷基基团的氧基,并且具有1个至60个碳原子,但不限于此。
[0028]
除非另外说明,否则如本文使用的术语“芳基氧基基团”或“芳氧基基团”意指连接至芳基基团的氧基,并且具有6个至60个碳原子,但不限于此。
[0029]
除非另有说明,本发明中使用的术语“芳基”和“亚芳基”分别具有6至60个碳原子,但不限于此。在本发明中,芳基或亚芳基是指单环或多环芳族,并且包括由连接或参与反应的相邻取代基形成的芳族环。
[0030]
例如,芳基可以是苯基、联苯基、芴基或螺芴基。
[0031]
前缀“芳基”或“芳”意指被芳基基团取代的基团。例如,芳基烷基可以是被芳基取代的烷基,并且芳基烯基可以是被芳基取代的烯基,并且被芳基取代的基团具有如本文定义的碳原子数。
[0032]
此外,当前缀依次命名时,这意味着按首先描述的顺序列出取代基。例如,芳基烷氧基意指被芳基取代的烷氧基,烷氧基羰基意指被烷氧基取代的羰基,并且芳基羰基烯基也意指被芳基羰基取代的烯基,其中芳基羰基可以是被芳基取代的羰基。
[0033]
除非另外说明,否则如本文使用的术语“杂环基团”含有一个或多个杂原子,但不限于此,具有2个至60个碳原子,包括单环或多环中的任一个,并且可以包括杂脂肪族环和杂芳族环。此外,也可以与相邻基团结合而形成杂环基团。
[0034]
除非另外说明,否则如本文使用的术语“杂原子”表示n、o、s、p或si中的至少一个。
[0035]
此外,术语“杂环基团”可以包括含有so2代替构成环的碳的环。
[0036]
例如,“杂环基团”包括以下化合物。
[0037][0038]
除非另有说明,否则本文所用的术语“芴基”或“亚芴基”是指一价或二价官能团,其中r、r’和r”在以下结构中都是氢,并且术语“取代的芴基”或“取代的亚芴基”是指取代基r、r’、r”中的至少一个是除氢以外的取代基,并且包括其中r和r'彼此键合以与它们所键合
的碳一起形成螺化合物的那些。
[0039][0040]
本文所用的术语“螺化合物”具有“螺连接”,并且螺连接是指其中两个环仅共用一个原子的连接。此时,在两个环中共享的原子被称为“螺原子”,并且这些化合物根据化合物中螺原子的数量分别被称为“单螺
‑”
、“双螺
‑”
和“三螺
‑”
。
[0041]
除非另外说明,否则如本文使用的术语“脂肪族”意指具有1个至60个碳原子的脂肪族烃,并且如本文使用的术语“脂肪族环”意指具有3个至60个碳原子的脂肪族烃环。
[0042]
除非另外说明,否则如本文使用的术语“环”意指具有3个至60个碳原子的脂肪族环、或具有6个至60个碳原子的芳香族环、或具有2个至60个碳原子的杂环、或通过它们的组合而形成的稠合环,并且包括饱和环或不饱和环。
[0043]
除了上述杂化合物以外的其它杂化合物或杂基团包括但不限于一个或多个杂原子。
[0044]
此外,除非明确说明,否则如本文所使用,术语“取代的或未取代的”中的“取代的”是指被一个或多个取代基取代,所述取代基选自氘、卤素、氨基、腈基、硝基、c
1-c
20
烷基基团、c
1-c
20
烷氧基基团、c
1-c
20
烷基胺基团、c
1-c
20
烷基硫喷(thiopen)基团,c
6-c
20
芳基硫喷基团、c
2-c
20
烯基基团、c
2-c
20
炔基基团、c
3-c
20
环烷基基团、c
6-c
20
芳基基团、被氘取代的c
6-c
20
芳基基团、c
8-c
20
芳基烯基基团、硅烷基团、硼基团、锗基团和c
2-c
20
杂环基团,但不限于这些取代基。
[0045]
此外,除非有明确的解释,否则本发明中使用的式与下式的典型定义的取代基的定义相同。
[0046][0047]
在此,当a是零的整数时,取代基r1不存在,当a是1的整数时,唯一的取代基r1连接至构成苯环的碳中的任一个,当a是2或3的整数时,各自如下组合,其中r1可以彼此相同或不同,当a是4至6的整数时,其以类似的方式键合至苯环的碳,尽管省略了键合至形成苯环的碳的氢的指示。
[0048][0049]
在下文,将描述根据本发明的方面的化合物和包含所述化合物的有机电子元件。
[0050]
本发明提供了由式(1)表示的化合物。
[0051]
式(1)
[0052][0053]
其中,每个符号可以如下所定义。
[0054]
1)ar1选自c
6-c
60
芳基基团;芴基基团;包含o、n、s、si或p中的至少一种杂原子的c
2-c
60
杂环基团;-l'-nrarb;
[0055]
当ar1可以为芳基基团时,其可以优选为c
6-c
30
芳基基团,更优选c
6-c
25
芳基基团,如苯基(phenylene)、联苯基、萘基、三联苯基等;
[0056]
当ar1为杂环基团时,其可以优选为c
2-c
30
杂环基团,更优选c
2-c
24
杂环基团,例如,其可以为吡嗪基团、噻吩基团、吡啶基团、嘧啶并吲哚基团、5-苯基-5h-嘧啶并[5,4-b]吲哚基团、喹唑啉基团、苯并喹唑啉基团、咔唑基团、二苯并喹唑基团、二苯并呋喃基团、二苯并噻吩基团、苯并噻吩并嘧啶基团、苯并呋喃并嘧啶基团、吩噻嗪基团、苯基吩噻嗪基团等。
[0057]
2)l1和l'各自独立地选自
[0058]
单键;c
6-c
60
亚芳基基团;和包含o、n、s、si或p中的至少一种杂原子的c
2-c
60
杂环基团;
[0059]
当l1和l'为亚芳基基团时,其可以优选为c
6-c
30
亚芳基基团,更优选c
6-c
24
亚芳基基团,例如,亚苯基(phenylene)、亚联苯基、亚萘基、亚三联苯基等。
[0060]
当l1和l'为杂环基团时,其可以优选为c
2-c
30
杂环基团,更优选c
2-c
24
杂环基团,例如,二价的吡嗪基团、噻吩基团、吡啶基团、嘧啶并吲哚基团、5-苯基-5h-嘧啶并[5,4-b]吲哚基团、喹唑啉基团、苯并喹唑啉基团、咔唑基团、二苯并喹唑基团、二苯并呋喃基团、二苯并噻吩基团、苯并噻吩并嘧啶基团、苯并呋喃并嘧啶基团、吩噻嗪基团、苯基吩噻嗪基团等。
[0061]
3)ra和rb各自独立地选自c
6-c
60
芳基基团;芴基基团;c
3-c
60
脂族环和c
6-c
60
芳族环的稠合环;包含o、n、s、si或p中的至少一种杂原子的c
2-c
60
杂环基团;c
1-c
50
烷基基团、c
2-c
20
烯基基团、c
2-c
20
炔基基团、c
1-c
30
烷氧基基团和c
6-c
30
芳氧基基团,
[0062]
当ra和rb为芳基基团时,其可以优选为c
6-c
30
芳基基团,更优选c
6-c
25
芳基基团,例如苯基(phenylene)、联苯基、萘基、三联苯基等。
[0063]
当ra和rb为稠合环基团时,其可以优选为c
3-c
30
脂族环和c
6-c
30
芳族环的稠合环,更优选c
3-c
24
脂族环和c
6-c
24
芳族环的稠合环。
[0064]
当ra和rb为杂环基团时,其可以优选为c
2-c
30
杂环基团,更优选c
2-c
24
杂环基团,例如,吡嗪基团、噻吩基团、吡啶基团、嘧啶并吲哚基团、5-苯基-5h-嘧啶并[5,4-b]吲哚基团、喹唑啉基团、苯并喹唑啉基团、咔唑基团、二苯并喹唑基团、二苯并呋喃基团、二苯并噻吩基团、苯并噻吩并嘧啶基团、苯并呋喃并嘧啶基团、吩噻嗪基团、苯基吩噻嗪基团等。
[0065]
当ra和rb为烷基基团时,其可以优选为c
1-c
30
烷基基团,并且更优选c
1-c
24
烷基基团。
[0066]
当ra和rb为烷氧基基团时,其可以优选为c
1-c
24
烷氧基基团。
[0067]
当ra和rb为芳氧基基团时,其可以优选为c
6-c
24
芳氧基基团。
[0068]
4)r1和r2为氘,
[0069]
5)a为0至7的整数,b为0至4的整数,
[0070]
6)其中,所述芳基基团、亚芳基基团、杂环基团、芴基基团、稠合环基团、烷基基团、烯基基团、炔基基团、烷氧基基团和芳氧基基团可以被一个或多个选自以下的取代基取代:氘;卤素;硅烷基团;硅氧烷基团;硼基团;锗基团;氰基基团;硝基基团;c
1-c
20
烷硫基基团;c
1-c
20
烷氧基基团;c
1-c
20
烷基基团;c
2-c
20
烯基基团;c
2-c
20
炔基基团;c
6-c
20
芳基基团;氘取代的c
6-c
20
芳基基团;芴基基团;c
2-c
20
杂环基团;c
3-c
20
环烷基基团;c
7-c
20
芳烷基基团;c
8-c
20
芳基烯基基团;和-l'-nrarb;或所述取代基可以彼此键合以形成饱和或不饱和环,其中所述术语“环”表示c
3-c
60
脂族环或c
6-c
60
芳族环或c
2-c
60
杂环基团或由其组合形成的稠合环。
[0071]
此外,本发明提供了化合物,其中式(1)由式(1-1)表示。
[0072]
式(1-1)
[0073][0074]
其中
[0075]
ar1和l1如在式(1)中所定义,
[0076]
此外,本发明提供了化合物,其中式(1)由式(1-2)表示。
[0077]
式(1-2)
[0078]
[0079]
其中
[0080]
1)ar1和l1和r2与式(1)中的定义相同,
[0081]
2)b'为1至4的整数。
[0082]
此外,本发明提供了化合物,其中式(1)由式(1-3)表示。
[0083]
式(1-3)
[0084][0085]
其中
[0086]
1)ar1、l1、r1和r2与式(1)中的定义相同,
[0087]
2)a'为1至7的整数,b'为1至4的整数。
[0088]
此外,l1为单键;或c
6-c
60
亚芳基;ar1为c
6-c
18
芳基基团。
[0089]
此外,本发明提供了化合物,其中式(1)由式(2-1)表示。
[0090]
式(2-1)
[0091][0092]
其中,每个符号可以如下所定义。
[0093]
1)x为o、s或nrc,
[0094]
2)r3和r4各自独立地选自氢;c
6-c
60
芳基基团;包含o、n、s、si或p中的至少一种杂原子的c
2-c
60
杂环基团;c
3-c
60
脂族环和c
6-c
60
芳族环的稠合环;c
1-c
50
烷基基团、c
2-c
20
烯基基团、c
2-c
20
炔基基团、c
1-c
30
烷氧基基团和c
6-c
30
芳氧基基团,和-l'-nrarb;或多个相邻的r3或多个r4可以彼此键合以形成环,
[0095]
当r3和r4为芳基基团时,其可以优选为c
6-c
30
芳基基团,更优选c
6-c
25
芳基基团,例如苯基(phenylene)、联苯基、萘基、三联苯基等。
[0096]
当r3和r4为杂环基团时,其可以优选为c
2-c
30
杂环基团,更优选c
2-c
24
杂环基团,例如,吡嗪基团、噻吩基团、吡啶基团、嘧啶并吲哚基团、5-苯基-5h-嘧啶并[5,4-b]吲哚基团、
喹唑啉基团、苯并喹唑啉基团、咔唑基团、二苯并喹唑基团、二苯并呋喃基团、二苯并噻吩基团、苯并噻吩并嘧啶基团、苯并呋喃并嘧啶基团、吩噻嗪基团、苯基吩噻嗪基团等。
[0097]
当r3和r4为稠合环基团时,其可以优选为c
3-c
30
脂族环和c
6-c
30
芳族环的稠合环基团,更优选c
3-c
24
脂族环和c
6-c
24
芳族环的稠合环基团。
[0098]
当r3和r4为烷基基团时,其可以优选为c
1-c
30
烷基基团,且更优选c
1-c
24
烷基基团。
[0099]
当r3和r4为烷氧基基团时,其可以优选为c
1-c
24
烷氧基基团。
[0100]
当r3和r4为芳氧基基团时,其可以优选为c
6-c
24
芳氧基基团。
[0101]
3)c为0至4的整数,d为0至3的整数,
[0102]
4)l1、r1、r2、a、b、l'、ra和rb与式(1)中定义的相同,
[0103]
5)rc各自独立地选自氢;c
6-c
60
芳基基团;芴基基团;包含o、n、s、si或p中的至少一种杂原子的c
2-c
60
杂环基团;c
3-c
60
脂族环和c
6-c
60
芳族环的稠合环;c
1-c
60
烷基基团、c2~c
20
烯基基团、c
2-c
20
炔基基团、c
1-c
30
烷氧基基团和c
6-c
30
芳氧基基团,
[0104]
当rc为芳基基团时,其可以优选为c
6-c
30
芳基基团,更优选c
6-c
25
芳基基团,例如苯基(phenylene)、联苯基、萘基、三联苯基等。
[0105]
当rc为杂环基团时,其可以优选为c
2-c
30
杂环基团,且更优选c
2-c
24
杂环基团,例如,吡嗪基团、噻吩基团、吡啶基团、嘧啶并吲哚基团、5-苯基-5h-嘧啶并[5,4-b]吲哚基团、喹唑啉基团、苯并喹唑啉基团、咔唑基团、二苯并喹唑基团、二苯并呋喃基团、二苯并噻吩基团、苯并噻吩并嘧啶基团、苯并呋喃并嘧啶基团、吩噻嗪基团、苯基吩噻嗪基团等。
[0106]
当rc为稠合环基团时,其可以优选为c
3-c
30
脂族环和c
6-c
30
芳族环的稠合环基团,更优选c
3-c
24
脂族环和c
6-c
24
芳族环的稠合环基团。
[0107]
当rc为烷基基团时,其可以优选为c
1-c
30
烷基基团,且更优选c
1-c
24
烷基基团。
[0108]
当rc为烷氧基基团时,其可以优选为c
1-c
24
烷氧基基团。
[0109]
当rc为芳氧基基团时,其可以优选为c
6-c
24
芳氧基基团。
[0110]
此外,本发明提供了由式(1)表示的化合物中具有0.2100或小于0.2100的δe
st
值的化合物。
[0111]
此外,本发明提供了由式(1)表示的化合物中具有0.150至0.2100的δe
st
值的化合物。
[0112]
此外,由式(1)表示的化合物由以下化合物p-1至化合物p-60中的任一个表示:
[0113]
[0114]
[0115]
[0116][0117]
参照图1,根据本发明的有机电子元件(100)包括第一电极(110)、第二电极(170)和在第一电极(110)与第二电极(170)之间的包含由式1表示的一种化合物或两种或更多种化合物的有机材料层。在这种情况下,第一电极(110)可以是阳极,第二电极(170)可以是阴极。在相反类型的情况下,第一电极可以是阴极,第二电极可以是阳极。
[0118]
有机材料层可以在第一电极(110)上依次包括空穴注入层(120)、空穴传输层(130)、发射层(140)、电子传输层(150)和电子注入层(160)。在这种情况下,可以不形成除了发射层(140)之外的其余层。它还可以包括空穴阻挡层、电子阻挡层、发射辅助层(220)、缓冲层(210)等,并且电子传输层(150)等可以用作空穴阻挡层。(参见图2)
[0119]
此外,根据本发明实施方案的有机电子元件还可以包括保护层或光效率增强层(180)。光效率增强层可以形成在第一电极的两个表面中不与有机材料层接触的一个表面上,或者形成在第二电极的两个表面中不与有机材料层接触的一个表面上。应用于有机材料层的根据本发明实施方案的化合物可以用作空穴注入层(120)、空穴传输层(130)、发射辅助层(220)、电子传输辅助层、电子传输层(150)和电子注入层(160)、发射层(140)的主体或掺杂剂,或者用作光效率增强层的材料。优选地,例如,根据本发明的式(1)的化合物可以用作发射层的主体材料。
[0120]
有机材料层可以包括2个或更多个堆叠体,包括依次形成在阳极上的空穴传输层、发射层和电子传输层,还包括形成在2个或更多个堆叠体之间的电荷产生层(参见图3)。
[0121]
另外,即使在相同的核的情况下,带隙、电特性、界面特性等也可以根据取代基键合到哪个位置而变化,因此,核和结合到其上的子取代基的组合的选择也是非常重要的,并且特别地,当实现每个有机材料层的能量水平和t1值以及材料的独特性质(迁移率、界面特性等)的最佳组合时。可以同时实现长使用寿命和高效率。
[0122]
根据本发明实施方案的有机电致发光装置可以使用pvd(物理气相沉积)方法制造。例如,在衬底上沉积具有传导性的金属或金属氧化物或其合金以形成阳极,并且在其上形成包括空穴注入层(120)、空穴传输层(130)、发射层(140)、电子传输层(150)和电子注入层(160)的有机材料层之后,其可以通过在其上沉积可以用作阴极的材料来制备。
[0123]
此外,在本发明中,有机材料层通过旋涂工艺、喷嘴印刷工艺、喷墨印刷工艺、狭缝涂布工艺、浸涂工艺和辊对辊工艺中的任一种形成,并且有机材料层提供包含该化合物的有机电子元件作为发射层。
[0124]
作为另一个具体实例,将由式(1)表示的化合物的相同或不同的化合物混合并且用于有机材料层中。
[0125]
此外,本发明提供了包含由式(1)表示的化合物的发射层组合物,并且提供了包含所述发射层的有机电子元件。
[0126]
此外,本发明提供了电子装置,其包括包含有机电子元件的显示装置;以及用于驱动所述显示装置的控制单元。
[0127]
在另一方面,有机电子元件是有机电致发光装置、有机太阳能电池、有机光感受器、有机晶体管和用于单色或白色照明的装置中的至少一种。此时,电子装置可以是当前或将来的有线/无线通信终端,并且覆盖所有种类的电子装置,包括移动通信终端,诸如移动电话、个人数字助理(pda)、电子字典、点对多点(pmp)、遥控器、导航单元、游戏机、各种tv和各种计算机。
[0128]
在下文中,将参考实施例详细描述本发明的由式(1)表示的化合物的合成实施例和本发明的有机电子元件的制造实施例,但是本发明不限于以下实施例。
[0129]
[合成实施例]
[0130]
根据本发明的由式(1)表示的化合物(最终产物)通过如以下方案1中所示sub 1和sub 2的反应来合成,但不限于此。
[0131]
《反应方案1》
[0132][0133]
1.sub1-1的合成例
[0134][0135]
(1)sub1-1b的合成
[0136]
将sub1-1a(50g,0.11mol)、1-氯萘-2-胺(19.8g,0.11mol)、pd2(dba)3(3.1g,0.003mol)、50%p(t-bu)3(2.7g,0.007mol)、naot-bu(32.2g,0.33mol)添加至甲苯(220ml)并在90℃搅拌。反应完成后,除去反应溶剂并且将浓缩的有机材料使用硅胶柱或重结晶方法分离,得到50g(88.3%)的sub1-1b产物。
[0137]
(2)sub1-1的合成
[0138]
将pd(oac)2(0.62g,0.003mol)、p(t-bu)3(2.2g,0.006mol)、k2co3(38g,0.28mol)、
dma(185ml)添加至sub1-1b(50g,0.09mol)并在170℃搅拌2小时。当反应完成时,除去反应溶剂并放入冰水中。然后,将沉淀的固体使用硅胶柱或重结晶方法分离,得到28g(60.1%)的产物sub1-1。
[0139]
2.sub1-2的合成例
[0140][0141]
(1)sub1-2b的合成
[0142]
将sub1-2a(38g,0.08mol)、1-氯萘-2-胺(14.9g,0.08mol)、pd2(dba)3(2.3g,0.003mol)、50%p(t-bu)3(2.0g,0.005mol)、naot-bu(24.3g,0.25mol)添加至甲苯(170ml)并在90℃搅拌。当反应完成时,通过使用上文关于sub1-1b描述的分离方法得到40g(86.7%)的产物sub1-2b。
[0143]
(2)sub1-2的合成
[0144]
将pd(oac)2(0.49g,0.002mol)、p(t-bu)3(1.8g,0.004mol)、k2co3(30.2g,0.22mol)、dma(145ml)添加至sub1-2b(40g,0.07mol)并在170℃搅拌12小时。当反应完成时,除去反应溶剂并放入冰水中。然后,将沉淀的固体使用硅胶柱或重结晶方法分离,得到23g(61.7%)的产物sub1-2。
[0145]
3.sub1-13的合成例
[0146][0147]
(1)sub1-13b的合成
[0148]
将sub1-13a(50g,0.11mol)、1-氯萘-2-胺(19.3g,0.11mol)、pd2(dba)3(3.0g,0.003mol)、50%p(t-bu)3(2.6g,0.007mol)naot-bu(31.4g,0.33mol)添加至甲苯(220ml)并在90℃搅拌。当反应完成时,通过使用用于sub1-1b的分离方法得到51g(84.2%)的产物sub1-13b。
[0149]
(2)sub1-13的合成
[0150]
将pd(oac)2(0.48g,0.002mol)、p(t-bu)3(1.7g,0.004mol)、k2co3(29.8g,
0.22mol)、dma(145ml)添加至sub1-13b(40g,0.07mol)并在170℃搅拌12小时。当反应完成时,除去反应溶剂并放入冰水中。然后,将沉淀的固体使用硅胶柱或重结晶方法分离,得到24g(64.3%)的产物sub1-13。
[0151]
同时,属于sub 1的化合物可以是以下化合物,但不限于此,下
[0152]
表1显示了属于sub1-1至sub1-13的化合物的场解吸质谱(fd-ms)值。
[0153][0154][0155]
[表1]
[0156][0157]
同时,属于sub 2的化合物可以是如下的化合物,但不限于此,下表2显示了属于sub 2-1至sub2-52的化合物的场解吸质谱(fd-ms)值。
[0158]
[0159][0160]
[表2]
[0161]
[0162][0163]
ii.最终产物的合成
[0164]
1.p-1的合成例
[0165][0166]
添加sub1-1(30g,0.06mol)、sub2-1(9.3g,0.06mol)、pd2(dba)3(1.6g,0.002mol)、naot-bu(16.9g,0.18mol)、p(t-bu)3(1.4g,0.004mol)、甲苯(120ml)并在135℃反应6小时。当反应完成时,将反应物的温度冷却至室温,并除去反应溶剂。然后,将浓缩的反应物使用硅胶柱或重结晶方法分离,得到28g(81.3%)的产物p-1。
[0167]
2.p-7的合成例
[0168][0169]
添加sub1-1(50g,0.10mol)、sub2-7(30.4g,0.10mol)、pd2(dba)3(2.7g,
0.003mol)、naot-bu(28.4g,0.29mol)、p(t-bu)3(2.4g,0.006mol)、甲苯(200ml)并在135℃反应6小时。当反应完成时,通过使用用于p-1的分离方法得到59g(81.5%)的产物p-7。
[0170]
3.p-12的合成例
[0171][0172]
添加sub1-1(20g,0.04mol)、sub2-12(10.1g,0.04mol)、pd2(dba)3(1.1g,0.001mol)、naot-bu(11.3g,0.12mol)、p(t-bu)3(1.0g,0.0024mol)、甲苯(80ml)并在135℃反应6小时。当反应完成时,通过使用用于p-1的分离方法得到24g(89.2%)的产物p-12。
[0173]
4.p-20的合成例
[0174][0175]
添加sub1-1(30g,0.06mol)、sub2-31(15.5g,0.06mol)、pd2(dba)3(1.6g,0.002mol)、naot-bu(17g,0.18mol)、p(t-bu)3(1.4g,0.0035mol)、甲苯(120ml)并在135℃反应6小时。反应完成时,通过使用用于p-1的分离方法得到35g(86%)的产物p-20。
[0176]
5.p-25的合成例
[0177][0178]
添加sub1-2(15g,0.03mol)、sub2-1(4.6g,0.03mol)、pd2(dba)3(0.8g,0.0009mol)、naot-bu(8.5g,0.09mol)、p(t-bu)3(0.7g,0.0018mol)、甲苯(60ml)并在135℃反应6小时。当反应完成时,通过使用用于p-1的分离方法得到16g(92.9%)的产物p-25。
[0179]
6.p-42的合成例
[0180][0181]
添加sub1-13(20g,0.04mol)、sub2-1(6.1g,0.04mol)、pd2(dba)3(1.1g,0.0012mol)、naot-bu(11.1g,0.12mol)、p(t-bu)3(0.9g,0.0023mol)、甲苯(80ml)并在135℃反应6小时。当反应完成时,通过使用用于p-1的分离方法得到20g(87.2%)的产物p-42。
[0182]
7.p-53的合成例
[0183][0184]
添加sub1-1(30g,0.06mol)、sub2-28(18.7g,0.06mol)、pd2(dba)3(1.6g,0.0018mol)、naot-bu(17g,0.18mol)、p(t-bu)3(1.4g,0.0035mol)、甲苯(120ml)并在135℃反应6小时。当反应完成时,通过使用用于p-1的分离方法得到38g(87.5%)的产物p-53。
[0185]
同时,根据上述合成例制备的本发明的化合物p-1至化合物p-60的fd-ms值示于下表3中。
[0186]
[表3]
[0187]
[0188][0189]
发明描述
[0190]
在本发明中,avg.δe
st
可以表达为avg.s1-t1,并且表示在不同化合物的混合状态下不同分子中特定单个分子的单重态能量(s1)与三重态能量(t1)之差的平均值。为了平滑计算,使用三嗪类化合物作为在不同化合物中显示电学性质的化合物,并且其他化合物利用本发明的化合物。更详细地,作为三嗪类化合物,使用由c
6-c
20
芳基基团构成的三嗪类化合物或其中含有o、s、si或n元素的杂环被取代的三嗪类化合物,并且δe
st
值是在三嗪类化合物和本发明的化合物混合的状态下测量的。
[0191]
关于avg.δe
st
更详细地来说,许多电子供体和受体单分子[128]以恒定比例[p:n=5:5]置于具有周期性边界条件(pbc)的元胞(unit cell)中,并为此进行分子动力学模拟。分子动力学模拟共分4个步骤进行,并且第一步骤是根据布朗力学在等体积的条件下在10开尔文(k)的温度下进行的。第二步骤也根据布朗动力学进行,但在恒定大气压(1.01325巴)下,在100开尔文(k)的温度下进行。然后,在第三步骤中,根据力场计算分子动力学,并且该过程在恒定压力(大气压力)和温度(室温)下进行0.1纳秒(ns)。最后,在与第三步骤相同的条件(大气压、室温)下,以2飞秒(fs)为单位进行分子动力学过程,并且要求进行模拟
直到预定时间[140纳秒]为止。此时,预定时间应足够长,使非晶固体结构达到平衡状态。之后,提取最终时间点[140纳秒]的结构数据,并从相应的结构中提取(采样)具有不同单体(供体和受体)的二聚体。在这种情况下,提取二聚体的条件是当异二聚体之间的距离小于时,随机选择满足条件的一些[1/3]二聚体并用于计算。对于通过量子力学模拟提取的二聚体,通过时间相关密度泛函理论(td-dft)进行单点能量计算,因此计算每个异二聚体的第一最低单重态激发能量(s1)和第一最低三重态激发能量(t1)。此时,s1和t1之间的差称为异二聚体的第一单重态-三线重态激发能量(δe
st
)差。
[0192]
所有计算均通过分子模拟(schrodinger materials science suite 4.1.161)进行,并使用desmond包进行分子动力学模拟。分子动力学模拟是在npt集合下使用nose-hoover链方法和martyna-tobias-klein方法进行的。从通过分子动力学模拟得到的结构中提取单体,计算基于第一原理的量子化学性质,并在该过程中使用了gaussian和jaguar包。在通过jaguar的量子力学计算中,采用td-dft计算第一单重态/三重态激发能量,采用常用的b3lyp/6-31g进行计算方法(method/basis set)。
[0193]
本发明中定义的异二聚体是具有分子动态确定的二聚体构象的两种不同的分子,并且此时,这两种分子分别对应于作为p型和n型(空穴、电子)主体材料起作用的分子,并且分子之间的最小距离必须为或更小。为了找到这些异二聚体,创建了其中两个分子以p:n=4:6的比例混合的多分子结构,并且分子动力学模拟分几个步骤进行,以找到最稳定的分子动力学(平衡点)。此时,由于分子间相互作用,分子的构象具有与一般单分子(气相状态)的量子力学优化结构相比的变化形式,并且因此,分子的形状和性质具有不是恒定值的分布,并表现出与单分子结构(气相分子)不同的特性。
[0194]
激基复合物是一种特殊的异二聚体,并且表示激发的异二聚体。
[0195]
要检查分子动力学确定的异二聚体的激发态,提取低于分子之间低于某个最小距离的异二聚体,并且为此,根据时间相关密度泛函理论(td-dft)计算激发态。此时,计算单点能量以照射在固相上的激基复合物,并且该结果对应于固相异二聚体激发态(单重态、三重态)的垂直激发能量。
[0196]
为确定是否形成激基复合物,分离异二聚体,根据密度泛函理论通过单点能量计算来计算每个单分子的单重态激发能,并根据文献确定以下判别式。
[0197][0198]
在该数据中,仅使用满足上述条件的异二聚体进行计算,并将其定义为在固相中的激基复合物。
[0199]
基于此测量的δe
st
值示于下表4中。
[0200]
[表4]
[0201]
化合物δe
st
p-10.2094p-250.1997p-420.2035对比化合物a0.2591对比化合物b0.3082
对比化合物c0.2185对比化合物d0.2212对比化合物e0.2128对比化合物f0.2466
[0202]
[实施例1]红色有机发光装置(磷光主体)
[0203]
有机电致发光装置根据常规方法通过使用通过合成获得的化合物作为发射层的发光主体材料来制造。首先,将n1-(萘-2-基)-n4,n4-双(4-(萘-2-基(苯基)氨基)苯基)-n1-苯基苯-1,4-二胺(缩写为2-tnata)膜真空沉积在形成于玻璃衬底上的ito层(阳极)上以形成60nm厚的空穴注入层,并且将4,4-双[n-(1-萘基)-n-苯基氨基]联苯(下文缩写为npd)作为空穴注入层上的空穴传输化合物真空沉积至60nm的厚度以形成空穴传输层。
[0204]
作为空穴传输层上的主体,以5:5的重量比使用由式(1)和dsnl1表示的本发明的化合物(p-1),并且以95:5的重量比掺杂作为掺杂剂材料的(piq)2ir(acac)[双(1-苯基异喹啉基)铱(iii)乙酰丙酮化物]以沉积30nm厚的发射层。随后,将(1,1'-双苯基)-4-油酸根合)双(2-甲基-8-喹啉油酸根合)铝(缩写为balq)真空沉积至10nm的厚度作为空穴阻挡层,并且将三(8-羟基喹啉)铝(缩写为alq3)沉积至40nm的厚度作为电子传输层。然后,将lif(碱金属卤化物)沉积至0.2nm的厚度作为电子注入层,然后将al沉积至150nm的厚度并且用作阴极以制备有机电致发光装置。
[0205][0206]
[实施例2]至[实施例14]
[0207]
以与实施例1相同的方式制备有机电致发光装置,但使用表5中所示的化合物dsnl1或dsnl2和本发明化合物代替本发明化合物(p-1)作为发射层的主体材料。
[0208]
[对比例1]至[对比例12]
[0209]
以与实施例1相同的方式制造有机电致发光装置,但使用化合物dsnl1或dsnl2和对比化合物a至对比化合物f作为发射层的主体材料。
[0210][0211]
通过向以这种方式制备的实施例1至实施例14和对比例1至对比例12中制备的有机电子装置施加正向偏置dc电压,用来自照片研究(photo research)的pr-650测量电致发光(el)特性,并且作为测量结果,使用mcscience制造的使用寿命测量装置以2500cd/m2标准亮度测量t95使用寿命。以下表6示出了装置制造和评估结果。
[0212]
[表5]
[0213]
[0214]
[0215][0216]
从表5中的结果可以看出,当本发明的化合物用作发射层的材料时,可以看出,与使用比较化合物a至f的情况相比,驱动电压降低并且效率和使用寿命显著改善。
[0217]
更具体地,本发明的化合物具有比对比化合物更低的δe
st
值。该δe
st
值在很大程度上取决于在作为母体结构的结构中取代的取代基的组成。取决于特定取代基的取代,δe
st
值是在0.210或小于0.210和大于0.210的值之间显示出非常小差异的部分,但从0.210的值开始显示使用寿命的显著差异。在本发明中,证实了决定低δe
st
值的取代基具有将苯基取代为萘基的结构,并且此外,证实了当用氘取代苯基和萘基时,其具有低的δe
st
值。从这些δe
st
值与装置结果的关系来看,一般而言,激基复合物与单分子相比具有较低的s1-t1
(δe
st
)能量差,从而降低了三重态中的激子结合能(电子与空穴之间的结合能)。因此,当激子形成时,剩余能量减少,并且由于激子的非辐射衰变而发射的热能也减少。由于这些在发光过程中产生的额外能量会对oled装置造成损害,因此在发射层中形成激基复合物在装置的使用寿命方面是有利的。
[0218]
每个激基复合物的s1-t1能量差(δe
st
)用于比较激基复合物对使用寿命的影响。
[0219][0220]
激基复合物的s1-t1能量差越小,两个分子之间的轨道重叠矩阵元素越小,从而增加荧光寿命。处于荧光状态(s1)的激基复合物将能量传递给掺杂剂,但如果能量没有被传递并且其使用寿命结束,它就会通过非发光路径以热能的形式消散,从而导致在装置中的热降解。因此,随着具有低s1-t1能量差的激基复合物的荧光寿命增加,向发光体的能量转移效率增加,从而通过减少非发光路径导致的热性能劣化来提高装置使用寿命。
[0221]
在本发明中,证实了由于被特定的取代基取代,其会具有低的δe
st
值,并且当氘在特定的位置取代时,其具有更低的δe
st
值。在此基础上,设计了分子结构并测量了装置。因此,可以证实诸如上述那些的优异的装置结果。
[0222]
比较本发明的化合物,可以看出,在取代基含有化学不稳定元素的情况下,使用寿命降低,并且驱动电压和效率可以根据整体hod(仅空穴装置)和eod(仅电子装置)值来确定。可以看出,在这种hod和eod的情况下,其取决于化合物的板状结构的形式或能级来确定。因此,空穴和电子的迁移率取决于在同一骨架中取代的取代基的类型,并且本实施方案的化合物根据不同的迁移率表现出不同的特性。
[0223]
尽管为了说明的目的描述了本发明的示例性实施方案,但是本领域技术人员将理解,在不脱离如所附权利要求中所公开的本发明的范围和主旨的情况下,各种修改、添加和替换是可能的。因此,在本发明中公开的实施方案旨在说明本发明的技术思想的范围,并且本发明的范围不受实施方案的限制。本发明的范围应基于所附权利要求来解释,并且应解释为包括在与权利要求等同的范围内的所有技术思想都属于本发明。
[0224]
附图的简要说明
[0225]
100、200、300:有机电子元件
ꢀꢀꢀ
110:第一电极
[0226]
120:空穴注入层
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
130:空穴传输层
[0227]
140:发射层
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
150:电子传输层
[0228]
160:电子注入层
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
170:第二电极
[0229]
180:光效率增强层
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
210:缓冲层
[0230]
220:发射辅助层
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
320:第一空穴注入层
[0231]
330:第一空穴传输层
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
340:第一发射层
[0232]
350:第一电子传输层
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
360:第一电荷产生层
[0233]
361:第二电荷产生层
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
420:第二空穴注入层
[0234]
430:第二空穴传输层
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
440:第二发射层
[0235]
450:第二电子传输层
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
cgl:电荷产生层
[0236]
st1:第一堆叠体
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
st2:第二堆叠体。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。