1.本发明属于药物化学领域,具体涉及一种多靶点酪氨酸激酶抑制剂及其制备方法和用途。
背景技术:
2.恶性肿瘤(癌症)已经成为21世纪中国乃至全球最严重的公共卫生问题之一,严重威胁人类健康。使用抗癌药物进行化疗是目前治疗癌症的主要手段之一,然而,常用的化疗药物往往具有通过对肿瘤细胞的毒性来抑制杀死肿瘤,存在对正常细胞的毒副作用,不良反应多,而且还有易产生耐药性、疗效差等缺点。因此,目前的研究更着眼于分子靶向性的新型抗肿瘤药物。
3.由于酪氨酸激酶(rtks)存在于大多数的肿瘤致病基因中,因而以vegfr、egfr、pdgfr、igfr、flt3、csf1r、fgfr、ret、c
‑
kit等酪氨酸激酶为靶点的药物研究与开发受到了广泛的关注,酪氨酸激酶抑制剂已经成为抗肿瘤药物研究领域的热点。
4.酪氨酸激酶抑制剂具有高选择性、低毒性、副作用少的优势,在抗肿瘤药物中应用越来越广泛,目前已有许多rtks抑制剂药物上市。
5.例如,日本卫材(eisai)公司研发的仑伐替尼(lenvatinib)是一种多靶点受体酪氨酸激酶抑制剂,可抑制vegfr1、vegfr2和vegfr3,亦可抑制其他与病理性新生血管、肿瘤生长及癌症进展相关的rtk,包括成纤维细胞生长因子(fgf)受体fgfr1,2,3,4和血小板衍化生长因子受体α(pdgfrα),kit及ret。2015年美国fda和欧洲药品管理局ema批准仑伐替尼用于治疗侵袭性、局部晚期或转移性分化型甲状腺癌。2016年美国fda和欧洲ema又相继批准仑伐替尼联合依维莫司用于治疗晚期肾细胞癌。
[0006][0007]
然而,仑伐替尼仍存在药效不高和不良反应严重的问题,因此仍急需研发一种能够提高疗效的新型rtks抑制剂。
技术实现要素:
[0008]
本发明的目的在于提供一种新型多靶点酪氨酸激酶抑制剂。
[0009]
本发明提供了式i所示化合物或其药学上可接受的盐,
[0010][0011]
其中,r为h、卤素取代的c1~c3烷基或
‑
ch2‑
r’,所述r’为芳基或c3~c6环烃基。
[0012]
进一步地,r为h、卤素取代的甲基或
‑
ch2‑
r’,所述r’为苯基或c3~c6环烷基。
[0013]
更进一步地,r为h、f取代的甲基或
‑
ch2‑
r’,所述r’为环丙基。
[0014]
更进一步地,r为h、优选为h、
[0015]
进一步地,上述化合物选自如下结构:
[0016][0017]
本发明还提供了上述化合物的方法,合成路线如下:
[0018][0019]
其中,合成路线包括以下步骤:
[0020]
(1)化合物a与氨发生氨解反应,生成化合物b;
[0021]
(2)化合物b与化合物c在拔氢剂的作用下发生偶联反应,生成化合物d;
[0022]
(3)化合物d与化合物e在有机碱作用下发生缩合反应,生成化合物f;
[0023]
(4)化合物f与化合物g在有机碱作用下发生亲核取代反应,生成式i所示化合物;
[0024]
进一步地,步骤(1)所述氨解反应条件为:化合物a和氨甲醇在甲醇溶液中,20~30℃反应10~20h;所述化合物a和氨甲醇的摩尔比为1:(2~5);
[0025]
步骤(2)所述拔氢剂为氰化钠、二异丙基氨基锂、双三甲基硅基胺基锂或正丁基锂,优选为氰化钠;所述偶联反应条件为50~70℃反应3~5h;所述化合物b、化合物c和拔氢剂的摩尔比为1:(1~3):(1~3);
[0026]
步骤(3)所述有机碱为三乙胺、吡啶或n,n
‑
二异丙基乙胺,优选为三乙胺,所述缩合反应条件为:室温反应3~5h;所述化合物d、化合物e和有机碱的摩尔比为:1:(1~1.5):(1.5~2.5);
[0027]
步骤(4)所述有机碱为三乙胺、吡啶或n,n
‑
二异丙基乙胺,优选为三乙胺,所述亲核取代反应条件为70~90℃反应3~5h;所述化合物f、化合物g和有机碱的摩尔比为1:(1.5~2.5):(2.5~3.5)。
[0028]
更进一步地,步骤(1)所述反应为20~30℃反应16h;化合物a和氨甲醇的摩尔比为1:3;
[0029]
步骤(2)所述偶联反应条件为60℃反应4h;所述化合物b、化合物c和拔氢剂的摩尔比为1:1.5:1.5;
[0030]
步骤(3)所述缩合反应条件为:20~30℃反应4h;所述化合物d、化合物e和有机碱的摩尔比为:1:1.1:2;
[0031]
步骤(4)所述亲核取代反应条件为60℃反应4h;所述化合物f、化合物g和有机碱的摩尔比为1:2:3。
[0032]
本发明还提供了上述化合物或其药学上可接受的盐在酪氨酸激酶抑制剂中的用途。
[0033]
本发明还提供了上述化合物或其药学上可接受的盐在制备用于治疗和/或预防与酪氨酸激酶表达异常引起的相关疾病的药物中的用途。
[0034]
进一步地,上述治疗和/或预防与酪氨酸激酶表达异常引起的相关疾病的药物是
治疗和/或预防癌症的药物;优选的,所述癌症为肺癌、肝癌、胃癌、肾癌、乳腺癌、食道癌、鼻咽癌、子宫癌、结肠癌、直肠癌、白血病、骨癌或淋巴癌。
[0035]
本发明的有益效果在于,本发明提供的化合物靶向作用于血管内皮生长因子(vegf)受体vegfr1~3、纤维母细胞生长因子受体fgfr1~4、血小板衍生生长因子受体α(pdgfrα)、kit和ret,对以上酪氨酸激酶(rtks)均有显著的活性抑制作用,且效果优于阳性对照药lenvatinib。本发明提供的化合物在制备多靶点酪氨酸激酶抑制剂,以及制备预防和/或治疗与酪氨酸激酶(vegfr1~3、fgfr1~4、pdgfrα、kit和ret)过表达相关的肿瘤(肝癌、非小细胞肺癌、甲状腺癌等)的药物中具有广阔的应用前景。
[0036]
本发明所述药学上可接受的盐是指本发明“药学上可接受的盐”是指利用该化合物的游离碱与无机或有机酸直接成盐反应得到的产物。其中,无机或有机酸可选自盐酸、氢溴酸、氢氟酸、硫酸、磷酸、硝酸、甲酸、乙酸、苦味酸、柠檬酸、马来酸、甲烷磺酸、三氟甲烷磺酸、乙烷磺酸、对甲苯磺酸等
[0037]
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
[0038]
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。
[0039]
凡基于本发明上述内容所实现的技术均属于本发明的范围。
具体实施方式
[0040]
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
[0041]
本发明所用原料与设备均为已知产品,通过购买市售产品所得。
[0042]
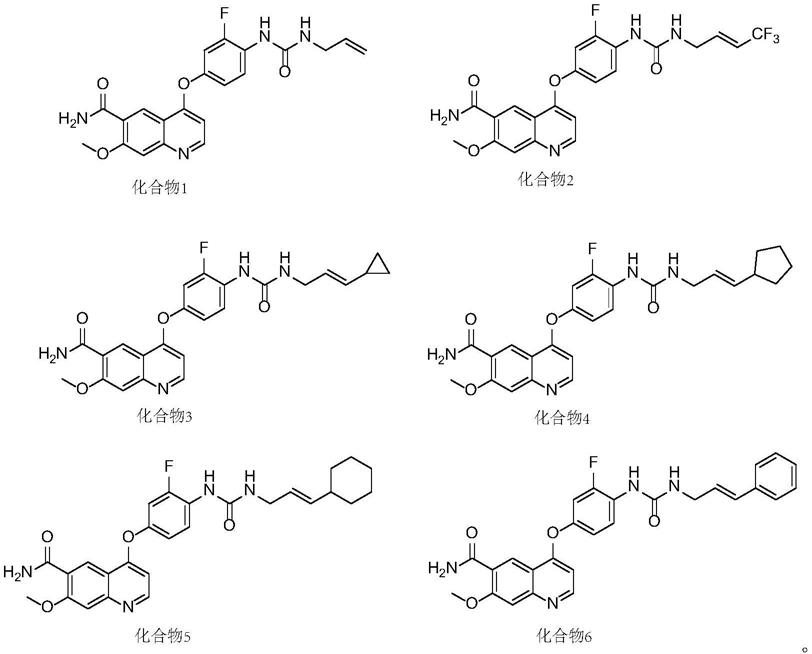
实施例1、化合物1的制备
[0043]
合成路线为:
[0044][0045]
具体制备方法包括:
[0046]
向反应瓶中加入化合物a 12.6g(50.0mmol)、氨甲醇溶液(150.0mmol)和50ml甲醇,20
‑
30℃反应16h,向体系加入250ml水和250ml乙酸乙酯,分液收集有机层,有机相先后经100ml水洗、50ml饱和食盐水洗、无水硫酸钠干燥后,经减压浓缩得化合物b。经硅胶柱纯
化(pe:ea=2:1)纯化得7.9g,收率67.0%,lc/ms m/z=237.2[m h]
。
[0047]
取化合物c 5.72g(45.0mmol)溶于45ml dmf中,缓慢加入拔氢剂nah 1.80g(45.0mmol),室温搅拌30min后加入化合物b 7.1g(30.0mmol),60℃反应4h反应,降温至室温加250ml水和250ml乙酸乙酯,搅拌1min后静置分液收集有机相,有机相用80ml水洗一次,减压浓缩有机相,浓缩物经硅胶柱纯化(dcm:meoh=20:1)得化合物d 9.82g,收率78.0%,lc/ms m/z=328.1[m h]
。
[0048]
取化合物d 9.00g(27.5mmol)、化合物e 7.74g(30.2mmol)、三乙胺5.56g(55.0mmol)和二氯甲烷100ml,降温至0
‑
5℃后滴加化合物e7.74g(30.2mmol)的二氯甲烷溶液(40ml),室温反应4h后加水100ml,收集有机相,有机相用50ml水洗后经减压浓缩得化合物f粗品,然后经硅胶柱纯化(pe:ea=1:2)的化合物f纯品10.30g,收率84.0%,lc/ms m/z=448.3[m h]
。
[0049]
取化合物f 0.70g(1.5mmol)、g
‑
1 0.28g(3.0mmol),三乙胺0.45g(4.5mmol)和dmf 5ml,反应体系在80℃下反应4h后降温至室温,加入25ml水和50ml ea,收集有机相,有机相用10ml水洗后减压浓缩至干得化合物1粗品,然后经硅胶柱纯化得化合物1纯品0.28g,收率45.0%。lc/ms m/z=411.2[m h]
,1hnmr(dmso
‑
d6):3.98(s,3h),4.26
‑
4.28(m,2h),5.10
‑
5.12(m,1h),5.21(m,1h),5.92
‑
5.93(m,1h),6.48(d,j=5.7hz,1h),7.20
‑
7.23(m,2h),7.49
‑
7.51(m,2h),7.85(s,1h),7.99(s,1h),8.25
‑
8.26(m,1h),8.61
‑
8.66(m,2h).
[0050]
实施例2、化合物2的制备
[0051]
合成路线为:
[0052][0053]
同实施例1的方法合成f,取化合物f 0.70g(1.5mmol)、化合物g
‑
2 0.48g(3.0mmol),三乙胺0.45g(4.5mmol)和dmf 5ml,反应体系在80℃下反应4h后降温至室温,加入25ml水和50ml ea,收集有机相,有机相用10ml水洗后减压浓缩至干得化合物2粗品,然后经硅胶柱纯化得化合物2纯品0.27g,收率38.0%。lc/ms m/z=479.1[m h]
,1hnmr(dmso
‑
d6):3.99(s,3h),4.26
‑
4.28(m,2h),5.72
‑
5.74(m,1h),6.12
‑
6.14(m,1h),6.49(d,j=5.5hz,1h),7.21
‑
7.24(m,2h),7.50
‑
7.5(m,2h),7.85(s,1h),7.98(s,1h),8.25
‑
8.26(m,1h),8.62
‑
8.65(m,2h).
[0054]
实施例3、化合物3的制备
[0055]
合成路线为:
[0056][0057]
同实施例1的方法合成f,取化合物f 0.70g(1.5mmol)、化合物g
‑
3 0.40g
(3.0mmol),三乙胺0.45g(4.5mmol)和dmf 5ml,反应体系在80℃下反应4h后降温至室温,加入25ml水和50ml ea,收集有机相,有机相用10ml水洗后减压浓缩至干得化合物3粗品,然后经硅胶柱纯化得化合物3纯品0.28g,收率41.0%。lc/ms m/z=451.1[m h]
,1hnmr(dmso
‑
d6):0.45
‑
0.47(m,4h),1.30
‑
1.32(m,1h),3.99(s,3h),4.26
‑
4.28(m,2h),5.71
‑
5.72(m,1h),5.90
‑
5.91(m,1h),6.48
‑
6.49(m,1h),7.20
‑
7.25(m,2h),7.49
‑
7.52(m,1h),7.85(s,1h),7.99(s,1h),8.25
‑
8.27(m,1h),8.62
‑
8.65(m,2h).
[0058]
实施例4、化合物4的制备
[0059]
合成路线为:
[0060][0061]
同实施例1的方法合成f,取化合物f 0.70g(1.5mmol)、化合物g
‑
4 0.49g(3.0mmol),三乙胺0.45g(4.5mmol)和dmf 5ml,反应体系在80℃下反应4h后降温至室温,加入25ml水和50ml ea,收集有机相,有机相用10ml水洗后减压浓缩至干得化合物4粗品,然后经硅胶柱纯化得化合物4纯品0.22g,收率31.0%。lc/ms m/z=479.5[m h]
,1hnmr(dmso
‑
d6):1.42
‑
1.46(m,4h),1.68
‑
1.73(m,4h),2.18
‑
2.21(m,1h),3.98(s,3h),4.26
‑
4.28(m,2h),5.67
‑
5.69(m,1h),5.85
‑
5.87(m,1h),6.48
‑
6.49(m,1h),7.20
‑
7.22(m,2h),7.49
‑
7.51(m,2h),7.85(s,1h),7.99(s,1h),8.25
‑
8.26(m,1h),8.61
‑
8.66(m,2h).
[0062]
实施例5、化合物5的制备
[0063]
合成路线为:
[0064][0065]
同实施例1的方法合成f,取化合物f 0.70g(1.5mmol)、化合物g
‑
5 0.53g(3.0mmol),三乙胺0.45g(4.5mmol)和dmf 5ml,反应体系在80℃下反应4h后降温至室温,加入25ml水和50ml ea,收集有机相,有机相用10ml水洗后减压浓缩至干得化合物5粗品,然后经硅胶柱纯化得化合物5纯品0.27g,收率37.0%。lc/ms m/z=493.5[m h]
,1hnmr(dmso
‑
d6):1.30
‑
1.39(m,4h),1.43
‑
1.49(m,6h),2.28
‑
2.31(m,1h),3.99(s,3h),4.26
‑
4.28(m,2h),5.67
‑
5.69(m,1h),5.85
‑
5.87(m,1h),6.48
‑
6.49(m,1h),7.21
‑
7.23(m,2h),7.51
‑
7.53(m,2h),7.82(s,1h),7.97(s,1h),8.25
‑
8.28(m,1h),8.63
‑
8.67(m,2h).
[0066]
实施例6、化合物6的制备
[0067]
合成路线为:
[0068][0069]
同实施例1的方法合成f,取化合物f 0.70g(1.5mmol)、化合物g
‑
6 0.51g(3.0mmol),三乙胺0.45g(4.5mmol)和dmf 5ml,反应体系在80℃下反应4h后降温至室温,加入25ml水和50ml ea,收集有机相,有机相用10ml水洗后减压浓缩至干得化合物6粗品,然后经硅胶柱纯化得化合物6纯品0.31g,收率43.0%。lc/ms m/z=497.5[m h]
。4.01(s,3h),4.26
‑
4.28(m,2h),5.67
‑
5.69(m,1h),5.85
‑
5.87(m,1h),6.48
‑
6.49(m,1h),7.10
‑
7.12(m,1h),7.25
‑
7.34(m,5h),7.22(m,1h),7.51
‑
7.54(m,2h),7.82(s,1h),7.97(s,1h),8.25
‑
8.28(m,1h),8.63
‑
8.67(m,2h).
[0070]
以下通过实验例证明本发明的有益效果。
[0071]
实验例1、本发明化合物对vegf1~3突变的肝癌细胞生长抑制作用
[0072]
1.实验方法
[0073]
将人肝癌细胞株hep g2、huh7平铺于96孔板上,培养72小时,将不同浓度的待测化合物加入到培养孔板中,每个待测化合物设置9个浓度,最高浓度为10um,按照1:3比例梯度稀释。然后将细胞于37℃下培养72小时。加入mtt工作液(0.3mg/ml mtt;0.00265mg/ml pms),培养箱中继续孵育2h,将96孔板取出,微孔板振荡器震荡5min,酶标仪上450nm处读取吸光值。计算各待测化合物对hep g2、huh7细胞的半数抑制浓度ic
50
。以fda批准的并在中国上市的rtks抑制剂lenvatinib作为阳性对照。
[0074]
2.实验结果
[0075]
表1 各化合物对hep g2、huh7细胞的抑制效果
[0076]
化合物hep g2/ic50(μm/l)huh7/ic50(μm/l)化合物10.798
±
0.035*0.864
±
0.063*化合物20.785
±
0.032*0.775
±
0.039*化合物30.895
±
0.073*0.909
±
0.066*化合物40.762
±
0.076*0.889
±
0.077*化合物51.263
±
0.053*1.162
±
0.076*化合物61.210
±
0.086*1.234
±
0.106*lenvatinib3.360
±
0.1034.070
±
0.189
[0077]
备注:*代表与lenvatinib组相对比p<0.05
[0078]
生物活性数据表明:本发明化合物对hep g2(人肝癌细胞株)和huh7(人肝癌细胞株)的体外增殖具有抑制作用,且生物活性优于阳性对照药lenvatinib。
[0079]
实验例2、本发明化合物对fgfr1~4激酶活性抑制作用
[0080]
1.实验方法
[0081]
在1nm的fgfr1、fgfr2、fgfr3、fgfr4,33μm atp,孵育1.5h的优化条件下,将激酶所需配制的浓度变为4x,向孔里加入2.5ul;化合物的浓度也需配成4x,向孔中加入2.5ul。其他步骤一致。需要做一个没有化合物的阳性对照,及反应0min的阴性对照。最后在envision
激酶仪上检测信号,收集数据,通过计算得到ic50值。
[0082]
2.实验结果
[0083]
表2 各化合物对fgfr1~4激酶活性的抑制效果
[0084][0085][0086]
备注:*代表与lenvatinib组相对比p<0.05
[0087]
生物活性数据表明:本发明化合物对fgfr1~4激酶活性具有抑制作用,且化合物1、2、3、4、5、6的fgfr1生物活性优于阳性对照药lenvatinib,化合物1、2、3、4、6的fgfr2生物活性优于阳性对照药lenvatinib,化合物1、2、3、4、5的fgfr3生物活性优于阳性对照药lenvatinib,化合物1、4、5的fgfr4生物活性优于阳性对照药lenvatinib。
[0088]
实验例3、本发明化合物对pdgfrα、kit和ret激酶活性抑制作用
[0089]
1.实验方法
[0090]
采用bac
‑
to
‑
bactm昆虫杆状病毒表达系统分别表达具有激酶活性的egfr和kit受体酪氨酸激酶胞内区蛋白,优化激酶活性和酶浓度、底物浓度及二价金属离子浓度的比例关系(poly(glu,tyr)4:110μg/ml,酶0.5μl,atp5μm,mg2 20mm,mn2 0.2mm),建立基于酶联免疫吸附法(enzyme
‑
linked immunosorbent assay,elisa)的pdgfrα、kit和ret酪氨酸激酶抑制剂筛选模型。最后在envision激酶仪上检测信号,收集数据,通过计算得到ic50值。
[0091]
2.实验结果
[0092]
表3 各化合物对pdgfrα、kit和ret酪氨酸激酶活性的抑制效果
[0093][0094]
备注:*代表与lenvatinib组相对比p<0.05
[0095]
生物活性数据表明:本发明化合物对pdgfrα、kit和ret酪氨酸激酶活性具有抑制作用,且化合物1、2、3、5抑制pdgfrα的生物活性优于阳性对照药lenvatinib,化合物1、2、3、4、5、6抑制kit的生物活性优于阳性对照药lenvatinib,化合物1、2、3、4抑制ret的生物活性
优于阳性对照药lenvatinib。
[0096]
综上,本发明提供了式i所示化合物或其药学上可接受的盐。试验结果表明其靶向作用于血管内皮生长因子(vegf)受体vegfr1、vegfr2、vegfr3、纤维母细胞生长因子受体fgfr1、fgfr 2、fgfr 3、fgfr 4、血小板衍生生长因子受体α(pdgfrα)、kit和ret,并对以上酪氨酸激酶(rtks)均有显著的活性抑制作用。本发明提供的化合物在制备多靶点酪氨酸激酶抑制剂,以及制备预防和/或治疗与酪氨酸激酶(vegfr1~3、fgfr1~4、pdgfrα、kit和ret)过表达相关的肿瘤(肝癌、非小细胞肺癌、甲状腺癌等)的药物中具有广阔的应用前景。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。