1.本发明属于基因工程技术领域,具体涉及一种高产木聚糖酶的里氏木霉菌株及其应用。
技术背景
2.木聚糖(xylan)是植物半纤维素的主要成分,约占植物干重的三分之一。是除纤维素之外自然界中最为丰富的多糖,也是自然界中最为丰富的可再生资源之一。β-1,4-糖苷键连接β-d-吡喃木糖残基构成了木聚糖的主链,其侧链取代基多种多样。自然界中的木聚糖存在于植物细胞壁中,结构复杂,且大部分为异质多糖。木聚糖的降解主要依赖于木聚糖酶酶解,由木聚糖的复杂性和多样性可知木聚糖酶是一系列降解木聚糖的酶的组合,而不是单一的酶。目前研究最多的木聚糖酶来自微生物中的真菌和细菌,真菌只能生产碱性木聚糖酶,细菌则既能生产碱性木聚糖酶又能生产酸性木聚糖酶。木聚糖酶随机切开木聚糖的主链,得到低聚木糖、木糖和阿拉伯糖降解产物。
3.木聚糖酶在食品、饲料以及造纸领域都有着广泛的应用。木聚糖酶作为饲料添加剂应用在动物饲料中能够对粗纤维进行降解,从而促进动物对饲料中营养物质的吸收;木聚糖酶在纸浆漂白过程中协同其他酶能够减少化学试剂的添加,改善漂白品质和造纸工业对环境的破坏;木聚糖酶对秸秆、玉米芯等农业废弃物进行降解生成可溶性戊糖来生产低聚木糖、乙醇等产品实现生物质资源再生;木聚糖酶可作为面粉面团、面包烘焙以及馒头改良剂应用在面制品中。
4.另外,木聚糖酶的水解产物——低聚木糖是一种功能性低聚糖,是利用内切木聚糖酶水解木聚糖的β-1,4糖苷键而得到的以木二糖、木三糖、木四糖、木五糖为主要成分的混合物。它在促进双歧杆菌等肠道益生菌增殖、降低血清胆固醇、调节血糖、促进肠道中钙的吸收和改善便秘等方面都有明显著效果。利用木聚糖酶进行酶法生产低聚木糖的过程反应比较温和,且酶具有专一性,产物中低聚木糖的纯度较高,是目前生产低聚木糖的最常用的方法。孙军涛等人的研究结果表明,在超声温度为60 ℃,超声功率为300 w,木聚糖酶与纤维素酶按照3:2的比例组成复合酶,复合酶的添加量为1 %,酶解时间为20 min,料液比为1:15(g/ml)的条件下,制备的酶解液中可溶性总糖的含量为75.01 mg/g,还原糖含量为43.61 mg/g,产物的平均聚合度为1.72。唐艳斌等报道,大豆秸秆碱性预处理液中加入嗜热踝节菌木聚糖酶,在实验条件为底物浓度1.0 %,酶添加量30 u/ml,温度60℃,时间240 min时低聚木糖得率能达到24.2%。刘国峰等研究结果显示,中性细菌木聚糖酶具有显著提高啤酒产品中功能性低聚糖的作用,并且在酶解温度为50℃,木聚糖酶添加量为110 u/g时,低聚木糖的得率最高,为0.621 g/l。
5.目前木聚糖酶的生产成本普遍偏高,严重限制了木聚糖酶在低聚木糖生产中的广泛应用,因此如何提高木聚糖酶的产量是当前本领域的一个研究重点。
技术实现要素:
6.本发明为解决现有技术问题,提供了一株高产木聚糖酶的里氏木霉及其应用。申请人首先将来源于斜卧青霉(penicillium decumbens)的木聚糖酶基因在里氏木霉宿主中过表达,构建得到重组表达菌株;然后以该菌株为出发菌进行紫外诱变,筛选获得一株能大幅度提高木聚糖酶表达量的突变菌。该突变菌株可以广泛应用于木聚糖酶的生产,有利于降低该酶的生产成本。
7.本发明一方面提供了一种里氏木霉工程菌,其携带有重组表达木聚糖酶基因的表达载体。
8.所述木聚糖酶的氨基酸序列为seq id no:1,其编码核苷酸序列为seq id no:2。
9.本发明一方面提供了一种里氏木霉突变菌株,是以上述里氏木霉工程菌为出发菌,通过紫外诱变方法获得的。
10.所述突变菌株命名为里氏木霉mq20(trichoderma reesei mq20),已于2021年7月21日保藏于中国武汉 武汉大学的中国典型培养物保藏中心,保藏编号为cctcc no:m2021920。
11.本发明还提供了上述里氏木霉突变菌株在木聚糖酶生产中的应用。
12.本发明将来源于斜卧青霉(penicillium decumbens)的木聚糖酶基因在里氏木霉(trichoderma reesei)宿主中过表达,构建得到的重组表达菌株里氏木霉mq1,30l罐发酵160h后,木聚糖酶酶活达到7610u/ml。
13.以里氏木霉mq1为出发菌,通过紫外诱变方法筛选获得的突变菌株里氏木霉mq20,30l罐发酵160h后,木聚糖酶酶活高达到16429u/ml,比出发菌里氏木霉mq1提高了116%,取得了意料不到的技术效果。所述里氏木霉突变菌株可广泛应用于木聚糖酶的生产,从而有利于降低木聚糖酶的生产成本,促进其广泛应用于低聚木糖生产领域。
附图说明
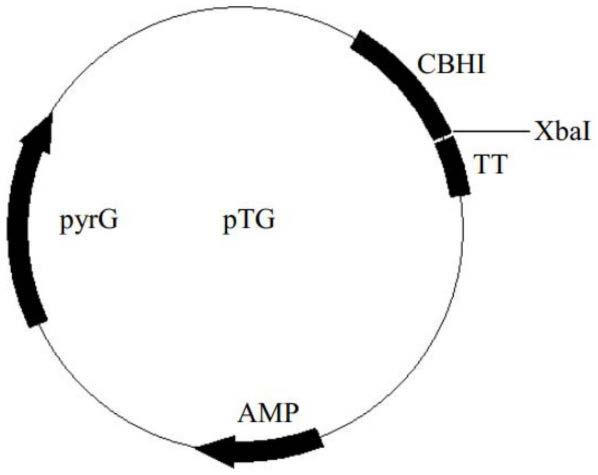
14.图1为质粒ptg图谱;图2为30l罐发酵曲线图。
具体实施方式
15.本发明用到了遗传工程和分子生物学领域使用的常规技术和方法,例如molecular cloning: a laboratory manual, 3nd ed. (sambrook, 2001)和current protocols in molecular biology (ausubel, 2003)中所记载的方法。这些一般性参考文献提供了本领域技术人员已知的定义和方法。但是,本领域的技术人员可以在本发明所记载的技术方案的基础上,采用本领域其它常规的方法、实验方案和试剂,而不限于本发明具体实施例的限定。
16.下面结合具体实施方式对本发明进行详细描述。
17.实施例1 木聚糖酶基因的克隆及重组载体的构建申请人将来源于斜卧青霉(penicillium decumbens)的木聚糖酶基因根据里氏木霉密码子偏好性进行密码子优化,在第1个氨基酸密码子前增加6个碱基tctaga(xba i酶切位点),在其终止密码子taa后增加tctaga(xba i酶切位点),优化后的核苷酸序列由上海捷
瑞生物工程公司合成。所述木聚糖酶的氨基酸序列为seqidno:1,其编码核苷酸序列为seqidno:2。
18.pcr扩增上述木聚糖酶基因。引物序列如下:引物1(f):gctctagaatggttcatctgtctgccacc;引物2(r):gctctagattacaagcactgagagtacca。
19.pcr反应条件为:94℃变性5min;然后94℃变性30s,56℃复性30s,72℃延伸70s,30个循环后,72℃保温10min。琼脂糖凝胶电泳结果显示,木聚糖酶基因为大小1233bp的片段。
20.将上述获得的木聚糖酶基因片段与表达载体ptg分别进行限制性内切酶xbai单酶切,酶切条件如下:pcr片段酶切体系(50ul)质粒ptg酶切体系(50ul)pcr片段 20ulptg质粒 20ul10*m 5ul10*m 5ulbsa 5ulbsa 5ulxbai 2ulxbai 2ulddh2o 18ulddh2o 18ul37℃水浴酶切处理2h,电泳后分别回收两个目的片段,溶于20ulddh2o。用t4dna连接酶进行连接,连接体系如下:pcr片段2ulptg2ul10*buffer1ult4dnaligase1ulddh2o4ul总体积10ul22℃连接1h,转化大肠杆菌dh5a感受态细胞,涂布lb amp平板,37℃培养过夜后长出单菌落。通过菌落pcr验证连接正确的转化子,提取质粒送测序,测序正确后,即得到含有木聚糖酶基因的重组载体ptg-mq。
21.实施例2木聚糖酶重组表达菌株的构建1、原生质体制备:接种宿主菌里氏木霉4q于pda u(马铃薯200g/l,煮沸20-30min后过滤除渣;葡萄糖2%;uridine1%;琼脂粉1.5%)平板,30℃培养5-7d;割取2cm
×
2cm大小的菌块,接种100ml液体pda u(马铃薯200g/l,煮沸20-30min后过滤除渣;葡萄糖2%;uridine1%)培养基中,30℃培养16h生长菌丝体用于转化;将长好的菌丝体过滤后,用20ml1.2m硫酸镁溶液重悬;加入0.2g溶菌酶,30℃、100rpm培养2-3h;将裂解好的菌丝用2层擦镜纸过滤,3000rpm离心10min获得原生质体;将裂解好的菌丝用擦镜纸过滤,离心获得原生质体;再用适量的山梨醇溶液重悬。
22.2、转化:将上述获得的里氏木霉4q原生质体用1.2m山梨醇溶液清洗2遍,再用适量的山梨醇溶液重悬,使原生质体浓度达到108个/ml;每200ul原生质体中分别加入10ul准备好的重组载体ptg-mq,加入50ul25%的peg6000,冰浴20min,再加入2ml25%的peg6000,室温放
置5min;加入4ml山梨醇溶液颠倒混匀,倒入50ml转化上层培养基后,倾倒入4个转化下层平板中,待上层培养基凝固后,于30℃培养箱中倒置培养5d。
23.3、转化子筛选:培养5d后,挑取长出的菌落,点种到转化下层平板进行复筛,30℃培养3d。将正常生长的转化子分别接种到新鲜的pda平板,30℃培养5-7d。每个转化子割取2cm
×
2cm大小的菌块,分别接种50ml液体摇瓶培养基(葡萄糖1%;乳糖2%;玉米浆1.5%;硫酸铵0.9%;硫酸镁0.15%;柠檬酸0.073%;氯化钙0.1125%;微量元素0.1%)中发酵,28℃培养5d。培养5d后,离心菌体获得上清液即为粗酶液,进行sds-page蛋白电泳检测及木聚糖酶酶活力检测。
24.(1)、木聚糖酶酶活单位的定义在37℃、ph值为5.5的条件下,每分钟从浓度为5mg/ml的木聚糖溶液中释放1μmol还原糖所需要的酶量即为一个酶活力单位u。
25.(2)、测定方法取2ml浓度为1%的木聚糖底物(ph5.5乙酸-乙酸钠缓冲液配制),加入到比色管中,37℃平衡10min,再加入2ml经ph5.5乙酸-乙酸钠缓冲液适当稀释并经37℃平衡好的酸性木聚糖酶酶液,混匀于37℃精确保温反应30min。反应结束后,加入5mldns试剂,混匀以终止反应。然后沸水浴煮沸5min,用自来水冷却至室温,加蒸馏水定容至25ml,混匀后,以标准空白样为空白对照,在540nm处测定吸光值ae。
26.酶活计算公式:xd=。
27.式中:xd为稀释酶液中木聚糖酶的活力,u/ml;ae为酶反应液的吸光度;ab为酶空白液的吸光度;k为标准曲线的斜率;c0为标准曲线的截距;m为木糖的摩尔质量,150.2g/mol;t为酶解反应时间,min;n为酶液稀释倍数;1000为转化因子,1mmol=1000μmol。
28.检测结果显示,上述构建得到的阳性转化子发酵上清液中木聚糖酶活力最高达356u/ml。申请人将该发酵酶活最高的阳性转化子命名为里氏木霉mq1(trichodermareeseimq1)。
29.实施例3诱变筛选紫外诱变导致的突变随机性很强,突变产生的效果也是随机的,难以预测。因此,为了获得有效的正突变,技术人员通常需要进行多轮紫外诱变,筛选的工作量较大,而且存在无法获得有效正突变的可能性。但因为紫外诱变所需设备简单、费用少,并且可在短时间内获得大量突变体,因此,它现在仍是一种常用的诱变选育方法。
30.申请人以里氏木霉mq1为出发菌株,通过紫外诱变方法对其进行遗传学改造,进一步提高其木聚糖酶的产量。
31.1、确定致死率:接种出发菌里氏木霉mq1于pda平板,30℃培养5-7d。待菌落表面产生大量孢子时,吸取5ml无菌水洗脱,获得孢子液,离心后用无菌水重悬,用血球计数板计数。取一个90mm培养皿,加入5ml稀释好的孢子悬液(浓度为1
×
107个/ml),加入转子并在磁力搅拌器上搅拌使孢子液处于均匀状态。在无菌超净工作台中,用功率为9w的紫外灯于垂直距离20cm的上方照射,分别照射30s、45s、60s、75s、90s、105s、120s,取照射后的孢子液稀释10、100、1000
倍,取100ul涂布pda平板,30℃培养2-3d后计数,以未照射的孢子液为对照,计算致死率。其中照射90s时,致死率为95%,选取该照射时间进行后续诱变实验。
32.2、第一轮诱变筛选:取一个90mm培养皿,加入5ml稀释好的孢子悬液(浓度为1
×
107个/ml),加入转子并在磁力搅拌器上搅拌使孢子液处于均匀状态。在无菌超净工作台中,用功率为9w的紫外灯于垂直距离20cm的上方照射,照射90s后稀释1000倍,取100ul涂布pda平板,30℃培养2-3d。
33.共涂布300块pda平板,30℃培养2-3d后,每个平板长出30-50个菌落。先通过菌落形态,筛选出短分枝的突变体。挑取菌落形态较小、菌丝致密、菌落周围绒毛较短的突变体共89个,分别接种到pda平板,30℃培养5-7d。每个转化子割取2cm
×
2cm大小的菌块,分别接种50ml液体摇瓶培养基中发酵,28℃培养5d。培养5d后,离心菌体获得上清液,分别进行蛋白电泳检测及木聚糖酶酶活力检测,同时以出发菌mq1作为对照组。
34.结果显示,第一轮紫外诱变筛选获得的89株突变菌中,没有一株突变菌发酵上清液中木聚糖酶酶活高于出发菌;其中,85株突变菌的酶活与出发菌基本相当,其余4株突变菌的酶活甚至低于出发菌。
35.申请人按照上述方法继续进行了26轮诱变筛选,最终获得一株木聚糖酶产量显著高于出发菌的突变菌株,命名为里氏木霉mq20(trichodermareeseimq20)。该突变菌株摇瓶发酵上清液中木聚糖酶酶活力达到697u/ml,比出发菌提高了96%,取得了意料不到的技术效果。
36.实施例430l罐发酵放大将出发菌里氏木霉mq1和突变菌里氏木霉mq20分别在30升发酵罐中进行发酵,发酵使用的培养基配方为:葡萄糖10g/l、乳糖20g/l、硫酸铵9g/l、氯化钙1.125g/l、硫酸镁1.5g/l、柠檬酸0.73g/l、磷酸二氢钾20g/l、磷酸氢二铵4g/l、玉米浆15ml/l、消泡剂0.05%。补料培养基:液糖浓度为400g/l,ph调至4.0-5.0之间。
37.发酵生产工艺:ph值4.0、温度30℃、搅拌速率300-700rpm、通风量1.0-1.5(v/v)、溶氧控制在20%以上。
38.整个发酵过程分为三个阶段:第一阶段为菌体培养阶段,按7%比例接入种子,30℃培养15-25h,以溶氧回升为标志;第二阶段为饥饿阶段,当底糖耗完之后,不流加任何碳源,溶氧上升至60%以上表明该阶段结束,为期约30-120min;第三阶段为产酶阶段,流加补料培养基进行产酶培养,期间保持溶氧在20%以上且维持发酵液中还原糖浓度不低于1g/l,发酵周期在140-170h之间。发酵结束后,发酵液通过板框过滤机处理后获得粗酶液。
39.通过测定不同时间发酵液中木聚糖酶的酶活力,可得发酵进程曲线(图2)。
40.结果显示:发酵160h后,出发菌里氏木霉mq1发酵上清液中木聚糖酶的酶活力达到7610u/ml,而突变菌里氏木霉mq20的酶活力达到16429u/ml,较出发菌提高了116%,取得了意料不到的技术效果。
41.申请人已于2021年7月21日将所述突变菌里氏木霉mq20(trichodermareeseimq20)保藏于中国武汉武汉大学的中国典型培养物保藏中心,其保藏号为cctccno:m2021920。
42.实施例5木聚糖酶在低聚木糖生产中的应用
以玉米芯蒸煮液为反应底物,加入里氏木霉mq20发酵上清液进行酶解。通过高效液相检测酶解产物中低聚木糖的含量来评价木聚糖酶的应用效果。
43.分别取5支试管,每支加入10ml玉米芯蒸煮液,按木聚糖酶酶活计算加量,使反应体系中最终的木聚糖酶酶活分别为0、5、10、20、30u,混匀后55℃水浴锅中反应8h。煮沸灭活酶后,进行高效液相检测。
44.仪器:waters 2695;检测器:示差检测器;色谱柱:钙基柱;柱温:90℃;流动相:水;流速:0.3ml/min。
45.分别计算单糖、木二糖-木七糖的峰面积,求和计算出总糖的峰面积。每个糖的含量等于该糖的峰面积除以总糖的峰面积。结果如下表所示。编号12345加酶量(u/ml)00.5123单糖含量(%)43.9934.0421.6220.1220.60木二糖含量(%)13.1016.2020.2125.3433.41木二糖-木四糖含量(%)46.3457.1752.9460.1666.01木二糖-木七糖含量(%)46.3457.1778.3879.8879.40
46.从表中的数据可以看出,添加本发明所述里氏木霉mq20发酵上清液后,木二糖含量提高了23.7%-155.0%;木二糖-木四糖总含量和木二糖-木七糖总含量分别提高了23.4%-42.4%和23.4%-71.3%。从而说明,本发明提供的突变菌里氏木霉mq20发酵产木聚糖酶可广泛应用于低聚木糖生产,效果显著。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。