1.本发明属于药物合成技术领域,具体涉及一种伊布替尼的制备方法。
背景技术:
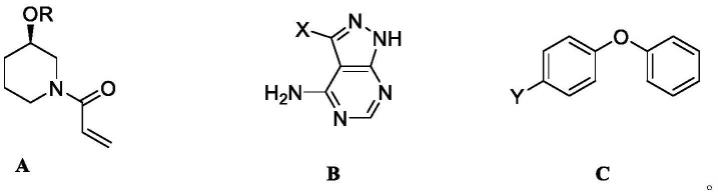
2.伊布替尼(ibrutinib)又称依鲁替尼,化学名为:1-[3(r)-[4-氨基-3-(4-苯氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基]-1-哌啶基]-2-丙烯-1-酮,由美国pharmacyclics公司和强生公司合作研发的一种口服的重量级的布鲁顿酪氨酸激酶(btk)抑制剂类抗癌新药,该药通过与靶蛋白btk活性位点半胱氨酸残基选择性地共价结合不可逆性地抑制btk,从而有效地阻止肿瘤从细胞迁移到适应于肿瘤生长环境的淋巴组织。伊布替尼自上市以来,已先后被fda授予了4个突破性药物认定,具有广阔的研究和开发前景,化学结构式如下:
[0003][0004]
伊布替尼因其良好的临床表现,引起了药学和有机合成工作者对其合成方法开发的极大关注,根据伊布替尼本身的化学结构,人们对其进行逆合成分析,其结构由3个片段组成,分别为哌啶环片段a、吡唑并嘧啶胺片段b和二苯甲醚片段c:
[0005][0006]
现有工艺片段a和b的c-n键连接主要通过mitsunobu反应或sn2取代反应实现,现有技术主要报道的方法有两种:
[0007]
方法一:通过mitsunobu反应实现的,如刘美霞.依鲁替尼的合成,结构改造及生物活性评价[d].山东大学,及中国专利申请cn105859728b、cn103121999、专利wo2017163257都报道了中间体iv与化合物11即(s)-2-(羟甲基)哌-1-甲酸叔丁酯在催化剂三苯基膦、偶氮二甲酸二异丙酯下发生mitsunobu反应得化合物x,但由于反应使用了大量偶氮二甲酸二异丙酯(diad),导致反应中产生大量副产物,后处理过程需要去除很多杂质,因此不是一个原子经济、绿色环保的工艺路线:
[0008][0009]
方法二:通过sn2反应实现,中国专利申请cn105820168及国际申请wo2016132383、wo2016151438等相继报道将手性原料与甲基磺酰氯反应得到含离去性官能团的化合物11,11与卤素取代的吡唑并嘧啶杂环化合物10通过在碱性条件下的取代反应制备中间体12,12经多步反应制得伊布替尼,从而避免了mitsunobu反应。但是sn2取代反应手性中心的控制较mitsunobu反应要差,不利于终产物的手性纯度控制:
[0010][0011]
片段b和c之间c-c键的构建可通过金属催化的偶联反应实现,如美国专利us2008108636以杂环化合物4为起始原料,与n-碘代丁二酰亚胺发生碘代反应得到化合物10,10在过渡金属催化剂催化下与对甲氧基苯硼酸iii发生suzuki偶联反应得到关键中间体iv,合成路线如下:
[0012][0013]
中国专利申请cn105859728利用4-溴苯甲醚制得含硅化合物15,15与化合物ii通过paterson偶联反应制备关键中间体iv:
[0014][0015]
以上c-c键的构建反应存在问题是:1)用到了贵金属催化剂,增加了生产成本;2)金属催化的偶联反应实现反应条件苛刻,收率低。
[0016]
综上,现已报道的伊布替尼的制备方法主要存在以下问题:
[0017]
1、mitsunobu反应的产品收率不高(《80%),需要当量的三苯基膦,产生当量难除去的三苯氧磷;
[0018]
2、mitsunobu反应自身对亲核试剂的酸度有要求,基本上pka《=15,小于11是最理想的选择;
[0019]
3、片段b和c之间c-c键的金属催化的偶联反应用到了贵金属催化剂,增加了生产成本,且容易有钯金属的残留。
[0020]
综上,目前针对伊布替尼的制备方法在工艺安全、操作繁琐,收率不高,生产成本较高等方面存在许多不足,因此,研究寻找一条反应条件温和,操作过程简便,产品收率高、纯度高,生产成本低的适合工业化生产的反应路线仍是目前需要解决的问题。
技术实现要素:
[0021]
为了解决现有技术中伊布替尼合成过程mitsunobu反应的产品收率不高,对亲核试剂的酸度有要求,及suzuki偶联反应需要贵金属催化剂的问题,本发明提供了一种新的伊布替尼制备方法;该方法避免了suzuki反应需要贵金属催化剂,同时mitsunobu采用新的催化剂无副产物的生成,反应收率高,周期短,适用条件更广泛,操作生产更安全。
[0022]
本发明的具体技术方案如下:
[0023][0024]
一种伊布替尼的制备方法,具体包括以下步骤:
[0025]
化合物iv的制备
[0026]
所述化合物iv的制备方法具体包括如下步骤:室温下将化合物ii、化合物iii、碱、催化剂a加至有机溶液a中,加热搅拌至反应结束得化合物iv。
[0027]
优选地,所述碱选自碳酸钾、碳酸铯、碳酸氢钠、叔丁醇钾、氢化钠中的一种,其中特别优选碳酸钾。
[0028]
优选地,所述催化剂a为胺类催化剂,选自2-甲基-n1,n
3-二-邻甲苯基苯-1,3-二胺、3-甲基二苯胺、2-甲基苯胺、2,6-二氨基甲苯中的一种,其中特别优选2-甲基-n1,n
3-二-邻甲苯基苯-1,3-二胺。
[0029]
优选地,所述化合物ii、化合物iii、碱、催化剂的投料摩尔比为1:1.0~1.8:2.5~3.5:0.02~0.1,其中特别优选1:1.2:3.0:0.05。
[0030]
优选地,所述有机溶剂a选自二甲苯,甲苯、二甲亚砜、n-甲基吡咯烷酮中的一种或其组合。
[0031]
优选地,所述反应温度为100℃~130℃。
[0032]
在一优选方案中,反应结束后需要进行后处理,具体操作为:检测反应结束后蒸除有机溶剂,加入纯化水和二氯甲烷打浆、过滤、干燥即得化合物iv。
[0033]
化合物i的制备
[0034]
所述化合物i制备具体包括如下步骤:将化合物iv、化合物v和催化剂b加入有机溶剂b中,控温回流反应,反应结束后得伊布替尼。
[0035]
优选地,所述催化剂b为膦氧化物,选自(2-甲氧基苄基)二苯基氧化膦、(2-羟基苄基)二苯基氧化膦、(2-羟基苯基)二苯基氧化膦中的一种,其中特别优选的(2-甲氧基苄基)二苯基氧化膦。
[0036]
优选地,所述化合物iv、化合物v、催化剂b的投料摩尔比为1:1.0~1.8:0.08~
0.20,其中特别优选1:1.2:0.1。
[0037]
优选地,所述有机溶剂b选自二甲苯、甲苯、n,n-二甲基甲酰胺、二甲基亚砜中的一种或其组合。
[0038]
在一优选方案中,反应结束后需要进行后处理,具体操作为:检测反应结束后,蒸除有机溶剂,-5℃下加入丙酮-正庚烷中重结晶即得化合物i。
[0039]
本发明的有益效果:
[0040]
1.本发明提供了一种制备伊布替尼的新方法,该工艺以胺类催化剂替代贵金属钯催化suzuki偶联反应,解决了传统此类反应收率不高、催化剂昂贵的问题;
[0041]
2.本发明的的制备工艺,以膦氧化物为催化剂催化mitsunobu反应,避开mitsunobu反应使用当量三苯基膦,解决了该反应自身对亲核试剂的酸度有要求的苛刻条件,操作简便,所得目标产品纯度高。
具体实施方式
[0042]
下面通过实施例来进一步说明本发明,应该正确理解的是:本发明的实施例仅仅是用于说明本发明,而不是对本发明的限制,所以,在本发明的方法前提下对本发明的简单改进均属于本发明要求保护的范围。
[0043]
对本发明所得产物结构进行表征:
[0044]
本发明采用hplc测定中间体化合物iv及伊布替尼的纯度,色谱条件如下:
[0045]
色谱柱:phenomenex kinetex c
18
(150mm
×
4.6mm,5μm);
[0046]
流动相:水-乙腈(体积比1:1);
[0047]
检测波长:260nm;
[0048]
流速:1.0ml
·
min-1
;
[0049]
柱温:30℃;
[0050]
进样量:20μl
[0051]
化合物iv的核磁表征:
[0052]1h nmr(400mhz,dmso-d6):δ13.58(s,1h),8.22(s,1h),7.67(d,j=8.8hz,2h),7.43(t,j=8.0hz,2h),7.20-7.11(m,5h).
13
c nmr(100mhz,dmso-d6)::δ158.11,157.04,156.33,155.82,143.99,130.17,128.48,123.82,119.05,96.95.
[0053]
伊布替尼的结构确证如下:
[0054]
hr-esi-ms(m/z):441.2015[m h]
;1h-nmr(400mz,dmso-d6):δ8.26(s,1h),7.64(d,j=8.0hz,2h),7.44(t,j=7.5hz,2h),7.19-7.09(m,5h),6.85(t,j=13.2,0.5h),6.69(t,j=15.6hz,0.5h),6.16-6.06(m,1h),5.70(d,j=10.2hz,0.5h),5.59(d,j=9.6hz,0.5h),4.79-4.71(m,1h),4.56(d,j=10.8hz,1h),4.19(brs,1h),4.06(d,j=13.2hz,0.5h),3.71(t,j=10.8hz,0.5h),3.26-3.19(m,1h),3.04(t,j=12.0hz,0.5h),2.30-2.23(m,1h),2.15-2.13(m,1h),1.95-1.92(m,1h),1.66-1.54(m,1h);
13
c nmr(100mhz,dmso-d6):δ164.6,157.5,156.1,152.7,144.7,130.1,128.3,127.5,127.2,127.0,126.1,123.9,119.0,115.8,97.1,53.0,52.4,49.2,45.7,45.1,41.5,29.5,29.27,24.7,23.1.
[0055]
伊布替尼手性检测方法
[0056]
色谱柱:ad-h柱(4.6mm
×
250mm,5μm);
[0057]
流动相:正己烷-乙醇(35:65);
[0058]
检测波长:258nm;
[0059]
流速0.5ml/min;
[0060]
柱温35℃;
[0061]
保留时间:化合物i:20.92min,(s)-型:28.29min
[0062]
以下各实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。
[0063]
化合物iv的制备
[0064]
实施例1
[0065]
向200ml单口瓶中,加入化合物ii(2.14g,10mmol),4-苯氧基苯硼酸(2.57g,12mmol),2-甲基-n1,n
3-二-邻甲苯基苯-1,3-二胺(15mg,0.05mmol),碳酸钾(3.85g,30mmol)和对二甲苯(80ml),110℃搅拌反应,检测反应结束后减压除去溶剂,向反应中加入30ml纯化水和80ml二氯甲烷打浆,过滤,固体真空干燥得中间体v,收率98.5%,hplc纯度99.98%。
[0066]
实施例2
[0067]
向200ml单口瓶中,加入化合物ii(2.14g,10mmol),4-苯氧基苯硼酸(2.14g,10mmol),3-甲基二苯胺(9.87mg,0.05mmol),碳酸钾(3.46g,25mmol)和对二甲苯(80ml),110℃搅拌反应,检测反应结束后减压除去溶剂,向反应中加入30ml纯化水和80ml二氯甲烷打浆,过滤,固体真空干燥得中间体v,收率94.1%,hplc纯度99.62%。
[0068]
实施例3
[0069]
向200ml单口瓶中,加入化合物ii(2.14g,10mmol),4-苯氧基苯硼酸(3.85g,18mmol),2-甲基苯胺(5.36mg,0.05mmol),碳酸钾(4.84g,35mmol)和对二甲苯(80ml),110℃搅拌反应,检测反应结束后减压除去溶剂,向反应中加入30ml纯化水和80ml二氯甲烷打浆,过滤,固体真空干燥得中间体v,收率93.6%,hplc纯度99.56%。
[0070]
实施例4
[0071]
向200ml单口瓶中,加入化合物ii(2.14g,10mmol),4-苯氧基苯硼酸(4.30g,20mmol),2,6-二氨基甲苯(6.11mg,0.05mmol),碳酸钾(5.11g,37mmol)和对二甲苯(80ml),110℃搅拌反应,检测反应结束后减压除去溶剂,向反应中加入30ml纯化水和80ml二氯甲烷打浆,过滤,固体真空干燥得中间体v,收率88.7%,hplc纯度98.86%。
[0072]
实施例5
[0073]
向200ml单口瓶中,加入化合物ii(2.14g,10mmol),4-苯氧基苯硼酸(2.57g,12mmol),2-甲基-n1,n
3-二-邻甲苯基苯-1,3-二胺(6.05mg,0.02mmol),碳酸铯(9.77g,30mmol)和间二甲苯(80ml),100℃搅拌反应,检测反应结束后减压除去溶剂,向反应中加入30ml纯化水和80ml二氯甲烷打浆,过滤,固体真空干燥得中间体v,收率93.3%,hplc纯度99.60%。
[0074]
实施例6
[0075]
向200ml单口瓶中,加入化合物ii(2.14g,10mmol),4-苯氧基苯硼酸(2.57g,12mmol),2-甲基-n1,n
3-二-邻甲苯基苯-1,3-二胺(30.24mg,0.1mmol),碳酸氢钠(2.52g,30mmol)和二甲亚砜(80ml),130℃搅拌反应,检测反应结束后减压除去溶剂,向反应中加入30ml纯化水和80ml二氯甲烷打浆,过滤,固体真空干燥得中间体v,收率94.2%,hplc纯度
99.52%。
[0076]
实施例7
[0077]
向200ml单口瓶中,加入化合物ii(2.14g,10mmol),4-苯氧基苯硼酸(2.57g,12mmol),2-甲基-n1,n
3-二-邻甲苯基苯-1,3-二胺(3.02mg,0.01mmol),叔丁醇钾(3.37g,30mmol)和甲苯(80ml),95℃搅拌反应,检测反应结束后减压除去溶剂,向反应中加入30ml纯化水和80ml二氯甲烷打浆,过滤,固体真空干燥得中间体v,收率88.2%,hplc纯度98.92%。
[0078]
实施例8
[0079]
向200ml单口瓶中,加入化合物ii(2.14g,10mmol),4-苯氧基苯硼酸(2.57g,12mmol),2-甲基-n1,n
3-二-邻甲苯基苯-1,3-二胺(36.26mg,0.12mmol),氢化钠(0.72g,30mmol)和n-甲基吡咯烷酮(80ml),135℃搅拌反应,检测反应结束后减压除去溶剂,向反应中加入30ml纯化水和80ml二氯甲烷打浆,过滤,固体真空干燥得中间体v,收率86.6%,hplc纯度98.63%。
[0080]
实施例9
[0081]
向单口瓶中加入化合物iv(3.03g,10mmol),化合物v(1.86g,12mmol),(2-羟基苄基)二苯基氧化膦(0.31g,1.0mmol),80ml对二甲苯中,控温回流反应,tlc检测反应完毕后,蒸除有机溶剂,所得固体于-5℃经异丙醇-正庚烷(2:3,体积比)60ml重结晶、干燥得伊布替尼收率97.3%,hlpc纯度99.88%,ee值99.97%。
[0082]
实施例10
[0083]
向单口瓶中加入化合物iv(3.03g,10mmol),化合物v(1.55g,10mmol),(2-羟基苄基)二苯基氧化膦(0.31g,1.0mmol),80ml间二甲苯中,控温回流反应,tlc检测反应完毕后,蒸除有机溶剂,所得固体于-5℃经异丙醇-正庚烷(2:3,体积比)60ml重结晶、干燥得伊布替尼收率93.2%,hlpc纯度99.62%,ee值99.84%。
[0084]
实施例11
[0085]
向单口瓶中加入化合物iv(3.03g,10mmol),化合物v(2.79g,18mmol),(2-羟基苯基)二苯基氧化膦(0.29g,1.0mmol),80ml邻二甲苯中,控温回流反应,tlc检测反应完毕后,蒸除有机溶剂,所得固体于-5℃经异丙醇-正庚烷(2:3,体积比)60ml重结晶、干燥得伊布替尼收率94.3%,hlpc纯度99.51%,ee值99.75%。
[0086]
实施例12
[0087]
向单口瓶中加入化合物iv(3.03g,10mmol),化合物v(1.86g,12mmol),(2-羟基苄基)二苯基氧化膦(0.25g,0.8mmol),80ml甲苯中,控温回流反应,tlc检测反应完毕后,蒸除有机溶剂,所得固体于-5℃经异丙醇-正庚烷(2:3,体积比)60ml重结晶、干燥得伊布替尼收率94.5%,hlpc纯度99.66%,ee值99.89%。
[0088]
实施例13
[0089]
向单口瓶中加入化合物iv(3.03g,10mmol),化合物v(1.86g,12mmol),(2-羟基苄基)二苯基氧化膦(0.62g,2.0mmol),80mln,n-二甲基甲酰胺中,控温回流反应,tlc检测反应完毕后,蒸除有机溶剂,所得固体于-5℃经异丙醇-正庚烷(2:3,体积比)60ml重结晶、干燥得伊布替尼收率93.2%,hlpc纯度99.45%,ee值99.66%。
[0090]
实施例14
[0091]
向单口瓶中加入化合物iv(3.03g,10mmol),化合物v(1.86g,12mmol),(2-羟基苄基)二苯基氧化膦(0.18g,0.6mmol),80ml甲苯中,控温回流反应,tlc检测反应完毕后,蒸除有机溶剂,所得固体于-5℃经异丙醇-正庚烷(2:3,体积比)60ml重结晶、干燥得伊布替尼收率88.5%,hlpc纯度98.85%,ee值97.66%。
[0092]
实施例15
[0093]
向单口瓶中加入化合物iv(3.03g,10mmol),化合物v(3.1g,20mmol),(2-羟基苄基)二苯基氧化膦(0.92g,3.0mmol),80ml二甲基亚砜中,控温回流反应,tlc检测反应完毕后,蒸除有机溶剂,所得固体于-5℃经异丙醇-正庚烷(2:3,体积比)60ml重结晶、干燥得伊布替尼收率82.3%,hlpc纯度97.44%,ee值96.35%。
[0094]
对比实施例
[0095]
称取3-溴-1h-吡唑并[3,4-d]嘧啶-4胺,4-苯氧基苯硼酸(1.5g,7.01mmol),pd(pph3)4(540mg,0.47mmol),k3po4·
3h2o(2.49g,9.34mmol),加入250m1两颈瓶中,加入50ml溶剂(1,4-二氧六环:水=4:1)溶解,超声除去溶液中的氧气,用氮气置换装置中的空气,135℃加热回流,反应30h后,tlc检测,反应基本完全。将反应液冷却至室温,用硅藻土过滤,减压蒸除滤液,得黄色固体,硅胶柱层析(二氯甲烷:甲醇二100:1),得化合物3-(4-苯氧基苯基)-1h-吡唑并[3,4-d]嘧啶-4-胺,白色固体,产率72.3%,hplc纯度97.32%。
[0096]
称取化合物3-(4-苯氧基苯基)-1h-吡唑并[3,4-d]嘧啶-4-胺(0.5g,1.65mmo1)置于100m1茄形瓶中,加入pph3(1.3g,4.95mmo1),(s)-1-boc-3-羟基派咤(0.5g,2.47mmo1),冰浴下搅拌l0 min,再滴加diad(1.0g,4.95mmo1),至溶液澄清后,tlc检测,反应完全,蒸除溶剂,硅胶柱层析(二氯甲烷:甲醇=300:1-100:1),(r)-3-(4-氨基-3-(4-苯氧基苯基)-1h-吡唑并[3,4-d]嘧啶-1-基)哌啶-1-羧酸叔丁酯,白色固体,产率47.5%,hplc纯度97.22%,ee值96.25%。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
