1.本发明涉及生物工程领域,特别是一种合成苯丙醇衍生物的方法。
背景技术:
2.苯丙醇及其衍生物是医药、食品、饲料、化妆品等多个领域产品的重要原料,以苯丙醇为例,天然存在于草莓、茶叶、桂叶油等物质中。在食品工业中苯丙醇是被允许使用的食品用香料;在化妆品行业中,可作为防腐剂进行添加;在医药领域,苯丙醇是中枢骨胳肌松弛剂强盘松的中间体。
3.苯丙醇及其衍生物拥有诸多的功效、应用,但目前获取的方式仍然局限于肉桂酸乙酯、桂醇等原料通过加氢等反应进行生产,该过程工艺复杂、能耗过高,不符合当今环保、绿色生产的理念,市场需要一种通过生物工程技术领域的方法,利用简单的工艺及较低的能耗得到苯丙醇及其衍生物,本发明解决这样的问题。
技术实现要素:
4.为解决现有技术的不足,本发明的目的在于提供一种合成苯丙醇衍生物的方法,合成技术简单,能耗低,得到的苯丙醇衍生物纯度高。
5.为了实现上述目标,本发明采用如下的技术方案:
6.一种合成苯丙醇衍生物的方法,包括:如下步骤:
7.步骤一,提取酶基因,构建工程菌:
8.提取羧酸还原酶、乙醇脱氢酶、烯键还原酶的基因,经过聚合酶链式反应扩增后,制备重组表达质粒,将重组表达质粒导入大肠杆菌中进行培养,获得重组表达的工程菌;
9.步骤二,培养工程菌,筛选有效表达的菌种,并保存菌种:
10.将重组大肠杆菌加入培养基中培养,得重组大肠杆菌的种子液;将重组大肠杆菌的种子液进行扩大培养、发酵,得到转化后溶液;检测其中目的酶类的含量,筛选酶类表达含量较高的菌种;将筛选到的菌种利用无菌水制成高浓度的菌悬液,取菌种保藏保护剂放入菌悬液中充分混匀,冻存,得到备用种子液;
11.步骤三,利用重组大肠杆菌将3,4-二羟基肉桂酸转化为3,4-二羟基苯丙醇:
12.将腺嘌呤核苷三磷酸、还原型烟酰胺腺嘌呤二核苷酸磷酸、黄素单核苷酸以质量比为1:(1-2):(1-12):(1-3)的比例溶解形成溶液,将溶液添加到步骤二得到的备用种子液中进行生物转化,最终得到粗产物;调节粗产物的ph值为5-8,并经过搅拌、抽滤、洗涤、干燥后得到纯化的
[0013][0014]
r1包括:-ch3、-oh、-h或-och3;
[0015]
r2包括:-ch3、-oh、-h或-och3;
[0016]
r3包括:-ch3、-oh、-h或-och3。
[0017]
前述的一种合成苯丙醇衍生物的方法,提取羧酸还原酶的基因的来源包括:mycobacterium marinum的hxw97-rs16665,序列为seq01,或mycobacterium paraintracellulare的ocq-rs16610,序列为seq02;所述提取乙醇脱氢酶的基因的来源包括:saccharomyces cerevisiae的adh1,序列为seq03,或fusarium subglutinans的fsubg-7421,序列为seq04;所述提取烯键还原酶的基因的来源包括:tarenaya hassleriana的loc104820880,序列为seq05,或camelina sativa的loc1047699854,序列为seq06。
[0018]
前述的一种合成苯丙醇衍生物的方法,步骤一种聚合酶链式反应扩增的pcr反应体系包括:10
×
pcr buffer 20ul,dntp 16ul,正向引物6ul,反向引物6ul,taq dna聚合酶10ul,dd h2o 140ul,模板dna0.1-2ug;扩增程序及条件:为94℃预变性3min;随后35个循环,94℃变性30s,55℃退火30s,72℃延伸30s;最后72℃延伸5min。
[0019]
前述的一种合成苯丙醇衍生物的方法,正向引物包括:hxw97-rs16665的正向引物的序列为seq07,ocq-rs16610的正向引物的序列为seq08,adh1的正向引物的序列为seq09,fsubg-7421的正向引物的序列为seq10,loc104820880的正向引物的序列为seq11,loc1047699854的正向引物的序列为seq12;
[0020]
反向引物包括:hxw97-rs16665的反向引物的序列为seq13,ocq-rs16610的反向引物的序列为seq14,adh1的反向引物的序列为seq15,fsubg-7421的反向引物的序列为seq16,loc104820880的反向引物的序列为seq17,loc1047699854的反向引物的序列为seq18。
[0021]
前述的一种利用固定化酶合成苯丙醇衍生物的方法,步骤一中制备重组表达质粒的具体方法是:采用限制性内切酶nde i/xho i双酶切体系针对基因及质粒载体pet-28a( )的酶切位点进行酶切处理,并使用t4连接酶在18℃条件下连接过夜,获得重组表达质粒。
[0022]
前述的一种利用固定化酶合成苯丙醇衍生物的方法,步骤一中获得重组表达的工程菌的具体方法是:取由cacl2处理过的感受态大肠杆菌菌悬液,加入重组质粒溶液,再加入培养基,使细菌恢复正常生长状态;将培养后的菌液涂布于筛选平板上,待菌液完全被培养基吸收后倒置培养皿,继续培养;从筛选平板上挑取新活化的单个菌落,接种于培养基中培养,直至对数生长后期;将该菌悬液接种于培养基中培养至od600=0.5。
[0023]
前述的一种利用固定化酶合成苯丙醇衍生物的方法,步骤二中检测目的酶类的含量的方法是:羧酸还原酶的检测方法为利用紫外分光光度计检测转化后溶液在340nm下的吸光度;乙醇脱氢酶的检测方法为利用紫外分光光度计检测转化后溶液在340nm下的吸光度;烯键还原酶的检测方法为利用紫外分光光度计检测转化后溶液在340nm下的吸光度。
[0024]
前述的一种利用固定化酶合成苯丙醇衍生物的方法,包括:3,4-二羟基肉桂酸、2-羟基-4-甲氧基肉桂酸或2-羟基-3,4-二甲氧基肉桂酸。
[0025]
前述的一种利用固定化酶合成苯丙醇衍生物的方法,包括:3,4-二羟基苯丙醇、2-羟基-4-甲氧基苯丙醇、2-羟基-3,4-二甲氧基苯丙醇。
[0026]
本发明的有益之处在于:
[0027]
本发明的方法相比常规合成技术工艺,操作简单、能耗低;
[0028]
本发明通过制成基因工程菌合成苯丙醇衍生物得到的苯丙醇衍生物纯度高。
附图说明
[0029]
图1是本发明羧酸还原酶检测中nadph的紫外吸收图谱;
[0030]
图2是本发明乙醇脱氢酶检测中nadh的紫外吸收图谱;
[0031]
图3是本发明烯键还原酶检测中nadh的紫外吸收图谱;
[0032]
图4是本发明实施例1的3,4-二羟基苯丙醇标准曲线;
[0033]
图5是本发明实施例2的2-羟基-4-甲氧基苯丙醇标准曲线;
[0034]
图6是本发明实施例3的2-羟基-3,4-二甲氧基苯丙醇标准曲线。
具体实施方式
[0035]
以下结合附图和具体实施例对本发明作具体的介绍。
[0036]
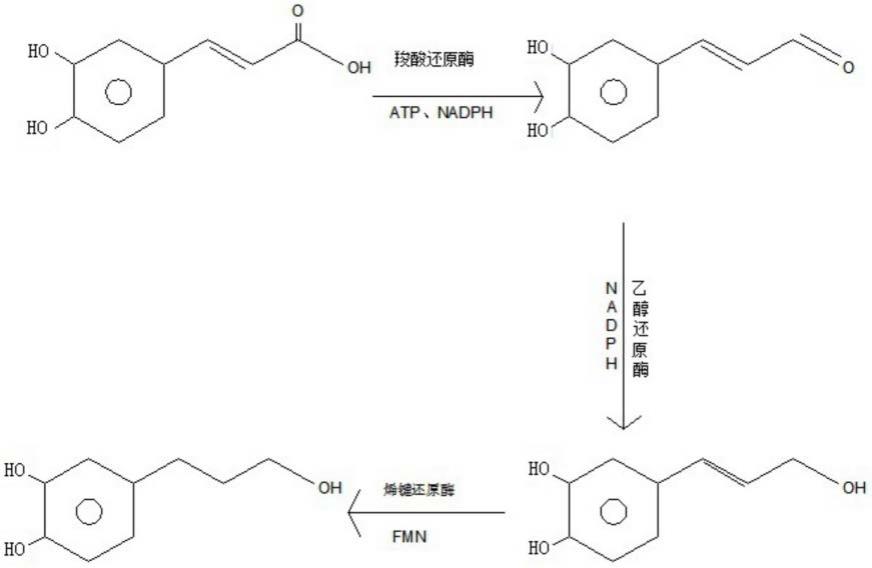
本发明的合成原理如下式所示:
[0037][0038]
r1包括-ch3、-oh、-h或-och3;
[0039]
r2包括-ch3、-oh、-h或-och3;
[0040]
r3包括-ch3、-oh、-h或-och3。
[0041]
实施例1:
[0042]
合成流程如下式所示:
[0043][0044]
具体包括如下步骤:
[0045]
1、提取酶基因,构建工程菌
[0046]
从mycobacterium marinum中提取羧酸还原酶基因hxw97-rs16665及其序列seq01、saccharomyces cerevisiae中提取乙醇脱氢酶基因adh1及其序列seq03、tarenaya hassleriana中提取烯键还原酶基因loc104820880及其序列seq05;对提取的基因进行聚合酶链式反应扩增;聚合酶链式反应扩增的pcr反应体系如表1所示;pcr仪设定的程序及条件:94℃预变性3min;随后35个循环,94℃变性30s,55℃退火30s,72℃延伸30s;最后72℃延伸5min;引物设计如表2所示。采用限制性内切酶nde i/xho i双酶切体系针对基因及质粒载体pet-28a( )的酶切位点进行酶切处理,并使用t4连接酶在18℃条件下连接过夜,获得重组表达质粒,获得具有三种目的基因的重组表达质粒;将重组表达质粒导入大肠杆菌中,进行重组菌种培养,取由cacl2处理过的感受态大肠杆菌菌悬液200ul,加入重组质粒溶液10ul,轻轻摇匀,冰上放置30分钟后,在37℃的水浴中热击45s-90s,热击后迅速置于冰上冷却3-5分钟。向管中加入1ml lb液体培养基,混匀后在37℃条件下振荡培养1小时,使细菌恢复正常生长状态。将培养的菌液摇匀后取100μl涂布于筛选平板上,正面向上放置半小时,待菌液完全被培养基吸收后倒置培养皿,37℃条件下培养16-24小时。从平板上挑取新活化的单个菌落,接种于3-5ml lb液体培养基中,37℃下振荡培养12小时左右,直至对数生长后期。将该菌悬液以1:100的比例接种于100ml lb液体培养基中,37℃振荡培养2-3小时至od600=0.5左右。获得重组表达的工程菌。
[0047]
表1
[0048][0049]
表2
[0050][0051]
2、培养工程菌,筛选有效表达的菌种
[0052]
将重组大肠杆菌加入lb培养基中,在ph为6-8范围内,温度范围为20-37℃、转速为100-200rpm条件下培养24小时,得重组大肠杆菌的种子液;将重组大肠杆菌的种子液接种到m9培养基中进行扩大培养、发酵;种子液和m9培养基的体积比为1:100,接种后,重组的大肠杆菌继续在上述条件中培养至菌液od
600
值达到0.6-0.8。在上述扩大培养重组大肠杆菌的情况下,检测其中目的酶类的含量,筛选酶类表达含量较高的菌种。
[0053]
羧酸还原酶检测:
[0054]
羧酸还原酶催化相应结构的转化的同时,会将还原型辅酶ⅱ(nadph)氧化为氧化型辅酶ⅱ(nadp ),nadp 没有吸收峰,而nadph在340nm处有一个吸收峰,因此利用紫外分光光度计检测转化后溶液的吸光度,可以检测羧酸还原酶酶活性,得到的nadph紫外吸收图谱如图1所示。
[0055]
在测定管中分别加入ph值为7.0的焦磷酸钠缓冲液1.5ml、27mmol/l的还原型辅酶ⅱ(nadph)1.0ml,11.5%的乙酸溶液0.5ml,混合后放入25℃的水浴中温育5min,之后加入0.1ml扩大培养菌种后的菌悬液,充分转化后,测定吸光度(对照组中利用蒸馏水代替乙酸)。
[0056]
乙醇脱氢酶检测:
[0057]
乙醇脱氢酶催化相应结构的转化的同时,会将氧化型辅酶ⅰ(nad )还原为还原型辅酶ⅰ(nadh),nad 没有吸收峰,而nadh在340nm处有一个吸收峰,因此利用紫外分光光度计检测转化后溶液的吸光度,可以检测乙醇脱氢酶酶活性,nadh紫外吸收图谱如图2所示。
[0058]
在测定管中分别加入ph值为8.8的焦磷酸钠缓冲液1.5ml、27mmol/l的氧化型辅酶ⅰ(nad )1.0ml,11.5%的乙醇溶液0.5ml,混合后放入25℃的水浴中温育5min,之后加入0.1ml扩大培养菌种后的菌悬液,充分转化后,测定吸光度(对照组中利用蒸馏水代替乙
醇)。
[0059]
烯键还原酶检测:
[0060]
烯键还原酶以终浓度为0.3mm的nadh、3.5mm的环己烯酮、50mm的tris-hcl(ph为7.5)的反应体系作为对照组,以终浓度为0.3mm的nadh、3.5mm的环己烯酮、50mm的tris-hcl(ph为7.5)及适量菌悬液的反应体系作为实验组,对比测量在340nm下的吸光度,检测烯键还原酶酶活性,nadh紫外吸收图谱如图3所示。
[0061]
3、菌种保存
[0062]
将步骤2中筛选到的菌种利用无菌水制成高浓度的菌悬液,取1-3ml灭菌甘油放入菌悬液中充分混匀,使得甘油的浓度约为10%-30%,置于-70℃的条件下冻存。
[0063]
4、利用重组大肠杆菌将3,4-二羟基肉桂酸转化为3,4-二羟基苯丙醇
[0064]
将3,4-二羟基肉桂酸、腺嘌呤核苷三磷酸、还原型烟酰胺腺嘌呤二核苷酸磷酸、黄素单核苷酸以质量比为1:(1-2):(1-12):(1-3)的比例溶解形成溶液,将所述的溶液添加到步骤2中得到的种子液中进行生物转化,最终得到3,4-二羟基苯丙醇粗产物。将粗产物离心,取上清液,分别过板框过滤器、微孔过滤器、超滤器;板框过滤器的目数为400目,微孔过滤器的孔径为0.5um,所述超滤器的截留分子量为10万。将过滤后的产物加入装有d101大孔树脂的层析柱进行吸附,用蒸馏水冲洗除杂,并吸干表面水分。后用乙醇水溶液作为流动相把产物洗脱出来,将层析得到的洗脱液置于旋转蒸发器中,将乙醇出去,得到纯化后的2-羟基-3,4-二甲氧基苯丙醇。
[0065]
大孔树脂预处理:将d101大孔树脂进行活化,浸泡在无水乙醇中搅拌除去气泡,静置24h,使用蒸馏水洗至树脂无乙醇味。用5%naoh溶液浸泡树脂4h,用蒸馏水洗至中性,再用5%hcl溶液浸泡4h,后用蒸馏水洗至中性,吸干水分备用。
[0066]
5、产品收率纯度检测、计算
[0067]
精密称定上述经纯化、干燥后的产物3,4-二羟基苯丙醇的重量,并以产品摩尔质量计算相应的摩尔数,按照产品收率公式:产品收率=((产物质量*含量)*产品相对分子质量)/(反应前关键组分的起始量*反应物相对分子质量)进行计算,得到产品收率约为71.55%。
[0068]
量取0.5ml的3,4-二羟基苯丙醇标准溶液,用无水乙醇稀释至25ml。用紫外分光光度计扫描其紫外图谱,选取252nm处为紫外吸收检测波长。精密称取3,4-二羟基苯丙醇标准溶液适量,加乙醇溶解,配成1.0mg/ml的贮备液,分别吸取该贮备液1、1.5、2.0、2.5、3.0ml于100ml量瓶中,加乙醇稀释至刻度,在252nm波长处测定吸收值,3,4-二羟基苯丙醇标准溶液浓度及吸光度检测数据如表3所示。
[0069]
表3
[0070][0071]
以浓度(c)对吸收值(a)进行线性回归,回归方程为:c(ug/ml)=0.0223
40.8903a,r=0.9997(n=5),如图4所示。
[0072]
量取上述纯化后的3,4-二羟基苯丙醇5mg,用无水乙醇稀释至100ml,混合均匀后,用微孔滤膜过滤,取滤液,将其分为5份,进行吸光度测定,3,4-二羟基苯丙醇吸光度测定及含量计算数据如表4所示。
[0073]
表4
[0074][0075]
由测定的结果来看,上述纯化后的3,4-二羟基苯丙醇的含量约为69.18%。
[0076]
实施例2:
[0077]
合成流程如下式所示:
[0078][0079]
1、提取酶基因,构建工程菌
[0080]
从mycobacterium paraintracellulare中提取羧酸还原酶基因ocq-rs16610及其序列seq02、fusarium subglutinans中提取乙醇脱氢酶基因fsubg-7421及其序列seq04、camelina sativa中提取烯键还原酶基因loc104769985及其序列seq06;对提取的基因进行聚合酶链式反应扩增;采用限制性内切酶nde i/xho i双酶切体系针对基因及质粒载体pet-28a( )的酶切位点进行酶切处理,并使用t4连接酶在18℃条件下连接过夜,获得重组
表达质粒,获得具有三种目的基因的重组表达质粒;将重组表达质粒导入大肠杆菌中,获得重组表达的工程菌。
[0081]
聚合酶链式反应扩增的pcr反应体系如表1所示;pcr仪设定的程序及条件:94℃预变性3min;随后35个循环,94℃变性30s,55℃退火30s,72℃延伸30s;最后72℃延伸5min;引物设计如表2所示。
[0082]
导入质粒的感受态大肠杆菌及重组菌种培养:
[0083]
取由cacl2处理过的感受态大肠杆菌菌悬液200ul,加入重组质粒溶液10ul,轻轻摇匀,冰上放置30分钟后,在37℃的水浴中热击45s-90s,热击后迅速置于冰上冷却3-5分钟。向管中加入1ml lb液体培养基,混匀后在37℃条件下振荡培养1小时,使细菌恢复正常生长状态。将培养的菌液摇匀后取100μl涂布于筛选平板上,正面向上放置半小时,待菌液完全被培养基吸收后倒置培养皿,37℃条件下培养16-24小时。
[0084]
从上述平板上挑取新活化的单个菌落,接种于3-5ml lb液体培养基中,37℃下振荡培养12小时左右,直至对数生长后期。将该菌悬液以1:100的比例接种于100ml lb液体培养基中,37℃振荡培养2-3小时至od600=0.5左右。
[0085]
2、培养工程菌,筛选有效表达的菌种
[0086]
将重组大肠杆菌加入lb培养基中,在ph为6-8范围内,温度范围为20-37℃、转速为100-200rpm条件下培养24小时,得重组大肠杆菌的种子液;将重组大肠杆菌的种子液接种到m9培养基中进行扩大培养、发酵;种子液和m9培养基的体积比为1:100,接种后,重组的大肠杆菌继续在上述条件中培养至菌液od
600
值达到0.6-0.8。在上述扩大培养重组大肠杆菌的情况下,检测其中目的酶类的含量,筛选酶类表达含量较高的菌种。
[0087]
羧酸还原酶检测:
[0088]
羧酸还原酶催化相应结构的转化的同时,会将还原型辅酶ⅱ(nadph)氧化为氧化型辅酶ⅱ(nadp ),nadp 没有吸收峰,而nadph在340nm处有一个吸收峰,因此利用紫外分光光度计检测转化后溶液的吸光度,可以检测羧酸还原酶酶活性。
[0089]
在测定管中分别加入ph值为7.0的焦磷酸钠缓冲液1.5ml、27mmol/l的还原型辅酶ⅱ(nadph)1.0ml,11.5%的乙酸溶液0.5ml,混合后放入25℃的水浴中温育5min,之后加入0.1ml扩大培养菌种后的菌悬液,充分转化后,测定吸光度(对照组中利用蒸馏水代替乙酸)。
[0090]
乙醇脱氢酶检测:
[0091]
乙醇脱氢酶催化相应结构的转化的同时,会将氧化型辅酶ⅰ(nad )还原为还原型辅酶ⅰ(nadh),nad 没有吸收峰,而nadh在340nm处有一个吸收峰,因此利用紫外分光光度计检测转化后溶液的吸光度,可以检测乙醇脱氢酶酶活性。
[0092]
在测定管中分别加入ph值为8.8的焦磷酸钠缓冲液1.5ml、27mmol/l的氧化型辅酶ⅰ(nad )1.0ml,11.5%的乙醇溶液0.5ml,混合后放入25℃的水浴中温育5min,之后加入0.1ml扩大培养菌种后的菌悬液,充分转化后,测定吸光度(对照组中利用蒸馏水代替乙醇)。
[0093]
烯键还原酶检测:
[0094]
烯键还原酶
[0095]
以终浓度为0.3mm的nadh、3.5mm的环己烯酮、50mm的tris-hcl(ph为7.5)的反应体
系作为对照组,以终浓度为0.3mm的nadh、3.5mm的环己烯酮、50mm的tris-hcl(ph为7.5)及适量菌悬液的反应体系作为实验组,对比测量在340nm下的吸光度,检测烯键还原酶酶活性。
[0096]
3、菌种保存
[0097]
将步骤2中筛选到的菌种利用无菌水制成高浓度的菌悬液,取1-3ml灭菌甘油放入菌悬液中充分混匀,使得甘油的浓度约为10%-30%,置于-70℃的条件下冻存。
[0098]
4、利用重组大肠杆菌将2-羟基-4-甲氧基肉桂酸转化为2-羟基-4-甲氧基苯丙醇
[0099]
将2-羟基-4-甲氧基肉桂酸、腺嘌呤核苷三磷酸、还原型烟酰胺腺嘌呤二核苷酸磷酸、黄素单核苷酸以质量比为1:(1-2):(1-12):(1-3)的比例溶解形成溶液,将所述的溶液添加到步骤2中得到的种子液中进行生物转化,最终得到2-羟基-4-甲氧基苯丙醇粗产物。-将粗产物离心,取上清液,分别过板框过滤器、微孔过滤器、超滤器;板框过滤器的目数为400目,微孔过滤器的孔径为0.5um,所述超滤器的截留分子量为10万。将过滤后的产物加入装有d101大孔树脂的层析柱进行吸附,用蒸馏水冲洗除杂,并吸干表面水分。后用乙醇水溶液作为流动相把产物洗脱出来,将层析得到的洗脱液置于旋转蒸发器中,将乙醇出去,得到纯化后的2-羟基-3,4-二甲氧基苯丙醇。
[0100]
大孔树脂预处理:将d101大孔树脂进行活化,浸泡在无水乙醇中搅拌除去气泡,静置24h,使用蒸馏水洗至树脂无乙醇味。用5%naoh溶液浸泡树脂4h,用蒸馏水洗至中性,再用5%hcl溶液浸泡4h,后用蒸馏水洗至中性,吸干水分备用。
[0101]
5、产品收率纯度检测、计算
[0102]
精密称定上述经纯化、干燥后的产物2-羟基-4-甲氧基苯丙醇的重量,并以产品摩尔质量计算相应的摩尔数,按照产品收率公式:产品收率=((产物质量*含量)*产品相对分子质量)/(反应前关键组分的起始量*反应物相对分子质量)进行计算,得到产品收率约为69.59%。
[0103]
量取0.5ml的2-羟基-4-甲氧基苯丙醇的重量标准溶液,用无水乙醇稀释至25ml。用紫外分光光度计扫描其紫外图谱,选取252nm处为紫外吸收检测波长。精密称取2-羟基-4-甲氧基苯丙醇的重量标准溶液适量,加乙醇溶解,配成1.0mg/ml的贮备液,分别吸取该贮备液1、1.5、2.0、2.5、3.0ml于100ml量瓶中,加乙醇稀释至刻度,在252nm波长处测定吸收值,2-羟基-4-甲氧基苯丙醇标准溶液浓度及吸光度检测数据如表5。
[0104]
表5
[0105][0106]
以浓度(c)对吸收值(a)进行线性回归,回归方程为:c(ug/ml)=0.0217 41.3089a,r=0.9999(n=5),2-羟基-4-甲氧基苯丙醇标准曲线如下图5所示。
[0107]
量取上述纯化后的2-羟基-4-甲氧基苯丙醇5mg,用无水乙醇稀释至100ml,混合均匀后,用微孔滤膜过滤,取滤液,将其分为5份,进行吸光度测定,2-羟基-4-甲氧基苯丙醇吸
光度测定及含量计算数据如表6所示。
[0108]
表6
[0109][0110]
由测定的结果来看,上述纯化后的3,4-二羟基苯丙醇的含量约为71.44%。
[0111]
实施例3:
[0112][0113]
1、提取酶基因,构建工程菌
[0114]
从mycobacterium marinum中提取羧酸还原酶基因hxw97-rs16665及其序列seq01、fusarium subglutinans中提取乙醇脱氢酶基因fsubg-7421及其序列seq04、tarenaya hassleriana中提取烯键还原酶基因loc104820880及其序列seq05;对提取的基因进行聚合酶链式反应扩增;采用限制性内切酶nde i/xho i双酶切体系针对基因及质粒载体pet-28a( )的酶切位点进行酶切处理,并使用t4连接酶在18℃条件下连接过夜,获得重组表达质粒,获得具有三种目的基因的重组表达质粒;将重组表达质粒导入大肠杆菌中,获得重组表达的工程菌。聚合酶链式反应扩增的pcr反应体系如表1所示;pcr仪设定的程序及条件:94℃预变性3min;随后35个循环,94℃变性30s,55℃退火30s,72℃延伸30s;最后72℃延伸5min;引物设计如表2所示。导入质粒的感受态大肠杆菌及重组菌种培养:
[0115]
取由cacl2处理过的感受态大肠杆菌菌悬液200ul,加入重组质粒溶液10ul,轻轻
摇匀,冰上放置30分钟后,在37℃的水浴中热击45s-90s,热击后迅速置于冰上冷却3-5分钟。向管中加入1ml lb液体培养基,混匀后在37℃条件下振荡培养1小时,使细菌恢复正常生长状态。将培养的菌液摇匀后取100μl涂布于筛选平板上,正面向上放置半小时,待菌液完全被培养基吸收后倒置培养皿,37℃条件下培养16-24小时。
[0116]
从上述平板上挑取新活化的单个菌落,接种于3-5ml lb液体培养基中,37℃下振荡培养12小时左右,直至对数生长后期。将该菌悬液以1:100的比例接种于100ml lb液体培养基中,37℃振荡培养2-3小时至od600=0.5左右。
[0117]
2、培养工程菌,筛选有效表达的菌种
[0118]
将重组大肠杆菌加入lb培养基中,在ph为6-8范围内,温度范围为20-37℃、转速为100-200rpm条件下培养24小时,得重组大肠杆菌的种子液;将重组大肠杆菌的种子液接种到m9培养基中进行扩大培养、发酵;种子液和m9培养基的体积比为1:100,接种后,重组的大肠杆菌继续在上述条件中培养至菌液od
600
值达到0.6-0.8。在上述扩大培养重组大肠杆菌的情况下,检测其中目的酶类的含量,筛选酶类表达含量较高的菌种。
[0119]
羧酸还原酶检测:
[0120]
羧酸还原酶催化相应结构的转化的同时,会将还原型辅酶ⅱ(nadph)氧化为氧化型辅酶ⅱ(nadp ),nadp 没有吸收峰,而nadph在340nm处有一个吸收峰,因此利用紫外分光光度计检测转化后溶液的吸光度,可以检测羧酸还原酶酶活性。
[0121]
在测定管中分别加入ph值为7.0的焦磷酸钠缓冲液1.5ml、27mmol/l的还原型辅酶ⅱ(nadph)1.0ml,11.5%的乙酸溶液0.5ml,混合后放入25℃的水浴中温育5min,之后加入0.1ml扩大培养菌种后的菌悬液,充分转化后,测定吸光度(对照组中利用蒸馏水代替乙酸)。
[0122]
乙醇脱氢酶检测:
[0123]
乙醇脱氢酶催化相应结构的转化的同时,会将氧化型辅酶ⅰ(nad )还原为还原型辅酶ⅰ(nadh),nad 没有吸收峰,而nadh在340nm处有一个吸收峰,因此利用紫外分光光度计检测转化后溶液的吸光度,可以检测乙醇脱氢酶酶活性。
[0124]
在测定管中分别加入ph值为8.8的焦磷酸钠缓冲液1.5ml、27mmol/l的氧化型辅酶ⅰ(nad )1.0ml,11.5%的乙醇溶液0.5ml,混合后放入25℃的水浴中温育5min,之后加入0.1ml扩大培养菌种后的菌悬液,充分转化后,测定吸光度(对照组中利用蒸馏水代替乙醇)。
[0125]
烯键还原酶检测:
[0126]
烯键还原酶
[0127]
以终浓度为0.3mm的nadh、3.5mm的环己烯酮、50mm的tris-hcl(ph为7.5)的反应体系作为对照组,以终浓度为0.3mm的nadh、3.5mm的环己烯酮、50mm的tris-hcl(ph为7.5)及适量菌悬液的反应体系作为实验组,对比测量在340nm下的吸光度,检测烯键还原酶酶活性。
[0128]
3、菌种保存
[0129]
将步骤2中筛选到的菌种利用无菌水制成高浓度的菌悬液,取1-3ml灭菌甘油放入菌悬液中充分混匀,使得甘油的浓度约为10%-30%,置于-70℃的条件下冻存。
[0130]
4、利用重组大肠杆菌将2-羟基-3,4-二甲氧基肉桂酸转化为2-羟基-3,4-二甲氧
基苯丙醇
[0131]
将2-羟基-3,4-二甲氧基肉桂酸、腺嘌呤核苷三磷酸、还原型烟酰胺腺嘌呤二核苷酸磷酸、黄素单核苷酸以质量比为1:(1-2):(1-12):(1-3)的比例溶解形成溶液,将所述的溶液添加到步骤2中得到的种子液中进行生物转化,最终得到2-羟基-3,4-二甲氧基苯丙醇粗产物。-将粗产物离心,取上清液,分别过板框过滤器、微孔过滤器、超滤器;板框过滤器的目数为400目,微孔过滤器的孔径为0.5um,所述超滤器的截留分子量为10万。将过滤后的产物加入装有d101大孔树脂的层析柱进行吸附,用蒸馏水冲洗除杂,并吸干表面水分。后用乙醇水溶液作为流动相把产物洗脱出来,将层析得到的洗脱液置于旋转蒸发器中,将乙醇出去,得到纯化后的2-羟基-3,4-二甲氧基苯丙醇。
[0132]
大孔树脂预处理:将d101大孔树脂进行活化,浸泡在无水乙醇中搅拌除去气泡,静置24h,使用蒸馏水洗至树脂无乙醇味。用5%naoh溶液浸泡树脂4h,用蒸馏水洗至中性,再用5%hcl溶液浸泡4h,后用蒸馏水洗至中性,吸干水分备用。
[0133]
5、产品收率纯度检测、计算
[0134]
精密称定上述经纯化、干燥后的产物2-羟基-3,4-二甲氧基苯丙醇的重量,并以产品摩尔质量计算相应的摩尔数,按照产品收率公式:产品收率=((产物质量*含量)*产品相对分子质量)/(反应前关键组分的起始量*反应物相对分子质量)进行计算,得到产品收率约为80.56%。
[0135]
量取0.5ml的2-羟基-3,4-二甲氧基苯丙醇标准溶液,用无水乙醇稀释至25ml。用紫外分光光度计扫描其紫外图谱,选取252nm处为紫外吸收检测波长。精密称取2-羟基-3,4-二甲氧基苯丙醇标准溶液适量,加乙醇溶解,配成1.0mg/ml的贮备液,分别吸取该贮备液1、1.5、2.0、2.5、3.0ml于100ml量瓶中,加乙醇稀释至刻度,在252nm波长处测定吸收值,2-羟基-3,4-二甲氧基苯丙醇标准溶液浓度及吸光度检测数据如表7。
[0136]
表7
[0137][0138][0139]
以浓度(c)对吸收值(a)进行线性回归,回归方程为:c(ug/ml)=0.0235 42.1023a,r=0.9998(n=5),2-羟基-3,4-二甲氧基苯丙醇标准曲线如图6所示。
[0140]
量取上述纯化后的2-羟基-3,4-二甲氧基苯丙醇5mg,用无水乙醇稀释至100ml,混合均匀后,用微孔滤膜过滤,取滤液,将其分为5份,进行吸光度测定,2-羟基-3,4-二甲氧基苯丙醇吸光度测定及含量计算数据如表8所示。
[0141]
表8
[0142][0143]
由测定的结果来看,上述纯化后的3,4-二羟基苯丙醇的含量约为91.98%。
[0144]
实验二:
[0145]
以实施例3的产物含量及得率对比实施例1及实施例2的产物含量及得率,发现实施例3的产物含量及得率远高于其它2项实施例。
[0146]
3项实施例的实验除相应酶类的基因组合及反应产物的不同外,均属于同一个实验条件,因此,补充实验以判断重组菌种中不同基因组合对苯丙醇衍生物转化的优选。
[0147]
以实施例3的基因组合为优选实验的重组菌种的基因组合,针对实施例1、2的实验进行优选。
[0148]
优选实验1仅针对实施例1的酶类组合进行修改,使用羧酸还原酶(ocq-rs16610)、乙醇脱氢酶(adh1)、烯键还原酶(loc104820880)的酶类组合将3,4-二羟基肉桂酸转化为3,4-二羟基苯丙醇,其余实验条件、步骤流程参考实施例1,得到的实验数据如下表9-10所示。
[0149]
表9优选实验1数据
[0150][0151]
表10优选实验1对比实施例1
[0152]
指标原实验优选实验羧酸还原酶基因hxw97-rs16665ocq-rs16610乙醇脱氢酶基因fsubg-7421adh1烯键还原酶基因loc104769985loc104820880产物纯度/含量69.18%79.68%产物得率71.55%82.78%
[0153]
优选实验2仅针对实施例2的酶类组合进行修改,使用羧酸还原酶(ocq-rs16610)、乙醇脱氢酶(adh1)、烯键还原酶(loc104820880)的酶类组合将将2-羟基-4-甲氧基肉桂酸转化为2-羟基-4-甲氧基苯丙醇,其余实验条件、步骤流程参考实施例1,得到的实验数据如下表11-12所示。
[0154]
表11优选实验2数据
[0155][0156]
表12优选实验2对比实施例2
[0157]
指标原实验优选实验羧酸还原酶基因ocq-rs16610ocq-rs16610乙醇脱氢酶基因fsubg-7421adh1烯键还原酶基因loc104769985loc104820880产物纯度/含量71.44%81.69%产物得率69.59%80.55%
[0158]
由以上的优选实验对比可知,当ocq-rs16610、adh1、loc104820880三种基因组合构建菌种时,具有协同作用,对重组菌种的生物发酵转化具有良好的促进作用。
[0159]
需要说明的是:本发明已经公开了基因工程菌的全部制备过程、条件、试剂内容,本领域技术人员根据本发明的说明书充分可以重复实现本发明的基因工程菌,所以无需保藏该菌种。
[0160]
以上显示和描述了本发明的基本原理、主要特征和优点。本行业的技术人员应该了解,上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。