1.本发明涉及癌症免疫治疗技术领域,特别涉及一种具有抗肿瘤活性的细胞及应用有该树突状细胞的抑制肿瘤生长的方法。
背景技术:
2.功能性宿主专业抗原呈递细胞(apc)已被证明在免疫反应中起到至关重要的作用。树突状细胞(dc)是高度专业化的专业apc,具有捕获、加工和呈递t细胞抗原的强大能力。然而,肿瘤细胞干扰宿主dc的成熟和功能。为了避免肿瘤介导的dc成熟和功能抑制,离体细胞因子刺激的dc已被有效地用于临床试验和鼠类癌症模型。有充足的证据证明可以通过使用离体抗原脉冲的dc或用肿瘤rna转染的dc来实现抗原特异性ctl反应。此外,使用细胞因子基因转导的肿瘤细胞和dc、肿瘤细胞与dc融合以及肿瘤内注射细胞因子修饰的dc的新型肿瘤抗原递送系统已被有效地用于诱导抗肿瘤免疫。有充足的证据证明通过离体刺激的dc递送肿瘤抗原在避免ctl耐受性方面优于纯化的肽。多种肿瘤抗原的疫苗接种可能优于单一表位的疫苗接种,并且这些免疫反应可以通过共同使用免疫增强细胞因子来增强。因此,科学界已经提出可以通过募集专业的宿主apc用于肿瘤抗原呈递以促进特异性t细胞活化来实现有效的抗癌免疫。
3.ccl19是在高内皮小静脉、脾脏和淋巴结的t细胞区表达的cc类趋化因子,它可以强烈吸引未成熟的t细胞和dc。因此,推测将ccl19递送至肿瘤部位可能是有益的,因为它将使t细胞和dc共定位,从而可能逆转肿瘤介导的免疫抑制并协调有效的细胞介导的免疫反应。ccl19吸引dc的能力是其他趋化因子共有的特性。但是,ccl19可能具有明显的优势,因为它具有在体内引发1型细胞因子应答的能力。除了其免疫治疗潜力外,趋化因子具有有效的血管抑制作用。的在先研究中已经证明,在已建立的肺癌的鼠模型中,瘤内给予的重组趋化因子引起有效的抗肿瘤反应。使用两个可移植的鼠类肺癌模型,已经证明趋化因子的抗肿瘤功效是t细胞依赖性的。趋化因子介导的抗肿瘤反应依赖于cd4和cd8淋巴细胞亚群,并伴有肿瘤的dc浸润。vicari等证实了在c26结肠癌模型中早期发现的结果,即使用趋化因子cdna转导的c26结肠癌细胞证明趋化因子转导的肿瘤细胞具有降低的致瘤性,这归因于免疫学和血管抑制机制。在最近直接支持这种趋化因子抗血管生成能力的研究中,arenberg等人报道了趋化因子在scid小鼠模型中抑制人肺癌的生长和血管生成。dubinett等人进一步报道了表达趋化因子ccl21的树突细胞(dc)在动物模型的抗肿瘤效应(us20160058837a1)。
技术实现要素:
4.为了克服上述现有技术的缺陷,本发明所要解决的技术问题是:提供一种具有抗肿瘤活性的新型树突状细胞及应用有该树突状细胞的抑制肿瘤生长的方法。
5.为了解决上述技术问题,本发明提供一种具有抗肿瘤活性的细胞,所述细胞与肿瘤细胞同系,并经表达载体所转导以表达ccl19或表达具有与ccl19相似生物活性结构和/
或生物学功能且具有至少60%以上同源性序列的肽。
6.进一步提供一种抑制肿瘤生长的方法,包括将前述细胞以肿瘤内给药、淋巴结给药或全身给药。
7.本发明的有益效果在于:本发明所提供的细胞(树突状细胞)在小鼠肺癌模型表现出优秀的抗肿瘤活性。经过三周的施用,小鼠体内肿瘤被彻底根除。同时,在治疗过程中,检测到cd4 ,cd8 和cd3 cxcr3 t细胞以及表达cd11c dec205 的dc增加,治疗后浸润肿瘤的cd4 cd25 t调节细胞明显减少,同时也被观察到肿瘤部位的细胞浸润伴随着粒细胞巨噬细胞集落刺激因子,ifn-γ,mig/cxcl9,ip-10/cxcl10和白介素12的增加,但转化生长因子β和前列腺素e2的免疫抑制因子在减少。并且在治疗后的肿瘤部位中显示出分泌ifn-γ的肿瘤特异性t淋巴细胞的频率增加,以及诱导了肿瘤保护性免疫。
附图说明
8.图1所示为本发明在具体实施方式中不同测试条件下抗肿瘤反应的折线图;
9.图2所示为本发明在具体实施方式中不同测试条件下注射侧肿瘤生长的折线图;
10.图3所示为本发明在具体实施方式中不同测试条件下注射对侧肿瘤生长的折线图;
11.图4所示为本发明在具体实施方式中不同测试条件下增强肿瘤部位t细胞亚群和树突状细胞(dc)的频率的柱形图;
12.图5所示为本发明在具体实施方式中不同测试条件下ⅰ型细胞因子表达量的柱状图;
13.图6所示为本发明在具体实施方式中不同测试条件下免疫抑制分子表达量的柱状图;
14.图7所示为本发明在具体实施方式中不同测试条件下诱导特异性t细胞应答的柱状图;
15.图8所示为本发明在具体实施方式中不同测试条件下抑制肿瘤生长的折线图;
16.图9所示为本发明在具体实施方式中不同测试条件下相关细胞因子表达量的柱状图。
17.图10所示为本发明在具体实施方式中插入有ccl19 cdna片段的慢病毒载体质粒图谱。
具体实施方式
18.为详细说明本发明的技术内容、所实现目的及效果,以下结合实施方式并配合附图予以说明。
19.一种具有抗肿瘤活性的细胞,所述细胞与肿瘤细胞同系,并经表达载体所转导以表达ccl19或表达具有与ccl19相似生物活性结构和/或生物学功能且具有至少60%以上同源性序列的肽。
20.其中,所述同系指所述细胞与肿瘤细胞具有相同的遗传背景,并且不发生免疫排斥反应,即所述细胞来源于具有该肿瘤细胞的哺乳动物。所述细胞可以为免疫细胞和/或apc细胞,即在一种实施方式中,所述细胞可以为免疫细胞、或apc细胞、或免疫细胞和apc细
胞的集群。优选地,所述细胞为apc细胞,更优选为树突状细胞。所述树突状细胞优选来源于哺乳动物的骨髓,即通过在所述哺乳动物的骨髓中分选获得所述树突状细胞。其中,所述哺乳动物可以为人、小鼠等,优选为人。
21.所述细胞通过在瘤内表达有效量的肽以抑制肿瘤的生长。所述ccl19根据具体的施用对象的不同进行特异性选择并表达。当施用对象为人时,所述ccl19的蛋白序列如seq id:np_006265.1(ncbi参考序列)。当施用对象为小鼠时,ccl19的蛋白序列如seq id:nm_011888.2(ncbi参考序列)。当然,其余具有与ccl19相似的生物活性结构和/或生物学功能且具有至少60%以上同源性序列的肽均能实现本技术所期望的抑制肿瘤生长的效果。示例性地,所述肽具有与ccl19至少60%以上的同源性,如60%、70%、80%、90%、95%等。
22.所述肿瘤细胞为自发性癌细胞,优选为肺癌细胞。
23.所述肽在由所述肿瘤细胞聚集的肿瘤部位内表达。即在一种实施方式中,通过将所述细胞以瘤内给药的方式接种在肿瘤部位中,以实现所述肽在肿瘤部位内表达,以在肿瘤部位中吸引成熟的宿主树突状细胞和活化的t细胞的同时,使细胞(apc细胞)具有原位肿瘤抗原摄取和呈递,即通过自体肿瘤提供在肿瘤部位施用细胞进入原位可用抗原的全部库的能力,从而增加反应可能性的同时,降低由于表型调节引起的肿瘤抵抗的可能性。
24.具体的,所述抗肿瘤活性为在所述肿瘤部位内招募cd11c dec205 树突状细胞和cd4 t细胞、cd8 t细胞和cd3 cxcr3 t细胞,并在所述肿瘤部位引发ⅰ型细胞因子应答。同时经过验证,当人为阻断ip-10/cxcl10,mig/cxcl9或ifn-γ后,树突状细胞的抗肿瘤功效显著降低,即表明所述抗肿瘤活性对是ifn-γ,mig/cxcl9和ip-10/cxcl10所依赖的。
25.所述表达载体优选为慢病毒载体,更优选为复制缺陷型慢病毒载体,如pcdh(addgene公司)。当然,所述表达载体也可以为其他病毒载体类型,如腺病毒载体、腺相关病毒载体等,即可实现本技术所期望的ccl19或具有与ccl19相似生物活性结构和/或生物学功能且具有至少60%以上同源性序列的肽的编码序列转染至所述细胞中并实现其高效、稳定表达的载体,均适用于本技术。
26.一种抑制肿瘤生长的方法,包括将前述细胞以肿瘤内给药、淋巴结给药或全身给药。其中,所述淋巴结优选为腋窝淋巴结区域,即通过将所述细胞注射进腋窝淋巴结区域以利用ccl19或具有与ccl19相似生物活性结构和/或生物学功能且具有至少60%以上同源性序列的肽在dc共定位到淋巴结的t细胞区域,以引发系统性的抗肿瘤反应。虽然淋巴结给药或全身给药相较于肿瘤内给药更容易实现,但是肿瘤内给药表现出更为优异的抗肿瘤疗效。
27.其中,具有所述肿瘤的施用对象为哺乳动物,如人、小鼠等,优选为人。
28.实施例
29.材料与方法
30.老鼠。
31.6~8周龄的c57bl6雌性小鼠获自集萃药康,并由厦门大学对实验室动物护理认可的动物研究设施进行评估和鉴定。机构动物研究委员会批准了所有实验。
32.细胞培养。
33.在这些研究中使用了鼠系肺部肿瘤llc。在rpmi 1640(irvine scientific,santa anna,ca)中补充了10%胎牛血清(gemini bioproducts,calabasas,ca),青霉素(100单位/
ml),链霉素(0.1mg/ml)和2ml谷氨酰胺(jrh biosciences,lenexa,ks),并保持在37℃的潮湿空气中,空气中含5%co2。细胞系不含支原体,在从液氮中解冻冷冻原细胞之前,将细胞使用至第十代。从小鼠皮肤建立成纤维细胞培养物。将皮肤切成小块,用胰蛋白酶消化1小时,用pbs洗涤3次,然后涂在dmem和ham's f11的1:1混合物中,其中含有牛胰岛素(10μg/ml),15mm hepes缓冲液(life technologies,inc.,gaithersburg,md),人转铁蛋白(25μg/ml),人高密度脂蛋白(20μg/ml),人血小板衍生生长因子(1单位/ml)和小鼠表皮生长因子(100ng/ml;西格玛,密苏里州圣路易斯)。用胰蛋白酶消化单层细胞以获得用于病毒转导的单细胞悬液。
34.肿瘤发生实验。
35.皮下注射llc肿瘤细胞(5
×
105)。在小鼠的右肩上区域中,每周监测3次肿瘤体积。已建立肿瘤的小鼠通过每周一次的肿瘤内注射106dc进行治疗,持续3周。所有治疗均每周一次进行肿瘤内给药,持续3周,治疗组包括dc-ccl19,dc,dc-cv,慢病毒ccl19(106个噬斑形成单位;pfu),cv和成纤维细胞-ccl19。用卡尺测量每个肿瘤的两等分直径。使用公式v=0.4ab2计算体积,其中“a”为较大直径,“b”为较小直径。通过完全排斥肿瘤对治疗产生反应的小鼠在第31天接受皮下注射。在左肩上区域注射5
×
105l1c2细胞。
36.为了评估dc-ccl19介导的全身性抗肿瘤反应,小鼠在右侧(5
×
105格)和左侧(2
×
104格)皮下接种了llc细胞。所有治疗均每周一次在肿瘤右侧腹腔内给药,持续3周,治疗组包括慢病毒-ccl19(106pfu),成纤维细胞-ccl19和dc-ccl19。
37.体内细胞因子中和。
38.为了确定ifn-γ,mig/cxcl9和ip-10/cxcl10在dc-ccl19介导的抗肿瘤应答中的重要性,进行体内中和实验。皮下注射llc肿瘤细胞(5
×
105)。在小鼠的右肩上区域注射。每周一次瘤内注射dc-ccl19治疗五天的肿瘤,持续3周。治疗前24小时,然后每周3次,经腹腔注射小鼠。在持续时间内以1毫升/剂量的抗ip-10/cxcl10或抗mig/cxcl9或100μg/剂量的纯化的单克隆抗ifn-γ或适当对照抗体(山羊igg和大鼠igg)的等效剂量服用实验的每周评估三次肿瘤体积。
39.表达ccl19的慢病毒载体的制备。
40.慢病毒构建体(ccl19)是一种复制缺陷型慢病毒载体(pcdh),编码鼠的ccl19 cdna由鼠脾脏原组织提取rna反转录合成,进而将ccl19 cdna片段插入慢病毒载体质粒克隆位点(见图10),并由巨细胞病毒启动子增强子驱动。通过转染293t细胞,将ccl19 cdna的穿梭质粒和包含完整复制因子的补充质粒基因表达序列随机整合到293t细胞基因组合序列中,从而使其长期稳定制备高表达带有产生ccl19的慢病毒,同时也建立只含对照载体不包含ccl19 cdna插入片段的293t细胞株为对照组使用。由于基因整合后的293t细胞能持续将表达ccl19的慢病毒释放出来,通过elisa和病毒滴度检测得出293t基因整合细胞的培养液中的ccl19因子和慢病毒浓度含量。
41.骨髓来源dc的分离和繁殖。
42.从骨髓细胞中分离dc,并与鼠粒细胞巨噬细胞集落刺激因子(gm-csf;20ng/ml)和il-4(20ng/ml))体外培养13天。流式细胞仪分析后,发现超过90%的该dc细胞高表达cd80,cd86,cd-11c dec205 ,mhc ii和mhc i。
43.用慢病毒载体感染dc和成纤维细胞。
44.为了优化ccl19产生的感染效率,在细胞培养的第12天,用前述的慢病毒-ccl19以如下不同moi值感染细胞:10:1、20:1,50:1和100:1。通过ccl19特异性elisa测定感染的dc或成纤维细胞上清液中的ccl19蛋白浓度。从第1天到第17天体外评估感染的dc或成纤维细胞上清液中的ccl19蛋白浓度。在培养中,转导的dc和成纤维细胞产生ccl19长达17天。对于体内实验,将第12天dc或成纤维细胞以1
×
107细胞/ml的浓度重悬于含有10%胎牛血清的rpmi 1640中,并以100:1的moi值感染浓度用慢病毒-ccl19感染4~6h。感染的dc和成纤维细胞产生7~10ng/(ml
×
106细胞
×
24h)的ccl19。
45.流式细胞仪。
46.接种肿瘤后第12天,在流式细胞仪上进行t细胞和dc标记的流式细胞仪分析。收获非坏死的肿瘤,在rpmi 1640中切成小块,并通过100微米的筛子分选。通过37℃下在含有胶原酶iv的rpmi 1640培养液中搅拌消化肿瘤组织30分钟来分离肿瘤免疫细胞。使用带有16针平端针头的10毫升注射器进一步破碎组织。细胞悬浮液通过一次性塑料过滤器(fisher,宾夕法尼亚州匹兹堡)过滤,从组织基质中分离出游离淋巴细胞。将细胞以2000rpm离心10分钟,并将细胞沉淀洗涤两次以去除胶原酶。另外,使用不连续的percoll(sigma)梯度密度离心纯化白细胞,在4℃下以1500rpm离心20分钟后,收集35~60%界面上的细胞。将收集的细胞在pbs中洗涤两次并染色以进行流式细胞术评估。percoll纯化后,白细胞在细胞群中的百分比约为》95%。通过fsc,ssc散射图进行选择,可以将细胞识别为淋巴细胞或dc。cd11c dc被定义为肿瘤结节内的亮种群。对于染色,使用两种或三种荧光染料(phycoerythrin,fitc和percp)对来自肿瘤结节的单细胞悬液中的cd3,cd4和cd8 t淋巴细胞群或cd11c dc进行分析。对t细胞进行了cd3和cxcr3细胞表面标记的双重染色。对于t调节细胞的定量,对t细胞进行cd4和cd25细胞表面标记的双重染色。
47.elisa检测肿瘤结节和脾脏中的细胞因子。
48.确定肿瘤和脾脏中的细胞因子。如上所述,接种肿瘤后第12天,收获非坏死肿瘤,切成小块,均质化,并通过筛子分选。收获脾脏,将其磨碎,去除红细胞。通过elisa评估评估il-12,gm-csf,ifn-γ,tgf-β,mig/cxcl9和ip-10/cxcl10的产生。通过酶标反应测定pge2浓度,结果以pg/mg的总蛋白表示。ccl19,gm-csf,ifn-γtgf-β,mig/cxl9和ip-10/cxcl10 elisa的灵敏度为15pg/ml。对于il-12,灵敏度为5pg/ml。通过tgf-βelisa测定了tgf-β1。
49.ifn-γelispot。
50.进行ifn-γ酶联免疫斑点测定以确定响应于照射的肿瘤的脾细胞产生ifn-γ的浓度。接种肿瘤后第12天,收集脾脏,压碎后去除rbc,通过10μm滤膜(millipore,minneapolis,mn)过滤,并与辐照后的特异性llc细胞系或非特异性肿瘤细胞wehi共孵育。以10:1(脾脏细胞:肿瘤细胞)比例孵育24小时。在辐照器中,对llc或wehi肿瘤细胞的单细胞悬液(106个细胞/ml)进行80gyγ辐照。用免疫斑点图像分析仪对elispot进行定量。
51.统计分析。
52.每个实验使用6~8只小鼠。所有实验至少重复三遍。使用kruskal-wallis单次方差分析对数据进行统计分析,然后根据dunn的方法进行成对比较。表示在p《0.05水平上的显著性。
53.结果与分析
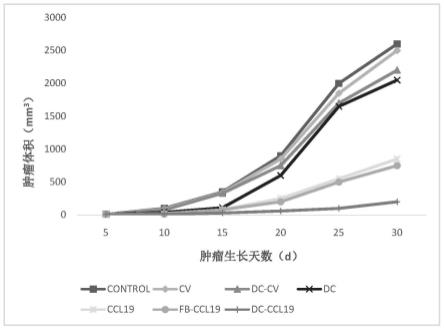
54.参见图1所示,在已建立的llc肿瘤的小鼠中评估了dc-ccl19的抗肿瘤功效。肿瘤
植入后五天,每周对小鼠进行瘤内治疗,治疗时间为三周。图中,(a)用于稀释细胞准备注射的稀释剂(control);(b)未转染载体的dc(dc);(c)转染ccl19修饰载体的dcs(dc-ccl19);(d)转染载体未经修饰的dcs(dc-cv);(e)成纤维细胞-ccl19(fb-ccl19);(f)具有ccl19修饰的载体的慢病毒(ccl19;106pfu;后文表示为ccl19病毒);(g)具有未经修饰载体的慢病毒(cv)。
55.进行肿瘤生长曲线斜率分析以比较治疗组与稀释剂对照组的肿瘤生长速率。在前两次治疗后,与稀释剂治疗的对照组相比,以下治疗组中肿瘤生长曲线斜率有下降:dc(1.7倍);dc-ccl19(7倍);dc-cv(1.5倍);成纤维细胞-ccl19(4倍);ccl19(3.5倍)。在第三次治疗后,与稀释剂治疗的对照组相比,以下治疗组中肿瘤生长曲线斜率的降低为:dc(2.4倍);dc-ccl19(16倍);dc-cv(2倍);成纤维细胞-ccl19(4倍);和ccl19(3.2倍)。与稀释剂治疗的对照组(dc,dc-cv,control)相比,每周一次间隔3周的瘤内注射106dc-ccl19(7~10ng/(ml
×
106细胞
×
24h)ccl19)可显著减少肿瘤体积。cv和ccl19(图1,dc-ccl19与dc或dc-cv组的p《0.01)。尽管现有证据报道病毒载体可引发抗病毒ctl反应,但发现dc-cv疗法在减轻肿瘤负担方面不比未修饰的dc更为有效,因为这两个组均介导了1.5~2倍肿瘤负担的减轻。类似地,在该模型中,在由转导的dc分泌的剂量范围内注射重组ccl19(10ng)仅具有有限的抗肿瘤治疗功效,并且肿瘤生长曲线与用稀释剂处理的对照没有明显区别。因此,在体外dc产生的范围内的重组ccl19在体内产生抗肿瘤应答方面无效。相反,与稀释剂治疗的小鼠相比,用dc-ccl19治疗的小鼠在治疗的前2周后肿瘤生长速率降低了7倍,在治疗3周后肿瘤生长速率降低了16倍。这些发现表明,在该模型系统中,ccl19是获得最佳反应的关键要素,必须由dc分泌才能有效治疗。为了确定dc作为递送ccl19的载体的重要性,在肿瘤内施用ccl19转导的成纤维细胞。尽管它们产生相似水平的ccl19,并且在前两次治疗后与dc-ccl19一样有效,但是ccl19转导的成纤维细胞在降低肿瘤方面不如第三次治疗后的dc-ccl19有效。用dc-ccl19治疗的8只小鼠中有5只显示出完全根除肿瘤,而在肿瘤内用成纤维细胞-ccl19治疗的8只小鼠中只有2只显示出完全根除肿瘤。尽管与稀释剂对照治疗的肿瘤相比,经dcs或对照载体修饰的dcs治疗的小鼠显示出肿瘤体积缩小(p《0.05),但未经修饰或对照载体修饰的dcs(dc-cv)治疗的8只小鼠中只有1只显示出完整的肿瘤拒绝。同样,用ccl19病毒(106pfu/周
×
3)治疗的小鼠显示出肿瘤生长减少,但8只小鼠中只有1只具有完全根除肿瘤的能力。瘤内注射5
×
106或107pfu ccl19病毒显示出与106pfu ccl19病毒剂量无法区分的抗肿瘤反应。在用dc-ccl19处理的小鼠中根除肿瘤后,5只小鼠中的5只对5
×
105肿瘤细胞的再次攻击产生排斥反应,即诱导了肿瘤免疫。
56.参见图2和图3,为了确定肿瘤内注射产生的全身性抗肿瘤反应的程度,在小鼠的右胁腹同时接种5
×
105llc细胞,在左胁腹同时接种2
×
104细胞。仅使用在局部模型中显示出最大肿瘤体积减少的治疗组。使用以下治疗组:稀释剂对照(control),具有ccl19修饰载体的病毒(ccl19),成纤维细胞-ccl19(fb-ccl19)和转染有ccl19修饰载体的dcs(dc-ccl19)。仅在右胁腹肿瘤中进行治疗性注射。在双侧肿瘤模型中(图2),与用稀释液治疗的对照组相比,其余治疗组的肿瘤生长曲线的斜率显示降低:ccl19(1.5倍),成纤维细胞-ccl19(2~3倍)和dc-ccl19(5~10倍)。用dc-ccl19治疗的7只小鼠中有3只显示出两个侧面肿瘤的完全消退。相比之下,接受dc-cv的小鼠均无抗肿瘤反应(数据未显示)。尽管注射成纤维细胞-ccl19导致肿瘤生长速率全身性降低,但该治疗组中的7只小鼠中只有1只仅在治
疗侧部显示出完全根除肿瘤。注射ccl19病毒导致两侧的肿瘤生长减少;但是,该组中的所有治疗小鼠均未完全根除肿瘤。
57.参见图4,因为ccl19对t细胞和dc都是趋化性的,所以假设肿瘤内注射dc-ccl19会引起这些细胞类型向肿瘤部位的迁移。对肿瘤单细胞悬液的流式细胞术评估表明,与稀释剂治疗的对照组相比,接受dc,dc-cv,ccl19病毒和成纤维细胞-ccl19的治疗组的cd4 ,cd8 和cd3 cxcr3 t细胞数量有适度但显著的增加,并且表达cd11c dec205 的dc也在增加,但是cd4 cd25 浸润肿瘤的t调节细胞频率显著减少。肿瘤内dc-ccl19产生cd4 (248%),cd8 (71.8%)和cd3 cxcr3 t细胞(71%)以及表达cd11c dec205 的dc(94%)的频率增加最明显。并且与对照组相比,dc-ccl19疗法减少了浸润肿瘤的cd4 cd25 t调节细胞(41.7%)。
58.参见图5和图6,评估了肿瘤部位的细胞因子的产生数量。通过elisa评估肿瘤部位的ifn-γ,gm-csf,il-12,mig/cxcl9,ip-10/cxcl10和tgf-β的存在,并且通过酶免疫测定评估pge2的存在。与稀释剂治疗的对照组相比,接受dc,dc-cv,成纤维细胞-ccl19和ccl19病毒的治疗组的ⅰ型细胞因子(ifn-γ和il-12)和抗血管生成趋化因子(ip-10/cxcl10,mig/cxcl9)适度但显著增加,并且在肿瘤部位的免疫抑制介质(pge2和tgf-β)随之减少。与稀释剂和其他治疗组相比,dc-ccl19产生的ⅰ型细胞因子和抗血管生成趋化因子的增幅最大,而肿瘤免疫抑制介质的降幅最大。与稀释剂治疗组的肿瘤相比,用dc-ccl19治疗的小鼠的pge2(2倍)和tgf-β(4倍)显著降低,但以下细胞因子显著增加:ifn-γ(18倍),gm-csf(4.5倍),ip-10/cxcl10(4倍),il-12(4倍)和mig/cxcl9(4倍)。在dc-ccl19处理的小鼠的脾脏中也观察到相似的细胞因子模式(数据未显示)。即表明dc-ccl19治疗促进ⅰ型细胞因子和抗血管生成趋化因子的释放,以及免疫抑制药物tgf-β和pge2的下降。
59.参见图7所示,dc-ccl19治疗可诱导针对llc的特定t细胞反应,为了验证这种肿瘤的特异性诱导,对来自以下方面的脾细胞进行了ifn-γ酶联免疫斑点测定:(a)稀释剂(control);(b)dc;(c)dc-ccl19;(d)dc-cv;(e)成纤维细胞-ccl19(fb-ccl19);(f)ccl19病毒(ccl19);或(g)cv处理的小鼠。在肿瘤接种后第12天,用经过放射灭活的自体llc或无关的同基因wehi对照肿瘤以10:1的比例对脾细胞再刺激过夜。与稀释剂治疗的对照组相比,各治疗组存在如下增长:dcs(2倍),dc-cv(2倍),ccl19病毒(4倍)和成纤维细胞-ccl19(5倍;p《0.05)。与其他治疗组相比,瘤内dc-ccl19(9倍)产生的肿瘤特异性产生ifn-γ的细胞频率增加最显着(p《0.01)。对对照同系肿瘤wehi的反应增加极少。
60.参见图8和9所示,验证dc-ccl19介导的抗肿瘤反应需要ifn-γ,mig/cxcl9和ip-10/cxcl10。在该模型中观察到的肿瘤减少可能是由于分泌ifn-γ的t细胞参与导致通过mig/cxcl9和ip-10/cxcl10抑制血管生成,以及t细胞依赖性免疫。因此,推测在dc-ccl19治疗的背景下,除ifn-γ外,ip-10/cxcl10和mig/cxcl9也将是肿瘤减少的重要因素。为了确定mig/cxcl9,ip-10/cxcl10和ifn-γ在dc-ccl19介导的抗肿瘤反应中的重要性,在dc-ccl19处理的小鼠中这些细胞因子被清除。抗ip-10/cxcl10,mig/cxcl9和ifn-γ抗体均显着抑制dc-ccl19的抗肿瘤功效(与对照组相比,p《0.01)。ifn-γ的中和引起mig/cxcl9和ip-10/cxcl10的显着降低,表明这些趋化因子很大程度上依赖于ifn-γ。因此,在dc-ccl19治疗的小鼠的肿瘤部位,ifn-γ的增加可以解释ip-10/cxcl10和mig/cxcl9的相对增加。同时,还发现肿瘤部位的ifn-γ产生是mig/cxcl9和ip-10/cxcl10依赖性的,这是由于这些细胞因子的清除引起ifn-γ的显着降低这一事实所表明。这些细胞因子中的任何一种的中和
作用都会导致所有三种细胞因子的减少,因此表明ifn-γ,mig/cxcl9和ip-10/cxcl10在dc-ccl19介导的抗肿瘤应答中是相互依赖的。
61.综上所述,本发明所提供的树突状细胞(dc-ccl19)在瘤内可产生全身性抗肿瘤反应并赋予肿瘤免疫力。在已建立的llc肿瘤的小鼠中评估了dc-ccl19的抗肿瘤功效。肿瘤植入后五天,每周对小鼠进行瘤内治疗,治疗时间为三周:(a)control;(b)dc;(c)dc-ccl19;(d)dc-cv;(e)fb-ccl19;(f)ccl19(106pfu);(g)cv。进行肿瘤生长曲线斜率分析以比较治疗组(b~g)与稀释剂对照组(a)的肿瘤生长速率。在前两次治疗后,与稀释剂治疗的对照组相比,以下治疗组中肿瘤生长曲线斜率的下降为:dc(1.7倍);dc-ccl19(7倍);dc-cv(1.5倍);fb-ccl19(4倍);和ccl19(3.5倍)。在第三次治疗后,与稀释剂治疗的对照组相比,以下治疗组中肿瘤生长曲线斜率的降低为:dc(2.4倍);dc-ccl19(16倍);dc-cv(2倍);fb-ccl19(4倍);和ccl19(3.2倍)。与稀释剂治疗的对照组(dc,dc-cv,对照组)相比,每周一次间隔3周的瘤内注射106dc-ccl19(7~10ng/(ml
×
106细胞
×
24h)ccl19)可显着减少肿瘤体积。dc-ccl19与dc或dc-cv组的p《0.01。尽管据报道病毒载体可引发抗病毒ctl反应,但发现dc-cv疗法在减轻肿瘤负担方面不比未修饰的dc更为有效,因为这两个组均介导了1.5~2倍减轻肿瘤负担。类似地,在该模型中,在由转导的dc分泌的剂量范围内注射重组ccl19(10ng)仅具有有限的抗肿瘤治疗功效,并且肿瘤生长曲线与用稀释剂处理的对照没有明显区别。因此,在体外dc产生的范围内的重组ccl19在体内产生抗肿瘤应答方面无效。相反,与稀释剂治疗的小鼠相比,用dc-ccl19治疗的小鼠在治疗的前2周后肿瘤生长速率降低了7倍,在治疗3周后肿瘤生长速率降低了16倍。这些发现表明,在该模型系统中,ccl19是获得最佳反应的关键要素,必须由dc分泌才能有效治疗。为了确定dc作为递送ccl19的载体的重要性,在肿瘤内施用ccl19转导的成纤维细胞。尽管它们产生相似水平的ccl19,并且在前两次治疗后与dc-ccl19一样有效,但是ccl19转导的成纤维细胞在降低肿瘤方面不如第三次治疗后的dc-ccl19有效。用dc-ccl19治疗的8只小鼠中有5只,而在肿瘤内用成纤维细胞-ccl19治疗的8只小鼠中只有2只显示出完全根除肿瘤。尽管与稀释剂对照治疗的肿瘤相比,经dcs或对照载体修饰的dcs治疗的小鼠显示出肿瘤体积缩小(p《0.05),但未经修饰或对照载体修饰的dcs(dc-cv)治疗的8只小鼠中只有1只显示出完整的肿瘤拒绝。同样,用ccl19病毒(106pfu/周
×
3)治疗的小鼠显示出肿瘤生长减少,但8只小鼠中只有1只具有完全根除肿瘤的能力。瘤内注射5
×
106或107pfu ccl19病毒显示出与106pfu ccl19病毒剂量无法区分的抗肿瘤反应。在用dc-ccl19处理的小鼠中根除肿瘤后,5只小鼠中的5只对5
×
105肿瘤细胞的次要攻击反产生排斥反应,即诱导肿瘤免疫。为了确定肿瘤内注射产生的全身性抗肿瘤反应的程度,在小鼠的右胁腹同时接.5
×
105llc细胞,在左胁腹同时接种2
×
104细胞。仅使用在局部模型中显示出最大肿瘤体积减少的治疗组。在双侧肿瘤模型中,与用稀释液治疗的对照组相比,与用稀释液治疗的对照组相比,其余治疗组的肿瘤生长曲线的斜率显示降低:ccl19(1.5倍),成纤维细胞-ccl19(2~3倍)和dc-ccl19(5~10倍)。用dc-ccl19治疗的7只小鼠中有3只显示出两个侧面肿瘤的完全消退。相比之下,接受dc-cv的小鼠均无抗肿瘤反应(数据未显示)。尽管注射成纤维细胞-ccl19导致肿瘤生长速率全身性降低,但该治疗组中的7只小鼠中只有1只仅在治疗侧部显示出完全根除肿瘤。注射ccl19病毒导致两侧的肿瘤生长减少;但是,该组中的所有治疗小鼠均未完全根除肿瘤。
62.以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发
明说明书及附图内容所作的等同变换,或直接或间接运用在相关的技术领域,均同理包括在本发明的专利保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
