1.本发明涉及扇贝深加工的技术领域,特别涉及一种具有抑制酪氨酸酶活性的扇贝多肽及其制备方法。
背景技术:
2.目前,有关扇贝的深加工产品较为少见。一般是涉及扇贝多肽在抗氧化、抗老化或美白功效方面的研究。关于抗氧化的研究可参考牛瑞等人在“扇贝裙边酶解制备抗氧化肽的实验研究”一文中报道,利用海洋碱性蛋白酶水解扇贝裙边并发现获得多肽的抗氧化作用,表现为羟自由基清除率高于80%。
3.抗老化可参考曹鹏利等人的文章“扇贝多肽对长期紫外线辐射豚鼠皮肤光老化的保护作用研究”,阐明了扇贝多肽可对抗紫外线引发的皮肤老化损伤。
4.关于美白方面的研究可见公告号为cn107523601b(公开日2019年10月11日)的专利文件所公开的扇贝边美白肽的制备方法,即扇贝裙边经胃蛋白酶和胰蛋白酶酶解得到水解液,用乙醇沉淀和回收纯化,再经5000da超滤可得到具有酪氨酸酶抑制活性的多肽。
5.然而在上述获取具有酪氨酸酶抑制活性的扇贝美白肽的工艺中需经过醇沉工艺,这个操作时间成本较高,生产效率较低,有待进一步改进。
技术实现要素:
6.为解决上述背景技术中提到的问题,本发明提供一种具有抑制酪氨酸酶活性的扇贝多肽的制备方法,包括如下制备步骤:
7.s100、原料预处理:将扇贝裙边加水软化加热并倒入胶体磨成浆料;
8.s200、第一次水解:在所述浆料中加入中性蛋白酶进行第一次水解,水解结束后,经灭酶得到第一次水解液;
9.s300、第二次水解:在所述第一次水解液中加入酸性蛋白酶进行第二次水解,水解结束后,经灭酶得到第二次水解液;
10.s400、离心、微滤与超滤:将所述第二次水解液进行离心得上清液,所述上清液依次经0.22-0.45微米膜微滤和3000da的滤膜超滤,得到分子量小于3000da的超滤多肽液;
11.s500、纳滤浓缩:将所述超滤多肽液用200da的纳滤膜装置经浓缩到分子量200-3000da的浓缩多肽液即为所述具有抑制酪氨酸酶活性的扇贝多肽。
12.在一实施例中,在s100中,所述扇贝裙边与水的质量比为1:10-15,且加热至煮沸后,冷却到60-75℃并保温3-5小时再倒入胶体磨成浆料。
13.在一实施例中,在s200中,第一次水解的条件为在45-60℃,ph的范围为6.0-7.5下水解80-160min;第一次水解的灭酶条件为90-100℃灭酶5-10min。
14.在一实施例中,按所述扇贝裙边中蛋白质量,所述中性蛋白酶的添加量为4000-7000u/g。优选地,所述中性蛋白酶为0.8l中性蛋白酶或ax中性蛋白酶。
15.在一实施例中,在s300中,第二次水解的条件为在42-55℃,ph的范围为2.5-3.5下
水解60-120min;第二次水解的灭酶条件为70-80℃灭酶3-6min。
16.在一实施例中,按所述扇贝裙边中蛋白质量,所述酸性蛋白酶的添加量为3000-6000u/g。优选地,所述酸性蛋白酶为3.350酸性蛋白酶。
17.在一实施例中,在s400中,所述第二次水解液的离心条件为在5000-8000rpm下离心10-20min。
18.在一实施例中,所述浓缩多肽液到多肽含量为7%-9%。
19.在一实施例中,所述浓缩多肽液还可经喷雾干燥成粉状进行保存。
20.具体地,一种具有抑制酪氨酸酶活性的扇贝多肽的制备方法,包括以下制备步骤:
21.s100、原料预处理:将扇贝裙边按1:10-15的质量比加水软化,加热煮沸后,冷却到60-75℃保温3-5小时;然后倒入胶体磨成细腻的浆料;
22.s200、第一次水解:按扇贝裙边中蛋白质量,在浆料中加入0.8l中性蛋白酶或ax中性蛋白酶4000-7000u/g,调节浆料的ph到6.0-7.5,在45-60℃水解80-160min;在90℃灭酶5-10min,自然冷却得到第一次水解液;
23.s300、第二次水解:按扇贝裙边中蛋白质量,在第一次水解液中加入3.350酸性蛋白酶3000-6000u/g,控制ph值2.5-3.5,在42-55℃水解60-120min,水解结束后,调ph到5.0-5.8,升温到70-80℃灭酶3-6min得到第二次水解液;
24.s400、离心、微滤与超滤:第二次水解液在5000-8000rpm离心10-20min,得到离心上清液,上清液经0.22-0.45微米膜微滤和3000da的滤膜超滤,得到分子量小于3000da的超滤多肽液;
25.s500、纳滤浓缩:将所述超滤多肽液用200da的纳滤膜装置浓缩到多肽含量7%-9%,得到分子量200-3000da的浓缩多肽液。
26.本发明还提供一种具有抑制酪氨酸酶活性的扇贝多肽,采用如上任意所述的具有抑制酪氨酸酶活性的扇贝多肽的制备方法制得。
27.基于上述,与现有技术相比,本发明提供的一种具有抑制酪氨酸酶活性的扇贝多肽的制备方法具备如下有益效果:
28.1、本发明在多肽纯化方面,不采用传统的醇沉工艺,直接使用微滤和超滤进行产品纯化,具有节省成本和操作简化等优点。
29.2、本发明利用纳滤浓缩代替传统的真空浓缩工艺,避免生物活性物质的破坏,同时节约能耗,提高生产效率。
30.3、本发明的扇贝多肽水解液中发现有两段分子多肽具有酪氨酸酶抑制活性,分别为1000-3000da的分子段和小于1000da的分子段,以上多肽稀释到5-25mg/ml时,酪氨酸酶的抑制率可达45%-82%,可作为美容食品或化妆品原料。
31.本发明的其它特征和有益效果将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本发明而了解。本发明的目的和其他有益效果可通过在说明书、权利要求书中所指出的结构和/或组分来实现和获得。
附图说明
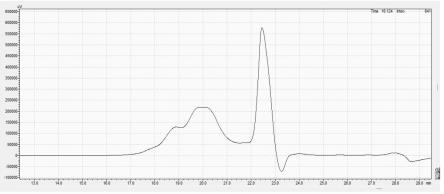
32.图1为实施例3中微滤液的多肽高效凝胶色谱法色谱图。
33.图2为实施例4中微滤液的多肽高效凝胶色谱法色谱图。
具体实施方式
34.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
35.在本发明的描述中,需要说明的是,本发明所使用的所有术语(包括技术术语和科学术语)具有与本发明所属领域的普通技术人员通常所理解的含义相同的含义,不能理解为对本发明的限制;应进一步理解,本发明所使用的术语应被理解为具有与这些术语在本说明书的上下文和相关领域中的含义一致的含义,并且不应以理想化或过于正式的意义来理解,除本发明中明确如此定义之外。
36.本发明提供如下实施例
37.实施例1
38.s100、原料预处理:取80g扇贝裙边(蛋白含量:64%)加800g水软化,加热煮沸后,冷却到75℃保温3小时;然后倒入胶体磨循环磨浆1.5分钟,形成扇贝浆料。
39.s200、第一次水解:在浆料中加入0.8l中性蛋白酶204.8ku,调节浆料的ph到7.0,在55℃水解80min;第一次水解液在90℃灭酶5min,自然冷却得到第一次水解液;。
40.s300、第二次水解:在第一次水解液中加入3.350酸性蛋白酶204.8ku,控制ph值3.5左右,在55℃水解60min。二次水解后,调ph到5.5,升温到80℃灭酶3min得到第二次水解液。
41.s400、离心、微滤与超滤:第二次水解液在5000rpm离心15min,得到离心上清液,上清液经0.45微米膜微滤和3000da的滤膜超滤,得到分子量小于3000da的超滤多肽液。
42.s500、纳滤浓缩:将超滤多肽液用200da的纳滤膜装置浓缩到多肽含量8%,得到分子量200-3000da的浓缩多肽液。
43.针对该实施例,本发明提供如下对比例:
44.对比例1
45.只保留0.8l中性蛋白酶的一次水解,除去3.350酸性蛋白酶水解环节,其他操作、工艺均与实施例1相同。
46.对比例2
47.去除0.8l中性蛋白酶水解环节,直接进行3.350酸性蛋白酶水解,其他操作、工艺均与实施例1相同。
48.对比例3
49.将第二次水解用酶中的3.350酸性蛋白酶等酶活替换成3.4310酸性蛋白酶(黑曲霉3.4310菌株产),其他操作、工艺及均与实施例1相同。
50.对比例4
51.第二次水解用酶中的3.350酸性蛋白酶等酶活替换成地衣芽孢杆菌酸性蛋白酶(地衣芽孢杆菌株产),其余所有操作、工艺均与实施例1相同。
52.对比例5
53.第二次水解用酶中的3.350酸性蛋白酶等酶活替换成537酸性蛋白酶(宇佐美曲霉菌株产),其余所有操作、工艺均与实施例1相同。
54.将实施例1和对比例1至对比例5制得的多肽液,稀释到15mg/ml,并采用t/shrh 015~2018化妆品~酪氨酸酶活性抑制测试,具体结果表1所示:
55.表1
[0056] 实施例1对比例1对比例2对比例3对比例4对比例5酪氨酸酶抑制率%65.5
‑‑‑‑‑‑‑‑
10.6
[0057]
注:
‑‑
为无抑制活性
[0058]
由表1可知,与实施例1用的0.8l中性蛋白酶 3.350酸性蛋白酶水解相比,对比例1和对比例2分别只使用0.8l中性蛋白酶或3.350酸性蛋白酶一次水解扇贝裙边,所得的多肽水解液不具有酪氨酸酶抑制活性。
[0059]
而用3.4310酸性蛋白酶和地衣芽孢杆菌酸性蛋白酶取代3.350酸性蛋白酶水解的对比例3和对比例4均未检出酪氨酸酶抑制活性。对比例5用537酸性蛋白酶取代3.350酸性蛋白酶,酪氨酸酶抑制活性为10.6%,仅为实施例1的16.2%。实验表明,实施例1所使用的0.8l中性蛋白酶和3.350酶组合水解是获取高酪氨酸酶抑制活性多肽的最佳组合。
[0060]
实施例2
[0061]
s100、原料预处理:取80g扇贝裙边(蛋白含量:64%)加1200g水软化,加热煮沸后,冷却到65℃保温4小时;然后倒入胶体磨循环磨浆形成扇贝浆料。
[0062]
s200、第一次水解:在浆料中加入ax中性蛋白酶256ku,调节浆料的ph到6.0,在60℃水解80min;在90℃灭酶5min,自然冷却得到第一次水解液。
[0063]
s300、第二次水解:在第一次水解液加入3.350酸性蛋白酶204.8ku,控制ph值3.5,在42℃水解120min。二次水解后,调ph到5.0,升温到70℃灭酶6min得到第二次水解液。
[0064]
s400、离心、微滤与超滤:第二次水解液在5000rpm离心15min,得到离心上清液,上清液经0.45微米膜微滤和3000da的滤膜超滤,得到分子量小于3000da的超滤多肽液。
[0065]
s500、纳滤浓缩:超滤多肽液用200da的纳滤膜装置浓缩到多肽含量8%,得到分子量200-3000da的浓缩多肽液。
[0066]
对该实施例,本发明提供如下对比例:
[0067]
对比例6
[0068]
第一次水解用酶等酶活替换成枯草杆菌中性蛋白酶(枯草杆菌产)且水解温度设置为45℃、ph7.0,其余操作、工艺及检测均与实施例2相同。
[0069]
对比例7
[0070]
第一次水解用酶等酶活替换成2sd中性蛋白酶(米曲霉产,阿玛诺天野酶制剂商贸有限公司),且水解温度设置为55℃、ph7.0,其他操作与工艺条件与实施例2一致。
[0071]
对比例8
[0072]
第一次水解用酶等酶活替换成pc10f中性蛋白酶(嗜热脂解芽孢杆菌产,阿玛诺天野酶制剂商贸有限公司),且水解温度设置为60℃、ph7.5,其他操作与工艺条件与实施例2一致。
[0073]
对比例9
[0074]
将实施例2中得到的小于3000da的超滤多肽液,不采用纳滤浓缩,而是采用真空浓缩到多肽含量9%,其中,真空浓缩的参数设置为绝对压0.098mpa,温度45℃,其他操作与工艺条件与实施例2一致。
[0075]
将实施例2和对比例6至对比例9制得的多肽液,稀释到15mg/ml,并采用t/shrh 015~2018化妆品~酪氨酸酶活性抑制测试,具体结果表2所示:
[0076]
表2
[0077] 实施例2对比例6对比例7对比例8对比例9酪氨酸酶抑制率%52.88.2
‑‑‑‑
40.6
[0078]
注:
‑‑
为无抑制活性
[0079]
由表2可知,与实施例2相比,第一次水解用其他中性蛋白酶替换ax中性蛋白酶的对比例6的酪氨酸酶抑制活性远低于实施例2;而对比例7和对比例8的多肽未发现酪氨酸酶抑制活性。以上结果说明ax中性蛋白酶和3.350酶两次水解的组合可得到酪氨酸酶抑制率较高的多肽产品。
[0080]
另外,对比例9采用真空浓缩替代纳滤浓缩工艺,导致酪氨酸酶抑制活性比实施例2下降了23.1%,可能是有些活性多肽热稳定不好,加热浓缩过程中部分多肽受热聚合变性,从而造成活性降低。因此,为了避免真空浓缩的不利影响,本发明选择使用纳滤浓缩工艺。
[0081]
实施例3
[0082]
s100、原料预处理:取200g扇贝裙边(蛋白含量:64%)加3000g水软化,加热煮沸后,冷却到75℃保温4小时;然后倒入胶体磨循环磨浆1.5分钟,形成扇贝浆料。
[0083]
s200、第一次水解:在浆料中加入0.8l中性蛋白酶896ku,调节浆料的ph到6.0,在45℃水解160min;在90℃灭酶5min,自然冷却得到第一次水解液。
[0084]
s300、第二次水解:在第一次水解液中加入3.350酸性蛋白酶480ku,控制ph值3.0,在50℃水解90min。二次水解后,调ph到5.7,升温到75℃灭酶5min得到第二次水解液。
[0085]
s400、离心、微滤与超滤:第二次水解液在8000rpm离心10min,得到离心上清液,上清液经0.45微米膜微滤。微滤液分别用通过3000da和1000da的超滤膜超滤,分别得到大于3000da、1000-3000da、小于3000和小于1000da的4种超滤液。取以上微滤液,用高压液相色谱仪和tskgelg2000凝胶柱分析吸收峰面积和分子量分布。
[0086]
s500、纳滤浓缩:4种超滤多肽液分别用200da的纳滤膜装置浓缩到多肽含量8%后,低温保存。
[0087]
将以上4种多肽液分别稀释到15mg/ml,并采用t/shrh 015~2018化妆品-酪氨酸酶活性抑制测试,具体结果表3所示:
[0088]
表3各段多肽的酪氨酸酶抑制率/%(15mg/ml)
[0089]
多肽分子段》3000da1000-3000da<3000da<1000da酪氨酸酶抑制率%4.855.165.371.5微滤液多肽分子量分布(%)12.743.287.344.1
[0090]
由表3可知,大于3000da的多肽的活性较低,仅为4.8%,推测是由于少量小分子多肽未完全滤除导致的。但是1000-3000da和小于1000da的多肽段都有较高的酪氨酸酶抑制活性,分别为55.1%和71.5%。通过对实施例3所得的微滤液的高效凝胶色谱图分析发现(参照图1),在1000-3000da和小于1000da分子量段各有一个吸收峰,且分子量分布为43.2%和44.1%。以上两个段多肽均有酪氨酸酶抑制活性,但是小于1000da分子段的多肽活性较高,为了提高多肽得率,本发明选取了小于3000da的多肽作为产品。
[0091]
实施例4
[0092]
s100、原料预处理:取200g扇贝裙边(蛋白含量:64%)加2600g水软化,加热煮沸后,冷却到60℃保温5小时;然后倒入胶体磨循环磨浆1.5分钟,形成扇贝浆料。
[0093]
s200、第一次水解:在浆料中加入ax中性蛋白酶640ku,调节浆料的ph到6.5,在60℃水解80min;在90℃灭酶10min,自然冷却得到第一次水解液。
[0094]
s300、第二次水解:在第一次水解液中加入3.350酸性蛋白酶768ku,控制ph值3.0,在42℃水解120min。二次水解后,调ph到5.8,升温到80℃灭酶3min,得到第二次水解液。
[0095]
s400、离心、微滤与超滤:第二次水解液在7000rpm离心12min,得到离心上清液,上清液经0.22微米膜微滤。微滤液分别用通过3000da和1000da的超滤膜超滤,分别得到大于3000da、1000-3000da、小于3000和小于1000da的4种超滤液。取以上微滤液用高压液相色谱仪和tskgelg2000凝胶柱分析吸收峰面积和分子量分布。
[0096]
s500、纳滤浓缩:4种超滤多肽液分别用200da的纳滤膜装置浓缩到多肽含量8%后,低温保存。
[0097]
将以上4种多肽液分别稀释到15mg/ml,并采用t/shrh 015~2018化妆品~酪氨酸酶活性抑制测试,具体结果表4所示:
[0098]
表4
[0099]
多肽分子段》3000da1000-3000da<3000da<1000da酪氨酸酶抑制率%5.646.553.458.2微滤液多肽分子量分布(%)18.349.081.732.7
[0100]
从表4可知,在实施例4中,大于3000da的多肽的酪氨酸酶抑制活性仅为5.6%,少量的活性可能是有少量低分子活性多肽未完全滤出所致。与实施例3相似,1000-3000da和小于1000da的多肽段都有一定的酪氨酸酶抑制活性。对实施例4所得微滤液的高效凝胶色谱图分析发现(参照图2),在1000-3000da和小于1000da分子量段各有一个吸收峰,分子量分布分别为49.0%和32.7%,判断两个多肽段均有酪氨酸酶抑制活性,但是分子小于1000da的多肽段活性明显高于1000-3000da的多肽段。与实施例3相同,为了提高多肽得率,本发明选取小于3000da的多肽作为产品。
[0101]
另外,本领域技术人员应当理解,尽管现有技术中存在许多问题,但是,本发明的每个实施例或技术方案可以仅在一个或几个方面进行改进,而不必同时解决现有技术中或者背景技术中列出的全部技术问题。本领域技术人员应当理解,对于一个权利要求中没有提到的内容不应当作为对于该权利要求的限制。
[0102]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。