1.本发明涉及共聚聚羟基烷酸酯混合物的制造方法及转化微生物。
背景技术:
2.聚羟基烷酸酯(以下有时称为“pha”)是由广范的微生物产生的聚酯型有机聚合物。pha是具有生物分解性的热塑性高分子,可以以可再生资源作为原料进行生产。由此,尝试了以pha作为环保型原材料或生物相容型原材料进行工业生产并用于多种产业的尝试。
3.目前为止,已知大量微生物以pha作为储能物质蓄积于菌体内。作为pha的代表例,可以举出作为3-羟基丁酸(以下有时也称为“3hb”)的均聚物的聚-3-羟基丁酸(以下有时也称为“p(3hb)”)。p(3hb)为热塑性高分子,由于在自然环境中可生物分解,因此,作为对环境友好的塑料而备受瞩目。但是,p(3hb)的结晶性高,因此具有硬且脆的性质,在实际使用上应用范围受到限制。为了扩大应用范围,需要对p(3hb)赋予柔软性。
4.于是,开发了由3hb和3-羟基戊酸(以下称为“3hv”)形成的共聚pha(以下称为“p(3hb-co-3hv)”)及其制造方法(例如,参照专利文献1及专利文献2)。p(3hb-co-3hv)比p(3hb)更富于柔软性,因此可以认为能够用于广泛的用途。然而,实际上即使使p(3hb-co-3hv)中的3hv摩尔分率增加,与此相伴的物性的变化也不大,特别是由于柔软性没有提高到加工成膜、片、软质类包装容器等所要求的程度,因此,只能用于洗发水瓶、一次性剃刀的把手等硬质成型体的有限的领域。
5.为了提高pha的柔软性,对于由3hb和3-羟基己酸(以下称为“3hh”)形成的共聚聚羟基烷酸酯(以下也称为“p(3hb-co-3hh)”)及其制造方法进行了研究(例如,参照专利文献3及专利文献4)。在这些报告中,p(3hb-co-3hh)是使用由土壤分离的豚鼠气单胞菌(aeromonas caviae)的野生株以油酸、棕榈酸等脂肪酸作为碳源而发酵生产的。
6.另外,也进行了以杀虫贪铜菌(cupriavidus necator)作为宿主并利用来源于豚鼠气单胞菌的pha合成酶大量生产p(3hb-co-3hh)的研究。通过对于具有来源于豚鼠气单胞菌的pha合成酶的杀虫贪铜菌导入r体特异性烯酰coa水合酶基因,或者通过增加宿主染色体上的r体特异性烯酰coa水合酶基因的表达量,以植物油脂作为原料而生产p(3hb-co-3hh),可将该p(3hb-co-3hh)的3hh组成比率提高至最大14mol%左右(参照专利文献5、专利文献6及非专利文献1)。
7.此外,也有对于具有来源于豚鼠气单胞菌的pha合成酶的杀虫贪铜菌,通过抑制编码β-酮硫解酶的基因的表达而将p(3hb-co-3hh)的3hh组成比率提高至20mol%以上的例子(参照专利文献7),所述β-酮硫解酶具有对于碳原子数6的β-酮酰基-coa(即,β-酮己酰基-coa)的硫解活性。
8.也进行了与p(3hb-co-3hh)的物性相关的研究(参照非专利文献2)。在该报告中,以碳原子数为12以上的脂肪酸作为唯一碳源对豚鼠气单胞菌进行培养,发酵生产了具有各种3hh组成比率的p(3hb-co-3hh)。p(3hb-co-3hh)的结晶性随着3hh组成比率的增加而降低,因此,从p(3hb)那样的硬且脆的性质逐渐显示出柔软的性质,3hh组成比率进一步提高
时,显示出比p(3hb-co-3hv)更高的柔软性。即,p(3hb-co-3hh)能够通过改变3hh组成比率而具有从硬质聚合物至软质聚合物的可应用范围宽广的物性,可以期待在广泛领域中的应用。
9.另一方面,尽管在使3hh组成比率上升时,p(3hb-co-3hh)的结晶性降低而柔软性提高,但具有加工特性降低的倾向。例如,虽然将3hh组成比率提高至10摩尔%左右的p(3hb-co-3hh)较软质,但在注塑成型、膜成型、吹塑成型、纤维的纺丝、挤出发泡、珠粒发泡等加工中结晶化速度慢,因此存在生产性低的课题。为了解决该课题,也进行了如下研究:通过在同一细胞内一起生产上述较软质的p(3hb-co-3hh)和3hh组成比率低且熔点高(即结晶性高)的共聚pha,从而改善熔融加工性、加工速度(参照专利文献8)。
10.然而,在专利文献8中记载的pha混合品中,由于低熔点成分(考虑具有最高的3hh组成比率的pha成分)的熔点超过100℃,因此可以推测,该pha混合品不包含20摩尔%以上的3hh组成比率高的pha成分,撕裂强度等机械特性不足,仍有改进的余地。
11.现有技术文献
12.专利文献
13.专利文献1:日本特开昭57-150393号公报
14.专利文献2:日本特开昭59-220192号公报
15.专利文献3:日本特开平5-93049号公报
16.专利文献4:日本特开平7-265065号公报
17.专利文献5:国际公开第2011/105379号
18.专利文献6:国际公开第2015/115619号
19.专利文献7:国际公开第2019/142845号
20.专利文献8:国际公开第2017/056442号
21.非专利文献
22.非专利文献1:h.arikawa,k.matsumoto,microb.cell.fact.,15,pp.184(2016)
23.非专利文献2:y.doi,s.kitamura,h.abe,macromolecules,28,pp.4822-4823(1995)
技术实现要素:
24.发明要解决的课题
25.如上所述,使用p(3hb-co-3hh)得到满足良好的加工性和机械特性这两者的成型体是很困难的。
26.鉴于上述现状,本发明的目的在于提供制造兼顾优异的加工性和机械特性的共聚聚羟基烷酸酯的方法。
27.解决课题的方法
28.本发明人为了解决上述课题而进行了深入研究,结果发现,通过对微生物进行培养,生产具有特定组成的包含2种聚羟基烷酸酯级分的共聚聚羟基烷酸酯混合物,能够得到兼顾了优异的加工性和机械特性的共聚聚羟基烷酸酯混合物,从而完成了本发明。
29.即,本发明涉及一种制造共聚聚羟基烷酸酯混合物的方法,该方法包括:对生产上述共聚聚羟基烷酸酯混合物的微生物进行培养的工序,上述共聚聚羟基烷酸酯混合物含有
聚羟基烷酸酯级分(i)和聚羟基烷酸酯级分(ii),所述聚羟基烷酸酯级分(i)包含具有3-羟基丁酸结构单元及3-羟基己酸结构单元的共聚聚羟基烷酸酯,而且3-羟基己酸的平均组成比率为20摩尔%以上,所述聚羟基烷酸酯级分(ii)包含具有3-羟基丁酸结构单元的聚羟基烷酸酯,而且3-羟基己酸的平均组成比率为0摩尔%以上且15摩尔%以下,上述共聚聚羟基烷酸酯混合物中3-羟基己酸的平均组成比率为22摩尔%以下。
30.优选上述共聚聚羟基烷酸酯混合物中的上述聚羟基烷酸酯级分(i)的重量比例为10~90%。
31.优选上述共聚聚羟基烷酸酯混合物中3-羟基己酸的平均组成比率为10~22摩尔%。
32.优选上述微生物具有编码下述酶的基因:对3-羟基己酰基-coa的聚合活性彼此不同的2种聚羟基烷酸酯合成酶。
33.优选上述对3-羟基己酰基-coa的聚合活性彼此不同的2种聚羟基烷酸酯合成酶的氨基酸序列的序列同一性为90%以下。
34.优选编码上述对3-羟基己酰基-coa的聚合活性彼此不同的2种聚羟基烷酸酯合成酶的基因为以下的基因(a)和基因(b),所述基因(a)编码对3-羟基己酰基-coa的聚合活性比野生型聚羟基烷酸酯合成酶高的聚羟基烷酸酯合成酶,所述野生型聚羟基烷酸酯合成酶来源于具有序列号1中记载的氨基酸序列的豚鼠气单胞菌,所述基因(b)编码对3-羟基己酰基-coa的聚合活性比野生型聚羟基烷酸酯合成酶低的聚羟基烷酸酯合成酶,所述野生型聚羟基烷酸酯合成酶来源于上述豚鼠气单胞菌。
35.优选上述基因(a)为来源于气单胞菌属微生物的聚羟基烷酸酯合成酶基因或其突变体。更优选上述基因(a)是编码下述氨基酸序列的基因:相对于序列号2或序列号3所示的氨基酸序列具有99.5~100%的序列同一性的氨基酸序列。
36.优选上述基因(b)是将来源于气单胞菌属微生物的聚羟基烷酸酯合成酶基因的一部分和来源于贪铜菌属微生物的聚羟基烷酸酯合成酶基因的一部分组合而成的。更优选上述基因(b)是编码相对于序列号6所示的氨基酸序列具有90~100%的序列同一性的氨基酸序列的基因。
37.优选上述基因(b)为来源于色杆菌属微生物的聚羟基烷酸酯合成酶基因或其突变体。更优选上述基因(b)是编码相对于序列号4或序列号5所示的氨基酸序列具有90~100%的序列同一性的氨基酸序列的基因。
38.优选上述基因(b)为来源于芽孢杆菌属微生物的聚羟基烷酸酯合成酶基因或其突变体。更优选上述基因(b)是编码相对于序列号7及序列号8所示的氨基酸序列具有90~100%的序列同一性的氨基酸序列的基因。
39.优选上述微生物为转化微生物,所述转化微生物进行了如下转化:与该微生物的野生株相比,细胞内的3-羟基己酰基-coa相对于聚羟基烷酸酯合成酶的供给增大。更优选上述转化微生物进行了如下转化:油脂或脂肪酸的β氧化中碳原子数6的中间代谢物的分解受到抑制。进一步优选上述转化微生物进行了如下转化:编码β-酮硫解酶的基因的表达受到抑制,所述β-酮硫解酶对作为碳原子数6的β-酮酰基-coa的β-酮己酰基-coa具有硫解活性。
40.优选上述β-酮硫解酶具有相对于序列号9或序列号10所示的氨基酸序列显示出90
~100%的序列同一性的氨基酸序列。
41.优选上述微生物为具有下述基因的微生物:编码显示出r体特异性烯酰-coa水合酶活性的蛋白质的基因。
42.优选在上述培养工序中添加包含油脂或脂肪酸的碳源。更优选上述包含油脂或脂肪酸的碳源为包含碳原子数6~12的中链脂肪酸或该中链脂肪酸的甘油酯的碳源。进一步优选上述中链脂肪酸为己酸。
43.优选上述微生物属于贪铜菌属、或为贪铜菌属微生物的转化体。更优选上述微生物为杀虫贪铜菌、或杀虫贪铜菌的转化体。
44.另外,本发明也涉及生产共聚聚羟基烷酸酯混合物的转化微生物,所述转化微生物具有编码对3-羟基己酰基-coa的聚合活性彼此不同的2种聚羟基烷酸酯合成酶的基因,所述转化微生物进行了如下转化:与所述转化微生物的野生株相比,细胞内的3-羟基己酰基-coa相对于聚羟基烷酸酯合成酶的供给增大,上述共聚聚羟基烷酸酯混合物含有聚羟基烷酸酯级分(i)和聚羟基烷酸酯级分(ii),所述聚羟基烷酸酯级分(i)包含具有3-羟基丁酸结构单元及3-羟基己酸结构单元的共聚聚羟基烷酸酯,而且3-羟基己酸的平均组成比率为20摩尔%以上,所述聚羟基烷酸酯级分(ii)包含具有3-羟基丁酸结构单元的聚羟基烷酸酯,而且3-羟基己酸的平均组成比率为0摩尔%以上且15摩尔%以下,上述共聚聚羟基烷酸酯混合物的3-羟基己酸的平均组成比率为22摩尔%以下。
45.发明的效果
46.根据本发明,可以制造兼顾了优异的加工性和机械特性的共聚聚羟基烷酸酯混合物。根据本发明的优选实施方式,制造的共聚聚羟基烷酸酯混合物易于操作,能够容易地由微生物实施工业上的分离及纯化。
具体实施方式
47.以下,对本发明的实施方式进行说明,但本发明并不限定于以下的实施方式。
48.本发明是制造共聚pha混合物的方法,包括对生产上述共聚pha混合物的微生物进行培养的工序。
49.(共聚pha混合物)
50.上述共聚pha混合物由pha级分(i)和pha级分(ii)构成,所述pha级分(i)包含具有3hb结构单元及3hh结构单元的共聚pha、且3hh的平均组成比率为20摩尔%以上,所述pha级分(ii)包含具有3hb结构单元的pha、且3hh的平均组成比率为0摩尔%以上且15摩尔%以下。上述共聚pha混合物可以通过后述的mibk分级法而分级为上述pha级分(i)和pha级分(ii)。
51.上述pha级分(i)是包含至少具有3hb结构单元及3hh结构单元的共聚pha的级分,可以包含含有除3hb结构单元及3hh结构单元以外的羟基烷酸结构单元的pha,优选为包含不含有除3hb结构单元及3hh结构单元以外的羟基烷酸结构单元而仅具有3hb结构单元及3hh结构单元的共聚pha的级分、即包含p(3hb-co-3hh)的级分。
52.作为除3hb结构单元及3hh结构单元以外的羟基烷酸结构单元,可以列举:3-羟基丙酸、3hv、碳原子数7~16的3-羟基烷酸、碳原子数4~16的2-羟基烷酸、4-羟基烷酸(例如4-羟基丁酸)、5-羟基烷酸、6-羟基烷酸(例如6-羟基己酸)、乳酸等羟基烷酸的结构单元,但
并不限定于此。
53.pha级分(i)中3hh的平均组成比率为20摩尔%以上、优选为22摩尔%以上、更优选为24摩尔%以上。该3hh的平均组成比率的上限值没有特别限定,优选为35摩尔%以下、更优选为32摩尔%以下、特别优选为30摩尔%以下。
54.上述pha级分(ii)是包含具有3hb结构单元的pha的级分。pha级分(ii)中包含的pha可以是仅具有3hb结构单元的均聚物,也可以是具有3hb结构单元和除此以外的羟基烷酸结构单元的共聚pha。考虑到机械物性,优选为具有3hb结构单元和除此以外的羟基烷酸结构单元的共聚pha。作为该共聚pha,优选为具有3hb结构单元、以及3hv结构单元和/或3hh结构单元的共聚pha,更优选为具有3hb结构单元和3hh结构单元的共聚pha,进一步优选为仅具有3hb结构单元及3hh结构单元的共聚pha、即p(3hb-co-3hh)。
55.pha级分(ii)中3hh的平均组成比率为0摩尔%以上且15摩尔%以下。该3hh的平均组成比率的下限值优选为0.1摩尔%以上、更优选为1摩尔%以上、进一步优选为2摩尔%以上、更进一步优选为3摩尔%以上。该3hh的平均组成比率的上限值优选为12摩尔%以下、更优选为10摩尔%以下。
56.上述共聚pha混合物中上述pha级分(i)所占的重量比例优选为10%~90%、更优选为20%~80%、特别优选为30%~70%。另外,上述共聚pha混合物中上述pha级分(ii)所占的重量比例优选为10%~90%、更优选为20%~80%、特别优选为30%~70%。
57.上述共聚pha混合物整体显示的3hh的平均组成比率为22摩尔%以下。该3hh的平均组成比率超过22摩尔%时,共聚pha混合物的粘合性增高,在基于微生物的发酵生产后的共聚pha混合物的分离及纯化工序中,容易产生不期望的凝聚块的形成、堵塞或附着于配管或泵设备内等问题,具有共聚pha混合物的工业上的分离及纯化变得困难的倾向。
58.考虑到由该混合物形成的成型体的机械特性与该混合物的加工特性、工业上的操作性的平衡,上述共聚pha混合物整体显示的3hh的平均组成比率优选为10~22摩尔%、更优选为11~20摩尔%、进一步优选为12~18摩尔%、特别优选为13~17摩尔%。
59.(mibk分级法)
60.上述共聚pha混合物可以通过利用了在甲基异丁基酮(mibk)中的溶解度之差的溶剂分级法而分级为3hh的平均组成比率高的pha级分(i)和3hh的平均组成比率低的pha级分(ii)。pha的3hh组成比率越高,在mibk中的溶解度越高。因此,在使上述共聚pha混合物全部溶解于高温的mibk之后,降低温度,使3hh组成比率低的pha成分析出,由此能够分级为上述pha级分(i)和pha级分(ii)。
61.以下,对具体的分级步骤进行说明。首先,称取共聚pha混合物约100mg至螺口试管,加入mibk 10ml后将盖关闭。然后,在140℃下振荡混合1~3小时左右并进行加热,使共聚pha混合物完全溶解。在完全溶解后,于25℃下放置1分钟,使温度降低至沸点以下,快速将全部溶解液转移至预先测定了重量的离心管,将盖关闭。将加盖的离心管进一步在25℃下放置15分钟,使溶解物的一部分析出。通过离心分离(9000rpm、5分钟),将析出物和溶解液进行分离,将溶解液全部转移至预先测定了重量的铝杯。向残留有析出物的离心管中加入mibk 10ml,用涡旋混合器混合,再次进行离心分离(9000rpm、5分钟),将溶液转移至装有上述溶解液的铝杯。将铝杯在120℃下加热30分钟,将mibk挥发,使溶解物析出。进一步,将铝杯中残留的析出物和离心管中残留的析出物分别在100℃下真空干燥6小时。将铝杯中残
留的析出物作为pha级分(i),另外,将离心管中残留的析出物作为pha级分(ii),分别进行称量。确认pha级分(i)和pha级分(ii)的合计重量与最初测定的共聚pha混合物的重量之差为
±
3%以内。
62.(共聚pha混合物所显示出的熔融行为)
63.对于上述共聚pha混合物而言,对其进行测定而得到的差示扫描量热分析中的最高的熔融峰温度优选为130℃以上。通过满足该条件,共聚pha混合物的结晶凝固可以在短时间进行,能够使该共聚pha混合物的加工性变得良好。上述最高的熔融峰温度优选为130~165℃、更优选为130~155℃。
64.上述共聚pha混合物所显示出的最高的熔融峰温度通过以下方式测定,使用差示扫描量热测定装置,称量上述共聚pha混合物约2mg,在以10℃/分的升温速度从-30℃升温至200℃时所得到的dsc曲线中,以最高温侧的熔融峰的温度的形式测定。
65.对于上述共聚pha混合物而言,除了最高温侧的熔融峰以外,还可以在比该峰更低温侧的区域具有其它熔融峰,例如,可以在100℃以下也具有熔融峰。
66.(共聚pha混合物生产微生物)
67.制造上述共聚pha混合物时使用的微生物(以下也称为“共聚pha混合物生产微生物”)只要是能够发酵生产上述共聚pha混合物的微生物即可,没有特别限定,可以是原本蓄积pha的野生株,也可以是将这样的野生株进行人工突变处理而得到的突变株、或者通过利用基因工程方法导入外来的pha合成酶基因而赋予了pha蓄积能力的菌株。
68.作为上述共聚pha混合物生产微生物,或者在该微生物为转化体的情况下,作为该转化体的宿主,没有没有特别限定,可以列举例如,属于罗尔斯通氏菌(ralstonia)属、贪铜菌(cupriavidus)属、沃斯特氏菌(wautersia)属、气单胞菌属(aeromonas)属、埃希氏菌(escherichia)属、产碱杆菌(alcaligenes)属、假单胞菌(pseudomonas)属等的细菌类作为优选的例子。从安全性及pha生产性的观点考虑,更优选为属于罗尔斯通氏菌属、贪铜菌属、气单胞菌属、沃斯特氏菌属的细菌,进一步优选为属于贪铜菌属或气单胞菌属的细菌,更进一步优选为属于贪铜菌属的细菌,特别优选为杀虫贪铜菌(cupriavidus nec ator)。
69.上述共聚pha混合物生产微生物优选为能够效率良好地分别生产3hh的平均组成比率不同的2种pha、且具有编码对3-羟基己酰基-coa的聚合活性彼此不同的2种pha合成酶的基因的微生物。3-羟基己酰基-coa是ph a中包含的3hh结构单元的前体。通过使上述微生物具有编码对3-羟基己酰基-coa的聚合活性彼此不同的2种pha合成酶的基因,可以在该微生物的细胞内发酵生产3hh的平均组成比率有很大不同的2种pha的混合物、即上述共聚pha混合物。上述微生物只要至少具有2种编码对3-羟基己酰基-coa的聚合活性彼此不同的pha合成酶的基因即可,只要能够发酵生产上述共聚pha混合物,也可以具有3种以上的上述基因。
70.上述对3-羟基己酰基-coa的聚合活性彼此不同的2种pha合成酶没有特别限定,该2种pha合成酶间的氨基酸序列的序列同一性优选为90%以下、更优选为80%以下、进一步优选为70%以下。通常认为,pha合成酶形成二聚体等多聚体而发挥功能。在上述2种pha合成酶间的氨基酸序列的序列同源性高于90%的情况下,可以认为该2种pha合成酶形成杂合二聚体等而可能无法生产上述共聚pha混合物。
71.作为上述对3-羟基己酰基-coa的聚合活性彼此不同的2种pha合成酶的组合的具
al.,science,343:80-84,2014)等公知的技术。例如,在crispr/cas9系统中,向导rna(grna)具有能够与待破坏的β-酮硫解酶基因的碱基序列的一部分结合的序列,具有靶向转运cas9的作用。另外,通过该基因周边的碱基序列的缺失、置换、添加、插入等的突变,使基因的转印/翻译效率、mrna的稳定性降低等,也能够使该酶活性消失或降低。
77.为了效率良好地生产3hh的平均组成比率高的共聚pha混合物,上述共聚pha混合物生产微生物优选为具有编码显示出r体特异性烯酰-coa水合酶活性的蛋白质的基因的微生物。r体特异性烯酰-coa水合酶在微生物细胞内具有将己酰基-coa转变为3-羟基己酰基-coa的功能。因此可以推测,通过使上述微生物具有编码显示出r体特异性烯酰-coa水合酶活性的蛋白质的基因,向3-羟基己酰基-coa的转变量会增大,结果是生产的共聚pha混合物所显示出的3hh的平均组成比率增高。
78.具有编码显示出上述r体特异性烯酰-coa水合酶活性的蛋白质的基因的微生物可以是原本就具有该基因的微生物,也可以是通过基因工程方法导入了外源性的该基因的微生物。
79.作为编码具有上述外源性的r体特异性烯酰-coa水合酶活性的蛋白质的基因,可以列举例如:编码具有序列号11中记载的氨基酸序列的r体特异性烯酰-coa水合酶的来源于豚鼠气单胞菌(aeromonas caviae)的基因、编码具有序列号12或序列号13中记载的氨基酸序列的r体特异性烯酰-coa水合酶的来源于杀虫贪铜菌源的基因、编码具有序列号14中记载的氨基酸序列的酶的来源于解脂耶氏酵母(yarrowia lipolytica)的multifunctional enzyme type 2(mfe2)基因、编码具有序列号15中记载的氨基酸序列的酶的来源于黑腹果蝇(drosophila melanogaster)的mfe2基因、或者编码相对于序列号11~15中记载的各氨基酸序列具有85%以上、优选为90%以上、更优选为95%以上、特别优选为99%以上的序列同一性且具有r体特异性烯酰-coa水合酶活性的蛋白质的基因等,但并不限定于此。
80.另外,为了增强编码具有r体特异性烯酰-coa水合酶活性的蛋白质的基因的表达,例如,可以如国际公开第2015/115619号中记载的那样进行用于增强该基因的表达的表达调节序列(启动子序列和/或sd序列)的修饰。
81.在共聚pha混合物生产微生物导入了外源性的基因的情况下,导入基因可以存在于成为宿主的微生物所具有的染色体上、或质粒、巨大质粒等的dna上。从导入基因的保持的观点考虑,优选存在于微生物所具有的染色体或巨大质粒上,更优选存在于微生物所具有的染色体上。另外,在使成为宿主的微生物原本保持的基因的表达量增加的情况下,通过对该基因的上游的碱基序列进行置换、缺失或添加等,也可以增加基因的表达量。
82.在微生物所具有的dna上对任意的dna进行部位特异性地置换或插入的方法、或者使微生物所具有的dna的任意部位缺失的方法是本领域技术人员公知的,可以在制造本实施方式的转化微生物时使用。虽然没有特别限定,但作为代表性的方法,可以列举:利用了转座子和同源重组的机构的方法(ohman等,j.bacteriol.,vol.162:p.1068(1985))、以利用同源重组的机构引起的部位特异性的导入和基于第二阶段的同源重组的脱落作为原理的方法(noti等,methods enzymol.,vol.154,p.197(1987))、将使来源于枯草芽孢杆菌(bacillus subtilis)的sacb基因共存并通过第二阶段的同源重组而使基因脱落的微生物株容易地分离为蔗糖添加培养基耐性株的方法(schweizer,mol.microbiol.,vol.6,
p.1195(1992);lenz等,j.bacteriol.,vol.176,p.4385(1994))等。另外,作为向细胞导入载体的方法,也没有特别限定,可以列举例如:氯化钙法、电穿孔法、聚乙二醇法、原生质球法等。
83.需要说明的是,对于基因克隆、基因重组技术,可以利用sambrook,j.et al.,molecular cloning,a laboratory manual,cold spring harbor laboratory press(1989或2001)等中记载的技术。
84.用于使导入基因表达的启动子没有特别限定。可以使用杀虫贪铜菌的phac1基因的启动子、phap1基因的启动子、来源于大肠杆菌的lac启动子、lacuv5启动子、trc启动子、tic启动子、tac启动子、或人工制备的具有序列号16所示的来源于大肠杆菌的修饰碱基序列的lacn17启动子、人工制备的具有序列号17所示的来源于大肠杆菌的修饰碱基序列的lacn19启动子等。
85.(微生物的培养)
86.通过对上述共聚pha混合物生产微生物进行培养,可以使上述共聚pha混合物蓄积于微生物细胞内。作为对上述共聚pha混合物生产微生物进行培养的方法,可以依据通常的微生物培养法,只要在存在适当碳源的培养基中进行培养即可。培养基组成、碳源的添加方法、培养规模、通气搅拌条件、培养温度、培养时间等没有特别限定。碳源优选连续地或间歇地添加于培养基。
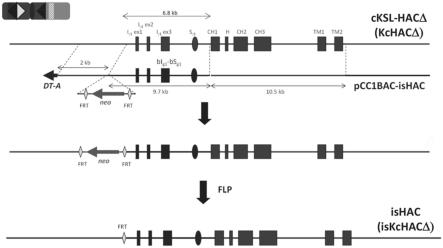
87.作为培养时的碳源,只要上述共聚pha混合物生产微生物能够同化,也可以使用任意的碳源。虽然没有特别限定,但可以列举例如:葡萄糖、果糖、蔗糖、木糖等糖类;棕榈油、棕榈仁油(也包括作为将它们分离而得到的低熔点分级的棕榈油精、棕榈双油精(palm double olein)、棕榈仁油精等)、玉米油、椰子油、橄榄油、大豆油、菜籽油、麻疯树油等油脂、其分级油类、或其纯化副产物;月桂酸、油酸、硬脂酸、棕榈酸、肉豆蔻酸等脂肪酸、其衍生物、或甘油等。另外,在上述共聚pha混合物生产微生物可以利用二氧化碳、一氧化碳、甲烷、甲醇、乙醇等气体、醇类的情况下,也可以使用这些作为碳源。
88.其中,碳源优选包含油脂或脂肪酸。作为上述油脂,优选为植物油或其分级油类。上述油脂或脂肪酸的链长优选更短,上述碳源更优选包含碳原子数6~12的中链脂肪酸、或该中链脂肪酸的甘油酯,上述碳源进一步优选包含己酸。在碳源中包含的脂肪酸的碳原子数为6~12时,β氧化中的碳原子数6的中间代谢物的生成量增多,可以认为能够效率良好地得到3hh的平均组成比率高的pha级分。
89.在上述共聚pha混合物的制造中,优选使用包含作为上述碳源、碳源以外的营养源的氮源、无机盐类、其它有机营养源的培养基对上述微生物进行培养。虽然并不限定于以下,但作为氮源,可以列举例如:氨;氯化铵、硫酸铵、磷酸铵等铵盐;蛋白胨、肉提取物、酵母提取物等。作为无机盐类,可以列举例如:磷酸二氢钾、磷酸氢二钠、磷酸镁、硫酸镁、氯化钠等。作为其它的有机营养源,可以列举例如:甘氨酸、丙氨酸、丝氨酸、苏氨酸、脯氨酸等氨基酸、维生素b1、维生素b12、维生素c等维生素等。
90.在将上述共聚pha混合物生产微生物的培养进行适当的时间而使上述共聚pha混合物蓄积于微生物细胞内之后,使用公知的方法回收上述共聚pha混合物。对于回收方法,没有特别限定,在工业上,优选为环境负担低的基于水体系中的分离/纯化的回收。例如,在培养结束后,施加机械性的剪切力或使用表面活性剂、碱、酶等对细胞进行破碎,由此,可以
得到pha以外的细胞成分溶解于水中而得到的细胞破碎液。通过上述细胞破碎液的过滤、离心分离而将上述共聚pha混合物从水相中分离后使其干燥,可以回收上述共聚pha混合物。
91.实施例
92.以下,通过实施例对本发明更具体地进行说明。但是,本发明并不受这些实施例的限定。需要说明的是,全部的基因操作例如可以通过molecular cloning(cold spring harbor laboratory press(1989))中记载的方式进行。另外,基因操作中使用的酶、克隆宿主等可以从市场的供给商购入并按照其说明而使用。需要说明的是,作为酶,只要能够用于基因操作即可,没有特别限定。
93.(微生物株制备例1)共聚pha混合物生产微生物株(1)的制备
94.首先,进行了pha合成酶基因破坏用质粒的制备。如下所述进行了制备。
95.通过使用了合成寡聚dna的pcr,得到了具有杀虫贪铜菌h16株的phac1结构基因(pha合成酶基因)的上游及下游的碱基序列的dna片段(序列号18)。用限制酶swai消化该dna片段,用dna连接酶(ligation high(东洋纺株式会社制))将得到的dna片段与同样经swai消化的日本特开2007-259708号公报中记载的载体pns2x-sacb连接,制备了pha合成酶基因破坏用质粒载体pns2x-sacb phac1ud。
96.接着,使用pha合成酶基因破坏用质粒载体pns2x-sacb phac1ud如下所述进行了pha合成酶基因破坏株的制备。
97.用pha合成酶基因破坏用质粒载体pns2x-sacb phac1ud对大肠杆菌s17-1株(atcc47055)进行转化,将由此得到的转化微生物和knk005dz/trc-j4b/dbktb/da1528株在nutrient agar培养基(difco公司制)上进行混合培养,进行了接合传递。
98.需要说明的是,knk005dz/trc-j4b/dbktb/da1528株是使杀虫贪铜菌h16株的染色体上的phaz1基因、phaz2基因及phaz6基因缺失,将染色体上的pha合成酶基因置换为来源于豚鼠气单胞菌的pha合成酶基因的修饰体(编码具有序列号2中记载的氨基酸序列的pha合成酶的基因、即n149s/d171g突变体基因),染色体上的r体特异性烯酰-coa水合酶基因的表达得到增强,使bktb结构基因缺失,并且进一步使a1528结构基因缺失而得到的菌株,可以依据pct国际公开第2019/142845号中记载的方法制备。
99.将得到的培养液播种于包含250mg/l的卡那霉素的西蒙斯琼脂培养基(柠檬酸钠2g/l、氯化钠5g/l、七水硫酸镁0.2g/l、磷酸二氢铵1g/l、磷酸氢二钾1g/l、琼脂15g/l、ph6.8),选择在琼脂培养基上生长的菌株,得到了在knk005dz/trc-j4b/dbktb/da1528株的染色体上导入了质粒的菌株。将该株用nutrient broth培养基(difco公司制)进行2代培养后,稀释并涂布于包含15%蔗糖的nutrient agar培养基上,得到了生长的菌株作为质粒发生了脱落的菌株。进一步,通过基于pcr及dna测序的分析,分离了染色体上的pha合成酶基因缺失的1株菌株。将该基因破坏株命名为knk005dz/dnsdg/trc-j4b/dbktb/da1528株。
100.此外,进行了pha合成酶基因导入用质粒的制备。如下所述进行了制备。
101.通过使用了合成寡聚dna的pcr,得到了dna片段(序列号19),该dna片段具有杀虫贪铜菌h16株的bktb结构基因(β-酮硫解酶基因)的上游及下游的碱基序列、作为大肠杆菌的lac启动子修饰体的lacn19启动子、以及编码具有序列号2中记载的氨基酸序列的pha合成酶的基因的碱基序列。用限制酶swai消化该dna片段,用dna连接酶(ligation high(东洋纺株式会社制))将得到的dna片段与同样经swai消化的日本特开2007-259708号公报中记
sacb连接,制备了pha合成酶基因导入用质粒载体pns2x-sacb bktbu-lac-nsdg-bktbd。
111.接着,使用pha合成酶基因导入用质粒载体pns2x-sacb bktbu-lac-nsdg-bktbd,如下所述进行了pha合成酶基因导入株的制备。
112.通过使用了与上述相同的接合传递的方法将pha合成酶基因导入用质粒载体pns2x-sacb bktbu-lac-nsdg-bktb导入knk005dz/dnsdg/trc-j4b/dbktb/da1528株。进一步,通过与上述相同的培养及基于包含15%蔗糖的nutrient agar培养基的筛选,分离了在染色体上的原本bktb基因存在的位置导入有lac启动子及编码具有序列号2中记载的氨基酸序列的pha合成酶的基因的1株菌株。将得到的菌株命名为knk005dz/dnsdg/trc-j4b/dbktb::lac-nsdg/da1528株。
113.接着,通过使用了与上述相同的接合传递的方法将pha合成酶基因导入用质粒载体pns2x-sacb a1528u-lacn17-acnsre12-a1528d导入knk005dz/dnsdg/trc-j4b/dbktb::lac-nsdg/da1528株。进一步,通过与上述相同的培养及基于包含15%蔗糖的nutrient agar培养基的筛选,分离了在染色体上的原本a1528基因存在的位置导入有lacn17启动子及编码具有序列号6中记载的氨基酸序列的pha合成酶的基因的1株菌株。将得到的菌株命名为knk005dz/dnsdg/trc-j4b/dbktb::lac-nsdg/da1528::lacn17-acnsre12株(以下,有时也称为共聚pha混合物生产微生物株(2))。
114.需要说明的是,共聚pha混合物生产微生物株(2)是使杀虫贪铜菌h16株的染色体上的phaz1基因、phaz2基因及phaz6基因缺失,导入了编码具有序列号2中记载的氨基酸序列的来源于气单胞菌属的pha合成酶突变体的基因和编码具有序列号6中记载的氨基酸序列的pha合成酶的基因(即,将来源于气单胞菌属微生物的聚羟基烷酸酯合成酶基因的一部分和来源于贪铜菌属微生物的聚羟基烷酸酯合成酶基因的一部分组合而成的编码pha合成酶的基因),染色体上的r体特异性烯酰-coa水合酶基因的表达得到增强,使bktb结构基因(β-酮硫解酶基因)缺失,并且进一步使a1528结构基因(β-酮硫解酶基因)缺失的菌株。
115.(微生物株制备例3)共聚pha混合物生产微生物株(3)的制备
116.首先,进行了pha合成酶基因表达用质粒的制备。如下所述进行了制备。通过使用了合成寡聚dna的pcr,得到了具有作为大肠杆菌的lac启动子修饰体的lacn17启动子的dna片段(序列号22)。用限制酶ecori及muni消化该dna片段,将用muni切断国际公开2007/049716号中记载的质粒载体pcup2而得到的产物与得到的dna片段连接,筛选出以pcup2的限制酶spei识别序列位于lacn17启动子的下游的朝向连接的产物,得到了pcup2-lacn17。接着,通过使用了合成寡聚dna的pcr,得到了dna片段(序列号23),该dna片段(序列号23)具有编码具有序列号6中记载的氨基酸序列的pha合成酶的基因及编码具有序列号2中记载的氨基酸序列的pha合成酶的基因的碱基序列。用限制酶muni及spei消化该dna片段,将得到的dna片段与用muni及spei切断pcup2-lacn17而得到的产物连接,得到了pha合成酶基因表达用质粒pcup2-lacn17-acnsre12-nsdg。
117.接着,将pha合成酶基因表达用质粒pcup2-lacn17-acnsre12-nsdg导入knk005dz/dnsdg/trc-j4b/dbktb/da1528株,得到了pcup2-lacn17-acnsre12-nsdg/knk005dz/dnsdg/trc-j4b/dbktb/da1528株(以下,有时也称为共聚pha混合物生产微生物株(3))。
118.如下所述,通过电穿孔法进行了质粒载体向细胞的导入。基因导入装置使用biorad公司制的gene pulser,样品池同样地使用了biorad公司制的gap 0.2cm。向样品池
中注入感受态细胞400μl和表达载体20μl并设置于脉冲装置,在静电容量25μf、电压1.5kv、电阻值800ω的条件下施加电脉冲。在脉冲后,用nutrientbroth培养基(difco公司制)在30℃下将样品池内的菌液进行3小时振荡培养,用选择板(nutrientagar培养基(difco公司制)、卡那霉素100mg/l)在30℃下培养2天,得到了生长的共聚pha混合物生产微生物株(3)。
119.需要说明的是,共聚pha混合物生产微生物株(3)是使杀虫贪铜菌h16株的染色体上的phaz1基因、phaz2基因及phaz6基因缺失,导入了编码具有序列号2中记载的氨基酸序列的来源于气单胞菌属的pha合成酶突变体的基因和编码具有序列号6中记载的氨基酸序列的pha合成酶的基因(即,将来源于气单胞菌属微生物的聚羟基烷酸酯合成酶基因的一部分和来源于贪铜菌属微生物的聚羟基烷酸酯合成酶基因的一部分组合而成的编码pha合成酶的基因),染色体上的r体特异性烯酰-coa水合酶基因的表达得到增强,使bktb结构基因(β-酮硫解酶基因)缺失,并且进一步使a1528结构基因(β-酮硫解酶基因)缺失的菌株。
120.(微生物株制备例4)共聚pha混合物生产微生物株(4)的制备
121.首先,进行了pha合成酶基因导入用质粒的制备。如下所述进行了制备。
122.通过使用了合成寡聚dna的pcr,得到了dna片段(序列号24),该dna片段(序列号24)具有杀虫贪铜菌h16株的bktb结构基因(β-酮硫解酶基因)的上游及下游的碱基序列、大肠杆菌的lac启动子、编码具有序列号6中记载的氨基酸序列的pha合成酶的基因、以及编码具有序列号2中记载的氨基酸序列的pha合成酶的基因的碱基序列。用限制酶swai消化该dna片段,用dna连接酶(ligation high(东洋纺株式会社制))将得到的dna片段与同样经swai消化的日本特开2007-259708号公报中记载的载体pns2x-sacb连接,制备了pha合成酶基因导入用质粒载体pns2x-sacb bktbu-lac-acnsre12-nsdg-bktbd。
123.接着,使用pha合成酶基因导入用质粒载体pns2x-sacb bktbu-lac-acnsre12-nsdg-bktbd,如下所述进行了pha合成酶基因导入株的制备。
124.通过使用了与上述相同的接合传递的方法将pha合成酶基因导入用质粒载体pns2x-sacb bktbu-lac-acnsre12-nsdg-bktbd导入knk005dz/dnsdg/trc-j4b/dbktb/da1528株。进一步,通过与上述相同的培养及基于包含15%蔗糖的nutrient agar培养基的筛选,分离了在染色体上的原本bktb基因存在的位置导入有lac启动子、编码具有序列号6中记载的氨基酸序列的pha合成酶的基因、以及编码具有序列号2中记载的氨基酸序列的pha合成酶的基因的1株菌株。将得到的菌株命名为knk005dz/dnsdg/trc-j4b/dbktb::lac-acnsre12-nsdg/da1528株(以下,有时也称为共聚pha混合物生产微生物株(4))。
125.需要说明的是,共聚pha混合物生产微生物株(4)是使杀虫贪铜菌h16株的染色体上的phaz1基因、phaz2基因及phaz6基因缺失,导入了编码具有序列号2中记载的氨基酸序列的来源于气单胞菌属的pha合成酶突变体的基因和编码具有序列号6中记载的氨基酸序列的pha合成酶的基因(即,将来源于气单胞菌属微生物的聚羟基烷酸酯合成酶基因的一部分和来源于贪铜菌属微生物的聚羟基烷酸酯合成酶基因的一部分组合而成的编码pha合成酶的基因),使染色体上的r体特异性烯酰-coa水合酶基因的表达得到增强,使bktb结构基因(β-酮硫解酶基因)缺失,并且进一步使a1528结构基因(β-酮硫解酶基因)缺失的菌株。
126.(微生物株制备例5)共聚pha混合物生产微生物株(5)的制备
127.首先,进行了pha合成酶基因表达用质粒的制备。如下所述进行了制备。通过使用了合成寡聚dna的pcr,得到了dna片段(序列号26),该dna片段(序列号26)具有编码具有序
列号7中记载的氨基酸序列的pha合成酶的基因、编码具有序列号8中记载的氨基酸序列的pha合成酶的基因、以及具有编码序列号3中记载的氨基酸序列的pha合成酶的基因的碱基序列。用限制酶muni及spei消化该dna片段,将得到的dna片段与用muni及spei切断pcup2-lacn17而得到的产物连接,得到了pha合成酶基因表达用质粒pcup2-lacn17-rcyb4-nsdgst。
128.接着,通过微生物株制备例3中记载的电穿孔法将pha合成酶基因表达用质粒pcup2-lacn17-rcyb4-nsdgst导入knk005dz/dnsdg/trc-j4b/dbktb/da1528株,得到了pcup2-lacn17-rcyb4-nsdgst/knk005dz/dnsdg/trc-j4b/dbktb/da1528株(以下,有时称为共聚pha混合物生产微生物株(5))。
129.需要说明的是,共聚pha混合物生产微生物株(5)是使杀虫贪铜菌h16株的染色体上的phaz1基因、phaz2基因及phaz6基因缺失,导入了编码具有序列号3中记载的氨基酸序列的来源于气单胞菌属的pha合成酶突变体的基因、以及编码具有序列号7及序列号8中记载的氨基酸序列的来源于芽孢杆菌属的pha合成酶的基因,染色体上的r体特异性烯酰-coa水合酶基因的表达得到增强,使bktb结构基因(β-酮硫解酶基因)缺失,并且进一步使a1528结构基因(β-酮硫解酶基因)缺失的菌株。
130.(微生物株制备例6)共聚pha混合物生产微生物株(6)的制备
131.首先,进行了pha合成酶基因导入用质粒的制备。如下所述进行了制备。通过使用了合成寡聚dna的pcr,得到了dna片段(序列号27),该dna片段(序列号27)具有杀虫贪铜菌h16株的a1528结构基因(β-酮硫解酶基因)的上游及下游的碱基序列、作为大肠杆菌的lac启动子修饰体的lacn17启动子、以及编码具有序列号5中记载的氨基酸序列的pha合成酶的基因的碱基序列。用限制酶swai消化该dna片段,用dna连接酶(ligation high(东洋纺株式会社制))将得到的dna片段与同样经swai消化的日本特开2007-259708号公报中记载的载体pns2x-sacb连接,制备了pha合成酶基因导入用质粒载体pns2x-sacb a1528u-lacn17-csag-a1528d。
132.接着,通过使用了与上述相同的接合传递的方法将pha合成酶基因导入用质粒载体pns2x-sacb a1528u-lacn17-csag-a1528d导入knk005dz/dnsdg/trc-j4b/dbktb::lac-nsdg/da1528株。进一步,通过与上述相同的培养及基于包含15%蔗糖的nutrient agar培养基的筛选,分离了在染色体上的原本a1528基因存在的位置导入有lacn17启动子及编码具有序列号5中记载的氨基酸序列的pha合成酶的基因的1株菌株。将得到的菌株命名为knk005dz/dnsdg/trc-j4b/dbktb::lac-nsdg/da1528::lacn17-csag株(以下,有时也称为共聚pha混合物生产微生物株(6))。
133.需要说明的是,共聚pha混合物生产微生物株(6)是使杀虫贪铜菌h16株的染色体上的phaz1基因、phaz2基因及phaz6基因缺失,导入了编码具有序列号2中记载的氨基酸序列的来源于气单胞菌属的pha合成酶突变体的基因和编码具有序列号5中记载的氨基酸序列的来源于色杆菌属的pha合成酶的基因,染色体上的r体特异性烯酰-coa水合酶基因的表达得到增强,使bktb结构基因(β-酮硫解酶基因)缺失,并且进一步使a1528结构基因(β-酮硫解酶基因)缺失的菌株。
134.(微生物株制备例7)p(3hb-co-3hh)生产微生物株(1)的制备
135.knk005dz株(以下,有时也称为p(3hb-co-3hh)生产微生物株(1))是在杀虫贪铜菌
h16株的染色体上导入来源于气单胞菌属的pha合成酶基因(编码具有序列号2中记载的氨基酸序列的pha合成酶的基因)、并且使染色体上的作为pha分解酶基因的phaz1、2、6基因缺失的转化微生物。该转化微生物可以依据pct国际公开第2014/065253号中记载的方法而制备。
136.(微生物株制备例8)p(3hb-co-3hh)生产微生物株(2)的制备
137.首先,进行了pha合成酶基因导入用质粒的制备。如下所述进行了制备。
138.通过使用了合成寡聚dna的pcr,得到了dna片段(序列号28),该dna片段(序列号28)具有杀虫贪铜菌h16株的phaz6结构基因的上游及下游的碱基序列、作为大肠杆菌的lac启动子修饰体的lacn17启动子、以及编码具有序列号2中记载的氨基酸序列的pha合成酶的基因的碱基序列。用限制酶swai消化该dna片段,用dna连接酶(ligation high(东洋纺株式会社制))将得到的dna片段与同样经swai消化的日本特开2007-259708号公报中记载的载体pns2x-sacb连接,制备了pha合成酶基因导入用质粒载体pns2x-sacb phaz6u-lacn17-nsdg-phaz6d。
139.接着,通过使用了与上述相同的接合传递的方法将pha合成酶基因导入用质粒载体pns2x-sacb phaz6u-lacn17-nsdg-phaz6d导入knk005dz/trc-j4b/dbktb株。
140.需要说明的是,knk005dz/trc-j4b/dbktb株是使杀虫贪铜菌h16株的染色体上的phaz1基因、phaz2基因及phaz6基因缺失,将染色体上的pha合成酶基因置换为来源于豚鼠气单胞菌的pha合成酶基因的修饰体(编码具有序列号2中记载的氨基酸序列的pha合成酶的基因,即n149s/d171g突变体基因),染色体上的r体特异性烯酰-coa水合酶基因的表达得到增强,使bktb结构基因缺失的菌株,可以依据pct国际公开第2019/142845号中记载的方法而制备。
141.进一步,通过与上述相同的培养及基于包含15%蔗糖的nutrient agar培养基的筛选,分离了在染色体上的原本phaz6基因存在的位置导入有lacn17启动子及编码具有序列号2中记载的氨基酸序列的pha合成酶的基因的1株菌株。将得到的菌株命名为knk005dz/trc-j4b/z6::lacn17-nsdg/dbktb株(以下,有时也称为p(3hb-co-3hh)生产微生物株(2))。
142.(微生物株制备例9)p(3hb-co-3hh)生产微生物株(3)的制备
143.首先,通过使用了与上述相同的接合传递的方法将pha合成酶基因破坏用质粒载体pns2x-sacb phac1ud导入knk005dz/trc-j4b/dbktb株。
144.进一步,通过与上述相同的培养及基于包含15%蔗糖的nutrient agar培养基的筛选,分离了染色体上的pha合成酶基因缺失的1株菌株。将得到的菌株命名为knk005dz/dnsdg/trc-j4b/dbktb株。
145.接着,进行了pha合成酶基因导入用质粒的制备。如下所述进行了制备。
146.通过使用了合成寡聚dna的pcr,得到了dna片段(序列号29),该dna片段(序列号29)具有杀虫贪铜菌h16株的phac1结构基因的上游及下游的碱基序列和编码具有序列号3中记载的氨基酸序列的pha合成酶的基因的碱基序列。用限制酶swai消化该dna片段,用dna连接酶(ligation high(东洋纺株式会社制))将得到的dna片段与同样经swai消化的日本特开2007-259708号公报中记载的载体pns2x-sacb连接,制备了pha合成酶基因导入用质粒载体pns2x-sacb phac1u-nsdgst-phac1d。
147.接着,通过使用了与上述相同的接合传递的方法将pha合成酶基因导入用质粒载
体pns2x-sacb phac1u-nsdgst-phac1d导入knk005dz/dnsdg/trc-j4b/dbktb株。
148.进一步,通过与上述相同的培养及基于包含15%蔗糖的nutrient agar培养基的筛选,分离了在染色体上的原本phac1基因存在的位置导入有编码具有序列号3中记载的氨基酸序列的pha合成酶的基因的1株菌株。将得到的菌株命名为knk005dz/nsdgst/trc-j4b/dbktb株。
149.接下来,进行了pha合成酶基因表达用质粒的制备。如下所述进行了制备。通过使用了合成寡聚dna的pcr,得到了dna片段(序列号30),该dna片段(序列号30)具有编码具有序列号3中记载的氨基酸序列的pha合成酶的基因的碱基序列。用限制酶muni及spei消化该dna片段,将得到的dna片段与用muni及spei切断国际公开2007/049716号中记载的pcup2而得到的产物连接,得到了pcup2-nsdgst。接着,通过使用了合成寡聚dna的pcr,得到了具有trp启动子的dna片段(序列号31)。用限制酶muni消化该dna片段,将得到的dna片段与用muni切断pcup2-nsdgst而得到的产物以编码pha合成酶的基因位于trp启动子的下游的朝向连接,得到了pha合成酶基因表达用质粒pcup2-trp-nsdgst。
150.接着,通过微生物株制备例3中记载的电穿孔法将pha合成酶基因表达用质粒pcup2-trp-nsdgst导入knk005dz/nsdgst/trc-j4b/dbktb株,得到了pcup2-trp-nsdgst/knk005dz/nsdgst/trc-j4b/dbktb株(以下,有时也称为p(3hb-co-3hh)生产微生物株(3))。
151.需要说明的是,p(3hb-co-3hh)生产微生物株(3)是使杀虫贪铜菌h16株的染色体上的phaz1基因、phaz2基因及phaz6基因缺失,导入了编码具有序列号3中记载的氨基酸序列的来源于气单胞菌属的pha合成酶突变体的基因,染色体上的r体特异性烯酰-coa水合酶基因的表达得到增强,使bktb结构基因(β-酮硫解酶基因)缺失的菌株。
152.(微生物株制备例10)p(3hb-co-3hh)生产微生物株(4)的制备
153.首先,通过使用了与上述相同的接合传递的方法将pha合成酶基因导入用质粒载体pns2x-sacb phac1u-nsdgst-phac1d导入knk005dz/dnsdg/trc-j4b/dbktb/da1528株。
154.进一步,通过与上述相同的培养及基于包含15%蔗糖的nutrient agar培养基的筛选,分离了在染色体上的原本phac1基因存在的位置导入有编码具有序列号3中记载的氨基酸序列的pha合成酶的基因的1株菌株。将得到的菌株命名为knk005dz/nsdgst/trc-j4b/dbktb/da1528株。
155.接着,通过微生物株制备例3中记载的电穿孔法将pha合成酶基因表达用质粒pcup2-trp-nsdgst导入knk005dz/nsdgst/trc-j4b/dbktb/da1528株,得到了pcup2-trp-nsdgst/knk005dz/nsdgst/trc-j4b/dbktb/da1528株(以下,有时也称为p(3hb-co-3hh)生产微生物株(4))。
156.需要说明的是,p(3hb-co-3hh)生产微生物株(4)是使杀虫贪铜菌h16株的染色体上的phaz1基因、phaz2基因及phaz6基因缺失,导入了编码具有序列号3中记载的氨基酸序列的来源于气单胞菌属的pha合成酶突变体的基因,染色体上的r体特异性烯酰-coa水合酶基因的表达得到增强,使bktb结构基因(β-酮硫解酶基因)缺失,并且进一步使a1528结构基因(β-酮硫解酶基因)缺失的菌株。
157.(实施例1)基于共聚pha混合物生产微生物株(1)的pha生产
158.在下述条件下进行了使用共聚pha混合物生产微生物株(1)的培养研究。
159.(培养基)
160.母种培养基的组成设为1w/v%meat-extract、1w/v%bacto-tryptone、0.2w/v%yeast-extract、0.9w/v%na2hpo4·
12h2o、0.15w/v%kh2po4、(ph6.8)。
161.前培养培养基的组成设为1.1w/v%na2hpo4·
12h2o、0.19w/v%kh2po4、1.29w/v%(nh4)2so4、0.1w/v%mgso4·
7h2o、2.5w/v%棕榈油精油、0.5v/v%微量金属盐溶液(在0.1n盐酸中溶有1.6w/v%fecl3·
6h2o、1w/v%cacl2·
2h2o、0.02w/v%cocl2·
6h2o、0.016w/v%cuso4·
5h2o、0.012w/v%nicl2·
6h2o而成的溶液)。
162.pha生产培养基的组成设为0.385w/v%na2hpo4·
12h2o、0.067w/v%kh2po4、0.291w/v%(nh4)2so4、0.1w/v%mgso4·
7h2o、0.5v/v%微量金属盐溶液(在0.1n盐酸中溶有1.6w/v%fecl3·
6h2o、1w/v%cacl2·
2h2o、0.02w/v%cocl2·
6h2o、0.016w/v%cuso4·
5h2o、0.012w/v%nicl2·
6h2o而成的溶液)。
163.(pha蓄积量比例的测定方法)
164.如下所述测定了pha蓄积量相对于干燥菌体的比例。通过离心分离从培养液中回收菌体,用乙醇清洗,进行冷冻干燥,得到干燥菌体,测定了重量。向得到的干燥菌体1g中添加100ml的氯仿,在室温下搅拌一昼夜,提取出菌体内的pha(共聚pha混合物)。滤去菌体残渣后,用蒸发器浓缩至总容量达到30ml,然后,逐步加入90ml的己醇,缓慢搅拌并放置1小时。将析出的pha滤取后,在50℃下真空干燥3小时。测定干燥pha的重量,计算出pha蓄积量相对于干燥菌体量所占的比例。
165.(pha级分(i)及(ii)的重量比例的测定方法)
166.如下所述测定了共聚pha混合物中的pha级分(i)及(ii)的重量比例。首先,通过上述mibk分级法将干燥pha分级为pha级分(i)和pha级分(ii),分别称量。接着,计算出各级分相对于pha级分(i)和pha级分(ii)的合计重量的重量比例。
167.(3hh的平均组成比率的测定方法)
168.如下所述测定了共聚pha混合物、pha级分(i)、或pha级分(ii)各自的3hh的平均组成比率。向干燥后的共聚pha混合物、pha级分(i)、或pha级分(ii)约20mg添加1ml的硫酸-甲醇混液(15∶85)和1ml的氯仿并密封,在100℃下加热140分钟,由此得到了pha分解物的甲酯。在冷却后,向其中加入0.5ml的去离子水并充分混合,然后放置至水层和有机层发生分离。然后,通过毛细管气相色谱法分析了分离出的有机层中的pha分解物的单体单元组成。毛细管气相色谱仪使用了岛津制作所gc-17a、毛细管色谱柱使用了gl sciences公司制neutra bond-1(柱长25m、柱内径0.25mm、液膜厚0.4μm)。作为载气,使用了he,色谱柱入口压力设为100kpa,注入了样品1μl。温度条件为:以8℃/分的速度升温至初始温度50~200℃,进一步以30℃/分的速度升温至200~290℃。根据通过上述条件下的分析而得到的峰,计算出共聚pha混合物、pha级分(i)、或pha级分(ii)的3hh的平均组成比率。
169.(共聚pha混合物的熔融峰温度的测定方法)
170.使用差示扫描量热测定装置(perkinelmer公司制dsc8500),称量共聚pha混合物约2mg,求出在以10℃/分的升温速度从-30℃升温至200℃时得到的dsc曲线中检测到的熔融焓为0.5j/g以上的熔融峰的温度。
171.(共聚pha混合物的加工性评价和颗粒制作)
172.将共聚pha混合物4.5g、作为添加剂的季戊四醇(三菱化学株式会社制:noiraizer p)0.045g、山嵛酸酰胺(日本精化株式会社制:bnt-22h)0.0225g、芥酸酰胺(日本精化株式
会社制:neutron-s)0.0225g投入小型混炼机(dsm公司制:dsm xplore 5 model 2005),在滚筒温度170℃、螺杆转速100rpm的条件下混炼5分钟。在混炼结束后,通过模头排出熔融状态的线状树脂组合物,立即投入加热至60℃的水浴中,测定了发生结晶凝固的时间。将100秒钟以内发生凝固的情况评价为加工性良好(
○
)。
173.然后,用钳子裁断在水浴中发生了结晶凝固的线料,制成了树脂组合物颗粒。
174.(撕裂强度的评价)
175.将经过单面脱模处理的pet膜(厚度50μm)的脱模面以与sus板相反的朝向设置在2mm厚的sus板(30cm
×
35cm)上,在上述pet膜上放置树脂组合物颗粒1.3g。进一步,以包围上述树脂组合物颗粒的方式设置了作为间隔物的70μm的垫板。然后,以夹持上述树脂组合物颗粒的方式覆盖与上述sus板相同的板,设置在加热至160℃的压力机(株式会社神藤金属工业所制:压缩成型机nsf-50)的加热压制板上,预热5分钟。在预热后,用2分钟的时间逐渐加压至5mpa,然后保持压力2分钟。压制结束后,在冷却至约20℃的冷却板上冷却至室温,得到了约50μm厚的膜。将该膜在室温23℃、湿度50%的环境中熟化1周,作为膜样品。
176.将通过具有依据jis p-8116规定的标准埃尔门多夫撕裂试验机的功能和结构的轻负载撕裂度试验机(熊谷理机工业株式会社制:no.2037特殊规格机)测定的值除以膜的厚度,作为膜样品的埃尔门多夫撕裂强度。
177.(pha生产培养)
178.如下所述进行了pha生产培养。首先,将共聚pha混合物生产微生物株(1)的甘油原液(50μl)接种于母种培养基(10ml),培养24小时,进行了母种培养。接着,将母种培养液以1.0v/v%接种于加入了1.8l前培养培养基的3l发酵罐(b.e.marubishi公司制mdl-300型)。运行条件设为培养温度30℃、搅拌速度500rpm、通气量1.8l/min,将ph控制为6.7~6.8之间,培养28小时,进行了前培养。ph控制使用了14%氢氧化铵水溶液。
179.接着,将前培养液以5.0v/v%接种于加入了2.5l的pha生产培养基的5l发酵罐(b.e.marubishi公司制mds-u50型)。运行条件设为培养温度33℃、搅拌速度420rpm、通气量2.1l/min,将ph控制在6.7~6.8之间。ph控制使用了25%氢氧化铵水溶液。间歇地添加碳源。作为碳源,使用了棕榈油精油。培养进行至pha蓄积量相对于干燥菌体量的比例达到80%以上。pha蓄积量相对于干燥菌体的比例、共聚pha混合物、pha级分(i)、或pha级分(ii)的3hh的平均组成比率、pha级分(i)及(ii)的重量比例、熔融峰温度及熔融焓、加工性、埃尔门多夫撕裂强度如上所述进行了测定。将结果示于表1。
180.(实施例2)基于共聚pha混合物生产微生物株(2)的pha生产
181.在与实施例1相同的条件下进行了使用共聚pha混合物生产微生物株(2)的培养研究。将pha蓄积量相对于干燥菌体的比例、共聚pha混合物、pha级分(i)、或pha级分(ii)的3hh的平均组成比率、pha级分(i)及(ii)的重量比例、熔融峰温度及熔融焓、加工性、埃尔门多夫撕裂强度示于表1。
182.(实施例3)基于共聚pha混合物生产微生物株(3)的pha生产
183.在与实施例1相同的条件下进行了使用共聚pha混合物生产微生物株(3)的培养研究。将pha蓄积量相对于干燥菌体的比例、共聚pha混合物、pha级分(i)、或pha级分(ii)的3hh的平均组成比率、pha级分(i)及(ii)的重量比例、熔融峰温度及熔融焓、加工性、埃尔门多夫撕裂强度示于表1。
184.(实施例4)基于共聚pha混合物生产微生物株(4)的pha生产
185.在与实施例1相同的条件下进行了使用共聚pha混合物生产微生物株(4)的培养研究。将pha蓄积量相对于干燥菌体的比例、共聚pha混合物、pha级分(i)、或pha级分(ii)的3hh的平均组成比率、pha级分(i)及(ii)的重量比例、熔融峰温度及熔融焓、加工性、埃尔门多夫撕裂强度示于表1。
186.(实施例5)基于共聚pha混合物生产微生物株(5)的pha生产
187.在与实施例1相同的条件下进行了使用共聚pha混合物生产微生物株(5)的培养研究。将pha蓄积量相对于干燥菌体的比例、共聚pha混合物、pha级分(i)、或pha级分(ii)的3hh的平均组成比率、pha级分(i)及(ii)的重量比例、熔融峰温度及熔融焓、加工性、埃尔门多夫撕裂强度示于表1。
188.(实施例6)基于共聚pha混合物生产微生物株(6)的pha生产
189.在与实施例1相同的条件下进行了使用共聚pha混合物生产微生物株(6)的培养研究。pha蓄积量相对于干燥菌体的比例、共聚pha混合物、pha级分(i)、或pha级分(ii)的3hh的平均组成比率、pha级分(i)及(ii)的重量比例、熔融峰温度及熔融焓、加工性、埃尔门多夫撕裂强度示于表1。
190.(比较例1)基于p(3hb-co-3hh)生产微生物株(1)的pha生产
191.在与实施例1相同的条件下进行了使用p(3hb-co-3hh)生产微生物株(1)的培养研究。将pha蓄积量相对于干燥菌体的比例、p(3hb-co-3hh)、mibk可溶性级分、或mibk不溶性级分的3hh的平均组成比率、mibk可溶性级分及mibk不溶性级分的重量比例、熔融峰温度及熔融焓、加工性、埃尔门多夫撕裂强度示于表1。需要说明的是,在各分析中,使用了p(3hb-co-3hh)生产微生物株(1)蓄积得到的pha来代替共聚pha混合物。p(3hb-co-3hh)生产微生物株(1)蓄积得到的pha为p(3hb-co-3hh)。mibk可溶性级分及mibk不溶性级分是指分别通过与pha级分(i)或pha级分(ii)相同的方法得到的级分。
192.(比较例2)基于p(3hb-co-3hh)生产微生物株(2)的pha生产
193.在与实施例1相同的条件下进行了使用p(3hb-co-3hh)生产微生物株(2)的培养研究。将pha蓄积量相对于干燥菌体的比例、p(3hb-co-3hh)、mibk可溶性级分、或mibk不溶性级分的3hh的平均组成比率、mibk可溶性级分及mibk不溶性级分的重量比例、熔融峰温度及熔融焓、加工性、埃尔门多夫撕裂强度示于表1。需要说明的是,在各分析中,使用了p(3hb-co-3hh)生产微生物株(2)蓄积得到的pha来代替共聚pha混合物。p(3hb-co-3hh)生产微生物株(2)蓄积得到的pha为p(3hb-co-3hh)。mibk可溶性级分及mibk不溶性级分是指分别通过与pha级分(i)或pha级分(ii)相同的方法得到的级分。
194.(比较例3)基于p(3hb-co-3hh)生产微生物株(3)的pha生产
195.在与实施例1相同的条件下进行了使用p(3hb-co-3hh)生产微生物株(3)的培养研究。将pha蓄积量相对于干燥菌体的比例、p(3hb-co-3hh)、mibk可溶性级分、或mibk不溶性级分的3hh的平均组成比率、mibk可溶性级分及mibk不溶性级分的重量比例、熔融峰温度及熔融焓、加工性、埃尔门多夫撕裂强度示于表1。需要说明的是,在各分析中,使用了p(3hb-co-3hh)生产微生物株(3)蓄积得到的pha来代替共聚pha混合物。p(3hb-co-3hh)生产微生物株(3)蓄积得到的pha为p(3hb-co-3hh)。mibk可溶性级分及mibk不溶性级分是指分别通过与pha级分(i)或pha级分(ii)相同的方法得到的级分。
196.(比较例4)基于p(3hb-co-3hh)生产微生物株(4)的pha生产
197.在与实施例1相同的条件下进行了使用p(3hb-co-3hh)生产微生物株(4)的培养研究。将pha蓄积量相对于干燥菌体的比例、p(3hb-co-3hh)、mibk可溶性级分、或mibk不溶性级分的3hh的平均组成比率、mibk可溶性级分及mibk不溶性级分的重量比例、熔融峰温度及熔融焓、加工性、埃尔门多夫撕裂强度示于表1。需要说明的是,在各分析中,使用了p(3hb-co-3hh)生产微生物株(4)蓄积得到的pha来代替共聚pha混合物。p(3hb-co-3hh)生产微生物株(4)蓄积得到的pha为p(3hb-co-3hh)。mibk可溶性级分及mibk不溶性级分是指分别通过与pha级分(i)或pha级分(ii)相同的方法得到的级分。
[0198][0199]
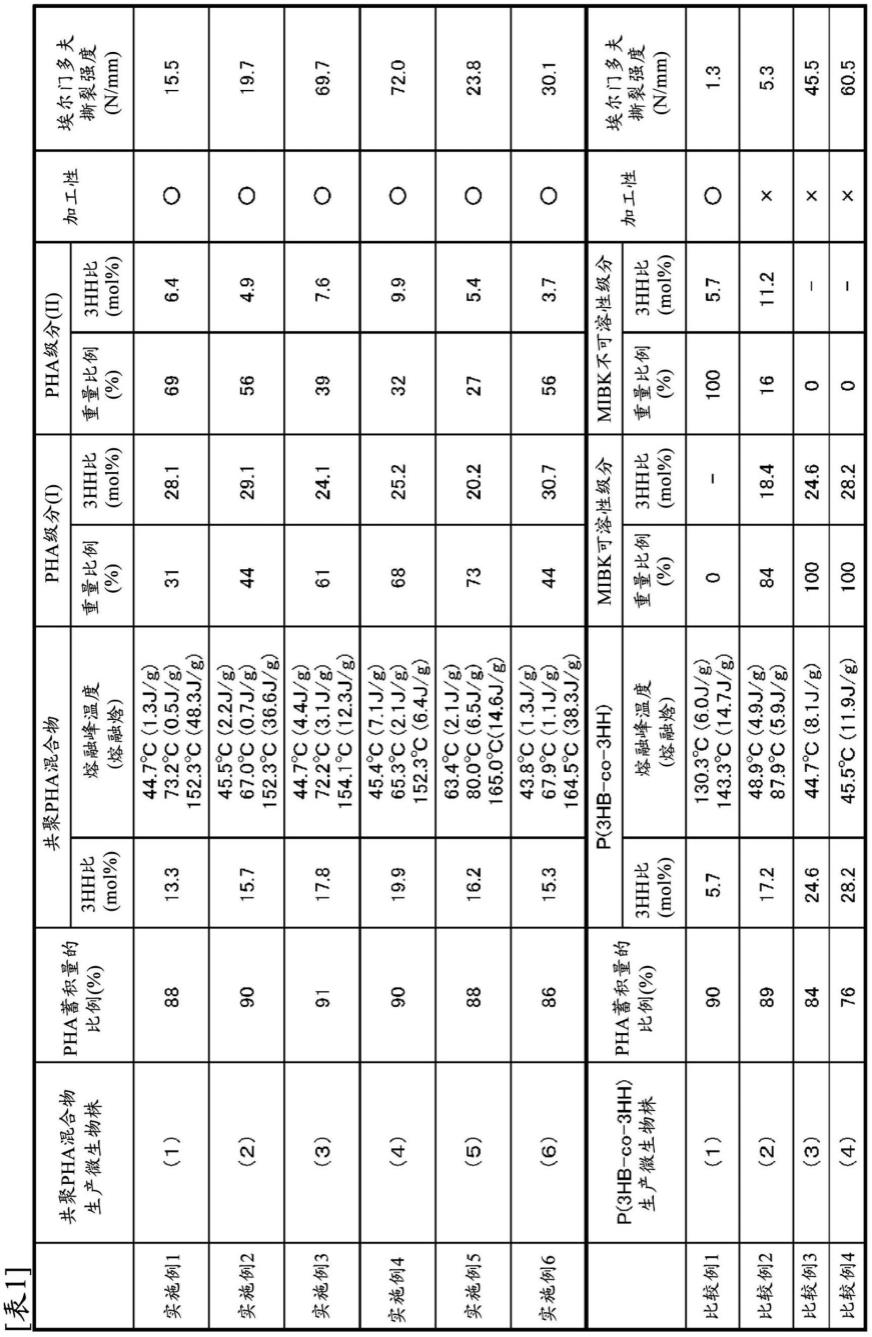
根据表1,实施例1~6中得到的共聚pha混合物的加工性良好,埃尔门多夫撕裂强度高,机械特性优异。另一方面,在得到的共聚pha混合物不包含pha级分(i)的比较例1中,埃尔门多夫撕裂强度为很低的值。在pha级分(i)的3hh的平均组成比率不为20摩尔%以上
的比较例2中,加工性不良,而且埃尔门多夫撕裂强度也为很低的值。在共聚pha混合物的3hh的平均组成比率不为22摩尔%以下、且不包含pha级分(ii)的比较例3及4中,加工性不良。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。