抗胸腺细胞球蛋白
1.相关申请的交叉引用
2.本技术要求于2020年02月12日提交的美国申请号62/975,649(其通过引用被整体并入本文)的优先权。
3.通过引用序列表并入
4.本技术与电子格式的序列表一起提交。序列表以名称为a2bi_001_01wo_seqlist.txt、创建于2021年09月08日并且大小为70kb的文件被提供。序列表的电子格式中的信息通过引用被整体并入本文。
技术领域
5.本发明大体上涉及制作用于生物医学应用的抗胸腺细胞球蛋白的方法。
6.背景
7.atg(抗胸腺细胞球蛋白)是fda批准用于在器官移植中使用的多克隆免疫球蛋白。atg也被用来或在临床试验中被用来治疗移植物抗宿主病和i型糖尿病(t1d)。在t1d中,atg被用作单一疗法以保持β细胞功能和被用作用于非清髓性造血干细胞移植的免疫抑制剂。
8.通过兔或马的免疫生成多克隆异型生物质免疫球蛋白来产生当前的atg产品。atg疗法将患者置于患血清病的风险,因为接受者的免疫系统对atg中的异型生物质免疫球蛋白做出反应。对atg的免疫应答也使得二次给药成为问题。此外,t1d中的血清病无法用糖皮质激素控制,因为糖皮质激素损害患者的β细胞的功能。
9.因此,本领域中仍存在对于产生atg的改进的方法以及相关联的组合物和使用方法的需要。
10.概述
11.本公开大体上涉及在具有完全人类的(或者至少部分人类的)免疫球蛋白基因座的转基因动物中产生的抗胸腺细胞球蛋白(atg)。所获得的组合物包括完全人类的(或者基本上人类的)免疫球蛋白。出人意料地,具有人类胸腺细胞的转基因动物的免疫生成具有与参考atg产品一样的效力或比参考atg产品更大的效力的atg。因此,本文中公开的方法产生充足产量和效力的atg,以允许制造解决由于异型生物质免疫球蛋白造成的血清病问题的人类atg产品。
12.在一方面,本公开提供有蹄类动物多克隆免疫球蛋白组合物,该有蹄类动物多克隆免疫球蛋白组合物包括完全人类的或基本上人类的免疫球蛋白的群体。完全人类的或基本上人类的免疫球蛋白的群体特异性结合人类胸腺细胞、t细胞、b细胞和/或单核细胞。
13.在另一方面,本公开提供通过用人类胸腺细胞免疫转基因有蹄类动物产生的组合物。组合物包括完全人类的或基本上人类的免疫球蛋白的群体。完全人类的或基本上人类的免疫球蛋白的群体特异性结合人类胸腺细胞、t细胞、b细胞和/或单核细胞。
14.在又一方面,本公开提供产生抗胸腺细胞球蛋白(atg)的方法,方法包括向转基因有蹄类动物施用人类胸腺细胞。转基因有蹄类动物的基因组包括人类免疫球蛋白基因座。转基因有蹄类动物产生包括抗胸腺细胞球蛋白(atg)的多克隆免疫球蛋白。
15.在另外的方面,本公开提供向有需要的受试者提供抗胸腺细胞球蛋白(atg)的方法,方法包括向受试者施用:i)根据本公开的多克隆免疫球蛋白组合物;ii)根据本公开的组合物;或者iii)根据本公开产生的多克隆免疫球蛋白组合物。方法向受试者提供有效量的抗胸腺细胞球蛋白(atg)。
16.在又一另外的方面,本公开提供药物组合物,药物组合物包括完全人类的或基本上人类的免疫球蛋白的群体以及一种或更多种药学上可接受的赋形剂。完全人类的或基本上人类的免疫球蛋白的群体特异性结合人类胸腺细胞、t细胞、b细胞和/或单核细胞。
17.本发明的其他的实施方案、特征和优点将因以下详细说明和通过本发明的实践而变得明显。
18.附图的简要说明
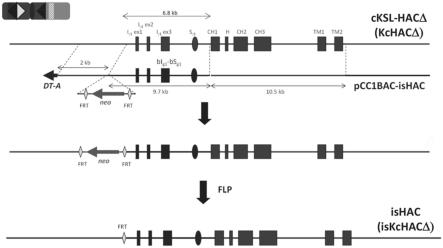
19.图1a-1h示出ishac载体和iskchacδ载体的构建。
20.图1a示出ishac载体和iskchacδ载体构建的流程。牛化载体pcc1bac-ishac是一种基于bac的载体(骨架为pcc1bac载体),由以下组成:10.5kb和2kb的基因组dna分别作为长臂和短臂、9.7kb的牛基因组dna覆盖牛iγ1-sγ1及其周边区以替换人类相应的6.8kb的iγ1-sγ1区、两侧为frt序列的鸡β-肌动蛋白启动子驱动的neo基因、和dt-a基因。在靶标牛化后,通过flp引入去除neo基因盒(cassette)。
21.图1b示出关于靶向载体pcc1bac-ishac的详细信息。通过使用人类iγ1-sγ1区周围的探针筛选,分别从克隆h10和克隆h18/h20(来源于从含有κhac的cho细胞构建的λ噬菌体基因组文库)中获得用于短臂和长臂的2kb的afe i-bam hi片段和10.5kb的apa i-hpa i片段。从来源于λ噬菌体牛基因组文库的克隆b42获得9.7kb片段(通过bsu36 i的5'端)。
22.图1c示出牛化iγ1-sγ1区的基因分型。如图所示,实施了五组基因组pcr。iscont1-f1/r1是对同源重组特异性的阳性pcr。iscont1-f1
×
higg1-r10是由于neo基因盒的存在而被禁止的阴性pcr。ishac-sw-dig-f5/r3和ishac-tm-dig-f3/r2用于对其对应区的结构完整性检查,分别由bam hi pvu ii和age i、sma i或pvu ii酶切。bneo5'-r
×
bigg1-5'-seq-r6是为了确认frt序列的存在。
23.图1d示出neo基因盒的flp-frt缺失后的基因分型。
24.图1e示出用于ishac载体基因分型的广泛基因组pcr。每个基因组pcr引物对的位置被描述为与ishac载体结构有关。
25.图1f示出对于含有ishac载体的三种不同的cho克隆之间的cgh分析。来自isc1-133的dna用作参考。三种细胞系之间的ishac没有明显的结构差异。
26.图1g示出用于iskchacδ载体基因分型的广泛基因组pcr。每个基因组pcr引物对的位置被描述为与iskchacδ载体结构有关。
27.图1h示出对于含有iskchacδ载体的三种不同的cho克隆之间的cgh分析。来自iskcdc15-8的dna用作参考。三种细胞系之间的iskchacδ没有明显的结构差异。
28.图2示出tcb源性atg产品与人类pbmc的结合的流式细胞术评估。
29.图3a-3b示出用马(ho-atg)、兔(rb-atg)或tcb(sab-atg)产品处理的调控性t(treg)细胞的水平。图3a示出cd4 cd25 foxp3 细胞的百分比。图3b示出cd4 cd25 foxp3 细胞相对于免疫球蛋白g的量的百分比。(**表示双尾p值小于0.001)。
30.图4a-4b示出用马(ho-atg)、兔(rb-atg)或tcb(sab-atg)产品处理的经激活的常
规t(tconv)细胞的水平。图4a示出cd4 cd25 foxp3-细胞的百分比。图4b示出cd4 cd25 foxp3-细胞相对于免疫球蛋白g的量的百分比。(双尾p值:**=小于0.05;**=小于0.001;***=小于0.0001)。
31.图5a-5b示出用马(ho-atg)、兔(rb-atg)或tcb(sab-atg)产品处理的原初常规t(tconv)细胞的水平。图5a示出cd4 cd25-foxp3-细胞的百分比。图5b示出cd4 cd25-foxp3-细胞相对于免疫球蛋白g的量的百分比。(双尾p值:**=小于0.05;**=小于0.001;***=小于0.0001)。
32.详细说明
33.本发明人已经开发了克服动物atg限制的人类atg产品。具有被人类人工染色体替换的内源性ig基因座的转基因动物表达完全人类的多克隆抗体,人类人工染色体编码人类ig基因座。用人类胸腺细胞免疫这样的转基因动物生成具有使之能够在医学应用中使用的产量、纯度和抗原特异性的多克隆免疫球蛋白。在下文的说明中提供了本发明的各种实施方案。
34.定义
35.所引用的全部参考文献通过引用被整体并入本文。在本技术中,除非另有说明,否则所利用的技术可以在数个众所周知的参考文献中找到,如molecular cloning:a laboratory manual(sambrook,et al.,1989,cold spring harbor laboratory press),gene expression technology(methods in enzymology,vol.185,edited by d.goeddel,1991.academic press,san diego,calif.),“guide to protein purification”in methods in enzymology(m.p.deutshcer,ed.,(1990)academic press,inc.);pcr protocols:a guide to methods and applications(innis,et al.1990.academic press,san diego,calif.),culture of animal cells:a manual of basic technique,2nd ed.(r.i.freshney.1987.liss,inc.new york,n.y.),gene transfer and expression protocols,pp.109-128,ed.e.j.murray,the humana press inc.,clifton,n.j.)和the ambion 1998 catalog(ambion,austin,tex.)。
36.除非上下文另外明确规定,否则如本文中所使用的,单数形式“一(a)”、“一(an)”和“所述(the)”包含复数提及。除非另外明确说明,否则如本文中所使用的,“和”与“或”可互换地使用。
37.除非上下文另外明确规定,否则本发明的任意方面的全部实施方案可以组合使用。
38.除非上下文另外明确要求,否则贯穿说明书和权利要求,词语
‘
包括(comprise)’、
‘
包括(comprising)’等将被解释为包容性的含义,而不是排他性或穷举性的含义;也就是说,在“包含但不限于”的意义上。使用单数或复数的词语也分别包含复数和单数。此外,当在本技术中使用时,词语“本文”、“上文”、“下文”和类似含义的词语应指整个本技术,而不是指本技术的任意特定部分。
39.术语“有蹄类动物”指任意适合的有蹄类动物,包含但不限于牛、猪、马、驴、斑马、鹿、公牛(oxen)、山羊、绵羊和羚羊。
40.术语“转基因的”意为有蹄类动物的细胞包括一种或更多种编码外源基因(一种或多种)(例如,免疫球蛋白基因座)的多核苷酸。这样的多核苷酸可以是人工染色体的一部
分。可替换地,或者除了人工染色体外,一种或更多种编码外源基因(一种或多种)的多核苷酸被整合到有蹄类动物的细胞的基因组中。
41.术语“多克隆”或“多克隆血清”或“多克隆血浆”或“多克隆免疫球蛋白”指具有共有的恒定区和不同的可变区的免疫球蛋白的群体。然而,术语多克隆不排除来源于单个b细胞前体或单个重组事件的免疫球蛋白(当优势免疫应答生成时可能出现这种情况)。多克隆血清或多克隆血浆含有免疫球蛋白的群体的可溶形式(例如,igg)。术语“经纯化的多克隆免疫球蛋白”指通过血清或血浆纯化的多克隆免疫球蛋白。纯化多克隆免疫球蛋白的方法包含(不限于)辛酸分馏和用红血细胞(rbc)吸附。
42.免疫球蛋白的“群体”指具有不同序列的免疫球蛋白,与具有单个免疫球蛋白的多个拷贝的样品不同。类似地规定,术语群体排除从培养基中的单个b细胞、血浆细胞或杂交瘤细胞分泌的,或者从用编码单对的重链免疫球蛋白序列和轻链免疫球蛋白序列的重组多核苷酸(一种或多种)转导或转化的宿主细胞分泌的免疫球蛋白。
43.术语“免疫球蛋白”指1:1比率至少两个重链和至少两个轻链的蛋白质复合物,包含五类免疫球蛋白(igm、igg、iga、igd、ige)中的任意免疫球蛋白。在变体中,免疫球蛋白以本领域已知的或预期发现的各种方法中的任意方法(包含(不限于)改变糖基化模式和/或增加或降低补体依赖细胞毒性的突变)被工程化。
44.当免疫球蛋白的蛋白质序列与天然人类免疫球蛋白的序列足够类似时,免疫球蛋白是“完全人类的或基本上人类的”,当被施用到受试者时,免疫球蛋白生成与对天然人类免疫球蛋白的免疫反应类似或者没有比对天然人类免疫球蛋白的免疫反应显著更差的抗免疫球蛋白免疫应答。完全人类的免疫球蛋白将在可变区中包括与免疫球蛋白序列的重组、选择和亲和力成熟一致的一种或更多种置换、插入或缺失。在变体中,完全人类的或基本上人类的免疫球蛋白以本领域已知的或预期发现的各种方法中的任意方法(包含(不限于)改变糖基化模式和/或增加或降低补体依赖细胞毒性的突变)被工程化。
45.术语“胸腺细胞”、“t细胞”、“b细胞”和“单核细胞”被赋予其在本领域中普通含义。胸腺细胞是存在于胸腺中的造血祖细胞。在本公开的方法中,在一些实施方案中,施用(人类)胸腺细胞可以指施用包含胸腺细胞的细胞的混合群体,条件是胸腺细胞以足够在转基因有蹄类动物中生成抗胸腺细胞免疫应答的数量和纯度存在。在本公开的方法的变体中,非人类胸腺细胞被使用,如例如非人类灵长类动物的胸腺细胞。
[0046]“按总免疫球蛋白的质量计”,免疫球蛋白(例如,特异性结合人类胸腺细胞的免疫球蛋白)的百分比指除以样品中总免疫球蛋白的浓度、乘以100的靶标免疫球蛋白群体的浓度。靶标免疫球蛋白的浓度可以通过,例如靶标免疫球蛋白的亲和纯化(例如在包括胸腺细胞或胸腺细胞膜的亲和柱上),随后浓度测定,来确定。
[0047]
术语“约”或“大约”意为在本领域普通技术人员确定的特定数值的可接受误差范围内,这将部分取决于该数值如何测量或确定,例如测量系统的限制。例如,“约”可以意为在标准偏差1内或超过标准偏差1。可替换地,“约”可以意为加或减至多20%、至多10%或至多5%的范围。
[0048]
术语“免疫(immunization)”和“免疫(immunizing)”指以足够在一个或更多个施用步骤之后引起期望的免疫应答(例如,对胸腺细胞特异性的多克隆免疫球蛋白应答)的量向受试者(例如,转基因有蹄类动物)施用组合物。施用可以通过肌肉注射、静脉注射、腹膜
内注射或者任何其他适合的途径。免疫可以包括组合物的介于1和10之间或者更多次的施用(例如注射),如1次、2次、3次、4次、5次、6次、7次、8次、9次、10次或更多次施用。第一次施用可能不引起可检测的免疫应答,因为通常每次后续施用都将会增强先前施用生成的免疫应答。
[0049]
术语“靶标抗原”指用于引起期望的免疫应答的任意抗原。用于生成atg产品的靶标抗原可以是胸腺细胞,与胸腺细胞共有一个或更多个内源性蛋白质标志物的细胞,重组表达一种或更多种胸腺细胞蛋白、重组胸腺细胞蛋白或编码胸腺细胞蛋白的核酸(例如,rna、线性dna或质粒dna)的细胞。
[0050]
术语“纯化”指将靶标细胞或分子(例如,免疫球蛋白的群体、胸腺细胞)与组合物中存在的其他物质分离。可以通过血浆分级、通过亲和力(例如,蛋白质a或蛋白质g结合、或其他捕获分子)、通过电荷(例如,离子交换色谱)、通过尺寸(例如,尺寸排阻色谱)或者以其他的方式纯化免疫球蛋白。纯化免疫球蛋白的群体的操作可以包括用酸、碱、盐、酶、热、冷、凝血因子、或其他适合的助剂中的一种或更多种处理包括免疫球蛋白的群体的组合物。纯化操作可以进一步包含将包括靶标细胞或分子以及杂质的组合物吸附到非靶标细胞或分子(例如,红血细胞)上,以部分地或完全地去除杂质。纯化操作可以进一步包含血清或血浆的预处理,例如,辛酸分馏。
[0051]
术语“治疗(treating)”和“治疗(treatment)”指下列中的一种或更多种:减轻、缓解、延迟、减少、逆转、改善或控制受试者的病况的至少一种症状。术语“治疗(treating)”还可以意为下列中的一种或更多种:阻止、延迟发作(即,在病况的临床表现之前的时期)或减少病况发展或恶化的风险。
[0052]
术语“药学上可接受的”意为对于动物或人类体内使用在生物学上或药理学上相容,并且可以意为由联邦或州政府的监管机构批准,或者在美国药典或其他公认的药典中列出用于在动物中(并且更明确地,在人类中)使用。
[0053]
术语“超免疫”指在稀释由受试者产生的免疫球蛋白之后,生成对受试者的免疫应答大于产生期望的滴度(例如,结合滴度)所需的免疫方案。例如,如果期望的滴度为1:100,则可以通过初次免疫,然后进行一次、两次、三次或更多次加强免疫对动物进行超免疫,以在受试者中产生1:1000或更高的滴度——使得由受试者产生的免疫球蛋白可以在生物治疗剂的生产中被稀释,以便给出生物治疗剂中期望的滴度。
[0054]
免疫球蛋白对靶标(例如,胸腺细胞或胸腺细胞抗原)“特异性”或“特异性结合”靶标(例如,胸腺细胞或胸腺细胞抗原)(在本文中可互换使用)是本领域公知的术语,并且确定这样的特异性结合或优先结合的方法在本领域中也是公知的。如果与可替代细胞或物质相比,分子与特定细胞或物质的反应或结合更频繁、更迅速、持续时间更长和/或具有更强的亲和力,则称其表现出“特异性结合”或“优先结合”。如果相比于免疫球蛋白与可替代细胞或物质的结合,免疫球蛋白以更大的亲和力、抗体亲抗原性(avidity)、更容易和/或以更长的持续时间与特定细胞或物质结合,则免疫球蛋白与特定细胞或物质“特异性结合”。例如,特异性或优先与胸腺细胞结合的免疫球蛋白是比相比于和其他细胞的结合,以更大的亲和力、抗体亲抗原性、更容易和/或以更长的持续时间结合胸腺细胞的免疫球蛋白。与第一细胞或物质特异性结合的免疫球蛋白可以或可以不与第二细胞或物质特异性或优先结合。因此,“特异性结合”并非必须要求(尽管其可以包含)排他性结合。通常(但并非必须),
对结合的提及意味着特异性结合。
[0055]
术语“hac载体”意为包括至少人类染色体源性着丝粒序列、端粒序列和复制起点并且可以含有给定应用所期望的任何其他序列的载体。当存在于宿主细胞中时,hac载体独立于宿主细胞染色体存在于细胞核中。可以使用任何适合的方法来制备hac载体并将感兴趣的核酸插入hac,包括但不限于以下实施例中描述的那些。hac载体是本领域技术人员已知的双链dna载体。
[0056]
实施方案
[0057]
提供了产生抗胸腺细胞球蛋白(atg)的方法,方法包括向转基因有蹄类动物施用人类胸腺细胞。胸腺细胞是存在与胸腺中的造血祖细胞。它们可以从多种来源获得,包含儿童和青年心脏手术,其中胸腺组织必须从患者中移除并且将通常被丢弃。胸腺细胞可以是活的人类胸腺细胞,因为活的人类胸腺细胞更好地保存了表面抗原的构象。在一些实施方案中,方法包括施用有效量的人类胸腺细胞。在实施方案中,有效量为至少约1
×
108个、至少约5
×
108个、至少约1
×
109个、至少约5
×
109个、至少约1
×
10
10
个或至少约5
×
10
11
个胸腺细胞。
[0058]
在变体中,非人类胸腺细胞被使用(例如,家养动物(如狗、猫、绵羊等)的胸腺细胞)。在这样的情况下,转基因有蹄类动物可以包括编码非人类物种的ig基因组的人工染色体,使得生成该物种的抗体。
[0059]
在一些实施方案中,在一种或更多种佐剂的施用之前、期间或之后施用胸腺细胞。在一些实施方案中,胸腺细胞和一种或更多种佐剂在单个组合物中一起施用,组合物可选地包括一种或更多种药学上可接受的赋形剂。
[0060]
说明性佐剂包含铝盐佐剂、水包油乳剂(例如,包括角鲨烯的水包油乳剂,如mf59或as03)、tlr7激动剂(如咪唑喹啉或咪喹莫特)或其组合。适合的铝盐包含氢氧化物(例如,羟基氧化物)、磷酸盐(例如,羟基磷酸盐、正磷酸盐)(例如,参见vaccine design.(1995)eds.powell&newman.isbn:030644867x.plenum,第8和9章)或其混合物。进一步的说明性佐剂包含(但不限于)adju-phos、adjumerlm、白蛋白-肝素微颗粒、海藻葡聚糖、algammulin、明矾、抗原制剂、as-2佐剂、自体树突细胞、自体pbmc、阿夫立定
tm
、b7-2、bak、bay r1005、布比卡因、布比卡因-hcl、bwzl、骨化三醇、磷酸钙凝胶、ccr5肽、cfa、霍乱全毒素(cholera holotoxin,ct)和霍乱毒素b亚单元(ctb)、霍乱毒素al-亚单元-蛋白质a d-片段融合蛋白、cpg、crl1005、含细胞因子脂质体(cytokine-containing liposomes)、d-murapalmitine、dda、dhea、白喉类毒素、dl-pgl、dmpc、dmpg、doc/明矾复合物、鸟痘、弗氏完全佐剂、γ-菊粉、gerbu佐剂、gm-csf、gmdp、hgm-csf、hil-12(n222l)、htnf-α、ifa、pcdna3中ifn-γ、il-12dna、il-12质粒、il-12/gmcsf质粒(sykes)、pcdna3中il-2、il-2/ig质粒、il-2/ig蛋白、il-4、pcdna3中il-4、咪喹莫特、immther
tm
、含有协同刺激分子的抗体的免疫脂质体、干扰素γ、白细胞介素-1β、白细胞介素-12、白细胞介素-2、白细胞介素-7、iscom(s)
tm
、iscoprep 7.0.3
tm
、montanide
tm
isa-25、钥孔血蓝蛋白(keyhole limpet hemocyanin)、脂基佐剂、脂质体、洛索立宾(loxoribine)、lt(r192g)、lt-oa或lt口服佐剂、lt-r192g、ltk63、ltk72、mf59、montanide isa 51、montanide isa 720、mpl.tm.、mpl-se、mtp-pe、mtp-pe脂质体、murametide、murapalmitine、nago、nct天然霍乱毒素、非离子表面活性剂囊泡、霍乱毒素mct-e112k的非毒性突变e1 12k、对羟基苯甲酸甲酯、pcil-10、pcil12、pcmvmcat1、pcmvn、
peptomer-np、pleuran、plg、plga、pga和pla、普朗尼克l121、pmma、podds
tm
、poly ra:poly ru、聚山梨酯80、蛋白脂质卷(protein cochleates)、qs-21、quadri a saponin、quil-a、isa-25/quil-a、rehydragel hpa、rehydragel lv、ribi、ribilike佐剂系统(mpl、tmd、cws)、s-28463、sab-adj-1、sab-adj-2、saf-1、sclavo肽、sendai脂蛋白体、sendai-containing lipid matrices、司班85、specol、角鲨烷1、角鲨烯2、硬脂酰酪氨酸盐、破伤风类毒素(tt)、theramide
tm
、苏氨酸胞壁酰二肽(threonyl muramyl dipeptide,tmdp)、ty颗粒和沃尔特
·
里德脂质体(walter reed liposomes)。
[0061]
可以通过将人类胸腺细胞与例如完全弗氏佐剂免疫或者合适的佐剂(如氢氧化铝凝胶)和百日咳菌疫苗皮下、静脉或腹膜内施用到转基因有蹄类动物中来执行免疫。在一实施方案中,免疫包括超免疫。在各种实施方案中,在第一次施用后,每1至4周施用人类胸腺细胞一次至10次。在每次施用1至14天后,从动物收集血液以测量血清的抗体值。
[0062]
在一些实施方案中,人类胸腺细胞被施用3次、4次、5次、6次或更多次。可以例如每1-2周、2-3周、3-4周、4-5周、5-6周或6-7周或者更长的间隔(例如,每1周、2周、3周、4周、5周或6周)执行人类胸腺细胞的施用。在每次免疫后,可以从转基因有蹄类动物一次或更多次收获血清和/或血浆。例如,方法可以包含以约7-14天的间隔执行控制抽血(controls bleeds)两次或三次。
[0063]
在一些实施方案中,被用于生成atg产品的抗原可以是与胸腺细胞共有一个或更多个内源性蛋白标志物的细胞(而非胸腺细胞),重组表达一种或更多种胸腺细胞蛋白、重组胸腺细胞蛋白或编码胸腺蛋白的核酸(例如,rna、线性dna或质粒dna)的细胞。
[0064]
在本公开的方法的实施方案中,转基因有蹄类动物的基因组包括人类免疫球蛋白基因座。说明性的方法在u.s.专利号9,902,970;u.s.专利号9,315,824;u.s.专利号7,652,192;和u.s.专利号7,429,690;以及u.s.专利号7,253,334(其公开内容通过引用并入本文用于所有目的)中提供。进一步说明性的方法由kuroiwa,y.,et al.(2009)nat biotechnol.27(2):173-81和matsushita et al.(2015)plos one 10(6):e0130699提供。
[0065]
本公开提供人类人工染色体(hac)载体,hac载体包括编码下列的基因:
[0066]
(a)一种或更多种人类抗体重链,其中编码抗体重链的每个基因可操作地与类别转换调控元件连接;
[0067]
(b)一种或更多种人类抗体轻链;以及
[0068]
(c)一种或更多种人类抗体替代轻链,和/或有蹄类动物源性igm重链恒定区;
[0069]
其中编码一种或更多种人类抗体重链的基因的至少一种类别转换调控元件被有蹄类动物源性类别转换调控元件替换。
[0070]
如对于本发明的方法所描述的,本公开的hac载体可以被用于例如通过转基因动物的完全人类抗体的大规模生产。本公开的hac载体包括一个或更多个编码人类抗体重链的基因。可以通过hac上的一个或更多个核酸编码组合中的任意人类抗体重链或人类抗体重链的组合。在各种实施方案中,可以在hac上以一个或更多个拷贝编码人类抗体重链igm、igg1、igg2、igg3、igg4、iga1、iga2、ige和igd中的1个、2个、3个、4个、5个、6个、7个、8个或全部9个。在一实施方案中,hac包括仅人类igm抗体重链编码基因或包括人类igm抗体重链编码基因与1个、2个、3个、4个、5个、6个、7个或其他8个人类抗体链编码基因的组合。在一优选的实施方案中,hac包括编码至少人类igg1抗体重链的基因;在该实施方案中,进一步优选
hac包括编码人类igm抗体重链的基因或者已经被嵌合以编码有蹄类动物源性igm重链恒定区(如牛重链恒定区)的编码人类igm抗体重链的基因。在另一实施方案中,hac包括编码至少人类iga抗体重链的基因;在该实施方案中,进一步优选hac包括编码人类igm抗体重链的基因或者已经被嵌合以编码有蹄类动物源性igm重链恒定区(如牛重链恒定区)的编码人类igm抗体重链的基因。在另一优选的实施方案中,hac包括编码全部9个抗体重链的基因,并且更优选地,其中编码人类igm抗体重链的基因已经被嵌合以编码有蹄类动物源性igm重链恒定区。在另一实施方案中,hac可以包括人类染色体14的编码人类抗体重链的部分。人类抗体重链的可变区基因和恒定区基因形成簇,并且人类重链基因座被定位在人类染色体14上的14q32处。在一实施方案中,人类染色体14的插入hac中的区包括来自人类染色体14的14q32区的人类抗体重链的可变区和恒定区。
[0071]
在本公开的hac载体的一些实施方案中,人类抗体重链编码核酸的至少一个类别转换调控元件被有蹄类动物源性类别转换调控元件替换。类别转换调控元件指抗体重链恒定区的5
′
的核酸。每个重链恒定区基因被可操作地与其自己的转换区连接(即,受其自己的转换区的控制),其自己的转换区也与其自己的i-外显子相关联。类别转换调控元件调控类别转换重组和确定ig重链同种型。每个重链同种型的种系转录由位于i-外显子的仅5’处的启动子/增强子元件驱动,并且这些元件是细胞因子或者其他响应性激活因子(activator-responsive)。在类别转换的简单模型中,特异性激活因子和/或细胞因子包含各个自其类别转换调控元件(即,激活因子/细胞因子响应性启动子和/或增强子)的重链同种型种系转录。类别转换之前是来自各个ig重(igh)基因座相关联的转换区的i-外显子的转录。因为每个重链恒定区基因与其自己的转换区连接。
[0072]
可以使用任意适合的有蹄类动物源性类别转换调控元件。例如,下文列出的人类重链基因同种型具有下列类别转换调控元件:
[0073]
igm:iμ-sμ,
[0074]
igg1:iγ1-sγ1,
[0075]
igg2:iγ2-sγ2,
[0076]
igg3:iγ3-sγ3,
[0077]
igg4:iγ4-sγ4,
[0078]
iga1:iα1-sα1,
[0079]
iga2:iα2-sα2,以及
[0080]
ige:iε-sε。
[0081]
在各种实施方案中,hac上的人类抗体重链基因中的1个、超过1个或全部基因具有其被有蹄类动物源性类别转换调控元件替换的类别转换调控元件,包含但不限于有蹄类动物iμ-sμ、iγ-sγ、iα-sα或iε-s类别转换调控元件。在一实施方案中,hac上的人类igg1重链编码核酸的iγ1-sγ1人类类别转换调控元件(如在seq id no:1中的类别转换调控元件)被有蹄类动物iγ1-sγ1类别转换调控元件替换。示例性的有蹄类动物iγ1-sγ1类别调控转换元件包含牛igg1 iγ1-sγ1类别转换调控元件(seq id no:2)、马iγ1-sγ1类别转换调控元件(seq id no:3)和猪iγ1-sγ1类别转换调控元件(seq id:4)。然而,用来自对应重链同种型的有蹄类动物类别转换调控元件替换人类类别转换调控元件不是必需的。因此,例如,hac上的人类igg3重链编码核酸的iγ3-sγ3人类类别转换调控元件可以被有
蹄类动物iγ1-sγ1类别转换调控元件替换。如基于本文的教导,对于本领域技术人员将显而易见的,任何这样的组合可以被用于本公开的hac中。
[0082]
在另一实施方案中,hac包括至少一个有蹄类动物增强子元件,以替换与hac上的一个或更多个人类抗体重链恒定区编码核酸相关联的增强子元件。存在与人类抗体重链基因相关联的两个3’增强子区(α1和α2)。增强子元件是重链恒定区的3’,并且还帮助调控类别转换。可以使用任何适合的有蹄类动物增强子,包含但不限于3’eα增强子。可以使用的3’eα增强子的非限制性实例包含3’eα、3’eα1和3’eα2。可以在hac中使用并且替换人类增强子的来自牛的示例性3’eα增强子元件包含(但不限于)牛hs3增强子(seq id no:5)、牛hs12增强子(seq id no:6)和牛增强子hs4。该实施方案在其中hac包括来自人类染色体14的14q32区的人类抗体重链的可变区和恒定区的实施方案中是特别优选的。
[0083]
本公开的hac载体可以包括编码人类抗体轻链的一个或更多个基因。任何适合的人类抗体轻链编码基因可以被用于本发明的hac载体中。人类抗体轻链包含两种类型的基因,即κ/k链基因和λ/l链基因。在一实施方案中,hac包括以一个或更多个拷贝编码κ和λ两者的基因。κ链的可变区和恒定区位于人类染色体2的2p11.2-2p12处,并且λ链形成位于人类染色体22的22q11.2处的簇。因此,在一实施方案中,本发明的hac载体包括含有2p11.2-2p12区的κ链基因簇的人类染色体2片段。在另一实施方案中,本发明的hac载体包括含有22q11.2区的λ链基因簇的人类染色体22片段。
[0084]
在另一实施方案中,hac载体包括至少一种编码人类抗体替代轻链的基因。编码人类抗体替代轻链的基因指编码瞬态抗体轻链的基因,瞬态抗体轻链与通过人类祖b细胞中的基因重构(gene reconstitution)产生的抗体重链相关联,以构成祖b细胞受体(prebcr)。可以使用任何适合的人类抗体替代轻链编码基因,包含但不限于vpreb1(seq id no:7)人类抗体替代轻链、vpreb3(seq id no:8)人类抗体替代轻链和λ5(也称作igll1,seq id no:9)人类抗体替代轻链及其组合。vpreb基因和λ5基因位于人类染色体22的22q11.2处的人类抗体λ链基因基因座内。因此,在一实施方案中,hac可以包括含有vpreb基因和λ5基因的人类染色体22的22q11.2区。本发明的人类vpreb基因提供vpreb1基因(seq id no:7)和vpreb3(seq id no:8)基因中的任意一者或vpreb1基因(seq id no:7)和vpreb3(seq id no:8)基因两者,并且在一实施方案中提供vpreb1基因和vpreb3基因两者。
[0085]
在再一实施方案中,hac载体包括编码有蹄类动物源性igm重链恒定区的基因。在该实施方案中,igm重链恒定区表达为具有人类igm抗体重链可变区的嵌合体。可以使用任何适合的有蹄类动物igm重链抗体恒定区编码核酸,包含但不限于牛igm(seq id no:10)、马igm(seq id no:11)、绵羊igm(seq id no:12)和猪igm(seq id no:13)。在一实施方案中,嵌合igm包括seq id no:14中的序列。通过igm重链分子的pre-bcr/bcr信号传导通过与b细胞膜分子ig-α/ig-β相互作用引起细胞中的信号转导来促进b细胞增殖和发育。igm的跨膜区和/或其他恒定区被认为在用于信号转导的与ig-α/ig-β的相互作用中具有重要作用。igm重链恒定区的实例包含编码恒定区域(如ch1、ch2、ch3和ch4)以及b细胞跨膜域和细胞质域(如tm1和tm2)的核酸。编码有蹄类动物源性igm重链恒定区的核酸(其被包括在本发明的人类人工染色体载体中)并没有特别限制,只要该区在可以在上文描述的igm重链恒定区中足以诱导b细胞受体或b细胞增殖/发育的信号的范围内。在一实施方案中,编码有蹄类动物源性igm重链恒定区的核酸提供来源于有蹄类动物的跨膜域以及细胞质tm1域和tm2域,
并且在其他实施方案中编码有蹄类动物源性ch2域、ch3域、ch4域、tm1域和tm2域、或者有蹄类动物源性ch1域、ch2域、ch3域、ch4域、tm1域和tm2域。
[0086]
在一实施方案中,编码牛的igm重链恒定区的基因是编码包含在ighm区(牛内源性igm重链基因位于ighm区处)中的牛igm重链恒定区的基因(来源于ighm)或者编码ighml1区中的牛igm重链恒定区的基因(来源于ighml1)。在另一实施方案中,编码牛igm重链恒定区的基因包含在ighm区中。
[0087]
在进一步的实施方案中,hac包括编码人类抗体重链的基因,包括编码人类重链的基因(例如,人类igg重链,如igg1重链),并且其中人类重链基因的恒定区的跨膜域和胞内域被有蹄类动物源性重链(例如,有蹄类动物igg重链,如igg1重链)恒定区基因的跨膜域和胞内域替换。在一实施方案中,编码有蹄类动物源性(如牛)igg(如igg1)重链恒定区的跨膜域和胞内域的基因被用于替换人类igg重链基因的对应的区。在另一实施方案中,编码有蹄类动物源性(如牛)igg(如igg1)重链恒定区的tm1域和tm2域的基因被用于替换人类igg重链基因的对应的区。在另一实施方案中,编码有蹄类动物源性(如牛)igg(如igg1)重链恒定区的ch1-ch4域和/或tm1域和tm2域中的一个或更多个的基因被用于替换人类igg重链基因的对应的区。
[0088]
本公开还提供包括根据本公开的任意实施方案或实施方案的组合的hac载体的转基因有蹄类动物。包括本发明的hac载体的转基因有蹄类动物指被引入本发明的人类人工染色体载体的动物。具有本发明的hac的转基因有蹄类动物并没有特别限制,只要该动物是其中人类人工染色体片段可以被引入其细胞中的转基因有蹄类动物,并且可以使用任意非人类动物(例如,有蹄类动物,如母牛(cow)、马、山羊、绵羊和猪等)。在一方面,转基因有蹄类动物是牛。例如,可以通过使用任何适合的技术(如本文中描述的那些)将本公开的hac载体引入宿主动物的卵母细胞中来构建具有本发明的hac载体转基因有蹄类动物。例如,可以通过微细胞融合方法将本发明的hac载体引入到来源于宿主有蹄类动物的体细胞中。此后,可以通过将细胞的细胞核或染色质团聚物移植到卵母细胞中以及将卵母细胞或将由卵母细胞形成的胚胎到宿主动物的子宫中生产来构建具有hac载体的动物。可以通过kuroiwa等人的方法(kuroiwa et al.,nature biotechnology,18,1086-1090,2000 and kuroiwa et al.,nature biotechnology,20,889-894)确认通过上述方法构建的动物是否具有人类人工染色体载体。
[0089]
本公开还提供转基因有蹄类动物,转基因有蹄类动物包括被整合到其基因组中的编码下列的基因:
[0090]
(a)一种或更多种人类抗体重链,其中编码抗体重链的每个基因可操作地与类别转换调控元件连接;
[0091]
(b)一种或更多种人类抗体轻链;以及
[0092]
(c)一种或更多种人类抗体替代轻链,和/或有蹄类动物源性igm重链恒定区;
[0093]
其中编码一种或更多种人类抗体重链的基因的至少一种类别转换调控元件被有蹄类动物源性类别转换调控元件替换。
[0094]
在这样的实施方案中,转基因有蹄类动物可以包括用于hac的本文所描述的核酸的任何实施方案或实施方案的任何组合,但是其被整合到有蹄类动物的染色体中,而非存在与hac中。
[0095]
本公开还提供产生人类抗体的方法,方法包括:(a)向本公开的任何实施方案或实施方案的任何组合的转基因有蹄类动物施用本公开的人类胸腺细胞或其他靶标抗原,以产生和积累对有蹄类动物的血清或血浆中的人类胸腺细胞(或者对t细胞、b细胞和/或单核细胞)特异性的人类免疫球蛋白的群体;以及可选地(b)分离、回收和/或纯化对来自有蹄类动物的血清或血浆的人类胸腺细胞(或者对t细胞、b细胞和/或单核细胞)特异性的人类免疫球蛋白的群体。
[0096]
多克隆血清或血浆或者从多克隆血清或血浆纯化的人类免疫球蛋白可以被用作atg产品。
[0097]
在变体中,本公开提供回收人类抗体的蛋白质序列的方法,方法包括:(i)分离来自转基因有蹄类动物的淋巴细胞;(ii)由淋巴细胞生成人类单克隆抗体产生杂交瘤细胞;以及(iii)从杂交瘤细胞回收对人类胸腺细胞特异性的人类单克隆抗体。在另一实施方案中,从转基因有蹄类动物的淋巴结分离来自转基因有蹄类动物的淋巴细胞。在进一步的实施方案中,用本公开的人类胸腺细胞或其他靶标抗原超免疫转基因有蹄类动物。
[0098]
通过用本公开的人类胸腺细胞或其他靶标抗原免疫具有hac载体的转基因有蹄类动物以在转基因有蹄类动物的血清或血浆中产生胸腺细胞特异性人类免疫球蛋白以及从转基因有蹄类动物的血清或血浆回收胸腺细胞特异性人类免疫球蛋白来产生胸腺细胞特异性人类免疫球蛋白。
[0099]
用于检测和测量组合物中的胸腺细胞特异性人类免疫球蛋白的方法的实例包含通过酶联免疫吸附测定的结合测定等。可以通过将包括人类免疫球蛋白的组合物与细胞(例如,胸腺细胞、t细胞、b细胞和/或单核细胞、或者重组蛋白抗原(一种或多种))孵育以及随后使用特异性识别人类免疫球蛋白的抗体来测量人类免疫球蛋白的结合量。
[0100]
在变体中,本公开的方法被用于生成单克隆抗体。制备和利用各种类型的抗体的方法对于本领域技术人员是公知的并且将适于在本发明中实践(参见,例如harlow,et al.antibodies:a laboratory manual,cold spring harbor laboratory,1988;kohler and milstein,nature 256:495(1975))。用于杂交瘤细胞的制备方法的实例包括下列步骤:(1)用胸腺细胞免疫转基因有蹄类动物;(2)从转基因有蹄类动物(即,从淋巴结)收集抗体产生细胞;(3)融合抗体产生细胞和骨髓瘤细胞;(4)从在以上步骤中获得的融合细胞选择产生对胸腺细胞特异性的单克隆抗体的杂交瘤细胞;以及可选地(5)从经选择的杂交瘤细胞选择产生对胸腺细胞特异性的单克隆抗体的杂交瘤细胞。
[0101]
在本公开的产生抗胸腺细胞球蛋白(atg)的方法的实施方案中,转基因有蹄类动物产生人类抗胸腺细胞球蛋白(atg)。方法可以包括从转基因有蹄类动物收集多克隆血清和/或多克隆血浆。在一些实施方案中,有蹄类动物是牛。在一些实施方案中,多克隆免疫球蛋白组合物包括完全人类的免疫球蛋白的群体或者基本上人类的免疫球蛋白的群体。
[0102]
本公开的方法和相关组合物的一些实施方案具有出人意料的优势:以高产量、高纯度和/或以转基因有蹄类动物的血清或血浆中存在的总免疫球蛋白的高百分率产生胸腺细胞特异性免疫球蛋白。在一些实施方案中,有蹄类动物是牛。
[0103]
在本公开的方法和组合物的一些实施方案中,按多克隆血清或者多克隆血浆中总免疫球蛋白的质量计,多克隆血清或者多克隆血浆包括至少0.1%、至少0.2%、至少0.3%、至少0.4%、至少0.5%、至少0.6%、至少0.7%、至少0.8%、至少0.9%、至少1%、至少
1.1%、至少1.2%、至少1.3%、至少1.4%、至少1.5%、至少1.6%、至少1.7%、至少1.8%、至少1.9%、至少2%、至少2.1%、至少2.2%、至少2.3%、至少2.4%、至少2.5%、至少2.6%、至少2.7%、至少2.8%、至少2.9%、至少3%、至少3.1%、至少3.2%、至少3.3%、至少3.4%、至少3.5%、至少3.6%、至少3.7%、至少3.8%、至少3.9%、至少4%、至少4.1%、至少4.2%、至少4.3%、至少4.4%、至少4.5%、至少4.6%、至少4.7%、至少4.8%、至少4.9%、至少5%、至少5.1%、至少5.2%、至少5.3%、至少5.4%、至少5.5%、至少5.6%、至少5.7%、至少5.8%、至少5.9%、至少5.9%、至少6.0%、至少6.1%、至少6.2%、至少6.3%、至少6.4%、至少6.5%、至少6.6%、至少6.7%、至少6.8%、至少6.9%、至少7.0%、至少7.1%、至少7.2%、至少7.3%、至少7.4%、至少7.5%、至少7.6%、至少7.7%、至少7.8%、至少7.9%、至少8.0%、至少8.1%、至少8.2%、至少8.3%、至少8.4%、至少8.5%、至少8.6%、至少8.7%、至少8.8%、至少8.8%、至少9.0%、至少9.1%、至少9.2%、至少9.3%、至少9.4%、至少9.5%、至少9.6%、至少9.7%、至少9.8%、至少9.8%、至少9.9%或至少10%的完全人类的(或者基本上人类的)免疫球蛋白。
[0104]
在本公开的方法和组合物的一些实施方案中,按多克隆血清或者多克隆血浆中总免疫球蛋白的质量计,多克隆血清或者多克隆血浆包括0.1-0.6%、0.2-0.7%、0.3-0.8%、0.4-0.9%、0.5-1%、0.6-1.1%、0.7-1.2%、0.8-1.3%、0.9-1.4%、1-1.5%、1.1-1.6%、1.2-1.7%、1.3-1.8%、1.4-1.9%、1.5-2%、1.6-2.1%、1.7-2.2%、1.8-2.3%、1.9-2.4%、2-2.5%、2.1-2.6%、2.2-2.7%、2.3-2.8%、2.4-2.9%、2.5-3%、2.6-3.1%、2.7-3.2%、2.8-3.3%、2.9-3.4%、3-3.5%、3.1-3.6%、3.2-3.7%、3.3-3.8%、3.4-3.9%、3.5-4%、3.6-4.1%、3.7-4.2%、3.8-4.3%、3.9-4.4%、4-4.5%、4.1-4.6%、4.2-4.7%、4.3-4.8%、4.4-4.9%、4.5-5%、4.6-5.1%、4.7-5.2%、4.8-5.3%、4.9-5.4%、5-5.5%、5.1-5.6%、5.2-5.7%、5.3-5.8%、5.4-5.9%、5.5-6%、5.6-6.1%、5.7-6.2%、5.8-6.3%或5.9-6.4%的完全人类的(或者基本上人类的)免疫球蛋白。
[0105]
在本公开的方法和组合物的一些实施方案中,按多克隆血清或者多克隆血浆中总免疫球蛋白的质量计,多克隆血清或者多克隆血浆包括0-0.5%、0.5-1%、1-1.5%、1.5-2%、2-2.5%、2.5-3%、3-3.5%、3.5-4%、4-4.5%、4.5-5%、5-5.5%、5.5-6%、6-6.5%、6.5-7%、7-7.5%、7.5-8%、8-8.5%、8.5-9%、9-9.5%、9.5-10%或更多的完全人类的(或者基本上人类的)免疫球蛋白。
[0106]
在本公开的方法和组合物的一些实施方案中,按多克隆血清或者多克隆血浆中总免疫球蛋白的质量计,多克隆血清或者多克隆血浆包括0-1%、1-2%、2-3%、3-4%、4-5%、5-6%、6-7%、7-8%、8-9%、9-10%或更多的完全人类的(或者基本上人类的)免疫球蛋白。
[0107]
在本公开的方法和组合物的一些实施方案中,按多克隆血清或者多克隆血浆中总免疫球蛋白的质量计,多克隆血清或者多克隆血浆包括0-5%、5-10%、10-15%、15-20%、20-25%、25-30%、30-35%、35-40%或更多的完全人类的(或者基本上人类的)免疫球蛋白。
[0108]
在本公开的方法和组合物的一些实施方案中,按多克隆血清或者多克隆血浆中总免疫球蛋白的质量计,多克隆血清或者多克隆血浆包括0-5%、5-10%、10-15%、15-20%、20-25%、25-30%、30-35%、35-40%或更多的完全人类的(或者基本上人类的)免疫球蛋白。
[0109]
在本公开的方法和组合物的一些实施方案中,按多克隆血清或者多克隆血浆中总免疫球蛋白的质量计,多克隆血清或者多克隆血浆包括至少1%、至少2%、至少3%、至少4%、至少5%、至少6%、至少7%、至少8%、至少9%或至少10%的完全人类的(或者基本上人类的)免疫球蛋白。
[0110]
在本公开的方法和组合物的一些实施方案中,按多克隆血清或者多克隆血浆中总免疫球蛋白的质量计,多克隆血清或者多克隆血浆包括1-4%、2-5%、3-6%、4-7%、5-8%、6-9%或7-10%的完全人类的(或者基本上人类的)免疫球蛋白。
[0111]
在本公开的方法和组合物的一些实施方案中,按多克隆免疫球蛋白中总免疫球蛋白的质量计,多克隆免疫球蛋白包括至少0.1%、至少0.2%、至少0.3%、至少0.4%、至少0.5%、至少0.6%、至少0.7%、至少0.8%、至少0.9%、至少1%、至少1.1%、至少1.2%、至少1.3%、至少1.4%、至少1.5%、至少1.6%、至少1.7%、至少1.8%、至少1.9%、至少2%、至少2.1%、至少2.2%、至少2.3%、至少2.4%、至少2.5%、至少2.6%、至少2.7%、至少2.8%、至少2.9%、至少3%、至少3.1%、至少3.2%、至少3.3%、至少3.4%、至少3.5%、至少3.6%、至少3.7%、至少3.8%、至少3.9%、至少4%、至少4.1%、至少4.2%、至少4.3%、至少4.4%、至少4.5%、至少4.6%、至少4.7%、至少4.8%、至少4.9%、至少5%、至少5.1%、至少5.2%、至少5.3%、至少5.4%、至少5.5%、至少5.6%、至少5.7%、至少5.8%、至少5.9%、至少5.9%、至少6.0%、至少6.1%、至少6.2%、至少6.3%、至少6.4%、至少6.5%、至少6.6%、至少6.7%、至少6.8%、至少6.9%、至少7.0%、至少7.1%、至少7.2%、至少7.3%、至少7.4%、至少7.5%、至少7.6%、至少7.7%、至少7.8%、至少7.9%、至少8.0%、至少8.1%、至少8.2%、至少8.3%、至少8.4%、至少8.5%、至少8.6%、至少8.7%、至少8.8%、至少8.8%、至少9.0%、至少9.1%、至少9.2%、至少9.3%、至少9.4%、至少9.5%、至少9.6%、至少9.7%、至少9.8%、至少9.8%、至少9.9%或至少10%的完全人类的(或者基本上人类的)免疫球蛋白。
[0112]
在本公开的方法和组合物的一些实施方案中,按多克隆免疫球蛋白中总免疫球蛋白的质量计,多克隆免疫球蛋白包括0.1-0.6%、0.2-0.7%、0.3-0.8%、0.4-0.9%、0.5-1%、0.6-1.1%、0.7-1.2%、0.8-1.3%、0.9-1.4%、1-1.5%、1.1-1.6%、1.2-1.7%、1.3-1.8%、1.4-1.9%、1.5-2%、1.6-2.1%、1.7-2.2%、1.8-2.3%、1.9-2.4%、2-2.5%、2.1-2.6%、2.2-2.7%、2.3-2.8%、2.4-2.9%、2.5-3%、2.6-3.1%、2.7-3.2%、2.8-3.3%、2.9-3.4%、3-3.5%、3.1-3.6%、3.2-3.7%、3.3-3.8%、3.4-3.9%、3.5-4%、3.6-4.1%、3.7-4.2%、3.8-4.3%、3.9-4.4%、4-4.5%、4.1-4.6%、4.2-4.7%、4.3-4.8%、4.4-4.9%、4.5-5%、4.6-5.1%、4.7-5.2%、4.8-5.3%、4.9-5.4%、5-5.5%、5.1-5.6%、5.2-5.7%、5.3-5.8%、5.4-5.9%、5.5-6%、5.6-6.1%、5.7-6.2%、5.8-6.3%或5.9-6.4%的完全人类的(或者基本上人类的)免疫球蛋白。
[0113]
在本公开的方法和组合物的一些实施方案中,按多克隆免疫球蛋白中总免疫球蛋白的质量计,多克隆免疫球蛋白包括0-0.5%、0.5-1%、1-1.5%、1.5-2%、2-2.5%、2.5-3%、3-3.5%、3.5-4%、4-4.5%、4.5-5%、5-5.5%、5.5-6%、6-6.5%、6.5-7%、7-7.5%、7.5-8%、8-8.5%、8.5-9%、9-9.5%、9.5-10%或更多的完全人类的(或者基本上人类的)免疫球蛋白。
[0114]
在本公开的方法和组合物的一些实施方案中,按多克隆免疫球蛋白中总免疫球蛋
白的质量计,多克隆免疫球蛋白包括0-1%、1-2%、2-3%、3-4%、4-5%、5-6%、6-7%、7-8%、8-9%、9-10%或更多的完全人类的(或者基本上人类的)免疫球蛋白。
[0115]
在本公开的方法和组合物的一些实施方案中,按多克隆免疫球蛋白中总免疫球蛋白的质量计,多克隆免疫球蛋白包括0-5%、5-10%、10-15%、15-20%、20-25%、25-30%、30-35%、35-40%或更多的完全人类的(或者基本上人类的)免疫球蛋白。
[0116]
在本公开的方法和组合物的一些实施方案中,按多克隆免疫球蛋白中总免疫球蛋白的质量计,多克隆免疫球蛋白包括0-5%、5-10%、10-15%、15-20%、20-25%、25-30%、30-35%、35-40%或更多的完全人类的(或者基本上人类的)免疫球蛋白。
[0117]
在本公开的方法和组合物的一些实施方案中,按多克隆免疫球蛋白中总免疫球蛋白的质量计,多克隆免疫球蛋白包括至少1%、至少2%、至少3%、至少4%、至少5%、至少6%、至少7%、至少8%、至少9%或至少10%的完全人类的(或者基本上人类的)免疫球蛋白。
[0118]
在本公开的方法和组合物的一些实施方案中,按多克隆免疫球蛋白中总免疫球蛋白的质量计,多克隆免疫球蛋白包括1-4%、2-5%、3-6%、4-7%、5-8%、6-9%或7-10%的完全人类的(或者基本上人类的)免疫球蛋白。
[0119]
在本公开的方法和组合物的一些实施方案中,按多克隆免疫球蛋白中总免疫球蛋白的质量计,多克隆免疫球蛋白包括至少5%的完全人类的免疫球蛋白。
[0120]
在本公开的方法和组合物的一些实施方案中,按多克隆免疫球蛋白中总免疫球蛋白的质量计,多克隆免疫球蛋白包括2%至5%的完全人类的免疫球蛋白。
[0121]
在一些实施方案中,有蹄类动物源性多克隆免疫球蛋白包括具有人类重链和有蹄类动物κ轻链的“嵌合”人类免疫球蛋白(称作“cigg”)。在一些实施方案中,多克隆免疫球蛋白包括占总蛋白浓度的百分比小于约0.5%、小于约0.75%、小于约1.0%、小于约1.25%、小于约1.5%、小于约1.75%、小于约2.0%、小于约2.25%、小于约2.5%、小于约2.75%、小于约3.0%、小于约3.25%、小于约3.5%、小于约3.75%或小于约4.0%的cigg。在一些实施方案中,多克隆免疫球蛋白包括占总蛋白浓度的百分比约0.5%至约1.0%、约1.0%至约1.5%、约1.5%至约2.0%、约1.5%至约2.0%、约2.0%至约2.5%或约2.5%至约3.0%的cigg。在一些实施方案中,多克隆免疫球蛋白包括占总蛋白浓度的百分比约0.5%至约1.0%、约1.0%至约2.0%或约1.0至约3.0%的cigg。
[0122]
在一些实施方案中,本公开的多克隆免疫球蛋白在补体依赖性细胞毒性(cdc)测定比参考产品(例如,即复宁(thymoglobulin)或atgam)更具效力。在一些实施方案中,本公开的多克隆免疫球蛋白在补体依赖型细胞毒性(cdc)测定中的效力比参考产品(例如,即复宁或atgam)高至少约5%、至少约10%、至少约25%、至少约50%、至少约100%、至少约150%或高至少约200%。
[0123]
在一些实施方案中,相比于参考产品(例如,即复宁或atgam),本公开的多克隆免疫球蛋白对cd8 细胞生成更高的毒性。在一些实施方案中,本公开的多克隆免疫球蛋白在cd8 细胞杀伤测定中的效力比参考产品(例如,即复宁或atgam)高至少约5%、至少约10%、至少约25%、至少约50%、至少约100%、至少约150%或至少约200%。
[0124]
在一些实施方案中,相比于参考产品(例如,即复宁或atgam),本公开的多克隆免疫球蛋白生成更低的cd4 t细胞凋亡率。在一些实施方案中,本公开的多克隆免疫球蛋白在
cd4 细胞凋亡测定中的毒性比参考产品(例如,即复宁或atgam)低至少约5%、至少约10%、至少约25%、至少约50%、至少约100%、至少约150%或至少约200%。
[0125]
在一些实施方案中,相比于参考产品(例如,即复宁或atgam),本公开的多克隆免疫球蛋白更好地将t
reg
保持到常规t细胞定量。在一些实施方案中,本公开的多克隆免疫球蛋白对t
reg
细胞的毒性比参考产品(例如,即复宁或atgam)低至少约5%、至少约10%、至少约25%、至少约50%、至少约100%、至少约150%或至少约200%。
[0126]
在本公开的方法和组合物的一些实施方案中,完全人类的(或者基本上人类的)免疫球蛋白的群体特异性结合人类胸腺细胞、t细胞、b细胞和/或单核细胞。在一些实施方案中,完全人类的(或者基本上人类的)免疫球蛋白的群体特异性结合人类胸腺细胞。
[0127]
本公开还提供通过用人类胸腺细胞免疫转基因有蹄类动物产生的组合物,其中组合物包括完全人类的或基本上人类的免疫球蛋白的群体,并且其中完全人类的或基本上人类的免疫球蛋白的群体特异性结合人类胸腺细胞、t细胞、b细胞和/或单核细胞。
[0128]
在一些实施方案中,转基因有蹄类动物的基因组包括人类免疫球蛋白基因座。
[0129]
在一些实施方案中,转基因有蹄类动物被免疫3次、4次、5次或更多次。
[0130]
在一些实施方案中,在免疫后从转基因有蹄类动物的血清纯化完全人类的或者基本上人类的免疫球蛋白的群体。
[0131]
本公开提供向有需要的受试者提供抗胸腺细胞球蛋白(atg)治疗的方法,方法包括向受试者施用根据本公开的多克隆免疫球蛋白。在一些实施方案中,方法向受试者提供有效量的抗胸腺细胞球蛋白(atg)。在一些实施方案中,受试者患有i型糖尿病。在一些实施方案中,受试者是器官移植接受者。在一些实施方案中,受试者患有移植物抗宿主病或者有患移植物抗宿主病的风险。在一些实施方案中,受试者是干细胞移植接受者。
[0132]
本公开提供向有需要的受试者提供抗胸腺细胞球蛋白(atg)治疗的方法,方法包括向受试者施用通过用人类胸腺细胞免疫转基因有蹄类动物产生的组合物。在一些实施方案中,方法向受试者提供有效量的抗胸腺细胞球蛋白(atg)。在一些实施方案中,受试者患有i型糖尿病。在一些实施方案中,受试者是器官移植接受者。在一些实施方案中,受试者患有移植物抗宿主病或者有患移植物抗宿主病的风险。在一些实施方案中,受试者是干细胞移植接受者。
[0133]
本公开提供向有需要的受试者提供抗胸腺细胞球蛋白(atg)治疗的方法,方法包括向受试者施用根据本公开产生的多克隆免疫球蛋白。在一些实施方案中,方法向受试者提供有效量的抗胸腺细胞球蛋白(atg)。在一些实施方案中,受试者患有i型糖尿病。在一些实施方案中,受试者是器官移植接受者。在一些实施方案中,受试者患有移植物抗宿主病或者有患移植物抗宿主病的风险。在一些实施方案中,受试者是干细胞移植接受者。
[0134]
例如,用于atg治疗的说明性方法在下列参考文献中提供:
[0135]
voltarelli,j.c.,et al.(2007)autologous nonmyeloablative hematopoietic stem cell transplantation in newly diagnosed type 1diabetes mellitus.jama.297(14):1568-76.
[0136]
couri,c.e.,et al.(2009)c-peptide levels and insulin independence following autologous nonmyeloablative hematopoietic stem cell transplantation in newly diagnosed type 1 diabetes mellitus.jama.301(15):1573-9.
[0137]
haller,m.j.,et al.,(2015)anti-thymocyte globulin/g-csf treatment preserves beta cell function in patients with established type 1diabetes.j clin invest.125(1):448-55.
[0138]
haller,m.j.,et al.,(2018)low-dose anti-thymocyte globulin(atg)preserves beta-cell function and improves hba1c in new-onset type 1diabetes.diabetes care.41(9):1917-1925.
[0139]
本公开还提供药物组合物,药物组合物包括完全人类的或者基本上人类的免疫球蛋白的群体,以及一种或更多种药学上可接受的赋形剂。在一些实施方案中,完全人类的或者基本上人类的免疫球蛋白的群体特异性结合人类胸腺细胞、t细胞、b细胞和/或单核细胞。
[0140]
在一些实施方案中,药物组合物包括至少约1mg/ml、至少约50mg/ml、至少约100mg/ml或至少约1000mg/ml的完全人类的或者基本上人类的免疫球蛋白。在一些实施方案中,药物组合物包括至少约100μg/ml、至少约250μg/ml、至少约500μg/ml、至少约750μg/ml或至少约1000μg/ml的完全人类的或者基本上人类的免疫球蛋白。
[0141]
在一些实施方案中,在有蹄类动物中产生完全人类的或者基本上人类的免疫球蛋白。在一些实施方案中,有蹄类动物是牛。
[0142]
在一些实施方案中,按药物组合物中总免疫球蛋白的质量计,药物组合物包括至少5%的完全人类的免疫球蛋白。
[0143]
在一些实施方案中,按药物组合物中总免疫球蛋白的质量计,药物组合物包括2%至5%的完全人类的免疫球蛋白。
实施例
[0144]
下列具体实施例应被解释为仅是说明性的,而不以任何方式限制本公开的其余部分。
[0145]
实施例1
[0146]
转染色体牛(tcb)系统中人类多克隆atg的生产
[0147]
我们报告了克服动物atg的已知限制的新型人类多克隆atg产品(本文称作“tcb产品”)的开发。我们利用diversitab
tm
平台技术、转染色体牛(tcb)系统,其中具有牛ig基因座被人类人工染色体替换的母牛表达完全人类的多克隆抗体。
[0148]
用人类胸腺细胞和佐剂以3-5周的间隔免疫tcb受试者。在第3次至第5次疫苗接种(v3-v5)后收集超免疫血浆。免疫研究设计概括在表1中。在疫苗接种5(v5)后第7、11和14天从受试者动物收集的超免疫血浆的量为按动物重量(bw)计的血浆的2.1%。
[0149]
表1
[0150][0151]
补体依赖型细胞毒性
[0152]
补体依赖性细胞毒性(cdc)与atgam和即复宁相当,sab-atg效力从v3/v4增加到v5。通过nanodrop
tm
分光光度计仪器(该仪器在260nm波长下测量总蛋白质)测量每个样品中的免疫球蛋白浓度。
[0153]
cdc测定是基于细胞计数技术的测定,其中血清、血浆、处理中的或经纯化的抗体产品与人类pbmc孵育,随后与兔补体孵育。对人类淋巴细胞特异性的抗体将与细胞结合,并且补体随后将转而与免疫球蛋白和细胞两者结合。补体是与细胞结合时,最终导致细胞裂解的蛋白质的级联。使用细胞活力染料(如viacount)测量细胞死亡。当在流式细胞仪上读取样品时计算存活细胞的比例。通过绘制相对于抗体浓度的细胞活力百分比,可以计算lt
25
值。该值表示杀死25%的细胞所需的抗体量。较低的值转化为较高的atg效力或活性。如果需要,可以随后使用cf
25
对该值进行标准化。
[0154]
使用兔补体的cdc测定的结果在表2中示出。对于兔补体,tcb产品具有与兔源性即复宁类似的cdc效力。
[0155]
表2
[0156][0157]
lt
25
意为在存在兔补体的情况下25%的人类pbmc裂解的igg浓度。
[0158]
cf
25
意为第25个百分位的细胞毒性因子。其是用于解释测定变异的lt
25
的标定,计算为(样品lt
25
/参考lt
25
)
×
参考lt
25
。
[0159]
在进一步的cdc测定中,在疫苗接种3(v3)或疫苗接种5(v5)后,超免疫血浆被吸附到人类红血细胞(rbc)上。使用兔补体测定cdc效力。使用兔补体的cdc测定的结果在表3中示出。较低的值表示较大的效力。
[0160]
表3
[0161][0162][0163]
lt50意为在存在兔补体的情况下50%的人类pbmc裂解的igg浓度。lt50值是来自两天的测定的平均值
[0164]
对于人类补体,tcb产品具有与兔源性即复宁类似的cdc效力(数据未示出)。
[0165]
生物化学表征
[0166]
为了确定人类免疫球蛋白的浓度以及确认血浆样品中不存在牛免疫球蛋白,将产品中的一部分吸附到人类红血细胞(rbc)上。
[0167]
尺寸排阻色谱和sds-page确认其主要含有折叠良好且未聚集的配对重链和轻链igg分子。只有约5.6%(=(62.1-58.6)/62.1)的总蛋白质被吸附到rbc,从而证明即使没有通过吸附到rbc进行纯化,也只有一小部分免疫球蛋白与rbc发生交叉反应。
[0168]
与人类pbmc结合
[0169]
与人pbmc结合的流式细胞术评估(图2):泛t细胞、cd4 和cd8 常规t细胞、treg、nk t细胞、b细胞和中性粒细胞显示tcb产品对t细胞、b细胞和/或单核细胞的特异性与马源性(atgam)和兔源性(即复宁)atg相同。没有观察到单阳性细胞和高度相似的平均荧光强度(mfi)。被tcb产品染色的稀有(~0.4%)rbc也被atgam和即复宁染色,证实tcb产品没有可能禁止人类使用的独特的rbc特异性。
[0170]
t细胞杀伤
[0171]
atg产品部分通过杀伤t细胞实现其医学效果。因此,体外t细胞杀伤是atg产品体内效力的常用替代指标。
[0172]
在非激活条件下,出人意料的是,与即复宁相比,tcb产品对cd8 细胞具有显著更高的毒性,而atgam的效力最低。再次出人意料的是,tcb产品治疗诱导了较低的cd4 t细胞凋亡率,与即复宁相比,保留了更多的cd4 细胞,与常规t细胞相比,treg的保留增加。非激活的t细胞的结果在表4中示出(百分比表示细胞群体, /-标准偏差)。
[0173]
表4
[0174][0175]
在细胞激活后,tcb产品对cd8 细胞和cd4 细胞两者具有细胞毒性(对cd4 细胞更是如此)。出人意料的是,tcb产品比其他atg具有更大的效力。不可预料的是,在更高浓度的tcb产品下,凋亡的cd8 细胞和cd4 细胞比其他atg少,这表明tcb产品介导的细胞毒性更快速并且涉及额外的生物化学途径。pha激活的t细胞的结果在表5中示出(百分比表示细胞群, /-标准偏差)。
[0176]
表5
[0177]
[0178][0179]
总之,sab-atg显示出与商业atg产品类似或更好的结合力和体外细胞毒性。
[0180]
t细胞存活
[0181]
将tcb产品对调控性t(treg)细胞存活的影响与即复宁和进行比较。图3a-3b示出了用马(ho-atg)、兔(rb-atg)或tcb(sab-atg)产品处理的调控性t(treg)细胞的水平。tcb产品保持的treg细胞水平与即复宁类似。
[0182]
对常规t(tconv)细胞进行了类似的测定。激活的tconv细胞和原初tconv细胞的结果分别在图4a-4b和图5a-5b中示出。tcb产品以与即复宁类似的水平诱导t细胞的激活。tcb产品以与即复宁类似的水平减少原初t细胞。
[0183]
尽管本发明的实施方案已经在本文中被示出和描述,但是本领域技术人员将理解,这样的实施方案仅作为示例提供。在不背离本发明的情况下,本领域技术人员将想到许多变化、改变和替换。应当理解的是,在实施本发明时可以采用本文中描述的本发明实施方案的各种替代方案。下列权利要求旨在限定本发明的范围,并且这些权利要求的范围内的方法和结构及其等同物由此被覆盖。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。