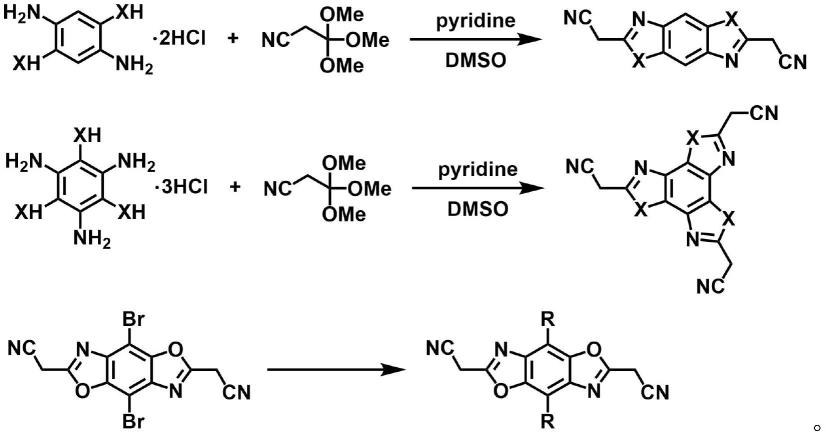
一种检测重组腺相关病毒宿主细胞dna残留的方法
技术领域
1.本发明涉及一种检测dna残留的方法,具体涉及一种检测病毒宿主细胞dna残留的方法。
背景技术:
2.根据市场调研机构fortune business insights发布的报告,2019年基因治疗市场规模为36.1亿美元,预计到2027年将达到356.7亿美元,预测期内的年均复合增长率为33.6%。目前,基因药物的病毒类载体主要是腺相关病毒(adeno-associated virus,缩略为aav)和腺病毒(adenovirus)两大类。
3.2012年11月2日,以1型aav为载体表达脂蛋白脂酶的药物glybera被欧盟正式批准上市,递送表达编码脂蛋白脂肪酶(lipoprotein lipase,缩略为lpl)的转基因,用于治疗lpl缺失患者,但后来于2017年退市。2017年12月20日,美国spark therapeutics公司开发的luxturna获fda批准,用于治疗leber先天性黑蒙2型(leber’s congenital amaurosis 2,缩略为lca2),由于rpe65(retinal pigment epithelium-specific 65kda protein,缩略为rpe65)基因突变而导致失明的患者。它使用aav2平台来递送正常rpe65基因,采用在视网膜下腔直接注射的方法将病毒导入眼球中。这是美国第一个利用aav作为载体,体内直接用药,用于治疗“基因缺失遗传病”的基因治疗药物。2019年5月24日,美国fda(food and drug administration,缩略为fda)批准novartis公司avexis inc.开发的基因治疗产品zolgensma,应用aav9介导表达运动神经元存活蛋白smn1(survival motor neuron gene 1,缩略为smn1),用于治疗smn-1缺失的脊髓性肌萎缩症的婴儿患者。
4.这些基因治疗的成功,激发了raav(recombinant adeno-associated virus,缩略为raav)基因药物的研发热潮。
5.aav是一种隶属细小病毒科(parvoviridae),无包膜的单链线状dna病毒,外形为裸露的20面体颗粒,大小为20~26nm。aav不能独立复制,只有在辅助病毒(如腺病毒、单纯疱疹病毒、痘苗病毒)存在时,才能进行复制。aav病毒的基因组约4700bp,包括上下游两个开放读码框架(open reading frame,缩略为orf),位于分别由145个核苷酸组成的2个反向末端重复序列(inverted terminal repeat,缩略为itr)之间。在两个itr之间编码两个蛋白:cap和rep。其中rep基因参与病毒的复制和整合,cap基因编码病毒衣壳蛋白。
6.raav基因治疗制品的适应症主要集中在单基因遗传病领域,包括血友病、杜氏肌营养不良症、先天性黑蒙症、脂蛋白脂酶缺乏症和阿尔茨海默症等。与传统的替代疗法相比,raav病毒制品在基因层面进行修复,单次给药即有可能达到长期疗效。
7.根据衣壳蛋白的不同,aav可分为12种血清型和100多种变体。不同血清型对人体不同组织的靶向性和感染效率存在差异,如aav8对肝脏组织细胞感染效率较高,aav1和aav9则分别对心脏细胞和骨骼肌细胞更为敏感。raav载体对于骨骼肌、视网膜、肝细胞、心脏平滑肌细胞、神经元细胞、胰岛b细胞、关节滑膜细胞等具有良好的感染效果。
8.raav病毒是安全级别最高的基因治疗载体。raav病毒源于非致病的野生型腺相关
病毒,raav病毒具有结构简单、无致病性、可感染分裂期/非分裂期细胞、不整合至基因组等优势。由于其安全性好、宿主细胞范围广(可感染分裂和非分裂细胞)、免疫源性低,在体内表达外源基因时间长等特点,raav病毒被视为最有前途的基因转移载体之一,在世界范围内的基因治疗和疫苗研究中得到广泛应用。
9.目前,大多数药企和cdmo平台,采用传统的hek293细胞质粒转染方式生产raav病毒。raav病毒生产工艺中,hek293宿主细胞dna残留是表征raav产品质量的重要参数之一。一般对于宿主细胞dna残留,含量应小于10ng/dose,且残留dna片段应小于200bp。准确检测raav病毒的宿主细胞dna残留,是法规和临床安全要求所需。
10.目前,检测raav病毒宿主细胞dna残留,一般是用磁珠法提取病毒中和病毒外的总dna,再检测宿主细胞dna残留。也有使用蛋白酶k裂解病毒的方法,再检测宿主细胞dna残留。这两种方法操作步骤繁琐,耗时长,获得的数据波动大。
技术实现要素:
11.本发明的目的在于,解决上述现有技术的不足,提供了一种用实时荧光定量pcr准确检测raav病毒中hek293宿主细胞dna残留的方法。本发明应用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction),准确检测重组腺相关病毒(recombinantadeno-associate virus,缩略为raav)病毒中hek293宿主细胞dna(host cell dna,缩略为hcd)残留的方法。本发明操作简便,从处理病毒到获得dna残留数据,只需要2.5小时。本发明采用新型prepgem酶裂解raav病毒,5-15分钟内裂解病毒,2-10分钟内使酶失活。病毒裂解液可以直接应用于定量聚合酶链反应(quantitative polymerase chain reaction,缩略为qpcr反应)。本发明检测方法所获得的hek293宿主细胞dna残留,数据稳定,方差比磁珠法和蛋白酶k裂解法都小。
12.一种检测重组腺相关病毒宿主细胞dna残留的方法,包括以下步骤:
13.1.取2-50μl重组腺相关病毒(recombinantadeno-associatedvirus,缩略为raav)病毒工艺中间品样品,加入5-10μl 10x dnase i缓冲液,1-5μl 1%pluronic f-68,1-5μldnase i酶或无核酸酶水,轻轻混合均匀。加入无核酸酶水至总体积为50-100μl,轻轻吹打,混合均匀。将raav病毒放置在37℃水浴中消化30分钟,然后在75℃孵育10-30分钟,使dnase i酶失活。
14.2.加入10-20μl 10x prepgem酶缓冲液,1-20μlprepgem酶,加入无核酸酶水至总体积为100-200μl,轻轻吹打,混合均匀。将混合物置于75℃,孵育5-15分钟,使prepgem酶裂解病毒。然后将混合物置于95℃,孵育2-10分钟,使酶失活。
15.3.取1-10μl病毒裂解液样品,根据宿主细胞dna(host cell dna,缩略为hcd)残留的含量,不稀释或稀释1-1000倍。加入12.5-15μl 2x pcr supermix,2-5μl引物探针,加入无核酸酶水,使聚合酶链反应(polymerase chain reaction,缩略为pcr)体系体积为25-30μl。将pcr反应体系转移入96孔板中,封膜96孔板,轻轻离心30秒,使液滴沉降到96孔板孔底。将96孔板放置入实时荧光定量pcr(real-time fluorescence polymerase chain reaction)仪进行pcr扩增。
16.实时荧光定量pcr反应完成后,分析raav样品中hcd含量。
17.进一步的,raav病毒工艺中间产品样品为hek293细胞裂解上清液。
18.进一步的,所述,pcr扩增的条件为:
19.a:50℃,2分钟
20.b:95℃,10分钟
21.c:95℃,15秒
22.d:58-62℃,60秒
23.e:重复c和d,40个循环
24.f:4℃,保持。
25.本发明有以下创新和优势:
26.1.本发明使用一种新型的酶prepgem直接裂解重组腺相关病毒(recombinant adeno-associated virus,缩略为raav),操作简单方便,只有酶裂解和酶失活两个步骤。5-15分钟内裂解病毒,2-10分钟内使酶失活。两个步骤在同一微量离心管内完成,中间不需要打开微量管添加试剂,需要的人工成本少。与常用的蛋白酶k裂解病毒相比,蛋白酶k需要在55℃裂解病毒1个小时,再在95℃孵育30分钟,使蛋白酶k失活。同样,与使用磁珠法提取dna的方法相比,用磁珠法提取dna操作繁琐,共有33个步骤,处理一个样品至少需要3.5小时;如果处理多个样品,需要的时间更长。
27.2.磁珠法需要的病毒样本量至少是酶裂解方法的2.5倍或更多。
28.3.使用prepgem酶裂解的病毒液可以直接应用于定量聚合酶链反应(quantitative polymerase chain reaction,缩略为qpcr),而蛋白酶k裂解的病毒液至少需要稀释100倍后,才能用于qpcr反应。磁珠法的操作步骤繁多,操作过程中容易丢失样品dna,且洗脱时需要100-200μl洗脱液,实际上造成了dna的稀释。如果aav纯度高,宿主细胞dna(host cell dna,缩略为hcd)残留量较低时,蛋白酶k裂解法和磁珠法可能检测不到信号,或检测的误差大。
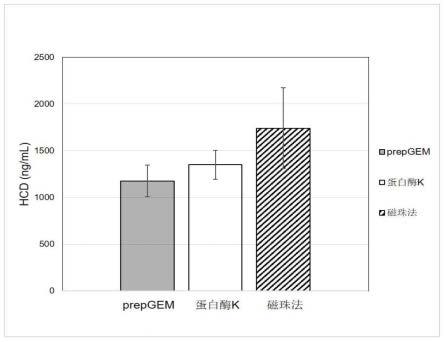
29.4.比较用prepgem酶裂解法、蛋白酶k裂解法、以及用磁珠法提取dna三种方法处理raav病毒工艺中间品获得的hcd残留。raav病毒工艺中间品,即hek293细胞裂解上清液,分别用dnase i酶或无核酸酶水消化后,分别用三种方法处理病毒样品。hcd残留分别用商业化hcd检测试剂盒(湖州申科,cat.no.sk030207h100)和18s基因检测。
30.两种检测方法获得的结果一致。prepgem酶裂解法获得的hcd数据稳定,方差最小。而蛋白酶k裂解法和磁珠法获得的hcd数据波动大,方差大。
31.图1和图2是用商业化hcd检测试剂盒检测得到的hcd残留结果。其中图1是用dnase i酶消化的样品,图2是未用dnase i酶消化的样品。三种方法获得的结果一致,用dnase i酶消化样品的hcd比未用dnase i酶消化样品的hcd低,与预期设想一致。图1中,三种方法处理病毒所获得的hcd残留,均值没有显著差异(本发明定义p value≤0.05为有显著差异,pvalue》0.05为没有显著差异,以下同),pvalue为0.0525;三种方法的方差也没有显著差异,其中prepgem酶裂解法和蛋白酶k裂解法方差比较的pvalue为0.443,prepgem酶裂解法和磁珠法方差比较的p value为0.079,蛋白酶k裂解法和磁珠法方差比较的p value为0.063。虽然raav病毒工艺中间品含有杂质多,prepgem酶裂解法获得的数据稳定,波动小。三种方法中,prepgem酶裂解法的方差最小,磁珠法的方差最大。图2中,三种方法处理病毒所获得的hcd残留,均值没有显著差异,pvalue为0.135;三种方法的方差也没有显著差异,其中prepgem酶裂解法和蛋白酶k裂解法方差比较的pvalue为0.168,prepgem酶裂解法和磁
珠法方差比较的pvalue为0.099,蛋白酶k裂解法和磁珠法方差比较的p value为0.358。同图1,虽然raav病毒工艺中间品含有杂质多,prepgem酶裂解法获得的数据稳定,波动小。三种方法中,prepgem酶裂解法的方差最小,磁珠法的方差最大。
32.图3和图4是用18s基因检测得到的hcd残留结果。其中图3是用dnase i酶消化的样品,图4是未用dnase i酶消化的样品。三种方法获得的结果一致,用dnase i酶消化样品的hcd比未用dnase i酶消化样品的hcd低,与预期设想一致。图3中,三种方法处理病毒所获得的hcd残留,均值没有显著差异,p value为0.075;三种方法的方差有显著差异,其中蛋白酶k裂解法与prepgem酶裂解法和磁珠法均有显著差异,蛋白酶k裂解法和prepgem酶裂解法方差比较的p value为0.016,蛋白酶k裂解法和磁珠法方差比较的p value为0.030,而prepgem酶裂解法和磁珠法没有显著差异,方差比较的p value为0.360。虽然raav病毒工艺中间品含有杂质多,prepgem酶裂解法获得的数据稳定,波动小。在三种方法中,prepgem酶裂解法的方差最小,蛋白酶k裂解法的方差最大。图4中,三种方法处理病毒所获得的hcd残留,均值没有显著差异,p value为0.167。但三种方法的方差有显著差异,其中磁珠法与prepgem酶裂解法和蛋白酶k裂解法均有显著差异,磁珠法和prepgem酶裂解法方差比较的p value为0.050,磁珠法和蛋白酶k裂解法方差比较的pvalue为0.046,而prepgem酶裂解法和蛋白酶k裂解法没有显著差异,方差比较的p value为0.480。虽然raav病毒工艺中间品含有杂质多,prepgem酶裂解法获得的数据稳定,波动小。三种方法中,prepgem酶裂解法的方差最小,磁珠法的方差最大。
33.图1、2、3和4均表明,prepgem酶裂解法获得的数据稳定,波动小。即使用于处理杂质含量高的raav病毒工艺中间品,prepgem酶裂解法的方差比蛋白酶k裂解法和磁珠法都小。
34.5.本发明耐受性好。如图5所示,分别用三个批次的prepgem酶裂解raav病毒工艺中间品,用18s基因检测hcd残留。如图5所示,三个批次酶获得的hcd残留数据稳定,均值没有显著差异,p value为0.844;三个批次酶的方差也没有显著差异,批次1与批次2,批次1与批次3,批次2与批次3之间方差比较的p value分别0.247,0.414和0.316。说明不同批次prepgem酶对于hcd残留的检测没有显著影响。
35.6.本发明成本低,用prepgem酶裂解的方法,成本只有磁珠法的1/6。
36.7.本发明适用于raav病毒工艺中间品和终产品。
附图说明
37.图1是用dnase i酶消化重组腺相关病毒(recombinantadeno-associatedvirus,缩略为raav)工艺中间品,即hek293细胞裂解上清液,比较用prepgem酶裂解、蛋白酶k裂解、以及用磁珠法提取dna三种方法处理raav病毒中间品所得到的宿主细胞dna(host cell dna,缩略为hcd)残留。hcd残留用商业化试剂盒(湖州申科,cat.no.sk030207h100)检测。如图所示,三种方法处理病毒所获得的hcd残留,均值没有显著差异(本发明定义p value≤0.05为有显著差异,p value》0.05为没有显著差异,以下同),p value为0.0525;三种方法的方差也没有显著差异,其中prepgem酶裂解法和蛋白酶k裂解法方差比较的p value为0.443,prepgem酶裂解法和磁珠法方差比较的p value为0.079,蛋白酶k裂解法和磁珠法方差比较的pvalue为0.063。三种方法中,prepgem酶裂解法的方差最小,磁珠法的方差最大。
38.图2是用无核酸酶水取代dnase i酶,比较用prepgem酶裂解、蛋白酶k裂解、以及用磁珠法提取dna三种方法处理所得到的hcd残留。hcd残留用商业化试剂盒(湖州申科,cat.no.sk030207h100)检测。如图所示,三种方法处理病毒所获得的hcd残留,均值没有显著差异,p value为0.135;三种方法的方差也没有显著差异,其中prepgem酶裂解法和蛋白酶k裂解法方差比较的pvalue为0.168,prepgem酶裂解法和磁珠法方差比较的pvalue为0.099,蛋白酶k裂解法和磁珠法方差比较的p value为0.358。三种方法中,prepgem酶裂解法的方差最小,磁珠法的方差最大。
39.图3是用dnase i酶消化raav病毒工艺中间品,即hek293细胞裂解上清液,比较用prepgem酶裂解、蛋白酶k裂解、以及用磁珠法提取dna三种方法处理raav病毒中间品所得到的hcd残留。hcd残留用qpcr方法检测18s基因。如图所示,三种方法处理病毒所获得的hcd残留,均值没有显著差异,pvalue为0.075;三种方法的方差有显著差异,其中蛋白酶k裂解法与prepgem酶裂解法和磁珠法均有显著差异,蛋白酶k裂解法和prepgem酶裂解法方差比较的p value为0.016,蛋白酶k裂解法和磁珠法方差比较的pvalue为0.030,而prepgem酶裂解法和磁珠法没有显著差异,方差比较的p value为0.360。在三种方法中,prepgem酶裂解法的方差最小,蛋白酶k裂解法的方差最大。
40.图4是用无核酸酶水替代dnase i酶,未用dnase i酶消化,比较用prepgem酶裂解、蛋白酶k裂解、以及用磁珠法提取dna三种方法处理所得到的hcd残留。hcd残留用qpcr方法检测18s基因。如图所示,三种方法处理病毒所获得的hcd残留,均比图3中用dnase i酶处理样品获得的对应值高,符合预期设想。三种方法处理病毒所获得的hcd残留均值没有显著差异,p value为0.167。但三种方法的方差有显著差异,其中磁珠法与prepgem酶裂解法和蛋白酶k裂解法均有显著差异,磁珠法和prepgem酶裂解法方差比较的pvalue为0.050,磁珠法和蛋白酶k裂解法方差比较的pvalue为0.046,而prepgem酶裂解法和蛋白酶k裂解法没有显著差异,方差比较的pvalue为0.480。三种方法中,prepgem酶裂解法的方差最小,磁珠法的方差最大。
41.图5是用dnase i酶消化raav病毒工艺中间品,即hek293细胞裂解液,然后用3个批次prepgem酶裂解病毒样品,比较不同批次的酶对hcd检测的影响。hcd残留用18s基因检测。如图所示,三个批次prepgem酶所得到的hcd残留,均值没有显著差异,p value为0.844。三个批次的方差也没有显著差异,批次1与批次2,批次1与批次3,批次2与批次3之间方差比较的pvalue分别0.247,0.414和0.316。
具体实施方式
42.实施例1:
43.1.1prepgem酶裂解重组腺相关病毒(recombinantadeno-associatedvirus,缩略为raav)样品。
44.取raav病毒工艺中间品,即hek293细胞裂解上清液,用dnase i酶消化样品中的质粒残留,再用prepgem酶裂解raav病毒,检测raav病毒样品中的宿主细胞dna(host cell dna,缩略为hcd)残留。做同样处理流程,但用无核酸酶水取代dnase i酶,不去除hek293细胞裂解上清液中的质粒残留,作为对照。
45.具体为:取2-50μlraav病毒工艺中间品(hek293细胞裂解上清液)样品,加入5-10μ
l 10x dnase i缓冲液,1-5μl 1%pluronic f-68,1-5μldnase i酶,轻轻混合均匀。加入无核酸酶水至总体积为50-100μl,轻轻吹打,混合均匀。将raav病毒放置在37℃水浴中消化30分钟,然后在75℃孵育10-30分钟,使dnase i酶失活。
46.在另一份病毒样品中,做同样处理,但用无核酸酶水替代dnase i酶,不去除hek293细胞裂解上清液中的质粒残留,作为对照。
47.分别在上述病毒混合物中加入10-20μl 10xprepgem酶缓冲液,1-20μlprepgem酶,加入无核酸酶水至总体积为100-200μl,轻轻吹打,混合均匀。将混合物置于75℃孵育5-15分钟,使prepgem酶裂解raav病毒。然后将混合物置于95℃,孵育2-10分钟,使酶失活。
48.1.2蛋白酶k裂解raav病毒。
49.取raav病毒工艺中间品,即hek293细胞裂解上清液,用dnase i酶消化病毒样品中的质粒残留,再用蛋白酶k裂解raav病毒,检测raav病毒样品中的hcd残留。做同样处理流程,但用无核酸酶水取代dnase i酶,不去除hek293细胞裂解上清液中的质粒残留,作为对照。
50.具体为:取2-50μlraav病毒中间产品(hek293细胞裂解上清液)样品,加入5-10μl 10x dnase i缓冲液,1-5μl 1%pluronic f-68,1-5μldnase i酶,轻轻混合均匀。加入无核酸酶水至总体积为50-100μl,轻轻吹打,混合均匀。将raav病毒放置在37℃水浴中消化30分钟,然后在75℃孵育10-30分钟,使dnase i酶失活。
51.在另一份病毒样品中,做同样处理流程,但用无核酸酶水替代dnase i酶,作为对照。
52.分别在上述病毒混合物中加入10-20μl 10x蛋白酶k缓冲液,1-20μl蛋白酶k,加入无核酸酶水至总体积为100-200μl,轻轻吹打,混合均匀。将混合物置于55℃,孵育60分钟,使蛋白酶k消化raav病毒蛋白外壳。然后将混合物置于95℃,孵育10-30分钟,使蛋白酶k失活。
53.蛋白酶k消化后的病毒样品,需要稀释至少100倍,再进行qpcr反应(定量聚合酶链反应,quantitative polymerase chain reaction,缩略为qpcr)。
54.1.3磁珠法提取总dna。
55.在1.5ml离心管中加入5-100μlraav病毒工艺中间品,即hek293细胞裂解上清液,用dnase i酶消化,或用无核酸酶水替代dnase i酶处理。将raav病毒放置在37℃水浴中消化30分钟,然后在75℃孵育10-30分钟,使dnase i酶失活。用商业化试剂盒提取总dna,具体步骤按照试剂盒说明书进行操作。
56.1.4qpcr(quantitative polymerase chain reaction,缩略为qpcr)扩增反应
57.采用商业化hcd检测试剂盒(湖州申科,cat.no.sk030207h100)进行实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction)扩增。取1.1,1.2和1.3中获得的病毒裂解液或dna样品1-10μl,加入15μl 2x pcr supermix,2-5μl引物探针混合物,加入无核酸酶水,使聚合酶链反应(polymerase chain reaction,缩略为pcr)反应体系体积为30μl。将pcr反应体系转移入96孔板中,封膜96孔板,轻轻离心30秒,使液滴沉降到96孔板孔底。将96孔板放置入实时荧光定量pcr(real-timefluorescence quantitative polymerase chain reaction)仪进行pcr扩增,扩增条件为:a:50℃,2分钟
58.b:95℃,10分钟
59.c:95℃,15秒
60.d:58-62℃,60秒
61.e:重复c和d,40个循环
62.f:4℃,保持
63.实时荧光定量pcr扩增结束后,分析hcd含量。
64.实验结果如图1和图2所示。图1用dnase i酶消化raav病毒工艺中间品,即hek293细胞裂解上清液的质粒残留,比较用prepgem酶裂解、蛋白酶k裂解、以及用磁珠法提取dna三种方法处理raav病毒中间品所得到的hcd残留。hcd残留用商业化试剂盒(湖州申科,cat.no.sk030207h100)检测。如图所示,三种方法处理病毒所获得的hcd残留,均值没有显著差异(本发明定义pvalue≤0.05为有显著差异,pvalue》0.05为没有显著差异,以下同),p value为0.0525;三种方法的方差也没有显著差异,其中prepgem酶裂解法和蛋白酶k裂解法方差比较的pvalue为0.443,prepgem酶裂解法和磁珠法方差比较的pvalue为0.079,蛋白酶k裂解法和磁珠法方差比较的p value为0.063。三种方法中,prepgem酶裂解法的方差最小,磁珠法的方差最大。
65.图2用无核酸酶水取代dnase i酶,比较用prepgem酶裂解、蛋白酶k裂解、以及用磁珠法提取dna三种方法处理所得到的hcd残留。hcd残留用商业化试剂盒(湖州申科,cat.no.sk030207h100)检测。如图所示,三种方法处理病毒所获得的hcd残留,均比图1中的对应值高,符合预期设想。三种方法获得的hcd残留,均值没有显著差异,pvalue为0.135;三种方法的方差也没有显著差异,其中prepgem酶裂解法和蛋白酶k裂解法方差比较的pvalue为0.168,prepgem酶裂解法和磁珠法方差比较的pvalue为0.099,蛋白酶k裂解法和磁珠法方差比较的pvalue为0.358。三种方法中,prepgem酶裂解法的方差最小,磁珠法的方差最大。
66.从图1和图2可以得出,尽管raav病毒工艺中间品杂质多,prepgem酶裂解法获得的hcd数据稳定,与蛋白酶k裂解法和磁珠法相比,prepgem酶裂解法的方差最小。
67.实施例2:
68.2.1,2.2和2.3分别同实施例1.1,1.2和1.3。
69.2.4qpcr扩增
70.采用18s基因检测hcd残留。取1.1,1.2和1.3中获得的病毒裂解液或dna样品1-10μl,加入12.5-15μl 2x pcr supermix,2-5μl 18s基因引物探针混合物,加入无核酸酶水,使pcr反应体系体积为25-30μl。将pcr反应体系转移入96孔板中,封膜96孔板,轻轻离心30秒,使液滴沉降到96孔板孔底。将96孔板放置入实时荧光定量pcr仪进行pcr扩增,扩增条件为:
71.a:50℃,10分钟;
72.b:95℃,10分钟;
73.c:95℃,15秒;
74.d:58-62℃,60秒;
75.e:重复c和d,40个循环;
76.f:4℃,保持。
77.实时荧光定量pcr扩增结束后,分析raav病毒中间品里的hcd含量。
78.图3是用dnase i酶消化raav病毒工艺中间品,即hek293细胞裂解上清液,比较用prepgem酶裂解、蛋白酶k裂解、以及用磁珠法提取dna三种方法处理raav病毒工艺中间品所得到的hcd残留。hcd残留用qpcr方法检测18s基因。如图所示,三种方法处理病毒所获得的hcd残留均值,没有显著差异,pvalue为0.075;三种方法的方差有显著差异,其中蛋白酶k裂解法与prepgem酶裂解法和磁珠法均有显著差异,蛋白酶k裂解法和prepgem酶裂解法方差比较的p value为0.016,蛋白酶k裂解法和磁珠法方差比较的pvalue为0.030,而prepgem酶裂解法和磁珠法没有显著差异,方差比较的p value为0.360。在三种方法中,prepgem酶裂解法的方差最小,蛋白酶k裂解法的方差最大。
79.图4是用无核酸酶水替代dnase i酶,比较用prepgem酶裂解、蛋白酶k裂解、以及用磁珠法提取dna三种方法处理所得到的hcd残留。hcd残留用qpcr方法检测18s基因。如图所示,三种方法处理病毒所获得的hcd残留均值没有显著差异,pvalue为0.167。但三种方法的方差有显著差异,其中磁珠法与prepgem酶裂解法和蛋白酶k裂解法均有显著差异,磁珠法和prepgem酶裂解法方差比较的p value为0.050,磁珠法和蛋白酶k裂解法方差比较的p value为0.046,而prepgem酶裂解法和蛋白酶k裂解法没有显著差异,方差比较的pvalue为0.480。三种方法中,prepgem酶裂解法的方差最小,磁珠法的方差最大。
80.从图3和图4可以得出,尽管raav病毒工艺中间品杂质多,prepgem酶裂解法获得的hcd数据稳定。与蛋白酶k裂解法和磁珠法相比,prepgem酶裂解法的方差最小。
81.图1、2、3和4均表明,prepgem酶裂解法、蛋白酶k裂解法和磁珠法三种方法相比,prepgem酶裂解法的数据稳定,方差最小。蛋白酶k裂解法和磁珠法的数据波动大,方差大。
82.实施例3:
83.取5-10μl 10x dnase i缓冲液,1-5μl1%pluronic f-68,1-5μl dnase i,轻轻混合均匀。加入2-50μl raav病毒工艺中间品(即hek293细胞裂解上清液),加入无核酸酶水至总体积为50-100μl,轻轻吹打,混合均匀。将raav病毒放置在37℃水浴中消化30分钟,以消化raav病毒中的残留质粒。消化后,在raav病毒中加入10-20μl 10x缓冲液,1-20μlprepgem酶,加入无核酸酶水至总体积为100-200μl,轻轻吹打,混合均匀。将混合物置于75℃,孵育5-15分钟,使prepgem酶裂解raav病毒。然后将混合物置于95℃,孵育2-10分钟,使酶失活。
84.取三个批次的prepgem酶裂解raav病毒工艺中间品,检测不同批次的prepgem酶,是否对hcd残留检测有显著影响。hcd残留用18s基因检测。
85.实验结果如图5所示,三个批次的prepgem酶,对于hcd检测结果没有显著影响。三个批次prepgem酶所得到的hcd残留,均值没有显著差异,pvalue为0.844。三个批次酶的方差也没有显著差异,批次1与批次2,批次1与批次3,批次2与批次3之间方差比较的pvalue分别0.247,0.414和0.316。
86.这些数据表明,prepgem酶裂解法有良好的耐受性。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。