1.本发明涉及放线菌培养技术领域,具体为一种利于产孢与次生代谢物产生的新型放线菌培养基。
背景技术:
2.链霉菌(streptomycesspp.)是普遍存在于土壤中的革兰氏阳性细菌,能够显著促进有机物的周转。它们是actinomycetales,streptomycetaceae中最大的属。链霉菌株脱叶链霉菌(streptomycesexfoliatus)ft05w和深蓝链霉菌(s.cyaneus)zea17i分离自植物根部,已被报道在体外实验中表现出对核盘菌(sclerotiniasclerotiorum)有高度抑制作用。
3.链霉菌ft05w和zea17i具有从生菜(lactucasativa)种子萌发和根系发育的早期阶段就与宿主相互作用的能力,及与生菜长期相互作用的潜力。对促进烟草(nicotianatabacum)、蔬菜等种子的萌发,提高番茄(lycopersiconesculentum)、非洲菊(gerberajamesonii)等园艺植物的抗逆性,促进植株生长有一定的作用。两株链霉菌能够溶解磷酸盐、产生几丁质酶等多种次生代谢产物,是优良的真菌病害生防菌株和植物促生菌株。特别是ft05w在农业中具有很高的潜力,可用于管理现有植保产品难以控制的土传病害。
4.磷、氮是植物的必需营养元素,在植物生长发育过程中发挥重要的作用。土壤中含有丰富的磷元素,但绝大多数以难溶性盐的形式存在,无法被植物直接吸收利用。植物根际中存在着大量的能将土壤中难溶性磷转化成植物可以直接吸收的可溶性磷的微生物。氮肥对提高土壤肥力和农业增产增收都发挥了重要作用。但过量、不合理的施氮方式导致氮肥利用率低,能源浪费严重,产生环境问题等。利用能够固定大气中氮气的微生物,为植物提供氮素营养。benson和silvester提出植物根际的链霉菌具有固氮作用,能与植物形成共生关系,进而促进植物的生长。微生物对不同的营养物质包括碳源、氮源、维生素、无机盐和微量元素等利用能力不同。碳源能为生物合成提供碳骨架和碳水化合物,包括蔗糖、葡萄糖、果糖、麦芽糖、可溶性淀粉等;氮源能够为合成氨基酸、蛋白质等提供原料,包括酵母浸粉和蛋白胨等有机氮,以及无机氮如硫酸铵和硝酸盐等。推测新型培养基中存在蔗糖、磷酸氢二钾、酵母浸粉等碳氮源,进而有利于两株链霉菌的产孢和iaa、水解酶等次生代谢产物的产生。
5.研究表明,培养基种类对同种菌株孢子的数量及次级代谢产物的产生等指标存在影响,目前链霉菌常用培养基为高氏一号琼脂培养基(g1)和isp2培养基(isp2),而经高氏一号琼脂培养基(g1)和isp2培养基(isp2)对链霉菌培养时的产孢量与次生代谢物产量较低,所以如何优化ft05w和zea17i的产孢量和次级代谢产物的量是急需解决的问题。
技术实现要素:
6.本发明的目的在于提供一种利于产孢与次生代谢物产生的新型放线菌培养基,以解决上述背景技术中提出的问题。
7.为了解决上述技术问题,本发明提供如下技术方案:一种利于产孢与次生代谢物产生的新型放线菌培养基,包括以下原料:蔗糖、硝酸钠、磷酸氢二钾、硫酸镁、氯化钾、硫酸亚铁、酵母浸粉和琼脂。
8.在一个优选的实施方式中,所述培养基中各原料的浓度为:蔗糖28-32g/l、硝酸钠2-4g/l,磷酸氢二钾0.8-1.2g/l,硫酸镁0.4-0.6g/l,氯化钾0.4-0.6g/l,硫酸亚铁0.008-0.012g/l,酵母浸粉2-4g/l,琼脂14-16g/l。
9.在一个优选的实施方式中,所述培养基中各原料的浓度为:蔗糖30g/l,硝酸钠3g/l,磷酸氢二钾1g/l,硫酸镁0.5g/l,氯化钾0.5g/l,硫酸亚铁0.01g/l,酵母浸粉3g/l,琼脂15g/l。
10.在一个优选的实施方式中,按照上述浓度称取培养基中各原料,于1
×
105pa条件下灭菌处理30min,冷却至50-60℃倒平板备用。
11.与现有技术相比,本发明所达到的有益效果是:
12.1、本发明提供的培养基培养的ft05w和zea17i的产孢量相比g1和isp2培养基更高。培养基是影响链霉菌生长孢子形成和产孢量的重要因子之一,产孢量的增加更为未来开发链霉菌类生物制剂的生产及应用奠定重要基础;
13.2、链霉菌株ft05w和zea17i经cy、g1、isp2培养基培养后iaa的含量依次降低;
14.3、ft05w和zea17i经cy培养基培养后的溶磷能力显著高于isp2培养基;固氮能力显著高于g1培养基;
15.4、zea17i于cy培养基培养后的纤维素酶产量显著高于g1和isp2培养基。除此之外,ft05w和zea17i两株链霉菌经cy培养基培养后多种水解酶的产量均高于g1和isp2培养基。
附图说明
16.附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
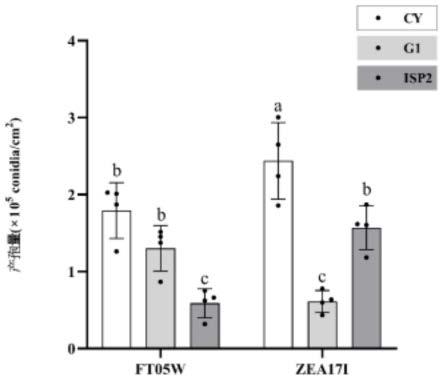
17.图1是本发明与g1培养基和isp2培养基产孢量的对比图;
18.图2是本发明iaa浓度标准曲线图;
19.图3是本发明与g1培养基和isp2培养基iaa分泌能力对比图;
20.图4是本发明与g1培养基和isp2培养基溶解有机磷能力对比图;
21.图5是本发明与g1培养基和isp2培养基固氮能力对比图;
22.图6是本发明与g1培养基和isp2培养基产蛋白酶能力对比图;
23.图7是本发明与g1培养基和isp2培养基淀粉水解能力对比图;
24.图8是本发明与g1培养基和isp2培养基产纤维酶能力对比图。
具体实施方式
25.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
26.实施例:
27.请参阅图1-图8,本发明提供一种利于产孢与次生代谢物产生的新型放线菌培养基,包括以下原料:蔗糖、硝酸钠、磷酸氢二钾、硫酸镁、氯化钾、硫酸亚铁、酵母浸粉和琼脂。
28.在一个优选的实施方式中,所述培养基中各原料的浓度为:蔗糖30g/l,硝酸钠3g/l,磷酸氢二钾1g/l,硫酸镁0.5g/l,氯化钾0.5g/l,硫酸亚铁0.01g/l,酵母浸粉3g/l,琼脂15g/l。
29.在一个优选的实施方式中,按照上述浓度称取培养基中各原料,于1
×
105pa条件下灭菌处理30min,冷却至55℃倒平板备用。
30.(一)产孢量的测定:
31.选取实施例配制的培养基(简称cy),并利用g1培养基和isp2培养基作为对照组对产孢量测量:
32.g1培养基:可溶性淀粉20g/l,硝酸钾1g/l,磷酸二氢钾0.5g/l,硫酸镁0.5g/l,氯化钠0.5g/l,硫酸亚铁0.01g/l,琼脂15g/l;
33.isp2培养基:葡萄糖4g/l,酵母浸粉4g/l,麦芽浸粉10g/l,琼脂20g/l;
34.测试方法为:将链霉菌孢子粉置于装有玻璃珠的无菌水三角瓶中,摇床180r/min振荡分散均匀,血球计数板计数并稀释得到1
×
107孢子/ml的孢悬液。取100μl涂布于3种不同培养基上,并取培养相同时间的平板,在菌落中心至边缘1/2处,用5mm的打孔器制出已产孢的菌饼,取10个菌饼,将其置于有10ml无菌水的15ml离心管中,于漩涡器上充分振荡,用双层纱布过滤,混匀并稀释适当倍数后用血球计数板计数,计算产孢量。每个处理重复3次,取其平均值。
35.产孢量(conidia/cm2)=稀释倍数
×n×
104/nπr2(其中n为5中格内的孢子总数,n为打孔菌饼数,r为打孔器内径)。
36.结果如图1所示,从单位面积产孢量来看,cy、g1、isp2三种液体培养基对ft05w和zea17i产孢量的影响存在差异。两种菌株在cy培养基的培养下的产孢量最大,分别为(1.79
±
0.18)、(2.44
±
0.25)
×
105conidia/cm2,与isp2培养基培养后菌株的产孢量差异显著。ft05w菌株在isp2培养基培养后的产孢量最低为(0.59
±
0.09)
×
105conidia/cm2;zea17i菌株在g1培养基培养后的产孢量最低为(0.61
±
0.07)
×
105conidia/cm2。
37.(二)次生代谢产物的量的测定
38.(1)分泌iaa能力测定
39.采用salkowski’s比色法测定链霉菌分泌iaa(indole-3-aceticacid)的能力。将10μl链霉菌孢子悬浮液(1
×
107cfu/ml)接种至含有0.5mg/ml色氨酸的cy、g1、isp2等不同液体培养基中,并在30℃的黑暗条件下,160r/min的摇床上培育10d。将2ml液体培养物在18000g下离心10min。吸取1ml上清液与1ml salkowski比色液(50ml 35%hclo4和1ml 0.5m fecl3)充分混匀。将试管在黑暗条件下孵化30min。粉红色微光出现表明有吲哚乙酸的产生,颜色变粉红者表示能分泌iaa,颜色越深表示分泌iaa能力越强;不变色为阴性,即不分泌iaa。使用分光光度计测量530nm下的吸光度,标准曲线用纯3-吲哚乙酸制作。标准曲线配制:配制浓度为2、4、6、8、10μg
·
ml-1
的标准溶液,各取0.5ml加入等量salkowski比色液中,于黑暗中静置30min后用紫外分光光度计在波长530nm处测定吸光度值(od)。
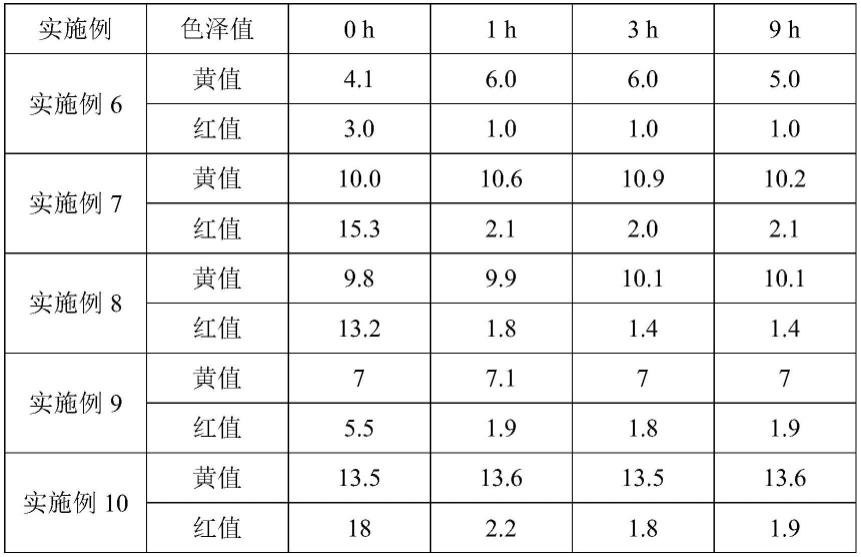
40.两种链霉菌株ft05w和zea17i的不同能力测定见表1:
[0041][0042]
表1
[0043]
注: 表示阳性反应;-表示阴性反应。
[0044]
以iaa标准溶液浓度为横坐标,纵坐标为对应浓度在530nm的吸光值,绘制散点图并添加线性趋势线,得到iaa标准曲线见图2。线性回归方程y=0.0121x-0.0257,r2=0.9685,拟合优度较好。故可根据此方程计算发酵液中iaa的含量。
[0045]
ft05w和zea17i菌株用cy、g1、isp2三种液体培养基摇床培养10d后,定性和定量测定各菌株的iaa能力。结果表明,各菌株iaa的能力和数量存在差异,如图3。测试菌株均具有iaa的能力,ft05w分泌量在(18.69
±
1.82)-(11.66
±
1.97)μg/ml;zea17i分泌量在(18.93
±
1.52)-(11.70
±
1.40)μg/ml。其中cy液体培养基培养的ft05w和zea17i分泌量最大,显著高于菌株于isp2液体培养基的分泌量。
[0046]
(2)分泌载铁离子能力测定
[0047]
使用chrome azurol s(cas)琼脂培养基检测放线菌分泌载铁离子能力。将10μl菌悬液接种至配置好的cas琼脂培养基上,最后在30℃的条件下培育6d。橘黄色光圈出现在菌落周围,光圈与菌落直径的比值表示菌种分泌载铁离子能力。铬天青染液具有毒性,不利于细胞的生长,可采用水琼脂培养基覆盖于cas培养基上,帮助菌体定殖。
[0048]
链霉菌ft05w和zea17i的菌液接至cas琼脂培养基平板上生长后,菌落周围均未出现橘黄色光圈,说明两个菌株无载铁离子能力。与前人研究结果一致。
[0049]
(3)溶磷能力测定
[0050]
使用pikovskayas琼脂培养基和有机磷琼脂培养基检测放线菌的溶无机磷和有机磷能力。将10ul cy、g1、isp2三种液体培养基培养的菌悬液接种至培养基中央,随后在27℃
±
2℃的条件下培育6d,之后测定透明圈(溶磷圈)(d)和菌落的直径(d)。透明圈与菌落直径的比值(d/d)表示菌种溶解磷酸盐的能力,比值越大溶磷能力越强,比值越小溶磷能力越
弱,比值为1时表示菌落无溶磷能力。
[0051]
透明圈(溶磷圈)直径(d)、菌落生长直径(d)及比值(d/d)是表明菌株相对能力的一个指标,可明确菌株的溶磷效果。对ft05w和zea17i在pikovskayas和有机磷培养基培养后,用溶磷圈法分别测定了各菌株的d/d值。结果如图4所示,ft05w和zea17i菌株在有机磷培养基中有溶磷圈存在,但在无机磷培养基中均无溶磷圈存在,表明两个菌株有溶解有机磷的能力。各菌株在有机磷培养基上的d/d值大小差异显著,ft05w的d/d值在(1.71
±
0.03)-(1.05
±
0.01),zea17i的d/d值在(1.56
±
0.04)-(1.14
±
0.05)。其中,两个菌株的d/d值大小趋势均为cy》g1》isp2。
[0052]
(4)固氮能力测定
[0053]
将链霉菌点接在阿须贝(ashby)培养基上培养,在27℃
±
2℃下静置培养,并重复接种三代,有菌落形成的即具有固氮活性。ashby培养基:ashby无氮培养基,包括甘露醇10g/l、kh2po
4 0.2g/l、mgso
4 0.2g/l、nacl 0.2g/l、k2so
4 0.3g/l、caco
3 3.5g/l、琼脂18g/l。
[0054]
ft05w和zea17i菌株的固氮能力测定结果如图5所示,两种菌株均有固氮能力,cy、g1、isp2三种液体培养基培养的zea17i菌株在ashby无氮培养基上的菌落直径均大于ft05w。两菌株的菌落直径大小趋势均为cy》isp2》g1。ft05w和zea17i在经cy液体培养基培养后的菌落直径(0.85
±
0.01)、(1.21
±
0.02)cm显著大于经g1液体培养基培养后的直径(0.78
±
0.02)、(0.99
±
0.02)cm。
[0055]
(5)产蛋白酶能力测定
[0056]
检测产生蛋白酶的活性,采用脱脂牛奶琼脂培养基(脱脂奶粉20g/l,琼脂粉15g/l)。吸取10μl用3种不同培养基培养的待测菌株的菌液,缓慢接至平板中央。将平板置于27℃
±
2℃培养箱中培养6d,如果菌落周围能形成透明圈则该菌株就能产生蛋白酶,测量和记录透明圈的直径,并计算比值。
[0057]
将三种培养基培养的链霉菌ft05w和zea17i的菌饼接到脱脂牛奶琼脂培养基平板上生长6d后,其菌饼周围均形成了透明水解圈,表明两株链霉菌在生长的过程中代谢产生了蛋白酶,使菌饼周围出现透明圈,且ft05w的水解圈显著高于zea17i,结果如图6所示,两个菌株经cy培养基培养后在脱脂牛奶琼脂培养基平板上产生的透明水解圈与菌落直径的比值最大,为(3.18
±
0.08)、(2.45
±
0.07),与g1、isp2培养基培养的菌株d/d差异显著。各菌株于g1培养基培养后的d/d值最低(2.80
±
0.04)、(2.10
±
0.04)。
[0058]
(6)淀粉水解试验
[0059]
在淀粉琼脂培养基平板上点种菌株,27℃
±
2℃倒置培养6d。待明显生长后,滴加碘液侵入培养基表面,轻轻旋转,以至于碘液均匀铺满整个平板。观察菌落周围是否有透明圈。有透明圈者为阳性,否则为阴性。测量和记录透明圈的直径,并计算比值。淀粉琼脂培养基:nacl 5g/l,牛肉膏5g/l,可溶性淀粉5g/l,琼脂20g/l。
[0060]
链霉菌ft05w和zea17i的菌液接至淀粉琼脂培养基平板上生长后,用碘液染色,发现各菌落周围出现透明水解圈,说明链霉菌ft05w和zea17i能产生淀粉酶,ft05w的淀粉水解圈显著高于zea17i,结果如图7所示。两株链霉菌均于cy培养基培养后在淀粉琼脂培养基平板上产生的透明水解圈与菌落直径的比值最大(3.30
±
0.06)、(2.58
±
0.05),与g1、isp2培养基培养的菌株d/d差异显著。
[0061]
(7)产纤维酶能力测定
[0062]
检测产生纤维酶的活性,吸取10μl用3种不同培养基培养的待测菌株的菌液,缓慢接至羧甲基纤维素培养基平板上,27℃
±
2℃下培养6d。后用0.1%的刚果红染色液浸染10min,再用1mol/l的nacl溶液脱色5min。观察菌落外围有无透明圈出现。若有清晰的透明圈出现,则证明该菌株可以产纤维素酶,反之,则不产纤维素酶。测量和记录透明圈的直径,并计算比值。羧甲基纤维素培养基:羧甲基纤维素钠5g/l,mgso4·
7h2o 0.1g/l,k2hpo
4 0.25g/l,(nh4)2so
4 0.5g/l,琼脂18g/l。
[0063]
将三种培养基培养的链霉菌ft05w和zea17i的菌液接到羧甲基纤维素培养基平板上生长6d后,先用刚果红染色液染色,后用nacl溶液脱色,菌落周围出现浅黄色的水解圈,说明链霉菌能够产生纤维素酶,结果如图8所示。ft05w经g1培养基培养后在羧甲基纤维素培养基平板上产生的水解圈与菌落直径的比值最大(4.28
±
0.11),与cy、isp2培养基培养后的d/d值无差异。zea17i经cy培养基培养后在羧甲基纤维素培养基平板上产生的水解圈与菌落直径的比值最大(4.39
±
0.09),与g1、isp2培养基培养后的d/d值差异显著。
[0064]
(8)产葡聚糖酶能力测定
[0065]
检测产生葡聚糖酶的活性,吸取10μl用3种不同培养基培养的待测菌株的菌液,缓慢接至葡聚糖培养基平板上,27℃
±
2℃下培养6d。用0.1%的刚果红染色液浸染30min,再用1mol/l的nacl溶液脱色5min。观察菌落外围有无透明圈出现。若有清晰的透明圈出现,则证明该菌株可以产葡聚糖酶,反之,则不产葡聚糖酶。测量和记录透明圈的直径,并计算比值。葡聚糖培养基:葡聚糖30g/l,mgso4·
7h2o 0.5g/l,k2hpo
4 1g/l,nano
3 3g/l,kcl 0.5g/l,feso4·
7h2o 0.01g/l,琼脂20g/l。
[0066]
链霉菌ft05w和zea17i的菌液接至葡聚糖培养基平板上生长后,先用刚果红染色液染色,后用nacl溶液脱色,发现各菌落周围不出现浅色的水解圈,说明两株链霉菌不能产生葡聚糖酶。
[0067]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。