1.本发明属于医药技术领域,具体涉及一种抑制程序性细胞坏死的硫代七元环衍生物及其应用。
背景技术:
2.细胞作为生命体的基本单位,其生存与死亡对于生物个体的发育、进化以及组织器官的生理代谢和平衡起着重要的作用。细胞的死亡方式可分为主动死亡和被动死亡。细胞的主动死亡包括细胞凋亡、程序性细胞坏死、细胞焦亡、铁死亡以及自噬性细胞死亡,其中程序性细胞坏死是由死亡受体介导、caspase蛋白水解酶非依赖性的细胞自主死亡方式,主要受受体相互作用蛋白激酶1(receptor-interacting protein kinase 1,ripk1)、受体相互作用蛋白激酶3(receptor-interacting protein kinase 3,ripk3)和混合系列蛋白激酶结构域样蛋白(mixed lineage kinase domain like protein,mlkl)调控。程序性细胞坏死的发生首先是tnf与细胞膜上的tnf受体1结合,通过tnf受体1驱动ripk1和ripk3形成磷酸激酶复合物并磷酸化下游靶蛋白mlkl诱导mlkl的多聚化,mlkl多聚体转移至细胞膜上,导致细胞膜肿胀、破裂,释放出大量炎症因子,诱发炎症。引起相关炎症疾病。
3.ripk1作为该通路的重要节点,ripk1激酶抑制剂的研究对程序性细胞坏死相关疾病尤为重要。首个ripk1抑制剂necrostatin-1(nec-1)单独和与其他抗癌药组合进行了i/ii期临床试验;dnl747已进入i期临床试验用于治疗阿尔兹海默症以及肌萎缩侧索硬化;dnl758是一种不易透过大脑屏障的ripk1抑制剂,目前用于治疗风湿性关节炎和牛皮癣等自身免疫疾病并对其进行临床前评估。但是,现有的抑制剂存在许多缺陷,如临床数据显示体内无效或者毒性,口服生物利用度低等问题限制了其临床研究。
4.所以,研究和发现一种有效的、选择性的小分子ripk1的抑制剂对于临床程序性坏死相关疾病十分重要。
技术实现要素:
5.本发明的目的是提供一种抑制程序性细胞坏死的硫代七元环衍生物。
6.本发明的第二个目的是提供一种所述抑制程序性细胞坏死的硫代七元环衍生物在制备预防或治疗程序性细胞坏死的药物或作为程序性细胞坏死抑制剂的应用。
7.为了实现上述目的,本发明采用的技术方案如下:
8.本发明的第一方面提供了一种硫代七元环衍生物或其药用盐,结构如通式i所示:
[0009][0010]
其中,r1选自氢、c1~c5烷基;
[0011]
r2选自氢、-si(ch3)3、
[0012][0013]
r3、r4、r5、r6、r7各自独立的选自氢、c1~c5烷基、c1~c5烷氧基、-ocf3、卤素(氟、氯、溴、碘)、-coor8、-no2、-cn、-cf3;r8选自c1~c5烷基。
[0014]
较优选的,所述硫代七元环衍生物中,
[0015]
r1选自氢、甲基、乙基、正丙基、异丙基、叔丁基、正丁基;
[0016]
r2选自氢、-si(ch3)3、
[0017][0018]
r3、r4、r5、r6、r7各自独立的选自氢、甲基、乙基、正丙基、异丙基、叔丁基、正丁基、甲氧基、乙氧基、正丙氧基、异丙氧基、叔丁氧基、-ocf3、氟、氯、溴、碘、-coor8、-no2、-cn、-cf3;r8选自甲基、乙基、正丙基、异丙基、叔丁基、正丁基。
[0019]
最优选的,所述硫代七元环衍生物选自以下化合物的一种:
[0020]
[0021]
[0022]
[0023][0024]
本发明的第二方面提供了一种所述硫代七元环衍生物或其药用盐在制备预防或治疗程序性细胞坏死的药物或在制备程序性细胞坏死抑制剂中的应用。
[0025]
本发明的第三方面提供了一种所述硫代七元环衍生物或其药用盐在制备抗肿瘤的药物中的应用。
[0026]
所述肿瘤的细胞为人结肠癌细胞(ht-29)。
[0027]
由于采用上述技术方案,本发明具有以下优点和有益效果:
[0028]
本发明的新型硫代七元环衍生物可以用于预防或治疗程序性细胞坏死所引起的炎症性、感染性、缺血性或退行性相关疾病,可以作为预防或治疗程序性细胞坏死的药物或作为程序性细胞坏死抑制剂使用。
[0029]
本发明提供了该类新型硫代七元环衍生物或其药用盐可以作为程序性细胞坏死相关激酶抑制剂,还可以作为程序性细胞坏死抑制剂,有效地抑制细胞坏死;可以用于制备程序性细胞坏死相关疾病的防治药物,或制备由程序性细胞坏死相关激酶紊乱、过度激活或过度相互作用引起的炎症性、感染性、缺血性或退行性相关疾病或组织损伤的药物。本发明合成简单,合成成本低。
具体实施方式
[0030]
为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
[0031]
下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商
所建议的条件。所有原料未注明合成方法的均购自探索平台、毕得、sigma-aldrich等厂家,均为分析纯。
[0032]
以下化合物的制备从原料到最终产物,没有涉及手心中心的反应,因此最终产物的构型与原料n-boc-丝氨酸的构型保持一致。
[0033]
实施例1
[0034]
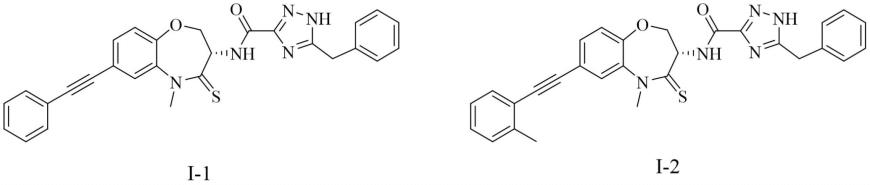
(s)-5-苄基-n-(5-甲基-7-(苯乙炔基)-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三唑-3-甲酰胺即化合物i-1的制备:
[0035][0036]
步骤a:(s)-叔丁基-(5-甲基-4-氧代-7-苯乙炔基)-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)氨基甲酸酯化合物2
[0037]
将化合物1(0.500g,1.35mmol)、碘化亚铜(0.064g,0.034mmol)和双三苯基二氯化钯(0.118g,0.169mmol)加到dmf(20ml)和dipea(25ml)中,氮气保护条件85℃加热搅拌6小时,tlc监测反应完全后加水淬灭,乙酸乙酯萃取,饱和氯化钠溶液洗涤3次,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含0-10%乙酸乙酯的石油醚溶液),得0.382g白色固体化合物2,收率72.10%。
[0038]
步骤b:化合物3的制备
[0039]
将化合物2(0.382g,0.97mmol)和劳森试剂(0.432g,1.07mmol)溶于甲苯溶液中,氮气保护条件95℃加热搅拌8小时。tlc监测,反应完全后待反应冷却至室温,加入乙酸乙酯稀释,减压浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含0-10%乙酸乙酯的石油醚溶液),得0.335g白色固体化合物3,收率84.25%。
[0040]
步骤c:化合物4的制备
[0041]
将化合物3(0.335g,0.82mmol)溶于3ml二氯甲烷中,然后加入1ml三氟乙酸,氮气保护条件室温搅拌0.5小时。tlc监测,反应完全后加入二氯甲烷稀释,用饱和碳酸氢钠中
和,二氯甲烷萃取,饱和氯化钠溶液洗涤3次,无水硫酸钠干燥,过滤,在减压下浓缩,得0.159g化合物4,收率63.0%。
[0042]
步骤d:目标化合物i-1的制备:
[0043]
在室温条件下,将化合物4(0.159g,0.52mmol)和化合物5(该化合物制备参考文献:cn105121432a)(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
1,收率78%。收率80%。1h nmr(600mhz,dmso-d6)δ14.36(s,1h),8.54(d,j=8.0hz,1h),7.85(d,j=2.0hz,1h),7.60
–
7.57(m,3h),7.46
–
7.44(m,3h),7.35
–
7.20(m,6h),5.05
–
4.99(m,1h),4.50
–
4.44(m,2h),4.15(s,2h),3.82(s,3h).hrms(esi,positive)m/zcalcd for c
28h23
n5o2s[m h]
496.1657;found 496.1652.
[0044]
实施例2
[0045]
(s)-5-苄基-n-(5-甲基-4-硫氧基-7-(邻甲苯乙炔基)-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三唑-3-甲酰胺即化合物i-2的制备:
[0046][0047]
化合物6按照实施例1的方法步骤制备。
[0048]
在室温条件下,将化合物6(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
2,收率78%。1h nmr(500mhz,dmso-d6)δ14.36(s,1h),8.55(d,j=8.0hz,1h),7.85(d,j=2.0hz,1h),7.60(dd,j=8.3,2.0hz,1h),7.52(d,j=7.6hz,1h),7.35
–
7.21(m,9h),5.07
–
5.00(m,1h),4.51
–
4.44(m,2h),4.15(s,2h),3.82(s,3h),2.49(s,3h).hrms(esi,positive)m/z calcd for c
29h25
n5o2s[m h]
508.1809;found 508.1794.
[0049]
实施例3
[0050]
(s)-5-苄基-n-(5-甲基-4-硫氧基-7-(间甲苯乙炔基)-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三氮唑-3-甲酰胺即化合物i-3的制备:
[0051][0052]
在室温条件下,将化合物7(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入
到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
3,收率78%。1h nmr(500mhz,dmso-d6)δ14.36(s,1h),8.55(d,j=8.0hz,1h),7.84(d,j=2.0hz,1h),7.58(dd,j=8.3,2.0hz,1h),7.41
–
7.25(m,10h),5.05
–
5.00(m,1h),4.50
–
4.43(m,2h)4.15(s,2h),3.82(s,3h),2.33(s,3h).hrms(esi,positive)m/z calcd for c
29h25
n5o2s[m h]
508.1809;found 508.1783.
[0053]
实施例4
[0054]
(s)-5-苄基-n-(5-甲基-4-硫氧基-7-(对甲苯甲炔基)-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三唑-3-甲酰胺即化合物i-4的制备:
[0055][0056]
在室温条件下,将化合物8(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
4,收率78%。1h nmr(500mhz,dmso-d6)δ8.61(m,1h),7.83(d,j=2.0hz,1h),7.57(dd,j=8.2,2.0hz,1h),7.47(d,j=7.8hz,2h),7.34
–
7.23(m,8h),5.05
–
4.92(m,1h),4.52
–
4.43(m,2h),4.13(s,2h),3.81(s,3h),2.34(s,3h).hrms(esi,positive)m/z calcd for c
29h25
n5o2s[m h]
508.1809;found 508.1816.
[0057]
实施例5
[0058]
(s)-5-苄基-n-(7((2-甲氧基苯基)乙炔基)-5-甲基-4-硫氧基2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三氮唑-3-甲酰胺即化合物i-5的制备:
[0059][0060]
在室温条件下,将化合物9(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
5,收率78%。1h nmr(500mhz,dmso-d6)δ14.37(s,1h),8.56(d,j=7.9hz,1h),7.79(d,j=2.1hz,1h),7.55(dd,j=8.3,2.0hz,1h),7.50(dd,j=7.6,1.7hz,1h),7.43-7.39(m,1h),7.365
–
7.23(m,6h),7.11(dd,j=8.5,
1.0hz,1h),7.00(dd,j=7.5,1.0hz,1h),5.03(d,j=9.0hz,1h),4.46(d,j=7.4hz,2h),4.15(s,2h),3.86(s,4h),3.82(s,3h).hrms(esi,positive)m/z calcd for c
29h25
n5o3s[m h]
524.1758;found 524.1757.
[0061]
实施例6
[0062]
(s)-5-苄基-n-(7((3-甲氧基苯基)乙炔基)-5-甲基-4-硫氧基2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三氮唑-3-甲酰胺即化合物i-5的制备:
[0063][0064]
在室温条件下,将化合物10(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
6,收率78%。1h nmr(300mhz,dmso-d6)δ8.62(d,j=7.9hz,1h),7.85(d,j=2.0hz,1h),7.59(dd,j=8.3,2.0hz,1h),7.38
–
7.24(m,7h),7.17
–
7.12(m,2h),7.04
–
7.00(m,1h),5.07
–
4.98(m,1h),4.55
–
4.42(m,2h),4.13(s,2h),3.82(s,3h),3.79(s,3h).hrms(esi,positive)m/z calcd for c
29h25
n5o3s[m h]
524.1758;found 524.1747.
[0065]
实施例7
[0066]
(s)-5-苄基-n-(7((4-甲氧基苯基)乙炔基)-5-甲基-4-硫氧基2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三氮唑-3-甲酰胺即化合物i-5的制备:
[0067][0068]
在室温条件下,将化合物11(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
7,收率78%。1h nmr(300mhz,dmso-d6)δ14.41(s,1h),8.50(d,j=7.5hz,1h),7.35
–
7.21(m,8h),7.12(d,j=8.4hz,1h),7.06(s,1h),6.99(d,j=8.7hz,2h),4.44
–
4.33(m,2h),4.14(s,2h),3.77(s,3h),3.55(s,3h).lcms( na)558.0.
[0069]
实施例8
[0070]
(s)-5-苄基-n-(5-甲基-4-硫氧基-7-((2-三氟甲氧基)苯基)乙炔基)-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-4h-1,2,4-三唑-3-甲酰胺即化合物i-8的制备:
[0071][0072]
在室温条件下,将化合物12(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
8,收率78%。1h nmr(500mhz,dmso-d6)δ8.65(s,1h),7.85(d,j=2.0hz,1h),7.77(dd,j=7.7,1.7hz,1h),7.63
–
7.50(m,4h),7.39
–
7.24(m,6h),5.08
–
5.03(m,1h),4.56
–
4.46(m,2h),4.15(s,2h),3.83(s,3h).hrms(esi,positive)m/z calcd for c
29h22
f3n5o3s[m h]
578.475;found 548.1479.
[0073]
实施例9
[0074]
(s)-5-苄基-n-(5-甲基-4-硫氧基-7-(3-三氟甲氧基)苯基)乙炔基)-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三唑-3-甲酰胺即化合物i-9的制备:
[0075][0076]
在室温条件下,将化合物13(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
9,收率78%。1h nmr(500mhz,dmso-d6)δ14.37(s,1h),8.56(d,j=8.0hz,1h),7.89(d,j=2.0hz,1h),7.61
–
7.57(m,4h),7.48
–
7.45(m,1h),7.35
–
7.21(m,6h),5.07
–
5.01(m,1h),4.52
–
4.45(m,2h),4.16(s,2h),3.82(s,3h).hrms(esi,positive)m/z calcd for c
29h22
f3n5o3s[m h]
578.475;found 578.1456.
[0077]
实施例10
[0078]
(s)-5-苄基-n-(5-甲基-4-硫氧基-7-(4-三氟甲氧基)苯基)乙炔基)-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三唑-3-甲酰胺即化合物i-10的制备:
[0079][0080]
在室温条件下,将化合物14(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30
分钟,tlc监测,反应完全后用10ml水淬灭,10ml乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
10,收率78%。1h nmr(500mhz,dmso-d6)δ8.62(s,1h),7.88(d,j=2.0hz,1h),7.73
–
7.70(,2h),7.61(dd,j=8.3,2.0hz,1h),7.46
–
7.44(m,2h),7.35
–
7.22(m,6h),5.05
–
5.00(m,1h),4.54
–
4.44(m,2h),4.13(s,2h),3.81(s,3h).hrms(esi,positive)m/z calcd for c
29h22
f3n5o3s[m h]
578.475;found 578.1450.
[0081]
实施例11
[0082]
甲基(s)-2-((3-(5-苄基-1h-1,2,4-三氮唑-3-甲酰胺基)-5-甲基-4-硫氧杂基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-7-基)乙炔基)苯甲酸甲酯即化合物i-11的制备:
[0083][0084]
在室温条件下,将化合物15(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
11,收率78%。1h nmr(500mhz,dmso-d6)δ14.37(s,1h),8.57(d,j=8.0hz,1h),7.95(dd,j=7.9,1.3hz,1h),7.81(d,j=2.0hz,1h),7.73(dd,j=7.8,1.4hz,1h),7.68
–
7.65(m,1h),7.61
–
7.54(m,2h),7.37
–
7.21(m,6h),5.08
–
5.00(m,1h),4.52
–
4.45(m,2h),4.16(s,2h),3.92(s,3h),3.83(s,3h).hrms(esi,positive)m/z calcd for c
30h25
n5o4s[m h]
522.1707;found 522.1684.
[0085]
实施例12
[0086]
甲基(s)-3-((3-(5-苄基-1h-1,2,4-三氮唑-3-甲酰胺基)-5-甲基-4-硫氧杂基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-7-基)乙炔基)苯甲酸甲酯即化合物i-12的制备:
[0087][0088]
在室温条件下,将化合物16(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
12,收率78%。1h nmr(600mhz,dmso-d6)δ14.36(s,1h),8.55(s,1h),8.12(t,j=1.8hz,1h),8.01
–
7.99(m,1h),7.91(d,j=2.0hz,1h),7.85
–
7.84(m,1h),7.64
–
7.60(m,2h),7.35
–
7.24(m,6h),5.03(q,j=8.6hz,1h),4.46
(dd,j=9.7,6.9hz,2h),4.14(s,2h),3.89(s,3h),3.82(s,3h).lcms( h)552.1.
[0089]
实施例13
[0090]
甲基(s)-4-((3-(5-苄基-1h-1,2,4-三氮唑-3-甲酰胺基)-5-甲基-4-硫氧杂基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-7-基)乙炔基)苯甲酸甲酯即化合物i-13的制备:
[0091][0092]
在室温条件下,将化合物17(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
13,收率78%。1h nmr(500mhz,dmso-d6)δ14.37(s,1h),8.55(d,j=8.0hz,1h),8.03
–
8.01(m,2h),7.91(d,j=2.1hz,1h),7.74
–
7.72ii(m,2h),7.64(dd,j=8.3,2.0hz,1h),7.37
–
7.26(m,6h),5.03(q,j=8.6hz,1h),4.52
–
4.44(m,2h),4.15(s,2h),3.88(s,3h),3.82(s,3h).hrms(esi,positive)m/z calcd for c
30h25
n5o4s[m h]
522.1707;found 522.1690.
[0093]
实施例14
[0094]
(s)-5-苄基-n-(7-((2-氟苯基)乙炔基-5-甲基-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-4h-1,2,4-三氮唑-3-甲酰胺即化合物i-14的制备:
[0095][0096]
在室温条件下,将化合物18(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
14,收率78%。1h nmr(600mhz,dmso-d6)δ14.36(s,1h),8.55(d,j=7.9hz,1h),7.87(d,j=2.0hz,1h),7.67
–
7.64(m,1h),7.61(dd,j=8.3,2.0hz,1h),7.53
–
7.49(m,1h),7.38
–
7.21(m,8h),5.06
–
5.01(m,1h),4.50
–
4.45(m,2h),4.15(s,2h),3.82(s,3h).hrms(esi,positive)m/z calcd for c
28h22
fn5o2s[m h]
512.1558;found 512.1552.
[0097]
实施例15
[0098]
(s)-5-苄基-n-(7-((3-氟苯基)乙炔基-5-甲基-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-4h-1,2,4-三氮唑-3-甲酰胺即化合物i-15的制备:
[0099][0100]
在室温条件下,将化合物19(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
15,收率78%。1h nmr(500mhz,dmso-d6)δ8.63(d,j=8.2hz,1h),7.86(s,1h),7.60(d,j=8.3hz,1h),7.52
–
7.42(m,3h),7.35
–
7.22(m,7h),5.06
–
5.01(m,1h),4.52
–
4.45(m,2h),4.13(s,2h),3.82(s,3h).hrms(esi,positive)m/z calcd for c
28h22
fn5o2s[m h]
512.1558;found 512.1545.
[0101]
实施例16
[0102]
(s)-5-苄基-n-(7-((4-氟苯基)乙炔基-5-甲基-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-4h-1,2,4-三氮唑-3-甲酰胺即化合物i-16的制备:
[0103][0104]
在室温条件下,将化合物20(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
16,收率78%。1h nmr(500mhz,dmso-d6)δ8.61(s,1h),7.85(s,1h),7.85
–
7.58(m,3h),7.29(m,8h),5.02(d,j=9.1hz,1h),4.46(d,j=7.8hz,2h),4.13(s,2h),3.81(s,3h).hrms(esi,positive)m/z calcd for c
28h22
fn5o2s[m h]
512.1558;found 512.1538.
[0105]
实施例17
[0106]
(s)-5-苄基-n-(7-((2-氯苯基)乙炔基-5-甲基-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-4h-1,2,4-三氮唑-3-甲酰胺即化合物i-17的制备:
[0107][0108]
在室温条件下,将化合物21(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30
分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
17,收率78%。1h nmr(500mhz,dmso-d6)δ8.62(s,1h),7.86(d,j=2.0hz,1h),7.60(dd,j=8.4,1.8hz,3h),7.53
–
7.51(m,2h),7.34
–
7.22(m,6h),5.05
–
5.00(m,1h),4.53
–
4.44(m,2h),4.13(s,2h),3.81(s,3h).hrms(esi,positive)m/z calcd for c
28h22
cln5o2s[m h]
528.1263;found 528.1239.
[0109]
实施例18
[0110]
(s)-5-苄基-n-(7-((3-氯苯基)乙炔基-5-甲基-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-4h-1,2,4-三氮唑-3-甲酰胺即化合物i-18的制备:
[0111][0112]
在室温条件下,将化合物22(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
18,收率78%。1h nmr(500mhz,dmso-d6)δ14.37(s,1h),8.57(s,1h),7.86(d,j=2.0hz,1h),7.70(dd,j=7.5,1.9hz,1h),7.63
–
7.60(m,2h),7.58
–
7.40(m,2h),7.34(dd,j=17.9,7.9hz,3h),7.28
–
7.23(m,3h),5.06
–
5.01(m,1h),4.51
–
4.45(m,2h),4.14(s,2h),3.82(s,3h).hrms(esi,positive)m/zcalcd for c
28h22
cln5o2s[m h]
528.1263;found 528.1250
[0113]
实施例19
[0114]
(s)-5-苄基-n-(7-((4-氯苯基)乙炔基-5-甲基-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-4h-1,2,4-三氮唑-3-甲酰胺即化合物i-19的制备:
[0115][0116]
在室温条件下,将化合物23(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
19,收率78%。1h nmr(600mhz,dmso-d6)δ14.36(s,1h),8.56(d,j=7.9hz,1h),7.87(d,j=2.0hz,1h),7.66(t,j=1.8hz,1h),7.61(dd,j=8.3,2.0hz,1h),7.55
–
7.46(m,3h),7.33(dd,j=11.9,7.9hz,3h),7.27(d,j=7.7hz,3h),5.05-5.00(m,1h),4.51
–
4.44(m,2h),4.15(s,2h),3.81(s,3h).hrms(esi,
positive)m/z calcd for c
28h22
cln5o2s[m h]
528.1263;found 528.1244
[0117]
实施例20
[0118]
(s)-5-苄基-n-(7-((2-硝基苯基)乙炔基-5-甲基-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-4h-1,2,4-三氮唑-3-甲酰胺即化合物i-20的制备:
[0119][0120]
在室温条件下,将化合物24(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
20,收率78%。1h nmr(500mhz,dmso-d6)δ14.38(s,1h),8.20
–
8.18(m,1h),7.90
–
7.81(m,3h),7.72
–
7.68(m,1h),7.62(dd,j=8.3,2.0hz,1h),7.40
–
7.20(m,7h),5.07
–
5.02(m,1h),4.55
–
4.46(m,2h),4.14(s,2h),3.82(s,3h).hrms(esi,positive)m/z calcd for c
28h22
n6o4s[m h]
539.1503;found539.1471.
[0121]
实施例21
[0122]
(s)-5-苄基-n-(7-((3-硝基苯基)乙炔基-5-甲基-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-4h-1,2,4-三氮唑-3-甲酰胺即化合物i-21的制备:
[0123][0124]
在室温条件下,将化合物25(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
21,收率78%。1h nmr(500mhz,dmso-d6)δ8.62(s,1h),8.37(s,1h),8.27(d,j=8.4hz,1h),8.01(d,j=7.8hz,1h),7.93(s,1h),7.75(t,j=8.1hz,1h),7.66(d,j=8.3hz,1h),7.37
–
7.22(m,6h),5.06
–
5.01(m,1h),4.55
–
4.45(m,2h),4.13(s,2h),3.82(s,3h).hrms(esi,positive)m/z calcd for c
28h22
n6o4s[m h]
539.1503;found 539.1480.
[0125]
实施例22
[0126]
(s)-5-苄基-n-(7-((4-硝基苯基)乙炔基-5-甲基-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-4h-1,2,4-三氮唑-3-甲酰胺即化合物i-22的制备:
[0127][0128]
在室温条件下,将化合物26(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
22,收率78%。1h nmr(500mhz,dmso-d6)δ8.63(d,j=8.0hz,1h),8.30
–
8.28(m,2h),7.94(d,j=2.0hz,1h),7.86
–
7.82(m,2h),7.66(dd,j=8.3,2.0hz,1h),7.38
–
7.22(m,6h),5.06-5.01(m,1h),4.55
–
4.45(m,2h),4.13(s,2h),3.82(s,3h).hrms(esi,positive)m/z calcd for c
28h22
n6o4s[m h]
539.1503;found 539.1483.
[0129]
实施例23
[0130]
(s)-5-苄基-n-(7-((2-氰基苯基)乙炔基-5-甲基-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-4h-1,2,4-三氮唑-3-甲酰胺即化合物i-23的制备:
[0131][0132]
在室温条件下,将化合物27(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
23,收率78%。1h nmr(600mhz,dmso-d6)δ14.35(s,1h),8.55(s,1h),8.99
–
7.97(m,1h),7.88(d,j=2.0hz,1h),7.83
–
7.78(m,2h),7.66
–
7.63(m,2h),7.40(s,1h),7.34
–
7.24(m,5h),5.06
–
5.02(m,1h),4.47(dd,j=9.7,6.8hz,2h),4.14(s,2h),3.82(s,3h).lcms( h)519.1.
[0133]
实施例24
[0134]
(s)-5-苄基-n-(7-((3-氰基苯基)乙炔基-5-甲基-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-4h-1,2,4-三氮唑-3-甲酰胺即化合物i-24的制备:
[0135][0136]
在室温条件下,将化合物28(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并
三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
24,收率78%。1h nmr(500mhz,dmso-d6)δ14.36(s,1h),8.57(s,1h),8.08(t,j=1.8hz,1h),7.92
–
7.88(m,3h),7.67
–
7.61(m,2h),7.36
–
7.22(m,6h),5.06
–
5.00(m,1h),4.51
–
4.45(m,2h),4.14(s,2h),3.81(s,3h).hrms(esi,positive)m/z calcd for c
29h22
n6o2s[m h]
519.1605;found 519.1587.
[0137]
实施例25
[0138]
(s)-5-苄基-n-(7-((4-氰基苯基)乙炔基-5-甲基-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-4h-1,2,4-三氮唑-3-甲酰胺即化合物i-25的制备:
[0139][0140]
在室温条件下,将化合物29(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
25,收率78%。1h nmr(500mhz,dmso-d6)δ8.63(s,1h),7.93
–
7.91(m,3h),7.76(d,j=8.3hz,2h),7.64(dd,j=8.4,2.0hz,1h),7.37
–
7.22(m,6h),5.05-5.00(m,1h),4.55
–
4.44(m,2h),4.13(s,2h),3.81(s,3h).hrms(esi,positive)m/z calcd for c
29h22
n6o2s[m h]
519.1605;found 519.1590.
[0141]
实施例26
[0142]
(s)-5-苄基-n-(5-甲基-4-硫氧基-7-((2-三氟甲基)苯基)乙炔基)-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三氮唑-3-甲酰胺即化合物i-26的制备:
[0143][0144]
在室温条件下,将化合物30(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
26,收率78%。1h nmr(500mhz,dmso-d6)δ14.37(s,1h),8.57(s,1h),7.94(d,j=1.9hz,1h),7.91
–
7.87(m,2h),7.81(dd,j=7.7,1.8hz,1h),7.70(t,j=7.8hz,1h),7.64(dd,j=8.3,2.0hz,1h),7.36
–
7.23(m,6h),5.06
–
5.01(m,1h),4.46(dd,j=9.8,7.0hz,2h),4.15(s,2h),3.82(s,3h).hrms(esi,positive)
m/z calcd for c
29h22
f3n5o2s[m h]
562.1526;found 562.1508.
[0145]
实施例27
[0146]
(s)-5-苄基-n-(5-甲基-4-硫氧基-7-((3-三氟甲基)苯基)乙炔基)-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三氮唑-3-甲酰胺即化合物i-27的制备:
[0147][0148]
在室温条件下,将化合物31(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
27,收率78%。1h nmr(500mhz,dmso-d6)δ14.37(s,1h),8.60
–
8.58(m,1h),7.91(d,j=2.1hz,1h),7.83
–
7.79(m,4h),7.64(dd,j=8.3,2.0hz,1h),7.36
–
7.24(m,6h),5.06
–
5.01(m,1h),4.52
–
4.45(m,2h),4.14(s,2h),3.82(s,3h).hrms(esi,positive)m/z calcd for c
29h22
f3n5o2s[m h]
562.1526;found562.1515.
[0149]
实施例28
[0150]
(s)-5-苄基-n-(5-甲基-4-硫氧基-7-((4-三氟甲基)苯基)乙炔基)-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三氮唑-3-甲酰胺即化合物i-28的制备:
[0151][0152]
在室温条件下,将化合物32(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
28,收率78%。1h nmr(500mhz,dmso-d6)δ8.63(s,1h),7.91(d,j=2.0hz,1h),7.83
–
7.79(m,4h),7.64(dd,j=8.3,2.0hz,1h),7.37
–
7.22(m,6h),5.06-5.00(m,1h),4.55
–
4.44(m,2h),4.13(s,2h),3.82(s,3h).hrms(esi,positive)m/z calcd for c
29h22
f3n5o2s[m h]
562.1526;found 562.1525.
[0153]
实施例29
[0154]
(s)-5-苄基-n-(5-甲基-7-(3-苯基丙酯-1-炔-1-基)-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三氮唑-3-甲酰胺即化合物i-29的制备:
[0155][0156]
在室温条件下,将化合物33(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
29,收率78%。1h nmr(500mhz,dmso-d6)δ8.60(s,1h),7.73(d,j=2.0hz,1h),7.48(dd,j=8.3,2.0hz,1h),7.43(d,j=7.1hz,2h),7.38
–
7.31(m,4h),7.28
–
7.21(m,5h),5.03
–
4.98(m,1h),4.48
–
4.42(m,2h),4.13(s,2h),3.93(s,2h),3.79(s,3h).hrms(esi,positive)m/z calcd for c
29h25
n5o2s[m h]
508.1809;found 508.1801.
[0157]
实施例30
[0158]
(s)-5-苄基-n-(7-乙炔基-5-甲基-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-4h-1,2,4-三氮唑-3-甲酰胺即化合物i-30的制备:
[0159][0160]
在室温条件下,将化合物34(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
30,收率78%。1h nmr(500mhz,dmso-d6)δ14.36(s,1h),8.55(s,1h),7.78(d,j=2.0hz,1h),7.52(dd,j=8.2,2.0hz,1h),7.34
–
7.23(m,6h),5.01
–
4.96(m,1h),4.43(dd,j=9.8,6.9hz,2h),4.33(s,1h),4.13(s,2h),3.78(s,3h).hrms(esi,positive)m/z calcd for c
22h19
n5o2s[m h]
418.1339;found418.1319.
[0161]
实施例31
[0162]
(s)-5-n-(5-甲基-4-硫氧基-7-((三甲基硅基)乙炔基)-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-4h-1,2,4-三氮唑-3-甲酰胺即化合物i-31的制备:
[0163][0164]
在室温条件下,将化合物35(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并
三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
31,收率78%。
[0165]1h nmr(500mhz,dmso-d6)δ14.35(s,1h),8.52(d,j=7.8hz,1h),7.74(d,j=2.1hz,1h),7.49(dd,j=8.3,2.0hz,1h),7.34
–
7.24(m,6h),4.98(q,j=8.6hz,1h),4.43(dd,j=9.5,7.4hz,2h),4.15(s,2h),3.78(s,3h),0.25(s,9h).hrms(esi,positive)m/z calcd for c
25h27
n5o2ssi[m h]
490.1735;found 490.1709.
[0166]
实施例32
[0167]
(s)-5-苄基-n-(7-(环丙基乙炔基)-5-甲基-4-硫氧基-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三氮唑-3-甲酰胺即化合物i-32的制备:
[0168][0169]
在室温条件下,将化合物36(0.159g,0.52mmol)和化合物5(0.211g,1.04mmol)加入到10ml二甲基亚砜中,然后加n,n-二异丙基乙胺(0.108ml,0.62mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.221g,0.57mmol)。将反应液在室温下搅拌30分钟,tlc监测,反应完全后用水淬灭,乙酸乙酯萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,减压下浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含30-50%乙酸乙酯的石油醚溶液),得0.2g白色固体化合物
ⅰ‑
32,收率78%。1h nmr(600mhz,dmso-d6)δ14.36(s,1h),8.53(s,1h),7.63(d,j=2.0hz,1h),7.38(dd,j=8.3,2.0hz,1h),7.32(t,j=7.6hz,2h),7.27
–
7.22(m,4h),4.97(q,j=8.6hz,1h),4.44
–
4.39(m,2h),4.14(s,2h),3.77(s,3h),1.57
–
1.55(m,1h),0.92
–
0.89(m,2h),0.76
–
0.74(m,2h).lcms( h)458.1.
[0170]
对比例1
[0171]
(s)-3-苄基-n-(5-甲基-4-氧代-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三唑-5-甲酰胺(1)的制备即化合物gsk’772的制备:
[0172]
合成路线如下:
[0173][0174]
步骤a:(s)-2-((叔丁氧羰基)氨基)-3-(2-硝基苯氧基)丙酸。
[0175]
在室温条件下,将氢化钠(4.09g,10.23mmol)溶解在二甲基甲酰胺(8ml)中,形成悬浮液。然后,将n-boc-l-丝氨酸(1.0g,4.87mmol)的二甲基甲酰胺(2ml)缓慢滴加到悬浮液中。观察到剧烈的气体逸出,待气体逸出停止,滴加1-氟-2-硝基苯(0.51ml,4.87mmol)。反应液室温搅拌10小时,tlc监测,反应完全后用乙酸乙酯(40ml)和盐酸溶液(0.5m,40ml)萃取,有机层用水(3
×
20ml)和饱和氯化钠溶液(20ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩得到粗产物,粗产物通过硅胶柱色谱纯化(洗脱剂:含10-50%乙酸乙酯的石油醚溶液),得红黄色半固体化合物(s)-2-((叔丁氧羰基)氨基)-3-(2-硝基苯氧基)丙酸1.23g,收率77%。
[0176]
步骤b:(s)-3-(2-氨基苯氧基)-2-((叔丁氧基羰基)氨基)丙酸
[0177]
在室温条件下,将(s)-2-((叔丁氧羰基)氨基)-3-(2-硝基苯氧基)丙酸(1.10g,3.40mmol)和钯/碳(0.11g)加到含有甲醇(10ml)的圆底烧瓶中,在氢气氛围下反应过夜,tlc点板监测,反应完成。用滤纸过滤,滤液减压浓缩,得到浅棕色半固体(s)-3-(2-氨基苯氧基)-2-((叔丁氧基羰基)氨基)丙酸0.98g,收率98%。直接用于下一步,未进一步纯化。
[0178]
步骤c:(s)-叔丁基-(4-氧代-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)氨基甲酸酯
[0179]
在2分钟内将2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(1.25g,3.27mmol)分批加入到(s)-3-(2-氨基苯氧基)-2-((叔丁氧基羰基)氨基)丙酸(0.97g,3.27mmol)和n,n-二异丙基乙胺(0.63ml,3.60mmol)的二甲基亚砜(12ml)溶液中。反应液在室温搅拌30分钟。加入水(30ml)形成沉淀物。将反应液在冰浴中冷却15分钟,过滤。收集的固体用水洗涤并真空干燥,得灰白色固体化合物(s)-叔丁基-(4-氧代-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)氨基甲酸酯0.76g,收率84%。
[0180]
步骤d:(s)-叔丁基-(5-甲基4-氧代-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)氨基甲酸酯
[0181]
在室温和氮气保护下,15分钟内将碘甲烷(0.08ml,1.29mmol)滴加到(s)-叔丁基-(4-氧代-2,3,4,5-四氢苯并[b]-[1,4]恶唑啉-3-基)氨基甲酸酯(0.3g,1.08mmol)和碳酸铯(0.5g,1.51mmol)的二甲基甲酰胺(6ml)溶液中。反应液在室温搅拌2小时。tlc监测反应完成。加入水(20ml)形成沉淀物。将反应液在冰浴中冷却15分钟后过滤。收集的固体用水洗涤并真空干燥,得白色固体化合物(s)-叔丁基-(5-甲基4-氧代-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)氨基甲酸酯0.19g,收率58.1%。
[0182]
步骤e:(s)-3-氨基-5-甲基-2,3-二氢苯并[b][1,4]恶唑啉-4(5h)-酮
[0183]
在室温和氮气保护条件下,将盐酸(4m,0.72ml,2.87mmol)滴加到(s)-叔丁基-(5-甲基4-氧代-2,3,4,5-四氢苯并[b]-[1,4]恶唑啉-3-基)氨基甲酸酯(0.28g,0.96mmol)的二氯甲烷(3ml)溶液中,反应液搅拌3小时。tlc监测,反应完全后用饱和碳酸氢钠中和,二氯甲烷(10ml)萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,在减压下浓缩得到灰白色固体粗产物(s)-3-氨基-5-甲基-2,3-二氢苯并[b][1,4]恶唑啉-4(5h)-酮0.17g,收率90%。
[0184]
步骤f:(e)-2-氨基-2-(2-(2-苯乙酰基)肼基乙酸酯乙酯
[0185]
将硫代草酸乙酯(3.3g,25mmol)和苯乙酰肼(3.3ml,25mmol)溶于无水乙醇(15ml)中,将反应液在圆底烧瓶中搅拌24小时。tlc监测,反应完全后,过滤得到固体,用无水乙醇(2
×
5ml)洗涤,干燥,得到白色固体化合物(e)-2-氨基-2-(2-(2-苯乙酰基)肼基乙酸乙酯5.60g,收率90%。
[0186]
步骤g:5-苄基-1h-1,2,4-三唑-3-羧酸乙酯
[0187]
将(e)-2-氨基-2-(2-(2-(苯基苯基乙酰基)肼基)乙酸乙酯(2.70g,10.90mmol)加到二苯醚(30ml)中,在170℃和氮气保护下加热8小时。tlc监测,反应完全后,将反应液冷却至室温,沉淀出固体。加入石油醚,将反应液在冰/水浴中搅拌15分钟,过滤得固体,用水和石油醚洗涤固体,得白色固体化合物5-苄基-1h-1,2,4-三唑-3-羧酸乙酯2.4g,收率95%。
[0188]
步骤h:5-苄基-1h-1,2,4-三唑-3-羧酸
[0189]
温度为15℃的条件下,将5-苄基-1h-1,2-4-噻唑-3-羧酸乙酯(8.30g,35.85mmol)加到四氢呋喃(100ml)中,然后添加氢氧化锂(2g,84mmol)在水中的溶液(20ml)。将反应液在室温下搅拌20小时。tlc监测,反应完全后,将反应液浓缩以除去四氢呋喃。在0℃条件下,往溶液中加入稀hcl溶液至ph=2,此时沉淀出固体,过滤,用冷水洗涤,真空干燥得白色化合物5-苄基-1h-1,2,4-三唑-3-羧酸5.80g,收率80%。
[0190]
步骤i:(s)-3-苄基-n-(5-甲基-4-氧代-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三唑-5-甲酰胺(gsk’772)。
[0191]
在0℃条件下,将(s)-3-氨基-5-甲基-2,3-二氢苯并[b][1,4]恶唑啉-4(5h)-酮(0.3g,1.56mmol)和5-苄基-1h-1,2,4-三唑-3-羧酸(0.35g,1.72mmol)加入到二氯甲烷(10ml)中,然后滴加1-正丙基磷酸酐(1.4ml,2.34mmol)和n,n-二异丙基乙胺(0.95ml,5.46mmol)。将反应液在室温搅拌30分钟,tlc监测,反应完全后用水(10ml)淬灭,二氯甲烷(10ml)萃取,并用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,在减压下浓缩得到粗产物,粗产物用二甲基亚砜和水重结晶得白色固体化合物(s)-3-苄基-n-(5-甲基-4-氧代-2,3,4,5-四氢苯并[b][1,4]恶唑啉-3-基)-1h-1,2,4-三唑-5-甲酰胺0.47g,收率80%。1h nmr(300mhz,dmso-d6)δ14.39(s,1h),8.41(s,1h),7.50(dd,j=7.1,2.3hz,1h),7.36
–
7.20(m,
8h),4.82(dt,j=11.5,7.8hz,1h),4.59(t,j=10.7hz,1h),4.40(dd,j=9.8,7.7hz,1h),4.12(s,2h),3.31(s,3h).hrms(esi,positive)m/z calcd for c
20h20
n5o3[m h]
378.1566;found378.1573.
[0192]
实施例36
[0193]
本发明实施例1~32及对比例1制备的化合物的体外抗肿瘤活性测试:抗程序性细胞坏死实验。
[0194]
通过z-vad-fmk(20mm)和smac模拟物(10μm)预处理30分钟后,加入htnf-α(20ng/ml)诱导肿瘤细胞(ht-29,人结肠癌细胞)的坏死。将本发明实施例1~32及对比例1的化合物gsk’772与上述组合的细胞一起孵育10小时。使用celltiter-glo发光细胞活力测定试剂盒(promega)测试细胞活性。用spectramax m5酶标仪(molecular devices,california)记录化学发光值,计算ec
50
值,结果见表1。
[0195]
表1.化合物的抗程序性细胞坏死活性
[0196]
[0197][0198]
从表1可以看出,本发明所有化合物对于tnfα诱导的程序性细胞坏死具有良好的抑制活性,这些化合物的活性与对比例1的化合物gsk’772活性相当,化合物i-24的细胞活性明显优于阳性,本发明提供的硫代七元环衍生物可以制备预防或治疗程序性细胞坏死的药物或作为程序性细胞坏死抑制剂使用。
[0199]
以上所述仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本专利的技术人员在不脱离本发明技术方案范围内,当可利用上述提示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明方案的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。