1.本发明属于细胞库构建技术领域,具体涉及一种即用型临床级脐带间充质干细胞工作库的构建方法及应用。
背景技术:
2.干细胞是一类具有自我复制能力的多潜能细胞,随着科技的发展,人类越来越认识到干细胞在临床应用中的巨大价值。其中间充质干细胞是干细胞中最常见的一种,它具有贴壁性,无限增殖和三系分化能力。间充质干细胞来源广泛,骨髓,胎盘,羊膜,脐带,脐带血等都有间充质干细胞的存在,这其中脐带间充质干细胞是研究比较成熟的一种间充质干细胞。
3.人源脐带间充质干细胞(human umbilical cord mesenchymal stem cells,huc-mscs)是一类存在于新生儿脐带组织中,具有多向分化潜能的多能干细胞。在一定条件下,脐带间充质干细胞可分化成多种功能组织和器官。除此之外其还具有材料来源丰富,无伦理问题,免疫原性低等优点,因此脐带间充质干细胞逐渐成为再生医学和组织工程移植的理想种子细胞之一。
4.要使干细胞应用于临床治疗,需要满足一定的条件,比如无动物源成分,内毒素含量低等,因此建立临床级huc-mscs(可达到用于临床的相关质量标准)资源库尤为关键,其不仅可以为干细胞临床研究和应用服务,也可为高校、科研院所、企事业单位等提供满足科学研究需求的干细胞资源。
5.目前,国内外干细胞库对脐带干细胞的保存大部分以科研为主,使用的制备技术和检测技术无法统一,并没有一个标准化方法。
6.此外,现有技术中,一根脐带经传代培养得到p5代细胞,一般仅可达10
10
数量级,细胞数量较少、扩增效率低,构建工作库后不能满足更多人的需求。
7.因此,需要提供一种针对上述现有技术不足的改进技术方案。
技术实现要素:
8.本发明的目的在于提供一种即用型临床级脐带间充质干细胞工作库的构建方法及应用,以解决或改善现有技术中细胞库构建过程中,不能稳定实现临床级脐带间充质干细胞库的构建和/或细胞库构建过程中细胞扩增效率低的问题。
9.为了实现上述目的,本发明提供如下技术方案:一种即用型临床级脐带间充质干细胞工作库的构建方法,包括下述步骤:(1)脐带供体筛选;(2)初代细胞分离:剥离华通氏胶,剪碎,接种至培养容器中,进行初代细胞分离;(3)初代细胞传代:对经步骤(1)处理分离得到的初代细胞进行传代培养,得到p2代细胞;(4)将p2代细胞与冻存液均匀混合,冻存,细胞检验合格,冻存的p2代细胞即为主细胞库;(5)对所述主细胞库进行复苏,并对复苏后的细胞进行传代培养,得到p5代细胞,将p5代细胞与所述冻存液均匀混合,冻存,细胞检验合
格,冻存的p5代细胞即为所述工作库;步骤(5)中传代培养得到的所述p5代细胞的数量为10
12
数量级/根脐带;所述工作库构建过程中用到的原辅料均为药用级。
10.优选地,步骤(1)中,所述脐带供体筛选包括对所述脐带供体进行乙型肝炎病毒、丙型肝炎病毒、艾滋病病毒、梅毒螺旋体、巨细胞病毒、人类嗜t细胞病毒、人乳头瘤病毒和eb病毒检测;步骤(2)包括:将脐带组织放入生物安全柜中,洗涤后使用无菌手术器械去除脐静脉和脐动脉,剥离华通氏胶后,将华通氏胶剪碎呈2-3mm3大小的块状,接种到培养瓶中进行组织块培养,37℃、5%co2培养箱中培养至细胞80%-90%融合,消化,即可分离得到初代细胞;采用组织块培养进行所述初代细胞分离;所述组织块培养时,前5d静置培养,以后每3d更换一次培养基。
11.优选地,步骤(2)、(3)和(5)中,所采用的培养基包括msc-t4基础培养基和终浓度为1%-10%的血小板裂解液。
12.优选地,步骤(3)和(5)中,传代培养时,所述脐带间充质干细胞的接种密度为8000-12000cells/cm2;步骤(3)和(5)中,所述传代培养在37.0℃、5.0%二氧化碳培养箱中进行,每次传代培养至细胞达80%-90%融合后,消化,进行下次传代培养。
13.优选地,所述消化包括:a.向待消化细胞中加入tryple select,室温消化2-7min;b.加入pbs,终止消化;c.对经步骤b处理所得的细胞悬液进行离心;d.离心结束后,pbs重悬细胞,并取样计数;步骤c中,所述离心的离心力为400-450g,离心时间为5-10min。
14.优选地,所述冻存液包括下述体积百分比的组分:所述干细胞冻存液包括下述体积百分比的组分:二甲基亚砜5-8%、谷胱甘肽注射液0.5-1%、羟乙基淀粉氯化钠注射液10-20%、氨甲环酸注射液0.5-1%、人血白蛋白注射液15%、维生素c注射液1.5%和右旋糖酐注射液25-30%,余量为10%葡萄糖注射液;所述谷胱甘肽注射液通过将无菌谷胱甘肽冻干粉溶解于10%葡萄糖注射液后制备得到,所述谷胱甘肽注射液中谷胱甘肽的浓度为0.6%;所述羟乙基淀粉氯化钠注射液中,羟乙基淀粉的浓度为0.06g/ml,氯化钠的浓度为0.009g/ml;所述氨甲环酸注射液中,氨甲环酸的浓度为0.1g/ml;所述人血白蛋白注射液中,人血白蛋白的浓度为20%;所述维生素c注射液中,维生素c的浓度为0.1g/ml;所述右旋糖酐注射液中,右旋糖酐的浓度为6%;所述葡萄糖注射液中葡萄糖的浓度为0.1g/ml。
15.优选地,所述冻存液包括下述体积百分比的组分:二甲基亚砜5%、谷胱甘肽注射液1%、羟乙基淀粉氯化钠注射液15%、氨甲环酸注射液1%、人血白蛋白注射液15%、维生素c注射液1.5%和右旋糖酐注射液25%,余量为10%葡萄糖注射液。
16.优选地,细胞的冻存密度为(2-5)
×
106cells/ml;所述冻存的方法为:向待冻存细胞中加入2-8℃保存的所述冻存液对细胞进行重悬,对得到的细胞悬浮液进行程序降温冻存。
17.本发明还提供了一种即用型临床级脐带间充质干细胞注射液,其采用下述技术方案:一种即用型临床级脐带间充质干细胞注射液,所述注射液由脐带间充质干细胞工作库细胞和生理盐水混合后得到;所述脐带间充质干细胞工作库细胞通过对脐带间充质干细胞工作库进行复苏后得到,所述脐带间充质干细胞存在于复苏后的冻存液中;所述脐带间充质干细胞工作库采用如上所述的方法构建得到。
18.优选地,所述冻存液与所述生理盐水的体积比为1:(3-4);所述复苏在37℃水浴中进行;或通过常温融化复苏;复苏后的所述脐带间充质干细胞工作库细胞在常温条件下存
放48h内的细胞活率≥80%。
19.有益效果:
20.本发明的即用型临床级脐带间充质干细胞工作库的构建方法,在工作库构建过程中用到的原辅料均为药用级,有助于实现脐带间充质干细胞的临床应用;此外,本发明的即用型临床级脐带间充质干细胞工作库的构建方法得到的p5代细胞的数量可达10
12
数量级/根脐带,理论上一根脐带可以满足上千人的治疗需求。
21.本发明的即用型临床级脐带间充质干细胞工作库的构建方法的过程中所采用的各种试剂(原辅料)均为药用级,无动物源成分,采用非动物源性的重组酶tryple select代替常规使用的动物源(猪源)的胰蛋白酶;用人源的血小板裂解液(hpl)代替了常规使用的胎牛血清,因为动物来源物料的残留物及生产过程中引入的污染物,如细菌、真菌、支原体、外源性病毒、农药残留、兽药残留、添加剂及抗生素类药物残留(如三聚氰胺、孔雀石绿)等,可能在使用时引起直接的毒副作用、外源因子污染及有害的免疫应答,引发不良反应。
22.本发明的即用型临床级脐带间充质干细胞工作库的构建方法,对可能感染的各种病毒进行了检测,确保不会携带有病毒。
23.本发明的即用型临床级脐带间充质干细胞工作库的构建方法构建得到的工作库细胞经检验在安全性、致瘤性和免疫调节能力等方面都是合格的,可以满足临床治疗的需要。
24.本发明的脐带间充质干细胞库的构建方法构建得到的细胞库不需要即时放行和风险放行,降低了风险和时间成本,细胞制剂经检测合格后可在液氮中长期存储(例如,可存储5年以上)。
25.本发明的即用型临床级脐带间充质干细胞工作库的构建方法中,我们对培养基进行了优化,优化的培养基(msc培养基)以msc-t4人类间充质干细胞无血清培养基作为基础培养基,再额外加入1-10%的血小板裂解液(hpl)。msc-t4人类间充质干细胞无血清培养基适用于人类间充质干细胞培养,是经过系列优化的基础培养基(用于维持未分化状态和增殖),不含有毒成分。本发明的即用型临床级脐带间充质干细胞工作库的构建方法中所采用的培养基不含有任何动物蛋白质成分,仅含有重组或医疗级人类蛋白质的无血清细胞培养基,可以满足人类间充质干细胞体外长期传代及增殖培养,有助于获取大量细胞。
26.本发明构建细胞库的过程中所采用的冻存液的原料均为药用级,不仅dmso含量低,可批量化生产,而且经过实验对比,冻存效果优于商品化的冻存液。
27.本发明的脐带间充质干细胞工作库可在常温下进行融化复苏,减少水浴复苏的污染风险。
28.本发明的工作库细胞复苏后只要注入生理盐水稀释后就可以直接给病人回输,在医院即可实现操作,无需在gmp生产车间(注入生理盐水的步骤可直接通过注射器注入,不涉及对于细胞的操作,对于操作环境要求小),不仅便捷和降低了对环境的要求,而且经实验验证细胞在此条件下6h内活率维持在90%以上,24h活率维持在85%以上,48h内细胞活率依然维持在80%以。
附图说明
29.构成本技术的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示
意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。其中:
30.图1为本发明实施例提供的即用型临床级脐带间充质干细胞工作库的构建方法流程图;
31.图2为本发明实施例提供的主细胞库p2代细胞(细胞1)的流式检测结果图;
32.图3为本发明实施例提供的主细胞库p2代细胞(细胞2)的流式检测结果图;
33.图4为本发明实施例提供的主细胞库p2代细胞(细胞3)的流式检测结果图;
34.图5为本发明实施例提供的工作库p5代细胞(细胞1)的流式检测结果图;
35.图6为本发明实施例提供的工作库p5代细胞(细胞2)的流式检测结果图;
36.图7为本发明实施例提供的工作库p5代细胞(细胞3)的流式检测结果图;
37.图8为本发明实施例提供的主细胞库p2代细胞和工作库p5代细胞的成脂分化性能检测结果图;
38.图9为本发明实施例提供的主细胞库p2代细胞和工作库p5代细胞的成骨分化性能检测结果图;
39.图10为本发明实施例提供的主细胞库p2代细胞和工作库p5代细胞的成软骨分化性能检测结果图;
40.图11为本发明实施例提供的工作库p5代细胞复苏前后的实物图;
41.图12为本发明实施例提供的工作库p5代细胞复苏后的稳定性检测结果图;
42.图13为本发明实施例提供的工作库p5代细胞在冻存0、1、2和3个月取样复苏检测得到的细胞活率、回收率和贴壁率;
43.图14为本发明实施例提供的不同培养基对脐带间充质干细胞的群加倍数的影响。
具体实施方式
44.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员所获得的所有其他实施例,都属于本发明保护的范围。
45.下面将结合实施例来详细说明本发明。需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
46.本发明针对目前存在的不能稳定实现临床级脐带间充质干细胞库的构建和/或细胞库构建过程中细胞扩增效率低的问题,提供一种即用型临床级脐带间充质干细胞库的构建方法;本发明实施例的即用型临床级脐带间充质干细胞库的构建方法包括下述步骤:(1)脐带供体筛选;(2)初代细胞分离:剥离华通氏胶,剪碎,接种至培养容器中,进行初代细胞分离;(3)初代细胞传代:对经步骤(1)处理分离得到的初代细胞进行传代培养,得到p2代细胞;(4)将p2代细胞与冻存液均匀混合,冻存,细胞检验合格,冻存的p2代细胞即为主细胞库;(5)对主细胞库进行复苏,并对复苏后的细胞进行传代培养,得到p5代细胞,将p5代细胞与冻存液均匀混合,冻存,细胞检验合格,冻存的p5代细胞即为工作库;步骤(5)中传代培养得到的p5代细胞的数量为10
12
数量级/根脐带;工作库构建过程中用到的原辅料均为药用级。
47.本发明优选实施例中,脐带供体筛选包括对供体脐带进行乙型肝炎病毒、丙型肝炎病毒、艾滋病病毒、梅毒螺旋体、巨细胞病毒、人类嗜t细胞病毒、人乳头瘤病毒和eb病毒
病毒检测。
48.本发明优选实施例中,脐带供体筛选还包括排除有病毒感染、家族遗传病史和吸毒史的情况,选取年龄在20-25岁之间健康女性足月生产得到的脐带。
49.本发明优选实施例中,步骤(2)包括:将脐带组织放入生物安全柜中,洗涤后使用无菌手术器械去除脐静脉和脐动脉,剥离华通氏胶后,将华通氏胶剪碎呈2-3mm3大小的块状,接种到培养瓶中进行组织块培养,37℃、5%co2培养箱中培养至细胞80%-90%融合,消化,即可分离得到初代细胞;采用组织块培养进行初代细胞分离;组织块培养时,前5d静置培养,以后每3d更换一次培养基。
50.本发明优选实施例中,步骤(2)、(3)和(5)中,所采用的培养基包括msc-t4基础培养基和终浓度为1%-10%(体积分数,例如,1%、3%、6%、8%或10%)的血小板裂解液。
51.本发明优选实施例中,步骤(3)和(5)中,传代培养时,脐带间充质干细胞的接种密度为8000-12000cells/cm2(例如,8000cells/cm2、10000cells/cm2或12000cells/cm2);步骤(3)和(5)中传代培养在37.0℃、5.0%二氧化碳培养箱中进行,每次传代培养至细胞达80%-90%融合后,消化,进行下次传代培养。
52.本发明优选实施例中,消化包括:a.向待消化细胞中加入tryple select,室温消化2-7min(例如,2min、4min或7min);b.加入pbs,终止消化;c.对经步骤b处理所得的细胞悬液进行离心;d.离心结束后,pbs重悬细胞,并取样计数;步骤c中,离心的离心力为400-450g(例如,400g、420g或450g),离心时间为5-10min(例如,5min、8min或10min)。
53.本发明优选实施例中,冻存液包括下述体积百分比的组分:二甲基亚砜5-8%(例如,5%、6%、7%或8%)、谷胱甘肽注射液0.5-1%(例如,0.5%、0.8%或1%)、羟乙基淀粉氯化钠注射液10-20%(例如,10%、15%、或20%)、氨甲环酸注射液0.5-1%(例如,0.5%、0.8%或1%)、人血白蛋白注射液15%、维生素c注射液1.5%和右旋糖酐注射液25-30%(例如,25%、28%或30%),余量为10%葡萄糖注射液;其中,谷胱甘肽注射液通过将无菌谷胱甘肽冻干粉溶解于10%葡萄糖注射液后制备得到,谷胱甘肽注射液中谷胱甘肽的浓度为0.6%;羟乙基淀粉氯化钠注射液中,羟乙基淀粉的浓度为0.06g/ml,氯化钠的浓度为0.009g/ml;氨甲环酸注射液中,氨甲环酸的浓度0.1g/ml;人血白蛋白注射液中,人血白蛋白的浓度为20%;维生素c注射液中,维生素c的浓度为0.1g/ml;右旋糖酐注射液中,右旋糖酐的浓度为6%;葡萄糖注射液中葡萄糖的浓度为0.1g/ml。
54.本发明优选实施例中,冻存液包括下述体积百分比的组分:二甲基亚砜5%、谷胱甘肽注射液1%、羟乙基淀粉氯化钠注射液15%、氨甲环酸注射液1%、人血白蛋白注射液15%、维生素c注射液1.5%和右旋糖酐注射25%,余量为10%葡萄糖注射液。
55.本发明优选实施例中,细胞冻存的密度为(2-5)
×
106cells/ml(例如,2
×
106cells/ml、2.5
×
106cells/ml或5
×
106cells/ml)。
56.本发明优选实施例中,冻存的方法为:向待冻存细胞中加入2-8℃(例如,2℃、4℃、6℃或8℃)保存的冻存液对细胞进行重悬,对得到的细胞悬浮液进行程序降温冻存。
57.本发明优选实施例中,程序降温冻存包括下述步骤:a.将干细胞与冻存液混匀;b.以1℃/min的降温速率降温至-4℃;c.以25℃/min的降温速率降温至-40℃;d.以10℃/min的升温速率升温至-12℃;e.以1℃/min的降温速率降温至-40℃;f.以10℃/min的降温速率降温至-90℃;g.置于液氮气相中保存。
58.本发明还提出了一种即用型临床级脐带间充质干细胞注射液,本发明实施例的即用型临床级脐带间充质干细胞注射液由脐带间充质干细胞工作库细胞和生理盐水混合后得到;脐带间充质干细胞工作库细胞通过对脐带间充质干细胞工作库进行复苏后得到,脐带间充质干细胞存在于复苏后的冻存液中;脐带间充质干细胞工作库采用如上所述的方法构建得到。
59.本发明优选实施例中,冻存液与所述生理盐水的体积比为1:(3-4)(例如,1:3、1:3.2、1:3.4、1:3.6、1:3.8或1:4);复苏在37℃水浴中进行;或,通过常温融化复苏;复苏后的脐带间充质干细胞工作库细胞在常温条件下存放48h内的细胞活率≥80%。
60.其中,本发明采用冻存袋和特定的冻存液冻存的工作库细胞可以在常温进行复苏的原理尚不明,我们推测是由于冻存袋的表面积比较大,其内的冻存细胞悬液可以大面积地和外界室温进行接触,另外冻存袋的温度传导性也较好,这样较好的避免了冰晶缓慢融化时进入细胞形成再结晶,对细胞造成损害。,实现工作库细胞的常温融化复苏,且使细胞保持较好的存活率。
61.下面通过具体实施例对本发明的脐带间充质干细胞库的构建方法、细胞库及脐带间充质干细胞注射液进行详细说明。
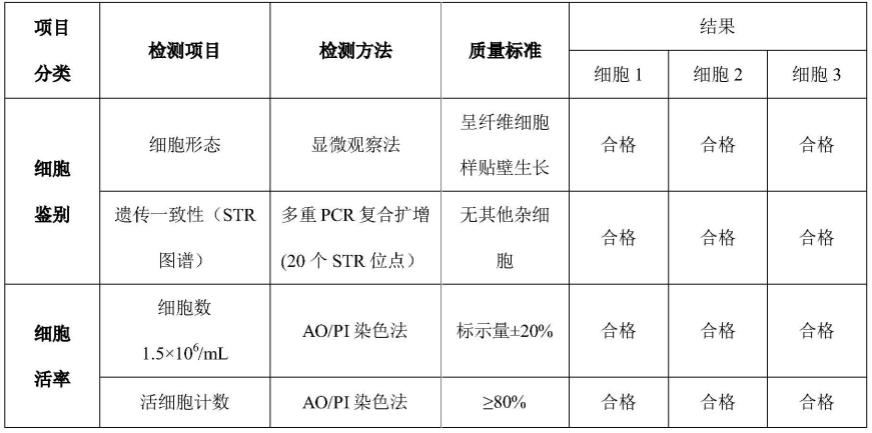
62.实施例1
63.参照图1,本实施例的脐带间充质干细胞库的构建方法,包括下述步骤:
64.(1)供体筛选(样本入场接收):
65.供体检测项目:乙型肝炎病毒、丙型肝炎病毒、艾滋病病毒、梅毒和巨细胞病毒、人类嗜t细胞病毒、人乳头瘤病毒和eb病毒;选取上述病毒检测结果为阴性、无家族遗传病史、无吸毒史且年龄在20-35岁之间的健康女性足月生产后得到的脐带作为供体,用于后续脐带间充质干细胞库的构建。
66.(2)初代细胞分离(脐带间充质干细胞分离(组织块法)):
67.将按照上述方法筛选得到的脐带组织放入生物安全柜中,洗涤后使用无菌手术器械去除脐静脉和脐动脉,剥离华通氏胶,然后将华通氏胶剪碎成2-3mm3大小的小块,接种到培养瓶,将培养瓶置于37℃、5%co2培养箱中进行培养;培养基使用msc-t4基础培养基(csti)和终浓度为5%血小板裂解液混合物,5天内不动培养瓶,以后每3天换液一次。
68.(3)初代细胞传代(脐带间充质干细胞传代p1):
69.待细胞80%左右融合后可以进行传代,传代时使用tryple select消化液室温消化5min左右,加入pbs终止消化,离心后得到p0代细胞;计数,根据8000-12000cells/cm2(推荐为10000cells/cm2),将p0代细胞接种至培养容器(培养基由msc-t4基础培养基和终浓度为5%血小板裂解液组成)后置于37.0℃,5.0%co2培养箱中培养。
70.(4)p1代细胞传代(脐带间充质干细胞传代p2):
71.传代细胞培养3-4d镜下观察p0代细胞至80%融合,此时进行传代。传代方式同p0代,37.0℃,5.0%co2培养箱中培养。
72.(5)主细胞库冻存(p2代细胞冻存):
73.上述传代细胞培养3-4d镜下观察细胞至80%融合,此时进行消化冻存;具体步骤如下:尽弃培养上清,加入适量pbs清洗1遍;之后加入tryple select,室温消化2-7min,加入适量体积的pbs,终止消化;收集细胞悬液到离心管,450g,离心5min,之后用pbs重悬细胞
沉淀混匀,取样计数;离心,向移除上清后的细胞沉淀中加入适量2-8℃冰箱保存的人源脐带间充质干细胞冻存液重悬,使细胞浓度达到200万细胞/ml;混匀,按照1ml/支的规格使用1ml移液器分装至2ml冻存管中,将冻存管插入冻存盒中,冻存盒通过低温保存箱转移到程序性降温仪中,进行冻存。冻存程序为:a.将脐带间充质干细胞与干细胞冻存液混匀;b.以1℃/min的降温速率降温至-4℃;c.以25℃/min的降温速率降温至-40℃;d.以10℃/min的升温速率升温至-12℃;e.以1℃/min的降温速率降温至-40℃;f.以10℃/min的降温速率降温至-90℃;g.置于液氮气相中保存。对冻存细胞进行细胞检验,若细胞检验不合格,则废弃或进行其他研究;若细胞检验合格,则冻存细胞即为主细胞库。
74.上述过程中所采用的冻存液包括下述体积百分比的组分:二甲基亚砜(湘食药辅准字f20090010)5%、谷胱甘肽注射液1%、羟乙基淀粉氯化钠注射液15%、氨甲环酸注射液1%、人血白蛋白注射液15%、维生素c注射液1.5%和右旋糖酐注射25%,余量为10%葡萄糖注射液。其中,谷胱甘肽注射液通过将无菌谷胱甘肽冻干粉溶解于10%葡萄糖注射液后制备得到,谷胱甘肽注射液(国药准字h19991067)中谷胱甘肽的浓度为0.6%;羟乙基淀粉氯化钠注射液(羟乙基淀粉200/0.5氯化钠注射液,国药准字h20061302)中,羟乙基淀粉的浓度为0.06g/ml,氯化钠的浓度为0.009g/ml;氨甲环酸注射液(国药准字h20065839)中,氨甲环酸的浓度0.1g/ml;人血白蛋白注射液(国药准字s10970069)中,人血白蛋白的浓度为20%;维生素c注射液(国药准字h14021211)中,维生素c的浓度为0.1g/ml;右旋糖酐注射液(右旋糖酐40氨基酸注射液,含有2.72%氨基酸;国药准字h44025079)中,右旋糖酐的浓度为6%;葡萄糖注射液(国药准字h43020477)中葡萄糖的浓度为0.1g/ml。
75.(6)主细胞库细胞复苏:
76.从人源脐带间充质干细胞主细胞库中取所需支数的细胞,迅速将细胞置于电热恒温水浴锅中,37.0℃条件下不断摇晃使冻存的细胞迅速融化;之后将融化的细胞缓缓移至已加msc培养基(培养基由msc-t4基础培养基和终浓度为5%血小板裂解液组成)的离心管中,450g,离心5min;离心结束后尽弃上清,用完全培养基重悬细胞沉淀,混匀,计数,按照8000-12000活细胞/cm2的密度接种至培养瓶。
77.(7)p3代(细胞)传代:
78.传代细胞培养3-4d,镜下观察细胞至80%融合,此时进行传代。传代方式同p0代传代方式。
79.(8)p4代(细胞)传代
80.传代细胞培养3-4d镜下观察细胞至80%融合,此时进行传代。传代方式同p0代传代方式。
81.(9)工作库的制备(p5代细胞收获冻存)
82.传代细胞培养3-4d镜下观察细胞至80%融合,此时进行消化冻存。冻存方式同主细胞库(区别仅在于,经蠕动泵灌装到50ml冻存袋中,每袋5000万细胞,体积为10ml);对冻存细胞进行细胞检验,若不合格,则废弃或其他研究;若合格,则作为工作库(液氮气相中保存)。
83.实施例2
84.本发明实施例的脐带间充质干细胞注射液:将实施例1的工作库细胞袋通过超低温运输箱运输到医院,在37℃水浴中快速融化或者常温慢速融化,之后向其中注入30-40ml
生理盐水,上下颠倒3次以混匀细胞悬液,即得本实施例的脐带间充质干细胞注射液。
85.本实施例的脐带间充质干细胞注射液的使用方法:将上述脐带间充质干细胞注射液连接上输液管(参照说明书附图图11)即可静脉回输给病人;回输完毕,再注入一定量的生理盐水到冻存袋中,上下颠倒,把冻存袋洗涤一次,然后把洗液再一次回输给病人,以确保所有的细胞都得到利用。
86.实验例
87.1、对构建得到的主细胞库进行检测
88.(1)按照实施例1中的步骤(1)-(5)对3根脐带组织(三个母本来源)分别进行培养,对主细胞库构建过程中得到的p0代、p1代和p2代细胞收获数量进行检测,实验结果如下表1所示:
89.表1主细胞库构建过程中p0代、p1代和p2代细胞收获数量检测结果
90.细胞编号细胞1细胞2细胞3p0代细胞收获量(
×
106cells)21.520.317.4接种密度(
×
104cells/cm2)1.001.051.00p1代细胞收获量(
×
108cells)2.982.772.24扩增倍数13.813.612.9接种密度(
×
104cells/cm2)1.001.001.00p2代细胞收获量(
×
109cells)3.132.912.87扩增倍数10.510.512.8总扩增倍数144.95142.8165.12
91.注:细胞收获量是把细胞培养到80-90%融合度后,是采用消化酶进行细胞消化,然后通过细胞计数仪进行计数获得,细胞收获量=计数浓度
×
重悬体积;扩增倍数=细胞收获量/细胞接种量
×
100%;
92.(2)对上述细胞1、细胞2和细胞3构建得到的主细胞库进行检测,检测结果如下表2所示:
93.表2主细胞库检测结果
94.[0095][0096]
(3)对上述主细胞库构建过程中收获的p2代细胞进行流式检测:
[0097]
细胞1的流式检测结果如说明书附图图2所示,细胞2的流式检测结果如图3所示,细胞3的流式检测结果如图4所示。
[0098]
由图2-4可知,p2代主细胞库细胞的cd73,cd90和cd105的阳性率均较高,在99%以上,甚至达到100%,而阴性标志物(cd45,hla-dr等)的表达量很低,基本不表达(0.5%以下)。这符合国际细胞疗法协会(isct)制定的mscs的定义的基本标准。
[0099]
2、对构建得到的工作库进行检测
[0100]
(1)按照实施例1中的步骤(6)-(9)对主细胞库复苏后进行培养,对工作库构建过程中得到的p3代、p4代和p5代细胞收获数量进行检测,实验结果如下表3所示:
[0101]
表3主细胞库构建过程中p3代、p4代和p5代细胞收获数量检测结果
[0102]
[0103][0104]
注:细胞收获量是把细胞培养到80-90%融合度后,是采用消化酶进行细胞消化,然后通过细胞计数仪进行计数获得,细胞收获量=计数浓度
×
重悬体积;扩增倍数=细胞收获量/细胞接种量
×
100%;理论产量=前一代次细胞的收获总量
×
扩增倍数。
[0105]
(2)对上述细胞1、细胞2和细胞3构建得到的工作库进行检测,检测结果如下表4所示:
[0106]
表4
[0107]
[0108]
[0109][0110]
(3)对上述工作库构建过程中收获的p5代细胞进行流式检测:
[0111]
细胞1的流式检测结果如说明书附图图5所示,细胞2的流式检测结果如图6所示,细胞3的流式检测结果如图7所示。
[0112]
由图5-7可知,p5代工作库细胞的cd73,cd90和cd105的阳性率均较高,在99%以上,甚至达到100%,而阴性标志物(cd45,hla-dr等)的表达量很低,基本不表达(0.5%以下)。这符合国际细胞疗法协会(isct)制定的mscs的定义的基本标准。
[0113]
3、对p2代主细胞库和p5代工作库细胞进行三系分化性能检测:
[0114]
成脂分化性能检测结果如图8所示,成骨分化性能检测结果如图9所示,成软骨分化性能检测结果如图10所示。
[0115]
实验方法:
[0116]
成脂诱导:12孔板每孔接种1.5
×
105细胞,补加msc培养基(添加有5%血小板裂解液的msc-t4基础培养基)至1ml/孔,设置1个对照孔,3个诱导孔。放入37℃,5%co2细胞培养箱中培养。培养24-48h后,确认细胞融合率达到80-90%,吸除培养基,每孔加入1ml诱导培养基,对照孔加入等体积的高糖dmem 10%fbs。每3-4天更换一次诱导液并观察细胞,换液时避免将液体直接加到细胞上,10-12天后如多数细胞变圆漂起或贴壁细胞数量减少,则更换为msc培养基(添加有5%血小板裂解液的msc-t4基础培养基),培养2-3天有成片细胞长出后,更换诱导培养基继续诱导,直至在显微镜下能观察到脂滴出现(通常诱导10天左右会有脂滴形成),使用油红o染色。
[0117]
成骨诱导:12孔板每孔接种1.5
×
105细胞,补加msc培养基(添加有5%血小板裂解液的msc-t4基础培养基)至1ml/孔,设置1个对照孔,3个诱导孔。放入37℃,5%co2细胞培养箱中培养。培养24-48h后,确认细胞融合率达到80-90%,吸除原培养基,每孔加入1ml诱导培养基,对照孔加入等体积的高糖dmem 10%fbs。每2-3天换液,诱导周期10-21天,培养时间越长,会有越多矿化的细胞,染色前显微镜下呈黑色点状或片状。对照组使用高糖dmem 10%fbs,每3-4天换液。当有大量矿化细胞形成时,可进行茜素红s染色。
[0118]
成软骨诱导:细胞以1
×
105/滴(细胞密度1
×
107/ml,取10μl)接种进24孔板的一个孔中,设置1个对照孔,3个诱导孔,在周围未加入细胞的孔中加入hbss。于37℃,5%co2细胞培养箱培养2小时后(促进细胞聚集成团),每孔小心加入0.5ml人源间充质干细胞完全培养基。放入37℃,5%co2细胞培养箱继续培养。
[0119]
配制成软骨诱导完全培养基:室温下解冻supplement mix,将10ml supplement mix i加入到90ml成软骨基础培养基(chondrogenic basal medium)中,于2-8℃储存,成脂诱导完全培养基可在2-8℃储存一个月。
[0120]
培养24小时后,将原培养基吸除,每孔加入0.5ml成软骨诱导完全培养基,对照孔加入高糖dmem 10%fbs每孔0.5ml。每3-4天换液,诱导周期10-21天,换液时注意不要将细胞球吸掉。培养时间长,可以得到更多成熟的软骨细胞(细胞球),alcian blue染色强度更大。对照组使用高糖dmem 10%fbs,每3-4天换液。
[0121]
从上述实验结果可以看出,无论是p2代主细胞库细胞还是p5代工作库细胞,均具有成脂、成骨和成软骨的能力,符合国际细胞疗法协会(isct)制定的mscs的定义的基本标准。
[0122]
4、采用elisa的方式进行功能学检测,检测结果如下表5所示:
[0123]
检测方法:a.msc细胞种板
[0124]
从液氮罐中取出msc细胞,在37℃的水浴锅中解冻,在冻存管内细胞悬液处于冰水混合物时取出,使用含酒精无尘布擦拭管壁放入生物安全柜内,移入预加有5%hpl(血小板裂解液)的msc-t4基础培养基的15ml离心管混匀,放置在离心机中400g离心5min;去上清,各管均加入1ml添加有5%hpl的msc-t4基础培养基,吹打均匀,吸取20μl细胞悬液与20μl ao/pi染液混匀用细胞计数仪计数;在12孔板中加入2ml添加有5%hpl的msc-t4基础培养液,再取含1
×
105个细胞的悬液加入对应孔位作为msc调节组,混匀,其他空白孔位加入2ml添加有5%hpl的msc-t4基础培养液作为对照组,放入37℃,5%co2的培养箱内培养约24h。
[0125]
b pbmc细胞(外周血单个核细胞)种板
[0126]
从液氮罐中取出pbmc细胞,在37℃的水浴锅中解冻,在冻存管内细胞悬液处于冰
水混合物时取出冻存管,使用含有酒精的无尘布擦拭瓶身放入生物安全柜内,均分至预加有10%fbs的1640完全培养液的15ml离心管混匀,400g离心5min;去上清,加入5ml完全培养液,吹打均匀,吸取20μl细胞悬液与20μl ao/pi染液混匀用细胞计数仪计数;用pbs清洗两遍种有细胞的孔板后,加入2ml 1640完全培养液,再取1
×
106个细胞分别加入上述步骤a中的msc调节组和对照组的板孔中,然后在msc调节组和对照组的板孔中再分别加入40μl 100μg/ml的pha(植物血凝素),混匀,放入37℃,5%co2的培养箱内培养3-5天。
[0127]
表5
[0128][0129]
从上述实验结果(表5)可以看出,无论是p2代主细胞库细胞还是p5代工作库细胞均具有免疫调控的能力,会显著性的降低ifnγ和tnfα的表达,同时能够分泌细胞因子tgf-β1。
[0130]
其中,由于个体差异,pbmc与msc共培养后,ifnγ有下降的趋势即认为主细胞库(或工作库)msc可以起到降低ifnγ的分泌的作用;优选地,ifnγ下降的比例大于40%时,即认为主细胞库(或工作库)msc可以起到显著降低ifnγ的分泌的作用。
[0131]
5、按照实施例2的方法对冻存两个月的工作库细胞进行37℃水浴复苏和常温(20-30℃)融化复苏,并对复苏后细胞的稳定性(细胞活率、活细胞浓度和结团率)进行检测:
[0132]
工作库细胞复苏前后的实物图如图11所示;复苏后细胞的性能检测结果数据如下表6和图12所示:
[0133]
表6复苏后工作库细胞稳定性检测结果
[0134][0135]
从上述实验结果可以看到,常温复苏的细胞活率稍低于37℃的复苏活率,但是二者基本无差别,并且均可以在48h内保持在85%以上的细胞活率,考虑到常温复苏操作的便捷性和低污染风险,后续使用常温复苏的方式进行细胞复苏。两种复苏方式的细胞在48h之内活细胞浓度无变化,且是稳定的。
[0136]
7、工作库细胞冻存后,分别在第0、1、2和3个月取样(每个时间点做3个重复),检测工作库细胞的细胞活率、回收率和贴壁率(复苏后再培养17h时测得的贴壁率):
[0137]
三个月稳定性数据见下表7-9和图13所示,无论是细胞活率、回收率还是培养17h的贴壁率均无统计学差异。
[0138]
表7工作库细胞冻存3个月的细胞活率检测结果
[0139][0140]
表8工作库细胞冻存3个月的回收率检测结果
[0141][0142]
表9工作库细胞冻存3个月的贴壁率检测结果
[0143][0144]
注:细胞活率=活细胞数目/总细胞数目
×
100%,细胞回收率=复苏后活细胞数目/冻存活细胞数目
×
100%,细胞贴壁率=培养17h贴壁细胞数目/接种细胞数目
×
100%。
[0145]
8、考察本发明的脐带间充质干细胞库的构建方法中,用到的培养基对脐带间充质干细胞的扩增的影响:
[0146]
(1)分别采用不同培养基按照实施例1中记载的传代培养方法进行传代培养,传代7次,并检测各代次的pdl(细胞群加倍数),实验结果如下表10和图14(图14中的“msc培养基”即为下表10中的“msc-t4基础培养基 5%hpl”)所示:
[0147]
表10和其他培养基对比实验结果(pdl)
[0148][0149]
由上表10可知,本发明的脐带间充质干细胞库的构建方法中,通过选用msc-t4基础培养基 5%hpl作为培养基,相对于现有技术中的其他常用培养基,可显著提高细胞群加倍数,与本发明的脐带间充质干细胞库的构建方法有更好地适应性。
[0150]
备注:上表中的pdl通过将细胞以10000cells/cm2浓度接种到培养容器,培养3-4d
后消化细胞,计数,按照公式pdl=x 3.322(logy
–
logi)计算得到,其中x为传代前代次,i为细胞接种前细胞数,y为培养后细胞总数。
[0151]
(2)分别采用培养基a(低糖dmem 5%hpl)和培养基b(msc-t4基础培养基 5%hpl)作为培养基,对3个批次(批次1:20220401403ucf;批次2:20220401507ucf;批次3:20220401609ucf)的脐带间充质干细胞进行培养,按照实施例1的方法构建得到工作库;并采用elisa的方式对工作库细胞的生物学效应进行检测(具体步骤同表5)和三阳五阴检测。
[0152]
三阳五阴的检测结果如下表11所示:
[0153]
表11
[0154]
[0155][0156]
生物学效应的检测结果如下表12所示:
[0157]
表12生物学效应检测结果
[0158][0159]
以上所述仅为本发明的优选实施例,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。