1.本发明涉及植物基因工程育种技术领域,更具体的说是涉及一种以紫锥菊叶柄作为外植体建立遗传转化体系的组合物及方法。
背景技术:
2.紫锥菊(echinacea purpurea(linn.)moench)是一种菊科(compositea)紫锥菊属(echinacea)多年生草本植物,其花是由管状花和舌状花组成,外形似松果,又被称为松果菊。它起源于北美洲,是当地具有较高药用价值的草药,如其根部含有的多糖、酚类化合物、烷基酰胺等活性物,具有抗炎、抗真菌、抗氧化等功效;此外,由紫锥菊熬制的药剂,可以治疗外伤、咳嗽、感冒、呼吸道感染以及免疫系统缺陷引发的一些慢性疾病。
3.然而紫锥菊受地缘因素的影响较大,质量参差不齐、生物活性成分含量低和种子发芽率不高等问题较为突出,严重影响紫锥菊规模化生产和可持续发展;此外紫锥菊的育种方式为传统育种,过程繁琐且周期长,难以达到短期实现定向育种的目标。
4.以植物组织培养技术为基础,建立紫锥菊的遗传转化体系,可以精准地针对重要生物活性成分,定向改良紫锥菊的遗传性状,对加快其本土化和提高药用价值具有重要的意义。
5.然而,在紫锥菊遗传转化体系建立方面,目前有关根瘤农杆菌建立紫锥菊遗传转化体系,培育出转基因植株的研究还鲜有报道。
6.因此通过建立根瘤农杆菌转化农杆菌的遗传转化体系,培育出具有优良性状的紫锥菊,在推进药用紫锥菊的遗传育种进程方面具有重要意义。
7.因此,能否以紫锥菊叶柄作为外植体建立遗传转化体系的方法是本领域技术人员亟需解决的问题。
技术实现要素:
8.有鉴于此,本发明提供了一种以紫锥菊叶柄作为外植体建立遗传转化体系的组合物及方法。结合根瘤农杆菌操作简单、成本低的优点,以gus基因作为报告基因以及普通pcr的手段快速验证转基因植株,有效提高紫锥菊的转基因育种效率。
9.为了实现上述目的,本发明采用如下技术方案:
10.一种以紫锥菊叶柄建立遗传转化体系的组合物,包括:农杆菌侵染液:4.4g/l ms培养基基盐、30g/l蔗糖、0.1mmol/l乙酰丁香酮,ph=5.8;
11.ms扩繁培养基:4.4g/l ms培养基基盐、30g/l蔗糖、4.8g/l琼脂粉、0.1g/l肌醇、0.4mg/l 6-ba、0.01mg/l naa,ph=5.8;
12.ms抑菌培养基:4.4g/l ms培养基基盐、30g/l蔗糖、4.8g/l琼脂粉、0.1g/l肌醇、0.4mg/l 6-ba、0.01mg/l naa,200mg/l特美汀,ph=5.8;
13.ms抗性筛选1培养基:4.4g/l ms培养基基盐、30g/l蔗糖、4.8g/l琼脂粉、0.1g/l肌
醇、0.4mg/l 6-ba、0.01mg/l naa、100mg/l特美汀、3mg/l潮霉素,ph=5.8;
14.ms抗性筛选2培养基:4.4g/l ms培养基基盐、30g/l蔗糖、4.8g/l琼脂粉、0.1g/l肌醇、0.6mg/l 6-ba、0.01mg/l naa、50mg/l特美汀、6mg/l潮霉素,ph=5.8;
15.生根诱导培养基:4.4g/l ms培养基基盐、30g/l蔗糖、4.8g/l琼脂粉、0.1g/l肌醇、0.02mg/l naa,50mg/l特美汀(timentin),ph=5.8。
16.进一步的,ms培养基基盐购自coolaber公司的pm1271 ms培养基基盐,产品编号pm1271-2
×
250g。
17.本发明还提供了基于上组合物的建立方法,包括以下步骤:
18.(1)将紫锥菊无菌组培苗置于无菌环境,取叶柄接种后暗培养诱导,得外植体;
19.(2)将含有报告基因的载体导入农杆菌中,得到的工程菌株继续培养,离心收集菌体后,用农杆菌侵染液进行重悬得菌液,备用;
20.(3)将步骤(2)的菌液侵染步骤(1)得到的外植体;侵染后的外植体接种后暗培养;
21.(4)将步骤(3)暗培养后的外植体冲洗,置于含特美汀的无菌水中浸泡处理;
22.(5)将步骤(4)处理后的外植体转接,暗培养;
23.(6)将步骤(5)暗培养后的外植体转接至ms抗性筛选1培养基中进行初步筛选直至长出抗性愈伤组织;
24.(7)将步骤(6)抗性愈伤组织转接至ms抗性筛选2培养基中培养至长出不定芽,转接至生根诱导培养基诱导不定根,获得完整的紫锥菊转基因苗。
25.优选的:步骤(1)置于无菌环境:置于超净台;叶柄:长度1~2cm;接种:接种至ms扩繁培养基;暗培养诱导:时间2~4d。
26.优选的:步骤(2)含有报告基因的载体:质粒pcambia1305;继续培养:置于含卡那霉素和利福平的lb液体培养基,于28℃振荡培养1~2天;将菌液转移至含卡那霉素和利福平的lb液体培养基进行扩大培养,至od600值为0.5~0.8;离心:4000~6000rpm,时间5min。
27.进一步的,转速过高会损伤菌株,转速过低会导致离心不彻底,低转速则需要离心更长时间。
28.优选的:步骤(3)侵染的时间为20min,侵染后吸干外植体表面多余的菌液;接种:接种至ms扩繁培养基中,暗培养:黑暗条件下共培养2d。
29.进一步的,吸干采用无菌滤纸。
30.优选的:步骤(4)冲洗:无菌水冲洗3遍至外植体表面无肉眼可见的菌丝残留;特美汀的的浓度:200mg/l;浸泡处理:浸泡10~15min,吸干水分;
31.进一步的,转移至无菌滤纸中吸干水分。
32.优选的:步骤(5)转接:至ms抑菌培养基中;暗培养:时间7d。
33.优选的:步骤(6)初步筛选:每隔一周更换一次ms抗性筛选1培养基,时间2~4周。
34.优选的:步骤(7)转接:每隔半月更换一次ms抗性筛选2培养基;不定芽:还包括gus染色和pcr鉴定;转接:鉴定为阳性的不定芽从基部切取,再转接至生根诱导培养基中。
35.本发明还提供了上述的组合物或上述建立方法在农业生产、育种中的应用。
36.经由上述的技术方案可知,与现有技术相比,本发明公开提供了一种以紫锥菊叶柄作为外植体建立遗传转化体系的组合物及方法,取得的技术效果为可以快速对紫锥菊进行有效的遗传转化,方法简单便捷,在保留母株并降低对母株伤害的同时,能获取大量具有
一致性的外植体材料,有利于转基因植株保持原有的优良性状,并且具备转基因的功能。
附图说明
37.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
38.图1附图为本发明提供的转化体系所用载体图谱示意图。
39.图2附图为本发明提供的紫锥菊外植体在不同潮霉素浓度的培养基中生长情况,其中,a为0mg/l,b为3mg/l,c为6mg/l,d为10mg/l,e为15mg/l。
40.图3附图为本发明提供的紫锥菊叶柄在抗性筛选1培养基中筛选诱导出胚性愈伤组织图。
41.图4附图为本发明提供的紫锥菊胚抗性愈伤分化出不定芽图。
42.图5附图为本发明提供的转基因紫锥菊叶片gus染色图,其中,a:空白对照,b:阳性的不定芽。
43.图6附图为本发明提供的转基因植株pcr检测结果,其中,m:dl2000maker; :阳性对照;-:阴性对照;1、2、3:转化植株。
44.图7附图为本发明提供的紫锥菊不定芽诱导出不定根图。
具体实施方式
45.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
46.本发明实施例公开了一种以紫锥菊叶柄作为外植体建立遗传转化体系的组合物及方法。
47.实施例1
48.一种以紫锥菊叶柄作为外植体建立遗传转化体系的组合物及方法,包括以下步骤:
49.1)农杆菌gv3101感受态细胞转化:含有gus基因的pcambia1305载体(图1,购自honorgene(奥诺基因)货号hg-vzc0568)。用热击转化法转入农杆菌gv3101感受态菌株中(购自上海唯地生物技术有限公司,产品规格cat#:ac1004)。
50.具体转化步骤如下:从-80℃冰箱中取出保存的农杆菌感受态于室温或手心片刻待其部分融化,处于冰水混合状态时插入冰中;加入100ng含有gus基因的pcambia1305载体,用手指轻弹管壁混匀,依次在冰上静置5分钟、液氮5分钟、37℃水浴5分钟、冰浴5分钟;加入700μl无抗生素的lb液体培养基,于28℃振荡培养2~3h;常温6000rpm离心1min,留取100μl左右上清轻轻吹打重悬菌块涂布于含50mg/l卡那霉素的lb平板上,倒置放于28℃培养箱培养2~3d;以单克隆菌作为模板,通过pcr法鉴定阳性转化菌株,鉴定引物序列如下:
51.gus-f 5
’‑
catcctcgacgatagcaccc-3’,如seq id no.1;
52.gus-r 5
’‑
atgaggaacttgccgtcgtt-3’,如seq id no.2。
53.鉴定序列长度459bp(catcctcgacgatagcaccctcccggtggggctgtacagcgagcgccacgaagagggcctcggaaaagtcattcgtaacaagccgaacttcgacttcttcaactatgcaggcctgcaccgtccggtgaaaatctacacgaccccgtttacgtacgtcgaggacatctcggttgtgaccgacttcaatggcccaaccgggactgtgacctatacggtggactttcaaggcaaagccgagaccgtgaaagtgtcggtcgtggatgaggaaggcaaagtggtcgcaagcaccgagggcctgagcggtaacgtggagattccgaatgtcatcctctgggaaccactgaacacgtatctctaccagatcaaagtggaactggtgaacgacggactgaccatcgatgtctatgaagagccgttcggcgtgcggaccgtggaagtcaacgacggcaagttcctcat,如seq id no.3)
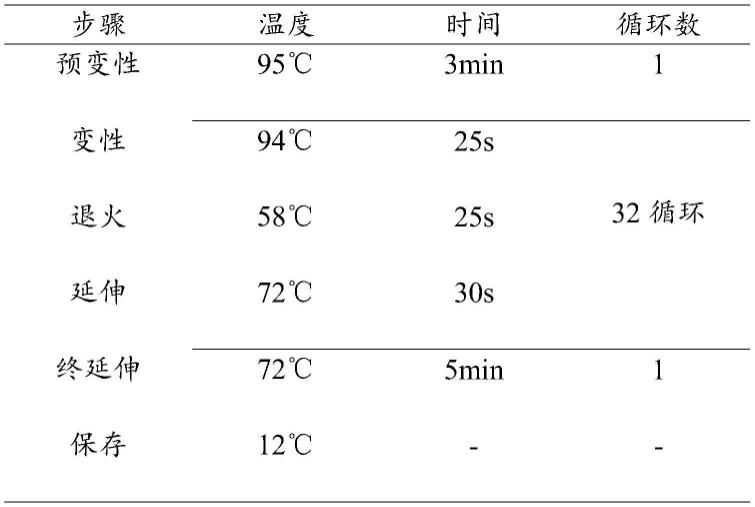
54.pcr扩增程序:
[0055][0056]
反应体系:20μl体系,酶(金沙生物2
×
gs taq pcr mix forpage)10μl,primer 1(10μm)1μl,primer 2(10μm)1μl,cdna 1μl,ddh2o 7μl。
[0057]
2)潮霉素筛选压测试:选择5个不同浓度梯度的潮霉素,分别为0,3,6,10,15mg/l,将生长健壮的无菌紫锥菊组培苗切取约1cm长的叶柄作为外植体,接种至含有不同浓度的潮霉素的ms扩繁培养基(4.4g/l ms培养基基盐、30g/l蔗糖、4.8g/l琼脂粉、0.1g/l肌醇、0.4mg/l 6-ba、0.01mg/l naa,调ph=5.8),筛选出能够有效抑制紫锥菊组织生长的最低潮霉素浓度。
[0058]
结果:当潮霉素浓度大于6mg/l时,外植体在半月时间内褐化死亡,并且没有明显的愈伤生长,如图2所示。
[0059]
3)农杆菌侵染液准备:挑取阳性单克隆农杆菌于1ml含50mg/l卡那霉素和50mg/l利福平的lb液体培养基,于28℃振荡培养1天;将菌液转移至50ml含50mg/l卡那霉素和50mg/l利福平的lb液体培养基(胰蛋白胨10g/l、酵母提取物5g/l、nacl 10g/l)进行扩大培养,待od
600
值为0.5~0.8,5000rpm离心5min,收集菌体;用农杆菌侵染液(4.4g/l ms培养基基盐、30g/l蔗糖、0.1mmol/l乙酰丁香酮,ph=5.8)重悬菌体,调节菌液od
600
值为0.5,作为侵染备用。
[0060]
4)农杆菌侵染紫锥菊外植体:切取生长健壮的无菌紫锥菊组培苗的叶柄作为外植
体,长度约为1cm,转接至ms扩繁培养基(4.4g/l ms培养基基盐、30g/l蔗糖、4.8g/l琼脂粉、0.1g/l肌醇、0.4mg/l 6-ba、0.01mg/l naa,ph=5.8)中分别黑暗预培养2d处理;用上述3)制备好的菌液侵染预培养完毕的叶柄外植体,侵染时间分别为20min,侵染期间不间断摇晃使农杆菌与外植体充分接触;侵染完毕的外植体用无菌滤纸吸干表面多余的菌液,然后转接至ms扩繁培养基中进行黑暗条件下共培养2d;共培养结束后用无菌水冲洗外植体2~3遍,直至外植体表面无肉眼可见的菌丝残留,放入含200mg/l特美汀(timentin)(购自生工生物工程(上海)股份有限公司,产品规格a600950-0001)的无菌水中浸泡10min以除去农杆菌,用无菌滤纸吸干水分,将叶柄外植体转接至ms抑菌培养基(4.4g/l ms培养基基盐、30g/l蔗糖、4.8g/l琼脂粉、0.1g/l肌醇、0.4mg/l 6-ba、0.01mg/l naa,200mg/l特美汀(timentin),ph=5.8)中黑暗培养7d。
[0061]
5)紫锥菊转基因不定芽抗性筛选:将外植体转接至ms抗性筛选1培养基(4.4g/l ms培养基基盐、30g/l蔗糖、4.8g/l琼脂粉、0.1g/l肌醇、0.4mg/l6-ba、0.01mg/l naa、100mg/l特美汀(timentin)、3mg/l潮霉素,ph=5.8)中进行初步筛选,每隔一周更换一次新鲜ms抗性筛选1培养基;待外植体长出绿色抗性愈伤组织后(约2~4周,参见图3),切取绿色的抗性愈伤组织转接至ms抗性筛选2培养基(4.4g/l ms培养基基盐、30g/l蔗糖、4.8g/l琼脂粉、0.1g/l肌醇、0.6mg/l 6-ba、0.01mg/l naa、50mg/l特美汀(timentin)、6mg/l潮霉素,ph=5.8)中进行不定芽诱导和筛选,每隔半个月更换一次新鲜ms抗性筛选2培养基,直至抗性愈伤分化出不定芽(图4)。
[0062]
6)紫锥菊抗性不定芽生根诱导:选取正常生长的不定芽,在超净台中切取部分叶片进行gus染色和pcr鉴定,检测载体中gus基因是否整合进了紫锥菊基因组中(图5和图6)。鉴定为阳性的不定芽,从基部切取不定芽,转接至生根诱导培养基(4.4g/l ms培养基基盐、30g/l蔗糖、4.8g/l琼脂粉、0.1g/l肌醇、0.02mg/l naa,50mg/l特美汀(timentin),ph=5.8)中进行不定根诱导(图7),即获得紫锥菊转基因再生苗。
[0063]
7)紫锥菊转基因植株炼苗移栽:待再生苗长出3~4片健壮的叶片,根长超过4cm后,即可进行炼苗移栽,将组培瓶开盖在温室的散光中进行炼苗3d,从组培瓶中取出紫锥菊组培苗,清洗干净根部残留的培养基,移栽到湿润的营养土中。炼苗移栽的过程中要注意保湿,以免组培苗干枯死亡。
[0064]
综上,紫锥菊是属于难转化的物种,目前国内没有紫锥菊相关的遗传转化体系报道,技术难点在于主要是如何建立转化体系,提供建立遗传转化体系方法(包括恰当的培养基组合)。
[0065]
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
[0066]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
