1.本发明涉及头颈鳞状细胞癌预后及放疗技术领域,具体涉及一种与头颈鳞状细胞癌放疗敏感性相关的预后标志物、预后及放疗风险评估方法的应用。
背景技术:
2.头颈癌,主要包括口腔癌、鼻咽癌、口咽癌、喉癌和下咽癌,其中90%以上为鳞状细胞癌。在中国,一项来自全国72个肿瘤登记处的流行病学调查结果显示口腔癌及咽喉癌的发病率为3.28/100 000,死亡率为1.37/100 000;鼻咽癌的发病率为3.61/100 000,死亡率为1.99/100 000。目前病因学研究表明吸烟及嗜酒仍是头颈部鳞癌的常见危险因素。早期头颈部鳞癌通过手术和(或)放疗可以取得很好的疗效。有超过50%的患者处于ⅲ期及以上(局部晚期或转移),疾病进展和复发可能性大。对于复发或转移性ⅳ期疾病,5年生存率仅有4%。
3.头颈解剖的复杂性给头颈肿瘤放射治疗带来巨大挑战,肿瘤周边正常口腔和咽粘膜表面、唾液腺、牙齿、下颌骨、喉部、皮肤和颈部软组织的意外剂量累积可能会引起短期或长期副作用,因此需要在杀伤肿瘤效果和避免过度毒性之间寻求适当平衡。放射敏感性是指生物机体或细胞、组织、器官接受电离辐射作用后发生死亡、损伤或其他效应的快慢程度。生物系统射线敏感性与dna的含量有一定关系。生物进化程度愈高,有机体组织结构愈复杂,其辐射敏感性愈高。细胞和组织的放射敏感性取决于本身的生物学特点,也受环境因素的影响。不同组织和器官的放射敏感性一般与其细胞分裂活动的强度成正比,而与其细胞分化的程度成反比。在亚细胞和分子水平上,细胞核的放射敏感性高于胞浆,细胞内不同靶分子的相对敏感性为:dna》mrna》trna》蛋白质。由于个体差异,肿瘤患者在接受放射治疗后,肿瘤细胞的dna会有一定程度改变,从而导致mrna表达量的改变,这可能导致肿瘤细胞对放疗敏感性的改变。对放疗敏感的患者往往需要的放疗剂量较小,从而接受放疗后引起的副作用也会相应减小。因此探索放疗敏感性相关基因对于治疗头颈鳞状细胞癌,指示疾病预后具有重要意义。
技术实现要素:
4.本发明的目的是克服现有技术的不足,提供构建并验证了一个包含9个放疗敏感性相关mrna的预后标志物,用于预测头颈鳞状细胞癌患者的预后情况,且通过耐放疗细胞系与临床标本验证9个mrna与放疗敏感性相关,提供了一种头颈鳞状细胞癌预后指标和9个有潜力的增强放疗效果的mrna基因靶点。
5.本发明的目的是通过以下技术措施达到的:一种与头颈鳞状细胞癌放疗敏感性相关的预后标志物,所述预后标志物包括如下基因:rasgef1b基因、tspan11基因、tcea3基因、ing4基因、tppp3基因、mrpl33基因、myof基因、vsig4基因和laptm4b基因。
6.基因组合作为预后标志物在制备用于评估头颈鳞状细胞癌预后及放疗风险的产
品中的应用,所述基因组合包括rasgef1b基因、tspan11基因、tcea3基因、ing4基因、tppp3基因、mrpl33基因、myof基因、vsig4基因和laptm4b基因,所述评估头颈鳞状细胞癌预后及放疗风险的产品包括检测所述基因组合的mrna表达的产品,所述评估头颈鳞状细胞癌预后及放疗风险的方法包括以下步骤:
7.(1)数据收集和处理
8.从肿瘤基因组图谱(tcga)数据库获取头颈鳞状细胞癌患者rna-seq数据和临床信息作为训练队列;从geo数据库中下载gse65858数据集作为验证队列;
9.(2)筛选差异表达基因
10.对步骤(1)中的基因进行识别,通过符合选择标准的r算法筛选出差异表达的基因;
11.(3)筛选放疗敏感性相关基因
12.从geo数据库获取gse40020数据集,通过符合选择标准的r筛选差异表达基因,为放疗敏感性相关基因。
13.(4)生存分析
14.对步骤(2)(3)中得到的差异表达基因取交集后通过r软件“survival”包进行单因素cox分析,lasso分析,识别出与放疗敏感和生存相关基因;
15.(5)预后风险评估模型的开发
16.对步骤(4)所述的放疗敏感和生存相关基因,采用多因素cox回归方法,建立了预后风险评估模型,所述模型用于评估头颈鳞状细胞癌预后风险指数,风险指数的计算公式为:风险评分=1.41*mrpl33 0.82*rasgef1b 0.73*tspan11 0.82*tcea3 1.23*myof 1.24*visg4 1.18*laptm4b 0.81*ing4 0.86*tppp3;
17.(6)在训练集上验证模型是否构建成功
18.根据步骤(5)所得的预后风险评估模型计算tcga数据集的风险评分,并将其分为高风险组和低风险组,对两组绘制roc曲线和km曲线,评估模型auc和os,对两组进行生存分析;
19.(7)在验证集中验证预后模型的准确性
20.在geo数据集的验证队列中,根据步骤(6)中预后标记的风险分层,验证高风险组的风险系数和死亡率是否高于低风险组的风险系数和死亡率;
21.(8)验证风险模型所含基因在肿瘤细胞系和耐放疗细胞系中的表达差异
22.在已经建立好的耐放疗人下咽癌fadu细胞系和放疗前fadu细胞系中进行基因表达差异检测验证。
23.进一步地,在步骤(4)中,所述风险评分高于中位风险评分时为高风险;所述风险评分低于中位风险评分时为低风险。
24.进一步地,独立评估所述基因组合中每个基因的mrna表达或蛋白表达水平,以评估头颈鳞状细胞癌对放射治疗敏感性。
25.进一步地,所述检测组合基因的mrna表达水平或蛋白表达水平的产品能够结合组合基因的核酸或能够结合组合基因所表达的蛋白的物质,所述产品包括试剂、试剂盒、基因芯片、试纸、高通量测序平台、抗体芯片。
26.进一步地,所述产品包括通过测序技术、核酸杂交技术、核酸扩增技术检测待测样
本中基因组合mrna的表达水平,以及通过蛋白质印记技术、elisa技术、质谱技术检测待测样本中蛋白的表达水平的试剂、试剂盒、试纸、基因芯片、抗体芯片、高通量测序。
27.进一步地,所述检测基因组合mrna或蛋白表达水平的检测样本是新鲜的、冷冻的或石蜡固定包埋的头颈鳞状细胞癌组织。
28.一种预后标志物风险评估模型方程式:风险评分=1.41*mrpl33 0.82*rasgef1b 0.73*tspan11 0.82*tcea3 1.23*myof 1.24*visg4 1.18*laptm4b 0.81*ing4 0.86*tppp3
29.一种预后标志物在制备头颈鳞状细胞癌放疗敏感性和预后诊断试剂中的应用。
30.一种预后标志物在制备头颈鳞状细胞癌治疗药物中的应用。
31.与现有技术相比,本发明的有益效果是:本发明构建并验证了一个包含9个放疗敏感性相关mrna的预后标志物,用于预测头颈鳞状细胞癌患者的预后情况,且通过耐放疗细胞系与临床标本验证9个mrna与放疗敏感性相关,提供了一种头颈鳞状细胞癌预后指标和9个有潜力的增强放疗效果的mrna基因靶点。本发明公开的9个mrna具有敏感性高、特异性好、准确率高的优点,可为临床医师对头颈鳞状细胞癌患者的放射治疗决策提供有效的指导意见,减少无效治疗的发生,从而降低患者的治疗成本和不适体验,能够改善头颈鳞状细胞癌患者的远期预后,以期缓解社会疾病负担。
32.下面结合附图和具体实施方式对本发明作详细说明。
附图说明
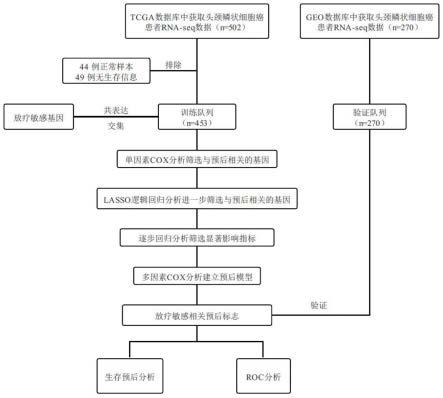
33.图1放疗相关预后模型构建与验证流程图。
34.图2放疗相关预后模型风险评分构建。a.lasso回归分析30个mrna的相关系数分布;b.lasso回归模型中回归系数λ的最优选择;c.lasso回归分析筛选获得9个mrna构建预后模型。*p《0.05,**p《0.01
35.图3在tcga训练集中高风险组与低风险的预后生存分析。a.kaplan-meier(km)生存分析比较高风险组与低风险组的生存率。b.roc预后曲线分析高风险组与低风险组预后3年、5年、8年的auc(roc曲线下方面积,其值越接近1,表示其真实性越高)。
36.图4在geo数据验证集中验证高低风险分组的预后生存分析。a.km生存分析比较高风险组与低风险组的生存率。b.roc预后曲线分析高风险组与低风险组预后1年、3年、5年的auc。
37.图5体外实验验证9个放疗预后模型相关mrna的表达差异。a和b.在耐放疗fadu细胞(fadurr)和fadu细胞中qpcr比较9个mrna表达差异;c和d,在头颈肿瘤组织的癌(cancer)和癌旁组织(paracancer)中qpcr方法比较9个mrna表达差异。
具体实施方式
38.一种与头颈鳞状细胞癌放疗敏感性相关的预后标志物,所述预后标志物包括如下基因:rasgef1b基因、tspan11基因、tcea3基因、ing4基因、tppp3基因、mrpl33基因、myof基因、vsig4基因和laptm4b基因。进一步地,所述的mrpl33基因、myof基因、vsig4基因和laptm4b基因的表达与放疗敏感性呈负相关,而rasgef1b基因、tcea3基因、ing4基因、tppp3基因和tspan11基因的表达与存活率呈正相关。
39.基因组合作为预后标志物在制备用于评估头颈鳞状细胞癌预后及放疗风险的产品中的应用,所述基因组合包括rasgef1b基因、tspan11基因、tcea3基因、ing4基因、tppp3基因、mrpl33基因、myof基因、vsig4基因和laptm4b基因,所述评估头颈鳞状细胞癌预后及放疗风险的产品包括检测所述基因组合的mrna表达的产品,所述评估头颈鳞状细胞癌预后及放疗风险的方法包括以下步骤:
40.(1)数据收集和处理
41.从肿瘤基因组图谱(tcga)数据库(https://portal.gdc.ancer.gov/)获取453名头颈鳞状细胞癌患者rna-seq数据和临床信息作为训练队列;从geo数据库中下载gse65858数据集作为验证队列,其中包含270名头颈鳞状细胞癌患者的rna-seq数据和临床信息。
42.(2)筛选差异表达基因
43.对步骤(1)中的基因进行识别,通过符合选择标准的r算法筛选出差异表达的基因;
44.(3)筛选放疗敏感性相关基因
45.从geo数据库获取gse40020数据集,通过符合选择标准的r筛选差异表达基因,为放疗敏感性相关基因。
46.(4)生存分析
47.对步骤(2)(3)中得到的差异表达基因取交集后通过r软件“survival”包进行单因素cox分析,lasso分析,识别出与放疗敏感和生存相关基因;
48.(5)预后风险评估模型的开发
49.对步骤(4)所述的生存相关基因,采用多因素cox回归方法,建立了预后风险评估模型,所述模型用于评估头颈鳞状细胞癌预后风险指数,风险指数的计算公式为:风险评分=1.41*mrpl33 0.82*rasgef1b 0.73*tspan11 0.82*tcea3 1.23*myof 1.24*visg4 1.18*laptm4b 0.81*ing4 0.86*tppp3;
50.(6)在训练集上验证模型是否构建成功
51.根据步骤(5)所得的预后风险评估模型计算tcga数据集的风险评分,并将其分为高风险组和低风险组,对两组绘制roc曲线和km曲线,评估模型auc和os,对两组进行生存分析;
52.(7)在验证集中验证预后模型的准确性
53.在geo数据集的验证队列中,根据步骤(6)中预后标记的风险分层,验证高风险组的风险系数和死亡率是否高于低风险组的风险系数和死亡率;
54.(8)在耐放疗细胞系与临床样本中验证模型准确性
55.在已经建立好的耐放疗人下咽癌fadu细胞系和正常fadu中进行qpcr验证,在临床头颈肿瘤组织的癌和癌旁中进行qpcr验证。
56.在步骤(5)中,所述风险评分高于中位风险评分时为高风险;所述风险评分低于中位风险评分时为低风险。此处的“中位风险评分”是指数据集中病人风险评分的中位数。中位数具体求解,数据集中病人风险评分按顺序排列的一组数据中居于中间位置的数。
57.独立评估所述基因组合中每个基因的mrna表达或蛋白表达水平,以评估头颈鳞状细胞癌对放射治疗敏感性。
58.所述检测组合基因的mrna表达水平或蛋白表达水平的产品能够结合组合基因的
核酸或能够结合组合基因所表达的蛋白的物质,所述产品包括试剂、试剂盒、基因芯片、试纸、高通量测序平台、抗体芯片。本发明提供了所述预后标志物在制备头颈鳞状细胞癌放疗敏感性诊断及预后试剂盒中的应用。所述试剂盒能够测定组织中ing4、myof、rasgef1b、tspan11、tcea3、tppp3、mrpl33、visg4、laptm4b的含量。所述试剂盒含有ing4、myof、rasgef1b、tspan11、tcea3、tppp3、mrpl33、visg4、laptm4b的引物和探针。所述引物和探针针对的目标序列如seq id no.1-9。所述试剂盒中含有公司的引物探针组合和产品编号等。所述试剂盒中还含有内参gapdh或actin。所述试剂盒还可以包括pcr反应常用试剂,如逆转录酶、缓冲液,dntps和depc水等;还可以含有标准品和/或对照品。所述试剂盒中优选的还包含其它一些辅助试剂,所述辅助试剂是定量pcr扩增试剂盒中常规使用的一些试剂,这些试剂的特性以及它们的配制方法均是本领域技术人员所熟知的;所述的试剂例如(但不限于):阴性对照品、阳性对照品;还可以包括荧光定量pcr反应板、pcr反应板封口膜等。
59.表格1 seq id no.1-9的引物序列
60.s1放射敏感性相关预后基因引物序列
[0061][0062]
可使用本领域技术人员所熟知的多种技术(例如定量或半定量rt-pcr,rna印迹分析,溶液杂交检测等)测定相关mrna在头颈鳞状细胞癌患者和健康人群中的水平;在本发明的具体实施方案中,使用了定量pcr的方法。
[0063]
进一步地,提供了所述试剂盒的使用方法,包括如下步骤:
[0064]
(1)从待测试样品中提取总rna;
[0065]
(2)将步骤(1)提取得到的总rna使用mrna逆转录试剂盒进行逆转录反应,得到相应的cdna;
[0066]
(3)将步骤(2)得到的cdna进行实时荧光定量pcr,并以gapdh或actin为内参,检测结果以δct表示;
[0067]
(4)将得到的结果代入公式y中,将计算值与x比较,如计算值大于x,判断存在放疗敏感性;如计算值小于x,判断为非放疗敏感性。其中risk score=∑iexpi(mrnai)*coef
(mrnai),
[0068]
具体为风险评分=1.41*mrpl33 0.82*rasgef1b 0.73*tspan11 0.82*tcea3 1.23*myof 1.24*visg4 1.18*laptm4b 0.81*ing4 0.86*tppp3
[0069]
发明人通过公共数据库队列,从训练队列中筛选出可能具有潜力的肿瘤标志物,并在验证队列中进行验证,并进行了基础实验的验证和分析,首次发现了与头颈鳞状细胞癌放疗敏感性具有较高诊断和预后价值的生物标志物ing4、myof、rasgef1b、tspan11、tcea3、tppp3、mrpl33、visg4、laptm4b九种mrna;通过mrna标志物和诊断预后试剂盒的研制和应用,可以使得头颈鳞状细胞癌放疗敏感性的诊断和预后评估更加方便易行,为临床医生快速准确掌握患者病情,治疗方式的正确选择,提高临床治疗效果奠定基础,并为发现具有潜在治疗价值的新型小分子药物靶标提供帮助。
[0070]
所述产品包括通过测序技术、核酸杂交技术、核酸扩增技术检测待测样本中基因组合mrna的表达水平,以及通过蛋白质印记技术、elisa技术、质谱技术检测待测样本中蛋白的表达水平的试剂、试剂盒、试纸、基因芯片、抗体芯片、高通量测序。
[0071]
所述检测基因组合mrna或蛋白表达水平的检测样本是新鲜的、冷冻的或石蜡固定包埋的头颈鳞状细胞癌组织。
[0072]
一种预后标志物风险评估模型方程式:风险评分=1.41*mrpl33 0.82*rasgef1b 0.73*tspan11 0.82*tcea3 1.23*myof 1.24*visg4 1.18*laptm4b 0.81*ing4 0.86*tppp3
[0073]
一种预后标志物在制备头颈鳞状细胞癌放疗敏感性和预后诊断试剂中的应用。
[0074]
一种预后标志物在制备头颈鳞状细胞癌治疗药物中的应用。
[0075]
具体的评估过程:从肿瘤基因组图谱(tcga)数据库(https://portal.gdc.ancer.gov/)获取453名头颈鳞状细胞癌患者rna-seq数据和临床信息作为训练队列。
[0076]
从geo数据库中下载gse65858数据集作为验证队列,其中包含270名头颈鳞状细胞癌患者的rna-seq数据和临床信息。
[0077]
我们收集了262个可能对放疗有反应的生物标志物。为了确定与预后相关的mrna,我们对放疗敏感性相关的mrna进行了单变量cox分析,从放疗敏感性相关的mrna中筛选出与预后相关的30个mrna(详见下面表格2)。单因素cox分析中p《0.05的mrna纳入lasso回归并再次筛选得到22个mrna。为了进一步提高签名的预测效率,双向逐步回归再次筛选显著影响特征值。多变量cox模型进一步筛选,并确保纳入预后标志的每个特征值都具有统计学意义。最终获得9个放疗敏感性相关mrna,纳入多变量cox回归建立预后标志物并建立了被认为具有显著特征和最有价值的与头颈鳞状细胞癌患者放疗敏感性相关的预后标志物,其中包括9个mrna,分别为mrpl33、rasgef1b、tspan11、tcea3、myof、vsig4、laptm4b、ing4、tppp3。风险评分=∑iexpr(mrnai)*coef(mrnai)expr是每个mrna的表达值,coef是目标mrna的多因素cox分析的回归系数(图2)。
[0078]
表格2 30个与预后相关的放疗敏感性生物标志物列表
[0079]
mrnahrp valuevsig41.166680670.028797357myof1.2096957260.022604577
adap20.8505929490.021422985ppif1.1942072430.012030134tspan110.8296968460.015183055barx11.1495410750.044268983exosc11.2128466660.009115235zfand2a1.2030721090.012070097chordc11.1654282270.032420272gsto11.2628938560.000928294csnk2a21.3081840380.000213138rasgef1b0.8142903840.002830488ing40.8693070130.046352047mrpl331.2885556620.000589714cct51.1593130130.037411003ckap2l1.1568866590.0418178clgn0.8334504930.040083058krt181.2227695840.006835887myb0.8519692950.044476159serinc21.1854627770.028331587c4orf190.8343088720.025318173cdc42ep40.8659361930.039464805edaradd0.8686283890.049883606laptm4b1.1662049320.031226385ccnb11.1564893190.038697941prss120.7560946120.0001292tcea30.8406895640.01730052selenbp10.8172462110.007327898dsg21.2080689920.011446011tppp30.8710299820.049549547
[0080]
根据中位风险评分,hnscc样本分为高风险组和低风险组。绘制roc曲线和km生存曲线(图3)。
[0081]
对于3年、5年和8年的预后评估,roc曲线分析的auc值分别为0.706、0.674和0.672。km曲线显示,高风险组的整体生存率(os)低于低风险组,表明风险评分可以有效进行人群分层,并评估预后情况(图3)。
[0082]
在验证队列中,根据预后标记的风险分层,高风险组的风险系数和死亡率高于低风险子组的风险系数和死亡率(图4)。km曲线显示,高风险组的整体生存率(os)低于低风险组(图4),表明风险评分的预后标记有效(p=0.021)。roc曲线分析显示,包含9个放疗敏感相关mrna的预后标志作为生物标志物对评估1、3、5年预后情况具有较高价值(auc为0.629,0.617和0.577)(图4)。
[0083]
在头颈肿瘤耐放疗细胞系qpcr结果表明,放疗会导致ing4基因,rasgef1b基因,
tspan11基因,tcea3基因,tppp3基因和vsig4基因表达量降低(图5a),mrpl33基因,myof基因,visg4基因,laptm4b基因表达量升高(图5b),但在头颈鳞状细胞癌的癌组织与癌旁组织中除tspan11基因、vsig4基因降低和myof基因升高外,其余基因无明显表达差异(图5c、5d)。
[0084]
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
[0085]
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。