1.本发明涉及基因重组技术领域,具体讲是一种利用生物反应器大规模生产重组痘苗病毒载体的方法。
背景技术:
2.痘苗病毒(vacv或vv)是一种大型的、复杂的包膜病毒,属于痘病毒家族。痘苗病毒(vacv或vv)有一个线性的双链dna基因组,长度约为190kbp,可编码的基因约有250个,尺寸约为360
×
270
×
250nm,质量约为5
–
10fg。通过同源重组将外源基因插入到痘苗病毒基因组内,以痘苗病毒为载体使外源基因在动物细胞内表达以获得目的蛋白,从而达到免疫接种的目的。痘苗病毒的宿主范围广,不仅允许插入长片段的外源基因,还可通过多种途径进行接种,能诱导体液和细胞免疫反应并且易于增殖生产,在疫苗研制中得到了广泛的应用。此外,痘苗病毒被证明具有裂解肿瘤细胞的能力,因此,结合肿瘤免疫治疗基因的改造,可更有效的实现肿瘤的溶瘤治疗效果。
3.目前重组痘苗病毒载体采用的是细胞培养瓶或摇瓶小规模的培养293、hela细胞,尚未实现规模化生产。
4.重组痘苗病毒载体大规模生物反应器产业化生产不同于小规模的培养瓶培养工艺疫苗生产,有许多需要攻克的技术难点,具体如下:
5.(1)传统的利用培养瓶培养重组痘苗病毒过程中,是将感染后的细胞培养约48-96h后,将细胞离心收获,加入病毒保存液进行反复冻融,使细胞破碎,将病毒释放。这样的病毒培养及收获方式不仅繁琐、费时费力,而且培养工艺不易大规模产业化。所以要想利用生物反应器大规模培养重组痘苗病毒,首先需解决不采用冻融细胞的方式,而又能够获得高毒力滴度的病毒收获液。
6.(2)重组痘苗病毒相较于其他病毒而言,培养过程中不能很好地释放到细胞外,在传统小规模培养过程中该缺点不明显,但工业化大生产过程中,重组痘苗病毒不能被释放出细胞的缺陷被放大,会导致获得的病毒滴度很低,因此需要对工艺进行摸索改进,以提高收获液的产量。
技术实现要素:
7.本发明的目的在于提供一种利用生物反应器大规模生产重组痘苗病毒载体的方法,以解决上述背景技术中提出的问题。
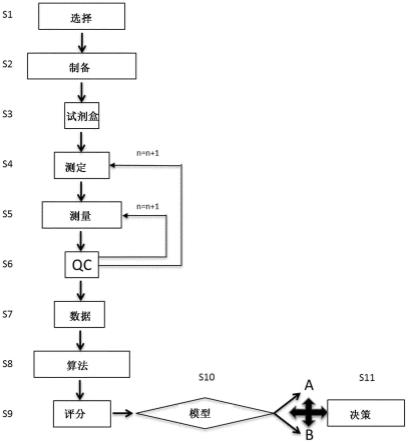
8.本发明的技术方案包括以下步骤:
9.s1、细胞的复苏与传代;
10.s2、生物反应器的准备工作;
11.s3、细胞的收集与培养;
12.s4、痘病毒的感染;
13.s5、痘病毒的维持培养及收获。
14.进一步的,所述细胞的复苏与传代是将293贴壁细胞加入细胞培养液后放入到co2培养箱中培养,细胞长成单层后,消化细胞,并制成均匀的细胞悬液,分种于培养瓶中,加入细胞培养液继续培养,细胞这样传代2-3次后,消化收集培养瓶中的细胞,并接种于10层细胞工厂,然后加入细胞培养液继续培养。
15.进一步的,所述细胞的复苏与传代是将hela-f细胞加入细胞培养液放入到摇床上培养,细胞长到1~3
×
106个/ml,分种于培养瓶中,加入细胞培养液继续培养,扩增至1l或2l摇瓶中,或者扩增至20l细胞袋中。
16.进一步的,所述生物反应器的准备工作是将300g~500g片状载体装入固定床生物反应器14l罐体里,加入10~12lpbs,然后将罐体连同其中的载体及pbs一并经高压蒸汽灭菌,高压蒸汽灭菌的温度为121℃,时长为60~120分钟;
17.灭菌后冷却至常温,将pbs排出罐体,加入细胞培养液(10%血清dmem),搅拌转速100rpm,ph7.2
±
0.05,溶氧(do)20%~50%,培养温度37℃。
18.进一步的,所述细胞的收集与培养是将10层细胞工厂细胞消化收集至接种瓶中,从瓶中取样计数细胞,然后将细胞接种于固定床生物反应器,初始密度为2~5
×
105个/ml,细胞培养初始设定搅拌转速为40~70rpm,随着细胞生长和do控制,逐渐加大搅拌转速至80~120rpm,细胞培养液是10%血清dmem培养液,培养过程中可通过监测葡萄糖浓度,计算葡萄糖的消耗情况来反映、监测细胞的分裂生长情况;当葡萄糖浓度下降至0.5~3g/l,开始灌注;根据葡萄糖浓度调节灌注量,灌注量在0.5vvd-2.5vvd。
19.进一步的,所述痘病毒的感染是直接将罐内液体换为病毒感染液(2%血清培养液),将重组痘苗病毒接入细胞罐中,moi为0.02~0.2,感染约6小时,搅拌转速40~60rpm,ph7.2
±
0.05自动调节,溶氧(do)20%~50%自动调节,培养温度35℃,6小时后开启灌注灌注量2.5~4vvd。
20.进一步的,所述痘病毒的维持培养及收获的步骤为:染毒24h,罐内液体和灌流培养液更换为无血清dmem培养液,继续灌流培养至染毒48~96小时,排空罐内液体,加入裂解液(20mmtris/0.8mmmgcl2ph8.0)4~5次裂解,收获裂解液。
21.进一步的,所述生物反应器的准备工作是将20l细胞袋安装至波浪式反应器的托盘上,如果是基本袋,需无菌连接细胞截留系统(atf或duolysis),如果是灌流袋,则不需要外接细胞截留系统;接入细胞培养液(293sfmⅱ),摇摆转速10~30rpm,摇摆角度3~6
°
ph7.0
±
0.2,溶氧(do)20%~50%,培养温度37℃;所述细胞的收集与培养是将1l或2l摇瓶细胞收集,直接接种波浪式生物反应器20l细胞袋,初始密度3~5
×
105个/ml,每天从生物反应器中取样计数细胞,细胞密度达到2
×
106个/ml开始灌流,灌注量在0.5vvd-3vvd,如做低密度培养则不需灌流;所述痘病毒的感染是将细胞袋内培养液通过截留膜或细胞截留系统更换为emem培养液,将重组痘苗病毒接入细胞罐中,moi为0.02~0.5,感染6小时,摇摆转速15~30rpm,摇摆角度3~6
°
,ph7.0
±
0.2自动调节,溶氧(do)20%~50%自动调节,培养温度37℃,6小时后开启灌注,灌注量约2~3vvd;所述痘病毒的维持培养及收获的步骤为:染毒48~96小时,将袋内悬液直接高压破碎,收获破碎后病毒液;或通过离心收集病变细胞,加入≥培养体积的裂解液,进行裂解,最后通过离心收获病毒液。
22.进一步的,所述生物反应器的准备工作是200l一次性细胞袋直接安装至生物反应器,无菌连接细胞截留系统(atf或duolysis),加入细胞培养液(293sfmⅱ),搅拌转速60~
培养箱中培养,细胞长成单层后,消化细胞,并制成均匀的细胞悬液,分种于培养瓶中,加入细胞培养液继续培养,细胞这样传代2-3次后,消化收集培养瓶中的细胞,并接种于10层细胞工厂,然后加入细胞培养液继续培养。
42.进一步的,所述细胞的复苏与传代是将hela-f细胞加入细胞培养液放入到摇床上培养,细胞长到1~3
×
106个/ml,分种于培养瓶中,加入细胞培养液继续培养,扩增至1l或2l摇瓶中,或者扩增至20l细胞袋中。
43.进一步的,所述生物反应器的准备工作是将300g~500g片状载体装入固定床生物反应器14l罐体里,加入10~12lpbs,然后将罐体连同其中的载体及pbs一并经高压蒸汽灭菌,高压蒸汽灭菌的温度为121℃,时长为60~120分钟;
44.灭菌后冷却至常温,将pbs排出罐体,加入细胞培养液(10%血清dmem),搅拌转速100rpm,ph7.2
±
0.05,溶氧(do)20%~50%,培养温度37℃。
45.进一步的,所述细胞的收集与培养是将10层细胞工厂细胞消化收集至接种瓶中,从瓶中取样计数细胞,然后将细胞接种于固定床生物反应器,初始密度为2~5
×
105个/ml,细胞培养初始设定搅拌转速为40~70rpm,随着细胞生长和do控制,逐渐加大搅拌转速至80~120rpm,细胞培养液是10%血清dmem培养液,培养过程中可通过监测葡萄糖浓度,计算葡萄糖的消耗情况来反映、监测细胞的分裂生长情况;当葡萄糖浓度下降至0.5~3g/l,开始灌注;根据葡萄糖浓度调节灌注量,灌注量在0.5vvd-2.5vvd。
46.进一步的,所述痘病毒的感染是直接将罐内液体换为病毒感染液(2%血清培养液),将重组痘苗病毒接入细胞罐中,moi为0.02~0.2,感染约6小时,搅拌转速50~60rpm,ph7.2
±
0.05自动调节,溶氧(do)20%~50%自动调节,培养温度35℃,6小时后开启灌注灌注量2.5~3vvd。
47.进一步的,所述痘病毒的维持培养及收获的步骤为:染毒24h,罐内液体和灌流培养液更换为无血清dmem培养液,继续灌流培养至染毒48~96小时,排空罐内液体,加入裂解液(20mmtris/0.8mmmgcl2ph8.0)4~5次裂解,收获裂解液。
48.进一步的,所述生物反应器的准备工作是将20l细胞袋安装至波浪式反应器的托盘上,如果是基本袋,需无菌连接细胞截留系统(atf或duolysis),如果是灌流袋,则不需要外接细胞截留系统;接入细胞培养液(293sfmⅱ),摇摆转速10~30rpm,摇摆角度3~6
°
ph7.0
±
0.2,溶氧(do)20%~50%,培养温度37℃;所述细胞的收集与培养是将1l或2l摇瓶细胞收集,直接接种波浪式生物反应器20l细胞袋,初始密度3~5
×
105个/ml,每天从生物反应器中取样计数细胞,细胞密度达到2
×
106开始灌流,灌注量在0.5vvd-3vvd,如做低密度培养则不需灌流;所述痘病毒的感染是将细胞袋内培养液通过截留膜或细胞截留系统更换为emem培养液,将重组痘苗病毒接入细胞罐中,moi为0.02~0.5,感染6小时,摇摆转速15~30rpm,摇摆角度3~6
°
,ph7.0
±
0.2自动调节,溶氧(do)20%~50%自动调节,培养温度37℃,6小时后开启灌注,灌注量约2~3vvd;所述痘病毒的维持培养及收获的步骤为:染毒48~96小时,将袋内悬液直接高压破碎,收获破碎后病毒液;或通过离心收集病变细胞,加入≥培养体积的裂解液,进行裂解,最后通过离心收获病毒液。
49.进一步的,所述生物反应器的准备工作是200l一次性细胞袋直接安装至生物反应器,无菌连接细胞截留系统(atf或duolysis),加入细胞培养液(293sfmⅱ),搅拌转速60~90rpm,ph7.0
±
0.2自动调节,溶氧(do)20%~50%自动调节,温度37℃自动调节;所述细胞
的收集与培养是将50l细胞袋细胞接种至200l细胞袋,初始体积60~70l,初始细胞密度3~5
×
105个/ml,初始搅拌转速约为60~90rpm,每天从生物反应器中取样计数细胞,细胞密度达到1
×
106个/ml,补加培养液,稀释成3~5
×
105个/ml,直至最终培养体积达到200l,当细胞密度达到2
×
106个/ml开始灌流,灌注量在0.5vvd-3vvd,如做低密度培养则不需灌流;所述痘病毒的感染是将培养液更换为emem培养液,将重组痘苗病毒接入细胞罐中,moi为0.02~0.5,感染6小时,搅拌转速60~90rpm,ph7.0
±
0.2自动调节,溶氧(do)20%~50%自动调节,温度37℃;6小时后开启灌注,灌注量约2~3vvd;所述痘病毒的维持培养及收获的步骤为:染毒48~96小时,将罐内悬液直接高压破碎,收获破碎后病毒液。
50.实施例1:
51.将重组痘苗病毒载体以0.02moi感染10个t225培养瓶293贴壁细胞,染毒48小时,分别将10瓶病变细胞离心收集,分成2组,一组按5ml/瓶的量加入病毒保存液置-80℃和37℃反复冻融3次离心收获上清,另一组按20ml/瓶的量加入低渗裂解液,裂解约1~2小时,离心收获上清,结果图1所示:可以看出,裂解法收获病毒的细胞单产基本与冻融法持平,生物反应器贴壁细胞病毒收获方式采用低渗裂解替代冻融法更容易于规模放大。
52.实施例2:
53.将重组痘苗病毒载体以0.2moi感染3.6
×
108个hela-f悬浮细胞,分装至6个100ml摇瓶中,30ml/瓶,染毒72小时,将病变细胞分成3组,一组直接连同培养基冻融2次,离心收获上清,一组离心后收集病变细胞,加入等体积的裂解液,4℃裂解过夜,一组直接用高压均质机高压破碎,破碎后离心收获上清,结果图2所示:在悬浮细胞扩增重组痘苗病毒载体中,收获方式采用高压均质机高压破碎的方式收获病毒更利于病毒产量的提高。
54.实施例3:
55.s1、细胞的复苏与传代;293细胞种子悬液准备:细胞复苏后先用培养瓶传代扩增,后用细胞工厂扩增至细胞量达到2.5
×
109~4
×
109个,消化制备成细胞悬液;
56.s2、生物反应器的准备工作;14l细胞罐装约300~400g片状载体,罐体组装灭菌后,连接控制台,校准ph和溶氧,进行无菌实验(约3~7天),观测到罐内液体澄清、各参数无异常,无菌实验合格,准备接种细胞;
57.s3、细胞的收集与培养;细胞接种后,根据氧气消耗调控搅拌转速在60~110rpm,溶氧浓度控制在30%~70%,温度控制在37
±
0.5℃,ph控制在7.2
±
0.05,每日取样检测罐内葡萄糖浓度,大约在接种细胞3-4天开启灌流,根据每次检测的葡萄糖浓度调节灌流速度,葡萄糖浓度控制在0.5-4.5g/l;
58.s4、痘病毒的感染;根据检测的葡萄糖浓度和培养液消耗计算葡萄糖消耗量,当葡萄糖日消耗达80~110g时(约在细胞接种后6~8天),准备感染病毒;排空细胞培养液,加入病毒培养液(2%血清dmem培养液),当反应器处于稳定状态时,以moi(pfu/cells)0.05
±
0.03接种于反应器中。病毒感染时参数:温度35
±
1℃;接种前设置搅拌转速为100rpm,接种3~5min后设置搅拌转速为60rpm,6小时后设置搅拌转速为100rpm;感染6小时后逐渐将温度升至37
±
0.5℃。开启灌流,进入病毒培养阶段;病毒培养24小时后排空罐内2%血清dmem培养液,加入无血清dmem培养液。根据氧气消耗调整搅拌转速在60~100rpm,溶氧浓度控制在20%~50%,温度控制在37
±
0.5℃,ph控制在7.2
±
0.05,每日根据检测的葡萄糖浓度调整灌流速度,将葡萄糖浓度控制在0.1~2.0g/l;
59.s5、痘病毒的维持培养及收获;染毒70~96h后,排空罐内无血清dmem培养液,加入病毒裂解液,开始裂解细胞,罐内裂解5次,收获每次裂解液即病毒收获液。
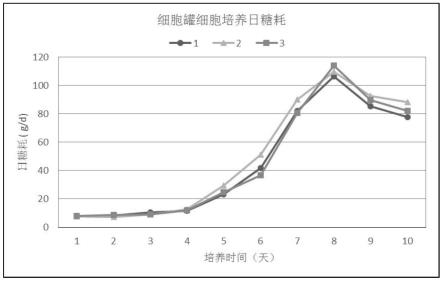
60.按此过程进行了3批实验,结果如图3、图4和图5所示。图3为细胞罐细胞培养日糖耗曲线,图4为细胞罐接种情况,图5为细胞罐收获病毒产量。
61.三批固定床生物反应器实验过程中,日糖耗曲线变化趋势基本一致,细胞培养参数稳定,细胞代谢正常,说明该生物反应器培养参数对重组痘苗病毒具有较好的适用性,生物反应器培养工艺具有良好的稳定性和可重复性。病毒总产量约在2.5~3.6
×
10
12
pfu之间,产量相对稳定,进一步说明生物反应器生产工艺具有良好的稳定性。
62.实施例4:
63.用293sfmⅱ完全培养液稀释hela-f细胞种子液至适宜接种的浓度后,将细胞种子液转入20l细胞培养袋中,初始体积约为5l,设置好培养参数,启动细胞培养。当细胞密度达到1.0e 6个细胞/ml时,补加293sfmⅱ完全培养液至最终培养体积约10l。当细胞密度达到2.0e 6cells/ml时,使用新鲜的emem培养液逐步替换培养袋中的培养液,最终emem浓度在90%以上,计算细胞袋中总的细胞数量,调整病毒种子液病毒浓度,以moi=0.1~0.5的比例,使用病毒种子液感染细胞袋中的细胞。染毒后48小时,停止培养,收获细胞培养物,高压破碎。细胞袋工艺主要工艺参数如下:
64.1)细胞培养液:293sfmⅱ完全培养液;
65.2)接种细胞量:2.0~3.0e 9个细胞;
66.3)初始接种体积:根据细胞种子液中的细胞总量,使用293sfmⅱ完全培养液稀释细胞种子液后接种,初始体积5l;
67.4)细胞培养参数:37℃(
±
1℃),ph7.0、do50%、摇动速度10~20rpm、转动角度3
°
~6
°
;
68.5)补加培养液至最终培养体积:细胞密度达到1.0e 6cells/ml时,补加293sfmⅱ完全培养液至最终培养体积;
69.6)病毒感染:细胞密度达到约2.0e 6个细胞/ml时,用新鲜的emem培养液逐步替换培养袋中的培养液,最终emem浓度在90%以上,以moi=0.1~0.2的比例,使用病毒种子液染毒;
70.7)病毒感染期参数:37℃(
±
1℃),ph7.0、do50%、摇动速度10~20rpm、转动角度6
°
~8
°
;
71.8)病毒培养期参数:37℃(
±
1℃),ph7.0、do50%、摇动速度10~20rpm、转动角度6
°
~8
°
;
72.9)收获:染毒后48h小时开始收获,直接用高压均质机高压破碎,压力约600-800bar,然后3000rpm离心10~30min,收获上清。
73.按此过程进行了3批实验,结果如图6和图7所示。图6为三批细胞袋培养细胞生长情况,图7为病毒产量情况。
74.接种于细胞袋hela-f细胞,采用低密度批次培养方式培养。在细胞接种后约第五、六天即可使用病毒种子液对细胞进行感染,在病毒感染48小时,细胞活力降低至65%以下,停止培养,收获病毒液。在三批样品生产过程中,各项参数控制稳定,细胞生长曲线基本一致,各批次之间病毒产量较为稳定。
75.对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。