1.本发明属于微生物学和基因工程领域,具体涉及一种大肠杆菌噬菌体id52裂解蛋白e高效裂解肠杆菌科细菌制备菌影的方法。
背景技术:
2.菌影(bacterial ghost)是不含核酸、蛋白质等细胞内容物的灭活细菌空壳,它保留了细菌原本的完整细胞形态大小及细胞壁表面的免疫抗原物质等结构,其表面含有的脂多糖、脂质a和肽聚糖等佐剂效应成分,能有效刺激机体免疫系统,从而产生体液免疫、细胞免疫及黏膜免疫,因此菌影可作为一种良好的疫苗及疫苗佐剂。此外,菌影广泛的空腔结构、周质间隙及内外膜均可装载单一或复合组分的抗原,如药物、核酸、蛋白质等多种物质,不仅可以应用于多价疫苗和联合疫苗的研发,还可以作为良好的递送载体系统,具有良好的应用前景。
3.目前,菌影主要通过在革兰氏阴性细菌中诱导表达噬菌体裂解基因e的方式制备形成。研究表明,噬菌体属于微病毒科,基因组很小,为ssdna。其裂解基因e编码含91个氨基酸的膜蛋白,该裂解蛋白通过寡聚化和共翻译整合至细胞内外膜上,最终诱导细菌内外膜融合,形成40~200nm的特异性跨膜通道。由于细胞膜内外渗透压的差异,核酸、蛋白质等细胞内容物通过该跨膜通道排出。
4.大多数学者通过不同启动子来控制噬菌体裂解基因e的表达,以此来制备菌影。但只有在对数生长前期(od约为0.3~0.6时)诱导噬菌体裂解基因e表达,才能有效裂解宿主菌,从而形成菌影。然而由于其起始诱导裂解od值较低,导致菌影的产量很低,不利于进行大规模生产应用。
5.与噬菌体相似,大肠杆菌噬菌体id52亦属于微病毒科,通过蛋白质同源性比对可得,噬菌体id52的裂解蛋白e与噬菌体的裂解蛋白e的同源性为55.34%。研究表明,噬菌体id52的裂解蛋白e亦能够在宿主菌的细胞膜上形成跨膜孔道,形成菌影。此外,与噬菌体裂解蛋白e不同,在对数生长后期诱导噬菌体id52e裂解蛋白表达,亦可以有效地裂解宿主菌。噬菌体id52的裂解蛋白e的菌影形成效率显著高于噬菌体裂解蛋白,并且可在高起始od诱导裂解蛋白表达,菌影产量高。
6.由于常规的温控菌影制备体系需要将宿主菌先在30℃或以下培养至一定od
600
后,再将宿主菌转移至42℃诱导裂解。由于诱导裂解前的培养温度较低,大多数宿主菌生长缓慢,不利于宿主菌进行大量繁殖,培养时间较长。同时将温度升高至42℃时,细菌表面的抗原决定簇结构可能会被损坏。此外,与细菌对化学试剂的感应相比,由于细菌对温度的感应较慢,其裂解也相应较缓慢,裂解时间较长。
技术实现要素:
7.本发明的目的是建立一种肠杆菌科细菌菌影的高效制备体系,解决菌影传统制备方法产量低的不足。
8.为实现以上目的,本发明的技术方案如下:
9.一种肠杆菌科细菌菌影的高效制备方法,包括以下步骤:
10.(1)采用rf克隆方法将噬菌体裂解基因e及噬菌体id52裂解基因e分别与温控载体连接,构建温控重组质粒;
11.(2)采用无缝克隆同源重组的方法构建阿拉伯糖诱导型重组质粒,其过程为:分别以步骤(1)构建的温控质粒pbv220-id52-e和质粒pkd46为模板进行pcr扩增,得到缺失了对温度敏感的阻遏因子λci857基因的pbv220-id52-e线性化片段和阿拉伯糖诱导型启动子arac-parabad片段,采用无缝克隆同源重组的方法,将上述获得的两个片段进行重组反应,构建阿拉伯糖诱导型id52-e重组质粒;
12.(3)将步骤(1)或(2)所述重组质粒转入大肠杆菌感受态细胞中,以氯霉素为抗性筛选,得到重组大肠杆菌单克隆;
13.(4)将步骤(3)得到的重组大肠杆菌单克隆接种至含有氯霉素的lb液体培养基中振荡培养;当菌液od
600
值达到0.8以上时,诱导裂解基因e表达,每30min取样测od
600
,最后收集诱导表达后的菌影;
14.(5)收集的菌影经离心、pbs洗涤、2.5%戊二醛固定、去离子水洗涤、乙醇逐级脱水、临界点干燥,喷金等步骤后用场发射扫描电子显微镜观察;
15.(6)收集的菌影经离心,pbs洗涤、2.5%戊二醛固定、去离子水洗涤、磷钨酸染色等步骤后,于透射电子显微镜观察。
16.步骤(1)中所述噬菌体裂解基因e的基因序列如seq id no.1所示。
17.优选地,步骤(1)中所述噬菌体id52裂解基因e的基因序列如seq id no.2所示。
18.优选地,步骤(1)中所述载体为pbv220,其基因序列如seq id no.3所示。
19.优选地,所述阿拉伯糖诱导型启动子arac-parabad片段的基因序列如seq id no.4所示。
20.优选地,步骤(3)中所述大肠杆菌感受态细胞为e.coli bl21、e.colinissle 1917或dh5α感受态细胞,e.coli bl21、dh5α的转化方法为热激法,e.colinissle 1917的转化方法为电转化。
21.更优选地,所述e.colinissle 1917采用λred重组技术将其与阿拉伯糖消耗相关基因arab、araa及arad敲除掉。
22.更优选地,所述电转化的电压为2.0~3.0kv。
23.优选地,步骤(4)中含有温控重组质粒的大肠杆菌的裂解蛋白表达的诱导条件为升温至37-42℃,含有阿拉伯糖诱导型重组质粒的大肠杆菌的裂解蛋白表达的诱导条件为加入诱导剂l-阿拉伯糖。
24.优选地,步骤(4)所述诱导od
600
值达到2.0以上。
25.优选地,步骤(4)中含有温控重组质粒的大肠杆菌的振荡培养条件为28-30℃、200-220rpm,含有阿拉伯糖诱导型重组质粒的大肠杆菌的振荡培养条件为28-37℃、200-220rpm过夜培养。
26.与现有菌影制备技术相比,本发明建立了一种肠菌科细菌菌影高效制备体系。与噬菌体裂解蛋白e相比,噬菌体id52-e裂解蛋白的裂解活性更强,菌影形成率更高。本发明建立的肠菌科细菌菌影高效制备体系,以e.coli bl21、e.colinissle 1917、肠炎沙门氏菌等肠菌科细菌为宿主菌,宿主菌诱导前后均在37℃培养,缩短了裂解前细菌培养所耗费的时间;以l-阿拉伯糖作为诱导剂,由于细菌对化学试剂感应较快,信号接收较快,添加l-阿拉伯糖后细菌便开始裂解,且阿拉伯糖成本较iptg等诱导剂低,此外,l-阿拉伯糖是一种可食用物质,安全性高;当起始诱导od
600
值达到2.0时,加入诱导剂l-阿拉伯糖,其od
600
值可降低至0.3-0.4。本发明显著提高了菌影的产量,为菌影的大规模生产及应用提供了技术基础。
附图说明
27.图1为温控重组质粒的构建过程及琼脂糖凝胶电泳图,其中,a、b分别为温控质粒和pbv220-id52-e的构建,c为裂解基因和裂解基因id52-e的pcr扩增电泳图,d为含有裂解基因的重组质粒的菌落pcr电泳图,m为dl 2000dna maker。
28.图2为阿拉伯糖诱导型id52-e重组质粒的构建及琼脂糖凝胶电泳图,其中,a为阿拉伯糖诱导型id52-e重组质粒的构建,b为pcr扩增电泳图,泳道1为缺失了对温度敏感的阻遏因子λci857基因的pbv220-id52-e线性化片段,泳道2为阿拉伯糖诱导启动子arac-parabad片段,c为阿拉伯糖诱导型id52-e重组质粒的菌落pcr电泳图其中,m为dl 5000dna maker。
29.图3为分别含有温控质粒pbv220-id52-e和阿拉伯糖诱导型id52e重组质粒arac-parabad-id52-e的e.coli bl21裂解曲线测定及其od
600
下降程度比较,其中,a-b、c-d、e-f、g-h分别为:起始诱导od为0.8、1.2、1.6、2.0。
30.图4为不同裂解质粒在e.coli bl21(de3)中的灭活效率。
31.图5为含有不同裂解质粒的e.coli bl21(de3)基因组及蛋白质泄露情况的表征,a:裂解前后菌体基因组残余量;b:基因组泄露程度;c:胞内蛋白质泄露情况。
32.图6为e.coli bl21扫描电子显微镜图,a为未处理的形态完整野生型e.coli bl21;b为裂解质粒形成的菌影;c为裂解质粒pbv220-id52-e形成的菌影;d为裂解质粒arac-parabad-id52-e形成的菌影;箭头所指为裂解孔道。
33.图7为e.coli bl21透射电子显微镜图:a为未处理的形态完整的野生型e.coli bl21;b为裂解质粒形成的菌影;c为裂解质粒pbv220-id52-e形成的菌影;d为裂解质粒arac-parabad-id52-e形成的菌影。
34.图8为不同浓度阿拉伯糖诱导条件下,质粒arac-parabad-id52-e在e.colinissle1917δarabad::frt中的裂解曲线。
35.图9为e.colinissle 1917δarabad::frt扫描电子显微镜图,a为形态完整的e.colinissle1917δarabad::frt;b为裂解后的e.colinissle 1917δarabad::frt菌影,箭头所指为裂解孔道。
36.图10为e.colinissle 1917裂解前后的透射电子显微镜图,a为形态完整的e.colinissle1917δarabad::frt,由于含有细胞内含物,菌体呈现均匀的黑色;b、c为裂解
后的e.colinissle 1917δarabad::frt在不同放大倍数的菌影,由于细胞内含物外流,细菌细胞质空腔部分颜色较浅。
具体实施方式
37.为了使本领域技术人员更清晰的了解本发明的核心技术,下面结合附图和具体实施方式,进一步阐明本发明。下述方法中,若无特殊说明,则为常规方法。
38.实验材料:e.coli dh5α和e.coli bl21感受态均购于天根生化科技(北京)有限公司,e.colinissle 1917购于德国ardeypharm有限责任公司,质粒pkd46为优宝生物提供的,产品编号为vt1692。
39.主要试剂:dl 2000dna marker及dl 5000dna marker购于takara公司;蛋白质marker购于赛默飞公司;质粒提取试剂盒、通用型dna纯化回收试剂盒、细菌基因组提取试剂盒均购于天根生化科技(北京)有限公司;氯霉素及l-阿拉伯糖等均购于生工生物(上海)有限公司;lb肉汤培养基购于北京陆桥生物技术有限责任公司。
40.实施例1:e.coli bl21重组菌株的制备
41.1.1温控重组质粒和pbv220-id52-e的构建
42.根据质粒pbv220-sgfp-chl、及pet29a-id52-e的序列(质粒图谱见图1),使用rf克隆方法,设计上下游引物,引物序列如下:
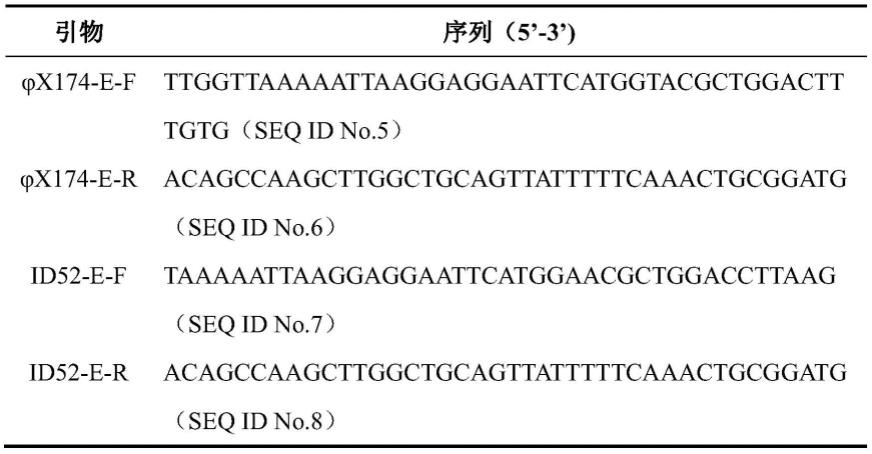
43.表1裂解基因和裂解基因id52e pcr扩增引物
[0044][0045]
配制pcr体系,以及pet29a-id52-e分别为模板进行pcr扩增,合成基因(seq id no.1)及id52-e基因(seq id no.2),pcr体系及程序如下:
[0046]
表2裂解基因和id52-e pcr扩增体系及反应程序
[0047][0048]
取4μl pcr扩增产物进行琼脂糖凝胶电泳分析;纯化回收,得到目的基因基因及id52-e基因;
[0049]
采用rf线性扩增的方法以pbv220-sgfp-chl质粒为模板,以上述回收的pcr产物为引物进行线性扩增,pcr反应体系如下:
[0050]
表3 rf线性扩增反应体系及反应程序
[0051][0052]
线性扩增反应完成后,用dpni酶消化体系中未甲基化的模板质粒,程序如下:
[0053]
表4 dpni酶切体系
[0054][0055]
体系配制完成后,在37℃条件下,酶切1h;
[0056]
将酶切产物转化至e.coli dh5α感受态中,以氯霉素作为抗性筛选;次日,挑取单克隆,用特异性引物引物和id52e-f/id52e-r进行菌落pcr,将条带大小正确的阳性克隆子测序;测序正确的阳性克隆质粒即为构建成功的重组质粒,命名为和pbv220-id52-e;
[0057]
1.2重组质粒arac-parabad-id52-e的构建
[0058]
根据1.1构建好的质粒pbv220-id52-e及质粒pkd46的序列(质粒图谱见图2),使用无缝克隆同源重组的方法,设计上下游引物,引物序列如下:
[0059]
表5线性化pbv220-id52-e片段及阿拉伯糖诱导型启动子arac-parabad片段pcr扩增引物
[0060][0061]
配制pcr体系,以质粒pbv220-id52-e及pkd46分别为模板进行pcr扩增,合成线性化pbv220-id52-e片段及阿拉伯糖诱导型启动子arac-parabad片段(seq id no.4),pcr体系及程序如下:
[0062]
表6线性化pbv220-id52e-strep-chl片段及阿拉伯糖诱导启动子arac-parabad片段pcr扩增体系及反应程序
[0063][0064]
取4μl pcr扩增产物进行琼脂糖凝胶电泳分析;纯化回收,得到线性化pbv220-id52e片段及阿拉伯糖诱导启动子arac-parabad片段;
[0065]
采用无缝克隆同源重组的方法,将上述获得的片段线性化pbv220-id52-e片段及阿拉伯糖诱导启动子arac-parabad片段进行重组反应,反应体系如下:
[0066]
表7线性化pbv220-id52-e片段及阿拉伯糖诱导型启动子arac-parabad片段重组连接反应体系
[0067][0068][0069]
50℃连接反应15min。
[0070]
将重组连接产物转化至e.coli dh5α感受态中,以氯霉素作为抗性筛选;次日,挑取单克隆,用特异性引物进行菌落pcr,将条带大小正确的阳性克隆子测序;测序正确的阳性克隆质粒即为构建成功的重组质粒,命名为arac-parabad-id52-e;
[0071]
1.3重组质粒pbv220-id52-e及arac-parabad-id52-e的转化
[0072]
将重组质粒pbv220-id52-e及arac-parabad-id52-e分别用热激法转入e.coli bl21感受态细胞中,以氯霉素为抗性筛选,得到重组e.coli bl21单克隆;
[0073]
实施例2:pbv220-id52-e和arac-parabad-id52-e裂解效果比较
[0074]
将实施例1得到的重组e.coli bl21单克隆接种至含有25μg/ml氯霉素的lb液体培
养基中,含有重组质粒的e.coli bl21及含有重组质粒pbv220-id52-e的e.coli bl21在30℃、220rpm条件下过夜培养;次日按体积比1:50转接至新鲜lb液体培养基中,30℃、220rpm条件下培养至od
600
约为0.8、1.2、1.6、2.0时,将培养温度升至42℃,诱导裂解蛋白和id52-e表达,每30min取样,测定od
600
值,绘制裂解曲线;
[0075]
含有重组质粒arac-parabad-id52-e的e.coli bl21在37℃、220rpm过夜培养;次日按体积比1:50转接至新鲜lb液体培养基中,37℃、220rpm条件下培养至od
600
约为0.8、1.2、1.6、2.0时,加入诱导剂0.5mg/ml l-阿拉伯糖,诱导裂解蛋白id52e表达,每30min取样,测定od
600
值,绘制裂解曲线;
[0076]
此外,分别取100μl诱导前和诱导裂解后od
600
值最低点菌液进行梯度稀释,分别涂布于含有25μg/ml氯霉素的lb琼脂平板上,在30℃/37℃培养箱过夜培养,统计诱导前及诱导裂解后od
600
值最低点的活菌数,计算细菌灭活解率,细菌灭活效率=(诱导前cfu-诱导后cfu)/诱导前cfu
×
100%,结果如表8及图4所示,随着起始诱导od
600
的升高,温控裂解蛋白温控裂解蛋白id52-e及阿拉伯糖诱导id52-e的灭活效率逐渐提高,且三者之间的灭活效率无显著差异。然而,由裂解曲线(图3)可知,高od诱导时,温控裂解蛋白的裂解效果比温控id52-e和阿拉伯糖诱导id52-e差,其od
600
下降程度具有显著差异;菌影形成后,由于基因组、蛋白质等内含物从细胞内流出,od
600
因此下降,由此说明温控id52-e和阿拉伯糖诱导id52-e的菌影形成率显著高于温控裂解蛋白且阿拉伯糖诱导id52-e的菌影形成率最高,显著提高了菌影的产量。
[0077]
表8不同裂解质粒在在e.coli bl21(de3)中的灭活效率
[0078][0079]
实施例3:基因组、胞内蛋白质等细胞内含物泄露情况表征
[0080]
将含有不同裂解质粒的e.coli bl21培养至od
600
值约为1.6,分别收集2ml菌液,暂存于4℃冰箱;分别诱导裂解蛋白e表达,每30min取样测od
600
,当od
600
值达到最低点时,分别收集2ml菌液;将上述收集的诱导前菌液及裂解最低点菌液于5000rpm离心15min,收集菌体沉淀;使用天根公司的细菌基因组提取试剂盒对收集的上述沉淀进行基因组提取;超微量分光度计检测提取的基因组浓度(ng/μl),并计算基因组泄露程度,基因组泄露程度%=(诱导前基因组浓度-诱导后基因组浓度)/诱导前基因组浓度
×
100%。
[0081]
将含有不同裂解质粒的细菌分别培养至od
600
值约为1.6,分别收集5ml菌液,暂存于4℃冰箱;分别诱导裂解蛋白e表达,每30min取样测od
600
,当od
600
值达到最低点时,分别收集5ml菌液;将上述收集的菌液于5000rpm离心15min,分别收集菌体沉淀和培养基上清;分
别用500μl pbs重悬菌体,置于超声破碎仪下(冰浴)破碎菌体,超声功率为100w,3s开,3s关,超声5min;取40μl破碎后的样品全液及40μl离心后的培养基上清样品,分别加入10μl 5
×
sds-β-巯基乙醇loading buffer,混匀后沸水浴10min,12000rpm离心2min,然后进行sds-page检测。
[0082]
与裂解曲线(图3)趋势一致,细菌基因组泄漏情况的表征(图5a、b)显示,含有arac-parabad-id52-e质粒的e.coli bl21(de3)基因组残留量最少(图5a),基因组泄漏程度最高(图5b)。而含有质粒的e.coli bl21(de3)基因组残留量最多(图5a),基因组泄露程度最低(图5b)。sds-page结果(图5c)显示含有arac-parabad-id52-e质粒的e.coli bl21(de3)胞内蛋白质残留量最少,培养基上清中的蛋白质含量最多。基因组及胞内蛋白质泄露情况的表征结果表明arac-parabad-id52-e质粒对e.coli bl21(de3)的裂解效果最好,从而导致更多的细胞内含物外排至外部培养基中。
[0083]
实施例4:e.colinissle 1917菌影的高效制备
[0084]
4.1e.colinissle 1917δarabad::frt工程菌的构建
[0085]
由于e.colinissle 1917可利用l-阿拉伯糖作为碳源,且其利用速率较快,当e.colinissle1917δarabad::frt将l-阿拉伯糖消耗尽时,e.colinissle 1917δarabad::frt容易重新开始生长。故采用λred重组技术将e.colinissle 1917的阿拉伯糖消耗相关基因arab、araa及arad敲除掉,可使l-阿拉伯糖全部用于诱导细菌的裂解,提高l-阿拉伯糖的利用效率和菌影的形成效率。
[0086]
4.2e.colinissle 1917δarabad::frt菌影的高效制备
[0087]
将重组质粒arac-parabad-id52-e电转进e.colinissle 1917δarabad::frt电转感受态中,电转电压为2.0kv,以氯霉素为抗性筛选,得到重组e.colinissle 1917δarabad::frt单克隆;
[0088]
将得到的重组e.colinissle 1917δarabad::frt单克隆接种至含有25μg/ml氯霉素的lb液体培养基中,37℃、220rpm过夜培养,次日按体积比1:50转接至新鲜lb液体培养基中,37℃、220rpm培养至od约为2.5时,分别添加0.25、0.5、1mg/ml诱导剂l-阿拉伯糖,诱导裂解蛋白id52e表达,每隔30min取样测od
600
,od
600
最低可降至0.5左右(图8)。
[0089]
实施例5:e.coli bl21菌影及e.colinissle 1917菌影的扫描电子显微镜观察
[0090]
分别收集实施例2和实施例4例中诱导前及诱导裂解后菌液10ml,4℃、5000rpm离心15min,弃上清;用pbs洗涤3次,每次4℃、5000rpm离心15min,充分洗去培养基;再加入5ml 2.5%戊二醛电镜专用固定液4℃固定过夜(8h以上);4℃、5000rpm离心15min,弃上清,去除固定液;用5ml去离子水浸泡菌液5min,4℃、5000rpm离心15min,弃上清,重复3次;用1ml去离子水重悬菌体,滴加适量菌液到干燥细胞扒片上,包埋在滤纸片中,使其依次浸泡在70%、85%、95%的乙醇中15min,最后再浸泡在100%乙醇中15min(此过程重复3次),逐级脱水,保证充分去除样品中的水分;将样品及滤纸片一起放入临界点干燥仪器中干燥,干燥完成后,取出滤纸中的细胞扒片,将含有样品的细胞扒片粘贴在导电胶上,然后放在喷金仪器中喷金处理,最后在场发射扫描电子显微镜下观察菌影形态。
[0091]
如图6所示,6a为未处理的形态完整野生型e.coli bl21;6b为裂解质粒形成的菌影,其保留了细胞膜形态结构,裂解孔道位于赤道中央,且由于细胞内含物的排出,细胞膜向空的细胞内腔塌陷;6c为裂解质粒pbv220-id52-e形成的菌
影,其保留了细胞膜形态结构,裂解孔道位于两极,且在裂解孔道处发生皱缩,推测其可能处于裂解初期,细胞内含物未完全外排,故细胞膜仅在裂解孔道处发生轻度皱缩;6d为裂解质粒arac-parabad-id52-e形成的菌影,其保留了细胞膜形态结构,裂解孔道位于赤道中央,且由于细胞内含物的排出,细胞膜向空的细胞内腔塌陷。箭头所指为裂解孔道。
[0092]
如图9所示,e.colinissle 1917菌影保持了完整的细胞形态和膜结构,其跨膜通道位于细菌细胞的赤道或两极(图9b)。箭头代表裂解孔道。
[0093]
实施例6:e.coli bl21菌影及e.colinissle 1917菌影的透射电子显微镜观察
[0094]
分别收集实施例2和实施例4例中诱导前及诱导裂解后菌液10ml,4℃、5000rpm离心15min,弃上清;用pbs洗涤3次,每次4℃、5000rpm离心15min,充分洗去培养基;再加入5ml 2.5%戊二醛电镜专用固定液4℃固定过夜(8h以上);4℃、5000rpm离心15min,弃上清,去除固定液,用5ml去离子水浸泡菌液5min,4℃、5000rpm离心15min,弃上清,重复3次;用1ml去离子水重悬菌体,用移液枪吸取适量菌液滴加到事先备好的碳膜铜网上,室温静置5-10min,用吸水纸吸走周围多余的水份。用移液枪吸取适量3%磷钨酸染液覆盖于附有菌体的碳膜铜网上,静置5min,吸水纸吸取多余染液。吸取适量双蒸水置于碳膜铜网上,洗掉未结合的染液,重复操作2次。最后,室温静置待水份蒸干,置于透射电子显微镜下观察,由于菌影及完整细菌的透光度不一,因此视野中观察到颜色深浅不一的菌体。
[0095]
如图7所示,7a为未处理的形态完整的野生型e.coli bl21,由于含有细胞内含物,菌体整体呈现颜色均一的黑色;e.coli bl21菌影由于细胞内含物外排而使细胞内腔部分颜色较浅,呈浅色透明状态,7b为裂解质粒形成的e.coli bl21菌影,其保留了细胞膜形态结构,但菌影的形成率较低,视野中大部分细菌仍未将细胞内含物排出,说明其裂解效果较差。7c为裂解质粒pbv220-id52-e形成的e.coli bl21菌影,其保留了细胞膜形态结构,大部分细菌已将细胞内含物排出,形成菌影。7d为裂解质粒arac-parabad-id52-e形成的e.coli bl21菌影,细菌保留了细胞膜形态结构,且除少数细菌外,绝大多数细菌基本将细胞质排出而形成菌影,说明其裂解效果最好。
[0096]
如图10所示,与未处理的e.colinissle 1917(图10a)相比,e.colinissle 1917菌影的内容物已全部排出(图10b)。
[0097]
本发明提供了一种制备肠菌科细菌菌影的制备方法,显著提高了菌影的产量,为肠菌科细菌菌影的大规模制备奠定了技术基础。
[0098]
对于所有公开的具体实施的上述说明,帮助本领域人员理解或实现本发明,不用作对保护范围的限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
