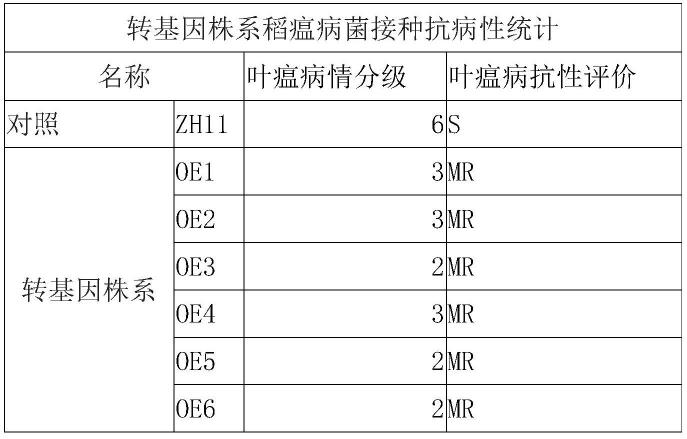
1.本发明涉及药物化学领域,具体地涉及一种化合物晶型及其制备方法和应用。
背景技术:
2.s-(-)-2,3-亚甲二氧基-5,8,13,13a-四氢-10,11-二甲氧基-6h-二苯并[a,g]喹嗪α
1a-ar拮抗剂,其制备方法在wo2018041112a1中公开。
[0003][0004]
前列腺增生是中老年男性常见的生理病变,全球50岁以上的男性有超过一半受到了前列腺疾病的困扰,已成为老年泌尿系统的主要疾病之一。尽管目前已有一些5α-还原酶抑制剂和α1肾上腺素受体(α1-ar)拮抗剂用于前列腺增生的治疗,但是这些药物在药效和安全性能方面仍然存在若干待解决的问题,性功能障碍和体位性低血压等副作用在很大程度上局限了这些药物疗效的发挥。因此,开发新型的更为安全有效的药物,对满足bph患者的临床用药需求具有重要的意义。
[0005]
由于药物的不同晶型可能会影响其在体内的溶出、吸收,进而可能在一定程度上影响药物的临床疗效和安全性,特别是一些难溶性口服固体或半固体制剂,晶型的影响会更大。
[0006]
因此,有必要开发高稳定性、低吸湿性、方便加工的化合物晶型。
技术实现要素:
[0007]
本发明的目的是提供一种高稳定性、低吸湿性、方便加工的式i化合物的晶型。
[0008]
有鉴于此,本发明提出了一种式i化合物的晶型a,
[0009][0010]
所述晶型a的x-射线粉末衍射图谱包括3个及3个以上选自下组的2θ值:
[0011]
12.21
±
0.2
°
、13.381
±
0.2
°
、15.181
±
0.2
°
、16.171
±
0.2
°
、17.101
±
0.2
°
、19.801
±
0.2
°
、21.511
±
0.2
°
、24.391
±
0.2
°
、25.321
±
0.2
°
。
[0012]
进一步地,所述晶型a的x-射线粉末衍射图谱包括选自下组的2θ值:
[0013]
12.21
±
0.2
°
、13.381
±
0.2
°
、15.181
±
0.2
°
、16.171
±
0.2
°
、17.101
±
0.2
°
、19.801
±
0.2
°
、21.511
±
0.2
°
、24.391
±
0.2
°
、25.321
±
0.2
°
。
[0014]
进一步地,所述晶型a的x-射线粉末衍射图谱包括3个及3个以上选自下组的2θ值:
[0015]
12.21
±
0.1
°
、13.381
±
0.1
°
、15.181
±
0.1
°
、16.171
±
0.1
°
、17.101
±
0.1
°
、19.801
±
0.1
°
、21.511
±
0.1
°
、24.391
±
0.1
°
、25.321
±
0.1
°
。
[0016]
进一步地,前述2θ值位置峰对应的相对强度为:
[0017][0018][0019]
进一步地,所述晶型a包括在3个及3个以上选自下组的晶面间距d值处具有特征峰:峰:
[0020]
进一步地,所述晶型a具有基本如图2所示的xrpd图,或所述晶型a的x-射线粉末衍射图谱在基本如表1所示;2θ值处特征峰每个峰的2θ值可选地具有
±
0.2
°
的误差幅度,或优选具有
±
0.1
°
的误差幅度。
[0021]
进一步地,所述晶型a具有一个或多个选自下组的特征:
[0022]
1)所述晶型a的tga图在式i化合物分解前无失重;
[0023]
2)所述晶型a的dsc图在峰值(peak)为172
±
5℃(或
±
3℃,或
±
1℃)处具有特征吸收峰;
[0024]
3)所述晶型a在0-95%相对湿度下吸湿增重≤1%,较佳地,0.4%
±
0.3%。
[0025]
在另一优选例中,所述晶型a的ir图包括3个或3个以上用波长λ表示的以下特征吸
收峰:3599
±
2cm-1
、3001
±
2cm-1
、2934
±
2cm-1
、2835
±
2cm-1
、2789
±
2cm-1
、1611
±
2cm-1
、1520
±
2cm-1
、1485
±
2cm-1
、1452
±
2cm-1
、1348
±
2cm-1
、1248
±
2cm-1
、1217
±
2cm-1
、1107
±
2cm-1
、1030
±
2cm-1
、995
±
2cm-1
、926
±
2cm-1
、856
±
2cm-1
,较佳地,每个所述特征吸收峰存在
±
1cm-1
的误差幅度。
[0026]
进一步地,所述晶型a具有一个或多个选自下组的特征:
[0027]
1)所述晶型a具有基本如图3所示的tga图;
[0028]
2)所述晶型a具有基本如图4所示的dsc图;
[0029]
3)所述晶型a具有基本如图5所示的dvs图;
[0030]
4)所述晶型a具有基本如图6所示的ir图。
[0031]
本发明还提供一种晶体组合物,所述晶体组合物包含如前任一所述的晶型a。
[0032]
在另一优选例中,以所述晶体组合物的总重量计,晶型a的重量百分含量为60-99.999%,较佳地为80-99.999%,更佳地为90-99.999%。
[0033]
在另一优选例中,所述晶型组合还包括:非晶型a的式i化合物晶体或无定形的式i化合物。
[0034]
本发明还提供一种如前所述的晶型a的制备方法,所述方法包括如下步骤:
[0035]
将式i化合物混悬于惰性溶剂中,搅拌,过滤,得所述晶型a;
[0036]
在另一优选例中,所述惰性溶剂选自异丙醇或正己烷。
[0037]
在另一优选例中,所述式i化合物在惰性溶剂中的重量体积比为:10-100mg/ml,较佳地,15-50mg/ml,更佳地,20-40mg/ml。
[0038]
在另一优选例中,所述搅拌具有一个或多个选自下组的特征:
[0039]
(1)所述搅拌的时间为12-48h,较佳地,18-36h。
[0040]
(2)所述搅拌的温度为25
±
5℃。
[0041]
本发明还提供一种如前任一所述晶型a或如前所述晶型组合物的用途,其可用于制备用于预防和/或治疗前列腺增生疾病的药物。
[0042]
本发明还提供一种包括如前任一所述晶型a或如前所述晶型组合物的药物以及药学上可接受的载体。
[0043]
在另一优选例中,所述载体选自下组:填充剂、崩解剂、润滑剂、或其组合。
[0044]
在另一优选例中,所述填充剂选自下组:预胶化淀粉、乳糖、微晶纤维素、糊精、甘露醇、氧化镁、硫酸钙、或其组合。
[0045]
在另一优选例中,所述崩解剂选自下组:羧甲基纤维素及其盐、交联羧甲基纤维素及其盐、交联聚维酮、羧甲基淀粉钠、低取代羟丙基纤维素、或其组合。
[0046]
在另一优选例中,所述润滑剂选自下组:硬脂酸镁、硬脂酸钙、或其组合。
[0047]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0048]
图1为实施例1的晶型a的偏光显微镜照片。
[0049]
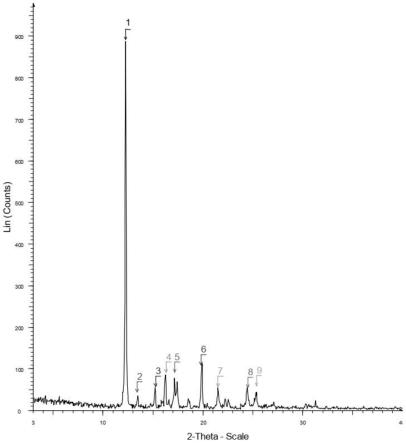
图2为实施例1的晶型a的x-射线粉末衍射(xrpd)图。
[0050]
图3为实施例1的晶型a的热失重分析(tga)图。
[0051]
图4为实施例1的晶型a的差示扫描量热分析(dsc)图。
[0052]
图5为实施例1的晶型a的动态蒸汽吸附(dvs)图。
[0053]
图6为实施例1的晶型a的红外光谱(ir)图。
[0054]
图7为对比例1的晶型b的x-射线粉末衍射(xrpd)图。
[0055]
图8为对比例2的晶型c的x-射线粉末衍射(xrpd)图。
[0056]
图9为对比例3的晶型d的x-射线粉末衍射(xrpd)图。
具体实施方式
[0057]
本发明人经过广泛而深入的研究,通过大量筛选和测试,提供了一种式i化合物的晶型a,所述晶型a不含水和溶剂,具有高稳定性和低吸湿性,易于加工,适合成药。在此基础上完成了本发明。
[0058]
术语
[0059]
除非另有定义,否则本文中所用的全部技术术语和科学术语均具有如本发明所属领域普通技术人员通常理解的相同含义。
[0060]
如本文所用,在提到具体列举的数值中使用时,术语“约”意指该值可以从列举的值变动不多于1%。例如,如本文所用,表述“约100”包括99和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。
[0061]
如本文所用,术语“含有”或“包括(包含)”可以是开放式、半封闭式和封闭式。换言之,所述术语也包括“基本上由
…
构成”、或“由
…
构成”。
[0062]
如本文所述,术语“式i化合物”、“s-(-)-2,3-亚甲二氧基-5,8,13,13a-四氢-10,11-二甲氧基-6h-二苯并[a,g]喹嗪”可互换使用。
[0063]
如本文所用,术语“n个或n个以上”指包括n以及大于n的任意正整数(例如n、n 1、
…
.),其中上限nup为该组中所有值的个数。例如“1个或1个以上”不仅包括1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、
…
上限nup各个正整数,还包括“2个或2个以上”、“3个或3个以上”、“4个或4个以上”、“5个或5个以上”、“6个或6个以上”、“7个或7个以上”、“8个或8个以上”、“9个或9个以上”、“10个或10个以上”、“11个或11个以上”、“12个或12个以上”、“13个或13个以上”、“14个或14个以上”、“15个或15个以上”、等范围。例如“3个或3个以上”不仅包括3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、
…
上限nup各个正整数,还包括“4个或4个以上”、“5个或5个以上”、“6个或6个以上”、“7个或7个以上”、“8个或8个以上”、“9个或9个以上”、“10个或10个以上”、“11个或11个以上”、“12个或12个以上”、“13个或13个以上”、“14个或14个以上”、“15个或15个以上”等范围。
[0064]
如本文所用,术语“惰性溶剂”指不与本发明的式i化合物发生反应的溶剂。优选地,本发明的晶型a制备方法中使用的溶剂均不与式i化合物发生反应。
[0065]
如无特别说明,术语“室温”或“常温”指温度为4-32℃,较佳地,25
±
5℃。
[0066]
多晶型物
[0067]
固体不是以无定形的形式就是以结晶的形式存在。在结晶形式的情况下,分子定位于三维晶格格位内。当化合物从溶液或浆液中结晶出来时,它可以不同的空间点阵排列结晶(这种性质被称作“多晶型现象”),形成具有不同的结晶形式的晶体,这各种结晶形式
被称作“多晶型物”。给定物质的不同多晶型物可在一个或多个物理属性方面(如溶解度和溶解速率、真比重、晶形、堆积方式、流动性和/或固态稳定性)彼此不同。
[0068]
如本发明所用,“晶型a”、“式i化合物的晶型a”、“本发明的晶型a”、“s-(-)-2,3-亚甲二氧基-5,8,13,13a-四氢-10,11-二甲氧基-6h-二苯并[a,g]喹嗪的晶型a”可互换使用。
[0069]
晶型a
[0070]
本发明提供了式i化合物的晶型a,
[0071][0072]
所述晶型a的x-射线粉末衍射图谱包括3个及3个以上选自下组的2θ值:
[0073]
12.21
±
0.2
°
、13.381
±
0.2
°
、15.181
±
0.2
°
、16.171
±
0.2
°
、17.101
±
0.2
°
、19.801
±
0.2
°
、21.511
±
0.2
°
、24.391
±
0.2
°
、25.321
±
0.2
°
。
[0074]
进一步地,所述晶型a的x-射线粉末衍射图谱包括3个及3个以上选自下组的2θ值:
[0075]
12.21
±
0.1
°
、13.381
±
0.1
°
、15.181
±
0.1
°
、16.171
±
0.1
°
、17.101
±
0.1
°
、19.801
±
0.1
°
、21.511
±
0.1
°
、24.391
±
0.1
°
、25.321
±
0.1
°
。
[0076]
进一步地,前述2θ值位置峰对应的相对强度为:
[0077]
2θ角相对强度12.21
±
0.2
°
10013.381
±
0.2
°
2.5
±
0.515.181
±
0.2
°
4.48
±
0.516.171
±
0.2
°
7.05
±
0.517.101
±
0.2
°
17.79
±
0.519.801
±
0.2
°
14.02
±
0.521.511
±
0.2
°
6.47
±
0.524.391
±
0.2
°
6.56
±
0.525.321
±
0.2
°
5.44
±
0.5
[0078]
进一步地,所述晶型a包括在3个及3个以上选自下组的晶面间距d值处具有特征峰:峰:
[0079]
进一步地,所述晶型a具有基本如图2所示的xrpd图,或所述晶型a的x-射线粉末衍射图谱在基本如表1所示。2θ值处特征峰每个峰的2θ值可选地具有
±
0.2
°
的误差幅度,或优选具有
±
0.1
°
的误差幅度。
[0080]
进一步地,所述晶型a具有一个或多个选自下组的特征:
[0081]
1)所述晶型a的tga图在式i化合物分解前无失重;
[0082]
2)所述晶型a的dsc图在峰值(peak)为172
±
5℃(或
±
3℃,或
±
1℃)处具有特征吸收峰;
[0083]
3)所述晶型a在0-95%相对湿度下吸湿增重≤1%,较佳地,0.4%
±
0.3%。
[0084]
在另一优选例中,所述晶型a的ir图包括3个或3个以上用波长λ表示的以下特征吸收峰:3599
±
2cm-1
、3001
±
2cm-1
、2934
±
2cm-1
、2835
±
2cm-1
、2789
±
2cm-1
、1611
±
2cm-1
、1520
±
2cm-1
、1485
±
2cm-1
、1452
±
2cm-1
、1348
±
2cm-1
、1248
±
2cm-1
、1217
±
2cm-1
、1107
±
2cm-1
、1030
±
2cm-1
、995
±
2cm-1
、926
±
2cm-1
、856
±
2cm-1
,较佳地,每个所述特征吸收峰存在
±
1cm-1
的误差幅度。
[0085]
进一步地,所述晶型a具有一个或多个选自下组的特征:
[0086]
1)所述晶型a具有基本如图3所示的tga图;
[0087]
2)所述晶型a具有基本如图4所示的dsc图;
[0088]
3)所述晶型a具有基本如图5所示的dvs图;
[0089]
4)所述晶型a具有基本如图6所示的ir图。
[0090]
晶体组合物
[0091]
本发明还提供了一种晶体组合物,所述晶体组合物包含本发明第一方面所述的晶型a。
[0092]
在另一优选例中,以所述晶体组合物的总重量计,晶型a的重量百分含量为60-99.999%,较佳地为80-99.999%,更佳地为90-99.999%。
[0093]
在另一优选例中,所述晶型组合还包括:非晶型a的式i化合物晶体或无定形的式i化合物。
[0094]
结晶
[0095]
可以通过操作溶液,使得目标化合物的溶解度极限被超过,从而完成生产规模的结晶。这可以通过多种方法来完成,例如,在相对高的温度下溶解化合物,然后冷却溶液至饱和极限以下。或者通过沸腾、常压蒸发、真空干燥或通过其它的一些方法来减小液体体积。可通过加入反溶剂或化合物在其中具有低的溶解度的溶剂或这样的溶剂的混合物,来降低感兴趣化合物的溶解度。另一种可选方法是调节ph值以降低溶解度。
[0096]
假如期望盐的形成与结晶同时发生,如果盐在反应介质中比原料溶解度小,那么加入适当的酸或碱可导致所需盐的直接结晶。同样,在最终想要的形式比反应物溶解度小的介质中,合成反应的完成可使最终产物直接结晶。
[0097]
结晶的优化可包括用所需形式的晶体作为晶种接种于结晶介质中。另外,许多结晶方法使用上述策略的组合。一个实施例是在高温下将感兴趣的化合物溶解在溶剂中,随后通过受控方式加入适当体积的反溶剂,以使体系正好在饱和水平之下。此时,可加入所需形式的晶种(并保持晶种的完整性),将体系冷却以完成结晶。
[0098]
晶型a的制备方法
[0099]
本发明还提供一种如前所述的晶型a的制备方法,所述方法包括如下步骤:
[0100]
将式i化合物混悬于惰性溶剂中,搅拌,过滤,得所述晶型a;
[0101]
在另一优选例中,所述惰性溶剂选自异丙醇或正己烷。
[0102]
在另一优选例中,所述式i化合物在惰性溶剂中的重量体积比为:10-100mg/ml,较佳地,15-50mg/ml,更佳地,20-40mg/ml。
[0103]
在另一优选例中,所述搅拌具有一个或多个选自下组的特征:
[0104]
(1)所述搅拌的时间为12-48h,较佳地,18-36h。
[0105]
(2)所述搅拌的温度为25
±
5℃。
[0106]
优选地,上述多种制备方法的原料为无定形形式的式i化合物。
[0107]
典型地,上述多种制备方法获得的晶型a可根据需要通过本领域常规方式进行过滤、干燥等步骤。
[0108]
优选地,所述过滤可以选自(但并不限于):离心后过滤、压滤或真空过滤。所述干燥可以选自(但并不限于):真空干燥或烘箱干燥。
[0109]
药物组合物和应用
[0110]
本发明的药物组合物包含安全有效量的式i化合物的所述晶型a及药学上可以接受的载体。
[0111]
本发明的“活性成分”是指本发明所述的的式i化合物,优选地,指本发明的晶型a。
[0112]
典型地,以所述活性成分的总重量计,晶型a的重量百分含量为60-99.999%,较佳地为80-99.999%,更佳地为90-99.999%。
[0113]
本发明的晶型a、晶体组合物和药物组合物可用于预防和/或治疗前列腺增生疾病。
[0114]
其中“安全有效量”指的是:化合物的量足以明显改善病情,而不至于产生严重的副作用。通常,药物组合物含有1-2000mg本发明晶型a/剂,更佳地,含有10-500mg本发明化合物/剂。较佳地,所述的“一剂”为一个胶囊或药片。
[0115]“药学上可接受的载体”指的是:一种或多种相容性固体或液体填充剂或凝胶物质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。“相容性”在此指的是组合物中各组份能和本发明的化合物以及它们之间相互掺和,而不明显降低化合物的药效。药学上可以接受的载体部分例子有纤维素及其衍生物(如羧甲基纤维素钠、乙基纤维素钠、纤维素乙酸酯等)、明胶、滑石、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂(如吐温)、润湿剂(如十二烷基硫酸钠)、着色剂、调味剂、稳定剂、抗氧化剂、防腐剂、无热原水等。
[0116]
本发明化合物或药物组合物的施用方式没有特别限制,代表性的施用方式包括(但并不限于):口服、直肠、肠胃外(静脉内、肌肉内或皮下)、和局部给药。
[0117]
本发明的晶型a的治疗有效剂量的一般范围将是:约1-2000mg/天、约10-1000mg/天、约10-500mg/天、约10-250mg/天、约10-100mg/天,或约10-50mg/天。治疗有效剂量将以一个或多个剂量给予。然而,应理解,对于任何特定患者的本发明化合物的特定剂量将取决于多种因素,例如,待治疗的患者的年龄、性别、体重、一般健康状况、饮食、个体响应,给予时间、待治疗的疾病的严重性、施用的具体化合物的活性、剂型、应用模式和伴用药物。给定情况的治疗有效量能用常规实验测定,并在临床医生或医师能力和判断范围内。在任何情况中,所述化合物或组合物将基于患者的个体情况以多个剂量给予并以允许递送治疗有效量的方式给予。
[0118]
本发明的主要优点包括:
[0119]
(1)本发明的式i化合物的晶型a不含水和溶剂,具有高稳定性和低吸湿性,非常适合成药。
[0120]
(2)本发明的式i化合物的晶型a在分装等药品制造过程中,不易扬起,易收集,不易造成浪费,且有助于保护操作人员的身体健康。
[0121]
(3)本发明的式i化合物的晶型a制备方法简单方便,适合大规模工业化生产。
[0122]
下面结合具体实施,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0123]
检测方法
[0124]
x射线衍射分析(x-ray diffraction,xrd)是利用晶体形成的x射线衍射,对物质进行内部原子在空间分布状况的结构分析方法。将具有一定波长的x射线照射到结晶性物质上时,x射线因在结晶内遇到规则排列的原子或离子而发生散射,散射的x射线在某些方向上相位得到加强,从而显示与结晶结构相对应的特有的衍射现象。
[0125]
在本发明中,xrd的测试参数如下:仪器型号:bruker d8advance;靶:cu-kα(40kv,40ma);样品到检测器距离:30cm;扫描范围:3
°
~40
°
(2theta值);扫描步径:0.1s。
[0126]
热重分析法(thermo gravimetric analysis,tga)是在程序控温条件下,测定物质的质量随温度变化的一种分析技术。热重分析法可获得样品热变化产生的热量,适用于检查晶型物质中的结晶溶剂或结晶水分子的丧失或样品升华、分解的过程和量值,也可有效区分物质是否含有结晶溶剂或结晶水成分。
[0127]
在本发明中,tga的测试参数如下:仪器型号:netzsch tg 209f3;温度范围:30~400℃;扫描速率:10k/min;吹扫气:25ml/min;保护气:15ml/min。
[0128]
差示扫描量热法(differential scanning calorimeter,dsc)是采用程序控制升温或降温,测量样品与惰性参比物(常用α-al2o3)之间的热量差随温度变化的技术。dsc检测适用于分析样品的熔融分解状态、混晶物质状态、转晶物质状态等。
[0129]
在本发明中,dsc的测试参数如下:仪器型号:perkin elmer dsc8500;氮气流速:20ml/min;温度范围:50-200℃,扫描速率:10℃/min。
[0130]
红外光谱(infra-red spectrometry,ir)是最早用于晶型物质识别与鉴定的分析方法。由于不同晶型分子共价键的电环境不一样,共价键强度也可能会有变化,共价键强度的改变必然会导致不同晶型的ir光谱的不同。
[0131]
在本发明中,ir的测试参数如下:仪器型号:nicolet 6700型傅里叶变换红外光谱仪;单点atr方法,分辨率4.0cm-1
。
[0132]
动态蒸汽吸附(dvs)测试/引湿性测试是通过快速测量设定了相对湿度(rh)的流动载气所引起的样品水分的增加和流失,样品置于自悬挂状态下的高灵敏度,高稳定性的数字微量天平上,然后,通过测量材料质量的增加/减少来检测水蒸气的吸附/解吸附,从而确定样品的吸湿性。
[0133]
在本发明中,dvs的测试参数如下:仪器型号:sms dvs intrinsic,0~95%rh,温度:25℃。
[0134]
偏光显微镜
[0135]
在本发明中,偏光显微镜仪器型号:xpv-400e。
[0136]
实施例1
[0137]
制备s-(-)-2,3-亚甲二氧基-5,8,13,13a-四氢-10,11-二甲氧基-6h-二苯并[a,
g]喹嗪晶体的晶型a:
[0138]
将15mg的s-(-)-2,3-亚甲二氧基-5,8,13,13a-四氢-10,11-二甲氧基-6h-二苯并[a,g]喹嗪溶于1ml异丙醇,于25℃条件下室温搅拌,平衡至少24h。过滤,将所得固体物料置于真空干燥箱中,真空干燥得到s-(-)-2,3-亚甲二氧基-5,8,13,13a-四氢-10,11-二甲氧基-6h-二苯并[a,g]喹嗪晶型a晶体。
[0139]
将实施例1所制得晶体的晶型a进行偏光显微镜成像、xrpd、tga、dsc、dvs、ir和raman等测试,表征结果如图1-图7。
[0140]
图1为晶型a的偏光显微镜照片,从图1中可以看出晶型a为块状晶体。
[0141]
图2为晶型a的xrpd图(峰表如表1)。
[0142]
表1晶型a的x-射线粉末衍射峰表
[0143][0144][0145]
图3为晶型a的tga图。从图3中可以看出晶型a在化合物分解前无失重现象,表明晶型a不含水或其他溶剂。
[0146]
图4为晶型a的差示扫描量热分析(dsc)图。从图4中可以看出晶型a对应的dsc显示在oneset为约170.3℃,熔融峰值温度为172.5℃。
[0147]
图5为晶型a的动态蒸汽吸附(dvs)图。从图5中可以看出晶型a在0-95%相对湿度的范围内,吸湿性变化很小,约为0.6%,重量变化小,说明晶型a具有低吸湿性。
[0148]
图6为晶型a的红外光谱(ir)图。从图6中可以看出晶型a在3599
±
2cm-1
、3001
±
2cm-1
、2934
±
2cm-1
、2835
±
2cm-1
、2789
±
2cm-1
、1611
±
2cm-1
、1520
±
2cm-1
、1485
±
2cm-1
、1452
±
2cm-1
、1348
±
2cm-1
、1248
±
2cm-1
、1217
±
2cm-1
、1107
±
2cm-1
、1030
±
2cm-1
、995
±
2cm-1
、926
±
2cm-1
、856
±
2cm-1
处有特征吸收峰。
[0149]
实施例2
[0150]
制备s-(-)-2,3-亚甲二氧基-5,8,13,13a-四氢-10,11-二甲氧基-6h-二苯并[a,g]喹嗪晶体的晶型a:
[0151]
将215mg的s-(-)-2,3-亚甲二氧基-5,8,13,13a-四氢-10,11-二甲氧基-6h-二苯并[a,g]喹嗪溶于1ml正己烷中,于25℃条件下室温搅拌,平衡至少24h。过滤,将所得固体物料置于真空干燥箱中,真空干燥得到s-(-)-2,3-亚甲二氧基-5,8,13,13a-四氢-10,11-二甲氧基-6h-二苯并[a,g]喹嗪晶型a晶体。
[0152]
所得产物的xrpd结果基本同实施例1。
[0153]
对比例1
[0154]
制备s-(-)-2,3-亚甲二氧基-5,8,13,13a-四氢-10,11-二甲氧基-6h-二苯并[a,g]喹嗪晶体的晶型b:
[0155]
将15mg的s-(-)-2,3-亚甲二氧基-5,8,13,13a-四氢-10,11-二甲氧基-6h-二苯并[a,g]喹嗪溶于1ml甲醇中,于25℃条件下室温搅拌,平衡至少24h。过滤,将所得固体物料置于真空干燥箱中,真空干燥得到晶型b。
[0156]
所得产物的xrpd结果见图7。
[0157]
对比例2
[0158]
制备s-(-)-2,3-亚甲二氧基-5,8,13,13a-四氢-10,11-二甲氧基-6h-二苯并[a,g]喹嗪晶体的晶型c:
[0159]
取约3mg s-(-)-2,3-亚甲二氧基-5,8,13,13a-四氢-10,11-二甲氧基-6h-二苯并[a,g]喹嗪溶解在200μl乙醇和100μl正己烷中,混匀,溶解,在25℃缓慢挥发至干,得晶型c。
[0160]
所得产物的xrpd结果见图8。
[0161]
对比例3
[0162]
制备s-(-)-2,3-亚甲二氧基-5,8,13,13a-四氢-10,11-二甲氧基-6h-二苯并[a,g]喹嗪晶体的晶型d:
[0163]
取约3mg s-(-)-2,3-亚甲二氧基-5,8,13,13a-四氢-10,11-二甲氧基-6h-二苯并[a,g]喹嗪溶解在200μl异丙醇和600μl氯仿中,混匀,溶解,在25℃缓慢挥发至干,得晶型d。
[0164]
所得产物的xrpd结果见图9。
[0165]
晶型之间的转变实验
[0166]
forma、form b、form c、form d四种晶型做相互转变实验。实验条件及结果如下:
[0167]
表2晶型稳定性比较
[0168]
起始样品加热温度(℃)加热时间(min)产物晶型forma12040formaformb12040formaformc12040formaformd12040forma
[0169]
每种样品取5mg,在25℃条件下与1ml溶剂搅拌。实验条件及结果如下:
[0170]
表3晶型稳定性比较(混悬平衡)
[0171]
起始样品混合物混悬溶剂组成混悬时间(天)产物晶型forma formb异丙醇2formaforma formc异丙醇2formaforma formd异丙醇2formaformb formc异丙醇2forma
formb formd异丙醇2formaformc formd异丙醇2forma
[0172]
由此晶型转变结果可以得知,forma为最稳定的晶型。
[0173]
引湿性考察
[0174]
采用动态水吸附仪(dvs),在25℃的温度下,在0~95%相对湿度考察样品对水份的吸附与解吸情况,以确定不同晶型的引湿性能。实验结果如下:
[0175]
表4晶型引湿性比较
[0176][0177][0178]
药物组合物制备以及稳定性研究
[0179]
1、药物组合物处方:
[0180]
成分用量原料药(晶型a/b/c/d)1份蔗糖24份乳糖24份交联聚维酮(cl-m)0.3份聚维酮k300.3份
[0181]
2、制备工艺:
[0182]
①
按照处方称取聚维酮k30,溶于80%乙醇中制得粘合剂。
[0183]
②
将原料药(晶型a/b/c/d)与辅料蔗糖/乳糖/交联聚维酮(cl-m)混合均匀,加粘合剂制软材。
[0184]
③
20目筛制粒。
[0185]
④
50℃干燥,水分控制小于2.0%。
[0186]
⑤
20目筛整粒,80目筛除去细粉。
[0187]
⑥
收集颗粒。
[0188]
⑦
内包装。
[0189]
3、稳定性研究数据:
[0190]
按照上述工艺制备4批中试规模样品,分别为样品a、样品b、样品c和样品d。按照《中国药典》2015年版二部附录xixc原料药与药物制剂稳定性试验指导原则,对按照以上4
批样品进行加速稳定性试验考察。
[0191]
加速稳定性试验的条件:对上述样品分别按照聚酯/铝/聚乙烯药品包装用复合膜进行包装,在温度40℃、相对湿度75%的条件下放置6个月,在试验期间第0、1、3、6个月各取样1次,按稳定性考察项目检查。
[0192]
表5加速试验考察结果
[0193][0194]
结果显示,晶型a所制颗粒剂稳定性优于其它晶型所制颗粒剂,溶出度也明显高于其它晶型所制颗粒剂,且颗粒剂有关物质变化a晶型远小于其它晶型。
[0195]
可见,本发明所述的晶型a不含水或溶剂,为柱状晶体,具有很好的物理稳定性,且晶型a在0-95%相对湿度下具有很低的吸湿性,非常适合用于加工成药。且本发明的晶型a在分装等药品制造过程中,不易扬起,易收集,不易造成浪费,且有助于保护操作人员的身体健康。
[0196]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。