基于基因多拷贝筛选高表达fad-gdh重组毕赤酵母菌株的方法
技术领域
1.本发明涉及酵母菌筛选技术领域,更具体的说是涉及一种基于基因多拷贝筛选高表达fad-gdh重组毕赤酵母菌株的方法。
背景技术:
2.fad依赖的葡萄糖脱氢酶(fad-dependent glucose dehydrogenase,简称fad-gdh,ec 1.1.99.10),与葡萄糖氧化酶(glucose oxidase,简称god)、吡喃糖脱氢酶、胆碱脱氢酶和甲醇氧化酶同属于gmc氧化还原酶(glucose-methanol-choline-oxidoreductase)家族。它是以fad为辅基能够在nad(p) 等存在的情况下催化β-d-葡萄糖生成d-葡萄糖酸-δ-内酯,而d-葡萄糖酸-δ-内酯会自发形成葡萄糖酸。
3.在目前使用的血糖检测用酶中,葡萄糖氧化酶(god)因其能利用氧作为电子受体,样品中氧分压的改变会使检测结果产生误差,而gdh不利用氧作为电子受体,不会产生此种偏差,适用于检测包括静脉血、动脉血、高海拔等氧气含量不同的样本,近年来成为便携式血糖监测系统的研究热点。
4.外源基因拷贝数(基因剂量)的多少对外源重组蛋白的表达有着显著的影响,外源基因利用单交换整合至毕赤酵母中往往易产生多拷贝菌株,许多报道表明单拷贝的外源基因往往导致较低的外源重组蛋白产量,而随着拷贝数的增加可以有效提高外源目的蛋白的表达,通常在一定基因剂量范围内,基因剂量与外源目的蛋白的产量成正比关系。例如,sunga等人报道在pfld1启动子控制下,β-半乳糖甘酶基因拷贝数增加到22时,其酶活比单拷贝提高了17倍;vassileva等采用paox1表达载体构建了毕赤酵母重组菌株,外源乙肝疫苗基因剂量为1至8个拷贝,实验结果发现乙肝疫苗表达水平与基因拷贝数呈正线性相关,然后通过nonhem分析发现乙肝疫苗mrna表达水平与基因拷贝数成正线性相关;zhu等人采用体内构建法构建了猪胰岛素前体基因的重组毕赤酵母菌株,结果发现基因剂量与目的蛋白产量呈现钟形的相关曲线关系,在拷贝数为12个拷贝时达到最高产量180mg/l。
5.因此,提供一种能实现fad-gdh的高效表达方法是本领域技术人员亟需解决的问题。
技术实现要素:
6.有鉴于此,本发明提供了一种基于基因多拷贝筛选高表达fad-gdh重组毕赤酵母菌株的方法,通过同尾酶法构建fad-gdh基因的多拷贝表达盒载体,并转入毕赤酵母x33后筛选优质的重组表达菌株,研究不同拷贝数对酶活表达的影响,筛选得到含高拷贝目的基因并具高表达水平的重组毕赤酵母菌株。
7.为实现上述目的,本发明提供如下技术方案:基于基因多拷贝筛选高表达fad-gdh重组毕赤酵母菌株的方法,包含如下步骤:
8.步骤一:构建重组质粒ppiczαa-gdh,将质粒puc57-gdh和质粒ppiczαa分别进行
ecor i和not i双酶切,酶切产物分别用1%琼脂糖凝胶电泳分离,切胶回收,得到有相同粘性末端的目的基因gdh和载体;用t4连接酶连接回收产物,连接后的产物转化入大肠杆菌top10感受态,对鉴定出的阳性克隆提取质粒进行酶切、测序,比对分析重组质粒构建成功;
9.步骤二:构建多拷贝重组表达载体,利用ppiczαa含有的两个同尾酶bg lii和bam h i酶切位点,构建基因多拷贝重组质粒;
10.步骤三:不同基因拷贝数阳性转化子的获得及重组蛋白的诱导表达,将构建成功的不同拷贝数重组载体质粒进行bamh i线性化后分别电转表达宿主pichiapastoris x33感受态,构建重组菌株;
11.步骤四:发酵罐放大表达fad-gdh,选择一株单拷贝菌株和一株四拷贝菌株进行发酵罐扩大培养,挑单克隆接种于ypd培养基培养10h,按3%接种量转接于100ml bmgy培养基至od
600
≈6-8接种于发酵罐。
12.优选的,在上述一种基于基因多拷贝筛选高表达fad-gdh重组毕赤酵母菌株的方法中,所述步骤一中,fad-gdh基因序列有bg l ii酶切位点,不利于后期同尾酶法构建基因多拷贝菌株,设计引物将1404位点由a突变为g,引物序列为a-g:fatcagaaggtctttcgagtcttaccctttg;a-g:rgaaagaccttctgatgtacttagcaacagca,用q5连接酶进行pcr扩增,程序为:98℃,5min;98℃,30s,退火温度分别设为58℃、60℃、62℃,60s,72℃,延伸10min,20个循环;72℃,延伸20min;16℃,保存;模板采用所述ppiczαa-gdh质粒;pcr结果用dpnⅰ酶消解,热激转化top10感受态,分别涂布于lb zeocin平板上,37℃过夜培养;分别挑取单菌落于lb液体培养基中培养,提取质粒,进行bg l ii和bam h i双酶切验证,酶切正确的送测序进一步验证,重组质粒ppiczαa-gdh构建成功。
13.优选的,在上述一种基于基因多拷贝筛选高表达fad-gdh重组毕赤酵母菌株的方法中,所述步骤二的具体操作如下:质粒ppiczαa-gdh分别进行bg l ii和bam h i双酶切和bam h i单酶切,然后分别将酶切产物切胶回收,将表达框片段和线性化的重组表达载体片段用t4 dna连接酶连接,将连接产物转化至大肠杆菌感受态top10中,筛选阳性克隆子后进行试剂盒提质粒,即得到fad依赖的葡萄糖脱氢酶两拷贝重组表达载体ppiczαa-2gdh;将两拷贝重组表达载体ppiczαa-2gdh分别进行bg lii和bam h i双酶切和bam h i单酶切,然后分别将酶切产物切胶回收,将表达框片段和线性化的重组表达载体片段用t4 dna连接酶连接,将连接产物转化至大肠杆菌感受态中,筛选阳性克隆子,即得到4拷贝的重组表达载体ppiczαa-4gdh;两拷贝载体单切线性化与单拷贝的表达框连接得到3拷贝的重组表达载体ppiczαa-3gdh,同理,得到多拷贝重组表达载体。
14.优选的,在上述一种基于基因多拷贝筛选高表达fad-gdh重组毕赤酵母菌株的方法中,所述步骤三中,电转条件:2kv,4-5ms,快速加入1ml预冷的ypds液体培养基,电转的感受态细胞置于30℃培养箱静置培养2-6h,4000rpm离心5min,弃上清,用1ml生理盐水洗3次,然后将菌液涂布在添加博来霉素zeocin的ypd平板上,在30℃下培养72h,从而获得转化子;将重组菌株挑取单菌落接种于5ml添加zeocin的ypcs试管培养基中,14-18h后加1%(v/v)甲醇,之后24h和48h后均各加1%(v/v)甲醇诱导,72h收菌,8000r/min离心5分钟收集上清,上清液利用dcip的方法测定fad依赖葡萄糖脱氢酶的活力,并以此来筛选高酶活菌株。
15.优选的,在上述一种基于基因多拷贝筛选高表达fad-gdh重组毕赤酵母菌株的方法中,所述dcip反应体系包括终浓度50mm乙酸钠缓冲液,ph5.5,300μm dcip和100mm葡萄
糖。具体如下:
16.(1)、反应体系3.1ml:底物葡萄糖2.9ml、9
×
10-3mol/l dcip100μl、酶液100μl;
17.(2)、检测520nm处吸光值的变化(吸光值下降);
18.(3)、计算公式:酶活(u/ml)=
△a×
3.1
×
稀释倍数d/6.9
×
0.1
×
3min。
19.优选的,在上述一种基于基因多拷贝筛选高表达fad-gdh重组毕赤酵母菌株的方法中,所述步骤四中,具体发酵方法如下:
20.(1)、菌株培养阶段:发酵培养基接种前先加入28%氨水使培养基的ph达到5.0(氨水同时也作为菌株生长的氮源),再按每升培养基加入4.37ml ptm1,以10%的接量接种种子液;30℃通气搅拌培养18-24h;在培养过程中随着菌株的生长,培养基中的溶氧量将由100%逐渐降低,当碳源消耗完后溶氧量将再度升高至50—70%以上;
21.(2)、碳源饲喂阶段:流加50%甘油(包含12ml/l ptm1),流加量为12ml/h/l,培养4h,此时培养基中的溶氧量为0;
22.(3)、饥饿饲喂阶段:至od
600
≈180,停止流加甘油,当碳源消耗完后溶氧量将再度升高至50—70%以上;
23.(4)、诱导表达阶段:流加甲醇(含12ml/l ptm1),使甲醇终浓度维持在0.3%,溶氧量始终为0,ph维持在6.0,在诱导过程中每隔24h加维生素c水溶液(终浓度80μg/l),甲醇诱导72h后一次性外源添加维生素b2(终浓度0.5mm),每隔12h取样一次检测od
600
,每隔12h测定表达的fad依赖的葡萄糖脱氢酶的活性。
24.经由上述的技术方案可知,与现有技术相比,本发明结果可知,单拷贝菌株诱导108h酶活达到最高697.125u/ml,四拷贝菌株诱导132h酶活达到最高1063.279u/ml,比单拷贝酶活提高52.52%;甲醇诱导前60h二者酶活差异不大,60h以后四拷贝菌株酶活一直比单拷贝菌株高;四拷贝菌株在诱导72h后酶活617.3u/ml,是原试管水平发酵72h(57.027)时的10.82倍,表明了通过增加目的基因拷贝数策略有助于提高fad-gdh的表达量。
附图说明
25.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
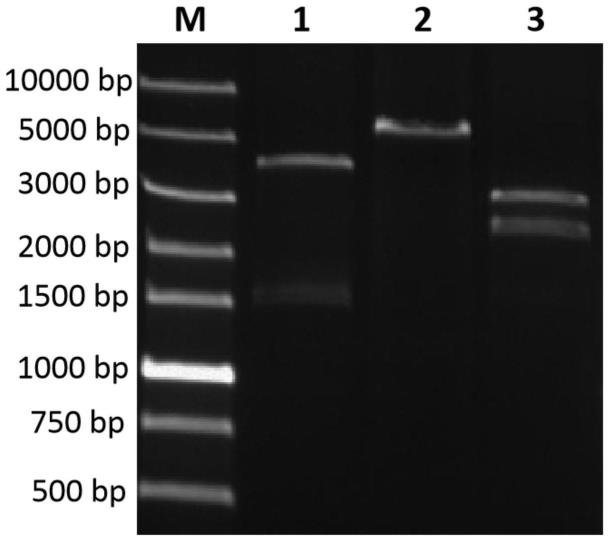
26.图1附图为重组质粒ppiczαa-gdh酶切验证结果(m:marker;1:ecor i和not i双酶切;2:bam h i单酶切3:bg l ii和bam h i双酶切)。
27.图2附图为测序比对结果。
28.图3附图为二拷贝载体构建示意图。
29.图4附图为拷贝bglii和bam h i双酶切结果。
30.图5附图为试管水平不同基因拷贝数重组菌株酶活比较。
31.图6附图为10l发酵罐上清液酶活比较。
具体实施方式
32.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完
整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
33.请参阅附图1-6,为本发明公开的具体实施例,具体实验过程包括:
34.1、重组质粒ppiczαa-gdh的构建
35.将本实验保藏的质粒puc57-gdh和购买的质粒ppiczαa分别进行ecor i和not i双酶切,酶切产物分别用1%琼脂糖凝胶电泳分离,切胶回收,得到有相同粘性末端的目的基因gdh和载体;用t4连接酶连接回收产物,连接后的产物转化入大肠杆菌top10感受态,对鉴定出的阳性克隆提取质粒进行酶切、测序,比对分析重组质粒构建成功。
36.由于fad-gdh基因序列有bg l ii酶切位点,不利于后期同尾酶法构建基因多拷贝菌株,所以需要设计引物将1404位点由a突变为g。引物序列为a-g:f atcagaaggtctttcgagtcttaccctttg;a-g:r gaaagaccttctgatgtacttagcaacagca。
37.用q5连接酶进行pcr扩增,程序为:98℃,5min;98℃,30s,退火温度分别设为58℃、60℃、62℃,60s,72℃,延伸10min,20个循环;72℃,延伸20min;16℃,保存。模板用之前构建的ppiczαa-gdh质粒。pcr结果用dpnⅰ酶消解,热激转化top10感受态,分别涂布于lb zeocin平板上,37℃过夜培养。分别挑取单菌落于lb液体培养基中培养,提取质粒,进行bg l ii和bam h i双酶切验证,酶切正确的送测序进一步验证,重组质粒ppiczαa-gdh构建成功。
38.2、多拷贝重组表达载体的构建
39.利用p piczαa含有的两个同尾酶bg l ii和bam h i酶切位点,构建基因多拷贝重组质粒。具体如下:质粒ppiczαa-gdh分别进行bg l ii和bam h i双酶切和bam h i单酶切,然后分别将酶切产物切胶回收,将表达框片段和线性化的重组表达载体片段用t4 dna连接酶连接,如图3所示,将连接产物转化至大肠杆菌感受态top10中,筛选阳性克隆子后进行试剂盒提质粒,即得到fad依赖的葡萄糖脱氢酶两拷贝重组表达载体ppiczαa-2gdh。将两拷贝重组表达载体ppiczαa-2gdh分别进行bg lii和bam h i双酶切和bam h i单酶切,然后分别将酶切产物切胶回收,将表达框片段和线性化的重组表达载体片段用t4 dna连接酶连接,将连接产物转化至大肠杆菌感受态中,筛选阳性克隆子,即得到4拷贝的重组表达载体ppiczαa-4gdh。两拷贝载体单切线性化与单拷贝的表达框连接得到3拷贝的重组表达载体ppiczαa-3gdh。同理,可以得到多拷贝重组表达载体。1-4拷贝bgl ii和bam h i双酶切结果如图4所示。
40.3、不同基因拷贝数阳性转化子的获得及重组蛋白的诱导表达
41.将构建成功的不同拷贝数重组载体质粒进行bamh i线性化后分别电转表达宿主pichiapastoris x33感受态,构建重组菌株,电转条件:2kv,4-5ms,快速加入1ml预冷的ypds液体培养基,电转的感受态细胞置于30℃培养箱静置培养2-6h,4000rpm离心5min,弃上清,用1ml生理盐水洗3次,然后将菌液涂布在添加博来霉素zeocin的ypd平板上,在30℃下培养72h,从而获得转化子。将重组菌株挑取单菌落接种于5ml添加zeocin的ypcs试管培养基中,14-18h后加1%(v/v)甲醇,之后24h和48h后均各加1%(v/v)甲醇诱导,72h收菌,8000r/min离心5分钟收集上清,上清液利用dcip的方法测定fad依赖葡萄糖脱氢酶的活力,并以此来筛选高酶活菌株。
42.具体方法如下:dcip反应体系包括终浓度50mm乙酸钠缓冲液,ph 5.5,300μm dcip
和100mm葡萄糖。具体如下:
43.(1)、反应体系3.1ml:底物葡萄糖2.9ml、9
×
10-3mol/l dcip 100μl、酶液100μl;
44.(2)、检测520nm处吸光值的变化(吸光值下降);
45.(3)、计算公式:
46.酶活(u/ml)=
△a×
3.1
×
稀释倍数d/6.9
×
0.1
×
3min。
47.4、10l发酵罐放大表达fad-gdh
48.选择一株单拷贝菌株和一株四拷贝菌株进行10l罐扩大培养,挑单克隆接种于ypd培养基培养10h,按3%接种量转接于100ml bmgy培养基至od
600
≈6-8接种于发酵罐。
49.具体发酵方法如下:
50.(1)、菌株培养阶段:发酵培养基接种前先加入28%氨水使培养基的ph达到5.0(氨水同时也作为菌株生长的氮源),再按每升培养基加入4.37ml ptm1,以10%的接量接种种子液。30℃通气搅拌培养18-24h。在培养过程中随着菌株的生长,培养基中的溶氧量将由100%逐渐降低,当碳源消耗完后溶氧量将再度升高至50—70%以上。
51.(2)、碳源饲喂阶段:流加50%甘油(包含12ml/l ptm1)。流加量为12ml/h/l。培养4h。此时培养基中的溶氧量为0。
52.(3)、饥饿饲喂阶段:至od
600
≈180,停止流加甘油,当碳源消耗完后溶氧量将再度升高至50—70%以上。
53.(4)、诱导表达阶段:流加甲醇(含12ml/l ptm 1),使甲醇终浓度维持在0.3%,溶氧量始终为0。ph维持在6.0,在诱导过程中每隔24h加维生素c水溶液(终浓度80μg/l),甲醇诱导72h后一次性外源添加维生素b2(终浓度0.5mm),每隔12h取样一次检测od
600
,每隔12h测定表达的fad依赖的葡萄糖脱氢酶的活性。
54.结果表明,单拷贝菌株诱导108h酶活达到最高697.125u/ml,四拷贝菌株诱导132h酶活达到最高1063.279u/ml,比单拷贝酶活提高52.52%。从图6可以看出,甲醇诱导前60h二者酶活差异不大,60h以后四拷贝菌株酶活一直比单拷贝菌株高。四拷贝菌株在诱导72h后酶活617.3u/ml,是原试管水平发酵72h(57.027)时的10.82倍。
55.本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。对于实施例公开的装置而言,由于其与实施例公开的方法相对应,所以描述的比较简单,相关之处参见方法部分说明即可。
56.对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
