检测微卫星mono27位点稳定性的引物对、试剂盒及方法
技术领域
1.本发明属于生物技术领域。具体地涉及一种检测微卫星mono27位点稳定性的引物对、试剂盒及方法。
背景技术:
2.结直肠癌(colorectal cancer,crc)是最常见的恶性肿瘤之一,在世界范围内的恶性肿瘤疾病当中,其发病率高居第3位,死亡率在恶性肿瘤行列高居第2位,在消化道恶性肿瘤中占全球发病和死亡首位,严重威胁着人类的健康与生存。近年来随着中国民众生活方式及饮食结构的变化,它已成为我国消化系统发病率第二,患病率第一位的恶性肿瘤。微卫星不稳定性(microsatellite instability,msi)是结直肠癌发病的重要原因,在预测肠癌患者预后及化疗反应方面也有重要作用,同时对lynch综合征的诊断具有重要意义。
3.近年来,msi的相关临床和基础方面研究取得较好的进展,对msi与crc的关系取得深入认识。2016年,美国国家癌症综合治疗联盟(nccn)在《结直肠癌临床实践指南》(2016.v2)指出,lynch综合征应行msi或错配修复(mismatch repair,mmr)检测:1)70岁及以下诊断结直肠癌患者以及符合bethesda指南的大于70岁患者均应行lynch综合征肿瘤检测;2)所有ⅱ期患者均应行msi或mmr检测,因为msi-h的ⅱ期患者预后较好,且不会从5-氟尿嘧啶单药辅助治疗获益。对于具有msi-h特征的ⅱ期结肠癌,组织分化差不再认为是高危因素。此外,nccn指南指出,对局部晚期、复发性或转移性的胃癌患者,考虑pd-1抑制剂治疗前,需行msi或mmr检测。fda已批准抗pd-1药pembrolizumab,用于不可切除或转移性msi-h或dmmr的实体肿瘤的二线或后续治疗选择。mono27是结直肠癌微卫星不稳定性检测的重要位点之一,当发生不稳定时单核苷酸重复数会出现改变。
4.目前,检测微卫星不稳定性的方法包括:mmr蛋白免疫组化法、dna测序、片段分析法、高效液相色谱技术、高分辨率熔解曲线(high-resolution melt,hrm)法等。片段分析法是目前公认的金标准方法;但该方法成本较高,检测时间较长,并且必须在价格昂贵的测序仪上进行分析,大部分实验室无法开展检测(v deschoolmeester et al.,detection of microsatellite instability in colorectal cancer using an alternative multiplex assay of quasi-monomorphic mononucleotide markers,j mol diagn,2008,10(2):154-9)。hrm法是基于核酸的物理性质进行分析,只需在常规pcr基础上增加一些饱和染料,熔解曲线的形状取决于gc含量、片段长度和产物序列,通过熔解曲线的差异即可分辨;样品经pcr扩增后直接进行hrm分析,pcr产物无需再转入其它分析装置,而直接在同一个pcr管内进行分析,实现闭管操作,具有快速、低成本、灵敏性高等优点,同时只需在荧光定量pcr仪上即可进行分析。然而,hrm法对引物设计的要求很高:引物既要有很好的特异性,又要求其扩增出的片段足够短,才能获得较好的检测灵敏度。基于此,hrm法还未成功应用于mono27位点稳定性的检测。
技术实现要素:
5.基于此,本发明的主要目的是提供一种检测微卫星mono27位点稳定性的引物对、试剂盒及方法。采用本发明的引物对卫星mono27位点稳定性进行检测,灵敏度高,特异性好。
6.本发明上述目的通过以下技术方案实现:
7.一种检测微卫星mono27位点稳定性的引物对,所述引物对具有如seq id no:1所示的碱基序列以及如seq id no:2所示的碱基序列。
8.一种检测微卫星mono27位点稳定性的试剂盒,所述试剂盒包括具有如seq id no:1以及seq id no:2所示的碱基序列的引物对。
9.在其中一个实施例中,所述试剂盒还包括扩增缓冲液、dntp、dna聚合酶、饱和荧光染料和水中的至少一种。
10.在其中一个实施例中,所述dna聚合酶为taq酶。
11.在其中一个实施例中,所述饱和荧光染料为eva green。
12.一种基于高分辨率熔解曲线检测微卫星mono27位点稳定性的方法,所述方法包括以下步骤:
13.分别以待检测样品和对照品的dna作为模板,采用如seq id no:1和seq id no:2所示碱基序列的引物对进行pcr反应,收集荧光信号,绘制熔解曲线;
14.进行高分辨率熔解曲线分析,通过对待检测样品的高分辨率熔解曲线与对照品的高分辨率熔解曲线的比较,鉴定待检测样品微卫星mono27位点稳定性。
15.在其中一个实施例中,所述pcr反应的体系包括:
[0016][0017][0018]
在其中一个实施例中,所述pcr反应的程序为:93℃~97℃、9min~11min;93℃~97℃、18s~22s,56℃~58℃、18s~22s,71℃~73℃、18s~22s,38个循环~42个循环;熔解温度为71℃~80℃;38~42℃、8s~12s。
[0019]
在其中一个实施例中,所述荧光信号的频率为11次/℃~13次/℃。
[0020]
在其中一个实施例中,所述荧光信号的频率为12次/℃。
[0021]
在其中一个实施例中,所述模板的浓度为50ng/μl~100ng/μl。
[0022]
在其中一个实施例中,所述模板的浓度为75ng/μl
[0023]
本发明具有以下有益效果:
[0024]
本发明的引物对检测灵敏度以及特异性都较高,采用本发明的引物进行hrm法检测微卫星mono27位点稳定性时,灵敏度高(例如可达到92.74%),特异性好(例如可达92.54%),能够满足临床需求。并且,采用本发明的引物进行hrm法检测微卫星mono27位点稳定性时,对设备的要求也大大降低,无需使用基因分析仪,只需一台带有hrm功能的荧光定量pcr仪即可。另外,同时,采用本发明的引物进行hrm法检测微卫星mono27位点稳定性时,操作程序大大简化,每检测一个样本所需的时间相较金标准方法缩短了约1小时,且成本降低了80%。因此,该方法在检测微卫星mono27位点稳定性中的应用前景良好。整体上,本发明提供了一种准确、快速且廉价的检测mono27位点稳定性的方法。
附图说明
[0025]
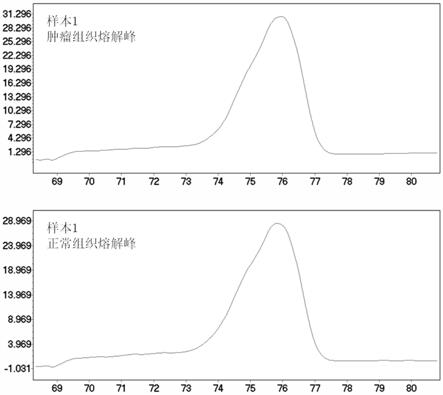
图1是引物对1对样品1的荧光定量pcr检测熔解曲线。
[0026]
图2是引物对1对样品2的荧光定量pcr检测熔解曲线。
[0027]
图3是引物对2对样品2的荧光定量pcr检测熔解曲线。
[0028]
图4是引物对3对样品2的荧光定量pcr检测熔解曲线。
[0029]
图5是引物对4对样品2的荧光定量pcr扩增曲线。
具体实施方式
[0030]
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用化学试剂,均为市售产品。
[0031]
除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。本发明所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
[0032]
本发明实施例提供一种检测微卫星mono27位点稳定性的引物对,所述引物对具有如seq id no:1所示的碱基序列以及如seq id no:2所示的碱基序列。
[0033]
本发明实施例还提供一种检测微卫星mono27位点稳定性的试剂盒,所述试剂盒包括具有如seq id no:1以及seq id no:2所示的碱基序列的引物对。
[0034]
优选地,所述试剂盒还包括扩增缓冲液、dntp、dna聚合酶、饱和荧光染料和水中的至少一种。
[0035]
优选地,所述dna聚合酶为taq酶。
[0036]
优选地,所述荧光染料为eva green。
[0037]
本发明实施例还提供一种基于高分辨率熔解曲线检测微卫星mono27位点稳定性
no:1和seq id no:2所示。
[0052]
上游引物(seq id no:1):5
’-
tgggagacagagcaagac-3’;
[0053]
下游引物(seq id no:2):5
’-
ttaagggtggatcaaatt-3’。
[0054]
2、反应体系
[0055]
利用上述引物对,使用blend taq plus酶(toyobo,cat no.btq-201)配制如表1所示的荧光定量pcr反应体系:
[0056]
表1、荧光定量pcr反应体系
[0057]
名称用量范围(μl)具体用量(μl)10
×
buffer2μl-2.5μl2.5μldntp2μl-2.5μl2.5μl模板1μl~5μl1μl饱和荧光染料(eva green)1μl-1.25μl1.25μl上游引物1μl-1.25μl1.25μl下游引物1μl-1.25μl1.25μltaq酶0.2μl-0.25μl0.25μl无酶水15μl-17μl加水至25μl
[0058]
3、检测方法
[0059]
(1)样品来源及基因组dna提取:所有结直肠癌患者肿瘤样品及正常样品均来自中山大学附属第六医院病理科,收集组织,使用石蜡样品提取试剂盒对基因组dna进行提取。将结直肠癌患者肿瘤组织和正常组织的dna均调整至75ng/μl,在上述反应体系中分别加入1μldna,涡旋混匀后,使用罗氏lightcycler 480荧光定量pcr仪,按照以下程序进行荧光定量pcr反应,以频率为12次/℃收集荧光信号,绘制熔解曲线;
[0060]
荧光定量pcr反应的程序为:95℃10min;95℃20s、58℃20s、72℃20s,40cycles;熔解温度71-80℃,40℃10s。
[0061]
(2)比较结直肠癌患者肿瘤组织和正常组织的熔解曲线,按照以下方法判断结直肠癌患者是否为微卫星mono27位点稳定型患者:
[0062]
若结直肠癌患者肿瘤组织的熔解曲线显示出两个及以上的熔解峰,而正常组织的熔解曲线仅显示出一个熔解峰,则判断两者的峰型不一致,表示结直肠癌患者为微卫星mono27位点不稳定型患者;反之,则表示结直肠癌患者为微卫星mono27位点稳定型患者。
[0063]
实施例2、检测微卫星mono27位点稳定性的试剂盒的构建
[0064]
本实施例提供一种检测微卫星mono27位点稳定性的试剂盒,包括以下组分:核苷酸序列如seq id no:1和seq id no:2所示的上游引物和下游引物、eva green、buffer、dntp和taq酶。
[0065]
上游引物(seq id no:1):5
’-
tgggagacagagcaagac-3’;
[0066]
下游引物(seq id no:2):5
’-
ttaagggtggatcaaatt-3’。
[0067]
试验例1、利用不同引物对检测微卫星mono27位点稳定性的结果对比
[0068]
1、实验方法
[0069]
本试验例利用实施例1构建得到的检测微卫星mono27位点稳定性的方法,摸索了5组引物对(表2)对检测结直肠癌患者肿瘤微卫星mono27位点稳定性的实验结果的影响,并
对本发明方法(hrm分析)的结果和现有片段分析法商品化试剂盒(北京阅微基因技术有限公司msi检测试剂盒)的结果进行比较,商品化试剂盒的工作步骤参照产品说明书。本试验例的样本1和样本2均来自中山大学附属第六医院病理科。
[0070]
2、实验结果
[0071]
5组引物对及其峰型、判读结果的比较如表2所示,引物对1对样品1的荧光定量pcr检测熔解曲线如图1所示,引物对1对样品2的荧光定量pcr检测熔解曲线如图2所示,引物对2对样品2的荧光定量pcr检测熔解曲线如图3所示,引物对3对样品2的荧光定量pcr检测熔解曲线如图4所示,引物对4对样品2的荧光定量pcr扩增曲线如图5所示,从表2和图1~5可以看出,样品2使用商品化试剂盒检测判读为微卫星mono27位点不稳定型;而使用上述4组引物对、利用实施例1构建得到的检测微卫星mono27位点稳定性的方法进行检测,发现只有引物对1(核苷酸序列如seq id no:1和seq id no:2所示)可以准确判读样品2的微卫星mono27位点不稳定型,其余3对引物(引物对2-4)均无法准确判读。因此,以引物对1作为检测微卫星mono27位点稳定性的引物对。
[0072]
表2、4组引物对及其扩增产物的hrm峰型、判读结果的比较
[0073][0074][0075]
注:样品扩增ct值以18~25为佳,若样品扩增ct值不在该范围内,则判读为该次荧光定量pcr反应扩增效果不好或无法扩增,最后有可能会影响扩增产物的量和后续的hrm分
析。
[0076]
试验例2、本发明方法与现有片段分析法商品化试剂盒的检出率、检测时间和成本比较
[0077]
1、实验方法
[0078]
191对(即肿瘤组织及其对应正常组织,编号1~141)结直肠癌患者样品均来自于中山大学附属第六医院病理科,按照实施例1中的方法分别提取样品基因组dna,采用试验例1中得到的引物对1(核苷酸序列如seq id no:1和seq id no:2所示),利用实施例1构建得到的检测微卫星mono27位点稳定性的方法对191对样品分别进行检测。
[0079]
上游引物(seq id no:1):5
’-
tgggagacagagcaagac-3’;
[0080]
下游引物(seq id no:2):5
’-
ttaagggtggatcaaatt-3’。
[0081]
同时,利用现有片段分析法商品化试剂盒(北京阅微基因技术有限公司msi检测试剂盒)(该试剂盒工作原理是:以荧光定量pcr为基础结合毛细管电泳来检测微卫星不稳定性)对上述191对样品进行检测。
[0082]
另外,对以上2种检测方法所用的检测时间、成本进行核算和对比。
[0083]
2、实验结果
[0084]
本发明方法与现有片段分析法商品化试剂盒的检出率比较结果如表3所示,可以看出,本发明方法与现有片段分析法商品化试剂盒有191例结果一致,14例样品结果不符;本发明方法的灵敏度=115/(115 9)
×
100%=92.74%,特异性=62/(62 5)
×
100%=92.54%。
[0085]
因此,本发明方法与现有片段分析法商品化试剂盒(金标准方法)相比,特异性为92.54%,敏感度也高达92.74%,能满足临床需求。
[0086]
表3、本发明方法与现有片段分析法商品化试剂盒的检出率比较结果
[0087][0088]
本发明方法与现有片段分析法商品化试剂盒的检测时间和成本比较结果如表4所示,可以看出,利用本发明方法进行微卫星mono27位点稳定性的检测,每个样品的检测时间比现有片段分析法商品化试剂盒检测时间缩短了33.3%,同时每个样品的检测成本降低了80%。
[0089]
因此,使用本发明方法进行微卫星mono27位点稳定性的检测,可以大大节约检测时间和成本,更好的服务临床病人。
[0090]
表4、本发明方法与现有片段分析法商品化试剂盒的检测时间和成本比较结果
[0091] 本发明方法现有片段分析法商品化试剂盒检测时间2小时/样品3小时/样品实验成本10元/样品50元/样品
[0092]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0093]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。