虹鳟ccne1基因的dsrna及其应用
技术领域
1.本发明涉及生物技术领域,特别是涉及虹鳟ccne1基因的dsrna及其应用。
背景技术:
2.虹鳟(oncorhynchus mykiss)属鲑形目,鲑科,鲑亚科,大麻哈鱼属,因体侧有带状红色纹而得名。虹鳟作为我国鲑鳟鱼类的主要养殖品种,其肉质细腻、味道鲜美深受消费者喜爱,具有很高的商业价值。然而,生产中发现因性腺发育造成的产品性能下降、耐逆性降低等困扰生产养殖的不利影响。近年来,针对虹鳟性腺分化这一关键科学问题,已成为研究热点,对其关键调控分子机制的解析被探索。
3.rnai(rnainterference,rnai)技术是通过小分子双链rna特异性地降解或抑制同源mrna的表达,从而抑制特定基因表达,目前该技术在基因功能调查方面被广泛研究。因此,利用rnai技术对虹鳟基因,尤其是与减数分裂相关基因进行分子机制调控,对解析虹鳟性腺发育作用机制具有一定的指导意义。
技术实现要素:
4.本发明的目的是提供一种虹鳟ccne1基因的dsrna及其应用,为鱼类减数分裂研究提供新的基因资源。
5.为实现上述目的,本发明提供了如下方案:
6.本发明提供了一种虹鳟ccne1基因的dsrna在抑制减数分裂或制备减数分裂抑制剂中的应用,所述dsrna以干扰基因片段为模板,由体外转录合成;所述干扰基因片段的核苷酸序列如seq id no.3所示。
7.进一步地,所述dsrna通过降低包括ccne1基因、sycp1基因、mlh1基因、dmc1基因、spindlin基因和β-tubulin基因的表达量抑制虹鳟性腺减数分裂。
8.本发明还提供一种虹鳟ccne1基因的干扰基因片段或dsrna在沉默ccne1基因中的应用,其特征在于,所述dsrna作用于ccne1基因中的干扰基因片段,从而抑制ccne1基因的表达。
9.进一步地,所述dsrna以干扰基因片段为模板,由体外转录合成;所述干扰基因片段的核苷酸序列如seq id no.3所示。
10.进一步地,所述dsrna通过降低包括ccne1基因、sycp1基因、mlh1基因、dmc1基因、spindlin基因和β-tubulin基因的表达量抑制虹鳟性腺减数分裂。
11.本发明还提供一种抑制性腺减数分裂的方法,其特征在于,将虹鳟ccne1基因的dsrna注入虹鳟体内。
12.本发明公开了以下技术效果:
13.(1)本发明提供了针对虹鳟ccne1基因的dsrna片段,该片段能够高效与靶基因结合,降低ccne1基因的表达,通过该模式的建立为虹鳟减数分裂通路解析提供帮助,也为解析虹鳟性腺发育作用机制提供线索和理论指导,具有应用意义。
14.(2)本发明利用rna干扰技术在体水平敲低虹鳟ccne1基因,dsrna注射后在虹鳟性腺组织中的沉默效率达到85%以上,有效的抑制了虹鳟ccne1基因的表达。
15.(3)本发明对敲低虹鳟ccne1基因后的个体的减数分裂关键基因的表达展开调查,发现注射dsrna可以有效降低虹鳟体内其他减数分裂相关基因mrna的表达,为虹鳟减数分裂通路解析提供研究思路。
附图说明
16.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
17.图1为虹鳟ccne1基因dsrna的凝胶电泳条带,其中m所示为dl5000 dna marker,1-5泳道为虹鳟ccne1 dsrna片段;
18.图2为注射dsrna后虹鳟体内ccne1基因表达量调查结果,不同字母代表差异显著p《0.05;
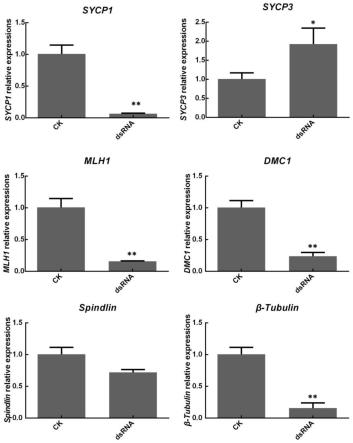
19.图3为注射dsrna后,虹鳟体内减数分裂相关基因表达量调查结果。*表示与对照组有显著性差异(p《0.05);**表示与对照组有极显著性差异(p《0.01)。
具体实施方式
20.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
21.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
22.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
23.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本技术说明书和实施例仅是示例性的。
24.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
25.本技术实施例中虹鳟幼鱼取自中国水产科学研究院黑龙江水产研究所渤海冷水性鱼类试验站(牡丹江),带水充气运回实验室,饲养在循环温控水族箱。
26.本技术实施例中所用的试剂,若无特殊说明,均可通过普通市售获得。
27.实施例1虹鳟ccne1基因片段的克隆
28.1.总rna提取
29.实验用虹鳟幼鱼(体重30
±
5g),经ms222麻醉后于冰盘上采集完整性腺组织,液氮收集样品,采用试剂盒法提取虹鳟性腺组织的总rna,具体方法参照simply p总rna提取试剂盒(bio flux)说明书。利用紫外分光光度计(analytikjena,germany)检测rna浓度和纯度。
30.2.cdna的反转录
31.对总rna进行反转录,利用反转录试剂盒primescript rt reagent kit(takara,大连)反转录得到cdna,反转录体系为:总rna 1μg,oligo dt primer 1μl,dntp mixture 1μl,rnaase-free dh2o至10μl。65℃保温5min后,冰上迅速冷却。在上述体系添加5
×
primescript
ꢀⅱ
buffer 4μl,rnase inhibitor 0.5μl,primescriptⅱrtase 1μl,加rnase free dh2o至20μl。缓慢混匀,42℃,30-60min,95℃,5min,冰上冷却。反转录之后的cdna,分装好保存于-20℃冰箱中,尽量避免反复冻融。
32.3.目的片段的扩增
33.在ncbi数据中获得虹鳟ccne1序列,其序列id为xm_021585952.1。利用primer5.0软件设计引物,获得的引物具体见表1。
34.表1
35.引物序列上游引物osccne1-f(seq id no.4)atgaccaacagaggccacgaatcga下游引物osccne1-r(seq id no.5)atgccaagcaaaggggaaaatgtgg
36.以反转录得到的cdna为模板,通过pcr扩增得到目的产物片段。pcr扩增体系为2
×
taq mix 25μl,forward primer 1.25μl,reverse primer 1.25μl,cdna 5μl,加ddh2o至50μl。反应条件为:94℃预变性2min;94℃30s,59.5℃30s,72℃30s(共30个循环);72℃延伸5min,4℃forever。
37.利用1%的琼脂糖凝胶电泳检测pcr产物,110v,30min。对目的条带进行切割回收(条带大小约为1230bp),采用gel dna extraction kitver 4.0(takara)试剂盒对条带进行回收纯化,具体操作步骤参照试剂盒说明书。
38.4.目的片段转化大肠杆菌
39.回收后的产物与pmd18-t载体连接,连接体系如下:pmd-18t载体1μl,胶回收产物4μl,solution 5μl,缓慢混匀后于16℃连接12-16h。
40.连接产物转化大肠杆菌dh5α感受态细胞,涂布于具有amp抗性的固体培养基中,晾干后倒置培养在37℃恒温培养箱内培养12-24h。挑取单菌落于具有amp抗性的液体lb培养基中37℃下摇菌12后,然后按照质粒提取试剂盒(北京天根生化科技有限公司)提取质粒,质粒送至苏州泓迅生物科技公司进行测序。
41.将测序结果通过ncbi数据库进行比对,得到虹鳟ccne1基因的序列片段如seq id no.1所示,其编码的氨基酸序列如seq id no.2所示。
42.seq id no.1:
43.atgccaagcaaaggggaaaatgtggaatccaggacaattgatcatgagatgcccaaagaaactgcagtgaggtccaagaaaagaaaatcagacgttgccgtttatttacaagacccagatgaagtggcagagatgacgaaaaat
aaccagtgtggagctttggtttgctggaatcctgagtcggttcacaccatcccgcacagccggatccccacacctgacaaagtcgatcaaccagttgctttgaatgccactgggttttctactcagtacaccttcaaaaacatatttgtcacccccaccaggtcttcccctcttcctgtgctatgctgggcaagcagagacgacgtatggaacaacctgttgaagaaagacgacacgtattctcgagacatccacgtcatgaagaaacacccacacctccaacccaagatgagggctattcttctggactggctaatggaggtgtgcgaggtgtacaagcttcacagagaaaccttctacctggctcaggattactttgatcggttcatggccacacagagcaatgttttcaagtgcacactacaactcatcggcatctcttctctgtttatagctgccaagatggaggaaatctaccctccaaaagtgcatcaatttgcctatgtaactgatggtgcctgcactgaggatgatatcctatgtatggagctaatcatcatgaaggagctgaagtggcgtttgagtcccctgacacctgtgtcctggctaaacatctacatgcaggttgcctacctgaaagagtccgaagaggttctcatcccacagtacccgcaaactacatttgtgcagattgtcgagctcctggacctctgtgtgttggatgtgaaatgtctggagttctcctacggggtgctggctgcctctgccttgttccatttctcctcgctggagctggtggagaaagtctcagctctgaagtggtctgatgttgaggagtgtgtgaggtggatggtcccctttgccatgtccatcagggaagtgggcagctcagccctgaggaccttcaaaggaatcccggcagacgacatgcacaacatccagacccatgctgcctatctggactggatggcgaaggcatgcgcctacccacaagtggatgtagatcgcagccagagttcacctataccatccggagtgctcactccgccccctagcagcgagaagccagagggcacagtctcttga。
44.seq id no.2:
45.mpskgenvesrtidhempketavrskkrksdvavylqdpdevaemtknnqcgalvcwnpesvhtiphsriptpdkvdqpvalnatgfstqytfknifvtptrssplpvlcwasrddvwnnllkkddtysrdihvmkkhphlqpkmrailldwlmevcevyklhretfylaqdyfdrfmatqsnvfkctlqligisslfiaakmeeiyppkvhqfayvtdgacteddilcmeliimkelkwrlspltpvswlniymqvaylkeseevlipqypqttfvqivelldlcvldvkclefsygvlaasalfhfsslelvekvsalkwsdveecvrwmvpfamsirevgssalrtfkgipaddmhniqthaayldwmakacaypqvdvdrsqsspipsgvltpppssekpegtvs。
46.实施例2虹鳟ccne1基因的干扰基因片段及dsrna的合成
47.以核苷酸序列如seq id no.1所示的虹鳟ccne1基因为依据,使用https://www.dkfz.de/signaling/e-rnai3/网站设计虹鳟ccne1基因的干扰基因片段引物,上、下游引物前需添加t7序列,引物信息见表2。
48.使用含有t7启动子的上游引物seq id no.6和下游引物seq id no.7通过pcr扩增得到pcr产物,序列如seq id no.3,经pcr纯化试剂盒进行纯化并回收,获得虹鳟ccne1基因的干扰基因片段。
49.表2
[0050][0051]
虹鳟ccne1基因的干扰基因片段序列如seq id no.3所示。
[0052]
seq id no.3:
[0053]
ccagtgtggagctttggtttgctggaatcctgagtcggttcacaccatcccgcacagccggatccccacacctgacaaagtcgatcaaccagttgctttgaatgccactgggttttctactcagtacaccttcaaaaacatatttgtcacccccaccaggtcttcccctcttcctgtgctatgctgggcaagcagagacgacgtatggaacaacctgttgaagaaagacgacacgtattctcgagacatccacgtcatgaagaaacacccacacctccaacccaagatgagggctattcttctggactggctaatggaggtgtgcgaggtgtacaagcttcacagagaaaccttctacctggctcaggattactttgatcggttcatggccacacagagcaatgttttcaagtgcacactacaactcatcggcatctcttctctgtttatagctgccaagatggaggaaatctaccctccaaaagtgcatcaat。
[0054]
将纯化回收得到的pcr产物为模板合成dsrna,dsrna体外转录使用megascript
tm rnai kit transcription and rnai preparation(invitrogen by thermo fisher scientific)试剂盒进行操作,具体实验步骤如下:
[0055]
(1)组装转录反应:1μg linear template dna,2μl 10
×
t7 reaction buffer,2μl atp solution,2μl ctp solution,2μl gtp solution,2μl utp solution,2μl t7 enzyme mix,加水至20μl,混匀,瞬时离心,37℃过夜孵育(12-16h),获得转录dsrna;
[0056]
(2)核酸酶消化去除dna和ssrna:取步骤(1)获得的转录dsrna 20μl,21μl nuclease-free water,5μl 10
×
digestion buffer,2μldnase i,2μl rnase,37℃下孵育1.5h;
[0057]
(3)dsrna的纯化:取步骤(2)中经过核酸酶消化去除dna和ssrna的dsrna50μl,50μl 10x binding buffer,150μl nuclease-free water,250μl无水乙醇,共500μl。混合后移至吸附柱上,离心2min;用2
×
500μl wash solution清洗,用50μl elution solution(经95℃预热)回收dsrna。
[0058]
(4)定量和存储:在1%琼脂糖凝胶电泳上检测dsrna的纯度(图1),-80℃保存备用。
[0059]
该dsrna作用于ccne1基因中的干扰基因片段,降解或抑制其mrna的表达,从而抑制ccne1基因的表达,以达到沉默ccne1基因的效果。
[0060]
实施例3虹鳟ccne1基因沉默效率检测
[0061]
1.虹鳟dsrna的注射
[0062]
采用1ml注射器将含有30μg dsrna的50μl pbs注射到虹鳟腹腔。将实验用鱼分为两组,即实验组和对照组,每组各10条鱼,试验组用1ml注射器将含有dsrna(浓度为0.6μg/μl)的pbs溶液50μl注射到虹鳟幼鱼(体质量为20g
±
1.2g)腹腔,对照组注射等体积的1
×
pbs溶液作为对照,连续注射三天,最后一次注射后的72h取性腺组织。
[0063]
2.ccne1基因表达量的变化
[0064]
提取注射后72h性腺组织总rna,反转录获得cdna,以此为模板进行荧光定量(real time pcr)检测ccne1 mrna的相对表达量,内参基因为β-actin,引物见表3。结果表明,与未注射的对照组相比,dsrna实验组在连续注射3天后,ccne1基因表达量显著降低,根据基因表达量计算沉默效率,沉默效率为85%(图2)。
[0065]
表3
[0066]
引物序列上游引物osccne-qf(seq id no.8)cctacctgaaagagtccgaaga下游引物osccne-qr(seq id no.9)cctacctgaaagagtccgaaga
osβ-actin-qf(seq id no.10)atcctgacggagcgcggttacagcosβ-actin-qr(seq id no.11)tgcccatctcctgctcaaagtcca
[0067]
实施例4ccne1基因沉默后对其他减数分裂关键基因表达量的影响
[0068]
为了调查dsrna注射后对虹鳟减数分裂的影响,比较了虹鳟体内其他减数分裂关键基因的相对表达,提取实施例3中最后一次注射dsrna后72h性腺组织的总rna,反转录获得cdna,以此为模板进行荧光定量(real time pcr)检测虹鳟体内其他减数分裂关键基因的相对表达量,内参基因为β-actin,引物见表4。
[0069]
表4
[0070]
引物序列上游引物ossycp1-qf(seq id no.12)accgaagctctcagaactcc下游引物ossycp1-qr(seq id no.13)tgttccgagctgtcagactt上游引物ossycp3-qf(seq id no.14)agccatgcaagccaagagaa下游引物ossycp3-qr(seq id no.15)gacagtggccatctcttgct上游引物osmlh1-qf(seq id no.16)taaagacccaacccaaaccc下游引物osmlh1-qr(seq id no.17)ctgctcaccacctccacaat上游引物osdmc1-qf(seq id no.18)catcagcaattccccctgga下游引物osdmc1-qr(seq id no.19)gttggattttgtggcagcca上游引物osspindlin-qf(seq id no.20)caccgtcaacacctccctcta下游引物osspindlin-qr(seq id no.21)actccacctgcttacccacaa上游引物osβ-tubulin-qf(seq id no.22)ttggatgtggtgaggaaaga下游引物osβ-tubulin-qr(seq id no.23)ataggtgggcgtggtaagtt
[0071]
结果如图3所示,联会复合体(synaptonemal complex)sycp1基因显著低于对照组,实验组表达量是对照组的0.064倍,然而该家族的sycp3的表达却高于对照组,我们推测两基因在虹鳟减数分裂过程中可能存在功能互补。mlh1(mutl homologous gene 1,mlh1)是通过组成mlh1/mlh3复合体来影响减数分裂的。本实验结果显示,注射dsrna的实验组mlh1基因表达量是对照组的0.156倍。dna减数分裂重组酶1(dna meiotic recombinase 1,dmc1)是减数分裂特有基因,是同源染色体配对和交叉重组所必须的。注射dsrna诱导了dmc1基因显著低表达,为对照组的0.233倍。同样的,spindlin和β-tubulin作为减数分裂关键调控基因,在注射dsrna组均观察到表达量降低的趋势,分别为对照组的0.718倍和0.156倍。综上结果表明,dsrna对虹鳟性腺减数分裂具有一定抑制作用。
[0072]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
