1.本发明属微生物和环境工程技术领域,具体涉及一种高效脱氮复合制剂及其应用。
背景技术:
2.我国是世界水产养殖第一大国,养殖产量占世界养殖总产量的70%。据统计,2019年我国水产养殖业产值达9700多亿元,总产量达5000多万吨。高密度集约化养殖已是我国主要的水产养殖模式,具有养殖产量高、养殖周期短和方便管理等特点。该养殖模式需要投放大量的饵料,而投放的饵料不能全部有效地被养殖动物所利用,过量的饵料与养殖动物粪便无法及时有效地被池塘中的微生物分解利用,从而导致养殖水体中亚硝态氮(no
2-‑
n)、硝态氮(no
3-‑
n)和氨态氮(nh
4 -n)等氮素超标。养殖水体中过量的氮素不仅会毒害养殖动物的健康生长,而且会严重破坏养殖环境和周围自然环境的生态平衡。氮素污染是目前水产养殖行业面临的重大共性关键问题。因此,如何高效、经济地脱除养殖废水中过量的无机氮素,具有重要的现实意义。
3.水体中含氮污染物的脱除主要有物理、化学、生物等三种方法,其中微生物脱氮技术克服了物理、化学脱氮工艺的一些缺陷,具有操作简单、适应范围广、处理效果好、基本上无二次污染等优点。因此,微生物脱氮技术已成为目前国内外应用最广泛的脱氮技术。目前,环境工程和污水、废水处理领域主要采用缺氧-好氧(anoxic-oxic,ao)脱氮、厌氧-缺氧-好氧(anaerobic-anoxic-oxic,aao)脱氮、间歇式(sequencing batch reactor,sbr)脱氮、曝气生物滤池(biological aeration filter,baf)脱氮等工艺,这些脱氮工艺普遍将硝化过程和反硝化过程分阶段进行或在不同的反应器中实现。
4.近年来,随着对脱氮微生物的深入研究,越来越多的脱氮功能微生物被分离得到,如假单胞菌属(pseudomonas)、产碱杆菌属(alcaligenes)、副球菌属(paracoccus)、芽胞杆菌属(bacillus)、卓贝尔氏菌属(zobellella)等属。目前,脱氮微生物相关国家发明专利也较多。然而,大多数单一脱氮菌株实际应用于养殖水体脱氮时,不能有效地定殖、生存,难以发挥高效的脱氮功能。
技术实现要素:
5.本发明的第一个目的在于提供一种高效脱氮效果的假单胞菌(pseudomonas sp.)jm13b8a,其于2021年12月9日保藏于广东省微生物菌种保藏中心(gdmcc),地址:广东省广州市越秀区先烈中路100号大院59号楼,邮编:510070,保藏编号为:gdmcc no.62114。
6.本发明的第二个目的在于提供假单胞菌(pseudomonas sp.)jm13b8a在水体脱氮处理中的应用。
7.本发明的第三个目的是提供一种具有脱氮功能的活菌复合制剂,其包括芽殖杆菌(gemmobacter sp.)jm14b9b和假单胞菌(pseudomonas sp.)jm13b8a;
8.所述的芽殖杆菌(gemmobacter sp.)jm14b9b,其于2021年12月9日保藏于广东省
微生物菌种保藏中心(gdmcc),地址:广东省广州市越秀区先烈中路100号大院59号楼,邮编:510070,保藏编号为:gdmcc no.62113。
9.优选,所述的具有脱氮功能的活菌复合制剂是将对数生长期的芽殖杆菌(gemmobacter sp.)jm14b9b菌液和假单胞菌(pseudomonas sp.)jm13b8a菌液混合。
10.进一步优选,是将对数生长期的芽殖杆菌(gemmobacter sp.)jm14b9b菌液和假单胞菌(pseudomonas sp.)jm13b8a菌液按照体积比1:1混合。
11.本发明的第四个目的是提供上述活菌复合制剂在水体脱氮处理中的应用。
12.优选,所述的脱氮是脱硝态氮和/或亚硝态氮。
13.优选,所述的水体可以是碳氮比大于等于5的氮素超标的任意废水。
14.本发明由芽殖杆菌(gemmobacter sp.)jm14b9b和假单胞菌(pseudomonas sp.)jm13b8a组成的高效脱氮合成群落(活菌复合制剂)能够快速高效地脱除水体中的硝态氮、亚硝态氮,且无其他无机氮素的积累,即该合成群落在以50mg/l no
3-‑
n为唯一氮源的培养基中培养24h时,对no
3-‑
n的脱除效率达100%,且无有害no
2-‑
n的积累;在以50mg/l no
2-‑
n为唯一氮源的培养基中培养24h时,对no
2-‑
n的脱除效率达100%,且无no
3-‑
n的积累。
15.本发明的高效脱氮合成群落(活菌复合制剂)在低碳氮比或高碳氮比水体中的硝态氮、亚硝态氮的脱除率均为100%。由此说明,高效脱氮合成群落能够应用于各种寡营养或富营养的硝态氮、亚硝态氮污染的水体脱氮处理。
16.gemmobacter sp.jm14b9b,其于2021年12月9日保藏于广东省微生物菌种保藏中心(gdmcc),地址:广东省广州市越秀区先烈中路100号大院59号楼,邮编:510070,保藏编号为:gdmcc no.62113。
17.pseudomonas sp.jm13b8a,其于2021年12月9日保藏于广东省微生物菌种保藏中心(gdmcc),地址:广东省广州市越秀区先烈中路100号大院59号楼,邮编:510070,保藏编号为:gdmcc no.62114。
附图说明
18.图1为gemmobacter sp.jm14b9b和pseudomonas sp.jm13b8a的菌落形态图。
19.图2为gemmobacter sp.jm14b9b和pseudomonas sp.jm13b8a的透射电镜下的细胞形态图。
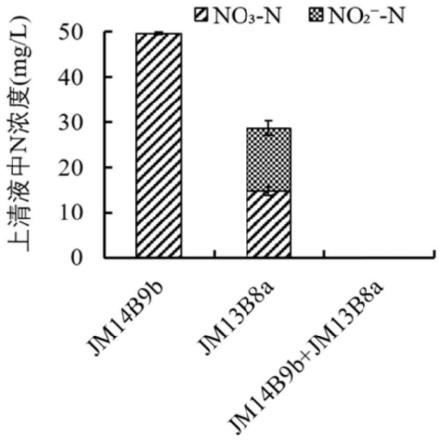
20.图3为单一菌株及高效脱氮合成群落在以硝态氮为唯一氮源条件下的脱氮效果图。
21.图4为高效脱氮合成群落在以硝态氮为唯一氮源条件下的生长和脱氮效果图。
22.图5为高效脱氮合成群落在以亚硝态氮为唯一氮源条件下的生长和脱氮效果图。
具体实施方式
23.以下实施例是对本发明的进一步说明,但不是对本发明的限制。
24.实施例1:高效脱氮合成群落组成菌株的分离纯化和保藏
25.样品采集自广东省江门市台山市年丰公司广海镇养殖基地(n21
°
56
′
31
″
;e112
°
46
′
16
″
)的南美白对虾和鳙鱼混合养殖池塘水。养殖水样品1ml,梯度稀释10-1
,10-2
,10-3
和10-4
后,取100μl 10-2
、10-3
和10-4
的稀释液涂布于以no
3-‑
n和no
2-‑
n为唯一氮源的选择性培
养基上,30℃培养箱中培养。肉眼观察菌落形态,挑取菌落形态上有差异的单菌落,分别划线纯化,将已纯化的菌落接种至5ml的r2a液体培养基中,30℃,180rpm培养,进行后续甘油管保存,由此得到菌株jm14b9b和jm13b8a。
26.选择性培养基配方如下:琥珀酸钠0.25g,二水合柠檬酸钠0.25g,nano
2 0.069g,kno30.101g,(nh4)2so
4 0.066g,na2hpo
4 1.0g,kh2po
4 1.0g,mgso4·
7h2o 0.2g,15g琼脂,ph 7.4,定容至1000ml,121℃,15min,高温高压灭菌。灭菌后添加体积比1%的复合碳源和体积比0.2%的微量元素混合液。
27.复合碳源:d-葡萄糖13.8g,d-果糖13.8g,d-乳糖13.8g,体积分数90%乳酸12.8ml,甘露醇14.0g,无水乙醇14.0ml,甘油12.6ml,苯甲酸钠9.6g,水杨酸9.2g,无水乙酸钠19.0g,溶于1000ml水中,ph 7.4,0.22μm滤膜过滤除菌。
28.微量元素混合液:edta-na 10.0g,znso4·
7h2o 0.5g,cacl
2 5.5g,mncl2·
4h2o 0.4g,feso4·
7h2o 1.1g,namoo4·
2h2o 0.4g,cuso4·
5h2o 0.2g,cocl2·
6h2o 0.5g,ph调至6.0,定容至1000ml,0.22μm滤膜过滤。
29.实施例2:高效脱氮合成群落组成菌株的菌落形态和细胞形态
30.如图1和图2所示,菌株jm14b9b为革兰氏阴性菌,该菌株在r2a培养基上培养48h时,其菌落形态特征为:蓝黑色,边缘规则整齐,表面光滑,不透明,菌落直径大小1.0-1.5mm。透射电镜观察其细胞形态特征为:杆状,大小为(0.7
×
1.7)μm,具有两根侧生鞭毛和纤毛;菌株jm13b8a,革兰氏阴性菌,该菌株在营养肉汤固体培养基(na)上30℃培养48h,其菌落形态为:米黄色,边缘不规则,表面光滑、不透明,菌落直径大小2.0-3.0mm。透射电镜观察其细胞形态特征为:长杆状,大小为(0.4
×
2.1)μm,具有极端生鞭毛。
31.实施例3:高效脱氮合成群落组成菌株的16s rrna序列分析
32.采用hipure细菌dna提取试剂盒(广州美基生物科技有限公司)提取菌株jm14b9b和jm13b8a的基因组dna,用细菌16s rrna基因扩增通用引物27f/1492r(27f:5
’‑
agag tttgatcatggctcag-3、1492r:5
’‑
tacggttaccttgttacgactt-3’)扩增得到pc r产物,并送至苏州金唯智生物科技有限公司进行序列测序,其序列如seq id no.1、seqid no.2所示,测序结果与ezbiocloud网站数据库中的16s rrna序列进行同源性比对分析,结果表明,菌株jm14b9b与gemmobacter caeruleus n8
t
相似性最高,为99.2%;菌株jm13b8a与pseudomonas fluvialis ass-1
t
相似性最高,为97.7%,小于细菌种水平的阈值(98.7%),为一株假单胞菌属的新种。
33.实施例4:高效脱氮合成群落组成菌株的基因组序列分析
34.提取菌株jm14b9b和jm13b8a的基因组dna,将其送至上海美吉生物医药科技有限公司进行基因组测序,测序结果分别采用spades v3.11.1和checkm 1.0.9进行基因组的组装和质量评估。采用rapid annotation using subsystem technology(rast)version 2.0在线注释工具对两株菌株的基因组进行注释。结果显示,菌株jm14b9b和jm13b8a的基因组完整度均大于95.0%,且污染度均小于3.0%。菌株jm14b9b的基因组大小为3,676,340bp,g c含量为66.4%,有136个contigs,含同化硝酸盐、亚硝酸盐还原酶及反硝化脱氮过程关键基因,其中膜结合硝酸盐还原酶基因narg、亚硝酸盐还原酶基因nirs、一氧化氮还原酶基因norb和一氧化二氮还原酶基因nosz等参与完整的反硝化脱氮过程;菌株jm13b8a的基因组大小为3,895,989bp,g c含量为64.4%,有18个contigs,含有同化硝酸盐、亚硝酸盐还原酶
及反硝化脱氮过程中的周质硝酸盐还原酶基因nap。
35.将菌株jm14b9b命名为芽殖杆菌(gemmobacter sp.)jm14b9b,其于2021年12月9日保藏于广东省微生物菌种保藏中心(gdmcc),地址:广东省广州市越秀区先烈中路100号大院59号楼,邮编:510070,保藏编号为:gdmcc no.62113。
36.将菌株jm13b8a命名为假单胞菌(pseudomonas sp.)jm13b8a,其于2021年12月9日保藏于广东省微生物菌种保藏中心(gdmcc),地址:广东省广州市越秀区先烈中路100号大院59号楼,邮编:510070,保藏编号为:gdmcc no.62114。
37.综上所述,本发明的高效脱氮合成群落由芽殖杆菌(gemmobacter sp.)jm14b9b和假单胞菌(pseudomonas sp.)jm13b8a组合而成。
38.实施例5:高效脱氮合成群落的脱氮特性
39.芽殖杆菌jm14b9b和假单胞菌jm13b8a分别接种于r2a液体和营养肉汤液体培养基(nb)中,30℃,150rpm振荡培养。培养24h后(菌株生长至对数期),菌液6000rpm离心10min,收集菌体,用生理盐水清洗2次后重悬于生理盐水中,并将其od
600
调整至1.0,作为种子液。分别将菌株jm14b9b和jm13b8a的单菌种子液、1:1体积比例混合的种子液按体积比2%总接种量分别接种至碳氮比为10的硝态氮为唯一氮源的培养基中,30℃,静置培养。在培养48h时取样,培养液离心取上清,用于no
3-‑
n和no
2-‑
n浓度测定。每个处理4个重复。由此确定,菌株jm14b9b和jm13b8a的单一菌株及由2株菌组成的合成群落的脱氮效果。
40.为了进一步确定由芽殖杆菌jm14b9b和假单胞菌jm13b8a组成的高效脱氮合成群落的脱氮特性,将菌株jm14b9b和jm13b8a的种子液1:1体积比例混合,并按体积比2%总接种量分别接种至碳氮比为10的硝态氮或亚硝态氮为唯一氮源的培养基中,其中no
3-‑
n和no
2-‑
n初始浓度均设置为50mg/l,30℃,静置培养。分别在培养0、6、12、24、48、60h时取样,一部份培养液用于检测od
600
值,另一部分培养液离心取上清,用于no
3-‑
n和no
2-‑
n浓度测定。no
3-‑
n浓度采用紫外分光光度法测定,no
2-‑
n采用n-(1-萘基)-乙二胺分光光度法测定。每个处理4个重复。
41.以硝态氮为唯一氮源的培养基:乙酸钠1.46g,kno
3 0.36g,na2hpo
4 1.0g,kh2po
4 1.0g,mgso4·
7h2o 0.2g,ph 7.4,定容至1000ml,121℃,15min,高温高压灭菌后添加体积比0.2%微量元素混合液。
42.以亚硝态氮为唯一氮源的培养基:乙酸钠1.46g,nano
2 0.25g,na2hpo
4 1.0g,kh2po41.0g,mgso4·
7h2o 0.2g,ph 7.4,定容至1000ml,121℃,15min,高温高压灭菌后添加体积比0.2%微量元素混合液。
43.如附图3所示,芽殖杆菌jm14b9b单一菌株无no
3-‑
n脱除效果;假单胞菌jm13b8a单一菌株对硝态氮脱除效果为42.8%,且该菌在no
3-‑
n脱除过程中有no
2-‑
n的积累;然而,由上述2株菌组成的合成群落能够将硝态氮完全脱除,且无no
2-‑
n的积累。由此说明,菌株jm14b9b和jm13b8a组成的合成群落具有高效脱氮的功能。如附图4所示,高效脱氮合成群落对初始浓度为50mg/l的no
3-‑
n具有很好的脱除效果,即在培养24h时,该菌od
600
为0.35,其对no
3-‑
n的脱除效果已达100%,且脱氮过程中无no
2-‑
n的产生。如附图5所示,高效脱氮合成群落对初始浓度为50mg/l的no
2-‑
n亦具有很好的脱除效果,即在培养24h时,该菌的od
600
分别为0.36,其对no
2-‑
n的脱除率达100%,且脱氮过程中无no
3-‑
n的产生。以上结果表明,本发明所述的高效脱氮合成群落在水体脱氮上具有很大的应用潜力。
44.实施例6:高效脱氮合成群落在低碳氮比水体中的脱氮效果
45.芽殖杆菌jm14b9b和假单胞菌jm13b8a分别接种于r2a液体和nb培养基中,30℃,150rpm振荡培养。培养24h后(菌株生长至对数期),菌液6000rpm离心10min,收集菌体,用生理盐水清洗2次后重悬于生理盐水中,并将其od
600
调整至1.0,作为种子液。将菌株jm14b9b和jm13b8a的种子液1:1体积比例混合,并按体积比2%总接种量分别接种至碳氮比为5的硝态氮或亚硝态氮为唯一氮源的培养基中,其中no
3-‑
n和no
2-‑
n初始浓度均设置为50mg/l,30℃,静置培养。在培养48h时取样,一部份培养液用于检测od
600
值,另一部分培养液离心取上清,用于no
3-‑
n和no
2-‑
n浓度测定。no
3-‑
n浓度采用紫外分光光度法测定,no
2-‑
n采用n-(1-萘基)-乙二胺分光光度法测定。每个处理4个重复。
46.以硝态氮为唯一氮源的培养基:乙酸钠0.73g,kno
3 0.36g,na2hpo
4 1.0g,kh2po
4 1.0g,mgso4·
7h2o 0.2g,ph 7.4,定容至1000ml,121℃,15min,高温高压灭菌后添加体积比0.2%微量元素混合液。
47.以亚硝态氮为唯一氮源的培养基:乙酸钠0.73g,nano
2 0.25g,na2hpo
4 1.0g,kh2po41.0g,mgso4·
7h2o 0.2g,ph 7.4,定容至1000ml,121℃,15min,高温高压灭菌后添加体积比0.2%微量元素混合液。
48.结果显示,高效脱氮合成群落在碳氮比为5的条件下,对50mg/l的no
3-‑
n和no
2-‑
n的脱除效率均为100%。由此说明,高效脱氮合成群落能够在低碳氮条件下进行生长和脱氮,即其在寡营养和富营养水体脱氮处理上具有很大的应用潜力。
49.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。