1.本发明提供了一种环状dna载体,可用于在宿主细胞的靶区域引入特异性突变。本发明进一步提供了使用所述环状dna载体产生工程化宿主细胞的方法。所述环状dna载体和方法可用于研究基因功能和生成产生重组基因产物的细胞。
背景技术:
2.乳杆菌已被广泛用作益生菌,并且越来越多地被研究作为医学相关重组蛋白至粘膜表面的传递载体。相比之下,用于研究和增强益生菌活性的遗传工具(尤其是诱变)开发得相当差。传统的基因组工程方法很大程度上依赖于细菌转化效率。这种缺陷可以通过条件复制质粒辅助重组工程来克服,例如含有pwv01热敏复制起点的质粒,但后者可能具有有限的宿主范围。因此,需要开发更灵活有效的基因组编辑策略,以更好地理解和应用这些促进健康的微生物。
技术实现要素:
3.本发明的第一方面提供了一种环状dna载体,包含:
4.(a)可选择的标志基因序列,其中所述标志基因序列可操作地连接至第一启动子序列,
5.(b)多克隆位点,其中所述多克隆位点任选地包含基因靶向序列,
6.(c)编码位点特异性重组酶的序列,其中所述序列可操作地连接至第二启动子序列,其中所述第二启动子是诱导型的,
7.(d)复制子序列,
8.(e)用于所述位点特异性重组酶的两个靶位点,
9.其中载体包含由所述用于所述位点特异性重组酶的靶位点之一侧翼在每一侧的第一区域,并且其中所述区域包含(a)和(b),前提条件是(c)和(d)不在所述第一区域内。
10.所述环状dna载体可用作靶向载体,用于通过同源重组将(基因)序列靶向整合到基因组宿主中。所述环状dna载体特别有用于宿主细胞中的基因靶向,通常已知这些宿主细胞难以转化,例如乳杆菌(lactobacilli)和双歧杆菌(bifidobacteria)的种类。根据本发明的方法,所述环状dna载体特别有用于基因靶向。
11.因此,在本发明的第二方面中,提供了一种在环状dna载体和宿主细胞基因组靶区之间引入重组的方法,所述方法包含步骤:
12.(i)将根据本发明的包含基因靶向序列的环状dna载体引入宿主细胞,其中所述靶序列包含侧翼序列,该侧翼序列包含与所述宿主细胞基因组的靶区的相应区域具有至少80%序列同一性的至少约200个连续核苷,
13.(ii)诱导由所述环状dna载体编码的位点特异性重组酶的表达,并且允许在所述位点特异性重组酶的靶位点之间的位点特异性重组以产生包含(a)和(b)的第一环状dna产物以及包含(c)和(d)的第二环状dna产物,
14.(iii)选择宿主细胞,其中通过所述靶序列的侧翼序列与所述宿主细胞基因组靶区之间的第一单交叉同源重组事件,将所述包含(a)和(b)的第一环状dna产物整合在所述基因组的靶区,和
15.(iv)选择宿主细胞,其中已经通过所述靶向序列的侧翼序列与所述基因组的靶区之间的第二同源重组事件将(a)从(iii)下获得的宿主细胞的基因组中切除。
16.在第三方面,本发明提供了一种产生在宿主细胞基因组的靶基因中具有突变的宿主细胞的方法,所述方法包含步骤:
17.(i)将根据本发明的包含基因靶向序列的环状dna载体引入宿主细胞,其中所述靶序列包含侧翼序列,所述侧翼序列包含与所述宿主细胞基因组的靶基因的相应区域具有至少80%序列同一性的至少约200个连续核苷,
18.(ii)诱导由所述环状dna载体编码的位点特异性重组酶的表达,并且允许在所述位点特异性重组酶的靶位点之间的位点特异性重组以产生包含(a)和(b)的第一环状dna产物以及包含(c)和(d)的第二环状dna产物,
19.(iii)选择宿主细胞,其中通过所述靶序列的侧翼序列与所述宿主细胞基因组靶区之间的第一单交叉同源重组事件,将所述包含(a)和(b)的第一环状dna产物整合在所述基因组的靶区,和(iv)选择宿主细胞,其中已经通过所述靶向序列的侧翼序列与所述基因组的靶区之间的第二同源重组事件将(a)从(iii)下获得的宿主细胞的基因组中切除,并且其中所述宿主细胞在所述靶区包含突变。
20.在第四方面,本发明提供了一种产生在宿主细胞基因组的靶基因中丧失了功能的宿主细胞的方法,所述方法包含步骤:
21.(i)将根据本发明的包含基因靶向序列的环状dna载体引入宿主细胞,其中所述靶序列包含侧翼序列,所述侧翼序列包含与所述宿主细胞基因组的靶基因的相应区域具有至少80%序列同一性的至少约200个连续核苷,
22.(ii)诱导由所述环状dna载体编码的位点特异性重组酶的表达,并且允许在所述位点特异性重组酶的靶位点之间的位点特异性重组以产生包含(a)和(b)的第一环状dna产物以及包含(c)和(d)的第二环状dna产物,
23.(iii)选择宿主细胞,其中通过所述靶序列的侧翼序列与所述宿主细胞基因组靶区之间的第一单交叉同源重组事件,将所述包含(a)和(b)的第一环状dna产物整合在所述基因组的靶区,和(iv)选择宿主细胞,其中已经通过所述靶向序列的侧翼序列与所述基因组的靶区之间的第二同源重组事件将(a)从(iii)下获得的宿主细胞的基因组中切除,并且其中所述宿主细胞包含所述靶基因的功能丧失。
24.在第五方面,本发明提供了一种产生在宿主细胞基因组的靶基因中具有功能增益(gain)的宿主细胞的方法,所述方法包含步骤:
25.(i)将根据本发明的包含基因靶向序列的环状dna载体引入宿主细胞,其中所述靶序列包含侧翼序列,所述侧翼序列包含与所述宿主细胞基因组的靶基因具有至少80%序列同一性的至少约200个连续核苷,
26.(ii)诱导由所述环状dna载体编码的位点特异性重组酶的表达,并且允许在所述位点特异性重组酶的靶位点之间的位点特异性重组以产生包含(a)和(b)的第一环状dna产物以及包含(c)和(d)的第二环状dna产物,
27.(iii)选择宿主细胞,其中通过所述靶序列的侧翼序列与所述宿主细胞基因组靶区之间的第一单交叉同源重组事件,将所述包含(a)和(b)的第一环状dna产物整合在所述基因组的靶区,和(iv)选择宿主细胞,其中已经通过所述靶向序列的侧翼序列与所述基因组的靶区之间的第二同源重组事件将(a)从(iii)下获得的宿主细胞的基因组中切除,并且其中所述宿主细胞包含所述靶基因的功能增益。
28.在第六方面,本发明提供了一种制备表达重组多肽的宿主细胞的方法,所述方法包含步骤:
29.(i)将根据本发明的包含基因靶向序列的环状dna载体引入宿主细胞,其中所述靶序列包含侧翼序列,所述侧翼序列包含与所述宿主细胞基因组的靶区的相应区域具有至少80%序列同一性的至少约200个连续核苷,并且其中所述基因靶向序列编码重组多肽,
30.(ii)诱导由所述环状dna载体编码的位点特异性重组酶的表达,并且允许在所述位点特异性重组酶的靶位点之间的位点特异性重组以产生包含(a)和(b)的第一环状dna产物以及包含(c)和(d)的第二环状dna产物,
31.(iii)选择宿主细胞,其中通过所述靶序列的侧翼序列与所述宿主细胞基因组靶区之间的第一单交叉同源重组事件,将所述包含(a)和(b)的第一环状dna产物整合在所述基因组的靶区,和
32.(iv)选择宿主细胞,其中已经通过所述靶向序列的侧翼序列与所述基因组的靶区之间的第二同源重组事件将(a)从(iii)下获得的宿主细胞的基因组中切除。
33.本发明的进一步方面提供了一种由任何本发明的方法获得的重组宿主细胞。
34.在又进一步方面,本发明提供了本发明的环状载体用于将基因序列引入宿主细胞基因组中的用途。
35.在一个进一步的方面,本发明提供了本发明的环状载体用于增加宿主细胞的组织粘附的用途。
附图说明
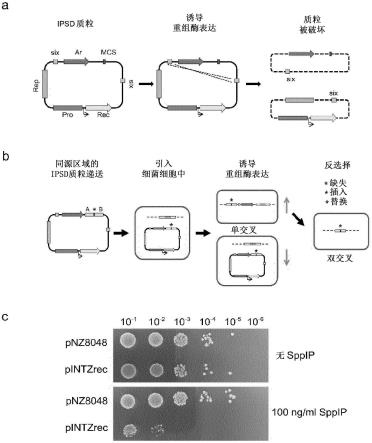
36.图1细菌重组的ipsd策略。a,诱导型质粒自毁示意图。构建了其中复制子和抗生素抗性基因被两个定向的six片断分隔的载体。添加诱导剂和β介导的重组后,载体由于复制子的切除而丧失功能。rep,复制子;pro,受控表达启动子;rec,重组酶;six:两个定向的six靶序列位点;ar,抗生素抗性基因;mcs,多克隆位点。b,ipsd辅助细菌重组工程的示意图,包括基因缺失、插入和替换(由星号指示)。重组后,含有附加型载体(episomal vector)的菌落的比例下降(蓝色箭头),而通过单交叉的整合dna片段的菌落比例增加(红色箭头)。单交叉突变菌落可以通过pcr筛选,并且双交叉克隆可以通过反选择进行选择。a和b指示了靶基因侧翼的同源末端。染色体上的靶基因用粉色矩形表示。c,在补充有10μg/ml氯霉素和存在或不存在100ng/ml sppip的mrs琼脂板上生长指示的格氏乳杆菌dsm 14869菌株。
37.图2
38.ipsd载体pintzrec的物理图谱。cmr,氯霉素抗性基因;rec,重组酶基因β。
39.图3乳杆菌中ipsd辅助的基因缺失和插入。a,b,缺失了格氏乳杆菌dsm 14869upp基因并且使用引物对uppleft-f和uppright-r通过pcr验证了缺失突变体。c,与wt相比,格氏乳杆菌(l.gasseri)dsm 14869upp突变体显示出对100μg/ml 5-fu的耐受性。
40.图4
41.在补充有10μg/ml氯霉素和存在或不存在100ng/ml sppip的mrs琼脂板上生产指示的乳杆菌菌株。(a)副干酪乳杆菌(l.paracasei)bl23,(b)嗜酸乳杆菌(l.acidophilus)atcc 4356,(c)植物乳杆菌(l.plantarum)nl42。
42.图5
43.通过ipsd辅助重组工程缺失格氏乳杆菌dsm 14869中的upp基因。
44.(a)upp-cmr片段单交叉整合到格氏乳杆菌dsm 14869的染色体中。使用引物pirec-f和pirec-r进行菌落pcr以检测完整质粒pintzrec-upp。没有对应条带的10个菌落作为候选单交叉克隆,标记为“ ”。(b)通过dna提取和使用引物uppleft-f和pirecsc-r(上部凝胶)或者pirecsc-f和uppright-r(下部凝胶)的pcr进一步证实了十个候选克隆中的单交叉事件。正确的克隆标记为“ ”,不确定的克隆标记为“?”。(c)进行使用引物uppseq-f和uppseq-r的菌落pcr以检测在补充有5-fu的sdm培养基上选择的upp双交叉缺失突变体。m,generuler
tm 1kb dna梯;p,格氏乳杆菌dsm 14869的含有质粒pintzrec-upp的dna;wt,野生型格氏乳杆菌dsm 14869的dna。
45.图6
46.用于驱动重组酶表达的诱导型启动子在某些菌株中无效。在补充有10μg/ml氯霉素的mrs琼脂板上并且在存在或不存在100ng/ml sppip的条件下生长指示的清酒乳杆菌(l.sakei)nc03菌株(a)和鼠李糖乳杆菌(l.rhamnosus)gg株菌(b)。
47.图7
48.格氏乳杆菌dsm 14869中eps基因簇(a)以及n506_1778(b)和n506_1709(c)的蛋白质结构域的示意图。(a)示出了位于基因组序列(cp006803)中核苷酸数379,930
–
394,580的eps基因簇(n506_0396至n506_0411)。使用菌株格氏乳杆菌atcc 33323和格氏乳杆菌cect 5714通过blastp分析对酶和基因名称进行注释(marcotte et al.2017)。(b)n506_1778蛋白质包括n-末端中的ysirk信号序列和c-末端中的革兰氏阳性lpxtg(lpqtg)基序。重复区域由两个mucbp-样结构域组成。(c)n506_1709蛋白质包括n-末端ysirk信号序列和c-末端lpqtg基序。重复区域包含三个不同的rib/alpha-样重复,其中一个是部分重复。n-末端(约1-900aa)与数据库中的其它蛋白质没有相似之处,而c-末端(约900-1456aa)与来自约氏乳杆菌(l.johnsonii)和格氏乳杆菌(登录号wp_095670316、qys15157、wp_061400034、oys08635、oys05727、oul52955和aha97914)的蛋白质的c-末端显示出较低的同一性百分比(34-48%)。基因和蛋白质结构未按比例显示。
49.图8
50.(a)格氏乳杆菌dsm 14869野生型(wt)、eps突变体(δeps)和补体菌株的透射电子显微镜图片。在wt中观察到致密的eps层,而eps突变株的表面eps生产显著降低。eps补体菌株将eps水平恢复到wt。比例尺=200nm。(b)wt、δeps和eps补体菌株的eps层厚度的比较。相对厚度显示为相对于wt(设定成100%)的百分比。每组评估10个细胞的厚度,并确定每个细胞的厚度的平均值
±
sd。
51.图9
52.(a)格氏乳杆菌dsm 14869(wt)及其突变衍生物的表型分析。将mrs培养基中的过夜培养物涡旋并在室温下放置1h。突变体显示出细胞沉淀物和非常清澈的上层溶液。相比
之下,对于wt和补体菌株,可以看到相对均匀的悬浮液。(b)wt及其突变衍生物的自动聚集的定量分析。洗涤过夜培养物并且在pbs中重悬浮至1.5的od
600
,并且静置不受干扰5h。测量上悬液的od。自动聚集百分比由以下表达式计算:自动聚集(%)=(1-(od
600 5h/od
600 0h))
×
100,其中od
600 5h表示5h时间点的吸光度并且od
600 0h表示在0h的吸光度。自动聚集能力显示为相对于野生型菌株(设定成100%)的百分比。数据表示三个独立实验的平均值
±
sd,*p《0.05,***p《0.001。(c)wt及其突变衍生物生物膜形成的量化。在mrs培养基中培养72小时后,使用结晶紫染色评估在聚苯乙烯板上形成的生物膜。读取在od
570
下的吸光度值,并且代表生物膜形成的能力。数据表示三个独立实验的平均值
±
sd,***p《0.001。
53.图10
54.格氏乳杆菌dsm 14869野生型、eps突变株和补体菌株的粘附能力的比较。粘附率显示为相对于野生型(设定成100%)的百分比。每个图显示了针对(a)caco-2细胞、(b)hela细胞和(c)阴道上皮细胞的粘附能力。数据表示三个独立实验的平均值
±
sd,**p《0.01,***p《0.001。
55.图11
56.wt、n506_1778突变体(δ1778)和n506_1778补体(1778补体)菌株(a)中基因n506_1778以及wt、n506_1709突变体(δ1709)和n506_1709补体(1709补体)菌株(b)中基因n506_1709的mrna表达。将wt中两个基因的mrna表达用作对照。数据表示三个独立实验的平均值
±
sd。
57.图12
58.格氏乳杆菌dsm 14869野生型、突变体δ1778和δ1709菌株的粘附能力的比较。粘附率显示为相对于野生型(设定成100%)的百分比。每个图显示了对(a)caco-2细胞、(b)hela细胞、(c)阴道上皮细胞的粘附能力。数据表示三个独立实验的平均值
±
sd,*p《0.05,**p《0.01,***p《0.001。
59.图13
60.(a)过表达菌株乳酸乳球菌(l.lactis)nz9000/pnz8048-1709中n506_1709的mrna表达。将含有空pnz8048质粒的乳酸乳球菌(nz9000/pnz8048)用作对照。(b)过表达菌株nz9000/pnz8048-1709对阴道上皮细胞的粘附能力。粘附率显示相对于nz9000/pnz8048(设定成100%)的为百分比。数据表示三个独立实验的平均值
±
sd,***p《0.001。
61.图14
62.格氏乳杆菌dsm 14869野生型、n506_0400突变体(δeps)、n506_1778突变体(δ1778)和n506_1709突变体(δ1709)菌株在mrs培养基中的生长曲线。
63.图15
64.(a)pintzrec的质粒谱。该质粒包含多克隆位点,可用于整合同源片段;两个six位点和一个β-重组酶(rec),其特异性催化位于抗生素抗性基因两侧翼的两个six位点与待整合dna之间的重组。β-重组酶的表达受sakacin-诱导型启动子的控制。(b)pnz8048的质粒谱。(c)pnze-rec的质粒谱。
具体实施方式
65.在第一方面,本发明提供了一种环状dna载体,包含:
66.(a)可选择的标志基因序列,其中所述标志基因序列可操作地连接至第一启动子序列,
67.(b)多克隆位点,其中所述多克隆位点任选地包含基因靶向序列,
68.(c)编码位点特异性重组酶的序列,其中所述序列可操作地连接至第二启动子序列,其中所述第二启动子是诱导型的,
69.(d)复制子序列,
70.(e)用于所述位点特异性重组酶的两个靶位点,
71.其中载体包含由所述位点特异性重组酶的所述靶位点之一侧翼在每一侧的第一区域,并且其中所述区域包含(a)和(b),前提条件是(c)和(d)不在所述第一区域内。该环状dna载体优选为质粒。
72.所述可选择的标志可以是适用于识别和选择该标志表达的宿主细胞的任何标志。在一个实施方式中,所述可选择的标志是抗生素抗性基因,如选自由氯霉素抗性基因、壮观霉素抗性基因、四环素抗性基因和红霉素抗性基因组成的组的抗生素抗性基因。
73.所述位点特异性重组酶可以是适用于基因工程的任何位点特异性重组酶。在一个实施方式中,所述位点特异性重组酶是位点特异性丝氨酸重组酶。在另一实施方式中,所述位点特异性重组酶选自由β-重组酶、cre-重组酶、flp-重组酶和phic31整合酶组成的组。
74.用于位点特异性重组酶的靶位点的长度通常为30到200个核苷酸,并且通常由具有部分反向重复对称性的两个基序组成,重组酶与之结合,并且位于中心交叉序列的侧翼,在该中心交叉序列中进行重组。靶位点的例子包括six(β-重组酶的靶位点)、lox(cre重组酶的靶位点)和frt(flp重组酶的靶位点)。可以对位点特异性重组酶的靶位点进行工程改造(工程化,工程改变,engineered)以促进重组。可以使用单突变位点组,例如lox66和lox71,它们产生双突变位点作为位点特异性重组的产物。双突变位点不是位点特异性重组酶的底物,因此阻止了可逆的位点特异性重组事件。
75.在优选的实施方式中,环状dna载体包含定向的用于所述位点特异性重组酶的两个靶位点,以便在用于所述位点特异性重组酶的两个靶位点之间的位点特异性重组的产物为包含(a)和(b)的第一环状dna产物以及包含(c)和(d)的第二环状dna产物。
76.所述环状dna载体包含复制子,优选原核生物复制子序列,其允许载体在可以从中收获载体的克隆宿主(例如大肠杆菌(e.coli))中复制。所述复制子可用于载体的扩增和克隆目的,例如克隆基因靶向序列。在一个实施方式中,所述复制子序列是允许所述载体在大肠杆菌中复制的复制子序列,例如pbr322的复制起点。所述环状dna载体包含允许宿主细胞复制的复制子,该复制子经受dna载体(例如乳杆菌(lactobacilli)或双歧杆菌(bifidobacteria))的靶向插入。在一个实施方式中,所述环状dna载体包含用于在克隆宿主中复制载体的复制子和用于在宿主细胞中复制载体的进一步复制子,该复制子经受宿主细胞基因组中dna载体的靶向插入。在另一实施方式中,所述复制子序列为允许所述载体在大肠杆菌和其它原核宿主细胞(例如选自由乳杆菌和双歧杆菌组成的组的宿主细胞)中复制的复制子序列。因此,在该实施方式中,所述复制子具有双重功能,即在克隆宿主细胞中复制,用于载体扩增以及载体在宿主细胞中的克隆和复制,其经受宿主细胞基因组中dna载体的靶向插入。
77.在一个实施方式中,所述复制子序列是允许所述载体在选自由格氏乳杆菌(如格
氏乳杆菌dsm 14869)、鼠李糖乳杆菌(lactobacillus rhamnosus)(如鼠李糖乳杆菌dsm 14870)、副干酪乳杆菌(lactobacillus paracasei)、植物乳杆菌(lactobacillus plantarum)、嗜酸乳杆菌(lactobacillus acidophilus)、发酵乳杆菌(lactobacillus fermentum)、卷曲乳杆菌(lactobacillus crispatus)、詹氏乳杆菌(lactobacillus jensenii)、阴道乳杆菌(lactobacillus vaginalis)、惰性乳杆菌(lactobacillus iners)、罗伊氏乳杆菌(lactobacillus reuteri)、干酪乳杆菌(lactobacillus casei)、保加利亚乳杆菌(lactobacillus bulgaricus)、弯曲乳杆菌(lactobacillus curvatus)、德氏乳杆菌(lactobacillus delbrueckii)和约氏乳杆菌(lactobacillus johnsonii)组成的组的至少一种宿主细胞中复制的复制子序列。
78.所得复制子序列通常编码复制起点(ori)和复制起始蛋白(rep蛋白)。在一个实施方式中,复制子包含编码调节蛋白repa的repa或编码repfib复制蛋白a的repb或编码复制起始蛋白的repc。
79.所述可选择的标志基因序列可操作地连接至第一启动子序列。指导所述可选择标志表达的第一启动子优选地是具有组成型活性并因此在宿主细胞中表达所述标志的启动子,该宿主细胞受制于dna载体的靶向插入。可以使用任何适合的启动子和标志。
80.为了控制位点特异性重组的时机,有条件地表达位点特异性重组酶,例如使用任何合适的诱导型启动子。表达重组酶的启动子(第二启动子)的选择取决于宿主细胞。在一个实施方式中,所述第二启动子序列是诱导型原核启动子。在另一实施方式中,所述第二启动子序列选自由sakacin-诱导型启动子、四环素诱导型启动子、d-木糖诱导型启动子、乳糖诱导型启动子、iptg诱导型启动子、乳链菌肽诱导型启动子、胆汁诱导型启动子、细菌素诱导型启动子和合成诱导型启动子组成的组。
81.所述环状dna载体包含克隆位点,优选多克隆位点,其允许载体中基因靶向序列的克隆。在优选的实施方式中,所述载体包含插入在多克隆位点中的基因靶向序列。所述基因靶向序列包含具有足够高的序列同一性以允许将载体靶向整合到宿主细胞中的相应靶区的序列。包含插入在克隆位点的基因靶向序列的环状dna载体适用于本发明的方法。所述宿主细胞优选为细菌细胞,更优选选自由乳杆菌和双歧杆菌组成的组的宿主细胞。可以使用任何合适的方法将载体引入宿主细胞中,例如通过转化,例如电转化、缀合或转导。
82.所述环状dna载体优选包含允许载体在宿主细胞中复制的复制子,其中所述载体要通过同源重组插入基因组中。在宿主细胞的游离状态下,载体可以通过位点特异性重组酶的表达重新排列,这(i)消除了载体在宿主细胞中复制的能力和(ii)有助于选择载体和染色体dna之间的同源重组事件。所述位点特异性重组事件的产物是第一环状dna产物和第二dna产物,其中所述第一环状dna产物包含所述可选择的标志和多克隆位点,在该多克隆位点中插入了靶向序列。第二环状dna产物包含复制子和编码位点特异性重组酶的序列。
83.可以使用可选择标志来选择单交叉基因组整合的基因组dna(第一同源重组事件)。由于位点特异性重组酶的表达消除了载体在宿主细胞中复制的能力,因此包含游离基因环状dna载体的细胞受到限制。可以例如通过pcr来验证dna载体(不再是环状)的靶特异性整合。宿主可以繁殖以允许进一步的(第二)同源重组事件,其产物是可选择标志的切除。经历过两次同源重组事件的宿主可以通过可选择标志的丧失的反选择来识别,例如对使用抗生素抗性标志的抗生素的敏感性。正确的双交叉应优先使用pcr和/或测序等方法进行识
别。
84.本发明的第二方面提供了一种在环状dna载体和宿主细胞基因组的靶区之间引入重组的方法,所述方法包含步骤:
85.(i)在宿主细胞中引入根据本发明的包含基因靶向序列的环状dna载体,其中所述靶序列包含侧翼序列,该侧翼序列包含与所述宿主细胞基因组的靶区的相应区域具有至少80%序列同一性的至少约200个连续核苷,
86.(ii)诱导由所述环状dna载体编码的位点特异性重组酶的表达,并且允许在所述位点特异性重组酶的靶位点之间的位点特异性重组以产生包含(a)和(b)的第一环状dna产物以及包含(c)和(d)的第二环状dna产物,
87.(iii)选择宿主细胞,其中通过所述靶序列的侧翼序列与所述宿主细胞基因组靶区之间的第一单交叉同源重组事件,将所述包含(a)和(b)的第一环状dna产物整合在所述基因组的靶区,和
88.(iv)选择宿主细胞,其中已经通过所述靶向序列的侧翼序列与所述基因组的靶区之间的第二同源重组事件将(a)从(iii)下获得的宿主细胞的基因组中切除。
89.本发明的环状dna载体可以用于在宿主细胞的靶区中引入特异性突变。所述靶区可以是编码区,如编码蛋白质的基因。突变可以是改变或破坏编码序列的点突变。编码序列也可被在序列中引入缺失或插入的突变破坏。或者,突变可以改变(减少或增加)或恢复所编码蛋白质的活性。
90.因此,本发明的第三方面提供了一种产生在宿主细胞基因组的靶基因中具有突变的宿主细胞的方法,所述方法包含步骤:
91.(i)在宿主细胞中引入根据本发明的包含基因靶向序列的环状dna载体,其中所述靶序列包含侧翼序列,所述侧翼序列包含与所述宿主细胞基因组的靶基因的相应区域具有至少80%序列同一性的至少约200个连续核苷,
92.(ii)诱导由所述环状dna载体编码的位点特异性重组酶的表达,并且允许在所述位点特异性重组酶的靶位点之间的位点特异性重组,以产生包含(a)和(b)的第一环状dna产物以及包含(c)和(d)的第二环状dna产物,
93.(iii)选择宿主细胞,其中通过所述靶序列的侧翼序列与所述宿主细胞基因组靶区之间的第一单交叉同源重组事件,将所述包含(a)和(b)的第一环状dna产物整合在所述基因组的靶区,和(iv)选择宿主细胞,其中已经通过所述靶向序列的侧翼序列与所述基因组的靶区之间的第二同源重组事件将(a)从(iii)下获得的宿主细胞的基因组中切除,和其中所述宿主细胞在所述靶区包含突变。
94.所述方法有用于例如评价特定基因的功能。例如,评价特定基因在例如细菌粘附、自动分布和/或生物膜形成方面是否具有功能。
95.在相关方面,本发明提供了一种产生在宿主细胞基因组的靶基因中具有功能丧失的宿主细胞的方法,所述方法包含步骤:
96.(i)在宿主细胞中引入根据本发明的包含基因靶向序列的环状dna载体,其中所述靶序列包含侧翼序列,所述侧翼序列包含与所述宿主细胞基因组的靶基因的相应区域具有至少80%序列同一性的至少约200个连续核苷,
97.(ii)诱导由所述环状dna载体编码的位点特异性重组酶的表达,并且允许在所述
位点特异性重组酶的靶位点之间的位点特异性重组,以产生包含(a)和(b)的第一环状dna产物以及包含(c)和(d)的第二环状dna产物,
98.(iii)选择宿主细胞,其中通过所述靶序列的侧翼序列与所述宿主细胞基因组靶区之间的第一单交叉同源重组事件,将所述包含(a)和(b)的第一环状dna产物整合在所述基因组的靶区,和(iv)选择宿主细胞,其中已经通过所述靶向序列的侧翼序列与所述基因组的靶区之间的第二同源重组事件将(a)从(iii)下获得的宿主细胞的基因组中切除并且,其中所述宿主细胞包含所述靶基因的功能丧失。
99.如上所述,该方法可用于例如评估特定基因的功能。功能分析可用于解决靶向工程在靶向区域导致基因功能丧失对宿主细胞表型特征的潜在影响(与野生型宿主细胞相比)。表型特征包括但不限于细菌粘附(例如对哺乳动物组织)、自动聚集和/或生物膜形成。
100.本发明的另一方面提供了一种产生在宿主细胞基因组的靶基因中具有功能增益的宿主细胞的方法,所述方法包含步骤:
101.(i)在宿主细胞中引入根据本发明的包含基因靶向序列的环状dna载体,其中所述靶序列包含侧翼序列,所述侧翼序列包含与所述宿主细胞基因组的靶基因具有至少80%序列同一性的至少约200个连续核苷,
102.(ii)诱导由所述环状dna载体编码的位点特异性重组酶的表达,和允许在所述位点特异性重组酶的靶位点之间的位点特异性重组,以产生包含(a)和(b)的第一环状dna产物以及包含(c)和(d)的第二环状dna产物,
103.(iii)选择宿主细胞,其中通过所述靶序列的侧翼序列与所述宿主细胞基因组靶区之间的第一单交叉同源重组事件,将所述包含(a)和(b)的第一环状dna产物整合在所述基因组的靶区,和(iv)选择宿主细胞,其中已经通过所述靶向序列的侧翼序列与所述基因组的靶区之间的第二同源重组事件将(a)从(iii)下获得的宿主细胞的基因组中切除并且,其中所述宿主细胞包含所述靶基因的功能增益。
104.该方法可用于例如评估宿主细胞中先前基因功能丧失的逆转恢复失去的表型特征,例如细菌粘附(例如对哺乳动物组织)、自动聚集和/或生物膜形成。
105.靶基因可以编码任何基因产物。靶基因通常编码蛋白质。在一个实施方式中,靶基因编码细胞表面蛋白。在一个实施方式中,靶基因编码与细菌粘附、自动聚集和/或生物膜形成有关的蛋白质。在另一实施方式中,细胞表面蛋白是分选酶依赖性蛋白(sdp)或s层蛋白,或编码参与细胞表面分子生物合成的蛋白。在一个实施方式中,细胞表面分子是胞外多糖(eps)。在一个特定实施方式中,靶基因是选自由n506_1709、n506_1778、n506_0396、n506_0397、n506_0398、n506_0399、n506_0400、n506_0401、n506_0402、n506_0403、n506_0404、n506_0405、n506_0406、n506_0407、n506_0408、n506_0409、n506_0410和n506_0411组成的组的基因。
106.在一个实施方式中,宿主细胞是格氏乳杆菌(如格氏乳杆菌dsm14869)并且靶基因选自由n506_1709、n506_1778、n506_0396、n506_0397、n506_0398、n506_0399、n506_0400、n506_0401、n506_0402、n506_0403、n506_0404、n506_0405、n506_0406、n506_0407、n506_0408、n506_0409、n506_0410和n506_0411组成的组。
107.本发明的环状dna载体可以用于制备重组基因产物(例如重组蛋白)的宿主细胞重组表达。在这一方面,基因靶向序列通常可包含与靶向区域具有足够序列同一性以允许靶
区域特异性整合的序列;和编码所述重组基因产物(例如多肽)的序列。
108.因此,在进一步方面,本发明提供了一种制备表达重组多肽的宿主细胞的方法,所述方法包含步骤:
109.(i)在宿主细胞中引入根据本发明的包含基因靶向序列的环状dna载体,其中所述靶序列包含侧翼序列,该侧翼序列包含与所述宿主细胞基因组的靶区的相应区域具有至少80%序列同一性的至少约200个连续核苷,并且其中所述基因靶向序列编码重组多肽,
110.(ii)诱导由所述环状dna载体编码的位点特异性重组酶的表达和,允许在所述位点特异性重组酶的靶位点之间的位点特异性重组,以产生包含(a)和(b)的第一环状dna产物以及包含(c)和(d)的第二环状dna产物,
111.(iii)选择宿主细胞,其中通过所述靶序列的侧翼序列与所述宿主细胞基因组靶区之间的第一单交叉同源重组事件,将所述包含(a)和(b)的第一环状dna产物整合在所述基因组的靶区,和
112.(iv)选择宿主细胞,其中已经通过所述靶向序列的侧翼序列与所述基因组的靶区之间的第二同源重组事件将(a)从(iii)下获得的宿主细胞的基因组中切除。
113.在一个实施方式中,所述重组多肽选自由抗体(如单克隆抗体、人源化单克隆抗体、嵌合抗体、单域抗体、骆驼抗体(camelid antibodies))、酶、细胞因子、激素和血液凝固蛋白组成的组。通过该方法获得的宿主细胞可以用作生产重组产品的生产细胞。
114.所述基因靶向序列包含侧翼区域中的序列,其与靶区的序列具有足够高的同一性以允许/促进同源重组。在一个实施方式中,所述侧翼区域中的序列(侧翼序列)包含在200至1500范围内的连续核苷,例如至少约300个连续核苷,如至少约400个连续核苷,例如至少约500个连续核苷,如至少约600个连续核苷,例如至少约700个连续核苷,如至少约800个连续核苷,例如至少约900个连续核苷,如至少约1000个连续核苷,例如至少约1100个连续核苷,如至少约1200个连续核苷,例如至少约1300个连续核苷,如至少约1400个连续核苷,例如至少约1500个连续核苷。
115.在另一实施方式中,所述侧翼序列与宿主细胞基因组靶基因的相应区域具有至少85%的序列同一性,例如与宿主细胞基因组靶基因的相应区域具有至少95%的序列同一性,如与宿主细胞基因组靶基因的相应区域具有至少97%的序列同一性,例如与宿主细胞基因组靶基因的相应区域具有至少98%的序列同一性,如与宿主细胞基因组靶基因的相应区域具有至少99%的序列同一性,例如与宿主细胞基因组靶基因的相应区域具有至少100%的序列同一性。
116.在一个实施方式中,(iii)下的选择使用环状dna载体的可选择的标志基因序列(a)(其选择具有dna载体单交叉整合的宿主细胞)。可以使用pcr和/或dna测序识别/验证包含dna载体的单交叉整合的宿主细胞。因此,在一个实施方式中,(iii)下的选择使用pcr和/或dna测序,如对靶向序列和靶区之间的序列连接进行测序。
117.宿主可以繁殖以允许进一步的(第二)同源重组事件,其产物是可选择标志的切除。经历过两次同源重组事件的宿主可以通过可选择标志丢失的反选择来识别,例如导致对其中使用抗生素抗性标志的抗生素敏感。正确的双交叉事件应该优选使用pcr和/或dna测序等方法进行识别。在优选的实施方式中,使用pcr或dna测序选择和/或验证经历了第一和第二同源重组事件的宿主细胞。
118.本发明方法的产物((iv)的产物)通常是宿主细胞,其包含靶区的缺失、靶区的部分缺失、靶区的序列插入、靶区的点突变或靶区的序列替换。
119.宿主细胞优选原核生物,优选细菌。在优选的实施方式中,宿主细胞是乳杆菌或双歧杆菌。在另一实施方式中,宿主细胞选自由格氏乳杆菌(如格氏乳杆菌dsm 14869)、鼠李糖乳杆菌(如鼠李糖乳杆菌dsm 14870)、副干酪乳杆菌、植物乳杆菌、嗜酸乳杆菌、发酵乳杆菌、卷曲乳杆菌、詹氏乳杆菌、阴道乳杆菌、惰性乳杆菌、罗伊氏乳杆菌、干酪乳杆菌、保加利亚乳杆菌、弯曲乳杆菌、德氏乳杆菌和约氏乳杆菌组成的组。在优选的实施方式中,宿主细胞是格氏乳杆菌(如格氏乳杆菌dsm 14869)。
120.在进一步方面,本发明提供了可通过本发明的方法获得的重组宿主细胞。在一个实施方式中,宿主细胞是乳杆菌或双歧杆菌。在另一实施方式中,宿主细胞是格氏乳杆菌(如格氏乳杆菌dsm 14869)。在另一实施方式中,宿主细胞是格氏乳杆菌(如格氏乳杆菌dsm 14869),其经工程化以表达选自由n506_1709、n506_1778、n506_0396、n506_0397、n506_0398、n506_0399、n506_0400、n506_0401、n506_0402、n506_0403、n506_0404、n506_0405、n506_0406、n506_0407、n506_0408、n506_0409、n506_0410和n506_0411组成的组的基因。在优选的实施方式中,所述格氏乳杆菌(如格氏乳杆菌dsm 14869)经工程化以表达n506_1709和/或n506_1778。
121.在一个实施方式中,所述基因的编码区可操作地连接至重组启动子,优选重组组成型启动子。
122.本发明的一个方面提供了本发明的环状dna载体用于将基因序列引入宿主细胞基因组中的用途。在一个实施方式中,环状dna载体的用途是用于增加宿主细胞的组织粘附,如用于增加细菌宿主细胞对阴道组织(优选人阴道组织)的组织粘附。宿主细胞优选为乳杆菌或双歧杆菌。在一个实施方式中,宿主细胞选自由格氏乳杆菌(如格氏乳杆菌dsm 14869)、鼠李糖乳杆菌(如鼠李糖乳杆菌dsm 14870)、副干酪乳杆菌、植物乳杆菌、嗜酸乳杆菌、发酵乳杆菌、卷曲乳杆菌、詹氏乳杆菌、阴道乳杆菌、惰性乳杆菌、罗伊氏乳杆菌、干酪乳杆菌、保加利亚乳杆菌、弯曲乳杆菌、德氏乳杆菌和约氏乳杆菌组成的组。
123.在一个实施方式中,环状dna载体的用途是用于引入靶区的缺失、靶区的部分缺失、靶区的序列插入、靶区的点突变或靶区的序列替换。
124.在一个实施方式中,环状dna载体的用途是用于靶向格氏乳杆菌(如格氏乳杆菌dsm 14869)宿主细胞中选自由n506_0396、n506_0397、n506_0398、n506_0399、n506_0400、n506_0401、n506_0402、n506_0403、n506_0404、n506_0405、n506_0406、n506_0407、n506_0408、n506_0409、n506_0410和n506_0411组成的组的靶基因。
125.在另一实施方式中,环状dna载体的用途是用于在所述宿主细胞中引入和表达所述基因序列。在又另一实施方式中,所述基因序列阻断内源宿主基因的表达。在进一步的实施方式中,所述基因序列替换相应的内源宿主基因。
126.在一个实施方式中,环状dna载体的用途是用于增加细菌宿主细胞的组织粘附,如增加细菌宿主细胞(如乳杆菌或双歧杆菌)对阴道组织(优选人类阴道组织)的组织粘附。在一个实施方式中,宿主细胞选自由格氏乳杆菌(如格氏乳杆菌dsm 14869)、鼠李糖乳杆菌(如鼠李糖乳杆菌dsm14870)、副干酪乳杆菌、植物乳杆菌、嗜酸乳杆菌、发酵乳杆菌、卷曲乳杆菌、詹氏乳杆菌、阴道乳杆菌、惰性乳杆菌、罗伊氏乳杆菌、干酪乳杆菌、保加利亚乳杆菌、
弯曲乳杆菌、德氏乳杆菌和约氏乳杆菌组成的组。
127.实施例
128.实施例1
129.提供了一种新的载体,它可以被有条件地破坏,以促进载体和染色体dna之间同源重组事件的选择。本质上,复制子和抗生素抗性基因被两个定向的six片段分开。在添加诱导子并表达位点特异性重组酶(β)后,由于复制子的切除,载体可重组并丧失功能(图1a)。这种称为诱导型质粒自毁(ipsd)的载体可用于协助细菌重组工程,包括基因缺失、插入和替换(图1b)。作为概念验证,基于β-six重组系统构建了ipsd质粒pintzrec(图2),其中β-重组酶基因受sakacin-诱导型启动子p
orfx
的控制。当将携带氯霉素抗性基因的质粒pintzrec引入到阴道益生菌菌株格氏乳杆菌dsm14869中时,pintzrec转化体显示出对sakacin p(sppip)诱导的显著敏感性。与非诱导对照相比,sppip-诱导的pintzrec转化体在补充有氯霉素的mrs琼脂板上的生存能力降低了三到四个数量级(图1c),表明质粒pintzrec在β-重组酶表达后被破坏。在其它乳酸菌物种(副干酪乳杆菌、嗜酸乳杆菌、植物乳杆菌)中也发现了这种观察结果(图4)。
130.发明人先前的工作表明,可能是由于覆盖细胞表面的eps厚度或存在两个常驻质粒(resident plasmid),格氏乳杆菌dsm 14869的转化效率非常低,因此,使用现有方法在该菌株中产生突变是不可能的(marcotte,h.et al.(2017)和未发表的数据)。为了证明格氏乳杆菌dsm 14869中ipsd辅助重组工程,我们靶向upp,一种编码通常用作反选择标志的尿嘧啶磷酸核糖基转移酶(uprtases)的非必需基因。构建了含有upp基因上下游同源区的重组质粒pintzrec-δupp,并导入格氏乳杆菌dsm 14869。转化体由sppip诱导,使用菌落pcr选择单交叉整合事件(图3a,图5a)。随机挑选的28个菌落中有10个(36%)显示没有质粒pintzrec-δupp,表明cmr表达盒通过单交叉事件整合到格氏乳杆菌dsm 14869的染色体中。这些结果通过对从分离克隆中提取的dna进行pcr进一步证实,六个克隆显示正确整合(图5b)。在没有抗生素的情况下单交叉克隆生长后,可以通过反选cms菌落或通过选择对5-氟尿嘧啶(5-fu)具有抗性的菌落来容易地选择双交叉upp突变体(图3b,图5c)。由于废除了5-fu转化为细胞毒性5-氟脱氧尿苷单磷酸酯(5-fdump),与亲本菌株相比,格氏乳杆菌dsm 14869upp突变体显示出对5-fu(100μg/ml)的抗性(图3c)。我们还基于该方法在格氏乳杆菌dsm 14869中生成了多个细胞表面特性相关基因的突变体以及广泛而有效的hiv-1-中和抗体的整合表达(未发表的数据)。这些结果表明ipsd质粒可以有效地用于乳杆菌中的基因组工程。
131.ipsd辅助细菌重组工程的主要优点是它不依赖于转化(或缀合)效率。然而,它需要两个先决条件:1)允许质粒在宿主细菌中复制的功能性复制子;2)用于驱动重组酶基因表达的严格受控的表达元件。由于强烈的背景表达(清酒乳杆菌(l.sakei)nc03)(图6a)或低诱导表达(鼠李糖乳杆菌gg)(图6b),本研究中使用的诱导型启动子在某些菌株中无效。因此,希望开发一种用于乳乳杆菌的通用严格受控的乳杆菌表达元件,如四环素调节系统。
132.总之,发明人已经表明,ipsd质粒可用于乳杆菌中的基因组工程,并有可能扩展到其它细菌物种。ipsd策略可用于食品和制药行业的一系列应用中,如益生菌基因的识别、代谢工程和疗法的递送,从而为具有增强健康促进功能特性的生物治疗剂的工程设计开辟了新途径。
133.方法
134.细菌菌株、质粒和生长条件
135.表1中列出了本项研究中使用的细菌菌株和质粒。通常在deman rogosa sharpe(mrs)培养基(difco,bd biosciences)中在37℃下培养乳杆菌菌株。对于基于upp的双交叉事件选择,使乳杆菌菌株在半限定培养基(sdm)琼脂板上生长(kimmel et al.)。大肠杆菌菌株在luria-bertani肉汤中于37℃下以200rpm的速度旋转摇动或在lb琼脂板上培养。需要时,按以下浓度补充抗生素:乳杆菌菌株和大肠杆菌ve7108菌株,10μg/ml氯霉素。
136.质粒构建
137.表2列出了本项研究中使用的引物。为构建用于乳杆菌重组工程的ipsd载体pintzrec,通过分别使用引物对six-f1&r1和six-f2&r2从位点特异性整合载体pem76扩增出两个six dna片段,并且在产生pnz8048-six的cmr表达盒的两侧插入到质粒pnz8048中。通过测序确认插入的方向。通过在psti和bglii之间插入接头以在pnz8048-six中引入多克隆位点,产生质粒pnzmcs-six。从质粒pem94扩增β-重组酶基因并且插入到质粒pvpl3017中在sakacin-诱导型启动子p
orfx
的下游,产生pvpl3017-rec。随后,使用sali和hindiii消化p
orfx-rec表达盒,并且插入到类似消化的pnzmcs-six质粒中,获得最终的质粒pintzrec。
138.为了构建用于格氏乳杆菌dsm 14869upp基因缺失的质粒,分别使用引物对upp-up-f/upp-up-r和upp-down-f/upp-down-r,从格氏乳杆菌dsm14869的基因组dna扩增upp基因的上游和下游的两个1090bp dna片段。通过ta克隆将上游dna片段插入到pmd19-t简单载体中,产生pmd19-upp-up,然后将下游dna片段插入到pmd19-upp-up在saci和sphi之间,产生pmd19-δupp。使用apai和sphi消化δupp并且插入到类似消化的pintzrec中,产生pintzrec-δupp。
139.转化
140.根据de keersmaecker et al,将质粒pintzrec和pintzrec-δupp电转化到格氏乳杆菌dsm 14869和其它乳杆菌菌株中。将质粒pnz8048用作对照。通过菌落pcr确认转化体,然后对从纯培养物中提取的dna进行pcr。
141.重组工程
142.在含有10μg/ml氯霉素的mrs肉汤中使具有质粒pintzrec或其衍生物的格氏乳杆菌dsm 14869的单个菌落生长过夜。将培养物接种到(1%,v/v)不具有抗生素的mrs肉汤中并且在37℃下生长直至od
600nm
达到约0.30,然后补充100ng/ml sakacin p(sppip)(genscript)。使培养物生长过夜,并且将系列稀释液接种在补充有10μg/ml氯霉素和100ng/ml sppip的mrs琼脂上。通过菌落pcr检测单交叉事件,然后对从纯培养物中提取的dna进行pcr。对于双交叉选择,单交叉克隆在没有抗生素的mrs肉汤中生长过夜,然后在补充了100μg/ml 5-氟尿嘧啶(5-fu)的mrs琼脂或sdm琼脂上散布连续稀释液。将来自mrs琼脂的菌落复制到含有10μg/ml氯霉素的mrs琼脂上,选择cms菌落并通过pcr检测提取的dna。
143.通过pcr和测序确认本研究中产生的所有突变体。
144.表1菌株和质粒。
[0145][0146][0147]
a kmr,卡那霉素抗性;cmr;氯霉素抗性;smr,壮观霉素抗性。
[0148]
表2本研究中使用的寡核苷酸
[0149][0150][0151]a限制位点带有下划线。
[0152]
实施例2
[0153]
乳杆菌在维持健康的阴道微生物群方面发挥着重要作用,并且一些选定的物种被广泛用作益生菌。先前选择了格氏乳杆菌dsm 14869和鼠李糖乳杆菌dsm 14870的阴道分离物以开发益生菌胶囊,并且已被证明对患有细菌性阴道病(bv)的女性有治疗作用。然而,它们的益生菌活性所涉及的分子基础和机制在很大程度上是未知的。在本研究中,我们通过构建专门的敲除突变体,我们在格氏乳杆菌dsm 14869中识别了促进粘附阴道
上皮细胞的三种细胞表面分子,包括胞外多糖(eps)、含有mucbp样结构域的蛋白质(n506_1778)和具有rib/α-样结构域重复的假定新粘附素(n506_1709)。与野生型相比,eps敲除突变体对caco-2和hela细胞的粘附分别增加了20倍和14倍,而突变对阴道细胞的粘附减少了30%,表明eps可能介导阴道细胞的组织趋向性。在n506_1778敲除突变体中观察到对caco-2、hela和阴道细胞的粘附显著降低。与wt相比,n506_1709突变体对caco-2和hela细胞的粘附未显示出显著差异;相比之下,对阴道细胞的粘附显著降低(42%),表明n506_1709可能介导与分层鳞状上皮细胞的特异性结合,这种假定的新粘附素被注释为乳杆菌阴道上皮细胞粘附素(lvea)。因此,本发明人首次发现了eps和新粘附素lvea在阴道益生菌乳杆菌菌株的粘附能力中的重要作用。
[0154]
已知乳杆菌有助于维持健康的阴道微生物群,并且一些被选为益生菌,用于预防或治疗泌尿生殖系统疾病,如细菌性阴道病。然而,人们对这些促进健康作用的分子机制知之甚少。此处,我们在功能上识别了可能参与与阴道上皮细胞粘附的格氏乳杆菌菌株的三种细胞表面因子,包括胞外多糖(eps)和两种分选酶依赖性蛋白(n506_1778和n506_1709)。本发明人首次证明了eps对阴道细胞的组织特异性粘附,并且n506_1709可能是一种新粘附素,其特异性地介导细菌与分层鳞状上皮细胞的结合。该结果为阴道乳杆菌粘附的分子机制提供了重要的新信息。
[0155]
引言
[0156]
健康女性的阴道微生物群通常以乳杆菌为主并且最常出现的物种是卷曲乳杆菌、格氏乳杆菌、詹氏乳杆菌、阴道乳杆菌和惰性乳杆菌(pendharkar et al.2013;ravel et al.2011;vasquez et al.2002)。这些细菌通过粘附在阴道上皮细胞(vec)上来维持正常的阴道微生物群,并防止致病生物的生长(ronnqvist et al.2006)。一旦局部微生物群的平衡被打破,就会使女性易患泌尿生殖系统感染,如细菌性阴道病(bv)(danielsson et al.2011)。提供选定的乳杆菌可能是恢复健康微生物群和预防感染的合理治疗策略(bolton et al.2008;reid et al.2009)。为了迎接这个挑战,先前已经开发了由从健康女性阴道上皮细胞分离的两种菌株(格氏乳杆菌dsm14869和鼠李糖乳杆菌dsm 14870,每种菌株为108cfu)组成的商业阴道胶囊,并且胶囊的阴道给药可以消除90%患者的bv症状(stray-pedersen et al.2003,未发表的数据)。使用阴道胶囊的补充治疗还可以有效提高抗生素治疗bv的疗效(larsson et al.2008;2011;pendharkar et al.2015)。尽管大量临床数据显示了菌株对人类的健康益处,但仍缺乏对其益生菌活性背后的细胞表面因素或分子机制的了解。
[0157]
胃肠道乳杆菌的研究表明,益生菌的健康促进作用可能与其粘附肠上皮细胞和/或粘液的能力有关,因为它可以促进定植、病原体排除和与宿主的相互作用(lebeer et al.2008;2010)。因此,对肠道表面的高粘附能力被认为是选择益生菌菌株的主要区别特征。细菌对宿主上皮表面的粘附通常由细胞表面成分介导,包括分选酶依赖性蛋白(sdp)和其它细胞表面分子,如胞外多糖(eps)、脂磷壁酸和s层蛋白(lebeer et al.2008)和细胞外附属物,如菌毛、伞毛和鞭毛(juge,2012)。
[0158]
eps显著促进乳杆菌-宿主相互作用,尤其是与肠粘膜和上皮细胞的相互作用,从而有助于菌株特异性益生菌特性(lebeer et al.,2008)。细菌多糖在糖组成、分支位置和
修饰方面各不相同,导致表面结构的广泛多样性(ruas-madiedo et al.2002)。已经报道eps参与了益生菌菌株的聚集、生物膜形成、粘附特性和免疫调节(lebeer et al.2009;dertli et al.2015;lee et al.2016;et al.2016)。
[0159]
sdp是革兰氏阳性菌中重要的一组细胞表面蛋白,其在乳杆菌中表现最好,并表明在细菌粘附中起关键作用(boekhorst et al.2005)。这些sdp具有共同的结构,包括促进分泌的ysirk信号肽(bae&schneewind,2003)、c末端lpxtg锚定基序、然后是跨膜螺旋和带正电荷的尾(lebeer et al.2008;jensen et al.2014)。表面蛋白前体转移到质膜后,会被分选酶a裂解并共价锚定在细胞壁上(marraffini et al.2006)。已在乳杆菌中识别出不同的sdp,包括鼠李糖乳杆菌gg中的粘液结合菌毛蛋白spac(kankainen et al.2009)、卷曲乳杆菌st1中的乳杆菌上皮粘附(lea)(edelman et al.2012)、罗伊氏乳杆菌atcc pta6475中的粘液结合蛋白a(cmba)(jensen et al.2014)和植物乳杆菌cmpg5300中的甘露糖特异性粘附素msi(malik et al.2016)。然而,到目前为止,在人类阴道乳杆菌中识别的sdp很少。
[0160]
在之前的研究中,发明人已经发现菌株显示出对阴道上皮细胞的高效粘附能力。我们还对这两种菌株进行了完整的基因组测序和表征,并发现了多个可能与细菌益生菌活性有关的基因(marcotte et al.2017)。特别是,在格氏乳杆菌dsm 14869中发现了厚(40nm)eps层和含有三个rib/α-样重复的推定新粘附素的产生(marcotte et al.2017)。在本研究中,发明人旨在表征介导对人类阴道粘膜粘附的格氏乳杆菌dsm 14869表面分子,包括eps、具有粘液结合样结构域的蛋白质(n506_1778)和具有rib/α-样重复结构域的推定新蛋白质(n506_1709)。结果表明,编码eps、n506_1778和n506_1709的基因有助于格氏乳杆菌dsm 14869在体外粘附阴道上皮细胞的能力。
[0161]
结果
[0162]
格氏乳杆菌dsm 14869中假定eps基因簇的识别。格氏乳杆菌dsm14869(marcotte et al.2017)的基因组具有假定的eps簇,其由与格氏乳杆菌atcc 33323(azcarate-peril et al.2008)共享高度相似度的16个基因(n506_0396至n506_0411)(图7a)组成。预计这些基因参与eps生物合成(图7a),包括编码糖基转移酶和参与聚合、输出和链长确定的蛋白质的那些(lebeer et al.2009)。基于blastp分析,n506_0400基因编码一种推定的引发糖基转移酶蛋白,与约氏乳杆菌fi9785中的引发糖基转移酶epse具有91%的氨基酸同源性(horn et al.2013)。已证明引发糖基转移酶是eps生物合成的必要控制点(horn et al.2013),并且我们由此假设推定的引发糖基转移酶基因(n506_0400)的缺失会影响格氏乳杆菌dsm 14869eps的产生。
[0163]
n506_0400基因的缺失影响eps的总水平。tem照片清楚地表明,与野生型(wt)菌株相比,n506_0400基因缺失突变菌株(δeps)在细胞表面周围产生显著(p《0.001)更少的eps层(图8)。同时,将功能性n506_0400基因重新引入突变菌株使eps层的厚度完全恢复至wt水平。
[0164]
缺失n506_0400基因导致自动聚集和生物膜形成增加。当在液体培养基中生长n506_0400突变菌株格氏乳杆菌dsm 14869-δn506_0400(δeps)时,与wt格氏乳杆菌dsm 14869相比,没有观察到生长率的显着差异(图14)。然而,突变体显示出细胞沉淀和非常清澈的上层溶液,而wt菌株显示出相对均匀的悬浮液(图9a)。补体菌株将表型恢复至wt水平,
显示出均质悬浮(图9a)。突变菌株格氏乳杆菌dsm 14869-δn506_0400还显示出自动聚集能力的显著增加(p《0.001),增加至wt的216%。补体菌株中的自动聚集恢复至136%(图9b)。此外,通过微量滴定生物膜测定评估,与wt相比,突变菌株的生物膜形成增加了15倍(p《0.001)(图9c)。补体部分地恢复了生物膜形成,与wt相比增加了8倍(图9c)。
[0165]
eps对格氏乳杆菌dsm 14869与不同上皮细胞的粘附的影响。先前的研究表明,来自肠道乳杆菌的eps参与了与肠上皮细胞的粘附(lebeer et al.2009;lee et al.2016;et al.2016)。在本研究中,我们研究了eps在阴道菌株格氏乳杆菌dsm 14869的粘附能力中的作用。如在图10a所观察到的,与wt菌株相比,eps突变格氏乳杆菌dsm14869-δn506_0400显示对结肠癌细胞系caco-2的粘附显著增加了20倍(p《0.001)。此外,eps突变体与宫颈癌细胞系hela的粘附也显示出大约14倍的显著增加(p《0.001)(图10b)。补充有pnze-n506_0400基因的突变菌株显示将对caco-2和hela细胞的粘附能力恢复至接近wt水平(图10a、b)。我们进一步研究了esp是否参与了对阴道上皮细胞的粘附。有趣地是,eps突变菌株显示出对阴道上皮细胞的粘附略有下降(约30%,(p《0.01)(图10c),而补体菌株(14869-δn506_0400/pnze-n506_0400)显示粘附的部分恢复(图10c)。这表明,格氏乳杆菌dsm 14869中的eps可以倡导对阴道上皮细胞的异异性组织趋向性。
[0166]
格氏乳杆菌dsm 14869中推定粘附蛋白的序列分析。表面蛋白是非常重要的分子,参与了细菌对粘液和上皮细胞的粘附。在格氏乳杆菌dsm14869的基因组中,之前已经识别了22个具有推定粘附相关结构域的预测orf(marcotte et al.2017)。然而,只有两个orf(n506_1778和n506_1709)编码ysirk-型信号肽(pf04650)和lp
x
tg锚定基序(pf00746),这将导致蛋白质分泌并共价锚定在细胞壁上(图7b、c)。因此,这两种蛋白质被归类为sdp,并且都可能参与格氏乳杆菌dsm 14869与上皮细胞的粘附。
[0167]
格氏乳杆菌dsm 14869中n506_1778基因的长度为5.055kb并且编码具有1684个氨基酸残基的蛋白质,预测分子量为186.7kd。n末端为ysirk-型信号肽并且c末端含有lpqtg(lp
x
tg-样细胞壁锚)基序,其属于革兰氏阳性lp
x
tg锚定超家族。n506_1778蛋白也含有显示出66%氨基酸同一性的2个不同的重复(氨基酸986-1092和1384-1490)(图7b)。所述两个重复显示出与mucbp(粘蛋白结合蛋白)(pf06458)结构域的低同源性,与来自罗伊氏乳杆菌(l.reuteri)atcc 53608(etzold et al.2014)的粘液结合蛋白(mub)的mub-rv重复具有35%-39%aa同一性、与来自罗伊氏乳杆菌1063(mackenzie et al.2009)的mub的mub1重复具有31-37%aa同一性并且与来自嗜酸乳杆菌ncfm的蛋白lba1460的mucbp结构域(片段187-294)具有36%-42%aa同一性。已在天然位于肠道生态位中的乳杆菌中识别出许多mub同源物和含有mucbp结构域的蛋白质,并且已经表明在益生菌菌株粘附于肠粘蛋白(ossowski et al.2011;etzold et al.2014;jensen et al.2014)和上皮细胞(call and klaenhammer,2013;jensen et al.2014)方面发挥重要作用。在本研究中,我们发现n506_1778及其同源物也存在于天然位于阴道生态位中的乳杆菌中。随后我们比较了所有10种已知格氏乳杆菌基因组(7种菌株来自人类阴道)中蛋白n506_1778的同源物(表3)。有趣地是,发现所有已知的格氏乳杆菌基因组均含有n506_1778同源物,aa同一性为79-98%(表3)。与格氏乳杆菌物种中其它同源蛋白的高相似性表明,n506_1778可能对该物种适应不同的宿主生态位发挥重要作用。因此,双交叉重组用于敲除基因n506_1778,并评估了突变体对不同上皮细胞的粘附能力。
[0168]
表3
[0169]
n506_1778与格氏乳杆菌中其它基因的同源性
[0170][0171][0172]
格氏乳杆菌dsm 14869中的n506_1709基因由4.371kb序列组成,其编码预测分子量为158.9kd的1456个氨基酸的大表面蛋白。这种蛋白包含ysirk信号肽、n-末端区域(氨基酸42至1233)、内部重复区域(氨基酸892至1372)和c-末端的lpqtg锚定基序,所述内部重复区域包含三个重复(第一个是部分重复),其在pfam分析中显示出与rib/α-样重复结构域(pf08428)的相似性(图7c)。blastp分析后,发明人发现n506_1709与来自格氏乳杆菌ljcm1025的假设蛋白(ljcm1025_14810)具有高序列同一性(99%),但与数据库中的其它蛋白的同一性低于10%。最后600个aa,含有rib/α-样重复区域,显示出与来自约氏乳杆菌和格氏乳杆菌的表面蛋白具有34%-48%的aa同一性(图7c)。在乳杆菌的多种细胞表面蛋白
中也发现了rib/α-样重复结构域,这表明具有该结构域的蛋白质可能促进细菌对分层鳞状上皮细胞的粘附(edelman et al.2012;stalhammar-carlemalm et al.1999)。由于n506_1709的蛋白质序列特征表明它可能是一种新的推定粘附蛋白,促进格氏乳杆菌dsm14869与阴道上皮细胞的结合,因此通过双交叉重组缺失了该编码基因。
[0173]
n506_1778和n506_1709敲除突变体的构建。如图11a、b所示,在n506_1778和n506_1709突变体中,没有表达基因n506_1778和n506_1709的mrna,而互补菌株中相应基因的mrna表达水平恢复至野生型。结果表明,成功地从格氏乳杆菌dsm14869的基因组中缺失了基因n506_1778和n506_1709。
[0174]
n506_1778介导的格氏乳杆菌dsm 14869与caco-2、hela和人类阴道细胞的结合。
[0175]
在本研究中使用的生长条件下未改变n506_1778突变菌株的生长速率(图14)。通过在体外评价了突变体粘附caco-2、hela和阴道上皮细胞的能力来确宝了n506_1778突变的效果。如图12a-c所示,与野生型菌株相比,n506_1778的突变导致对caco-2(42%,p《0.01)、hela(32%,p《0.001)和人类阴道细胞(32%,p《0.01)的粘附显著降低。用pnze-n506_1778的互补恢复了对阴道细胞的野生型水平粘附能力(图12c)。这些结果表明,n506_1778是一种重要的细胞表面蛋白,参与格氏乳杆菌dsm 14869对不同宿主上皮细胞的粘附。
[0176]
n506_1709介导的格氏乳杆菌dsm 14869与人类阴道细胞而不是与caco-2和hela细胞的结合。为了确定n506_1709对细菌粘附的贡献,构建了n506_1709敲除突变体。突变菌株显示出与野生型相同的生长速率(图14)。首先评估该突变体对柱状上皮细胞系caco-2和hela的粘附。如图6a、b的所示,与野生型菌株相比,n506_1709突变菌株格氏乳杆菌dsm 14869-δn506_1709对caco-2和hela细胞的粘附没有显示出显著差异。由于n506_1709包括rib/α-样重复结构域,已表明其参与与分层鳞状上皮细胞的结合(edelman et al.2012),发明人随后研究了n506_1709是否在粘附于人类阴道细胞(一种分层的鳞状上皮细胞)中起作用。如图12c所示,与野生型相比,n506_1709突变体显示在与人类阴道细胞的粘附能力方面有显著下降了约42%(p《0.001)。为了确认n506_1709基因的基因型-表型的关系,随后通过重新引入n506_1709基因来补充突变菌株。补体菌株格氏乳杆菌dsm 14869-δn506_1709/pnz8048-n506_1709显示部分恢复了粘附水平(图12c),表明n506_1709介导对阴道分层鳞状上皮细胞的组织特异性粘附。
[0177]
乳酸乳球菌nz9000中n506_1709的过表达增加对阴道上皮细胞的粘附。为了确认n506_1709的组织特异性粘附,使用pnz8048载体及其乳链菌肽诱导型表达系统在乳酸乳球菌nz9000中过表达蛋白n506_1709。将使用空质粒pnz8048转化的乳酸乳球菌nz9000用作对照。在乳酸乳球菌nz9000中乳链菌肽诱导n506_1709表达后,与对照相比,过表达菌株显示mrna转录增加了5000倍(图13a)。此外,过表达菌株对阴道细胞的粘附能力也增加了2.8倍(p《0.001)(图13b),确认了n506_1709在格氏乳杆菌dsm 14869与人类阴道上皮结合的粘附能力中起作用。
[0178]
讨论
[0179]
格氏乳杆菌是阴道微生物群中分离的主要物种之一(pendharkar et al.2013;ravel et al.2011),并且已经报告了格氏乳杆菌菌株中的多种健康益处(marcotte et al.2017;parolin et al.2015)。然而,促进健康作用的分子机制,如使乳杆菌最佳粘附到这一生态位的粘附因子,总体上还没有得到很好的理解。在本研究中,我们在遗传上识别并
在功能上分析了可能与益生菌菌株格氏乳杆菌dsm 14869粘附到阴道上皮细胞上的三个基因。
[0180]
首先,通过编码推定引发糖基转移酶的n506_0400基因的突变来评价了格氏乳杆菌dsm 14869中所识别的eps基因簇的功能。据文献报道,编码引发糖基转移酶的基因是高度保守的(jolly and stingele,2001)并且引发糖基转移酶通过将第一糖转移到undp-脂质载体,在eps生物合成的第一步中发挥重要作用(lebeer et al.2009)。约氏乳杆菌、鼠李糖乳杆菌或副干酪乳杆菌的编码引发糖基转移酶的基因的突变消除或减少了杂多糖的产生(lebeer et al.2009;horn et al.2012;et al.2016)。在本研究中,与野生型相比,n506_0400突变菌株的自动聚集能力增加和表面相关多糖的表达降低也指示了引发半乳糖基转移酶n506_0400在格氏乳杆菌dsm 14869的eps生物合成中的关键作用。同时,当在mrs培养基中生长时,格氏乳杆菌dsm 14869的eps突变体显示生物膜形成的显著增加,而补体菌株将生物膜形成能力部分恢复至野生型(图9c)。生物膜形成被认为是益生菌的重要表面特性之一,涉及它们对宿主的有益影响(younes et al.2012;jones&versalovic,2009)。这表明,生物膜形成的能力可能与分选酶a依赖性蛋白有关(sdp)。例如,鼠李糖乳杆菌gg的eps突变体显示生物膜形成大幅增加,推测这是由于去除eps后暴露更多细胞表面粘附素引起的(lebeer et al.2009;lebeer et al.2012)。malik et al.(2013)也报道,阴道植物乳杆菌cmpg 5300菌株中生物膜形成可能是由于sdp所致,因为该菌株的srta突变体失去了其生物膜形成能力。因此,在本研究中,eps突变菌株的生物膜形成能力增加也可能是由于暴露的sdp。
[0181]
此外,使用caco-2、hela和阴道上皮细胞研究了eps对粘附的作用。eps突变体显著增加结肠癌细胞caco-2和hela宫颈癌细胞的粘附能力,但对阴道上皮细胞的粘附能力略有降低。对caco-2和hela的粘附增加可能归因于因为没有eps导致粘附素更好地暴露。这些数据与鼠李糖乳杆菌gg的研究一致,表明剥夺富含半乳糖的eps增加了对caco-2细胞的粘附,这可能是因为粘附素的暴露增加(lebeer et al.2009)并且关于鼠李糖乳杆菌gg菌毛的特定粘附特性的附加研究证实了这种“屏蔽假说”(lebeer et al.2012)。在约氏乳杆菌ncc533(denou et al.2008)、鼠李糖乳杆菌e/n(polak-berecka et al.2014)和植物乳杆菌lp90菌株(lee et al.2016)中也报道了类似结果。然而,eps突变体对阴道上皮细胞的粘附能力略有下降(30%),表明eps可能促进了格氏乳杆菌dsm 14869对阴道上皮细胞的粘附。eps对粘附的作用是菌株特异性的,并且可能与eps结构特性的差异以及菌株的细胞表面特性有关。例如,植物乳杆菌菌株wcfs1和sf2a35b中cps族的突变对caco-2细胞的粘附无显著影响(lee et al.2016)。et al.(2016)报道,eps-sj p2的存在增加了对caco-2细胞的粘附,这可能归因于eps-sj p2基质的分子结构。因此,通过eps的格氏乳杆菌dsm14869对阴道细胞粘附的特异性增加,可能是由于与caco-2和hela细胞相比,eps的分子结构不同或阴道细胞中的受体不同。eps如何促进细菌对阴道细胞的粘附需要进一步研究。据我们所知,这是第一份证明阴道乳杆菌的eps可提供组织趋向性粘附的报告。这将有助于更好地了解其在益生菌-宿主相互作用中的具体贡献及其在适应这种阴道生态位中的作用。
[0182]
一些乳杆菌对肠粘膜层的粘附增加已被认为是由具有粘液结合能力的细胞表面
蛋白介导的(kankainen et al.2009;rojas et al.2002;ossowski et al.2011;jensen et al.2014)。包含与mucbp结构域具有同源性的2个重复的n506_1778蛋白是唯一预测的细胞壁锚定蛋白,其包括格氏乳杆菌dsm14869中的mucbp-样结构域。我们的结果表明,n506_1778蛋白可以促进格氏乳杆菌dsm 14869对caco-2、hela和人类阴道上皮细胞的粘附。在从不同生态位分离出的已知格氏乳杆菌菌株中均发现了n506_1778同源物(表3),表明n506_1778是格氏乳杆菌物种适应不同宿主生态位的重要细胞表面蛋白。这是首次报道具有mucbp-样结构域的蛋白质也参与对阴道上皮细胞的粘附。
[0183]
n506_1709是介导格氏乳杆菌dsm 14869对阴道粘膜细胞的粘附的另一种重要细胞表面蛋白。它是一种新描述的分选酶依赖性粘附素,显示出与分层鳞状上皮细胞的特异性结合。有趣的是,n506_1709不同于先前表征的乳杆菌粘附素,如lsp、mub和粘液结合因子(mbf)(walter et al.2005;buck et al.2005;von ossowski et al.2011),因为它不含mubp结构域,而是含有三个与rib/α-样重复序列同源的重复区域。rib和α蛋白首先在链球菌中识别到并且被认为参与病原体粘附和生物膜形成(michel et al.1992;et al.1996;
–
carlemalm et al.1999)。随后,在阴道乳杆菌中也报道了与rib/α-样重复具有同源性的蛋白质,如发酵乳杆菌中的蛋白rlp和卷曲乳杆菌中的lea(turner et al.2003;edelman et al.2012)。认为这些在乳杆菌中具有rib/α-样重复结构域的蛋白质介导与宿主分层鳞状上皮衬里的结合(edelman et al.2012;turner et al.2003)。在本研究中,n506_1709突变体显示出对阴道上皮细胞(分层鳞状上皮细胞)的粘附能力显著降低,但对结肠癌细胞和宫颈癌细胞(柱状上皮细胞)的粘附能力没有降低。这表明,n506_1709蛋白提供了对格氏乳杆菌dsm 14869的组织趋向性,可能是由在阴道上皮细胞的细胞膜上存在不同受体决定的。乳酸乳球菌中n506_1709的过表达显著改善了乳酸乳球菌对阴道上皮细胞的粘附,进一步确认了n506_1709对阴道上皮细胞的粘附能力。综合来看,n506_1709是一种介导格氏乳杆菌对人阴道上皮的粘附的重要表面蛋白,其可以促进宿主中的细菌定植,并且可能具有生态重要性。
[0184]
总之,本报告识别并功能上分析了三种细胞表面分子,包括eps、n506_1778和n506_1709,作为格氏乳杆菌dsm 14869参与阴道粘附的重要粘附因子。据我们所知,这是第一份证明eps在阴道乳杆菌菌株粘附中的作用的报告,并且具有mucbp-样结构域的蛋白质也可能参与阴道上皮粘附。此外,n506_1709可能是一种特异性介导细胞与分层鳞状上皮细胞结合的新粘附素,并且标注为乳杆菌阴道上皮粘附素(lvea)。该结果为乳杆菌粘附和组织趋向各种宿主粘膜表面的分子机制提供了重要的新信息,并有助于我们在未来筛选更好的益生菌候选物。仍然需要进一步的研究来解决阴道上皮细胞上eps和lvea的特异性受体以及lvea的功能结构域。
[0185]
材料和方法
[0186]
细菌菌株、质粒和生长条件。表4中列出了本研究中使用的细菌菌株和质粒。
[0187]
表4本研究中使用的细菌菌株和质粒
[0188]
[0189][0190]
a kmr,卡那霉素抗性;cmr,氯霉素抗性;emr,红霉素抗性。
[0191]
使用摇动在37℃下在补充有25μg ml-1
卡那霉素的luria肉汤中培养大肠杆菌ve7108(mora et al.2004)菌株。乳酸菌菌株在37℃厌氧条件下在mrs肉汤中静态生长。当需要时,添加下列抗生素:大肠杆菌,10μgml-1
氯霉素(cm)和300μg ml-1
红霉素(em);乳杆菌转化体,10μg ml-1
cm和5μg ml-1
em。
[0192]
dna操作.将标准dna协议用于大肠杆菌中的dna操作(sambrook et al.1989)。使用qiagen miniprep spin试剂盒(qiagen,hilden,germany)提取大肠杆菌的质粒dna。使用qiaamp dna stool mini试剂盒(qiagen,hilden,germany)分离格氏乳杆菌dna。引物(表5)由eurofins genomics(ebersberg,germany)合成。将phusion高保真dna聚合酶(finnzymes/thermo fisher scientific,espoo,finland)用于格氏乳杆菌基因组dna的扩增,并且将gotaq dna聚合酶(promega,fitchburg,wi,usa)用于菌落pcr。通过qiaquick凝胶提取试剂盒(qiagen,hilden,germany)纯化pcr产物。限制性内切酶由thermo scientific供应并且t4 dna连接酶来自invitrogen(carlsbad,ca)。所有程序均根据制造商的说明进行。按先前的描述,通过电穿孔将质粒转化到格氏乳杆菌dsm 14869中(de keersmaecker et al.2006)。
[0193]
表5本研究中使用的引物列表
[0194]
[0195]
[0196][0197]a限制位点在引物序列中加下划线。
[0198]
通过双同源重组构建eps(n506_0400)、n506_1778和n506_1709敲除突变体。在本研究中,将可复制质粒pintzrec(未发表数据)(图15a)用于介导同源重组。这种质粒包括两个six位点和β-重组酶,该β-重组酶特异性催化在抗生素抗性基因侧翼的两个six位点和要整合的dna之间的重组。β-重组酶的表达受sakacin-诱导型启动子的控制。为了从格氏乳杆菌dsm 14869的基因组缺失n506_0400基因,分别使用引物400上游-f/r和400下游-f/r通过pcr扩增n506_0400基因的5'和3'端侧翼的约1.0kb上游-和下游片段(表5)。使用引物对400上游-f/下游-r通过重叠延伸策略将生成的扩增子连接(表5)。使用sac i和nhe i消化所得的pcr产物,并且连接到类似消化的pintzrec质粒中并且转化到电感受态大肠杆菌ve7108中以获得最终的质粒构建体pintzrec-n506_0400中。然后将pintzrec-n506_0400电转化至根据de keersmaecker et al.(2006)制备的感受态格氏乳杆菌dsm 14869细胞中。为了重组活化的基因表达,使用sakacin诱导β-重组酶基因表达。简言之,将转化的格氏乳杆菌菌株接种到mrs培养基中并且将生长达到od
600
约0.5时,添加100ng ml-1
sakacin进行过夜诱导。将诱导的培养物的系列稀释液接种到mrs琼脂板(具有10μg ml-1
cm和100ng ml-1
sakacin)并且厌氧生长48h。为了获得已经切除的可复制质粒和单交叉整合,选择具有cm基因且没有repa基因的单个菌落,并使用seq1-f/intz-r和intz-f/seq1-r引物通过pcr进一步确认(表5)。使单交叉菌株在不含抗生素的3ml mrs培养基中生长,并在2天内每天进行两次继代培养。随后,将细菌培养物稀释并接种到不含抗生素的mrs平板上48小时以获得单
菌落分离物,然后将这些菌落复制接种到具有10μg ml-1
cm的mrs平板上。通过特异性引物seq1-f/seq1-r检查了非抗生素抗性菌落以获得n506_0400基因缺失菌株,格氏乳杆菌dsm14869-δn506_0400。
[0199]
为了从格氏乳杆菌dsm 14869的基因组缺失n506_1778和n506_1709基因,使用相同的eps敲除方法。简言之,分别使用引物1778上游-f/r和1778下游-f/r以及1709上游-f/r和1709下游-f/r,通过pcr扩增在n506_1778基因和n506_1709基因的5'和3'端侧翼的约1.0kb上游-和下游片段。使用引物对1778上游-f/下游-r和1709上游-f/下游-r通过重叠延伸策略将生成的扩增子连接(表5)。使用sac i和bam hi消化所得的pcr产物,连接到类似消化的pintzrec质粒中并且转化到大肠杆菌ve7108,以获得质粒构建pintzrec-n506_1778和pintzrec-n506_1709。分别将质粒pintzrec-n506_1778和pintzrec-n506_1709电转化至dsm14869中,并且通过sakacin诱导转化的菌株。对n506_1778使用seq2-f/intz-r和intz-f/seq2-r引物,并且对n506_1709使用seq3-f/intz-r和intz-f/seq3-r引物,通过pcr筛选单交叉整合菌落。最后,通过特异引物seq2-f/seq2-r检查双交叉整合菌株以获得称为格氏乳杆菌dsm14869-δn506_1778的n506_1778基因缺失菌株,并通过特异引物seq3-f/seq3-r检查双交叉整合菌株以获得称为格氏乳杆菌dsm14869-δn506_1709的n506_1709基因缺失菌株。
[0200]
互补:质粒构建和转化。将质粒pnze-rec用作起始材料以实现菌株格氏乳杆菌dsm 14869-δn506_0400中n506_0400基因的互补所需的质粒。基因n506_0400没有自己的启动子;其共享eps操纵子的启动子。因此,使用引物eps-启动子-f/r扩增eps基因簇的启动子(表5)并且使用引物n506_0400-f/r扩增n506_0400基因。使用引物对eps-启动子-f/n506_0400-r通过重叠延伸将启动子和n506_0400基因连接,然后使用kpn i和hin diii消化并且连接到类似消化的pnze-rec中,产生pnze-n506_0400。将质粒pnze-n506_0400电穿孔到格氏乳杆菌dsm14869-δn506_0400中以产生em-敏感性菌株,格氏乳杆菌dsm14869-δn506_0400/pnze-n506_0400。
[0201]
将质粒pnze-n506_0400用于互补菌株格氏乳杆菌dsm14869-δn506_1778中的基因n506_1778。使用特异引物n506_1778-f/r通过pcr扩增基因n506_1778及其启动子。pcr产物用kpn i和bam hi消化并且连接到使用kpn i和bgl ii(bam hi和bgl ii是同尾酶)消化的pnze-n506_0400中,产生pnze-n506_1778。将质粒pnze-n506_1778电穿孔到格氏乳杆菌dsm 14869-δn506_1778中以得到em-敏感性菌株,格氏乳杆菌dsm 14869-δn506_1778/pnze-n506_1778。
[0202]
将质粒pnz8048用于互补菌株格氏乳杆菌dsm 14869-δn506_1709中的基因n506_1709。将n506_1709基因分两步连接到pnz8048。首先,使用引物n506_1709-f1/r1扩增基因n506_1709(约2kb)及其启动子的第一部分。pcr产物用bgl ii和kpn i消化并且连接到类似消化的pnz8048,产生质粒pnz8048-n506_1709-1。然后,使用引物n506_1709-f2/r2扩增基因n506_1709的第二部分(约2.3kb)并且使用kpn i和sac i消化,连接到类似消化的pnz8048-n506_1709-1中,产生pnz8048-n506_1709。将质粒pnz8048-n506_1709电穿孔到格氏乳杆菌dsm14869-δn506_1709中,得到cm-敏感性菌株,格氏乳杆菌dsm14869-δn506_1709/pnz8048-n506_1709。
[0203]
乳酸乳球菌nz9000中n506_1709的过表达构建体的构建。为了在乳酸乳球菌中异
7.4)将从18h培养物中收获的格氏乳杆菌dsm 14869洗涤两次并且重悬于dmem培养基中以获得5
×
107cfu ml-1
的最终浓度。在过表达粘附测定中,将乳酸乳球菌菌株接种至od
600
约0.5并且使用10ng ml-1
乳酸链球菌素(50iu ml-1
,sigma)诱导1.5h。然后如上所述收获诱导的培养物。
[0211]
将等体积(400μl)的阴道上皮细胞和乳杆菌或乳酸乳球菌混合并且在37℃下温育2h。温育后,将细胞用pbs洗涤5次以去除非粘附细菌。最后一次离心后,将细胞团粒转移到显微镜载玻片上,干燥,用甲醇固定并用0.1%结晶紫染色。每个样品做三个重复,并且使用光学显微镜在油浸下检查从每个重复中随机选择的100个细胞,结果表示为每个细胞的细菌数。将未使用乳杆菌或乳酸乳球菌温育的vec包括为阴性对照。
[0212]
统计分析。数据表示为平均值
±
sd。使用spss 20通过单向方差分析(anova),之后通过邓肯检测程序,确定了平均值之间的显著差异(p《0.05)。所有实验进行一式三份并重复三次。
[0213]
参考文献
[0214]
1.turroni,f.et al.molecular dialogue between the humsn gut microbiota and the host:a lactobacillus and bifidobacterium perspective.cell.mol.life sci.71,183-203(2014).
[0215]
2.cano-garrido,o.,seras-franzoso,j.&garcia-fruit
ó
s,e.lactic acid bacteria:reviewing the potential of a promising deliverylive vector for biomedical purposes.microb.cell fact.,14,137(2015)
[0216]
3.fukiya,s.,sakanaka,m.&yokota,a.genetic manipulation and gene modification technologies in bifidobacteria.the bifidobacteria and related organismns:biology,taxonomy,applications.chapter 15,243-259(2018).
[0217]
4.biswas,l.,gruss,a.,ehrlich,s.d.&maguin,e,high-efficiency gene inactivation and replacement system for gram-positive bacteria.j.bacteriol.175,3628-3635(1993).
[0218]
5.canosa,l.,lurz,r.,rojo,f.&alonso,j.c.β recombinase catalyzes inversion and resolution between two inversely oriented six sites on a supercoiled dna substrate and only inversion on relaxed or linear substrates.j.biol.chem.273,13886-13891(1998)
[0219]
6.marcotte,h.et al.characterization and complete genome sequences of l.rhamnosus dsm 14870 and l.gasseri dsm 14869 contained in the probiotic vaginal capsules.microbiol.res.205,88-98(2017).
[0220]
7.goh,y.j.et al.development and application of a upp-based counterselecttive gene replacement system for tne study of the s-layer protein slpx of lactobacillus acidophilus ncfm.appl.environ.microbiol.75,3093-3105(2009).
[0221]
8.lim,b.,zimmermann,m.,barry,n.a.&goodman,a.l.engineered regulatory systerns modulate gene expression of human commensals in the gut,cell 169,547-558e15(2017).
[0222]
9.kr
ü
ger,c.et al.in situ delivery of passive immunity by lactobacilli producing singe-chain antibodies.nat.biotechnol,20,702-706(2002).
[0223]
10.okano,k.et al.metabolic engineering 0f lactobacillus plantarum for direct l-lactic acid production from raw corn starch.biotechnol.j.13,e1700517(2018).
[0224]
11.hidalgo-cantabrana.c.et al.a single mutation in the gene responsible for the mucoid phenotype of bifidobacterium animalis subsp.lactis confers surfaca and functional characteristics.appl.environ.microbiol.81,7960-7968(2015).
[0225]
12.kimmel,s.a.,roberts,r.f.,&ziegler,g.r.optimization of exopolysaccharide production by lactobacillus delbrueckiii subsp,bulgancus rr grown in a semidefined medium.appl.environ.microbiol.64,659-664(1998).
[0226]
13.de keersmaecker,s.c.j.et al.flow cytometric testing of green fluorescent protein-tagged lactobacillus rhamnosus gg for response to defensins.appl.environ.microbiol,72,4932-4930(2006).
[0227]
alvarez b,krogh-andersen k,tellgren-roth c,martinez n,gunaydin g,lin y,martin mc,alvarez ma,hammarstrom l,marcotte h,2015.an eps-deficient mutant of lactobacillus rhamnosus gg efficiently displays a protectivellama antibody fragment against rotavirus on its surface.appl environ microbiol 81:5784-5793.
[0228]
azcarate-peril ma,altermann e,goh yj,tallon r,sanozky-dawes rb,pfeiler ea,o
′
flaherty s,buck bl,dobson a,duong t,miller mj,barrangou r,klaenhammer tr.2008.analysis of the genome sequence of lactobacillus gasseri atcc 33323 reveals the molecular basis of an autochthonous intestinal organism.appl environ microbiol 74:4610-4625.
[0229]
bae t,schneewind o.2003.the ysirk-g/s motif of staphylococcal protein a and its role in efficiency of signal peptide processing.j bacteriol 185:2910-2919.
[0230]
boekhorst j,de been mwhj,kleerebezem m,siezen rj.2005.genome-wide detection and analysis of cell wall-bound proteins wth lpxtg-like sorting motifs.j bacteriol 187:4928-4934.
[0231]
bolton m,van der straten a,cohan cr.2008.probiotics:potential to prevent hiv and sexually transmitted infections in women.sex transm dis 35:214-225.
[0232]
buck bl,altermann e,svingerud t,klaenhammer tr.2005.functional analysis of putative adhesion factors in lactobacillus acidophilus ncfm.appl environ microbiol 71:8344-8351,
[0233]
call ek,klaenhammer tr.2013.relevance and application of sortase and sortase-dependent proteins in lactic acid bacteri,a.front microbiol 4∶73.
pili containing a human-mucus binding protein.proc natl acad sci u s a 106:17193-17198.
[0246]
de keersmaecker scj,braekan k,verhoeven tla,ve
′
lez mp,lebeer s,vanderleyden j,hols p.2006.flow cytometric testing of green fluorescent protein-tagged lactobacillus rhamnosus gg for response to defensins.appl environ microbiol72:4923-4930.
[0247]
kuipers op,de ruyter pg,kleerebezem m,de vos wm.1998.quorum sensing-controlled gene expression in lactic acid bacteria.j biotechnol 64:15-21.
[0248]
larsson pg,brandsborg e,forsum u,pendharkar s,andersen kk,nasic s,hammarstrom l,marcotte h.2011.extended antimicrobial treatment of bacterial vaginosis combined with human lactobacilli to find the best treatment and minimize the risk of relapses.bmc infect dis 11:223.
[0249]
larsson pg,stray-pedersen b,ryttig kr,larsen s.2008.human lactobacilli as supplementation of clindamycin to patients with bacterial vaginosis reduce the recurrence rate;a 6-month,double-blind,randomized,placebo-controlled study.bmc womens health 8∶3.
[0250]
lebeer s,claes l,tytgat hl,verhoeven tl,marien e,von ossowski l,reunanen j,palva a,vos wm,keersmaecker sc,vanderleyden j.2012.functional analysis of lactobacillus rhamnosus gg piliin relation to adhesion and immunomodulatory interactions with intestinal epithelial cells.appl environ microbiol 78:185-193.
[0251]
lebeer s,vanderleyden j,de keersmaecker scj.2008.genes and molecules of lactobacilli supporting probiotic action.microbid mol biol rev 72:728-764.
[0252]
lebeer s,vanderleyden j,de keersmaecker scj.2010.host interactions of probiotic bacterial surface molecules:comparison with commensals and pathogens.nat rev microbiol8:171-184.
[0253]
lebeer s,verhoeven tla,francius g,schoofs g,lambrichts l,dufrene y,vanderleyden j,de keersmaecker scj.2009.identification of a gene cluster for the biosynthesis of a long,galactose-rich exopolysaccharide in lactobacillus rhamnosus gg and functional analysis of the priming glycosyltransfierase.appl environ microbiol 753554-3563
[0254]
lebear s,verhoeven tla,ve
′
lez mp,vanderleyden j,de keersmaecker scj.2007.impact of environmental and genetic factors on biofflm formation by the probiotic strain lactobacillus rhamnosus gg.appl eviron microb 73:6768-6775.
[0255]
leccese terraf mc,mendoza1 lm,ju
á
rez tom
á
s ms,silva c,nader-macias mef.2014.phenotypic surface properties(aggregation,adhesion and biofilm formation)and presence of related genes in beneficial vaginal lactobacilli.j appl microbiol 117:1761-1772.
[0256]
lee i-c,caggianiello g,van swam ll,taverne n,meijerink m,bron pa,spano g,kleerebezema m.2016.strain-specific features of extracellular polysaccharides and their impact on lactobacillus plantarum-hostinteractions.appl eviron microbiol 82:3959-3970.
[0257]
mackenzie da,tailford le,hemmings am,juge n.2009.crystal structure of a mucus-binding protein repeat reveals an unexpected functional immunoglobulin binding activity.j biol chem 284:32444-32453.
[0258]
malik s,petrova ml,claes ijj,verhoeven tla,busschaert p,vaneechoutte m,lievens b,lambrichts i,siezen rj,balzarini j,vanderleyden j,lebeer s.2013.the high auto-aggregative and adhesive phenotype of the vaginal lactobecillus plantarum strain cmpg5300 is sortase
‑‑
dependent.appl environ microbiol 79:4576-4585.
[0259]
malik s,petrova mi,imholz nce,verhoeven tla,noppen s,van damme ejm,liekens s,balzarini j,schols d,vanderleyden j,lebeer s.2016.high mannose-specific lectin msl mediates key interactions of the vaginal lactobacillus plantarum isolate cmpg5300,sci rep6∶37339.
[0260]
marcotte h,andersen kk,lin y,zuo fl,zeng z,larsson pg,brandsborg e,g,l.2017.characterization and complete genome sequences of l.rhamnosus dsm 14870and l.gasseri dsm 14869contained in the probiotic vaginal capsules,microbiol res 205:88-98,
[0261]
marraffini la,dedent ac,schneewind o.2006.sortases and the art of anchoring proteins to the envelopes of gram-positive bacteria.microbiol mol biol rev 70:192-221.
[0262]
michel jl,madoff lc,olson k,kling de,kasper dl,ausubel fm.1992.large,identical,tandem repeating units in the c protein alpha antigen gene,bca,of group b streptococci,proc natl acad sci u sa 89:10060-10064.
[0263]
mora d,maguin e,masiero m,parini c,ricci g,manachini pl,daffonchio d.2004.characterization of urease genes cluster of streptococcus thermophilus.j appl microbiol 96:209-219.
[0264]
von ossowski l,satokari r,reunanen j,lebeer s,de keersmaecker sc,vanderleyden j,de vos wm,palva a.2011.furnctional characterization of a mucus-specific lpxtg surface adhesin from probiotic lactobacillus rhamnosus gg.appl environ microbiol 77:4465
‑‑
4472.
[0265]
parolin c,marangoni a,laghi l,foschi c,nahui palomino ra,calonghi n,cevenini r,vitali b.2015.lsolation of vaginal lactobecilli and characterization of anti-candida activity,plos one 10:e0131220.
[0266]
pendharkar s,brandsborg e,hammarstrom l,marcotte h,larsson pg.2015.vaginal colonization by probiotic lactobacilli and clinical outcome in women conventionally treated for bacterial vaginosis and yeast infection,
performance of lactobacillus reuteri in the murine gut.appl environ microbiol 71∶979-986.
[0280]
m,-carlemalm m,delisse a-m,cabezon t,lindahl g.1996.ldentification of a family of streptococcal surface proteins with extremely repetitive structure.j biol chem 271:18892-18897.
[0281]
younes ja,van der mei hc,van den heuvel e,busscher hj,reid g.2012.adhesion forces and coaggregation between vaginal staphylococci and lactobacilli.plos one 7:e36917.
[0282]
m,ms,ruas-madiedo p,mb,k,m,s,a,goiic n,2016.eps-sj exopolisaccharide produced by the strain lactobacillus paracasei subsp.paracasei bgsj2-8 is involved in adhesion to epithelial intestinal cells and decrease on e.coli association to caco-2cells.front microbiol 7:28.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。