1.本发明涉及一种分离纯血管内皮细胞的方法、血管内皮细胞特性的维持培养基、以及包含其的培养方法。
背景技术:
2.血管新生(血管形成)(angiogenesis(vasculogenesis))是指细胞外基质(ecm)分解,现有血管的内皮细胞迁移、分裂、分化以形成新的毛细血管的过程。因此,这种血管形成可能涉及各种生理和病理现象,例如伤口修复、胚胎发生、肿瘤形成、慢性炎症和肥胖。
3.血管新生对于伤口愈合或组织再生可能特别重要。例如,如果体内缺乏血管新生,则可能发生坏死、溃疡和缺血,导致组织或器官功能障碍。此外,由于血液供应不畅,还可能引起缺血性心脏病、动脉硬化、心肌梗塞和心绞痛之类的心血管疾病。因此,需要开发一种诱导或促进血管新生的治疗方法,以减少由血管新生不足而引起的组织损伤并治疗由此引起的心血管疾病。
4.为了便于理解本发明,对本发明的背景技术进行了说明。不应解释为承认本发明的背景技术中描述的事项作为现有技术存在。
技术实现要素:
5.[技术问题]
[0006]
从胚胎中分离出的人胚胎干细胞(hescs)和由体细胞制成的人诱导多能干细胞(hipscs)可以分化为在血管形成中起重要作用的内皮细胞,从而可用于血管再生疗法。因此,已经提出使用从人多能干细胞分化而来的内皮细胞作为再生受损血管并进一步诱导血管形成的新策略的血管再生疗法。
[0007]
同时,本发明的发明人认识到从诱导多能干细胞分化的内皮细胞的纯度及其体内存活率在血管再生治疗效果中的重要性。
[0008]
因此,本发明的发明人研究了从由人诱导多能干细胞分化的各种细胞系中以高纯度分离具有血管生成能力的内皮细胞的方法。
[0009]
结果,本发明的发明人发现基质粘附根据分化的内皮细胞的特性而变化。当细胞由于基质粘附而根据特定的粘附时间分离时,可以分离出高纯度的同质血管内皮细胞。
[0010]
要实现的目的是提供一种分离纯血管内皮细胞的方法,该方法能够从由人多能干细胞分化的内皮细胞谱系的细胞系中分离出在特定时间内粘附在基质上的同质内皮细胞,和用这种方法分离的高纯度血管内皮细胞。
[0011]
多能干细胞具有自我更新能力,并且可分化成多种细胞,因此其可用于血管再生治疗。因此,作为恢复缺血组织功能的新策略,提供了使用由从胚胎分离的胚胎干细胞分化的血管内皮细胞(ecs)和由体细胞制成的诱导性多能干细胞的血管再生疗法。
[0012]
同时,本发明的发明人认识到,多能干细胞的潜在危险因素(例如肿瘤和异常组织
的发展)、分化过程中使用的动物成分的使用以及干细胞体外进入血管内皮细胞的低分化率可能在血管再生治疗中引起副作用或治疗效果不显著。
[0013]
同时,为了将多能干细胞在体外人工分化并维持为内皮细胞,以体液(例如血浆或淋巴液)为基础,充分满足接近体内条件的例如营养、ph、温度和渗透压之类的环境条件的环境必须在提供合适的培养基的同时提供。存在以下问题:当干细胞和内皮细胞在体外反复培养或受到外界刺激时,细胞的形状、大小、特性发生显微变化或改变,并且细胞的再生能力、增殖和分化能力降低,即老化。
[0014]
因此,当干细胞和内皮细胞在不合适的培养基中进行体外培养时,干细胞和内皮细胞容易老化,失去增殖和分化能力。此外,由于干细胞和内皮细胞具有异质性,其中根据培养条件诱导分化成不需要的细胞,因此用于干细胞和内皮细胞的培养基和培养方法的开发对于干细胞研究是必不可少的并且是非常重要的技术领域。
[0015]
本发明的发明人认识到从人多能干细胞分化的内皮细胞的纯度和维持特性在血管再生治疗效果中的重要性。
[0016]
因此,本发明的发明人研究了一种培养基和培养方法,该培养基和培养方法可以从由高纯度的人多能干细胞分化而来的细胞系中分离出具有高血管新生能力的内皮细胞,并且可以在促进培养的同时进行长期培养,并在体外培养过程中保持与初始状态相同的细胞特性。
[0017]
结果,本发明的发明人发现,当将fgf和egf、细胞生长因子、vegf-a、细胞信号物质和抗坏血酸(抗氧化剂)添加到dmem/f-12(基础培养基)中并用于细胞培养时,即使在重复培养中也能保持血管内皮细胞特性的高纯度血管内皮细胞。因此,本发明的发明人开发了一种血管内皮细胞特性的维持培养基,其能够以高纯度维持和增殖从人多能干细胞分化的血管内皮细胞。
[0018]
因此,本发明的目的是提供一种血管内皮细胞特性的维持培养基,其中从人多能干细胞分化的血管内皮细胞即使在重复培养中也能在保持其特性的同时增殖。
[0019]
本发明的另一个目的是提供一种能够从人多能干细胞培养高纯度血管内皮细胞的维持血管内皮细胞特性的培养方法,以及通过其培养的高纯度血管内皮细胞。
[0020]
本发明的目的不限于上述目的,本领域技术人员通过以下描述将清楚地理解其他未提及的目的。
[0021]
[解决问题的手段]
[0022]
根据本发明的一个示例,提供了一种分离纯血管内皮细胞的方法,该方法包括以下步骤:从分化培养基获得从人多能干细胞分化的内皮细胞谱系的细胞系;使用过滤器过滤所获得的所述细胞系;在基质上培养经过滤的所述细胞系;以及仅将附着在所述基质上的同质内皮细胞从所培养的所述细胞系中分离出来持续20小时或更短时间。
[0023]
如本文所使用的,术语“人多能干细胞”可以指具有无限自我增殖同时保持未分化状态的能力和分化成人体所有细胞的分化能力的细胞,并且可以包括胚胎干细胞、诱导多能干细胞(ipsc)和体细胞核转移细胞(scnt)中的至少一种。
[0024]
如本文所使用的,术语“内皮细胞”可指构成覆盖血管和淋巴管内壁的层的鳞状细胞。因此,内皮细胞可以用作与“血管内皮细胞”有相同的含义。
[0025]
同时,在血管再生治疗中,干细胞(例如从人多能干细胞分化而来的内皮细胞)可
以作为细胞治疗剂移植到体内,以再生受损血管并诱导血管生成或血管新生。在这种情况下,用于治疗的内皮细胞的纯度也可能与血管再生治疗的预后有关。更具体地,当未分化的内皮细胞或与中胚层谱系的其他细胞系或杂质混合的内皮细胞被移植到缺血组织中时,内皮细胞的存活率会降低。因此,当移植的内皮细胞在再生治疗中长时间无法促进血管形成时,使用纯度低的内皮细胞会导致治疗效果下降。
[0026]
因此,以高纯度分选内皮细胞并保持其高水平的特性可能不仅与增加内皮细胞本身的产量有关,而且还与增强使用内皮细胞进行细胞再生治疗的效果有关。
[0027]
如本文所使用的,术语“过滤器”是细胞收集设备并且可以指用于从流体样品中分离和收集具有一定大小的靶细胞的筛网。例如,过滤器用于去除可能降低细胞纯度的杂质或细胞团块,并仅选择具有一定大小的细胞,从而提高纯度。因此,根据本发明的一个特征,用于筛选高纯度血管内皮细胞的过滤器的孔间距可以在20μm至40μm的范围内。
[0028]
如本文所使用的,术语“基质”是可以粘附细胞的成分,并且可以指结缔组织的基本材料。更具体地说,活的生物细胞可以在生物体基质中体外培养。这里,用于体外培养的基质可以通过表面的功能化区域控制与细胞的相互作用,即粘附、分化、增殖和迁移等。例如,不同类型的细胞在其表面具有不同的粘附蛋白。由于这些粘附蛋白根据每种细胞类型而变化,因此它们对于基质的功能化区域可能选择性地具有粘附亲和力。因此,随着细胞分化和增殖的培养进行,与基质的粘附亲和力可以通过粘附蛋白的分泌差异来确定,具体取决于细胞的类型。因此,可以在不同时间引起与基质的相互作用,即粘附。因此,血管内皮细胞可以在培养4小时至20小时后粘附于胶原基质。此外,如果执行培养超过20小时,则具有血管内皮细胞以外的特性的细胞会附着在基质上,在细胞分离过程中纯度可能会降低。另外,如果执行培养少于4小时,则血管内皮细胞可能不会粘附在基质上,因此可能无法获得血管内皮细胞。
[0029]
因此,血管内皮细胞在基质上培养,以允许根据时间通过在血管内皮细胞中显示的特定的表面粘附(即与基质的粘附亲和力)进行选择性培养。此外,根据本发明的另一特征,基质可以包含胶原、纤维蛋白、纤连蛋白、玻连蛋白、基质胶、明胶、层粘连蛋白、肝素、聚赖氨酸和透明质酸中的至少一种,但可以包含1mg/ml或更少,优选0.1mg/ml的胶原蛋白。然而,基质不限于此,可以使用血管内皮细胞可以选择性粘附的任何材料而没有限制。
[0030]
根据本发明的又一特征,在上述培养步骤中,可以培养在含有细胞生长因子和抗坏血酸的dmem/f-12培养基中过滤的内皮细胞谱系的细胞系。这里,细胞生长因子可以是指可以促进细胞分裂、细胞生长和分化的物质,并且可以包括成纤维细胞生长因子-1(fgf-1)、fgf-2(bfgf)、fgf-3、fgf-4、fgf-5、fgf-6、表皮生长因子(egf)、角质形成细胞生长因子(kgf)、肝细胞生长因子(hgf)、转化生长因子-α(tgf-α)、tgf-β、血管生成素1、血管生成素2、促红细胞生成素、神经纤毛蛋白、igf-1、骨素、多效素、激活素、内皮素01和血管内皮生长因子-a(vegf-a)中的至少一种,但不限于此。
[0031]
此外,作为抗氧化剂,抗坏血酸参与前胶原合成,可能是指与1型胶原生成增加相关的辅助因子。抗坏血酸可以在体外刺激和调节多种中胚层衍生细胞如内皮细胞、脂肪细胞、成骨细胞和软骨细胞的增殖。此外,当以特定浓度将抗坏血酸添加到细胞培养基中时,其可以作为细胞生长促进剂,以增加细胞增殖并促进dna合成。
[0032]
同时,dmem/f-12是一种基础培养基。在这种情况下,如本文所使用的,术语“基础
培养基”是指含有细胞存活所必需的糖、氨基酸和水的混合物,表示不包括血清、营养物质和各种生长因子的混合物。本发明的基础培养基可以人工合成并使用,或者也可以使用市售的培养基。例如,商业制备的培养基可以包括dulbecco's改良eagle's培养基(dmem)、最小必需培养基(mem)、eagle基础培养基(bme)、rpmi 1640、f-10、f-12、α-最小必需培养基(α-mem)、glasgow最小必需培养基(g-mem)、iscove改良的dulbecco培养基和胎牛血清(fbs),优选dmem/f-12,但不限于此。
[0033]
根据本发明的又一个特征,上述培养步骤可以包括将经过滤的内皮细胞谱系接种到两份基质上。在这种情况下,当细胞系在两份以上的基质中分割培养时,血管内皮细胞的选择产量可能会降低,因此在传代过程中血管内皮细胞的增殖效率和特性维持可能会降低。
[0034]
同时,如本文所使用的,术语“同质的”可以指在显微镜上观察到的具有相同形态学形状和标志物表达模式的相同细胞类型。在这种情况下,标志物是可以将靶细胞与附近的其他细胞区分开来的任何材料,并且可以包括由蛋白质、糖脂、核酸及其组合组成的组中的至少一种,但不限于此。更具体地,血管内皮细胞的标志物可以是在血管内皮细胞中特异性表达的蛋白质,并且可以包括cdh5、vwf、pecam1、tek和kdr,但优选cdh5和vwf。
[0035]
通过根据本发明的示例的分离纯血管内皮细胞的方法,可以提高血管内皮细胞的这些标志物的表达水平。更具体地,作为血管内皮细胞的特异性标志物的cdh5的基因表达水平可以是通过分离纯血管内皮细胞的方法分离前的12倍。此外,通过分离纯血管内皮细胞的方法,作为血管内皮细胞的特异性标志物的vwf的基因表达水平可能是分离前的两倍。
[0036]
此外,同质内皮细胞的增加可能意味着可以提供高纯度的内皮细胞。使用高纯度内皮细胞可能与血管生成或血管再生效果有关。例如,当将包括未分化干细胞或中胚层干细胞的低纯度内皮细胞移植到缺血组织中时,血管生成或血管再生的效果可能低于移植高纯度内皮细胞时的效果。因此,分离高纯度内皮细胞可能非常重要。
[0037]
根据本发明的一个示例,提供了一种血管内皮细胞,其含有98%或更多的通过上述方法分离的表达cdh5和vwf的同质内皮细胞。
[0038]
此外,根据本发明的一个示例,本发明提供了一种用于预防或治疗心血管疾病的细胞治疗组合物,该组合物包含上述血管内皮细胞。
[0039]
在这种情况下,如本文所使用的,术语“心血管疾病”可以指在心脏和主要动脉中发生的疾病。原因可能是由于缺乏血管形成而导致的血液供应不足。在本发明中,心血管疾病可以包括缺血性心脏病、心力衰竭、高血压性心脏病、心律失常、心肌病、室间隔缺损、先天性心脏病、心肌梗塞、心包疾病、中风、外周血管疾病、动脉瘤、动脉硬化、高血压、心绞痛和心肌梗塞中的至少一者。特别是,其对于各种心血管疾病中的缺血性心血管疾病特别有效。然而,作为用于预防或治疗内皮细胞的细胞治疗剂的效果不限于缺血性心血管疾病。
[0040]
如本文所使用的,术语“细胞治疗剂”是指通过一系列作用而用于治疗、诊断和预防目的的任何药物,所述作用例如在体外增殖或选择活的自体、同种异体和异种细胞或改变细胞的生物学特性,以恢复细胞和组织的功能。如本文所使用的,细胞治疗剂可指可移植以修复受损组织的细胞本身。例如,细胞治疗剂可以是从移植到缺血部位并有助于血管新生的人多能干细胞分化的内皮细胞。
[0041]
根据本发明的一个示例,提供了一种维持血管内皮细胞特性的培养方法,该方法
包括:第一次接种步骤,其用诱导培养基悬浮人多能干细胞(hpsc),并将悬浮液接种到板上;第一次培养步骤,其在诱导培养基中将第一次接种的干细胞分化为中胚层细胞;第二次培养步骤,其将第一次培养的细胞在分化培养基中分化成内皮细胞;选择步骤,其从第二培养细胞中选择血管内皮细胞谱系的细胞;第二次接种步骤,其用维持培养基悬浮所选择的血管内皮细胞,并将悬浮液接种在板上;以及传代培养步骤,其在维持培养基中增殖第二次接种的血管内皮细胞。
[0042]
如本文所使用的,术语“培养基”是指用于细胞(例如干细胞)体外生长和增殖的混合物,其包含细胞生长和增殖所必需的元素,例如糖、氨基酸、各种营养素、血清、生长因子和矿物质。
[0043]
此时,根据本发明的特征,本发明可以包括诱导培养基、分化培养基和维持培养基。更具体地,诱导培养基是指能够将未分化的人多能干细胞诱导成中胚层的培养基,可以包括4ng/ml至6ng/ml的fgf2、2μm至4μm的chirr99021和dmem/f-12。
[0044]
此外,分化培养基是指能够分化成中胚层诱导的细胞血管内皮细胞谱系的培养基,并且可以包括4ng/ml至6ng/ml的fgf2、5ng/ml至10ng/ml的egf、以及10ng/ml至30ng/ml的vegf-a、20ng/ml至30ng/ml的dll4和dmem/f-12。
[0045]
此外,维持培养基是指能够维持和增殖分化的血管内皮细胞的培养基,并且可以包括4ng/ml至6ng/ml的fgf2、5ng/ml至10ng/ml的egf、以及10ng/ml至30ng/ml的vegf-a、20ng/ml至50ng/ml的抗坏血酸和dmem/f-12。
[0046]
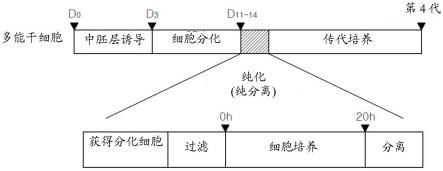
这里,dmem/f-12是基础培养基。
[0047]
根据本发明的又一特征,本发明的培养步骤可以根据阶段而具有不同的培养时间。更具体而言,第一次培养步骤是人多能干细胞在诱导培养基中分化成中胚层细胞的步骤,培养基每天更换,培养期间可以为3天。此外,第二次培养步骤是中胚层诱导细胞分化为内皮细胞的步骤,每天更换培养基,培养期间可以为11天~13天。
[0048]
同时,如本文所使用的,术语“板”是可以在其中进行细胞培养,即生长和增殖的容器,上表面可以包括基质的涂层膜,细胞可以粘附到该涂层膜上。这里,涂层膜可以包括由胶原蛋白、纤连蛋白、层粘连蛋白、层粘连蛋白片段、玻连蛋白、基底膜基质、明胶、透明质酸、聚赖氨酸和玻连蛋白中的至少一种制成的涂层膜,并且可以包含1mg/ml或更少,优选地0.1mg/ml的胶原蛋白。
[0049]
因此,在涂有含有1mg/ml或更少或0.1mg/ml胶原蛋白的涂层膜的板上培养分化细胞,并且只能通过自然选择来选择特异性粘附于涂层膜上的血管内皮细胞谱系的细胞。
[0050]
根据本发明的又一特征,传代培养是针对内皮细胞的增殖进行的,传代培养可以从第1代到第4代进行。
[0051]
如本文所使用的,术语“传代培养”是指一种培养连续几代细胞的方法,同时将一部分细胞定期转移到新的培养板中,并用新鲜培养物替换培养基以进行健康细胞的长期培养。随着培养板有限空间内细胞数量增加,经过一定时间段后,生长所需的养分被消耗或污染物堆积,导致细胞自然死亡。因此,传代培养用于增加健康细胞的数量。通常,第1代是指通过培养基(培养板)更换一次或细胞群分裂一次进行培养。可以使用本领域已知的继代培养方法而没有限制,但是可以优选进行酶促分裂法。
[0052]
根据本发明的一个示例,提供了一种用于维持血管内皮细胞特性的培养基,该培
养基包括4ng/ml至6ng/ml的fgf2、5ng/ml至10ng/ml的egf、10ng/ml至30ng/ml的vegf-a、20ng/ml至50ng/ml的抗坏血酸和dmem/f-12作为活性成分。
[0053]
此外,根据本发明的一个示例,提供了一种维持血管内皮细胞特性的方法,该方法包括:接种步骤,其用维持培养基(该维持培养基含有4ng/ml的至6ng/ml的fgf2、5ng/ml至10ng/ml的egf、10ng/ml至30ng/ml的vegf-a和20ng/ml至50ng/ml的抗坏血酸和dmem/f-12作为活性成分)悬浮作为血管内皮细胞谱系分离的细胞,并将悬浮液接种在板上;和传代培养步骤,其将接种的血管内皮细胞在维持培养基中培养,以维持血管内皮细胞的特性。
[0054]
在这种情况下,从人多能干细胞分化而来的血管内皮细胞可能具有在其中以高水平特异性表达的基因和蛋白质。例如,从人多能干细胞分化而来的血管内皮细胞中cdh5、pecam1和vwf基因的表达水平可能高于从人多能干细胞分化而来的其他细胞系。因此,在从人多能干细胞分化的血管内皮细胞中以高水平特异性表达的基因和蛋白质可以用作指示血管内皮细胞特性的标志物。因此,上述标志物的鉴定会使得能确认由在各种分化的细胞系中反复培养和分离高纯度的血管内皮细胞引起的血管内皮细胞劣化的问题。
[0055]
因此,根据本发明的又一特征,作为上述血管内皮细胞的特异性表达标志物的cdh5阳性细胞的表达可以在通过上述方法传代培养的血管内皮细胞中维持在98%或更高直到第4代。
[0056]
此外,根据本发明的又一特征,作为上述血管内皮细胞的特异性表达标志物的pecam1阳性细胞的表达可以在通过上述方法传代培养的血管内皮细胞中维持在40%或更高直到第4代。
[0057]
此外,根据本发明的又一特征,作为上述血管内皮细胞的特异性表达标志物的vwf阳性细胞的表达可以在通过上述方法传代培养的血管内皮细胞中维持在88%或更高直到第4代。
[0058]
根据本发明的又一特征,板可以包括由胶原蛋白、纤连蛋白、层粘连蛋白、层粘连蛋白片段、玻连蛋白、基底膜基质、明胶、透明质酸、聚赖氨酸和玻连蛋白中的至少一种组成的涂层膜,并且可以包括1mg/ml或更少,优选0.1mg/ml的胶原蛋白。
[0059]
此外,根据本发明的又一特征,上述方法的传代培养可进行至第1至4代。
[0060]
根据本发明的示例,可以提供通过上述方法制备的血管内皮细胞。这种血管内皮细胞可能具有血管生成和再生能力,因此可以用作预防或治疗心血管疾病的细胞治疗剂。
[0061]
在下文中,将通过示例更详细地描述本发明。然而,由于这些示例仅用于说明本发明的目的,因此本发明的范围不应被解释为受这些示例的限制。
[0062]
[发明效果]
[0063]
本发明提供了根据细胞特性表达的基于基质粘附的高纯度血管内皮细胞,以具有将其在临床实践中稳定应用的效果。
[0064]
更具体地,本发明可以利用相互作用(即在血管内皮细胞中特异性表达的粘附蛋白与基质之间的粘附力)仅分离在特定时间内分化和粘附的血管内皮细胞。此外,通过上述方法分离的血管内皮细胞表达98%以上的作为在血管内皮细胞中特异性表达的标志物的cdh5和vwf,从而提供纯度为98%以上的高纯度血管内皮细胞。
[0065]
此外,本发明是一种通过在培养容器中的培养过程分离高纯度血管内皮细胞的方法,并且可能比常规方法(例如磁性细胞分选和流式细胞术)相对更简单和更经济。
[0066]
此外,在用于血管内皮细胞的大量生产的血管内皮细胞的传代培养中,可以在短时间内以高产率提供高纯度的血管内皮细胞。
[0067]
此外,本发明促进血管新生并提供具有优异血管再生能力的血管内皮细胞,从而具有可用作预防或治疗心血管疾病的有效细胞治疗剂的效果。
[0068]
本发明提供通过使用动物来源的血清或饲养细胞产生的不诱导免疫反应的血管内皮细胞,具有能够以高纯度增殖和培养血管内皮细胞的血管内皮细胞特性的维持培养基,以及包括它们的培养方法,从而具有稳定应用于临床实践的效果。
[0069]
具体而言,本发明提供了一种专门针对将人多能干细胞培养成血管内皮细胞中的各个阶段的诱导、分化和维持培养基,从而提高分化细胞的产量并提供高纯度的血管内皮细胞。
[0070]
此外,提供了一种维持培养基,其专门用于血管内皮细胞的传代培养以大量生产血管内皮细胞,从而在短时间内提供高纯度的血管内皮细胞。
[0071]
根据本发明的效果不受以上例示的内容的限制,并且本说明书中包括更多的各种效果。
附图说明
[0072]
图1说明了纯血管内皮细胞的培养方法的过程。
[0073]
图2为本发明的示例的分离纯血管内皮细胞的方法的流程示意图。
[0074]
图3a至3d示出了分离从人多能干细胞分化的内皮细胞作为纯血管内皮细胞的过程。
[0075]
图4示出了血管内皮细胞的基质粘附机制。
[0076]
图5a和5b示出了根据本发明的示例的分离纯血管内皮细胞的方法中,根据是否使用过滤器的标志物表达和显微图像的结果。
[0077]
图6a至6c示出了通过根据本发明的示例的分离纯血管内皮细胞的方法分离的血管内皮细胞的标志物表达结果。
[0078]
图7示出了根据本发明的示例的分离纯血管内皮细胞的方法的传代培养的显微图像的结果。
[0079]
图8示出了根据本发明的示例的用于维持血管内皮细胞特性的培养方法的过程。
[0080]
图9a至9d示出了选择从人多能干细胞分化的内皮细胞作为纯血管内皮细胞的过程。
[0081]
图10示出了根据根据本发明的示例的维持血管内皮细胞特性的培养方法中的传代培养数的血管内皮细胞的显微图像的结果。
[0082]
图11a至图11c示出了根据本发明的示例的维持血管内皮细胞特性的培养方法中,阳性血管内皮细胞相对于标志物的相对表达量的结果。
[0083]
图12示出了根据本发明的示例的在维持血管内皮细胞特性的培养方法中,根据血管内皮细胞传代次数的细胞增殖率的结果。
[0084]
图13a和13b示出了在根据本发明的示例的维持血管内皮细胞特性的培养方法中,阳性血管内皮细胞相对于标志物的相对表达水平的结果。
[0085]
图14示出了在根据本发明的示例的维持血管内皮细胞特性的培养方法中,根据血
管内皮细胞的传代次数的血管内皮细胞的培养基的细胞增殖率的结果。
[0086]
图15示出了在根据本发明的示例的维持血管内皮细胞特性的培养方法中,根据血管内皮细胞的培养基的血管内皮细胞的显微图像的结果。
具体实施方式
[0087]
本发明的优点和特征以及实现它们的方法参考下面结合附图详细描述的示例变得显而易见。然而,本发明不限于以下公开的示例,而是以各种不同的形式实施,并且仅这些示例允许本发明的公开是完整的,并且被提供以充分告知本领域普通技术人员本发明属于哪一种,本发明的范围。本发明仅由权利要求的范围限定。如本文所使用的,术语“分化”是指细胞在具有特定功能的特异性细胞或组织的复合物或个体的水平上发育。
[0088]
如本文所使用的,术语“增殖”是指细胞数量的增加,并且与生长具有相同的含义。
[0089]
如本文所使用的,术语“更新能力”可以指细胞制造自身精确复制品的能力,并且当再生能力提高时,细胞的增殖能力可能是极好的。
[0090]
分离纯血管内皮细胞的方法
[0091]
在下文中,参考图1至图3d,详细描述了根据本发明的示例的分离纯血管内皮细胞的方法。
[0092]
图1示出了纯血管内皮细胞的培养方法的过程。在下文中,为了描述方便,将参考图2到3d进行描述。
[0093]
参考图1,首先,将多能干细胞悬浮在诱导培养基中,并将悬浮液接种在板上。每天更换诱导培养基持续3天,可诱导细胞分化为中胚层谱系的细胞。在这种情况下,诱导培养基可以是含有生长因子和chirr99021(一种gsk3β抑制剂)的dmem/f-12培养基。这里,生长因子可以包括成纤维细胞生长因子-1(fgf-1)、fgf-2(bfgf)、fgf-3、fgf-4、fgf-5、fgf-6、表皮生长因子(egf)、角质形成细胞生长因子(kgf)、肝细胞生长因子(hgf)、转化生长因子-α(tgf-α)、tgf-α、血管生成素1、血管生成素2、促红细胞生成素、神经纤毛蛋白、igf-1、骨脂素、多效素、激活素、内皮素01和血管内皮生长因子-a(vegf-a)中的至少一种,但不限于此。此外,chirr99021是一种抑制糖原合酶激酶(gsk)活性的物质。更具体地,gsk被抑制,使得参与细胞增殖的信号系统的β不被gsk降解,因此增加了参与细胞增殖的基因的表达水平,从而提高了细胞的存活和增殖。
[0094]
然后,通过每天更换分化培养基持续11天至14天,中胚层谱系的细胞可以在分化培养基中分化为内皮细胞谱系的细胞系。在这种情况下,分化培养基可以是含有生长因子和dll4(notch信号配体)的dmem/f-12培养基。这里,δ样配体4(dll4)是血管新生过程中的一种信号物质,可能与内皮细胞标志物表达水平的增加有关。
[0095]
然后,通过使用根据本发明的示例的分离纯血管内皮细胞的方法,可以从分化的内皮细胞谱系的细胞系中分离同源内皮细胞。更具体地,参考图2,示出了根据本发明的示例的分离纯血管内皮细胞的方法的过程。分离纯血管内皮细胞的方法是用于选择高纯度血管内皮细胞的方法,并且可以包括以下步骤:从分化培养基中获得从人多能干细胞分化的内皮细胞谱系的细胞系(s110),使用过滤器过滤所获得的细胞系(s120),在基质上培养经过滤的细胞系(s130),并且从培养的细胞系中分离附着在基质上的同质内皮细胞(s140)。
[0096]
首先,在从分化培养基获得从人多能干细胞分化的内皮细胞谱系的细胞系的步骤
(s110)中,可以使用蛋白水解酶法获得从分化培养基分化的内皮细胞谱系的细胞系。更具体地,参考图3a,蛋白水解酶法是一种利用蛋白水解酶分离细胞与细胞或细胞与基质的方法。降解酶物质可包括胶原酶、分散酶、蛋白酶、胰蛋白酶等,但不限于此。因此,内皮细胞谱系的细胞系可以从基质和细胞之间的连接分离成每个单个细胞。此外,在根据本发明的示例的分离纯血管内皮细胞的方法中,靶细胞可以通过使用上述蛋白水解酶法从基质中分离出来。
[0097]
接下来,在使用过滤器过滤获得的细胞系的步骤(s120)中,可以使用具有20μm至40μm范围内的孔间距的过滤器,从而分离一定尺寸的细胞。更具体地,参考图3b,过滤器用于从目标细胞中去除具有不同形态尺寸的其他细胞、杂质和细胞团块,并且仅分离具有相同形态尺寸的细胞。因此,可以获得更高同质性的细胞。此时,细胞团块是指通过细胞聚集形成的丸块。当形成细胞团块时,会发生细胞周期停滞,从而诱导自我分化。因此,难以分化成期望的细胞,即血管内皮细胞。
[0098]
然后,在基质上培养过滤的细胞系的步骤(s130)中,可以将细胞系分开并接种在基质上。更具体地,参考图3c,使用过滤器过滤从含有基质的一个板中获得的内皮细胞谱系的细胞系,并将经过滤的细胞系分割、接种和培养成两份基质。在这种情况下,如果细胞系在两个以上的基质中分开培养,则血管内皮细胞的选择产量可能会降低,因此在传代培养过程中血管内皮细胞的增殖效率和特性维持可能会降低。
[0099]
另外,在基质上培养经过滤的细胞系的步骤(s130)中,可以培养4小时至20小时。更具体地,参考图4,示出了血管内皮细胞的基质粘附机制。细胞可以使用诸如整合素之类的粘附蛋白与基质表面的功能化区域相互作用。在这种情况下,粘附蛋白可能具有不同的表达模式,具体取决于细胞分化时产生的细胞的特性和类型。对基质的粘附亲和力可以根据粘附蛋白的差异来确定,此外,由于根据细胞的特性和类型的粘附亲和力,可以在不同的时间引起对基质的相互作用,即粘附。另外,可以通过标志物来区分细胞的特性和类型,可以识别血管内皮细胞的标志物可以包括cdh5、vwf、pecam1、tek和kdr,但优选cdh5和vwf。
[0100]
因此,表达cdh5和vwf标志物的血管内皮细胞可以粘附到含有0.1mg/ml胶原蛋白的基质上持续4小时至20小时,并且当执行培养超过20小时时,可能会粘附表达cdh5和vwf标志物的血管内皮细胞以外的具有标志物的表达模式的不同类型的细胞。因此,根据本发明的示例的分离纯血管内皮细胞的方法的培养步骤可以进行4小时至20小时,但不限于此。培养时间可以根据基质的类型进行调整。
[0101]
此外,在基质上培养经过滤的细胞系的步骤(s130)中使用的基质可以包括胶原、纤维蛋白、纤连蛋白、玻连蛋白、基质胶、明胶、层粘连蛋白、肝素、聚赖氨酸和透明质酸中的至少一种。然而,它可以含有1mg/ml或更少,优选0.1mg/ml的胶原蛋白。然而,基质不限于此,血管内皮细胞可以选择性地附着的任何材料都可以使用而没有限制。
[0102]
此外,在基质上培养经过滤的细胞系的步骤(s130)中,经过滤的内皮细胞谱系的细胞系可以在含有细胞生长因子和抗坏血酸的dmem/f-12培养基中培养。在这种情况下,生长因子是指可以促进细胞分裂、细胞生长和分化的物质,并且可以包括成纤维细胞生长因子-1(fgf-1)、fgf-2(bfgf)、fgf-3、fgf-4、fgf-5、fgf-6、表皮生长因子(egf)、角质细胞生长因子(kgf)、肝细胞生长因子(hgf)、转化生长因子-α(tgf-α)、tgf-β、血管生成素1、血管生成素2、促红细胞生成素、神经纤维蛋白、igf-1、骨素、多效素、激活素、内皮素01和血管内
皮生长因子-a(vegf-a)中的至少一种。,但不限于此。
[0103]
此外,在培养环境条件下,温度可以为36℃至38℃,优选36.5℃至37.5℃,供应氧气(o2)可以为1%至25%,供应二氧化碳(co2)可以是1%至15%。
[0104]
接下来,在从培养的细胞系中分离附着于基质的同质内皮细胞的步骤(s140)中,可以将含有98%或更多的在血管内皮细胞中特异性表达的标志物的表达阳性细胞的高纯度血管内皮细胞隔离。更具体地,参考图3d,首先,去除4小时至20小时未粘附的细胞,并且可以分离仅粘附基质4小时至20小时的细胞。此时粘附在基质上4-20小时的细胞为同质细胞,其具有相同的形态和标志物表达模式,并且在血管内皮细胞中表达特异性cdh5和vwf标志物的阳性细胞数可能在98%以上。即,可以获得纯度为98%以上的内皮细胞。
[0105]
此外,通过根据本发明的示例的分离纯血管内皮细胞的方法,可以增加血管内皮细胞标志物的表达水平。更具体地,作为血管内皮细胞的特异性标志物的cdh5的基因表达水平可能比通过分离纯血管内皮细胞的方法分离前高12倍。此外,通过分离纯血管内皮细胞的方法,作为血管内皮细胞特异性标志物的vwf的基因表达水平可能是分离前的两倍。
[0106]
再次,参考图1,通过根据本发明的示例的分离纯血管内皮细胞的方法分离的同质内皮细胞可以进行传代培养以增加细胞数量并维持细胞。在这种情况下,用于传代培养的培养基可以与纯分离步骤中使用的培养基相同,其可以是含有细胞生长因子和抗坏血酸的dmem/f-12培养基。另外,也可以在第1至4代进行传代培养。更具体而言,当血管内皮细胞的培养超过第4代时,增殖和分化能力降低。另外,当长时间培养时,会形成细胞团块等,并且会伴随染色体突变。因此,能够以高纯度确保大量细胞同时保持血管内皮细胞特性的传代培养可以优选为传代1至4。
[0107]
通过根据本发明的示例的分离纯血管内皮细胞的方法,具有从人多能干细胞以高产率生产具有均一特性的高纯度血管内皮细胞的效果。
[0108]
在根据本发明的示例的分离纯血管内皮细胞的方法中过滤效果的确认。
[0109]
在下文中,将参考图5a到5b详细描述根据本发明的示例的分离纯血管内皮细胞的方法中过滤器的效果。
[0110]
图5a和5b示出了根据本发明的示例的分离纯血管内皮细胞的方法中,根据是否使用过滤器的标志物表达和显微图像的结果。
[0111]
参考图5a,示出了在根据本发明的示例的分离纯血管内皮细胞的方法中,取决于是否使用过滤器的针对标志物的阳性血管内皮细胞的表达水平结果。在这种情况下,取决于是否使用过滤器的血管内皮细胞可以与同种型对照一起测试。同种型对照是样品与无抗原特异性的同种免疫球蛋白反应的对照,其可以通过使同种型对照中阳性率小于2%来设置血管内皮细胞阳性的临界值。
[0112]
首先,参考图5a(a),当不使用过滤器时,针对cdh5标志物的血管内皮细胞的阳性表达水平为72.8%。此外,当使用过滤器时,针对cdh5标志物的血管内皮细胞的阳性表达水平为99.7%。
[0113]
此外,参考图5a(b),示出了根据如上所述的过滤器的存在或不存在显示针对标志物的血管内皮细胞的阳性表达水平的结果图。更具体地,表明由于使用过滤器,表达cdh5标志物的阳性细胞数从72.8%增加到99.7%。这可能意味着表达cdh5标志物的阳性细胞数量可能会由于使用过滤器而增加。
[0114]
此外,参考图5b,显示了在根据本发明的示例的分离纯血管内皮细胞的方法中,根据是否使用过滤器的显微镜图像的结果。更具体地说,当不使用过滤器时,观察到的细胞集落显示为由形态不均匀的细胞组成。另一方面,当使用过滤器时,细胞集落显示为由形态形状一致的细胞组成。这可能意味着只有具有相同形态特征的细胞可以由于使用过滤器而被分离。
[0115]
作为上述结果,在根据本发明的示例的分离纯血管内皮细胞的方法中,过滤器用于增加表达cdh5(其是血管内皮细胞的特异性标志物)的阳性细胞的数量以及分离具有形态等效形状的细胞。因此,过滤器的使用导致可以提供更高纯度的血管内皮细胞的效果。
[0116]
通过根据本发明的示例的分离纯血管内皮细胞的方法分离的血管内皮细胞纯度的确认
[0117]
在下文中,将参照图6a至6c和7详细描述通过根据本发明的示例的分离纯血管内皮细胞的方法分离的血管内皮细胞纯度的确认。
[0118]
图6a至6c示出了通过根据本发明的示例的分离纯血管内皮细胞的方法分离的血管内皮细胞的标志物表达结果。
[0119]
首先,参考图6a,示出了根据本发明的示例的分离纯血管内皮细胞的方法中针对标志物的阳性血管内皮细胞的表达水平结果。更具体地说,在不进行本发明的纯分离时,针对cdh5标志物的血管内皮细胞的阳性表达水平为41.6%,而在进行纯分离时,所述水平为99.7%。
[0120]
另外,在不进行本发明的纯分离时,这对pecam1标志物的血管内皮细胞的阳性表达水平为16.9%,而在进行纯分离时,所述水平为42.6%。
[0121]
另外,在不进行本发明的纯分离时,针对tek标志物的血管内皮细胞的阳性表达水平为11.6%,而在进行纯分离时,所述水平为28.8%。
[0122]
另外,在不进行本发明的纯分离时,针对kdr标志物的血管内皮细胞的阳性表达水平为2.6%,而在进行纯分离时,所述水平为16.0%。
[0123]
另外,在不进行本发明的纯分离时,针对vwf标志物的血管内皮细胞的阳性表达水平为71.6%,而在进行纯分离时,所述水平为98.4%。
[0124]
此外,参考图6b,显示了在上述分离纯血管内皮细胞的方法中显示针对标志物的阳性血管内皮细胞的表达水平的图。更具体地,在作为血管内皮细胞的特性指标的所有cdh5、pecam1、tek、kdr和vwf标志物中,通过纯分离增加了表达标志物的阳性细胞的数量。特别是针对cdh5和vwf的标志物表达阳性细胞数为98%以上,从而表明血管内皮细胞的纯度为98%以上。
[0125]
此外,参考图6c,根据本发明的示例显示了根据分离纯血管内皮细胞的方法的针对标志物的血管内皮细胞的mrna表达水平。此时,标志物的表达水平使用gapdh进行标准化。更具体地说,针对cdh5、pecam1、tek、vwf和nos标志物的血管内皮细胞的mrna表达水平被显示为通过纯分离增加。此外,通过纯分离的cdh5标志物的基因表达(其特征性地表达在纯度为98%的血管内皮细胞中)显示出比纯分离前高12倍。
[0126]
此外,通过纯分离的针对vwf标志物的基因表达(其特征性地表达在纯度为98%的血管内皮细胞中)显示出比纯分离前高两倍。
[0127]
同时,针对kdr标志物的血管内皮细胞的mrna表达水平比纯分离前高。这种kdr标
志物在血管内皮细胞分化的早期表达,并且当分化为成熟的血管内皮细胞时这些特性逐渐丧失。同时,vwf标志物是一种在分化早期不表达,但在分化为成熟血管内皮细胞的过程中表达的物质。因此,在纯分离之前具有针对kdr的高mrna表达水平的内皮细胞集落可能意味着包括未分化的血管内皮细胞。此外,纯分离后具有针对vwf的高mrna表达水平的内皮细胞集落可能意味着包括完全分化和成熟的血管内皮细胞。
[0128]
例如,参考图7,示出了根据本发明的示例的分离纯血管内皮细胞的方法的传代培养期间的显微图像。在未进行纯分离方法的血管内皮细胞的传代培养中,显示贴壁细胞和悬浮细胞混合。更具体地,根据本发明的示例的分离纯血管内皮细胞的方法中的血管内皮细胞可以从人多能干细胞分化。
[0129]
此时,由于人多能干细胞具有干细胞的特性,基质粘附性可能明显低于其他细胞,因此可以悬浮培养。然而,随着干细胞分化为血管内皮细胞,它们失去了干细胞的特性,并且可能获得与血管内皮细胞的基质粘附性。因此,在传代培养期间的悬浮细胞仍具有干细胞的基质粘附性差的特性,可能意味着它们是表达kdr标志物的分化早期的未分化细胞。此外,贴壁细胞可以指具有血管内皮细胞的基质粘附特性的成熟细胞。
[0130]
此外,当仅成熟血管内皮细胞通过根据本发明的示例的分离纯血管内皮细胞的方法分离并进行传代培养时,表明仅存在贴壁细胞。这可能意味着未分化的细胞不存在,只有成熟的血管内皮细胞被接种,并且它们增殖成高纯度的血管内皮细胞。
[0131]
作为上述结果,证实了通过根据本发明的示例的分离纯血管内皮细胞的方法分离未分化细胞和具有不同特性的细胞,从而在传代培养期间提供高纯度的血管内皮细胞。因此,可以提供高纯度血管内皮细胞,其中作为在血管内皮细胞中特征性表达的cdh5和vwf标志物的表达为98%以上、即纯度为98%以上。
[0132]
维持血管内皮细胞特性的培养方法
[0133]
在下文中,参考图8到10详细描述了根据本发明的示例的维持血管内皮细胞特性的方法。
[0134]
图8示出了根据本发明的示例的维持血管内皮细胞特性的培养方法的过程。在下文中,为了描述方便,将参考图9a到10进行描述。
[0135]
参考图8,维持血管内皮细胞特性的培养方法包括:第一次接种步骤,其用诱导培养基悬浮人多能干细胞(hpsc)并将悬浮液接种在板上(s110);第一次培养步骤,其将第一次接种的干细胞在诱导培养基中分化为中胚层细胞(s120);第二次培养步骤,其在分化培养基中将第一次培养的细胞分化为内皮细胞(s130);选择步骤,其从第二次培养的细胞中选择血管内皮细胞谱系的细胞(s140);第二次接种步骤,其用维持培养基悬浮选定的血管内皮细胞并将悬浮液接种在板上(s150);以及传代培养步骤,其在维持培养基中增殖第二次接种的血管内皮细胞(s160)。
[0136]
这里,在培养环境条件下,温度可以为36℃至38℃,优选36.5℃至37.5℃,供应氧气(o2)可以是1%至25%,供应二氧化碳(co2)可以是1%到15%。
[0137]
更具体地,首先,在用诱导培养基悬浮人多能干细胞并将悬浮液接种在板上的第一次接种步骤中(s110),未分化的人多能干细胞使用蛋白水解酶从组织中分离,并且然后用诱导培养基悬浮,并将悬浮液接种到涂有含有0.1mg/ml胶原蛋白的包衣膜的板上。
[0138]
这里,蛋白水解酶是指能够分离细胞间基质以释放活组织中所含的细胞或细胞聚
集体的酶,并且可以使用胶原酶、分散酶、蛋白酶、胰蛋白酶等来将人多能干细胞从组织或细胞和细胞团块分离出来,但不限于此。
[0139]
此外,板不受限制,只要细胞培养可以进行,并且可以包括各种类型的板,例如烧瓶、组织培养瓶、培养皿、皮氏培养皿(petri dishes)、微板、微孔板、微载玻片、室载玻片、小木屋、试管、托盘和培养袋等即可。它的上表面可以包括细胞粘附层涂层膜。更具体地,板的涂层膜可以包括胶原蛋白、纤连蛋白、层粘连蛋白、层粘连蛋白片段、玻连蛋白、基底膜基质、明胶、透明质酸、聚赖氨酸和玻连蛋白中的至少一种,并且可以包括1mg/ml或更少,优选0.1mg/ml的胶原蛋白。因此,通过在含有0.1mg/ml胶原涂层膜的板上培养促进细胞粘附和延伸,从而提高中胚层谱系的细胞的分化效率。
[0140]
接下来,在诱导培养基中将第一次接种的干细胞分化成中胚层细胞的第一次培养步骤(s120)中,培养通过以下方式进行:使用含有生长因子、4ng/ml至6ng/ml的fgf2作为生长因子,2μm到4μm的chirr99021作为gsk3β抑制剂和dmem/f-12的诱导培养基,同时每天更换培养基,持续3天,从而诱导干细胞分化为中胚层谱系细胞。
[0141]
在这种情况下,成纤维细胞生长因子(fgf2)是一种生长因子,其参与各种生物过程,例如促进分裂,其包括细胞增殖和细胞分化、血管新生、骨形态发生和神经生长。
[0142]
此外,chirr99021是一种抑制糖原合成酶激酶(gsk)活性的物质。更具体地说,由于gsk被抑制,参与细胞增殖的信号系统的β不会被gsk降解,因此增加了参与细胞增殖的基因的表达水平,从而提高了细胞的存活和增殖。
[0143]
接下来,在将第一次培养的细胞在分化培养基中分化为内皮细胞的第二次培养步骤(s130)中,培养通过以下方式进行:使用含有生长因子(4ng/ml至6ng/ml的fgf2,5ng/ml至10ng/ml的egf、10ng/ml至30ng/ml的vegf-a、20ng/ml至30ng/ml的dll4)作为notch信号配体和dmem/f-12的分化培养基,同时每天更换培养基,持续11天至13天,从而诱导从中胚层谱系的细胞向内皮谱系的细胞的分化。此外,在将第一次培养的细胞在分化培养基中分化成内皮细胞的第二次培养步骤(s130)中,选择性地使用肝素以提高分化成内皮细胞谱系的效率。
[0144]
这里,表皮生长因子(egf)是一种能够通过与其受体结合来促进细胞增殖、生长和分化的生长因子,并且可以具有促进上皮细胞增殖的活性。
[0145]
此外,血管内皮生长因子(vegf-a)是一种通过激活vegf信号参与胚胎循环和血管新生的形成的信号物质,并且可以刺激内皮细胞的细胞分裂和细胞迁移。
[0146]
此外,δ样配体4(dll4)是一种信号物质,其影响减少内皮细胞的生长和迁移的notch受体、动脉和静脉分化的测定、尖端和堆叠细胞结晶的测定以及尖端细胞的形成以抑制过度的血管新生,从而适当地调节血管新生的萌芽。特别是,确定加入dll4以调节notch信号,其作用是区分和维持细胞的特性,从而增加血管内皮细胞的特性,即标志物的表达水平。
[0147]
接下来,在选择第二次培养的细胞作为血管内皮细胞谱系的细胞的步骤(s140)中,选择从干细胞分化而来的各种细胞系,即来自内皮细胞谱系的血管内皮细胞,以获得高纯度血管内皮细胞。更具体地,参考图9a至9d描述了用于选择纯血管内皮细胞的过程。
[0148]
首先,参考图9a(a),显示了由内皮细胞谱系组成的集落。从人多能干细胞分化而来的内皮细胞自主分化以形成由异质内皮细胞谱系组成的集落。因此,参考图9a(b),分化
的内皮细胞谱系在大小和形状方面以各种类型混合。
[0149]
然后,参考图9b,在细胞选择之前由分化的内皮细胞谱系组成的集落可以分开并接种在两个或更少的板上。此时,当它们接种在两个以上的板上时,血管内皮细胞的选择产量会降低。
[0150]
然后,可以进行细胞选择以仅获得高纯度的血管内皮细胞。细胞选择是一种以高纯度分离分化的特异性细胞的技术。可以使用流式细胞分选和磁性细胞分选,但可以使用独特的细胞特性选择细胞。
[0151]
例如,参考图9c(a),可以使用对基质具有特异性表面粘附性的细胞的选择性粘附来分离和选择细胞。更具体地说,粘附到基质上的时间可能会根据每个细胞的特性而有所不同。因此,异种内皮细胞谱系在包括由基质制成的涂层膜的板上培养,从而根据培养时间对粘附在板的涂层膜上的细胞进行分类。
[0152]
参考图9c(b),显示了在特定时间内粘附的血管内皮细胞。同时粘附的所有细胞具有相同的形状,并且悬浮细胞被视为不是具有相同特性的内皮细胞,通过洗涤去除。在这种情况下,由基质制成的涂层膜可以含有0.1mg/ml的胶原蛋白,但不限于此,可以使用包括血管内皮细胞可以随时间推移特异性粘附的各种基质的涂层膜。
[0153]
最后,参考图9d(a),仅选择粘附在板的涂层膜上的细胞。参考图9d(b),选择的细胞具有相同的形状,其意味着它们是具有相同特性的内皮细胞。因此,可以通过上述方法仅选择和使用高纯度的血管内皮细胞。粘附时间可以是4小时至20小时。也就是说,细胞选择可能意味着在接种后4小时至20小时分离内皮细胞。
[0154]
再次,如图8所示,在用维持培养基悬浮选定的血管内皮细胞并将悬浮液接种到板上的第二次接种步骤中(s150),将高纯度选定的血管内皮细胞用维持培养基悬浮,并将结果接种在涂有含有0.1mg/ml胶原蛋白的涂层膜的板上。
[0155]
最后,在维持培养基中增殖第二次接种的血管内皮细胞的传代培养步骤(s160)中,在含有生长因子(4ng/ml至6ng/ml的fgf2、5ng/ml至10ng/ml的egf、10ng/ml至30ng的vegf-a)、20ng/ml至50ng/ml的抗坏血酸和dmem/f-12的维持培养基中进行传代培养,从而诱导血管内皮细胞增殖。
[0156]
这里,传代培养可以从第1代到第4代进行。更具体地,当培养血管内皮细胞超过4代时,增殖和分化能力降低,并且当长时间培养时,细胞团块等可能会形成并可能伴有染色体突变。因此,参考图10,示出了根据传代培养数显示的血管内皮细胞的显微图像的结果。其表明,根据每个传代的所有血管内皮细胞大小和形状都相同,直到第4代才产生细胞团块。这里,当细胞团块形成时,细胞周期停滞发生,从而诱导自我分化,所以它可能难以分化成所需细胞,即血管内皮细胞。因此,能够确保大量高纯度细胞同时保持血管内皮细胞特性的传代培养可以优选为传代1至4。
[0157]
此外,抗坏血酸是一种抗氧化剂,参与前胶原合成,并且是与增加1型胶原蛋白的产生相关的辅助因子。抗坏血酸可以在体外刺激和调节各种中胚层衍生细胞(例如脂肪细胞、成骨细胞和软骨细胞)的增殖。此外,当抗坏血酸以特定浓度添加到间充质干细胞的培养基中时,其作为细胞生长促进剂,以增加细胞增殖,甚至促进dna合成。但是,如果抗坏血酸的浓度不合适,则其反而可能会抑制细胞的增殖,并具有细胞毒性,以导致细胞凋亡。因此,能够改善细胞增殖的抗坏血酸的适当浓度可以是20ng/ml至50ng/ml,但不限于此。
[0158]
根据如上所述的根据本发明的示例的维持血管内皮细胞特性的培养方法,具有从人多能干细胞以高产率产生血管内皮细胞的效果。
[0159]
确认在根据本发明的示例的维持培养基中维持血管内皮细胞特性
[0160]
在下文中,将参照图11a至12详细描述根据本发明的示例的在维持培养基中的血管内皮细胞特性的维持。
[0161]
图11a至图11c示出了本发明的示例的维持血管内皮细胞特性的培养方法中,阳性血管内皮细胞相对于标志物的相对表达水平。
[0162]
首先,参考图11a,显示了血管内皮细胞阳性对照的相对标志物表达水平。更具体地,cdh5、pecam1、tek、kdr和vwf在血管内皮细胞阳性对照组中表达。这可能意味着cdh5、pecam1、tek、kdr和vwf是表现出血管内皮细胞的特性的标志物。因此,通过确认作为在血管内皮细胞中特异性表达的标志物的cdh5、pecam1、tek、kdr和vwf,可以确认血管内皮细胞的特性的维持。
[0163]
因此,参考图11b,示出了根据在维持培养基中的传代培养的血管内皮细胞的标志物表达水平的结果。更具体地,根据在维持培养基中的传代培养,针对cdh5标志物的血管内皮细胞的阳性表达水平在第1代时为99.7%,在第2代时为99.0%,在第3代时为99.2%,在第4代时为98.3%。
[0164]
此外,根据维持培养基中的传代培养,针对pecam1标志物的血管内皮细胞的阳性表达水平在第1代为42.8%,第2代为43.2%,第3代为38.6%,第4代为45.4%.
[0165]
此外,根据在维持培养基中的传代培养,针对tek标志物的血管内皮细胞的阳性表达水平在第1代时为28.8%,在第2代时为63.4%,在第3代时为30.2%,在第4代时为17.9%。
[0166]
此外,根据在维持培养基中的传代培养,针对kdr标志物的血管内皮细胞的阳性表达水平在第1代时为16.0%,在第2代时为61.2%,在第3代时为14.5%,在第4代时为4.6%。
[0167]
此外,根据在维持培养基中的传代培养,针对vwf标志物的血管内皮细胞的阳性表达水平在第1代时为98.4%,在第2代时为93.1%,在第3代时为88.3%,在第4代时为97.4%。
[0168]
因此,根据在维持培养基中的传代培养的血管内皮细胞可以指高纯度分化的血管内皮细胞,其显示针对cdh5、pecam1、tek、kdr和vwf(在血管内皮细胞阳性的对照组中被识别的标志物)的高表达水平。高纯度可能意味着纯度为98%或更高,例如,它可能意味着cdh5阳性细胞表达维持在98%或更高直到第4代。
[0169]
此外,参考图11c,示出了显示根据在上述维持培养基中的传代培养的针对标志物的血管内皮细胞的阳性表达水平的图。更具体地,对于cdh5标志物,表达cdh5的阳性细胞数维持在98%或更多,直到第4代,对于pecam1标志物,表达cdh5的阳性细胞数维持在40%或更多,直到第4代,并且对于vwf标志物,表达cdh5的阳性细胞数保持在88%或更多,直到第4代。然而,对于tek和kdr标志物,每代的表达标志物的阳性细胞数不一致或趋于减少,但直到第3代的表达标志物的阳性细胞数保持高于阳性对照组的血管内皮细胞。因此,当血管内皮细胞在维持培养基中传代培养时,作为在血管内皮细胞阳性对照组中鉴定的标志物的cdh5、pecam1、tek、kdr和vwf的表达持续维持直到第4代。这可能意味着在维持培养基中培养血管内皮细胞可以增殖,同时保持血管内皮细胞的特性。
[0170]
此外,参考图12,示出了根据本发明的示例的维持血管内皮细胞特性的培养方法中,根据血管内皮细胞的传代数的细胞生长速率。在这里,当细胞使用二元裂变增殖时,细胞生长速率根据将一个细胞变成两个细胞所需的时间来确定。这称为倍增时间,其可以作为评价细胞生长速率(即增殖能力)的衡量标准。因此,细胞生长速率表示为根据血管内皮细胞的传代数的累积群体倍增水平(cpdl)值。cpdl是细胞生长速率的指标。更具体地说,当cpdl值为10时,可能意味着细胞已经分裂了10次。如果这是用数字计算的,则其可能意味着一个细胞增殖到大约1,000个细胞。cpdl通过下面的等式1计算。
[0171]
[等式1]
[0172]
cpdl=ln(nf/ni)ln2
[0173]
在这种情况下,ni表示初始接种细胞的数量,nf表示最终细胞的数量,ln表示自然对数。
[0174]
在维持培养基中培养的血管内皮细胞的cpdl值显示在第1到4代中具有1到2.5的值。这可能意味着一个血管内皮细胞可以增殖多达22.5个细胞。
[0175]
结果,在根据本发明的示例的维持血管内皮细胞特性的培养方法中的血管内皮细胞的增殖培养可以允许均匀的血管内皮细胞增殖,而没有改变细胞形状和特性,尽管重复培养也如此。
[0176]
根据介质比较血管内皮细胞特性的维持
[0177]
在下文中,将参考图13a至15详细描述根据培养基的血管内皮细胞特性的维持。在这种情况下,根据本发明的示例的示例1被设定为根据本发明的示例的维持血管内皮细胞特性的含有4ng/ml至6ng/ml的fgf2、5ng/ml至10ng/ml的egf、10ng/ml至30ng/ml的vegf-a、20至50ng/ml的抗坏血酸和dmem/f-12的培养基。
[0178]
此外,比较例1设置为含有hfgf-b、vegf、r3-igf-1、抗坏血酸、hegf、肝素和ga-1000的常规细胞培养基,比较例2设置为本发明的血管内皮细胞的含有4ng/ml至6ng/ml的fgf2、5ng/ml至10ng/ml的egf、10ng/ml至30ng/ml的vegf-a、20ng/ml至30ng/ml的dll4和dmem/f-12的分化培养基。
[0179]
首先,图13a和13b示出了在根据本发明的示例的维持血管内皮细胞特性的培养方法中,根据血管内皮细胞培养基的阳性血管内皮细胞相对于标志物的相对表达水平。
[0180]
更具体地,参考图13a,示出了根据培养基的血管内皮细胞的标志物表达水平的结果。针对cdh5标志物的血管内皮细胞的阳性表达水平在比较例1中显示为96.2%,在比较例2中显示为99.4%,在示例1中显示为99.0%。
[0181]
此外,针对pecam1标志物的血管内皮细胞的阳性表达水平在比较例1中为42.9%,在比较例2中为37.6%,在示例1中为59.9%。
[0182]
此外,针对tek标志物的血管内皮细胞的阳性表达水平在比较例1中为57.3%,在比较例2中为38.8%,在示例1中为66.9%。
[0183]
此外,针对kdr标志物的血管内皮细胞的阳性表达水平在比较例1中为19.2%,在比较例2中为69.4%,在示例1中为63.8%。
[0184]
此外,针对vwf标志物的血管内皮细胞的阳性表达水平在比较例1中为85.0%,在比较例2中为91.6%,在示例1中为96.7%。
[0185]
因此,根据培养基的血管内皮细胞可以指显示针对作为在血管内皮细胞阳性对照
组中识别的标志物的cdh5、pecam1、tek、kdr和vwf的表达的血管内皮细胞。
[0186]
然而,参考图13b,示出了根据上述培养基的显示针对标志物的血管内皮细胞的阳性表达水平的图。更具体地,参考图13b(a)和13b(e),对于作为血管内皮细胞的特性指标的cdh5和vwf标志物,比较例1、比较例2和示例1均显示大量的阳性标志物表达细胞。另一方面,参考图13b(b)、13b(c)和13b(d)所示,对于作为血管内皮细胞的特征性指标的pecam1、tek和kdr标志物,示例1显示出比比较例1和比较例2更高数量的阳性标志物表达细胞。在这种情况下,仅通过确认少数指标的表达可能难以证明分化的细胞是血管内皮细胞。因此,与其相关的指标的数量越高,内皮细胞的纯度可能越高。因此,可能意指,对于在血管内皮细胞上特异性表达的所有标志物,显示大量阳性标志物表达细胞的示例1是最高纯度的分化血管内皮细胞。
[0187]
此外,参考图14,示出了根据本发明的示例的维持血管内皮细胞特性的培养方法中,根据血管内皮细胞的培养基的细胞生长速率与血管内皮细胞的传代次数的关系。更具体而言,比较例1中培养的血管内皮细胞的cpdl值在第1至4代中显示为1至4.5的范围内的值。这可能意味着一个血管内皮细胞可以增殖至24.5个。
[0188]
此外,在比较例2中培养的血管内皮细胞的cpdl值显示在第1至第4代中具有1至3范围内的值。这可能意味着一个血管内皮细胞可以增殖至23个。
[0189]
此外,在示例1中培养的血管内皮细胞的cpdl值在第1至第4代中显示具有在1至3.5的范围内的值。这可能意味着一个血管内皮细胞可增殖至23.5个。因此,细胞生长速率在比较例1中可能是最好的,可能增殖最多。然而,当细胞迅速而爆发性地增加时,细胞可能会形成细胞团块,从而诱导分化成不需要的细胞。
[0190]
因此,参考图15,在根据本发明的示例的维持血管内皮细胞特性的培养方法中,根据血管内皮细胞的培养基的血管内皮细胞的显微图像。更具体而言,显示出在比较例1中培养的血管内皮细胞中形成细胞团块。另一方面,在示例1中,显示出仅形成单个血管内皮细胞而没有形成细胞团块。因此,虽然仅在所需方向上诱导分化,但具有优异增殖能力的培养基可以是示例1。
[0191]
结果,根据本发明的示例的维持血管内皮细胞特性的培养基不会引起增殖和再生能力随着细胞培养的进行而降低的问题,并且血管内皮细胞特性是随突变而改变,从而具有增殖和维持高纯度的血管内皮细胞的作用。
[0192]
因此,本发明可以提供均匀的血管内皮细胞,从而提供可以稳定地用于临床应用的血管内皮细胞。
[0193]
尽管已经参照附图更详细地描述了本发明的示例,但是本发明不一定限于这些示例,并且可以在不背离本发明的技术精神的范围内进行各种修改。因此,本发明中公开的示例是说明性的,而不是限制本发明的技术精神,并且本发明的技术精神的范围不受这些示例的限制。因此,应当理解,上述示例在所有方面都是说明性的而不是限制性的。本发明的保护范围应以所附权利要求为准,凡与其等同的范围内的技术精神均应视为包含在本发明的保护范围之内。
[0194]
[支持本发明的国家研发项目]
[0195]
[项目唯一编号]hi16c2211
[0196]
[政府部门]保健福祉部
[0197]
[研究管理机构]韩国健康产业振兴院
[0198]
[研究项目名称]先进医疗技术开发计划
[0199]
[研究任务名称]人诱导多能干细胞源性内皮细胞的产生及疗效测定
[0200]
[贡献率]1/1
[0201]
[项目实施机构名称]延世大学产学研合作基金会
[0202]
[研究期间]2019年4月1日至2020年1月31日
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。