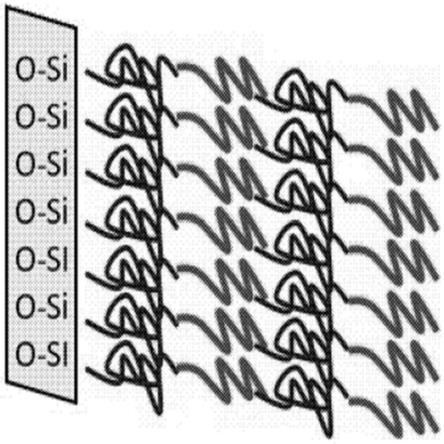
mta-协同prmt5抑制剂
1.相关申请的交叉引用
2.本技术要求2019年9月12日提交的美国临时申请第62/899,575号、2019年12月3日提交的美国临时申请第62/942,833号、2020年1月15日提交的美国临时申请第62/961,371号、2020年3月26日提交的美国临时申请第62/994,927号和2020年8月3日提交的美国临时申请第63/060,261号的优先权的权益,每个申请的公开据此通过引用以其整体并入。
技术领域
3.本发明涉及作为蛋白质精氨酸n-甲基转移酶5(prmt5)的mta协同抑制剂的化合物。特别地,本发明涉及化合物、包含所述化合物的药物组合物及其使用方法。
背景技术:
4.蛋白质精氨酸n-甲基转移酶(prmt5)是一种ii型精氨酸甲基转移酶,其催化甲基基团从s-腺苷-l-甲硫氨酸(sam)转移到蛋白质l-精氨酸残基的胍基功能的ω-氮(ω-单甲基化)以及第二甲基基团转移到另一个ω-氮,产生对称二甲基精氨酸(sdma)。prmt5与mep50(甲基小体蛋白50)形成复合物,这是底物识别和定向所必需的并且也是prmt5催化的组蛋白2a和组蛋白4甲基转移酶活性所必需的(例如,参见ho等人,(2013)plos one 8(8):10.1371/annotation/e6b5348e-9052-44ab-8f06-90d01dc88fc2)。
5.p16/cdkn2a的纯合性缺失在癌症中很普遍,并且这些突变通常涉及相邻基因的共缺失,包含编码甲硫腺苷磷酸化酶(mtap)的基因。据估计,约15%的所有人类癌症具有mtap基因的纯合性缺失(例如,参见firestone&schramm(2017)《美国化学学会杂志(j.am.chem soc.)》139(39):13754-13760.doi:10.1021/jacs.7b05803.epub 2017年9月20日)。
6.缺乏mtap活性的细胞具有升高水平的mtap底物甲硫腺苷(mta),其是prmt5的强效抑制剂。对prmt5活性的抑制导致甲基化活性降低和细胞增殖对prmt5耗竭或活性丧失的敏感性增加。因此,mtap活性的丧失会降低prmt5的甲基化活性,使细胞选择性地依赖于prmt5活性。
技术实现要素:
7.因此,我们认识到,在mtap缺失型癌症中,mta协同抑制prmt5活性将为广泛的癌症提供治疗益处。本发明的化合物作为prmt5的mta协同抑制剂提供这种治疗益处,所述prmt5负调节细胞(特别是mtap缺陷细胞)中mta结合的prmt5的活性,或用于治疗各种形式的mtap相关癌症。
8.需要开发新的mta协同prmt5抑制剂,其能够在升高的mta浓度的情况下抑制prmt5活性,特别是在mtap缺陷细胞中。
9.在本发明的一个方面中,提供了由式(i)表示的化合物:
[0010][0011]
及其药学上可接受的盐:
[0012]
其中:
[0013]
r1是氢、卤素、羟烷基、-l-cn、-y-c1-c5烷基、-y-环烷基、-y-杂环基、-y-芳基、-y-arc1-c3烷基或-y-杂芳基,其中环烷基、杂环基、芳基和杂芳基部分各自任选地被一个或多个r2取代;
[0014]
每个y独立地是键或-nr
4-;
[0015]
每个r2独立地是羟基、卤素、氰基、氰基甲基、-(nr4)2、羟烷基、烷氧基、-so2c1-c3烷基、-x-arc1-c3烷基、杂烷基、c2-c4炔基、-x-卤代烷基、-x-c1-c5烷基、-z-c1-c5烷基、杂环基、-x-l-环烷基、-z-环烷基、-x-芳基、-z-芳基或-x-杂芳基,其中杂环基、环烷基、芳基和杂芳基任选地被一个或多个r5取代;
[0016]
每个x独立地是键、o、s、-nr
4-或-nr4c(o)-;
[0017]
每个z独立地是键、-so-、-so
2-、-ch(oh)-或-c(o)-;
[0018]
每个l独立地是键或c1-c3亚烷基;
[0019]r3a
和r
3b
各自独立地是氢或氘,或r
3a
和r
3b
一起是氧代;
[0020]
每个r4独立地是氢或c1-c3烷基;
[0021]
每个r5独立地是氰基、氧代、卤素、c1-c3烷基、羟烷基、烷氧基、-x-卤代烷基、-z-环烷基、-x-arc1-c3烷基、被氰基取代的-x-arc1-c3烷基、-x-l-环烷基、任选被一个或多个c1-c3烷基或氧代取代的-x-l-杂芳基,或-x-芳基;和
[0022]
r6是氢、卤素、c1-c3烷基、卤代烷基或烷氧基。
[0023]
在本发明的一个方面中,提供了由式(i-a)表示的化合物:
[0024][0025]
或其药学上可接受的盐,其中r1、r2、r
3a
、r
3b
、r4、r5、r6、y、x、z和l如各自针对式i定义的。
[0026]
在本发明的一个方面中,提供了由式(i-b)表示的化合物:
[0027][0028]
或其药学上可接受的盐,其中r1、r2、r
3a
、r
3b
、r4、r5、r6、y、x、z和l如各自针对式i定义的。
[0029]
在本发明的一个方面中,提供了由式(i-c)表示的化合物:
[0030][0031]
或其药学上可接受的盐,其中r1、r2、r
3a
、r
3b
、r4、r5、r6、y、x、z和l如各自针对式i定义的。
[0032]
在本发明的另一个方面中,提供了由式(i-d)表示的化合物:
[0033][0034]
或其药学上可接受的盐:
[0035]
其中:
[0036]
每个y独立地是键或-nr
4-;
[0037]
每个r2独立地是羟基、卤素、氰基、氰基甲基、-(nr4)2、羟烷基、烷氧基、-so2c1-c3烷基、-x-arc1-c3烷基、杂烷基、c2-c4炔基、-x-卤代烷基、-x-c1-c5烷基、-z-c1-c5烷基、杂环基、-x-l-环烷基、-z-环烷基、-x-芳基、-z-芳基或-x-杂芳基,其中杂环基、环烷基、芳基
和杂芳基任选地被一个或多个r5取代,或者;
[0038]
每个x独立地是键、o、s、-nr
4-或-nr4c(o)-;
[0039]
每个z独立地是键、-so-、-so
2-、-ch(oh)-或-c(o)-;
[0040]
每个l独立地是键或c1-c3亚烷基;
[0041]
每个r4独立地是氢或c1-c3烷基;
[0042]
每个r5独立地是氰基、氧代、卤素、c1-c3烷基、羟烷基、烷氧基、-x-卤代烷基、-z-环烷基、-x-arc1-c3烷基、被氰基取代的x-arc1-c3烷基、-x-l-环烷基、任选地被一个或多个c1-c3烷基或氧代取代的-x-l-杂芳基,或-x-芳基;和
[0043]
r6是氢、卤素、c1-c3烷基、卤代烷基或烷氧基。
[0044]
在本发明的另一个方面中,提供了可用于制备式(i)、式(i-a)、式(i-b)和式(i-c)的化合物的中间体。
[0045]
在本发明的另一个方面中,提供了包含治疗有效量的本发明的化合物或其药学上可接受的盐和药学上可接受的赋形剂的药物组合物。
[0046]
在本发明的另一个方面中,用于抑制细胞中prmt5活性的方法,包括使细胞与式(i)、式(i-a)、式(i-b)和式(i-c)的化合物接触。在一个实施例中,所述接触是体外的。在一个实施例中,所述接触是体内的。
[0047]
本文还提供了一种体外或体内抑制细胞增殖的方法,所述方法包括使细胞与有效量的如本文所定义的式(i)、式(i-a)、式(i-b)、式(i-c)化合物或其药学上可接受的盐或其药物组合物接触。在一个实施例中,所述细胞是mtap缺陷型细胞。
[0048]
还提供了用于治疗患者的癌症的方法,所述方法包括向有需要的患者施用治疗有效量的本发明的化合物或药物组合物或其药学上可接受的盐。
[0049]
本文还提供了一种用于治疗需要其的患者的癌症的方法,所述方法包括(a)确定所述癌症与mtap双缺失相关(例如,mtap-相关癌症);和(b)向所述患者施用治疗有效量的式(i)、式(i-a)、式(i-b)、式(i-c)的化合物或其药学上可接受的盐或其药物组合物。
具体实施方式
[0050]
本发明涉及mta协同prmt5抑制剂。特别地,本发明涉及在结合的mta的存在下抑制prmt5活性的化合物、包含治疗有效量的化合物的药物组合物及其使用方法。
[0051]
定义
[0052]
除非另有定义,否则本文使用的所有技术术语和科学术语具有与本发明所属领域的技术人员通常理解的含义相同的含义。本文提及的所有专利、专利申请和出版物都在它们与本公开内容一致的程度上通过引用被并入。除非另有明确定义,否则术语和范围具有其通常限定的定义。
[0053]
为了简单起见,化学部分在全文中主要被定义为和称为单价化学部分(例如烷基、芳基等)。然而,此类术语也可以用于在本领域技术人员清楚的适当结构环境下表达相应的多价部分。例如,虽然“烷”部分通常指单价自由基(例如ch
3-ch
2-),但在某些情况下,二价连接部分可以是“烷基”,在这种情况下,本领域技术人员将理解烷基是二价自由基(例如-ch
2-ch
2-),其等同于术语“亚烷基”(类似地,在其中需要二价部分并被称为“芳基”的情况下,本领域技术人员将理解术语“芳基”是指相应的二价部分,亚芳基。)所有原子都被理解
为具有其用于键形成的正常的化合价数(即,对于碳为4价,对于n为3价,对于o为2价,对于s为2、4或6价,取决于s的氧化态)。
[0054]
如本文所用,“prmt5”是指哺乳动物蛋白质精氨酸n-甲基转移酶5(prmt5)酶。
[0055]
如本文所用,“prmt5抑制剂”或“mta-协同prmt5抑制剂”是指如本文所述由式(i)表示的本发明的化合物。在体外或体内存在结合的mta时,或在表达升高水平的mta的细胞中,这些化合物能够负调节或抑制prmt5的全部或部分酶活性。
[0056]
如本文所用,“mtap”是指哺乳动物甲硫腺苷磷酸化酶(mtap)酶。
[0057]
如本文所用的“mtap相关疾病或障碍”是指与mtap活性的丧失相关的或由mtap活性的丧失介导的或具有mtap活性的丧失的疾病或障碍,其导致使所述障碍对prmt5活性的选择性抑制敏感。mtap相关疾病或障碍的非限制性实例是mtap相关癌症。
[0058]
术语“氨基”是指
–
nh2。
[0059]
术语“乙酰基”是指
“‑
c(o)ch3。
[0060]
如本文所用,术语“酰基”是指烷基羰基或芳基羰基取代基,其中烷基和芳基部分如本文所定义。
[0061]
如本文所用的术语“烷基”是指具有1至12个碳原子的饱和直链和支链脂族基团。因此,“烷基”包括c1、c2、c3、c4、c5、c6、c7、c8、c9、c
10
、c
11
和c
12
基团。烷基基团的实例包含但不限于甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基和己基。
[0062]
如本文所用的术语“烯基”是指具有一个或多个碳-碳双键、具有2至12个碳原子的不饱和直链或支链脂族基团。因此,“烯基”包括c2、c3、c4、c5、c6、c7、c8、c9、c
10
、c
11
和c
12
基团。烯基基团的实例包含但不限于乙烯基、丙烯基、丁烯基、戊烯基和己烯基。
[0063]
如本文使用的术语“炔基”是指具有一个或多个碳-碳三键、具有2至12个碳原子的不饱和直链或支链脂族基团。因此,“炔基”包括c2、c3、c4、c5、c6、c7、c8、c9、c
10
、c
11
和c
12
基团。炔基基团的实例包含但不限于乙炔基、丙炔基、丁炔基、戊炔基和己炔基。
[0064]“亚烷基”、“亚烯基”或“亚炔基”基团是位于两个其它化学基团之间并用于连接两个其它化学基团的如上定义的烷基、烯基或炔基基团。亚烷基基团的实例包含但不限于亚甲基、亚乙基、亚丙基和亚丁基。示例性的亚烯基基团包含但不限于亚乙烯基、亚丙烯基和亚丁烯基。示例性的亚炔基基团包含但不限于亚乙炔基、亚丙炔基和亚丁炔基。
[0065]
术语“烷氧基”是指-oc1-c6烷基。
[0066]
如本文使用的术语“环烷基”是具有3至12个碳的饱和的和部分不饱和的环状烃基团。因此,“环烷基”包含c3、c4、c5、c6、c7、c8、c9、c
10
、c
11
和c
12
环状烃基团。环烷基基团的实例包含但不限于环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、环庚基和环辛基。
[0067]
术语“杂烷基”是指如上定义的烷基基团,其中链中的一个或多个碳原子独立地被o、s或nr
x
取代,其中r
x
是氢或c1-c3烷基。杂烷基基团的实例包含甲氧基甲基、甲氧基乙基和甲氧基丙基。
[0068]“芳基”基团是包含一至三个芳环的c
6-c
14
芳族部分。因此,“芳基”包含c6、c
10
、c
13
和c
14
环状烃基团。示例性的芳基基团是c
6-c
10
芳基基团。特定的芳基基团包含但不限于苯基、萘基、蒽基和芴基。“芳基”基团还包含稠合的多环(例如双环)环体系,其中一个或多个稠合环是非芳族的,条件是至少一个环是芳族的,例如茚基。
[0069]“芳烷基”或“芳基烷基”基团包括与烷基基团共价连接的芳基基团,其中该部分通
过烷基部分与另一个基团连接。示例性的芳烷基基团是-(c1-c6)烷基(c6-c10)芳基,包含但不限于苄基、苯乙基和萘甲基。例如,arc1-c3烷基是与c1-c3烷基共价连接的芳基基团。
[0070]“杂环基”或“杂环”基团是具有3至12个原子(3、4、5、6、7、8、9、10、11或12个原子),例如4至8个原子的单环或双环(稠合或螺)环结构,其中一个或多个环原子独立地为-c(o)-、n、nr4、o或s,并且其余环原子为季碳或羰基碳。杂环基团的实例包含但不限于环氧、环氧乙烷基、氧杂环丁烷基、氮杂环丁烷基、氮丙啶基、thfyl、四氢吡喃基、四氢噻吩基、吡咯烷基、哌啶基、哌嗪基、咪唑烷基、噻唑烷基、硫杂烷基、二噻烷基、三噻烷基、氮杂噻烷基、氧杂噻烷基、二氧戊环基、噁唑烷基、噁唑烷酮基、十氢喹啉基、哌啶基、4-哌啶基、硫代吗啉基、二甲基-吗啉基和吗啉基。特别排除在该术语范围之外的是具有相邻环o和/或s原子的化合物。
[0071]
如本文所用,“l-杂环基”是指通过亚烷基接头与另一个基团共价连接的杂环基基团。
[0072]
如本文所用,术语“杂芳基”是指这样的基团,所述基团具有5至14个环原子,优选地5、6、10、13或14个环原子;在环状阵列中具有6、10或14个π电子;并且除了碳原子之外,还具有1至3个各自独立地为n、o或s的杂原子。“杂芳基”还包含稠合的多环(例如双环)环体系,其中一个或多个稠合环是非芳族的,条件是至少一个环是芳族的,并且至少一个环包含n、o或s环原子。
[0073]
杂芳基基团的实例包含吖啶基、偶氮烷基(azocinyl)、苯并咪唑基、苯并呋喃基、苯并[d]噁唑-2(3h)-酮、2h-苯并[b][1,4]噁嗪-3(4h)-酮、苯并噻吩基(benzothiofuranyl)、苯并噻吩基(benzothiophenyl)、苯并噁唑基、苯并噻唑基、苯并三唑基、苯并四唑基、苯并异噁唑基、苯并异噻唑基、苯并咪唑啉基、咔唑基、4ah-咔唑基,咔啉基,苯并二氢吡喃基、苯并吡喃基、噌啉基、呋喃基、呋咱基、咪唑啉基、咪唑基、1h-吲唑基、吲哚烯基、二氢吲哚基、吲哚嗪基、吲哚基、3h-吲哚基、异苯并呋喃基、异苯并二氢吡喃基、异吲唑基、异吲哚啉基、异吲哚基、异喹啉基、异噻唑基、异噁唑基、萘啶基、八氢异喹啉基、噁二唑基、1,2,3-噁二唑基、1,2,4-噁二唑基、1,2,5-噁二唑基、1,3,4-噁二唑基、噁唑烷基、噁唑基、噁唑烷基、嘧啶基、菲啶基、菲咯啉基、吩嗪基、吩噻嗪基、吩噻嗪基、吩噁嗪基、酞嗪基、胡椒基、蝶啶基、嘌呤基、吡喃基、吡嗪基、吡唑烷基、吡唑啉基、吡唑基、哒嗪基、吡啶并噁唑、吡啶并咪唑、吡啶并噻唑、吡啶基(pyridinyl)、吡啶基(pyridyl)、嘧啶基、吡咯啉基、2h-吡咯基、吡咯基、喹唑啉基、喹啉基、4h-喹啉基、喹喔啉基、喹啉基、四氢异喹啉基、四氢喹啉基、四唑基、6h-1,2,5-噻二嗪基、1,2,3-噻二唑基、1,2,4-噻二唑基、1,2,5-噻二唑基、1,3,4-噻二唑基、噻蒽基、噻唑基、噻吩基、噻吩并噻唑基、噻吩并噁唑基、噻吩并咪唑基、噻吩基、三嗪基、1,2,3-三唑基、1,2,4-三唑基、1,2,5-三唑基、1,3,4-三唑基和呫吨基。
[0074]“l-杂芳烷基”或“l-杂芳基烷基”基团包含通过亚烷基接头共价连接到另一基团的杂芳基基团。杂烷基基团的实例包括c
1-c6烷基基团和具有5、6、9或10个环原子的杂芳基基团。杂芳烷基的实例包含吡啶基甲基、吡啶基乙基、吡咯基甲基、吡咯基乙基、咪唑基甲基、咪唑基乙基、噻唑基甲基、噻唑基乙基、苯并咪唑基甲基、苯并咪唑基乙基喹唑啉基甲基、喹啉基甲基、喹啉基乙基、苯并呋喃基甲基、吲哚啉基乙基异喹啉基甲基、异吲哚基甲基、肉桂基甲基和苯并噻吩基乙基。特别排除在该术语范围之外的是具有相邻环o和/或s原子的化合物。
[0075]“亚芳基”、“杂亚芳基”或“杂亚环基”基团分别是位于两个其它化学基团之间并用于连接两个其它化学基团的如上文所定义的二价芳基、杂芳基或杂环基基团。
[0076]
如本文所用,当部分(例如环烷基、芳基、杂芳基、杂环基、脲等)被描述为“任选取代的”而没有明确指出取代基是指该基团任选地具有1至4个,优选地1至3个,更优选地1或2个非氢取代基。
[0077]
如本文使用的术语“卤素”或“卤代”是指氯、溴、氟或碘。
[0078]
术语“卤代烷基”是指其中一个或多个氢已经被卤素取代的烷基链。示例性的卤代烷基是三氟甲基、二氟甲基、氟氯甲基、氯甲基和氟甲基。
[0079]
术语“羟烷基”是指-亚烷基-oh。
[0080]
如本文所用,化合物的“有效量”是足以负调节或抑制prmt5酶的活性的量。
[0081]
如本文所用,化合物的“治疗有效量”是足以改善或以某种方式减少症状或停止或逆转病症的进展,或负调节或抑制prmt5的活性的量。这样的量可以作为单剂量施用,或者可以根据方案施用,由此其是有效的。
[0082]
如本文所用,“治疗”是指改善或以其它方式有益地改变患者的病症、障碍或疾病的症状或病理的任何方式。
[0083]
如本文所用,“通过施用特定化合物或药物组合物改善特定障碍的症状”是指可以归因于施用所述组合物或与施用所述组合物相关的任何减轻,无论是永久的或暂时的、持久的或短暂的。
[0084]
化合物
[0085]
在本发明的一个方面中,提供了由式(i)表示的化合物:
[0086][0087]
或其药学上可接受的盐:
[0088]
其中:
[0089]
r1是氢、卤素、羟烷基、-l-cn、-y-c1-c5烷基、-y-环烷基、-y-杂环基、-y-芳基、-y-arc1-c3烷基或-y-杂芳基,其中环烷基、杂环基、芳基和杂芳基部分各自任选地被一个或多个r2取代;
[0090]
每个y是键或-nr
4-;
[0091]
每个r2独立地是羟基、卤素、氰基、氰基甲基、-(nr4)2、羟烷基、烷氧基、-so2c1-c3烷基、-x-arc1-c3烷基、杂烷基、c2-c4炔基、-x-卤代烷基、-x-c1-c5烷基、-z-c1-c5烷基、杂环基、-x-l-环烷基、-z-环烷基、-x-芳基、-z-芳基或-x-杂芳基,其中杂环基、环烷基、芳基和杂芳基任选地被一个或多个r5取代;
[0092]
每个x独立地是键、o、s、-nr
4-或-nr4c(o)-;
取代的吡唑并吡啶基。在一个实施例中,吡唑基吡啶基被一个r2取代,其中一个r2是烷氧基或-x-芳基。在一个实施例中,烷氧基是甲氧基或异丙氧基。在某些实施例中,-x-芳基,x是o并且芳基是苯基。
[0112]
在一个实施例中,y是键并且r1杂芳基是吡啶基,其任选地被一个或两个r2取代。在某些实施例中,吡啶基被一个r2取代,其中r2是羟基、卤素、氰基、氰基甲基、-(nr4)2、羟烷基、烷氧基、-so2c1-c3烷基、arc1-c3烷基、杂烷基、c2-c4炔基、-x-卤代烷基、-x-c1-c5烷基、-z-c1-c5烷基、杂环基、-x-l-环烷基、-z-环烷基、-x-芳基、-z-芳基或-x-杂芳基,其中杂环基、环烷基、芳基和杂芳基任选地被一个或多个r5取代。
[0113]
在一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是吡啶基并且r2是-x-c1-c5烷基,x是键并且c1-c5烷基是甲基、乙基丙基、异丙基、丁基、异丁基、戊基或异戊基。
[0114]
在一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是吡啶基并且r2是-x-卤代烷基,x是键并且卤代烷基是二氟甲基或三氟甲基。在另一个实施例中,r2是-x-卤代烷基,其中x是o,并且其中卤代烷基是二氟甲基或三氟甲基。
[0115]
在一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是吡啶基并且r2是-x-l-环烷基,其中x是键,l是键并且环烷基是环丙基或环己基。在另一个实施例中,r2是-x-l-环烷基,其中x是键,l是亚甲基并且环烷基是环丙基。在一个实施例中,r2是-x-l-环烷基,其中x是o,l是亚甲基并且环烷基是环丙基。
[0116]
在一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是吡啶基并且r2是c2-c4炔基,其中炔基是乙炔基或丙-2-炔基。
[0117]
在另一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是吡啶基并且r2是-so2c1-c3烷基,其中c1-c3烷基是甲基。
[0118]
在一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是吡啶基并且r2是杂环基,其中杂环基是吗啉基或四氢吡喃基。
[0119]
在其他实施例中,r1是-y-杂芳基,y是键并且杂芳基是吡啶基并且r2是-x-杂芳基,其中杂芳基任选地被一个或多个r5取代。在一个实施例中,x是键,杂芳基是被一个r5取代的吡唑基,其中r5是c1-c3烷基。在一个实施例中,x是键,杂芳基是吡啶基或嘧啶基,其各自任选被一个r5取代。
[0120]
在一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是吡啶基并且r2是arc1-c3烷基,其中arc1-c3烷基是苄基。
[0121]
在一个实施例中,其中r1是-y-杂芳基,y是键并且杂芳基是吡啶基并且r2是-x-杂芳基,其中x是o,并且杂芳基是任选地被一个或多个r5取代的喹啉基。在另一个实施例中,x是-nr
4-,并且杂芳基是任选地被一个或多个r5取代的喹啉基。
[0122]
在一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是吡啶基并且r2是-x-芳基,其中x是o并且芳基是任选地被一个、两个或三个r5取代的苯基。在一个实施例中,一个、两个或三个r5基团中的每一个独立地选自由氰基、卤素、c1-c3烷基和烷氧基组成的群组。在一个实施例中,x是s并且芳基是任选地被一个r5取代的苯基,其中r5是卤素或c1-c3烷基。在一个实施例中,x是o并且芳基是任选地被两个r5基团取代的苯基,其中每个r5基团独立地是氰基。在一个实施例中,x是-nr
4-并且芳基是任选地被两个r5基团取代的苯基,其中每个r5基团独立地是烷氧基。在某些实施例中,每个烷氧基是甲氧基。
[0123]
在一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是吡啶基并且r2是卤素,其中卤素是氯或氟。在一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是吡啶基并且r2是-x-l-环烷基、杂环基或-x-芳基,其中芳基任选地被一个或多个r5取代。在一个实施例中,r2是-x-l-环烷基,其中x和l各自是键并且环烷基是环己基。在一个实施例中,r2是杂环基,其中杂环基是四氢吡喃基。在一个实施例中,r2是-x-芳基,其中芳基是被两个r5取代的苯基,其中每个r5是氰基。
[0124]
在某些实施例中,r1是-y-杂芳基,y是键并且杂芳基是被两个r2取代的吡啶基。在一个实施例中,每个r2独立地是-x-c1-c5烷基或一个r2是卤素或环烷基并且第二个r2是-x-c1-c5烷基,其中x是键。
[0125]
在式(i)的化合物的一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是嘧啶基,其任选被一个或两个r2取代。在一个实施例中,嘧啶基被一个r2取代,其中r2是-x-c1-c5烷基或-x-卤代烷基。在一个实施例中,每个x是键。
[0126]
在式(i)的化合物的一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是喹啉基,其任选被一个或两个r2取代。在某些实施例中,一个r2基团是氰基。在某些实施例中,一个r2基团是氰基并且第二个r2是卤素或-x-c1c5烷基。
[0127]
在式(i)的化合物的一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是异噻唑基,其任选被一个或两个r2取代。在一个实施例中,r2是任选地被一个r5取代的-x-芳基,其中该芳基是被一个r5取代的萘基,其中r5是氰基。
[0128]
在式(i)的化合物的一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是吡唑基,其任选被一个、两个或三个r2基团取代。
[0129]
在某些实施例中,吡唑基被一个r2取代,其中r2是氰基、-x-c1-c5烷基、羟烷基、arc1-c3烷基或-x-芳基,其中芳基任选地被一个或多个r5取代。在一个实施例中,r2是-x-c1-c5烷基,其中x是键并且c1-c5烷基是甲基、乙基、丙基、异丙基、丁基、异丁基、戊基或异戊基。
[0130]
在其他实施例中,吡唑基被两个r2基团取代,其中两个r2基团独立地为(1)-x-c1-c5烷基,(2)-x-c1-c5烷基和卤素,(3)-x-c1-c5烷基和烷氧基,(4)-x-c1-c5烷基和-n(r4)2,-(5)x-c1-c5烷基和-x-卤代烷基,(6)-x-c1-c5烷基和arc1-c3烷基,(7)-x-c1-c5烷基和-x-l-环烷基,-(8)-x-c1-c5烷基和-杂环基,(9)-x-c1-c5烷基和-x-芳基任选地被一个或多个r5取代,(10)-x-c1-c5烷基和任选地被一个或多个r5取代的-x-杂芳基,(11)-x-c1-c5烷基和氰基甲基,(12)-x-c1-c5烷基和氰基,(13)氰基和卤素,其中卤素是氯或氟,(14)氰基和-x-l-环烷基,(15)独立地卤素,(16)氰基和烷氧基,其中每个x是键,(17)氰基和-x-芳基,(18)氰基和-x-杂芳基,(19)氰基和杂环基(20)卤素和-x-arc1-c3烷基或被氰基取代的x-arc1-c3烷基和(21)卤素和-x-芳基。
[0131]
在其中r1是吡唑基的一个实施例中,吡唑基被两个r2取代,其中一个r2是-x-c1-c5烷基,并且第二个r2是任选被一个或多个r5取代的-x-芳基。在一个实施例中,每个x是键,并且芳基是被两个r5取代的苯基,其中(1)每个r5独立地是-x-c1-c5烷基,其中x是键;(2)一个r5是氰基,并且一个r5是-x-c1-c5烷基,其中x是键;(3)一个r5是氰基,并且一个r5是-x-l-环烷基,其中x是键,并且l是键、亚甲基或亚乙基;(4)一个r5是氰基并且一个r5是卤素;(5)一个r5是氰基并且一个r5是烷氧基;(6)每个r5独立地是氰基或(7)每个r5独立地是卤素。
[0132]
在其中r1是吡唑基的一个实施例中,吡唑基被两个r2取代,其中一个r2是-x-c1-c5烷基,并且第二个r2是任选地被一个或多个r5取代的-x-芳基。在一个实施例中,x是键,并且芳基是被一个r5取代的萘基,其中r5是氰基或卤素。在一个实施例中,萘基被两个r5基团取代,其中一个r5是氰基,并且第二个r5是卤素、烷氧基或氰基。在一个实施例中,萘基被三个r5基团取代,其中一个r5是氰基,并且第二个r5是x-卤代烷基,且第三个r5是-x-l-环烷基。
[0133]
在一个实施例中,其中r1是吡唑基,吡唑基被两个r2取代,其中一个r2是-x-c1-c5烷基,并且第二个r2是任选地被一个或多个r5取代的-x-芳基。在一个实施例中,x是键,并且芳基是被三个r5取代的苯基,其中(1)每个r5独立地是-x-c1-c5烷基,其中每个x是键;(2)一个r5是氰基,并且两个r5是-x-c1-c5烷基,其中每个x是键;(3)一个r5是氰基,一个r5是卤素,并且一个r5是-x-c1-c5烷基,其中x是键;(4)一个r5是氰基,并且两个r5是烷氧基,(5)一个r5是氰基,并且两个r5是卤素,(6)一个r5是氰基,一个r5是卤素,并且一个r5是烷氧基,(7)或者一个r5是氰基,一个r5是卤素,并且一个r5是-x-l-环烷基。
[0134]
在其中r1是吡唑基的一个实施例中,吡唑基被两个r2取代,其中一个r2是-x-c1-c5烷基,并且第二个r2是任选地被一个或多个r5取代的-x-杂芳基。在一个实施例中,每个x是键,并且杂芳基是喹啉基、吡唑基、苯并二氢吡喃基、吲哚嗪基(indolizinyl)、二氢苄基呋喃基或嘧啶并吡啶基,其各自任选地被一个或多个r5取代。
[0135]
在一个实施例中,吡唑基被三个r2取代,其中每个r2独立地是-x-c1-c5烷基并且每个x是键。
[0136]
在其中r1是吡唑基的一个实施例中,吡唑基被三个r2取代,其中(1)一个r2是氰基,并且两个r2是卤素;(2)一个r2是氰基,一个r2是卤素,并且一个r2是烷氧基。在其他实施例中,一个r2是烷氧基,并且两个r2独立地是卤素。
[0137]
在式(i)的化合物的一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是咪唑基、1h-吡咯并吡啶基、四氢吡唑并吡嗪基、2h
‑‑
咪唑并嘧啶基、2h
‑‑
咪唑并哒嗪基或噁唑并吡啶基,其各自被一个r2基团取代,其中r2是-x-c1-c5烷基,其中x是键。在一个实施例中,杂芳基是被一个r2取代的1h-吡咯并吡啶基,其中r2是氰基或-x-芳基。在某些实施例中,-x-芳基的x是键并且芳基是苯基。在一个实施例中,杂芳基是被一个r2取代的咪唑基,其中r2是羟烷基或-x-芳基。
[0138]
在式(i)的化合物的一个实施例中,r1是-y-杂芳基,y是键并且杂芳基是被一个r2基团取代的咪唑并吡啶基,其中r2是氰基、烷氧基、卤素或-x-c1-c5烷基。在其他实施例中,杂芳基是被两个r2基团取代的咪唑并吡啶基,其中一个r2是卤素并且第二个r2基团是-x-c1-c5烷基或卤素。
[0139]
在式(i)的化合物的一个实施例中,r1是-y-芳基,y是-nr
4-并且芳基是任选地被一个或多个r5取代的苯基。
[0140]
在一个实施例中,r1是-y-arc1-c3烷基。在一个实施例中,y是-nr
4-并且arc1-c3烷基是苄基。
[0141]
在一个实施例中,r
3a
和r
3b
各自为氢。在另一个实施例中,r
3a
和r
3b
各自是氘。在某些实施例中,r
3a
和r
3b
之一是氢并且另一个是氘。在一个实施例中,r
3a
和r
3b
一起是氧代。
[0142]
在一个实施例中,每个r4是氢。在一个实施例中,每个r4独立地是c1-c3烷基。在一个实施例中,一个r4是氢,并且另一个r4是c1-c3烷基。
[0143]
在一个实施例中,环烷基、芳基或杂芳基环任选被一个或多个r5取代,其中r5是氰基、氧代、卤素、c1-c3烷基、羟烷基、烷氧基、-x-卤代烷基、-z-环烷基、-x-arc1-c3烷基、-x-l-环烷基或-x-芳基。
[0144]
在一个实施例中,r6是氢。在一个实施例中,r6是卤素。在某些实施例中,卤素是氯或氟。在一个实施例中,r6是c1-c3烷基。在某些实施例中,c1-c3烷基是甲基或乙基。在一个实施例中,r6是烷氧基。在某些实施例中,烷氧基是甲氧基。在一个实施例中,r6是卤代烷基。在某些实施例中,卤代烷基是三氟甲基。
[0145]
在本发明的一个方面中,提供了由式(i-a)表示的化合物:
[0146][0147]
或其药学上可接受的盐,其中r1、r2、r
3a
、r
3b
、r4、r5、r6、y、x、z和l如各自针对式i定义的。
[0148]
在本发明的一个方面中,提供了由式(i-b)表示的化合物:
[0149][0150]
或其药学上可接受的盐,其中r1、r2、r
3a
、r
3b
、r4、r5、r6、y、x、z和l如各自针对式i定义的。
[0151]
在本发明的一个方面中,提供了由式(i-c)表示的化合物:
[0152][0153]
或其药学上可接受的盐,其中r1、r2、r
3a
、r
3b
、r4、r5、r6、y、x、z和l如各自针对式i定义的。
[0154]
在本发明的另一个方面中,提供了由式(i-d)表示的化合物:
[0155][0156]
或其药学上可接受的盐:
[0157]
其中:
[0158]
每个y独立地是键或-nr
4-;
[0159]
每个r2独立地是羟基、卤素、氰基、氰基甲基、-(nr4)2、羟烷基、烷氧基、-so2c1-c3烷基、-x-arc1-c3烷基、杂烷基、c2-c4炔基、-x-卤代烷基、-x-c1-c5烷基、-z-c1-c5烷基、杂环基、-x-l-环烷基、-z-环烷基、-x-芳基、-z-芳基或-x-杂芳基,其中杂环基、环烷基、芳基和杂芳基任选地被一个或多个r5取代,或者;
[0160]
每个x独立地是键、o、s、-nr
4-或-nr4c(o)-;
[0161]
每个z独立地是键、-so-、-so
2-、-ch(oh)-或-c(o)-;
[0162]
每个l独立地是键或c1-c3亚烷基;
[0163]
每个r4独立地是氢或c1-c3烷基;
[0164]
每个r5独立地是氰基、氧代、卤素、c1-c3烷基、羟烷基、烷氧基、-x-卤代烷基、-z-环烷基、-x-arc1-c3烷基、被氰基取代的x-arc1-c3烷基、-x-l-环烷基、任选被一个或多个c1-c3烷基或氧代取代的-x-l-杂芳基,或-x-芳基;和
[0165]
r6是氢、卤素、c1-c3烷基、卤代烷基或烷氧基。
[0166]
在一个实施例中,式(i)、式(i-a)、式(i-b)和/或式(i-c)的化合物是:
[0167]
[0168]
[0169]
[0170]
[0171]
[0172]
[0173]
[0174]
[0175]
[0176]
[0177]
[0178]
[0179]
[0180]
[0181]
[0182]
[0183]
[0184]
[0185]
[0186][0187]
和前述化合物的药学上可接受的盐。
[0188]
在一个实施例中,式(i)的化合物是:
[0189][0190]
或前述化合物的药学上可接受的盐。
[0191]
式(i)、式(i-a)、式(i-b)和式(i-c)的化合物可以被配制成药物组合物。
[0192]
药物组合物
[0193]
在另一方面中,本发明提供了包括根据本发明的prmt5抑制剂和药学上可接受的
载体、赋形剂或稀释剂的药物组合物。本发明的化合物可以通过本领域熟知的任何方法配制,并且可以被制备用于通过任何途径(包含但不限于肠胃外、口服、舌下、透皮、局部、鼻内、气管内或直肠内)施用。在某些实施例中,本发明的化合物在医院环境中静脉内施用。在某些其他实施例中,可以优选地通过口服途径施用。
[0194]
载体的特性将取决于施用途径。如本文所用,术语“药学上可接受的”是指与生物系统诸如细胞、细胞培养物、组织或生物体相容,并且不干扰活性成分的生物活性的有效性的无毒材料。因此,除了抑制剂之外,本发明的组合物还可以包含稀释剂、填充剂、盐、缓冲剂、稳定剂、增溶剂和本领域熟知的其他材料。药学上可接受的制剂的制备描述于,例如,《雷明顿制药科学(remington's pharmaceutical sciences)》,第18版,编辑a.gennaro,麦克出版公司(mack publishing co.),宾夕法尼亚州伊斯顿(easton、pa.),1990。
[0195]
如本文所用,术语“药学上可接受的盐”是指保留上述化合物的所需生物活性并且表现出最小或不表现出不期望的毒理学作用的盐。此类盐的实例包含但不限于与无机酸(例如,盐酸、氢溴酸、硫酸、磷酸、硝酸等)形成的酸加成盐,以及与有机酸(诸如,乙酸、草酸、酒石酸、琥珀酸、苹果酸、抗坏血酸、苯甲酸、单宁酸、扑酸、海藻酸、聚谷氨酸、萘磺酸、萘二磺酸和聚半乳糖醛酸)形成的盐。所述化合物还可以作为本领域技术人员已知的药学上可接受的季铵盐施用,其具体包含式-nr z-的季铵盐,其中r是氢、烷基或苄基,并且z是抗衡离子,包含氯化物、溴化物、碘化物、
‑‑
o-烷基、甲苯磺酸盐、甲基磺酸盐、磺酸盐、磷酸盐或羧酸盐(诸如苯甲酸盐、琥珀酸盐、乙酸盐、乙醇酸盐、马来酸盐、苹果酸盐、柠檬酸盐、酒石酸盐、抗坏血酸盐、苯甲酸盐、肉桂酸盐、扁桃酸盐、苯甲酸苄酯(benzyloate)和二苯基乙酸盐)。
[0196]
活性化合物以足以向患者递送治疗有效量而不会在所治疗的患者中引起严重毒性作用的量被包含在药学上可接受的载体或稀释剂中。用于所有上述病症的活性化合物的剂量在约0.01至300mg/kg,优选地0.1至100mg/kg/天,更通常地0.5至约25mg/kg受体体重/天的范围内。在合适的载体中,典型的局部剂量为0.01-3%wt/wt。药学上可接受的衍生物的有效剂量范围可以基于待递送的母体化合物的重量来计算。如果该衍生物本身表现出活性,则可以使用该衍生物的重量或通过本领域技术人员已知的其它手段如上估计有效剂量。
[0197]
包括本发明的化合物的药物组合物可以用于本文所述的方法中。
[0198]
使用方法
[0199]
在另一个方面中,本发明提供了用于抑制细胞中prmt5活性的方法,所述方法包括在体外使需要抑制prmt5活性的细胞与有效量的式(i)、式(i-a)、式(i-b)或式(i-c)的化合物、其药学上可接受的盐或含有该化合物或其药学上可接受的盐的药物组合物接触。在一个实施例中,所述细胞是mtap缺陷型细胞。
[0200]
本文提供的组合物和方法尤其被认为可用于体内抑制细胞中的prmt5活性。在一个实施例中,使需要抑制prmt5活性的细胞在体内与治疗有效量的式(i)、式(i-a)、式(i-b)或式(i-c)的化合物或其药学上可接受的盐接触,以负调节prmt5的活性。在其它实施例中,可以使用治疗有效量的含有式(i)、式(i-a)、式(i-b)或式(i-c)的化合物的药学上可接受的盐或药物组合物。在一个实施例中,细胞是mtap缺陷型细胞。在一个实施例中,负调节prmt5的活性发生在存在结合的mta的情况下。
[0201]
通过负调节prmt5的活性,特别是在缺乏mtap活性的细胞的情况下,该方法被设计为抑制prmt5活性以阻断细胞增殖。根据特定的治疗方案,可以单剂量或多剂量接触细胞,以影响所需的prmt5的负调节。在存在和不存在mta的情况下以及在细胞中,使用众所周知的方法,包含下文实例b中所述的方法,可以在体外针对酶监测prmt5抑制的程度,以评估治疗的有效性和剂量。
[0202]
在另一个方面中,提供了治疗癌症的方法,所述方法包括向患有癌症的患者施用治疗有效量的式(i)、式(i-a)、式(i-b)或式(i-c)的化合物、其药学上可接受的盐或包含该化合物或其药学上可接受的盐的药物组合物。在一个实施例中,所述癌症是mtap相关癌症。
[0203]
本文提供的组合物和方法可以用于治疗多种癌症,包含肿瘤诸如前列腺癌、乳腺癌、脑癌、皮肤癌、宫颈癌、睾丸癌等。更具体地,可以通过本发明的组合物和方法治疗的癌症包含但不限于肿瘤类型诸如星形细胞癌、乳腺癌、宫颈癌、结肠直肠癌、子宫内膜癌、食道癌、胃癌、头颈癌、肝细胞癌、喉癌、肺癌、口腔癌、卵巢癌、前列腺癌和甲状腺癌以及肉瘤。更具体地,这些化合物可以用于治疗:心脏:肉瘤(血管肉瘤、纤维肉瘤、横纹肌肉瘤、脂肪肉瘤)、粘液瘤、横纹肌瘤、纤维瘤、脂肪瘤和畸胎瘤;肺:支气管肺癌(鳞状细胞、未分化小细胞、未分化大细胞、腺癌)、肺泡(细支气管)癌、支气管腺瘤、肉瘤、淋巴瘤、软骨瘤性错构瘤、间皮瘤;胃肠道:食管(鳞状细胞癌、腺癌、平滑肌肉瘤、淋巴瘤)、胃(癌、淋巴瘤、平滑肌肉瘤)、胰腺(导管腺癌、胰岛素瘤、胰高血糖素瘤、胃泌素瘤、类癌瘤、毒蛇瘤)、小肠(腺癌、淋巴瘤、类癌瘤、卡波西肉瘤、平滑肌瘤、血管瘤、脂肪瘤、神经纤维瘤、纤维瘤)、大肠(腺癌、管状腺瘤、绒毛状腺瘤、错构瘤、平滑肌瘤);泌尿生殖道:肾脏(腺癌、wilm瘤(肾母细胞瘤)、淋巴瘤、白血病)、膀胱和尿道(鳞状细胞癌、移行细胞癌、腺癌)、前列腺(腺癌、肉瘤)、睾丸(精原细胞瘤、畸胎瘤、胚胎癌、畸胎瘤、绒毛膜癌、肉瘤、间质细胞癌、纤维瘤、纤维腺瘤、腺瘤样瘤、脂肪瘤);肝脏:肝癌(肝细胞癌)、胆管癌、肝母细胞瘤、血管肉瘤、肝细胞腺瘤、血管瘤;胆道:胆囊癌、壶腹癌、胆管癌;骨:成骨肉瘤(骨肉瘤)、纤维肉瘤、恶性纤维组织细胞瘤、软骨肉瘤、尤文氏肉瘤、恶性淋巴瘤(网状细胞肉瘤)、多发性骨髓瘤、恶性巨细胞瘤脊索瘤、骨软骨性外生骨疣(osteochronfroma)(骨软骨性外生骨疣)、良性软骨瘤、软骨母细胞瘤、软骨粘液样纤维瘤(chondromyxofibroma)、骨样骨瘤和巨细胞瘤;神经系统:颅骨(骨瘤、血管瘤、肉芽瘤、黄色瘤、畸形性骨炎)、脑脊膜(脑脊膜瘤、脑脊膜肉瘤(meningiosarcoma)、神经胶质瘤病)、脑(星形细胞瘤、神经管母细胞瘤、神经胶质瘤、室管膜瘤、生殖细胞瘤、多形性胶质母细胞瘤(glioblastoma multiform)、少突神经胶质瘤、神经鞘瘤、视网膜母细胞瘤、先天性肿瘤)、脊髓神经纤维瘤、脑脊膜瘤、神经胶质瘤、肉瘤);妇科学的:子宫(子宫内膜癌)、宫颈(宫颈癌、肿瘤前宫颈非典型增生(pre-tumor cervical dysplasia))、卵巢(卵巢癌(浆液性囊腺癌、粘液性囊腺癌、未分类的癌)、粒-膜细胞肿瘤(granulosa-thecal cell tumor)、支持-间质细胞瘤、无性细胞瘤、恶性畸胎瘤)、外阴(鳞状细胞癌、上皮内癌、腺癌、纤维肉瘤、黑素瘤)、阴道(透明细胞癌、鳞状细胞癌、葡萄状肉瘤(胚胎性横纹肌肉瘤)、输卵管(癌);血液学的:血液(骨髓性白血病(急性的和慢性的)、急性淋巴母细胞性白血病、慢性淋巴细胞性白血病、骨髓增生性疾病、多发性骨髓瘤、骨髓增生异常综合征)、霍奇金病、非霍奇金淋巴瘤(恶性淋巴瘤);皮肤:恶性黑色素瘤、基底细胞癌、鳞状细胞癌、卡波西肉瘤、葡萄胎发育不良痣、脂肪瘤、血管瘤、皮肤纤维瘤、瘢痕疙瘩、银屑病;和肾上腺:神经母细胞瘤。在某些实施例中,癌症是弥漫性大b细胞淋巴瘤(dlbcl)。
[0204]
在一个实施例中,所述癌症是选自肝细胞癌、乳腺癌、皮肤癌、膀胱癌、肝癌、胰腺癌和头颈癌的mtap相关癌症。
[0205]
向患者施用的浓度和途径将根据待治疗的癌症而变化。所述化合物、其药学上可接受的盐和包括此类化合物和盐的药物组合物也可以与其它抗肿瘤化合物(例如,化疗)共同施用,或与其它治疗(诸如,放射或外科手术干预)组合使用,在手术前或手术后作为佐剂。
[0206]
一般反应方案、中间体和实例
[0207]
一般反应方案
[0208]
本发明的化合物可以在本文所述的合成方法和反应方案中使用市售试剂和中间体制备,或者可以使用本领域技术人员熟知的其它试剂和常规方法制备。
[0209]
例如,用于制备本发明的式(i)、式(i-a)、式(i-b)或式(i-c)的化合物的中间体和化合物可以根据一般反应方案i-xvi制备:
[0210]
一般反应方案i
[0211][0212]
其中r1=芳基/杂芳基,hal=cl、br或i
[0213]
其中r1是芳基或杂芳基的式(i)的化合物可以根据一般反应方案i制备。化合物7a和7b都是式(i)的实例,其中r1是芳基或杂芳基,并且r
3a
和r
3b
是h。卤代芳基环酸酐1在高温下用双(亲核试剂)诸如水合肼在乙酸中处理,以形成邻苯二甲酰肼2,其用卤化剂例如pocl3处理,以得到三卤代酞嗪3。用醇例如苯甲醇和nah在thf中在0℃下处理三卤代酞嗪3,得到了作为区域异构体的混合物的二卤代烷氧基酞嗪4a和4b。使4a和4b的混合物经受钯催化的交叉偶联条件,诸如与芳基/杂芳基金属反应物,例如与相应的芳基/杂芳基-三丁基锡或芳基/杂芳基硼酸/酯的施蒂勒偶联(stille coupling)或铃木偶联(suzuki coupling),以提供取代的卤代烷氧基酞嗪5a和5b作为区域异构体的混合物。取代的卤代烷氧基酞嗪混合物5a和5b在高温下用例如在dmf中的pd2(dba)3、dppf、zn和zncn2经受金属介导的氰化条件,并且所得的氰基烷氧基酞嗪混合物6a和6b用例如甲醇中的pd/c、hcl和h2经受氢化条件,以得到酞嗪酮甲胺混合物7a和7b。7a和7b的区域异构混合物通过色谱法诸如超临界流体色谱法(sfc)分离以提供所需的式(i)的化合物7a和7b。
[0214]
一般反应方案ii
[0215][0216]
其中r1=芳基/杂芳基,hal=cl、br或i
[0217]
其中r1为芳基或杂芳基的式(i)的化合物可以根据一般反应方案ii制备。化合物7a和7b都是式(i)的实例,其中r1是芳基或杂芳基,并且r
3a
和r
3b
是h。通过色谱法诸如超临界流体色谱法(sfc)来分离区域异构体4a和4b的混合物,得到同分异构纯的二卤代烷氧基酞嗪酮4a和4b。然后,4a或4b与芳基/杂芳基硼酸/酯经受金属介导的交叉偶联条件,例如铃木条件,以提供取代的卤代烷氧基酞嗪5a或5b。将取代的卤代烷氧基酞嗪5a或5b与例如pd2(dba)3、dppf、zn和zncn2在dmf中在高温下经受金属介导的氰化条件,以提供氰基烷氧基酞嗪6a或6b。氰基烷氧基酞嗪6a或6b例如在甲醇中与pd/c,hcl和h2经受氢化条件,以得到酞嗪酮7a或7b,以提供所需的式(i)的化合物。
[0218]
一般反应方案iii-a
[0219][0220]
其中r1=芳基、杂芳基、烷基并且hal=ci、br、或i
[0221]
其中r1是芳基、杂芳基、杂环基或烷基的式(i)的化合物可以根据一般反应方案iii-a制备。化合物7a是式(i)的实例,其中r1是芳基、杂芳基、杂环基或烷基,并且r
3a
和r
3b
是h。用氧化剂,例如kmno4在水中在50℃下处理1-(5-卤代-2-甲基苯基)乙烯酮8a,以提供2-(羧基羰基)-4-卤代苯甲酸9a。9a例如与水合肼在乙醇中在高温下缩合,产生7-卤代-4-氧代-3,4-二氢酞嗪-1-羧酸10a,其然后用酸和醇例如硫酸和甲醇酯化。7-卤代-4-氧代-3,4-二氢酞嗪-1-羧酸甲酯11a通过氢化物还原,例如在甲醇中用硼氢化钠和cacl2还原,以得到6-卤代-4-(羟甲基)酞嗪-1(2h)-酮12a,其然后用卤化剂例如亚硫酰氯处理12小时,以提供6-卤代-4-(卤代甲基)酞嗪-1(2h)-酮13a。在dmf中在高温下用氮亲核试剂例如邻苯二甲酰亚胺钾对13a进行亲核sn2置换,得到14a,其与芳基/杂芳基/杂环基/烷基硼酸/酯经受金属介导的交叉偶联条件,例如铃木条件,以提供酞嗪酮偶联产物15a。15a的邻苯二甲酰亚胺保护基团在溶剂分解条件下被除去,例如用乙醇中的水合肼除去,以提供所需的式(i)的化合物7a。
[0222]
一般反应方案iii-b
[0223][0224]
其中r1=芳基、杂芳基、烷基并且hal=ci、br、或i
[0225]
其中r1是芳基、杂芳基、杂环基或烷基的式(i)的化合物可以根据一般反应方案iii-b制备。化合物7b是式(i)的实例,其中r1是芳基、杂芳基、杂环基或烷基,并且r
3a
和r
3b
是h。用氧化剂,例如kmno4在水中在50℃下处理1-(5-卤代-2-甲基苯基)乙烯酮8b,以提供2-(羧基羰基)-4-卤代苯甲酸9b。9b例如与水合肼在乙醇中在高温下缩合,产生7-卤代-4-氧代-3,4-二氢酞嗪-1-羧酸10b,其然后用酸和醇例如硫酸和甲醇酯化。7-卤代-4-氧代-3,4-二氢酞嗪-1-羧酸甲酯11b通过氢化物还原,例如在甲醇中用硼氢化钠和cacl2还原,以得到6-卤代-4-(羟甲基)酞嗪-1(2h)-酮12b,其然后用卤化剂例如亚硫酰氯处理12小时,以提供6-卤代-4-(卤代甲基)酞嗪-1(2h)-酮13b。在dmf中在高温下用氮亲核试剂例如邻苯二甲酰亚胺钾对13b进行亲核sn2置换,得到14b,其与芳基/杂芳基/杂环基/烷基硼酸/酯经受金属介导的交叉偶联条件,例如铃木条件,以提供酞嗪酮偶联产物15b。15b的邻苯二甲酰亚胺保护基团在溶剂分解条件下被除去,例如用乙醇中的水合肼除去,以提供所需的式(i)的化合物7b。
[0226]
一般反应方案iv-a
[0227][0228]
其中r2=o-芳基、o-杂芳基并且hal=ci、br、或i
[0229]
其中r1为吡啶基且r2为-o-芳基或-o-杂芳基的式(i)的化合物可以根据一般反应方案iv-a制备。化合物29为式(i)的实例,其中r1为吡啶基,r2为-o-芳基或-o-杂芳基,并且r
3a
和r
3b
为h。将5-溴吡啶-3-醇25与适当取代的芳基/杂芳基卤化物26一起加热,例如在dmf和nah的混合物中加热,以提供3-卤代-5-r
2-氧吡啶27。3-卤代-5-r
2-吡啶27在钯催化的交叉偶联条件下,例如铃木偶联,与硼酸中间体an偶联,以生成r
2-吡啶基偶联产物28。r
2-吡啶基偶联产物28经受溶剂分解条件,例如用乙醇中的水合肼,以提供式(i)的游离胺29。
[0230]
一般反应方案iv-b
[0231][0232]
其中r2=o-芳基、o-杂芳基并且hal=cl、br、或i
[0233]
其中r1为吡啶基且r2为-o-芳基或-o-杂芳基的式(i)的化合物可以根据一般反应方案iv-b制备。化合物29为式(i)的实例,其中r1为吡啶基,r2为-o-芳基或-o-杂芳基,并且r
3a
和r
3b
为h。将5-溴吡啶-3-醇25与芳基/杂芳基卤化物26一起加热,例如在dmf和nah的混合物中加热,以提供3-卤代-5-r
2-吡啶27。3-卤代-5-r
2-吡啶27在钯催化的交叉偶联条件下,例如铃木偶联,与硼酸中间体j偶联,以生成偶联产物28-boc。偶联产物28-boc经受酸性条件,例如用tfa,以提供所需的式(i)的化合物29。
[0234]
一般反应方案iv-c
[0235][0236]
r2=-c1-c5烷基、杂环基、-l-环烷基、ch
2-芳基和ch
2-杂芳基,其中l是键或c1-c3亚烷基
[0237]
其中r1是5-r
2-6,7-二氢-4h-吡唑并[1,5-a]吡嗪-3-基且r2是-c1-c5烷基、杂环基、-l-环烷基、-ch
2-芳基和-ch
2-杂芳基(其中l是键或c1-c3亚烷基)的式(i)的化合物可以根据一般反应方案iv-c制备。化合物34是式(i)的实例,其中r1是5-r
2-6,7-二氢-4h-吡唑并[1,5-a]吡嗪-3-基,r2是-c1-c5烷基、杂环基、-l-环烷基、-ch
2-芳基和-ch
2-杂芳基(其中l
是键或c1-c3亚烷基),并且r
3a
和r
3b
是h。3-溴-4,5,6,7-四氢吡唑并[1,5-a]吡嗪30在还原胺化条件下与醛或酮31反应,例如在甲醇中与硼氢化钠反应,以形成r
2-取代的产物32。胺化产物32在钯催化的交叉偶联,例如铃木条件下,与硼酸酯中间体an偶联,提供偶联产物33。然后将偶联产物33暴露于溶剂分解条件,例如用水合肼,以得到式(i)的游离胺34。
[0238]
一般反应方案iv-d
[0239][0240]
r1=芳基或杂芳基并且hal=cl、br或1
[0241]
其中r1是芳基或杂芳基的式(i)的化合物可以根据一般反应方案iv-d制备。化合物94是式(i)的实例,其中r1是适当取代的芳基或杂芳基,并且r
3a
和r
3b
是h。n-boc硼酸酯中间体j在钯催化的交叉偶联条件下,例如铃木偶联条件下,与芳基/杂芳基取代的卤化物92偶联,以产生n-boc-r
1-取代的偶联产物90。使n-boc-r
1-取代的偶联产物90经受酸性条件以除去boc基团,例如tfa,以提供式(i)的r
1-取代的胺94。
[0242]
一般反应方案iv-e
[0243][0244]
r2=-c1-c5烷基、杂环基、-l-环烷基、ch
2-芳基和ch
2-杂芳基,其中l是键或c1-c3亚烷基
[0245]
其中r1是5-r
2-6,7-二氢-4h-吡唑并[1,5-a]吡嗪-3-基且r2是-c1-c5烷基、杂环基、-l-环烷基、-ch
2-芳基和-ch
2-杂芳基(其中l是键或c1-c3亚烷基)的式(i)的化合物可以根据一般反应方案iv-e制备。化合物34是式(i)的实例,其中r1是5-r
2-6,7-二氢-4h-吡唑并[1,5-a]吡嗪-3-基,r2是-c1-c5烷基、杂环基、-l-环烷基、-ch
2-芳基和-ch
2-杂芳基(其中l是键或c1-c3亚烷基),并且r
3a
和r
3b
是h。3-溴-5-r
2-6,7-二氢-4h-吡唑并[1,5-a]吡嗪32被硼化,例如在miyaura条件下,以提供硼酸酯32a-bpin。在钯催化的交叉偶联条件下,例如铃木条件下,将硼酰化产物32a-bpin与中间体f偶联,得到偶联产物33a。在酸性条件例如tfa,将偶联产物33a脱保护,以得到式(i)的胺34a。
[0246]
一般反应方案iv-f
[0247][0248]
其中r2=芳基或杂芳基,并且hal=ci、br或i
[0249]
其中r1是5-r
2-6,7-二氢-4h-吡唑并[1,5-a]吡嗪-3-基且r2是芳基或杂芳基的式(i)的化合物可以根据一般反应方案iv-f制备。化合物34是式(i)的实例,其中r1是5-r
2-6,7-二氢-4h-吡唑并[1,5-a]吡嗪-3-基,r2是芳基或杂芳基,并且r
3a
和r
3b
是h。3-溴-4,5,6,7-四氢吡唑并[1,5-a]吡嗪30与芳基/杂芳基卤化物26在铜催化剂介导的乌尔曼(ullman)偶联条件下反应,例如在高温下与dmf中的cu(i)i、cs2co3、l-脯氨酸反应,以形成胺化产物32。r
2-取代的胺化产物32在钯催化的交叉偶联条件下,例如在铃木条件下,与中间体an偶联,提供偶联产物33。偶联产物33经受溶剂分解条件,例如水合肼,以产生式(i)的胺34。
[0250]
一般反应方案iv-g
[0251][0252]
其中r2=-c(o)-芳基或-c(o)-杂芳基
[0253]
其中r1是5-r
2-6,7-二氢-4h-吡唑并[1,5-a]吡嗪-3-基且r2为-c(o)-芳基或-c(o)-杂芳基的式(i)的化合物可以根据一般反应方案iv-g制备。化合物40为式(i)的实例,其中r1是5-r
2-6,7-二氢-4h-吡唑并[1,5-a]吡嗪-3-基,r2为-c(o)-芳基或-c(o)-杂芳基,并且r
3a
和r
3b
为h。3-溴-4,5,6,7-四氢吡唑并[1,5-a]吡嗪30在dmf中用偶联剂,例如1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐(hatu)与碱诸如三乙胺被偶联至羧酸37,以形成酰胺38。在钯催化的交叉偶联条件下,例如suzuki偶联,酰胺38与硼酸酯中间体an偶联,以得到偶联产物39。r
2-偶联产物39经受溶剂分解条件,例如用一水合肼,以除去邻苯二甲酰亚胺部分并提供式(i)的胺化合物40。
[0254]
一般反应方案iv-h
[0255][0256]
其中r2=烷基、芳基、杂芳基并且hal=cl、br或i
[0257]
其中r1是1-甲基-5-r
2-1h-吡唑-4-基并且r2是烷基、芳基或杂芳基的式(i)的化合物可以根据一般反应方案iv-h制备。化合物45是式(i)的实例,其中r1是1-甲基-5-r
2-1h-吡
唑-4-基,r2是烷基、芳基或杂芳基,并且r
3a
和r
3b
是h。4-溴-1-甲基-1h-吡唑41在nmp中在高温下与烷基/芳基/杂芳基取代的卤化物42偶联,例如用乙酸钯、davephos、乙酸四丁铵、新戊酸,以提供r
2-取代的溴吡唑43。r
2-取代的溴吡唑43在钯介导的交叉偶联条件下,例如在铃木条件下,与中间体an偶联,以提供r
2-取代的偶联产物44。偶联产物44经受溶剂分解条件,例如用水合肼,以提供式(i)的胺45。
[0258]
一般反应方案iv-i
[0259][0260]
r2=-s-芳基或-s-杂芳基
[0261]
其中r1是吡啶基,r2是-s-芳基或-s-杂芳基的式(i)的化合物可以根据一般反应方案iv-i制备。化合物57是式(i)的实例,其中r1是吡啶基,r2是-s-芳基或-s-杂芳基,并且r
3a
和r
3b
是h。将3-溴-5-氟吡啶53a在高温下在dmf中经受snar取代条件,例如芳基/杂芳基硫醇钠54、nah,以提供3-溴-5-(芳基/杂芳基硫代)吡啶55。3-溴-5-(芳基/杂芳基硫代)吡啶55与硼酸酯中间体an在钯交叉偶联条件下,例如在铃木条件下偶联,以提供r
2-吡啶基交叉偶联产物56。r
2-吡啶基交叉偶联产物56经受溶剂分解条件,例如用水合肼,以产生式(i)的胺57。
[0262]
一般反应方案iv-j
[0263][0264]
55其中r2=-s-芳基或-s-杂芳基
[0265]
92其中r2=-s(o)-芳基或-s(o)-杂芳基
[0266]
其中r1是吡啶基,r2是-s(o)-芳基或-s(o)-杂芳基的式(i)的化合物可以根据一般反应方案iv-j制备。化合物94是式(i)的实例,其中r1是吡啶基,r2是-s(o)-芳基或-s(o)-杂芳基,并且r
3a
和r
3b
是h。使3-溴-5-(r
2-硫代)吡啶55经受氧化条件,例如在环境温度下在二氯甲烷中的mcpba,以提供3-溴-5-(r
2-亚磺酰基)吡啶92。3-溴-5-(r
2-亚磺酰基)吡啶92在钯催化的交叉偶联条件下,例如铃木条件下与硼酸酯中间体an偶联,以提供r
2-取代的亚磺酰基吡啶基产物93。r
2-取代的亚磺酰基吡啶基产物93经受溶剂分解条件,例如用水合肼,以获得式(i)的r
2-取代的亚磺酰基吡啶基胺94。
[0267]
一般反应方案iv-k
[0268][0269]
其中r1是1-甲基-5-r
2-1h-吡唑-4-基且r2是烷基、芳基或杂芳基的式(i)的化合物可以根据一般反应方案iv-k制备。化合物111是式(i)的实例,其中r1是1-甲基-5-r
2-1h-吡唑-4-基,r2是烷基、芳基或杂芳基,并且r
3a
和r
3b
是h。在钯催化的条件下,诸如在酸诸如对甲苯磺酸的存在下,在溶剂诸如二氯乙烷中,在高温例如70℃下,用卤化剂诸如n-溴代琥珀酰亚胺或n-氯琥珀酰亚胺卤化h-r
2 107,以得到卤化物108。4-溴-1-甲基-1h-吡唑41在高温下与烷基/芳基/杂芳基取代的卤化物108偶联,例如使用在nmp中的乙酸钯、davephos、乙酸四丁基铵、新戊酸,以提供r
2-取代的-溴吡唑109。在钯介导的交叉偶联条件下,例如在铃木条件下,将r
2-取代的-溴吡唑109偶联至中间体j,以提供n-boc-r
2-取代的偶联产物110。偶联产物110经受酸性条件以除去boc基团,例如tfa,以得到式(i)的r
2-取代的胺111。
[0270]
一般反应方案v
[0271][0272]
r1=环烷基或杂环基
[0273]
其中r1是环烷基或杂环基的式(i)的化合物可以根据一般反应方案v制备。化合物7a是式(i)的实例,其中r1是环烷基或杂环基,并且r
3a
和r
3b
是h。2-((7-溴-4-氧代-3,4-二氢酞嗪-1-基)甲基)异吲哚啉-1,3-二酮中间体f在钯催化的偶联条件下,例如在铃木偶联条件下,与4-6元环烯烃硼酸17偶联,以提供合适的烯烃偶联产物18。烯烃偶联产物18然后经受氢化条件,例如pd/c和h2,以提供合适的氢化产物19。氢化产物然后经受肼溶剂分解条
件,例如用水合肼,以提供式(i)的伯胺化合物7a。
[0274]
一般反应方案vi-a
[0275][0276]
其中r1是n-连接的杂芳基或n-连接的杂环基的式(i)的化合物可以根据一般反应方案vi-a制备。化合物22是式(i)的实例,其中r1是n-连接的杂芳基或n-连接的杂环基,并且r
3a
和r
3b
是h。硼酸酯中间体an与含氮杂环基或含氮杂芳基20经受金属催化的交叉偶联条件,例如乌尔曼、buchwald-hartwig或chan-lam条件,以提供合适的n-偶联产物21。该n-偶联产物21经受溶剂分解条件,例如用水合肼,以除去邻苯二甲酰亚胺,以提供所需的式(i)的伯胺22。
[0277]
一般反应方案vi-b
[0278][0279]
r1=n-连接的杂烷基、n-连接的芳基/杂烷基或n-连接的芳烷基
[0280]
其中r1是n-连接的杂芳基或n-连接的杂环基的式(i)的化合物可以根据一般反应方案vi-b制备。化合物23是式(i)的实例,其中r1是n-连接的杂芳基或n-连接的杂环基,并且r
3a
和r
3b
是h。将2-((7-溴-4-氧代-3,4-二氢酞嗪-1-基)甲基)异吲哚啉-1,3-二酮中间体f与含氮杂环基或含氮杂芳基20经受金属催化的交叉偶联条件,例如乌尔曼,buchwald-hartwig或chan-lam条件,以提供合适的n-偶联产物21a。该n-偶联产物21a然后经受溶剂分解条件,例如用水合肼,以提供所需的式(i)的伯胺91a。
[0281]
一般反应方案vi-c
[0282][0283]
r1=n-连接的杂烷基、n-连接的芳基/杂烷基或n-连接的芳烷基
[0284]
其中r1是n-连接的杂烷基、n-连接的芳基杂烷基或n-连接的芳烷基的式(i)的化合物可以根据一般反应方案vi-c制备。化合物24是式i的实例,其中r1是n-连接的杂烷基、n-连接的芳基杂烷基或n-连接的芳烷基,并且r
3a
和r
3b
是h。将2-((6-溴-4-氧代-3,4-二氢
酞嗪-1-基)甲基)异吲哚啉-1,3-二酮中间体f,与杂烷基/芳基杂烷基/芳烷基胺20经受金属催化的交叉偶联条件,例如乌尔曼,buchwald-hartwig或chan-lam条件,以提供合适的n-偶联产物21b。然后使该n-偶联产物21b经受溶剂分解条件,例如用水合肼,以提供所需的式(i)的r1取代的产物91b。
[0285]
一般反应方案vii
[0286][0287]
其中r2=o-芳基或o-杂芳基并且hal=cl、br或i
[0288]
其中r1是吡啶基且r2是o-芳基或o-杂芳基的式(i)的化合物可以根据一般反应方案vii制备。化合物29是式(i)的实例,其中r1是吡啶基,并且r2是o-芳基或o-杂芳基,并且r
3a
和r
3b
是h。使3-溴-5-羟基吡啶25在钯催化的交叉偶联条件例如铃木偶联条件pd(dppf)cl2、nahco3、二噁烷/水下,在80℃下,与硼酸酯中间体an偶联,以生成偶联产物28-oh。使偶联产物28-oh与r2取代的芳基/杂芳基卤化物26在110℃下经受snar反应条件,例如在dmf中的k2co3,以得到r2取代的芳基/杂芳基吡啶基醚28。r2取代的芳基/杂芳基吡啶基醚28经受溶剂分解条件,例如水合肼,以提供式(i)的游离胺29。
[0289]
一般反应方案viii-a
[0290][0291]
其中r2=芳基或杂芳基
[0292]
其中r1是吡啶基且r2是芳基或杂芳基的式(i)的化合物可根据一般反应方案viii-a制备。化合物85是式(i)的实例,其中r1是吡啶基,r2是芳基或杂芳基,并且r
3a
和r
3b
是h。中间体cb在miyaura条件下被硼化,例如在二噁烷中在高温下用双(频哪醇基)二硼、pd(dppf)cl2、koac硼化,以提供硼酸86。硼酸86与r2卤化物26在钯催化的交叉偶联条件例如铃木条件下偶联,以得到r
2-吡啶基偶联产物84。r
2-吡啶基偶联产物84经受溶剂分解条件,例如用水
二氢酞嗪-1-甲醛95。7-卤代-4-氧代-3,4-二氢酞嗪-1-甲醛95通过例如加入在thf中的叔丁磺酰胺、四异丙醇钛并加热至60℃持续12小时而被转化为亚磺酰胺化合物96。叔丁基磺酰胺96然后在-78℃下与在thf中的烷基卤化镁反应以生成甲基磺酰胺97。在钯催化的交叉偶联条件例如铃木条件下,将甲基磺酰胺97偶联到合适的r1取代的硼酸酯上,以得到r1取代的偶联产物99。r1取代的偶联产物99在酸性条件(例如hcl/二噁烷)下脱磺酰化,以得到式(i)的r1取代的伯胺100。
[0301]
一般反应方案ix-b
[0302][0303]
其中r1=芳基/杂芳基,r
3a
=烷基并且hal=ci、br或i
[0304]
其中r1是芳基或杂芳基,r
3a
是烷基且r
3b
是h的式(i)的化合物可以根据一般反应方案ix-b制备。化合物9-5a和9-5b是其中r1是芳基或杂芳基,r
3a
是烷基且r
3b
是h的式(i)的化合物的实例。叔丁基亚磺酰胺中间体97在miyaura条件下被硼化,例如用在二噁烷中的双(频哪醇基)二硼、pd(dppf)cl2、koac在高温下硼化,以提供硼酸酯9-2,然后将其在钯催化的交叉偶联条件例如铃木条件下与合适的r1取代的卤化物反应偶联,以提供r1取代的偶联产物9-3。r1取代的偶联产物9-3在酸性条件下,例如hcl/二噁烷中脱磺酰化,以得到式(i)的r1取代的伯胺9-4。然后通过手性制备hplc和/或手性sfc将9-4的外消旋混合物分离成相应的纯对映异构体,以得到式(i)的化合物的实例的手性胺9-5a和9-5b。
[0305]
一般反应方案x
[0306][0307]
其中r1是芳基/杂芳基并且r6=h、卤素、c1-c3烷基或烷氧基
[0308]
其中r1是芳基、杂芳基、杂环基或烷基的式(i)的化合物可以根据一般反应方案x制备。化合物10-10是式(i)的实例,其中r1是芳基、杂芳基、杂环基或烷基,r
3a
和r
3b
是h,并且r6是氢、卤素、c1-c3烷基或烷氧基。1-(5-溴-2-甲基-3-取代的苯基)乙酮10-1用氧化剂,例如在水中的kmno4在50℃下处理,以得到4-溴-2-(羧基羰基)-6-取代的苯甲酸10-2。10-2例如与在乙醇中的水合肼在高温下的缩合产生7-溴-4-氧代-3,4-二氢酞嗪-5-取代的-1-羧酸10-3,其然后用酸和醇例如硫酸和甲醇酯化,以得到酯10-4。7-溴-4-氧代-3,4-二氢酞嗪-5-取代的-1-羧酸甲酯10-4通过氢化物还原,例如用在甲醇中的硼氢化钠和cacl2还原,以得到6-溴-4-(羟甲基)-8-取代的-酞嗪-1(2h)-酮10-5,其然后用卤化剂例如亚硫酰氯处理12小时,以提供6-卤代-4-(氯甲基)-8-取代的-酞嗪-1(2h)-酮10-6。用氮亲核试剂例如在dmf中的邻苯二甲酰亚胺钾在高温下对10-6的亲核sn2置换得到10-7,例如用miyaura条件将其硼化,以得到硼酸酯10-8。钯介导的交叉偶联条件,例如铃木条件,用硼酸酯10-8和芳基/杂芳基/杂环基/烷基卤化物,提供了酞嗪酮偶联产物10-9。在溶剂分解条件下,例如用乙醇中的水合肼除去10-9的邻苯二甲酰亚胺保护基,以得到所需的式(i)的化合物10-10。
[0309]
一般反应方案xi
[0310][0311]
其中r1=芳基/杂芳基,r
3a
、r
3b
是d并且r6=h、卤素、c1-c3烷基或烷氧基
[0312]
其中r1是芳基、杂芳基、杂环基或烷基的式(i)的化合物可以根据一般反应方案xi制备。化合物11-7是式(i)的实例,其中r1是芳基、杂芳基、杂环基或烷基,r
3a
和r
3b
是d,并且r6是氢、卤素、c1-c3烷基或烷氧基。7-溴-4-氧代-3,4-二氢酞嗪-5-取代的-1-羧酸甲酯10-4通过氘还原,例如用在甲醇-d4中的硼氘化钠和cacl2还原,以得到6-溴-4-((羟基-d)甲基-d2)-8-取代的-酞嗪-1(2h)-酮11-2,其然后用卤化剂例如亚硫酰氯处理12小时,以提供6-溴-4-(氯甲基-d2)-8-取代的-酞嗪-1(2h)-酮11-3。在高温下,用氮亲核试剂例如在dmf中的邻苯二甲酰亚胺钾对11-3进行的亲核sn2置换得到11-4,该11-4例如在miyaura条件下被硼化,以得到硼酸酯11-5。钯介导的交叉偶联条件,例如铃木条件,与硼酸酯11-5和芳基/杂芳基/杂环基/烷基卤化物提供了酞嗪酮偶联产物11-6。在溶剂分解条件下,例如用在乙醇中的水合肼除去11-6的邻苯二甲酰亚胺保护基,以得到所需的式(i)的化合物11-7。
[0313]
一般反应方案xii
[0314][0315]
其中r2=芳基/杂芳基并且r6=h、卤素、c1-c3烷基或烷氧基
[0316]
其中r2为芳基或杂芳基的式(i)的化合物可以根据一般反应方案xii制备。化合物12-3是式(i)的实例,其中r2是芳基或杂芳基,r
3a
和r
3b
是h,r6是氢、卤素、c1-c3烷基或烷氧
基,并且取代基是烷基、芳基或杂芳基。溴代或氯代化合物12-1与烷基/芳基/杂芳基硼酸/酯经受钯介导的交叉偶联条件,例如铃木条件,以得到取代基偶联产物12-2。然后用酸化条件例如tfa除去boc基团,以得到式(i)的r2取代的胺12-3。
[0317]
一般反应方案xiii
[0318][0319]
其中r1是烷基氰基的式(i)的化合物可以根据一般反应方案xiii制备。化合物13-3是式(i)的实例,其中r1是ch2cn。溴代或氯代化合物13-1与异噁唑硼酸/酯经受钯介导的交叉偶联条件例如铃木条件,以得到取代基偶联产物13-2。然后使异噁唑在高温下经受在醇溶剂诸如乙醇中的水合肼,接着进行酸处理,例如用ph 1的hcl处理,以得到式(i)的腈产物13-3。
[0320]
一般反应方案xiv
[0321][0322]
其中r2=芳基/杂芳基并且r6=烷氧基
[0323]
其中r2是芳基或杂芳基且r6是烷氧基的式(i)的化合物可以根据一般反应方案xiv制备。化合物14-3是式(i)的实例,其中r2是芳基或杂芳基,并且r6是烷氧基。具有用例如boc基团或邻苯二甲酰亚胺基团适当保护的胺的氟代化合物14-1经受芳族sn2条件,其中-f作为离去基团,并且相应的氧阴离子作为亲核试剂。例如,在极性溶剂中用烷基氧化物钠加热以得到取代基取代产物14-2。然后在适当的条件下除去保护基团。例如,boc在酸性条件诸如在二噁烷中的hcl或tfa下被除去,或者邻苯二甲酰亚胺基团在碱性亲核条件诸如在乙醇中的水合肼下通过加热被除去,以得到式(i)的r6取代的胺14-3。
[0324]
一般反应方案xv
[0325][0326]
其中r2=芳基/杂芳基并且r
6=
c1-c3烷基
[0327]
其中r2是芳基或杂芳基且r6是c1-c3烷基的式(i)的化合物可以根据一般反应方案xv制备。化合物15-3是式(i)的实例,其中r2是芳基或杂芳基,并且r6是c1-c3烷基。在钯催化的交叉偶联条件例如suzuki-miyaura偶联条件下,具有用例如boc基团或邻苯二甲酰亚胺
基团适当保护的胺的氯代化合物15-1与合适的c1-c3三烷基硼烷偶联,以得到相应的r6取代的偶联产物15-2。然后在适当的条件下除去保护基团。例如,boc在酸性条件诸如在二噁烷中的hcl或在二噁烷中的tfa下被除去,并且邻苯二甲酰亚胺基团在碱性亲核条件诸如在乙醇中的水合肼下通过加热被除去,以得到式(i)的r6取代的胺15-3。
[0328]
一般反应方案xvi
[0329][0330]
其中r1是1-甲基-5-r
2-1h-吡唑-4-基且r2是烷基、芳基或杂芳基的式(i)的化合物可以根据一般反应方案xvi制备。化合物16-6是式(i)的实例,其中r1是1-甲基-5-r
2-1h-吡唑-4-基,r2是烷基、芳基或杂芳基,并且r
3a
和r
3b
是h。h-r
2 16-1被卤化,例如用卤化剂诸n-溴代琥珀酰亚胺或n-碘代琥珀酰亚胺在钯催化条件诸如乙酸钯下,在酸诸如对甲苯磺酸的存在下,在溶剂诸如二氯乙烷中,在高温例如70℃下被卤化,以得到卤化物16-2。溴代或碘代化合物16-2与1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-1h-吡唑经受钯介导的交叉偶联条件,例如铃木条件,以得到偶联产物16-3。1-甲基-5-r
2-1h-吡唑16-3例如用卤化剂诸如n-溴代琥珀酰亚胺或n-碘代琥珀酰亚胺在极性溶剂诸如乙腈中卤化,以得到4-卤代-1-甲基-5-r
2-1h-吡唑化合物16-4。4-溴-1-甲基-5-r
2-1h-吡唑16-4在钯介导的交叉偶联条件例如铃木条件下与中间体j偶联,以提供n-boc-r2取代的偶联产物16-5。使偶联产物16-5经受酸性条件以除去boc基团,例如tfa,以得到式(i)的r2取代的胺16-6。
[0331]
中间体c、d和e
[0332][0333]
步骤1:将5-溴异苯并呋喃-1,3-二酮1a(55.0g,242mmol,1.00当量)和乙酸(165ml)在125℃下搅拌1小时。在此时间后,将混合物冷却至10℃并且滴加水合肼(12.7g,254mmol,12.4ml,1.05当量),导致形成厚的白色沉淀。加入额外的乙酸(55ml),并将混合物在125℃下搅拌另外的30分钟。在此时间后,将混合物冷却,用乙酸(150ml)稀释并过滤。用乙酸(50ml
×
3)洗涤滤饼,干燥,然后溶解在5%(w/w)氢氧化钠溶液(800ml)中。用乙酸(200ml)酸化该溶液,以得到粘稠的白色沉淀,将其过滤。用水(50ml
×
3)洗涤滤饼,随后用甲醇洗涤,然后在真空中干燥,以得到作为白色固体的6-溴-2,3-二氢酞嗪-1,4-二酮2a(45.6g,粗品)。该固体然后被用于下一步骤而无需进一步纯化。1h nmr(400mhz,dmso-d6)δ=8.17(d,j=2.0hz,1h),8.01-7.97(m,1h),7.95-7.89(m,1h)。
[0334]
步骤2:将在三氯氧化磷(330g,2.15mol,200ml)中的6-溴-2,3-二氢酞嗪-1,4-二酮2a(20.0g,粗品)的溶液在120℃下搅拌12小时。在此时间后,在减压下浓缩反应混合物,并将残余物溶解在二氯甲烷(150ml)中,并滴加到冰水中。然后用二氯甲烷(300ml
×
3)提取混合物,并用碳酸氢钠水溶液(200ml
×
5)、盐水(200ml
×
2)洗涤合并的有机层,用硫酸钠干燥,过滤并在减压下浓缩,以得到作为黄色固体的6-溴-1,4-二氯-酞嗪3a(14.5g,粗品)。该固体然后被用于下一步骤而无需进一步纯化。1h nmr(400mhz,cdcl3)δ=8.49(d,j=1.2hz,1h),8.23-8.15(m,2h)。
[0335]
步骤3:将在thf(30ml)中的苯甲醇(4.59g,42.4mmol,4.41ml)和氢化钠(3.77g,94.3mmol,在矿物油中的60%分散体)的溶液在0℃下搅拌0.5小时。然后在0℃下将混合物滴加到在thf(80ml)中的6-溴-1,4-二氯-酞嗪3a(13.1g,粗品)的溶液中。将反应混合物加热至10℃并在10℃下搅拌1小时。在此时间后,用水(100ml)稀释反应混合物,并用乙酸乙酯(150ml
×
3)提取。用盐水(100ml)洗涤合并的有机层,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过柱色谱法(sio2,石油醚:乙酸乙酯10-25%)纯化,以得到作为黄色固体的中间体c,4-苄氧基-7-溴-1-氯-酞嗪4c和4-苄氧基-6-溴-1-氯-酞嗪4d的1:1混合物(9.79g,28.0mmol,66%产率)。1h nmr(400mhz,cdcl3)δ=8.39(d,j=1.2hz,1h),8.35(d,j=1.6hz,1h),8.17-8.10(m,1h),8.08-8.05(m,1h),8.04(d,j=2.0hz,1h),8.00(dt,j=
1.6,8.4hz,1h),7.59-7.53(m,4h),7.47-7.36(m,6h),5.70(s,4h)。
[0336]
步骤4:通过sfc(柱:daicel chiralpak ad(250
×
30mm,10μm);流动相:[0.1%nh3h2o meoh];b%:0%-60%;40分钟)分离中间体c,4c和4d的1:1混合物(9.79g,28.0mmol)的区域异构体,以得到作为白色固体的中间体d,4-苄氧基-7-溴-1-氯-酞嗪(2.40g,6.86mmol)和作为白色固体的中间体e,4-苄氧基-6-溴-1-氯-酞嗪(2.54g,7.27)。中间体d:4-苄氧基-7-溴-1-氯-酞嗪:1h nmr(400mhz,cdcl3)δ=8.36(d,j=2.0hz,1h),8.13(d,j=8.8hz,1h),7.99(dd,j=2.0,8.8hz,1h),7.58-7.54(m,2h),7.46-7.36(m,3h),5.70(s,2h).lcms[m 1]
351.0。中间体e:4-苄氧基-6-溴-1-氯-酞嗪:1h nmr(400mhz,cdcl3)δ=8.39(d,j=1.6hz,1h),8.10-8.01(m,2h),7.61-7.54(m,2h),7.48-7.35(m,3h),5.70(s,2h).lcms[m 1]
351.0。
[0337]
中间体f—路线1
[0338][0339]
步骤1:向在水(1.00l)中的1-(5-溴-2-甲基-苯基)乙烯酮8c(100g,445mmol,1.00当量)的溶液中加入碳酸钾(92.4g,668mmol,1.50当量)和高锰酸钾(493g,3.12mol,7.00当量)。将混合物在50℃下搅拌3小时,然后加入乙醇(1.00l),并且将所得的混合物在50℃下搅拌持续另外的30分钟。在此时间后,过滤固体,并且用浓盐酸(500ml)将滤液ph调节至ph 2。然后用乙酸乙酯(1.00l)提取混合物,分离有机层,然后在真空中浓缩,得到作为白色固体的4-溴-2-草酰-苯甲酸9c(278g,997mmol,75%产率),其被用于下一步骤而无需进一步纯化。lcms[m 1]
=271.1。
[0340]
步骤2:向在乙醇(3.00l)中的4-溴-2-草酰-苯甲酸9c(382g,1.27mol)的溶液中加入水合肼(71.2g,1.39mol,69.1ml)。将混合物在75℃下搅拌4小时,并过滤形成的沉淀,用乙醇(500ml)洗涤并干燥,以得到作为白色固体的7-溴-4-氧代-3h-酞嗪-1-羧酸10c(280g,1.03mol,81%产率),其被用于下一步骤而无需进一步纯化。1h nmr(400mhz,dmso-d6)δ=8.72-8.81(m,1h),8.11-8.21(m,1h),7.95-8.09(m,1h)。
[0341]
步骤3:向在甲醇(2.00l)中的7-溴-4-氧代-3h-酞嗪-1-羧酸10c(200g,675mmol)的溶液中加入硫酸(131g,1.31mol,71.0ml),并将反应混合物在65℃下搅拌24小时。在此时
间后,过滤冷却的反应混合物,并将滤饼在减压下干燥,以得到作为白色固体的7-溴-4-氧代-3h-酞嗪-1-羧酸甲酯11b(216g,粗品),其被用于下一步骤而无需进一步纯化。lcms[m 1]
=283.0;1h nmr(400mhz,dmso-d6)δ=13.31(s,1h),8.72(s,1h),8.16-8.18(d,j=8.4hz,1h),8.03-8.05(d,j=8.4hz,,1h),3.91(s,3h)。
[0342]
步骤4:在0℃下,用硼氢化钠(48.6g,1.29mol,2.60当量)逐份处理在乙醇(1.50l)中的7-溴-4-氧代-3h-酞嗪-1-羧酸甲酯11c(159g,494mmol)的搅拌溶液。向该混合物中加入氯化钙的溶液(65.8g,593mmol,1.20当量)。然后将混合物在0℃下搅拌2小时,并在20℃下搅拌另外的1小时。在此时间后,将反应混合物在减压下浓缩,并将残余物悬浮在水(800ml)中,用1n盐酸(300ml)将ph调节至ph 5,并过滤沉淀物,用水(300ml
×
3)洗涤并干燥,以得到作为黄色固体的6-溴-4-(羟甲基)-2h-酞嗪-1-酮12c(162g,粗品)。lcms[m 1]
=255.0;1h nmr(400mhz,dmso-d6)δ=12.66(s,1h),8.30(d,j=1.6hz,1h),8.16(d,j=8.8hz,1h),8.01(dd,j=8.4,2.0hz,1h),5.58(t,j=5.6hz,1h),4.67(d,j=6.0hz,2h)。
[0343]
步骤5:将6-溴-4-(羟甲基)-2h-酞嗪-1-酮12c(162g,粗品)溶解在亚硫酰氯(1.00l)中,并将混合物在70℃下搅拌2小时,然后在减压(35℃)下浓缩。将浓缩的残余物溶解在二氯甲烷(1.00l)中并浓缩至干燥,以得到作为白色固体的6-溴-4-(氯甲基)-2h-酞嗪-1-酮13c(154g,粗品),其被用于下一步骤而无需进一步纯化。lcms[m 1]
=274.8;1h nmr(400mhz,dmso-d6)δ=12.92(s,1h),8.30(s,1h),8.18-8.20(d,j=7.6hz,1h),8.06-8.08(t,j=8.8hz,1h),5.07(s,2h)。
[0344]
步骤6:向在dmf(1.5l)中的6-溴-4-(氯甲基)-2h-酞嗪-1-酮13c(148g,粗)的溶液中加入(1,3-二氧杂异二氢吲哚-2-基)钾(121g,653mmol)。将反应混合物在90℃下搅拌2小时,然后冷却至25℃。过滤形成的沉淀,并用dmf(200mlx2)洗涤,并且滤饼用水(1.00l)研磨,过滤并干燥,以得到作为白色固体的中间体f,2-[(7-溴-4-氧代-3h-酞嗪-1-基)甲基]异吲哚啉-1,3-二酮(162g,413mmol,76%产率)。1h nmr(400mhz,dmso-d6)δ=12.59(s,1h),8.43(d,j=1.2hz,1h),8.18(d,j=8.4hz,1h),8.07(dd,j=1.6,8.4hz,1h),7.97-7.93(m,2h),7.92-7.86(m,2h),5.19(s,2h).lcms[m 1]:383.9。
[0345]
中间体f—路线2
[0346][0347]
步骤1:将5-溴异苯并呋喃-1(3h)-酮(50.0g,235mmol,1.00当量)、dmf-dma(180g,1.51mol,201ml,6.44当量)和t-buok(2.63g,23.5mmol,0.10当量)的混合物脱气,并用n2吹扫3次,然后在n2气氛下在110℃下搅拌20小时。在此时间后,将反应混合物在减压下浓缩以
除去dmf-dma,并将形成的残余物在25℃下在石油醚(100ml)中搅拌30分钟。过滤形成的固体,并且将滤饼在乙酸乙酯(200ml)中在80℃下搅拌12小时,过滤,并且滤饼在减压下干燥,以得到作为红色固体的(z)-5-溴-3-((二甲基氨基)亚甲基)异苯并呋喃-1(3h)-酮(39.0g,120mmol,51%产率,82%纯度)。lcms[m 1]
=270.1;1h nmr(400mhz,dmso-d6)δ=7.97(d,j=1.2hz,1h),7.61-7.59(d,j=8.0,1h),7.30-7.27(dd,j=8.0&1.2hz,1h),3.10(s,6h)。
[0348]
步骤2:在25℃下向在etoh(650ml)中的(z)-5-溴-3-((二甲基氨基)亚甲基)异苯并呋喃-1(3h)-酮(39.0g,119mmol,82.0%纯度,1.00当量)的混合物中加入nh2nh2·
h2o(12.5g,245mmol,12.1ml,2.05当量)。将混合物用n2脱气,然后在25℃下搅拌0.5小时,然后在70℃下搅拌12小时。在此时间后,过滤反应混合物,并且干燥固体,以得到作为黄色固体的6-溴-4-((二甲基氨基)甲基)酞嗪-1(2h)-酮(30.0g,105mmol,88%产率,99%纯度)。lcms[m 1]
=282.1;1h nmr(400mhz,dmso-d6)δ12.6(s,1h),8.33(s,1h),8.14-8.12(d,j=8.4hz,1h),8.00-7.98(m,1h),3.61(s,1h),2.18(s,1h)。
[0349]
步骤3:在thf(187ml)中的6-溴-4-((二甲基氨基)甲基)酞嗪-1(2h)-酮(15.0g,53.2mmol,1.00当量)的混合物,并用n2脱气3次,然后冷却至0℃。然后滴加异丁基碳酰氯(isobutyl carbonochloridate)(8.71g,63.80mmol,8.38ml,1.20当量),然后将混合物在n2下在25℃下搅拌6小时。在此时间后,将混合物冷却至0℃,然后加入hcl(0.5m,250ml),温度保持在0℃至10℃之间。在加入完成后,过滤固体,用thf(30mlx3)洗涤并干燥,以得到作为黄色固体的6-溴-4-(氯甲基)酞嗪-1(2h)-酮(11.0g,37.56mmol,71%产率,93%纯度)。lcms[m 1]
=256.1;1h nmr(400mhz,dmso-d6)δ12.9(s,1h),8.29(d,j=1.6hz,1h),8.19-8.17(d,j=8.0hz,1h),8.06-80.4(dd,j=8.0hz&1.6hz,1h),5.06(s,2h)。
[0350]
步骤4:向在dmf(160ml)中的6-溴-4-(氯甲基)酞嗪-1(2h)-酮(8.06g,27.5mmol,93%纯度,1.00当量)的混合物中加入(1,3-二氧杂异二氢吲哚-2-基)钾(5.61g,30.3mmol,1.10当量),并在25℃下搅拌1小时。在此时间后,混合物用hcl(0.5m,100ml)洗涤,过滤,并且固体用饱和nahco3(30mlx2)、纯水(30mlx2)洗涤,然后用etoh(15ml)在70℃下研磨1小时。然后过滤并干燥固体,以得到作为黄色固体的中间体f(8.30g,17.9mmol,65.0%产率,83%纯度)。lcms[m 1]
=384.1/386.1;1h nmr(400mhz,dmso-d6)δ12.6(s,1h),8.43(s,1h),8.18-8.16(d,j=8.0hz,1h),8.08(d,j=8.0hz,1h),7.95-7.89(m,4h),5.18(s,2h)。
[0351]
中间体g
[0352][0353]
步骤1:向在水中的1-(4-溴-2-甲基-苯基)乙烯酮8d(10.0g,46.9mmol,1.00当量)的溶液中加入碳酸钾(9.73g,70.40mmol,1.50当量)和高锰酸钾(51.9g,329mmol,7.00当量)。将混合物在50℃下搅拌3小时,然后加入乙醇(50ml),并将所得的混合物在50℃下搅拌另外的30分钟。在此时间后,过滤固体,并用浓盐酸(5ml)将滤液ph调节至ph 2。然后用乙酸乙酯(50ml)提取混合物,分离有机层并在真空中浓缩,以得到作为白色固体的5-溴-2-草酰-苯甲酸9d(10.0g,粗品),其被用于下一步骤而无需进一步纯化。lcms[m 1]
=273.0。
[0354]
步骤2:向在乙醇(120ml)中的5-溴-2-草酰-苯甲酸9d(10.0g,粗品)的溶液中加入水合肼(1.87g,36.6mmol,1.82ml),并将混合物在75℃下搅拌4小时。在此时间后,过滤形成的沉淀,并用乙醇(5ml)洗涤并干燥,以得到作为白色固体的6-溴-4-氧代-3h-酞嗪-1-羧酸10d(7.50g,27.9mmol,59%产率)。lcms[m 1]
=269.0。
[0355]
步骤3:向在甲醇(40ml)中的6-溴-4-氧代-3h-酞嗪-1-羧酸10d(7.50g,27.9mmol,1.00当量)的溶液中加入硫酸(16.7g,167mmol,9.10ml,6.00当量),并将反应混合物在65℃下搅拌12小时。在此时间后,允许反应混合物冷却,并且过滤形成的沉淀并干燥,以得到作为白色固体的6-溴-4-氧代-3h-酞嗪-1-羧酸甲酯11d(7.00g,24.7mmol,89%产率)。lcms[m 1]
=282.9。
[0356]
步骤4:在0℃下,将在乙醇(250ml)中的硼氢化钠的搅拌的溶液(2.43g,64.29mmol,2.60当量)用6-溴-4-氧代-3h-酞嗪-1-羧酸甲酯11d(7.00g,24.7mmol,1.00当量)逐份处理。向该混合物中以滴加方式加入在乙醇(250ml)中的氯化钙的溶液(3.29g,29.7mmol,1.20当量)。然后将混合物在0℃下搅拌3小时,并在20℃下搅拌额外的1小时。在此时间后,将混合物在减压下浓缩,并将浓缩的残余物悬浮在水(30ml)中,并用1n盐酸(5ml)将ph调节至ph 5。过滤形成的沉淀,用水(5ml
×
3)洗涤,并用乙醇(50ml)研磨,过滤并干燥,以得到作为白色固体的7-溴-4-(羟甲基)-2h-酞嗪-1-酮12d(6.00g,23.5mmol,95%产率)。lcms[m 1]
=255.0。
[0357]
步骤5:在0℃下,将7-溴-4-(羟甲基)-2h-酞嗪-1-酮12d(6.00g,23.5mmol)溶解在
亚硫酰氯(50ml)中。将反应混合物在20℃下搅拌12小时,然后在减压(35℃)下浓缩。将浓缩的残余物溶解在二氯甲烷(20ml)中并浓缩,以得到作为白色固体的7-溴-4-(氯甲基)-2h-酞嗪-1-酮13d(5.50g,粗品),其被用于下一步骤而无需进一步纯化。lcms[m 1]
=275.0。
[0358]
步骤6:向在dmf(60.0ml)中的7-溴-4-(氯甲基)-2h-酞嗪-1-酮13d(5.50g,粗品)的溶液中加入(1,3-二氧代异二氢吲哚-2-基)钾(5.59g,30.2mmol)。将反应混合物在90℃下搅拌2小时,然后冷却至25℃,并将形成的沉淀物过滤并用乙醇(150ml)研磨,以得到作为白色固体的中间体g,2-[(6-溴-4-氧代-3h-酞嗪-1-基)甲基]异吲哚啉-1,3-二酮(5.00g,13.0mmol,65%产率)。1h nmr(400mhz,dmso-d6)δ=12.66(s,1h),8.36(d,j=2.0hz,1h),8.22-8.18(m,1h),8.14-8.10(m,1h),7.97-7.93(m,2h),7.91-7.87(m,2h),5.18(s,2h).lcms[m 1]:386.1。
[0359]
中间体i
[0360][0361]
步骤1:中间体f(3.00g,7.81mmol,1.00当量)和水合肼(1.60g,31.2mmol,1.55ml,4.00当量)的溶液在80℃下搅拌2小时,冷却并在减压下浓缩。然后用水洗涤浓缩的残余物,并在25℃下用乙醇研磨,以得到作为白色固体的4-(氨基甲基)-6-溴-2h-酞嗪-1-酮106(1.95g,7.67mmol,98%产率)。lcms[m 1]
=256.1。
[0362]
步骤2:向在二氯甲烷(40.0ml)中的4-(氨基甲基)-6-溴-2h-酞嗪-1-酮106(1.90g,7.48mmol,1.00当量)和三乙胺(2.27g,22.4mmol,3.12ml,3.00当量)的溶液中加入二碳酸二叔丁酯(3.26g,15.0mmol,3.44ml,2.00当量)。将混合物在25℃下搅拌2小时,过滤并在减压下浓缩,以得到残余物。用二氯甲烷(40ml)研磨浓缩的残余物,然后过滤并干燥,以得到作为白色固体的n-[(7-溴-4-氧代-3h-酞嗪-1-基)甲基]氨基甲酸叔丁酯,中间体i(1.97g,5.56mmol,74%产率)。lcms[m 1]
=356.1。1h nmr(400mhz,dmso-d6)δ=12.71(s,1h),8.26(br s,1h),8.16(br d,j=8.0hz,1h),8.02(br d,j=8.0hz,1h),7.46(br s,1h),4.41(br d,j=4.4hz,2h),1.40(br s,9h)。
[0363]
中间体j
[0364][0365]
将在二噁烷(2.60l)中的中间体i(130.0,275mmol,1.00当量)、双(频哪醇基)二硼(bpd)(104.9g,412.9mmol,1.50当量)、pd(dppf)cl2(20.1g,27.5mmol,0.10当量)、koac(81.0g,825mmol,3.00当量)的混合物脱气并用n2吹扫。然后将混合物在100℃下搅拌2小时。在此时间后,过滤混合物,浓缩,残余物用石油醚/乙酸乙酯10/1(400ml)在25℃下研磨1
小时。然后过滤并干燥固体,以得到作为棕色固体的中间体j(68.0g,162mmol,59%产率)。lcms[m 1]
=402.3;1h nmr(400mhz,cdcl3)δ=12.62(s,1h),8.25(s,2h),8.01-8.13(m,1h),7.21-7.45(m,1h),4.34-4.63(m,2h),1.42(s,9h),1.32(s,12h)。
[0366]
中间体k
[0367][0368]
将在n-甲基吡咯烷酮(10ml)中的4-溴-1-甲基-吡唑(500mg,3.11mmol,1.00当量)和1-溴-3-氟-苯(543mg,3.11mmol,346μl,1.00当量)的溶液用氮气脱气。然后,添加乙酸钯(7.0mg,31.1μmol,0.10当量)和2-(2-二环己基膦酰基苯基)-n,n-二甲基苯胺(davephos)(24.0mg,62.1μmol,0.02当量)。向所得的深棕色溶液中加入乙酸四丁基铵(1.87g,6.21mmol,2ml,2.00当量)和新戊酸(317mg,3.11mmol,357μl,1.00当量)并在100℃下搅拌所得的溶液15小时。在反应完成后,将混合物冷却。加入乙酸乙酯(100ml),并且将所得的混合物用盐水(3
×
100ml)洗涤。有机相用无水硫酸钠干燥,并在真空中浓缩,以得到粗的油状物。通过硅胶色谱法(石油醚/乙酸乙酯0-10%)纯化粗的油状物,以得到作为无色油状物的4-溴-5-(3-氟苯基)-1-甲基-1h-吡唑,中间体k(600mg,2.35mmol,76%产率)。lcms[m 1]
=255.0.1h nmr(400mhz,cdcl3)δ=7.56(s,1h),7.50(dt,j=6.0,8.0hz,1h),7.24-7.18(m,2h),7.18-7.13(m,1h),3.85(s,3h)。
[0369]
表i-i中所示的中间体a-1至a-32是根据一般反应方案的教导和制备中间体k的方法制备的。
[0370]
[0371]
[0372]
[0373][0374][0375]
中间体aa
[0376][0377]
向在二甲基甲酰胺(50ml)中的3-溴-5-氟-吡啶(2.20g,12.5mmol,1.00当量)的溶液中加入苯基磺胺基钠(1.98g,15.0mmol,1.20当量),然后在110℃下搅拌12小时。在此时间后,用水(700ml)稀释反应混合物,并用乙酸乙酯(150ml
×
3)提取。合并的有机层用盐水(300ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过柱色谱法(sio2,石油醚:乙酸乙酯0-10%)纯化,以得到作为黄色油状物的3-溴-5-苯基磺胺基-吡啶,中间体aa(1.31g,4.48mmol,35%产率)。lcms[m 1]
=268.0;1h nmr(400mhz,meod)δ=8.44(d,j=2.0hz,1h),8.31(d,j=2.0hz,1h),7.73(t,j=2.0hz,1h),7.50-7.46(m,2h),7.45-7.41(m,3h)。
[0378]
中间体ab
[0379][0380]
向在dmf(2ml)中的2-氯苯硫醇(296mg,2.05mmol,233μl,1.20当量)的溶液中加入氢化钠(82mg,2.05mmol,60%纯度,1.20当量)和3-溴-5-氟-吡啶(300mg,1.70mmol,1.00当量)并在25℃下搅拌2小时。通过加入水(10ml)来淬灭反应混合物,然后用乙酸乙酯(30ml
×
3)提取。合并的有机层用盐水(50ml
×
2)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过制备型tlc(石油醚:乙酸乙酯20%)纯化,以得到作为白色固体的3-溴-5-(2-氯苯基)磺胺基-吡啶,中间体ab(280mg,931μmol,54%产率)。lcms[m 1]
=302.0;1h nmr(400mhz,cdcl
3-d)δ=8.56(d,j=2.0hz,1h),8.45(d,j=2.0hz,1h),7.73(t,j=2.0hz,1h),7.51-7.47(m,1h),7.33-7.28(m,2h),7.26-7.22(m,1h)。
[0381]
表i-iia中示出的中间体ac至ag是根据一般反应方案的教导和制备中间体ab的方法制备的。
[0382][0383]
中间体ah
[0384][0385]
步骤1:向在dmf(10ml)中的2-甲基-1h-咪唑(1.00g,12.2mmol,1.00当量)的溶液中加入碳酸钾(1.68g,12.2mmol,1.00当量)和2-氯乙腈(920mg,12.2mmol,773μl,1.00当量)并将混合物在50℃下搅拌5小时。在此时间后,用水(20ml)稀释反应混合物,用乙酸乙酯(20ml
×
3)提取,用盐水(20ml)洗涤合并的有机相,用无水硫酸钠干燥,过滤并浓缩。残余物通过柱色谱法(sio2,石油醚:乙酸乙酯10-100%)纯化,以得到作为黄色油状物的2-(2-甲基咪唑-1-基)乙腈(460mg,3.80mmol,31%产率)。1h nmr(400mhz,cdcl3)δ=6.98(d,j=1.2hz,1h),6.94(d,j=1.2hz,1h),4.79(s,2h),2.47(s,3h)。
[0386]
步骤2:在0℃下,向在乙腈(10ml)中的2-(2-甲基咪唑-1-基)(410mg,3.38mmol,1.00当量)的溶液中逐滴加入在乙腈(10ml)中的n-溴代琥珀酰亚胺(542mg,3.05mmol,0.90当量)的溶液。将反应混合物在0℃下搅拌30分钟,并且在此时间后,将反应混合物用水(2ml)淬灭,并用乙酸乙酯(2ml
×
3)提取。用盐水(2ml)洗涤合并的有机相,用无水硫酸钠干燥,过滤并浓缩成残余物。残余物通过柱色谱法(sio2,石油醚:乙酸乙酯10-100%)纯化,然
后通过第二柱sio2,石油醚:乙酸乙酯:甲醇1:1:0.4)纯化,以得到作为棕色固体的2-(5-溴-2-甲基-咪唑-1-基)乙腈,中间体ah(460mg,2.30mmol,67%产率)。1h nmr(400mhz,cdcl3)δ=6.97(s,1h),4.82(s,2h),2.53(s,3h)。
[0387]
中间体ai
[0388][0389]
在0℃下,向在盐酸(12m,2ml,21.1当量)中的4-溴-2-甲基-吡唑-3-胺(0.20g,1.14mmol,1.00当量)的溶液中缓慢加入在水(1.8ml)中的亚硝酸钠(86mg,1.25mmol,1.10当量)的溶液。在搅拌10分钟后,将混合物分批加入到在盐酸(12m,1.00ml,10.6当量)中的氯化亚铜(112mg,1.14mmol,27.2μl,1.00当量)的溶液中。将反应混合物在25℃下搅拌3小时。在此时间后,用水(5ml)稀释反应混合物,并用乙酸乙酯(5ml
×
3)提取。合并的有机相用碳酸氢钠水溶液(5ml)、盐水(5ml)洗涤,用无水硫酸钠干燥,过滤并浓缩。残余物通过制备型tlc(石油醚:乙酸乙酯25%)纯化,以得到作为白色固体的4-溴-5-氯-1-甲基-吡唑,中间体ai(92mg,363mol,31%产率)。lcms[m 1]
=197.0;1h nmr(400mhz,cdcl
3-d)δ=7.48(s,1h),3.88(s,3h)。
[0390]
中间体aj
[0391][0392]
将硼氢化钠(22mg,572μmol,1.50当量)缓慢地加入到在乙醇(5ml)中的(5-溴-3-吡啶基)-苯基-甲酮(100mg,381μmol,1.00当量)的溶液中。在25℃下搅拌2小时后,用水(2ml)淬灭反应,并在真空下浓缩。残余物用乙酸乙酯(10ml)稀释,用盐水(10
×
3ml)洗涤,用无水硫酸钠干燥,过滤并浓缩,以得到作为无色油状物的(5-溴吡啶-3-基)(苯基)甲醇,中间体aj(97mg,367μmol,96%产率)。lcms[m 1]
=263.9.1h nmr(400mhz,cdcl3)δ=8.53(d,j=2.0hz,1h),8.48(d,j=2.0hz,1h),7.89(t,j=2.0hz,1h),7.43-7.38(m,1h),7.38-7.31(m,4h),5.85(s,1h),2.85(s,1h)。
[0393]
中间体ak
[0394][0395]
向在二氯甲烷(4ml)中的3-溴-5-(苯硫基)吡啶,中间体aa(200mg,751μmol,1.00当量)的溶液中加入3-氯过氧苯甲酸(153mg,751μmol,85.0%纯度,1.00当量)。将所得的混合物在氮气下在25℃下搅拌1小时。在此时间后,加入氢氧化钠水溶液(4n,40ml),并用二氯
甲烷(20ml
×
2)提取混合物。合并的有机层用盐水(5ml
×
2)洗涤,用硫酸钠干燥并浓缩。残余物通过柱色谱法(sio2,石油醚:乙酸乙酯5-20%)纯化,以得到作为白色固体的3-溴-5-(苯基亚磺酰基)吡啶,中间体ak(150mg,532μmol,70%产率)。1h nmr(400mhz,cdcl3)δ=8.72(d,j=2.0hz,1h),8.66(d,j=2.0hz,1h),8.16(t,j=2.0hz,1h),7.72-7.68(m,2h),7.55-7.27(m,3h)。
[0396]
中间体al
[0397][0398]
在0℃下,将在水(10ml)中的oxone(2.10g,3.42mmol,2.00当量)的溶液加入到在thf(10ml)和甲醇(10ml)中的3-溴-5-苯基硫烷基-吡啶中间体aa(500mg,1.71mmol,1.00当量)的溶液中。所得的混合物在35℃下搅拌12小时,并且在此时间后过滤,并且滤液在减压下浓缩。通过反相hplc(0.1%fa条件)纯化形成的残余物,以得到作为白色固体的3-(苯磺酰基)-5-溴-吡啶,中间体al(300mg,1.01mmol,59%产率)。1h nmr(400mhz,dmso-d6)δ=9.13(d,j=2.0hz,1h),9.01(d,j=2.0hz,1h),8.66(t,j=2.0hz,1h),8.12-8.08(m,2h),7.77-7.72(m,1h),7.69-7.64(m,2h)。
[0399]
中间体am
[0400][0401]
步骤1:在0℃下,将三氯氧磷(phosphorus oxychloride)(4.71g,30.7mmol,2.9ml,1.23当量)滴加到dmf(6ml)中,然后将混合物在0℃下搅拌10分钟。在此时间后,在搅拌的情况下逐滴加入在dmf(25ml)中的1-苯乙酮(3.00g,25.0mmol,2.91ml,1.00当量)的溶液。然后将反应混合物在60℃下加热3小时。在此时间后,将溶液冷却至室温,并缓慢倒入乙酸钠水溶液(10%,100ml)中。用额外的乙酸钠溶液(10ml)将ph调节至4,并用乙酸乙酯(20ml
×
3)提取。合并的有机相用盐水(20ml)洗涤,用无水硫酸钠干燥,过滤并浓缩,以得到作为黄色油状物的(z)-3-氯-3-苯基-丙-2-烯醛(2.50g,14.1mmol,56%产率)。lcms[m 1]
=167.1.1h nmr(400mhz,cdcl3)δ=10.24(d,j=6.8hz,1h),7.49(m,5h),6.69(d,j=6.8hz,1h)。
[0402]
步骤2:氰化氢(hcn)在该反应中作为副产物产生。应采用适当的安全预防措施和程序。将在丙酮(25ml)中的(z)-3-氯-3-苯基-丙-2-烯醛(1.76g,10.6mmol,1.00当量)、硫氰酸铵(1.61g,21.1mmol,1.61ml,2.00当量)脱气,并用氮气吹扫,并在80℃下搅拌1小时。在此时间后,将冷却的混合物倒入饱和碳酸氢钠水溶液(200ml)中,并用乙酸乙酯(100ml
×
3)提取。合并的有机相用盐水(100ml)洗涤,用无水硫酸钠干燥,过滤并浓缩。通过柱色谱法(sio2,石油醚/乙酸乙酯0-50%)纯化形成的残余物,以得到作为黄色油状物的5-苯基异噻唑(1.00g,6.20mmol,58%产率)。lcms[m 1]
=162.2.1h nmr(400mhz,cdcl3)δ=8.49(d,j=2.0hz,1h),7.64-7.60(m,2h),7.48-7.43(m,3h),7.42(d,j=2.0hz,1h)。
[0403]
步骤3:将溴(952mg,5.95mmol,307μl,3.20当量)在30分钟的时间段内滴加到5-苯基异噻唑(300mg,1.86mmol,1.00当量)、乙酸钾(365mg,3.72mmol,2.00当量)和乙酸(12ml)的搅拌混合物中。将反应混合物在25℃下搅拌5小时,并且在此时间后用亚硫酸氢钠水溶液(33%,10ml)处理。用氢氧化钠水溶液(20%,10ml)使溶液呈碱性,用二氯甲烷(3
×
80ml)提取。将合并的有机提取物干燥(无水硫酸钠),过滤并浓缩,以得到作为无色油状物的4-溴-5-苯基-异噻唑,中间体am(300mg,1.25mmol,67%产率)。lcms[m 1]
=240.91h nmr(400mhz,cdcl3)δ=8.39(s,1h),7.69-7.65(m,2h),7.52-7.47(m,3h).
13
c nmr(400mhz,cdcl3)δ=161.0,159.5,129.9,129.3,129.0,128.5,106.0。
[0404]
中间体an
[0405][0406]
将在二噁烷(2.0l)中的中间体i(160g,416mmol,1.00当量)、4,4,5,5-四甲基-2-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基(二氧硼杂环戊烷-2-基))-1,3,2-二氧硼杂环戊烷(bpd)(158g,624mmol,1.50当量)、pd(dppf)cl2(30.4g,41.6mmol,0.10当量)、乙酸钾(122g,1.25mol,3.00当量)的混合物用氮气吹扫,并在100℃下搅拌3小时。在此时间后,过滤反应混合物并在减压下浓缩。残余物用meoh(1.0l)在25℃下研磨2小时,过滤并干燥,以得到作为灰色固体的2-((4-氧代-7-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-3,4-二氢酞嗪-1-基)甲基)异吲哚啉-1,3-二酮,中间体an(93.0g,209mmol,50%产率)。lcms[m 1]
=432.4.1h nmr:(400mhz dmso-d6)δ:12.54(s,1h),8.24-8.37(m,2h),8.13(d,j=7.6hz,1h),7.93-7.99(m,2h),7.87-7.93(m,2h),5.22(s,2h),1.36(s,12h)。
[0407]
中间体ao
[0408][0409]
在0℃下经10分钟,向在dmf(10ml)中的3,5-二溴吡啶(1.00g,4.22mmol,1.00当量)的溶液中加入氢化钠(270mg,6.75mmol,60%纯度,1.60当量),然后加入n-甲基苯胺(452mg,4.22mmol,458μl,1.00当量)。将所得的混合物在100℃下搅拌2小时。在此时间后,用水(10ml)稀释反应混合物,并用乙酸乙酯(10ml
×
3)提取。用盐水(50ml
×
2)洗涤合并的有机层,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过快速硅胶色谱法(400g sio2,水/乙腈,0-100%70ml/min)纯化,以得到作为黄色固体的5-溴-n-甲基-n-苯基-吡啶-3-胺,中间体ao(50.0mg,190μmol,5%产率)。lcms[m 1]
262.9.1h nmr(400mhz,cdcl
3-d)δ=8.12(br d,j=6.4hz,2h),7.44-7.35(m,2h),7.26-7.24(m,1h),7.23-7.19(m,1h),
7.19-7.17(m,1h),7.17-7.14(m,1h),3.33(s,3h)。
[0410]
中间体ap
[0411][0412]
将在二氯甲烷(5ml)中的(5-溴-3-吡啶基)硼酸(325mg,1.61mmol,1.50当量)、1h-吡唑-5-甲腈(100mg,1.07mmol,1.00当量)、吡啶(255mg,3.22mmol,260μl,3.00当量)、分子筛(20.0mg,1.07mmol)和乙酸铜(585mg,3.22mmol,3.00当量)的混合物用氮气脱气,并在20℃下在氧气气氛(15psi)下搅拌12小时。在此时间后,过滤反应混合物并在减压下浓缩,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯5-20%)纯化,以得到作为白色固体的2-(5-溴-3-吡啶基)吡唑-3-甲腈,中间体ap(150mg,602mol,56%产率)。lcms[m 1]
249.0。1h nmr(400mhz,dmso-d6)δ=9.15(d,j=2.4hz,1h),8.91(d,j=2.4hz,1h),8.78(d,j=2.0hz,1h),8.63(t,j=2.0hz,1h),7.34(d,j=2.4hz,1h)。
[0413]
中间体as
[0414][0415]
步骤1:在0℃下,向在thf(10ml)中的环丙醇(450mg,7.74mmol,1.10当量)的溶液中加入氢化钠(310mg,7.74mmol,60.0%纯度,1.10当量),然后加入5-氟-2-硝基-吡啶(1.00g,7.04mmol,1.00当量)并将混合物加热至20℃并搅拌2小时。在完成后,过滤混合物并在真空中浓缩,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯20-80%)纯化,以得到作为白色固体的5-(环丙氧基)-2-硝基-吡啶(1.10g,6.11mmol,86%产率)。lcms[m 1]
=181.1。
[0416]
步骤2:向在甲醇(4ml)中的5-(环丙氧基)-2-硝基-吡啶(200mg,1.11mmol,1.00当量)的溶液中加入活性炭载钯(100mg,1.11mmol,10%纯度,1.00当量)并将混合物在氢气(15psi)气氛下在30℃下搅拌4小时。在完成后,过滤反应混合物,用甲醇(5ml
×
2)洗涤并浓缩,以得到作为黑色油状物的5-(环丙氧基)吡啶-2-胺(120mg,799μmol,72%产率),其被用于下一步骤而无需进一步纯化。lcms[m 1]
=151.1。
[0417]
步骤3:向在甲醇(2ml)和水(1.0ml)中的5-(环丙氧基)吡啶-2-胺(120mg,799μmol,1.00当量)的溶液中加入2-氯乙醛(313mg,1.60mmol,257μl,2.00当量)和碳酸氢钠(70.5mg,839μmol,1.05当量)。将混合物在70℃下搅拌2小时。在此时间后,在减压下除去溶剂,用乙酸乙酯(3ml)和水(2ml)稀释,并用乙酸乙酯(5ml
×
3)提取。合并的有机层用盐水
(10ml
×
3)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩,以得到作为黄色固体的6-(环丙氧基)咪唑并[1,2-a]吡啶(220mg,粗品),其被用于下一步骤而无需进一步纯化。lcms[m 1]
=175.2。
[0418]
步骤4:向在乙腈(2ml)中的6-(环丙氧基)咪唑并[1,2-a]吡啶(220mg,粗品)的溶液中加入n-碘代琥珀酰亚胺(313mg,1.39mmol)。将混合物在20℃下搅拌1小时。在完成后,在减压下浓缩反应混合物,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯20-80%)纯化,以得到作为白色固体的6-(环丙氧基)-3-碘代-咪唑并[1,2-a]吡啶,中间体as(220mg,733μmol,58%产率)。lcms[m 1]
=300.9。1h nmr(400mhz,dmso-d6)δ=8.03(d,j=2.0hz,1h),7.76(s,1h),7.60(d,j=9.6hz,1h),7.17(dd,j=2.4,9.6hz,1h),4.08-4.05(m,1h),0.88-0.82(m,2h),0.80-0.72(m,2h)。
[0419]
中间体at
[0420][0421]
步骤1:向在甲醇(5ml)和水(2.5ml)中的5-(三氟甲氧基)吡啶-2-胺(250mg,1.40mmol,1.00当量)的溶液中加入2-氯乙醛(289mg,1.47mmol,237μl,1.05当量)和碳酸氢钠(118mg,1.41mmol,54.8μl,1.00当量)。将混合物在70℃下搅拌2小时。然后将反应混合物在减压下浓缩,并且残余物用水(20ml)稀释,并用乙酸乙酯(20ml
×
2)提取。浓缩合并的有机层,以得到无色油状物的6-(三氟甲氧基)咪唑并[1,2-a]吡啶(250mg,粗品),其被用于下一步骤而无需进一步纯化。
[0422]
步骤2:在0℃下,向在乙腈(10ml)中的6-(三氟甲氧基)咪唑并[1,2-a]吡啶(238mg,粗品)的溶液中加入在乙腈(5ml)中的n-碘代琥珀酰亚胺(291mg,1.30mmol)的溶液,并允许所得的黄色悬浮液升温至20℃持续2小时。然后用水(10ml)稀释反应混合物,用乙酸乙酯(10ml
×
3)提取,并用盐水(10ml)洗涤合并的有机提取物,干燥,过滤并浓缩。残余物通过硅胶色谱法(石油醚:乙酸乙酯10-15%)纯化,以得到作为黄色固体的3-碘-6-(三氟甲氧基)咪唑并[1,2-a]吡啶,中间体at(180mg,548μmol,46%产率)。lcms[m 1]
=329.0.1h nmr(400mhz,cdcl3)δ=8.23-8.19(s,1h),7.80(s,1h),7.71(d,j=9.6hz,1h),7.27(m,1h)。
[0423]
中间体au
[0424][0425]
步骤1:将在二噁烷(5ml)和水(1.00ml)中的6-碘代咪唑并[1,2-a]吡啶(500mg,2.05mmol,1.00当量)、苯基硼酸(275mg,2.25mmol,1.10当量)、pd(dppf)cl2(150mg,205μmol,0.10当量)、碳酸氢钠(344mg,4.10mmol,159μl,2.00当量)的混合物用氮气脱气,并在80℃下搅拌1小时。在此时间后,反应混合物在减压下浓缩,并且残余物用乙醇(5ml)稀释,
然后浓缩溶液。残余物通过制备型tlc(二氯甲烷:甲醇,10%)纯化,以得到作为白色固体的6-苯基咪唑并[1,2-a]吡啶(250mg,1.29mmol,62%产率)。lcms[m 1]
=195.1。
[0426]
步骤2:向在乙腈(2ml)中的6-苯基咪唑并[1,2-a]吡啶(100mg,515μmol,1.00当量)的溶液中加入n-碘代琥珀酰亚胺(127mg,566μmol,1.10当量)并将混合物在0℃下搅拌1小时。在此时间后,反应混合物在减压下浓缩,并且残余物用乙醇(2ml)稀释,并且除去上清液并在减压下浓缩。残余物通过制备型tlc(石油醚:乙酸乙酯10%)纯化,以得到作为黄色固体的3-碘-6-苯基-咪唑并[1,2-a]吡啶,中间体au(120mg,375μmol,72%产率)。lcms[m 1]
=321.0.1h nmr(400mhz,dmso-d6)δ=8.40(br s,1h),7.77(m,3h),7.73-7.62(m,2h),7.58-7.49(m,2h),7.45(m,1h)。
[0427]
中间体av
[0428][0429]
向在甲醇(10ml)中的5-溴-1h-吡咯并[2,3-b]吡啶(2.00g,10.2mmol,1.00当量)的溶液中加入甲醛(610mg,20.3mmol,559μl,2.00当量)和氢氧化钠(812mg,20.3mmol,2.00当量)并将混合物在20℃下搅拌2小时。在完成后,过滤反应混合物,并在真空下浓缩。残余物通过硅胶柱色谱法(石油醚:乙酸乙酯5-20%)纯化,然后通过制备型tlc(石油醚:乙酸乙酯20%)纯化,以得到作为白色固体的5-溴-3-(甲氧基甲基)-1h-吡咯并[2,3-b]吡啶,中间体av(120mg,498μmol,5%产率)。lcms[m 1]
=243.0。1h nmr(400mhz,dmso-d6)δ=11.83(br s,1h),8.28(d,j=2.4hz,1h),8.18(d,j=2.0hz,1h),7.56(d,j=2.4hz,1h),4.53(s,2h),3.25(s,3h)。
[0430]
中间体ax
[0431][0432]
向在dmf(10ml)中的5-溴吡啶-3-醇(500mg,2.87mmol,1.00当量)的溶液中加入碳酸铯(1.87g,5.75mmol,2.00当量)、2-碘吡啶(707mg,3.45mmol,366μl,1.20当量)、2,2,6,6-四甲基庚烷-3,5-二酮(212mg,1.15mmol,237μl,0.40当量)和碘化亚铜(109mg,575μmol,0.20当量)。将混合物在100℃下搅拌0.5小时。然后用水(100ml)稀释反应混合物,并用乙酸乙酯(70.0ml
×
3)提取。合并的有机层用盐水(100ml)洗涤,干燥,过滤并在减压下浓缩。残余物通过柱色谱法(sio2,石油醚:乙酸乙酯0-20%)纯化,以得到作为黄色油状物的3-溴-5-(2-吡啶氧基)吡啶中间体ax(600mg,1.45mmol,50%产率)。lcms[m 1]
=250.8.1h nmr(400mhz,dmso-d6)δ=8.57(d,j=2.0hz,1h),8.48(d,j=2.4hz,1h),8.16(ddd,j=0.8,2.0,4.8hz,1h),8.02(s,1h),7.91(ddd,j=2.0,7.2,8.0hz,1h),7.21-7.15(m,2h)。
[0433]
中间体ay
[0434][0435]
向在dmf(2ml)中的2-氯嘧啶(300mg,2.62mmol,1.00当量)的溶液中加入碳酸钾(724mg,5.24mmol,2.00当量)和5-溴吡啶-3-醇(479mg,2.75mmol,1.05当量)。将混合物在110℃下搅拌5小时。用水(200ml)稀释反应混合物,并用乙酸乙酯(80ml
×
3)提取。合并的有机层用盐水(150ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩,以得到作为红色固体的2-[(5-溴-3-吡啶基)氧基]嘧啶,中间体ay(523mg,粗品),并且被直接用于下一步而无需进一步纯化。lcms[m 1]
=252.0;1h nmr(400mhz,dmso-d6)δ=8.70(s,1h),8.69(s,1h),8.63(d,j=2.0hz,1h),8.57(d,j=2.4hz,1h),8.17(t,j=2.0hz,1h),7.34(t,j=4.8hz,1h)。
[0436]
中间体ay-1
[0437][0438]
步骤1:向在dmf(6.00ml)中的2-甲基吡唑-3-醇(500mg,5.10mmol,1.00当量)、(溴甲基)苯(1.05g,6.12mmol,726μl,1.20当量)的溶液中加入碳酸钾(1.06g,7.65mmol,1.50当量)。将混合物在120℃下搅拌4小时。然后用水(10ml)稀释反应混合物,并用乙酸乙酯(20ml
×
3)提取。用盐水(50ml
×
2)洗涤合并的有机层,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过柱色谱法(sio2,石油醚/乙酸乙酯50/1至6/1)纯化,以得到无色油状物的5-苄氧基-1-甲基-吡唑(450mg,2.39mmol,47%产率)。lcms[m 1]
=189.2;1h nmr(400mhz,cdcl3)δ=7.43-7.41(m,3h),7.40-7.35(m,2h),7.31(d,j=2.0hz,1h),7.24-7.21(d,j=2.0hz,1h),5.08(s,2h),3.67(s,3h)。
[0439]
步骤2:向在乙腈(6ml)中的5-苄氧基-1-甲基-吡唑(400mg,2.13mmol,1.00当量)的溶液中加入nbs(416mg,2.34mmol,1.10当量)。将混合物在0℃下搅拌0.5小时。然后在减压下浓缩反应混合物,并且残余物通过柱色谱法(sio2,石油醚/乙酸乙酯=100/1至20/1)纯化,以得到作为黄色油状物的5-苄氧基-4-溴-1-甲基-吡唑(320mg,1.20mmol,56%产率)。lcms[m 1]
=266.9;1h nmr(400mhz,cdcl3)δ=7.39(s,5h),7.32(s,1h),5.28(s,2h),3.45(s,3h)。
[0440]
表i-iib中所示的中间体ay-2是根据一般反应方案的教导和制备中间体ay-1的方法制备的。
[0441][0442]
中间体b-1至b-15的一般程序
[0443][0444]
在0℃下在氮气下,向在dmf(10ml)中的对应的芳基/杂芳基苯酚(3.89mmol,1.00当量)中加入氢化钠(4.28mmol,60%纯度,1.10当量)。在加入后,将混合物在25℃下搅拌0.5小时,然后加入3-溴-5-氟-吡啶(3.89mmol,1.00当量)并在100℃下搅拌另外的12小时。在此时间后,通过加入水(10ml)淬灭反应混合物,然后用乙酸乙酯(20ml
×
3)提取。合并的有机层用盐水(50ml
×
2)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩,以得到残余物,其被直接用于下一步骤而无需进一步纯化。
[0445]
按照一般反应方案的教导和中间体b-1至b-15的一般程序,制备了表i-iii中的中间体。
[0446]
[0447][0448]
中间体bn
[0449][0450]
向在dmf(10ml)中的3-溴-5-氟-吡啶(210mg,1.19mmol,0.95当量)的溶液中加入碳酸钾(347mg,2.51mmol,2.00当量)和3-氯-2,4-二甲基-苯酚(197mg,1.26mmol,1.00当量)。将混合物在110℃下搅拌12小时。在此时间后,用水(80ml)稀释反应混合物,并用乙酸乙酯(50ml
×
3)提取。然后用盐水(50ml)洗涤合并的有机层,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过柱色谱法(sio2,石油醚:乙酸乙酯0-20%)纯化,以得到作为无色油状物的3-溴-5-(3-氯-2,4-二甲基-苯氧基)吡啶,中间体bn(178mg,569μmol,45%产率)。lcms[m 1]
=314.0。1h nmr(400mhz,dmso-d6)δ=8.45(d,j=2.0hz,1h),8.31(d,j=2.4hz,1h),7.57(t,j=2.0hz,1h),7.27(d,j=8.4hz,1h),6.99(d,j=8.4hz,1h),2.34(s,3h),2.22(s,3h)。
[0451]
中间体bp
[0452][0453]
向在二氯甲烷(10ml)中的3-溴-4,5,6,7-四氢吡唑并[1,5-a]吡嗪(300mg,949μmol,1.00当量,tfa)和苯甲醛(131mg,1.23mmol,125μl,1.30当量)的溶液中加入三乙酰氧基硼氢化钠(402mg,1.90mmol,2.00当量)和乙酸(114mg,1.90mmol,109μl,2.00当量)。然后将混合物在25℃下搅拌4小时。在此时间后,用水(10ml)稀释反应混合物,并用乙酸乙酯(15ml
×
3)提取。用盐水(50ml
×
2)洗涤合并的有机层,用无水硫酸钠干燥,过滤并浓缩。残余物通过制备型tlc(sio2,石油醚:乙酸乙酯25%)纯化,以得到作为无色油状物的5-苄基-3-溴-6,7-二氢-4h-吡唑并[1,5-a]吡嗪,中间体bp(170mg,582μmol,61%产率)。lcms[m 1]
=294.0.1h nmr(400mhz,cd3od)δ=7.45(s,1h),7.41-7.32(m,5h),4.12(t,j=5.6hz,2h),3.77(s,2h),3.57(s,2h),2.96(t,j=5.6hz,2h)。
[0454]
中间体bq
[0455][0456]
将在甲醇(8ml)中的3-溴-4,5,6,7-四氢吡唑并[1,5-a]吡嗪(400mg,1.27mmol,1.00当量)、乙醛(5.0m,508ul,2.01当量)、氰基硼氢化钠(160mg,2.54mmol,2.01当量)、氯化锌(1.0m,2.53ml,2.00当量)的混合物在25℃下搅拌2小时。在此时间后,蒸发溶剂,并且残余物通过柱色谱法(sio2,二氯甲烷:甲醇0-10%)纯化。产物通过制备型hplc(waters xbridge c18 150
×
50mm
×
10μm;流动相:[水(10mm nh4hco3)-acn];b%:16%-46%,11.5分
6,7-二氢-4h-吡唑并[1,5-a]吡嗪-5-基)-环丙基-甲酮,中间体bv(139mg,515μmol,65%产率)。1h nmr(400mhz,cdcl3)δ=7.48(s,1h),4.89-4.68(m,2h),4.33-4.05(m,4h),1.87-1.79(m,1h),1.09-1.04(m,2h),0.93-0.84(m,2h)。
[0473]
按照一般反应方案的教导和用于中间体bv的程序,制备了中间体c-1至c-5,如表i-iv所示:
[0474][0475][0476]
中间体cb
[0477][0478]
将在二噁烷(50ml)和水(10ml)中的3-溴-5-碘-吡啶(3.00g,10.6mmol,1.00当量)、中间体an(2.28g,5.28mmol,0.50当量)、碳酸氢钠(1.78g,21.1mmol,822μl,2.00当量)、pd(dppf)cl2(773mg,1.06mmol,0.10当量)的混合物用氮气3脱气,然后在80℃下搅拌1小时。然后将冷却的反应混合物在减压下浓缩,用水(200ml)稀释,过滤,并且滤饼用二氯甲烷:甲醇(10%,150ml)研磨。过滤并干燥固体,并且在甲醇(100ml)中二次研磨固体,然后过滤并干燥,以得到作为灰色固体的2-[[7-(5-溴-3-吡啶基)-4-氧代-3h-酞嗪-1-基]甲基]异吲哚啉-1,3-二酮,中间体cb(775mg,粗品)。1h nmr(400mhz,dmso-d6)δ=12.54(s,1h),9.16(d,j=1.2hz,1h),8.82(d,j=1.6hz,1h),8.73(s,1h),8.52(s,1h),8.38-8.28(m,2h),7.98-7.95(m,2h),7.90(m,2h),5.38(s,2h)。
[0479]
中间体cc
[0480][0481]
步骤1:向在dmf(2ml)中的吡唑并[1,5-a]吡啶-5-醇(250mg,1.86mmol,1.00当量)的溶液中加入碳酸钾(773mg,5.59mmol,3.00当量)并将混合物在30℃下搅拌0.5小时。加入碘乙烷(872mg,5.59mmol,447μl,3.00当量),并且将所得的混合物在30℃下搅拌12小时。在此时间后,用水(50ml)稀释反应混合物,用乙酸乙酯(20ml
×
3)提取,并且将合并的有机层用盐水(50ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过制备型tlc(sio2,石油醚/乙酸乙酯20%)纯化,以得到作为白色固体的5-乙氧基吡唑并[1,5-a]吡啶(272mg,1.68mmol,90%产率)。lcms[m 1]
=163.2;1h nmr(400mhz,dmso-d6)δ=8.50(d,j=7.6hz,1h),7.86(d,j=2.0hz,1h),6.98(d,j=2.8hz,1h),6.52(dd,j=2.8,7.6hz,1h),6.35(d,j=2.0hz,1h),4.06(q,j=6.8hz,2h),1.35(t,j=6.8hz,3h)。
[0482]
步骤2:向在乙腈(1.0ml)中的5-乙氧基吡唑并[1,5-a]吡啶(260mg,1.60mmol,1.00当量)的溶液中加入nis(397mg,1.76mmol,1.10当量)。在25℃下搅拌混合物1小时,然后用水(30ml)稀释混合物,并用乙酸乙酯(10ml
×
3)提取。合并的有机层用盐水(20ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过制备型tlc(sio2,石油醚/乙酸乙酯20%)纯化,以得到作为粉色固体的5-乙氧基-3-碘代-吡唑并[1,5-a]吡啶(369mg,1.28mmol,80%产率)。lcms[m 1]
=289.1;1h nmr(400mhz,dmso-d6)δ=8.57(d,j=7.6hz,1h),7.96(s,1h),6.67(d,j=2.4hz,1h),6.59(dd,j=2.4,7.6hz,1h),4.14(q,j=6.8hz,2h),1.37(t,j=6.8hz,3h)。
[0483]
中间体cd
[0484][0485]
按照与用于制备中间体cc相同的程序,使用2-碘丙烷,中间体cd,3-碘-5-异丙氧基-吡唑并[1,5-a]吡啶制备为黄色固体(299mg,0.99mmol,经过2步产率为87%)。lcms[m 1]
=303.0;1h nmr(400mhz,dmso-d6)δ=8.56(d,j=7.6hz,1h),7.96(s,1h),6.67(d,j=2.8hz,1h),6.57(dd,j=2.8,7.6hz,1h),4.77(td,j=6.0,12.0hz,1h),1.32(s,3h),1.30(s,3h)。
[0486]
中间体ce
[0487][0488]
步骤1:将在二氯甲烷(10ml)中的吡唑并[1,5-a]吡啶-5-醇(300mg,2.24mmol,1.00当量)、苯硼酸(545mg,4.47mmol,2.00当量)、ms(30mg)、乙酸铜(812mg,4.47mmol,2.00当量)和三乙胺(1.13g,11.2mmol,1.56ml,5.00当量)的混合物用氧气脱气,并在25℃下在氧气(15psi)气氛下搅拌10小时。在此时间后,将反应混合物过滤,浓缩,并通过柱色谱法(sio2,石油醚/乙酸乙酯0-20%)纯化形成的残余物,以得到作为黄色油状物的5-苯氧基吡唑并[1,5-a]吡啶(200mg,0.95mmol,43%产率)。lcms[m 1]
=211.2。
[0489]
步骤2:向在乙腈(2ml)中的5-苯氧基吡唑并[1,5-a]吡啶(180mg,0.86mmol,1.00当量)的溶液中加入nis(212mg,0.94mmol,1.10当量)。将混合物在0℃下搅拌1小时。然后浓缩反应混合物,并且残余物通过柱色谱法(sio2,石油醚/乙酸乙酯0-5%)纯化,以得到作为黄色油状物的3-碘-5-苯氧基-吡唑并[1,5-a]吡啶(170mg,0.51mmol,59%产率)。lcms[m 1]
=336.9。
[0490]
中间体cf
[0491][0492]
步骤1:将在乙醇(3.8ml)和dmf(7.5ml)中的1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(1.50g,7.21mmol,1.00当量),[(e)-2-溴乙烯基]苯(2.90g,15.8mmol,2.03ml,2.20当量)、pd(pph3)2cl2(506mg,721umol,0.10当量)、碳酸钾(1.30g,9.41mmol,1.30当量)的混合物用氮气脱气,然后在75℃下搅拌2小时。在此时间后,将混合物冷却至环境温度,用水(100ml)稀释,并用乙酸乙酯(80ml
×
3)提取。合并的有机层用盐水(150ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过柱色谱法(sio2,石油醚/乙酸乙酯0-20%)纯化,以得到作为黄色固体的1-甲基-5-[(e)-苯乙烯基]吡唑(990mg,5.37mmol,74%产率)。lcms[m 1]
=185.2;1h nmr(400mhz,dmso-d6)δ=7.65(d,j=7.2hz,2h),7.42-7.36(m,3h),7.32-7.25(m,2h),7.12(d,j=16.0hz,1h),6.63(d,j=2.0hz,1h),3.91(s,3h)。
[0493]
步骤2:在氮气下,向在乙醇(3ml)中的1-甲基-5-[(e)-苯乙烯基]吡唑(400mg,2.17mmol,1.00当量)的溶液中加入pd/c(10.0mg,10%pd)。将悬浮液在真空下脱气,并用氢气吹扫数次,并且然后在25℃下在氢气(15.0psi)下搅拌混合物12小时。在此时间后,过滤反应混合物并在减压下浓缩,以得到作为黄色油状物的1-甲基-5-(2-苯乙基)吡唑(385mg,1.93mmol,89%产率),并且被用于下一步骤而无需进一步纯化。lcms[m 1]
=187.2。
[0494]
步骤3:向在乙腈(10ml)中的1-甲基-5-(2-苯基乙基)吡唑(385mg,1.93mmol,1.00
当量)的溶液中加入n-溴代琥珀酰亚胺(343mg,1.93mmol,1.00当量)。然后将混合物在0℃下搅拌0.5小时。在此时间后,将反应混合物在减压下浓缩,并且残余物通过制备型tlc(sio2,石油醚/乙酸乙酯20%)纯化,以得到作为黄色油状物的4-溴-1-甲基-5-(2-苯乙基)吡唑(430mg,1.62mmol,84%产率)。1h nmr(400mhz,dmso-d6)δ=7.43(s,1h),7.31-7.24(m,2h),7.23-7.18(m,1h),7.17-7.11(m,2h),3.58(s,3h),2.97-2.89(t,j=7.2hz,2h),2.84-2.77(t,j=7.2hz,2h)。
[0495]
中间体cg
[0496][0497]
步骤1:将在二噁烷(10ml)和水(2ml)中的1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(1.00g,4.81mmol,1.00当量)、2-溴吡啶(911mg,5.77mmol,0.55ml,1.20当量)、碳酸铯(3.13g,9.61mmol,2.00当量)和pd(dppf)cl2(352mg,0.48mmol,0.10当量)的混合物脱气并用氮气吹扫,然后将混合物在100℃下搅拌1小时。在此时间后,将冷却的反应混合物在减压下浓缩,并通过柱色谱法(sio2,石油醚/乙酸乙酯0-20%)纯化,以得到作为红色油状物的2-(2-甲基吡唑-3-基)吡啶(860mg,粗品),其被直接用于下一步骤而无需进一步纯化。1h nmr(400mhz,dmso-d6)δ=8.69-8.66(m,1h),7.89(dt,j=1.6,7.6hz,1h),7.78(td,j=1.2,8.0hz,1h),7.48(d,j=2.0hz,1h),7.37(ddd,j=1.2,4.8,7.6hz,1h),6.78(d,j=1.6hz,1h),4.14(s,3h)。
[0498]
步骤2:向在乙腈(10ml)中的2-(2-甲基吡唑-3-基)吡啶(760mg,粗品)的溶液中加入n-溴代琥珀酰亚胺(850mg,4.77mmol)。将混合物在0℃下搅拌0.5小时。然后将反应混合物在减压下浓缩,并且残余物通过制备型tlc(sio2,石油醚/乙酸乙酯20%)纯化,以得到作为灰白色固体的2-(4-溴-2-甲基-吡唑-3-基)吡啶(507mg,2.13mmol,44%产率)。1h nmr(400mhz,dmso-d6)δ=8.77(td,j=0.8,4.0hz,1h),8.01(dt,j=2.0,7.6hz,1h),7.76
–
[0499]
步骤3:向在二氯乙烷(3ml)中的2-(4-溴-2-甲基-吡唑-3-基)吡啶(150mg,0.63mmol,1.00当量)的溶液中加入间氯过苯甲酸(435mg,2.14mmol,85%纯度,3.40当量)。将混合物在60℃下搅拌5小时。然后通过额外的饱和亚硫酸钠溶液(20ml)来淬灭反应混合物,并用二氯甲烷(20ml
×
3)提取。合并的有机层用盐水(30ml)洗涤,用无水硫酸钠干燥,过滤并浓缩,并且残余物通过制备型tlc(sio2,石油醚/乙酸乙酯50%)纯化,以得到作为黄色固体的2-(4-溴-1-甲基-1h-吡唑-5-基)吡啶1-氧化物(185mg,粗品),其被直接用于下一步骤而无需进一步纯化。lcms[m 1]
=254.1;1h nmr(400mhz,dmso-d6)δ=8.46(d,j=6.4hz,1h),7.70(s,1h),7.5(dt,j=1.2,7.6hz,2h),7.52-7.47(m,1h),3.74(s,3h)。
[0500]
中间体ch
[0501][0502]
步骤1:将在dmf(6ml)中的喹啉-8-醇(454mg,3.13mmol,0.54ml,1.10当量),3-溴-5-氟-吡啶(500mg,2.84mmol,1.00当量),碳酸钾(785mg,5.68mmol,2.00当量)的混合物用氮气脱气,然后在110℃下搅拌3小时。在此时间后,混合物用乙酸乙酯(5ml
×
3)提取,并且将合并的提取物用盐水(2ml)洗涤,用无水硫酸钠干燥,过滤并浓缩,以得到作为黄色油状物的8-[(5-溴-3-吡啶基)氧基]喹啉(0.30g,0.75mmol,26%产率)。lcms[m 1]
=301.0;1h nmr(400mhz,cdcl3)δ=8.95(dd,j=2.0,4.0hz,1h),8.43(d,j=2.0hz,1h),8.39(d,j=2.4hz,1h),8.25(dd,j=2.0,8.4hz,1h),7.73(dd,j=1.6,8.4hz,1h),7.55(t,j=8.0hz,1h),7.50(dd,j=4.0,8.4hz,1h),7.47-7.43(m,2h)。
[0503]
中间体ci
[0504][0505]
步骤1:将在二噁烷(10ml)中的3,5-二溴吡啶(1.48g,6.25mmol,1.00当量),喹啉-8-胺(901mg,6.25mmol,1.00当量)、叔丁醇钠(901mg,9.37mmol,1.50当量)、pd2(dba)3(57.2mg,62.5μmol,0.01当量)和xantphos(72.3mg,125μmol,0.02当量)的混合物用氮气脱气,然后在100℃下搅拌2小时。在此时间后,用水(20ml)稀释混合物,并用乙酸乙酯(20ml
×
3)提取。合并的有机相用盐水(20ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且残余物通过反相hplc(0.1%甲酸(fa)条件)纯化,以得到作为黄色固体的n-(5-溴-3-吡啶基)喹啉-8-胺(160mg,486μmol,7%产率)。lcms[m 1]
=300.0;1h nmr(400mhz,cdcl3)δ=8.82(dd,j=1.6,4.0hz,1h),8.61(d,j=2.4hz,1h),8.40(br s,1h),8.31(d,j=1.6hz,1h),8.17(dd,j=1.6,8.4hz,1h),7.92(t,j=2.0hz,1h),7.51-7.46(m,3h),7.37(dd,j=1.6,8.0hz,1h)。
[0506]
步骤2:将n-(5-溴-3-吡啶基)喹啉-8-胺(130mg,394μmol,1.00当量)溶解在dmf(2ml)中,然后在0℃下加入氢化钠(32mg,790μmol,60.0%纯度,2.00当量),并将混合物在0℃下搅拌10分钟。在此时间后,加入碘甲烷(224mg,1.58mmol,98μl,4.00当量)并在20℃下搅拌所得的混合物1小时。然后用水(10ml)淬灭反应混合物,用乙酸乙酯(20ml
×
3)提取,并且合并的有机相用盐水(20ml)洗涤,用无水硫酸钠干燥,过滤并浓缩,以得到作为黄色油状物的n-(5-溴-3-吡啶基)-n-甲基-喹啉-8-胺(150mg,334μmol,85%产率)。lcms[m 1]
=314.1;1h nmr(400mhz,cdcl3)δ=8.90(dd,j=1.6,4.4hz,1h),8.24(dd,j=1.6,8.4hz,1h),8.01(d,j=2.0hz,1h),7.92(d,j=2.8hz,1h),7.82(dd,j=1.6,8.0hz,1h),7.65-7.62(m,1h),7.61-7.57(m,1h),7.46(dd,j=4.4,8.4hz,1h),7.10(t,j=2.4hz,1h),3.49(s,3h)。
[0507]
中间体cj
[0508][0509]
步骤1:将在1,2-二氯乙烷(10ml)的2-乙基苄腈(500mg,3.81mmol,0.51ml,1.00当量)、对甲苯磺酸(363mg,1.91mmol,0.50当量)、n-溴代琥珀酰亚胺(746mg,4.19mmol,1.10当量)和醋酸钯(85.6mg,0.38mol,0.10当量)的混合物用氮气脱气,然后在70℃下搅拌12小时。在此时间后,反应混合物在减压下浓缩,并且残余物通过柱色谱法(sio2,石油醚/乙酸乙酯0-5%)纯化,以得到作为黄色油状物的2-溴-6-乙基-苄腈(446mg,1.15mmol,30%产率)。1h nmr(400mhz,dmso-d6)δ=7.76(dd,j=0.8,7.6hz,1h),7.70(d,j=8.0hz,1h),7.60-7.54(m,1h),2.81(m,2h),1.22(m,3h)。
[0510]
步骤2:将在n-甲基吡咯烷酮(10ml)中的2-溴-6-乙基-苄腈(446mg,1.15mmol,1.00当量)、4-溴-1-甲基-吡唑(203mg,1.26mmol,1.10当量)、乙酸钯(2.57mg,0.12mmol,0.01当量)、davephos(9.0mg,0.23mmol,0.02当量)、2-甲基丙酸(30.3mg,0.34mmol,31.9ul,0.30当量)和乙酸四丁基铵(691mg,2.29mmol,0.70ml,2.00当量)的混合物用氮气脱气,然后在100℃下搅拌12小时。在此时间后,用水(100ml)稀释反应混合物,用乙酸乙酯(60ml
×
3)提取,并且将合并的有机层用盐水(80ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过柱色谱法(sio2,石油醚/乙酸乙酯10-20%)纯化,以得到作为黄色固体的2-(4-溴-2-甲基-吡唑-3-基)-6-乙基-苄腈(310mg,0.44mmol,39%产率)。lcms[m 1]
=290.1;1h nmr(400hz,dmso-d6)δ=7.83-7.78(m,1h),7.73(s,1h),7.68(d,j=7.6hz,1h),7.50-7.47(m,1h),3.71(s,3h),2.90(q,j=7.6hz,2h),1.28(t,j=7.6hz,3h)。
[0511]
表i-v中所示的中间体d-1至d-20是根据一般反应方案的教导和制备中间体cj的方法制备的。
[0512]
[0513]
[0514][0515]
中间体da
[0516][0517]
步骤1:将在dmf(10ml)中的3-溴苯酚(1.00g,5.78mmol,1.00当量)、溴环丁烷(1.17g,8.65mmol,0.82ml,1.50当量)和碳酸钾(3.20g,23.1mmol,4.00当量)的混合物,并在120℃下搅拌6小时。用水(80ml)稀释反应混合物,并用(石油醚/乙酸乙酯20%)(50ml
×
3)提取,将合并的提取物用氢氧化钠水溶液(1.00m,50ml)、盐水(50ml)洗涤,并且用硫酸钠干燥并浓缩,以得到作为无色油状物的1-溴-3-(环丁氧基)苯(1.20g,5.27mmol,91%产率)。1h nmr(400mhz,cdcl3)δ=7.04-6.93(m,2h),6.86(t,j=2.4hz,1h),6.64(ddd,j=1.2,2.4,8.0hz,1h),4.60-4.44(m,1h),2.34(tddd,j=2.8,6.8,8.0,9.6hz,2h),2.14-1.98(m,2h),1.83-1.71(m,1h),1.66-1.50(m,1h)。
[0518]
步骤2:将在nmp(5ml)中的1-溴-3-(环丁氧基)苯(300mg,1.32mmol,1.00当量)、4-溴-1-甲基-吡唑(213mg,1.32mmol,1.00当量)、醋酸钯(2.97mg,13.2mmol,0.01当量)、乙酸四丁基铵(224mg,2.91mmol,2.20当量)、2-甲基丙酸(34.9mg,396μmol,36.8μl,0.30当量)和davephos(10.4mg,26.4μmol,0.02当量)用氮气脱气,并加热至100℃持续12小时。然后用水(20ml)稀释反应混合物,用乙酸乙酯(30ml
×
3)提取,并且合并的有机相用盐水(30ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过柱色谱法(sio2,石油醚/乙酸乙酯1-5%)纯化,以得到作为黄色油状物的4-溴-5-[3-(环丁氧基)苯基]-1-甲基-吡唑(40.0mg)。1h nmr(400mhz,cdcl3)δ=7.54(s,1h),7.45(s,1h),6.98-6.90(m,2h),6.86-6.83(m,1h),4.68(t,j=7.2hz,1h),3.83(s,3h),2.54-2.40(m,2h),2.27-2.14(m,2h),1.95-1.66(m,2h)。
[0519]
表i-vi中所示的中间体e-1和e-2是按照一般反应方案的教导和制备中间体da的方法制备的。
[0520][0521]
中间体db
[0522][0523]
步骤1:将在水(2.4ml)和二噁烷(12ml)中的1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(1.50g,7.21mmol,1.00当量)、1-溴-2-氯苯(1.38g,7.21mmol,0.84ml,1.00当量)、碳酸钠(2.29g,21.6mmol,3.00当量)、pd(dppf)cl2(528mg,0.72mmol,0.10当量)的混合物用氮气脱气,然后在80℃下搅拌2小时。在此时间后,将混合物在减压下浓缩,并通过柱色谱法(sio2,石油醚/乙酸乙酯10-20%)纯化,以得到作为黄色固体的5-(2-氯苯基)-1-甲基-吡唑(0.56g,2.88mmol,40%产率)。lcms[m 1]
=193.1;1h nmr(400mhz,cdcl3)δ=7.56(d,j=2.0hz,1h),7.52(dd,j=1.2,7.6hz,1h),7.43-7.33(m,3h),6.30(d,j=2.0hz,1h),3.74(s,3h)。
[0524]
步骤2:将在乙腈(2ml)中的5-(2-氯苯基)-1-甲基-吡唑(200mg,1.04mmol,1.00当量)、n-溴代琥珀酰亚胺(203mg,1.14mmol,1.10当量)的混合物用氮气脱气,然后在0℃下搅
拌2小时。在此时间后,将混合物在减压下浓缩,并且残余物通过制备型tlc(石油醚/乙酸乙酯20%)纯化,以得到作为黄色固体的4-溴-5-(2-氯苯基)-1-甲基-吡唑(220mg,0.77mmol,74%产率)。lcms[m 1]
=273.1;1h nmr(400mhz,cdcl3)δ=7.59-7.55(m,2h),7.50-7.40(m,2h),7.36-7.33(m,1h),3.74(s,3h)。
[0525]
表i-vii中所示的中间体f-1至f-22是按照一般反应方案的教导和制备中间体db的方法制备的。
[0526]
[0527]
[0528]
[0529][0530]
中间体dc
[0531][0532]
步骤1:向在水(5ml)中的2-溴萘-1-甲醛(220mg,0.94mmol,1.00当量)的溶液中加入氨基硫酸氢盐(212mg,1.87mmol,2.00当量)。将混合物在50℃下搅拌12小时。然后过滤悬浮液,并且将滤饼在减压下干燥,以得到作为白色固体的(1e)-2-溴萘-1-甲醛肟(220mg,0.88mmol,94%产率),其被使用而无需进一步纯化。1h nmr(400mhz,dmso-d6)δ=11.79(s,1h),8.58(s,1h),8.55(dd,j=1.6,8.0hz,1h),8.03-7.98(m,1h),7.92(d,j=8.8hz,1h),7.77(d,j=8.8hz,1h),7.67-7.57(m,2h)。向在thf(5ml)中的(1e)-2-溴萘-1-甲醛肟(220mg,粗品)的溶液中加入三乙胺(890mg,8.80mmol,1.22ml)和三氟乙酸酐(924mg,4.40mmol,0.61ml),并将混合物在20℃下搅拌1小时。在此时间后,将反应混合物在减压下浓缩,并且将残余物通过制备型tlc(sio2,石油醚/乙酸乙酯10%)纯化,以得到作为白色固体的2-溴萘-1-甲腈(190mg,0.82mmol,93%产率)。gcms[m 1]
=230.9;1h nmr(400mhz,dmso-d6)δ=8.26(d,j=8.8hz,1h),8.16(d,j=8.0hz,1h),8.09(d,j=8.0hz,1h),7.93(d,j=8.8hz,1h),7.85(dt,j=1.2,8.4hz,1h),7.79-7.71(m,1h)。
[0533]
步骤2:将在n-甲基吡咯烷酮(nmp)(6ml)中的2-溴萘-1-甲腈(190mg,0.82mmol,1.00当量)、4-溴-1-甲基-吡唑(132mg,0.82mmol,1.00当量)、乙酸四丁基铵(494mg,1.64mmol,0.50ml,2.00当量)、davephos(6.4mg,16μmol,0.02当量)、2-甲基丙酸(22mg,246μmol,23μl,0.30当量)和乙酸钯(1.8mg,8.2μmol,0.01当量)的混合物用氮气脱气,然后将混合物在100℃下搅拌12小时。在此时间后,用水(30ml)稀释反应混合物,并用乙酸乙酯(50ml
×
3)提取。合并的有机层用盐水(100ml
×
2)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过反相hplc(0.1%甲酸条件)纯化,以得到作为黄色油状物的2-(4-溴-2-甲基-吡唑-3-基)萘-1-甲腈(190mg,0.61mmol,74%产率)。lcms[m 1]
=314.1;1h nmr
(400mhz,dmso-d6)δ=8.49(d,j=8.4hz,1h),8.24(t,j=8.4hz,2h),7.92(dt,j=1.2,8.4hz,1h),7.87-7.82(m,1h),7.81(s,1h),7.76(d,j=8.4hz,1h),3.79(s,3h)。
[0534]
中间体dd
[0535][0536]
步骤1:向在thf(3ml)中的乙醇(207mg,4.50mmol,0.26ml,3.00当量)的溶液中加入氢化钠(180mg,4.50mmol,60.0%纯度,3.00当量),然后以滴加方式加入在thf(1ml)中的2-溴-6-氟-苄腈(300mg,1.50mmol,1.00当量)的溶液。在添加完成后,将混合物在25℃下搅拌3小时。在此时间后,用水(0.2ml)淬灭反应并在真空中浓缩,并且将残余物通过柱色谱法(sio2,石油醚/乙酸乙酯10%)纯化,以得到作为白色固体的2-溴-6-乙氧基-苄腈(200mg,0.89mmol,59%产率)。1h nmr(400mhz,cdcl3)δ=7.38-7.32(t,j=8.4hz,1h),7.20(d,j=8.0hz,1h),6.90(d,j=8.4hz,1h),4.15(q,j=7.2hz,2h),1.47(t,j=7.2hz,3h)。
[0537]
步骤2:将2-溴-6-乙氧基-苄腈(200mg,0.89mmol,1.00当量)、4-溴-1-甲基-吡唑(185mg,1.15mmol,1.30当量)、乙酸钯(2.0mg,8.9μmol,0.01当量)、davephos(7.0mg,17.7μmol,0.02当量)、2-甲基丙酸(23.4mg,265μmol,25μl,0.30当量)和乙酸四丁基铵(533mg,1.77mmol,2.00当量)的混合物用氮气脱气,然后将混合物在100℃下搅拌15小时。在此时间后,用乙酸乙酯(20ml)稀释混合物,用水(20ml
×
3)洗涤,并且将合并的有机相用无水硫酸钠干燥,过滤并在真空中浓缩。然后通过制备型tlc(sio2,石油醚/乙酸乙酯20%)纯化残余物,以得到作为白色固体的2-(4-溴-1-甲基-1h-吡唑-5-基)-6-乙氧基苄腈(60.0mg,0.20mmol,22%产率)。lcms[m 1]
=306.1;1h nmr(400mhz,cdcl3)δ=7.56(dd,j=7.6,8.4hz,1h),7.49(s,1h),7.02(d,j=8.4hz,1h),6.91(d,j=7.6hz,1h),4.15(q,j=7.2hz,2h),3.73(s,3h),1.46(t,j=7.2hz,3h)。
[0538]
中间体de
[0539][0540]
将在dmf(8ml)中的4-溴-2-甲基-吡唑-3-醇(300mg,1.69mmol,1.00当量)、1-(溴甲基)-2-氯苯(348mg,1.69mmol,0.22ml,1.00当量)和碳酸钾(469mg,3.39mmol,2.00当量)的混合物在18℃下搅拌2小时。在此时间后,用水(20ml)稀释反应混合物,并用乙酸乙酯(20ml
×
3)提取。合并的有机提取物用盐水(20ml)洗涤,用无水硫酸钠干燥,过滤,在减压下浓缩,并且残余物通过反相hplc(0.1%fa条件)纯化,以得到作为黄色固体的4-溴-5-[(2-氯苯基)甲氧基]-1-甲基-吡唑(220mg,0.72mmol,42%产率)。lcms[m 1]
=303.0;1h nmr
(400mhz,cdcl3)δ=7.48-7.43(m,2h),7.37-7.27(m,3h),5.40(s,2h),3.55(s,3h)。
[0541]
表i-viii中所示的g-1至g-4中间体是按照一般反应方案的教导和制备中间体de的方法制备的。
[0542][0543][0544]
中间体h-1
[0545][0546]
步骤1:将在dmf(6ml)中的2-溴-6-氟-苄腈(600mg,3.00mmol,1.00当量)、丙-2-醇(225mg,3.75mmol,0.29ml,1.25当量),碳酸铯(1.47g,4.50mmol,1.50当量)的混合物在75℃下搅拌1小时。在此时间后,用水(30ml)稀释反应混合物,并用乙酸乙酯(50ml
×
3)提取。合并的有机层用盐水(100ml
×
2)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过反相hplc(0.1%甲酸条件)纯化,以得到作为白色固体的2-溴-6-异丙氧基-苄腈(540mg,2.25mmol,75%产率)。lcms[m 1]
=241.9;1h nmr(400mhz,dmso-d6)δ=7.56(t,j=8.4hz,1h),7.37(d,j=7.6hz,1h),7.31(d,j=8.4hz,1h),4.90-4.75(m,1h),1.32(d,j=6.0hz,6h)。
[0547]
步骤2:将在1-甲基-2-吡咯烷酮(7ml)中的2-溴-6-异丙氧基-苄腈(500mg,2.08mmol,1.00当量)、4-溴-1-甲基-吡唑(335mg,2.08mmol,1.00当量)、二乙酰氧基钯(4.7mg,0.021mmol,0.01当量)、davephos(16mg,0.042mmol,0.02当量)、乙酸四丁基铵(1.26g,4.16mmol,2.00当量)和2-甲基丙酸(55mg,0.63mmol,0.06ml,0.30当量)的混合物用氮气脱气,然后在100℃下搅拌12小时。在此时间后,用水(30ml)稀释反应混合物,并用乙酸乙酯(40ml
×
3)提取。合并的有机层用盐水(100ml
×
2)洗涤,用无水硫酸钠干燥,过滤并
在减压下浓缩。残余物通过反相hplc(0.1%甲酸条件)纯化,以得到作为白色固体的2-(4-溴-2-甲基-吡唑-3-基)-6-异丙氧基-苄腈(160mg,0.50mmol,24%产率)。lcms[m 1]
=319.9;1h nmr(400mhz,dmso-d6)δ=7.81-7.76(m,1h),7.72(s,1h),7.46(d,j=8.8hz,1h),7.14(d,j=7.2hz,1h),4.88(td,j=6.0,12.0hz,1h),3.71(s,3h),1.36(d,j=6.0hz,6h)。
[0548]
表i-ix所示的中间体h-2至h-8是按照一般反应方案的教导和制备中间体h-1的方法制备的。
[0549][0550]
[0551]
中间体i-1
[0552][0553]
步骤1:在0℃下,向在二氯甲烷(2ml)中的6-羟基色满5-甲腈(150mg,0.86mmol,1.00当量)和三乙胺(2.57mmol,0.36ml,3.00当量)的溶液中逐滴加入在二氯甲烷(1ml)中的三氟甲磺酸酐(0.86mmol,0.141ml,1.00当量)的溶液。然后将混合物在0℃下搅拌0.5小时。在此时间后,用乙酸乙酯(50ml)稀释混合物,用盐水(50ml
×
3)洗涤,并用无水硫酸钠干燥,过滤并浓缩。残余物通过制备型tlc(sio2,石油醚/乙酸乙酯10%)纯化,以得到作为无色液体的(5-氰基色满-6-基)三氟甲磺酸酯(80mg,0.26mmol,30%产率)。1h nmr(400mhz,cdcl3)δ=7.21-7.15(m,1h),7.09-7.04(m,1h),4.31-4.20(m,2h),3.00(t,j=6.4hz,2h),2.18-2.02(m,2h)。
[0554]
步骤2:将在dmf(2ml)中的(5-氰基色满-6-基)三氟甲磺酸酯(70mg,0.23mmol,1.00当量)、1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(71.mg,0.34mmol,1.50当量)、pd(dtbpf)cl2(15mg,0.23mmol,0.10当量)、碳酸氢钠(38mg,0.46mmol,2.00当量)的混合物用氮气脱气。然后将混合物在80℃下搅拌1小时,冷却至25℃,用乙酸乙酯(30ml)稀释,并用盐水(30ml
×
3)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过制备型tlc(sio2,石油醚/乙酸乙酯30%)纯化,以得到作为白色固体的6-(2-甲基吡唑-3-基)色满-5-甲腈(40mg,0.17mmol,73%产率)。lcms[m 1]
=240.0;1h nmr(400mhz,cdcl3)=7.57(d,j=1.6hz,1h),7.19-7.14(m,1h),7.12-7.06(m,1h),6.40(d,j=2.0hz,1h),4.30-4.24(m,2h),3.82(s,3h),3.03(t,j=6.4hz,2h),2.17-2.09(m,2h)。
[0555]
步骤3:向在乙腈(1.5ml)中的6-(2-甲基吡唑-3-基)色满-5-甲腈(30mg,0.125mmol,1.00当量)的溶液中加入nbs(34mg,0.19mmol,1.50当量)。将混合物在25℃下搅拌1小时,然后浓缩。残余物通过制备型tlc(sio2,石油醚/乙酸乙酯30%)纯化,以得到作为黄色固体的6-(4-溴-2-甲基-吡唑-3-基)色满-5-甲腈(25mg,0.79mmol,63%产率)。lcms[m 1]
=320.1;1h nmr(400mhz,cdcl3)δ=7.57(s,1h),7.18-7.11(m,2h),4.29(dd,j=4.4,6.0hz,2h),3.79(s,3h),3.05(dt,j=2.0,6.4hz,2h),2.15(dq,j=4.4,6.4hz,2h)。
[0556]
表i-x中所示的中间体i-2至i-4是按照一般反应方案的教导和制备中间体i-1的方法制备的。
[0557]
[0558][0559]
中间体df
[0560][0561]
将在dmf(2ml)中的5-溴-3-碘-吡咯并[2,3-b]吡啶-1-羧酸叔丁酯(120mg,0.28mmol,1当量)、(2-氰基苯基)硼酸(83mg,0.57mmol,2当量)、pd(dppf)cl2(21mg,0.03mmol,0.1当量)、nahco3(71mg,0.85mmol)的混合物用氮气脱气,然后在80℃下搅拌3小时。在此时间后,用乙酸乙酯(20ml)稀释混合物,并用水(20ml
×
3)洗涤。浓缩有机相,并且残余物通过制备型tlc(sio2,石油醚/乙酸乙酯15%)纯化,以得到作为白色固体的中间体e-1,5-溴-3-(2-氰基苯基)吡咯并[2,3-b]吡啶-1-羧酸叔丁酯(50mg,0.13mmol,44%产率)。lcms[m-55]
=342.1;1h nmr(400mhz,cdcl3)δ=8.62(d,j=2.0hz,1h),8.06(d,j=2.4hz,1h),8.03(s,1h),7.84(dd,j=1.2,8.0hz,1h),7.76-7.70(m,1h),7.63(d,j=7.2hz,1h),7.52(dt,j=1.2,7.6hz,1h),1.70(s,9h)。
[0562]
中间体dg
[0563][0564]
步骤1:将在二噁烷(1.0ml)和水(0.2ml)中的6-溴-7-甲氧基-喹啉(100mg,0.420mmol,1.00当量)、1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(105mg,0.504mmol,1.20当量)、pd(dtbpf)cl2(27mg,0.042mmol,0.10当量)和碳酸钠(89mg,0.840mmol,2.00当量)的混合物用氮气脱气。然后将混合物在80℃下搅拌2小时,在
减压下浓缩,并且残余物通过制备型tlc(sio2,乙酸乙酯)纯化,以得到作为黄色固体的7-甲氧基-6-(2-甲基吡唑-3-基)喹啉(80mg,0.334mmol,80%产率)。lcms[m 1]
=240.2;1h nmr(400mhz,cdcl3)δ=8.82(dd,j=1.6,4.4hz,1h),8.04(d,j=8.0hz,1h),7.65(s,1h),7.51(d,j=1.6hz,1h),7.48(s,1h),7.27(dd,j=4.4,8.0hz,1h),6.28(d,j=1.6hz,1h),3.91(s,3h),3.70(s,3h)。
[0565]
步骤2:将7-甲氧基-6-(2-甲基吡唑-3-基)喹啉(500mg,2.09mmol,1.00当量)和吡啶盐酸盐(2.41g,20.9mmol,10.0当量)的混合物在160℃下搅拌0.5小时。在此时间后,残余物通过反向制备型hplc(0.1%甲酸)纯化,以得到作为黄色固体的6-(2-甲基吡唑-3-基)喹啉-7-醇(260mg,1.07mmol,51%产率,92%纯度)。lcms[m 1]
=226.1。
[0566]
步骤3:在0℃下,向在二氯甲烷(5ml)中的6-(2-甲基吡唑-3-基)喹啉-7-醇(260mg,1.15mmol,1.00当量)和三乙胺(0.32ml,2.31mmol,2.00当量)的溶液中以逐滴方式加入三氟甲磺酸酐(0.29ml,1.73mmol,1.50当量)。将混合物在20℃下搅拌1小时,用水(12ml)淬灭,并用二氯甲烷(15ml
×
3)提取。合并的有机提取物用盐水(12ml)洗涤,用无水硫酸钠干燥,过滤并浓缩,并且将残余物通过柱色谱法(sio2,石油醚/乙酸乙酯10-100%)纯化,以得到作为黄色油状物的[6-(2-甲基吡唑-3-基)-7-喹啉基]三氟甲磺酸酯(0.97g,0.706mmol,61%)。lcms[m 1]
=358.1。
[0567]
步骤4:将在dmf(10ml)中的[6-(2-甲基吡唑-3-基)-7-喹啉基]三氟甲磺酸酯(970mg,0.668mmol,1.00当量)、氰化锌(157mg,1.34mmol,2.00当量)、pd2(dba)3(61mg,0.67mmol,0.1当量)、dppf(74mg,0.134mmol,0.20当量)和锌粉(4.3mg,0.67mmol,0.10当量)的混合物用氮气脱气,然后在100℃下搅拌2小时。在此时间后,用水(20ml)稀释反应混合物,并用乙酸乙酯(20ml
×
3)提取。合并的有机相用盐水(20ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过hplc(0.1%甲酸条件)纯化,以得到作为棕色固体的6-(2-甲基吡唑-3-基)喹啉-7-甲腈(100mg,0.249mmol,37%产率)。lcms[m 1]
=235.2。
[0568]
步骤5:向在乙腈(5ml)中的6-(2-甲基吡唑-3-基)喹啉-7-甲腈(90mg,0.384mmol,1.00当量)的溶液中加入n-溴代琥珀酰亚胺(103mg,0.576mmol,1.50当量)。将混合物在20℃下搅拌0.5小时,然后在减压下浓缩,并将残余物通过制备型tlc(二氯甲烷/甲醇10%)纯化,以得到作为黄色固体的6-(4-溴-2-甲基-吡唑-3-基)喹啉-7-甲腈(50mg,0.160mmol,41%产率)。lcms[m 1]
=315.1;1h nmr(400mhz,cdcl3)δ=9.14(dd,j=1.6,4.4hz,1h),8.68(s,1h),8.31(d,j=8.4hz,1h),7.96(s,1h),7.69-7.65(m,1h),7.65(s,1h),3.86(s,3h)。
[0569]
中间体dh
[0570]
[0571]
步骤1:将在dmf(2ml)中的6-溴-7-甲氧基-喹啉(100mg,0.420mmol,1.00当量)、氰化锌(98mg,0.840mmol,2.00当量)、pd2(dba)3(38mg,0.042mmol,0.10当量)、dppf(47mg,0.084mmol,0.20当量)和锌粉(2.8mg,0.042mmol,0.10当量)的混合物脱气,并用氮气吹扫。然后将混合物在100℃下搅拌2小时,然后用水(2ml)稀释,并用乙酸乙酯(2ml
×
3)提取。合并的有机提取物用盐水(2ml)洗涤,用无水硫酸钠干燥,过滤并浓缩。残余物通过hplc(0.1%甲酸)纯化,以得到作为白色固体的7-甲氧基喹啉-6-甲腈(56mg,0.304mmol,72%产率)。lcms[m 1]
=185.2;1h nmr(400mhz,cdcl3)δ=8.97(dd,j=1.6,4.0hz,1h),8.17(s,1h),8.15(dd,j=1.2,8.4hz,1h),7.53(s,1h),7.40(dd,j=4.0,8.4hz,1h),4.09(s,3h)。
[0572]
步骤2:向在甲苯(20ml)中的7-甲氧基喹啉-6-甲腈(1.40g,7.60mmol,1.00当量)的溶液中加入三氯化铝(3.04g,22.8mmol,1.25ml,3.00当量)。将混合物在100℃下搅拌1小时,然后用水(3ml)稀释反应混合物,并用氢氧化钠(2n,0.1ml)将ph调节至4-5。过滤形成的固体并在减压下干燥,以得到作为黑色固体的7-羟基喹啉-6-甲腈(1.20g,粗品),其被直接用于下一步骤而无需进一步纯化。lcms[m 1]
=171.1。
[0573]
步骤3:在0℃下,向在二氯甲烷(10ml)中的7-羟基喹啉-6-甲腈(500mg,2.94mmol,1当量)和三乙胺(0.82ml,5.88mmol,2.00当量)的溶液中以逐滴方式加入三氟甲磺酸酐(0.73ml,4.41mmol,1.50当量)。将混合物在20℃下搅拌1小时,并且在此时间后用水(20ml)淬灭反应混合物,并用二氯甲烷(50ml
×
3)提取。合并的有机提取物用盐水(20ml)洗涤,用无水硫酸钠干燥,过滤并浓缩。残余物通过柱色谱法(sio2,石油醚/乙酸乙酯10-50%)纯化,以得到作为黄色油状物的(6-氰基-7-喹啉基)三氟甲磺酸酯(250mg,0.570mmol,19%产率)。lcms[m 1]
=303.0;1h nmr(400mhz,cdcl3)δ=9.15(dd,j=1.6,4.0hz,1h),8.37(s,1h),8.32-8.30(d,j=8.4hz 1h),8.23(s,1h),7.65(dd,j=4.0,8.4hz,1h)。
[0574]
步骤4:将在二噁烷(10ml)和水(2ml)中的(6-氰基-7-喹啉基)三氟甲磺酸酯(237mg,0.541mmol,1.00当量)、1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(135mg,0.649mmol,1.20当量)、碳酸氢钠(91mg,1.08mmol,2.00当量)和pd(dtbpf)cl2(35mg,0.054mmol,0.10当量)的混合物用氮气脱气,并在80℃下搅拌1小时。在此时间后,浓缩混合物,并且残余物通过柱色谱法(sio2,石油醚/乙酸乙酯10-100%)纯化,以得到作为黄色固体的7-(2-甲基吡唑-3-基)喹啉-6-甲腈(120mg,0.498mmol,92%产率)。lcms[m 1]
=235.2。
[0575]
步骤5:将在乙腈(4ml)中的7-(2-甲基吡唑-3-基)喹啉-6-甲腈(120mg,0.512mmol,1.00当量)和n-溴代琥珀酰亚胺(164mg,0.922mmol,1.80当量)的混合物用氮气脱气,并在20℃下搅拌2小时。在此时间后,将混合物浓缩,并且将残余物通过制备型tlc(sio2,二氯甲烷/甲醇10%)纯化,以得到作为黄色固体的7-(4-溴-2-甲基-吡唑-3-基)喹啉-6-甲腈(121mg,0.385mmol,75%产率)。lcms[m 1]
=314.9;1h nmr(400mhz,cdcl3)δ=9.15(dd,j=2.0,4.4hz,1h),8.43(s,1h),8.33(dd,j=0.8,8.4hz,1h),8.23(s,1h),7.68-7.63(m,2h),3.87(s,3h)。
[0576]
中间体di
[0577][0578]
向在0℃的dmf(5ml)中的n-(4-溴-2-甲基-吡唑-3-基)苯甲酰胺(500mg,1.78mmol,1.00当量)的溶液中加入氢化钠(143mg,3.57mmol,60.0%纯度,2.00当量)并将混合物在0℃下搅拌30分钟。在此时间后,加入在dmf(1ml)中的碘甲烷(0.133ml,2.14mmol,1.20当量),并将混合物在0℃下搅拌另外的10分钟。然后用水(50ml)稀释反应混合物,并用乙酸乙酯(40ml
×
3)提取,并且将合并的有机提取物用盐水(70ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过柱色谱法(sio2,石油醚/乙酸乙酯0-30%)纯化,以得到作为白色固体的n-(4-溴-2-甲基-吡唑-3-基)-n-甲基-苯甲酰胺(400mg,1.36mmol,76%产率)。1h nmr(400mhz,dmso-d6)δ=7.44(s,1h),7.36-7.41(m,1h),7.26-7.33(m,4h),3.72(s,3h),3.23(s,3h)。
[0579]
中间体dj
[0580][0581]
步骤1:向在0℃的甲醇-d4(30ml)中的7-溴-4-氧代-3h-酞嗪-1-羧酸甲酯(1.00g,3.53mmol,1.00当量)、硼氢化钠(347mg,9.18mmol,2.60当量)的搅拌溶液中加入氯化钙(470mg,4.24mmol,1.20当量)。然后将混合物在0℃下搅拌3小时,然后在20℃下搅拌1小时。在此时间后,浓缩反应混合物。用水(30ml)稀释残余物,用盐酸(1n,5ml)将ph调节至5,并过滤混合物,并且用水(5ml
×
3)洗涤滤饼,然后用乙醇(20ml)研磨,以得到作为白色固体的6-溴-4-((羟基-d)甲基-d2)酞嗪-1(2h)-酮(463mg,1.61mmol,46%产率)。lcms[m 1]
=259.0;1h nmr(400mhz,dmso-d6)δ=12.66(s,1h),8.31(d,j=2.0hz,1h),8.17(d,j=8.4hz,1h),8.02(dd,j=2.0,8.4hz,1h),5.53(s,1h)。
[0582]
步骤2:将6-溴-4-((羟基-d)甲基-d2)酞嗪-1(2h)-酮(463mg,1.61mmol,1.00当量)和亚硫酰氯(10ml)的混合物在30℃下搅拌12小时。在此时间后,浓缩混合物,并将残余物溶解在二氯甲烷中,并且浓缩3次(2ml
×
3),以得到作为黄色固体的6-溴-4-(氯甲基-d2)酞嗪-1(2h)-酮(450mg,1.43mmol,88%产率)。lcms[m 1]
=277.0。
[0583]
步骤3:向在dmf(3ml)中的6-溴-4-(氯甲基-d2)酞嗪-1(2h)-酮(450mg,1.63mmol,
1.00当量)的溶液中加入(1,3-二氧代异二氢吲哚-2-基)钾(454mg,2.45mmol,1.50当量)并将混合物在90℃下搅拌2小时。在此时间后,过滤冷却的反应混合物,并将收集的固体用乙醇(5ml)研磨,过滤并干燥,以得到作为白色固体的2-((7-溴-4-氧代-3,4-二氢酞嗪-1-基)甲基-d2)异吲哚啉-1,3-二酮(300mg,粗品)。lcms[m 1]
=386.0;1h nmr(400mhz,dmso-d6)δ=12.60(s,1h),8.43(d,j=1.6hz,1h),8.17(d,j=8.4hz,1h),8.09-8.05(m,1h),7.97-7.92(m,2h),7.92-7.87(m,2h)。
[0584]
步骤4:将在二噁烷(10ml)中的2-((7-溴-4-氧代-3,4-二氢酞嗪-1-基)甲基-d2)异吲哚啉-1,3-二酮(200mg,粗品)、4,4,5,5-四甲基-2-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-1,3,2-二氧硼杂环戊烷(197mg,0.78mmol)、pd(dppf)cl2(38mg,0.052mmol)和乙酸钾(152mg,1.55mmol)的混合物用氮气脱气。将混合物在100℃下搅拌2小时,并且在此时间后浓缩混合物,并将残余物用甲醇(3ml)研磨,过滤并干燥,以得到作为白色固体的2-((4-氧代-7-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-3,4-二氢酞嗪-1-基)甲基-d2)异吲哚啉-1,3-二酮(200mg,0.303mmol,经2步产率为59%)。lcms[m 1]
=352.1;1h nmr(400mhz,dmso-d6)δ=12.70-12.28(m,1h),8.35-8.25(m,2h),8.13(br s,1h),7.93(br d,j=17.0hz,4h),1.34(br s,12h)。
[0585]
中间体dk
[0586][0587]
步骤1:向在水(500ml)中的k2co3(44.7g,323mmol)的溶液中加入1-(5-溴-3-氯-2-甲基苯基)乙-1-酮(40.0g,162mmol)并加热至50℃。然后以10个批次(165g,1.04mol)小心加入kmno4,并将温度保持在低于80℃,以避免不受控的放热。在添加完成后,将混合物在60℃下搅拌6小时。在此时间后,将混合物冷却至0℃,并通过滴加饱和亚硫酸钠溶液(200ml)淬灭,同时将温度保持在低于10℃。然后,将混合物在0℃下搅拌30分钟。在此时间后,用硅藻土过滤透明无色的混合物,并用水(100ml)洗涤滤饼,并且用mtbe(200ml)洗涤水相。然后通过加入3m hcl将水相酸化至ph2,然后用乙酸乙酯(300ml
×
3)提取。合并的有机相用盐水(300ml)洗涤,用无水na2so4干燥,过滤并在真空中浓缩,以得到作为白色固体的化合物4-溴-2-(羧基羰基)-6-氯苯甲酸(20.0g,65.0mmol,36%产率)。lcms[m-1]-=306.8;1h nmr(400mhz,dmso-d6)δ12.7(s,1h),8.10(s,1h),8.00(s,1h)。
[0588]
步骤2:在n2下,向在etoh(200ml)中的化合物4-溴-2-(羧基羰基)-6-氯苯甲酸(20.0g,65.0mmol)的溶液中加入一份nh2nh2·
h2o(4.30g,85.9mmol)。然后将混合物在70℃下搅拌1小时。在此时间后,过滤冷却的反应混合物,洗涤,并将固体在真空中干燥,以得到
作为白色固体的7-溴-5-氯-4-氧代-3,4-二氢酞嗪-1-羧酸(14.0g,46.1mmol,71%产率)。lcms[m 1]
=305.2;1h nmr(400mhz,dmso-d6)δ7.77(d,j=2.0hz,1h),7.59(d,j=2.0hz,1h)。
[0589]
步骤3:在氮气下,向在meoh(250ml)中的7-溴-5-氯-4-氧代-3,4-二氢酞嗪-1-羧酸(14.0g,46.1mmol)的混合物中加入一份浓h2so4(9.23g,92.2mmol)。然后将混合物加热至70℃持续16小时,然后允许冷却至环境温度,过滤并干燥,以得到作为白色固体的7-溴-5-氯-4-氧代-3,4-二氢酞嗪-1-羧酸甲酯(7.50g,23.6mmol,51%产率)。1h nmr(400mhz,dmso-d6)δ13.2(s,1h),6.68(d,j=1.6hz,1h),8.18(d,j=1.6hz,1h)。
[0590]
步骤4:在0℃下,向在etoh(70ml)中的7-溴-5-氯-4-氧代-3,4-二氢酞嗪-1-羧酸甲酯(7.50g,23.6mmol)的溶液中加入nabh4(2.32g,61.4mmol),然后在0℃经2小时小心地缓慢加入cacl2(3.15g,28.3mmol)。然后允许混合物加热至15℃,并搅拌另外的2小时。在此时间后,反应被倒在饱和nh4cl(100ml)上,并且将固体过滤,用水(10ml)洗涤,然后用etoh(10ml)洗涤并干燥,以得到作为白色固体的6-溴-8-氯-4-(羟甲基)酞嗪-1(2h)-酮(4.00g,13.8mmol,54%产率)。lcms[m 1]
=291.0;1h nmr(400mhz,dmso-d6)δ12.6(s,1h),8.24(d,j=1.6hz,1h),8.14(d,j=1.6hz,1h),5.61-5.58(t,j=2hz,1h),4.65-4..63(d,j=8hz,2h)。
[0591]
步骤5:将6-溴-8-氯-4-(羟甲基)酞嗪-1(2h)-酮(4.00g,13.8mmol)和socl2(36.4g,306mmol)的混合物在65℃下搅拌1小时。在此时间后,将混合物浓缩,并将粗残余物用mtbe(30ml)在25℃下研磨30分钟。然后过滤并干燥固体,以得到作为作为淡黄色固体的6-溴-8-氯-4-(氯甲基)酞嗪-1(2h)-酮(3.50g,11.4mmol,82%产率)。lcms[m 1]
=309.1;1h nmr(400mhz,dmso-d6)δ12.9(s,1h),8.24(s,1h),8.19(s,1h),5.06(s,1h)。
[0592]
步骤6:在0℃下,向在dmf(5ml)中的邻苯二甲酰亚胺钾(2.53g,13.6mmol)的混合物中加入在dmf(35ml)中的6-溴-8-氯-4-(氯甲基)酞嗪-1(2h)-酮(3.50g,11.3mmol)的溶液,并将混合物在0℃下搅拌2小时。在此时间后,将混合物倒在冰水(200ml)上,搅拌30分钟,过滤,然后干燥固体,然后用meoh(30ml)在15℃下研磨30分钟。过滤并干燥固体,以得到作为淡黄色固体的2-((7-溴-5-氯-4-氧代-3,4-二氢酞嗪-1-基)甲基)异吲哚啉-1,3-二酮(1.30g,3.10mmol,27%产率)。lcms[m 1]
=420.0;1h nmr(400mhz,dmso-d6)δ12.5(s,1h),8.36(s,1h),8.19(s,1h),7.97-7.94(m,2h),7.92-7.89(m,2h),5.14(s,2h)。
[0593]
步骤7:将在二噁烷(20ml)中的2-((7-溴-5-氯-4-氧代-3,4-二氢酞嗪-1-基)甲基)异吲哚啉-1,3-二酮(1.30g,3.10mmol)、双(频哪醇基)二硼(1.20g,4.66mmol)和乙酸钾(762mg,7.76mmol)的混合物用氮气脱气。然后加入pd(dppf)cl2(114mg,0.16mmol),并将混合物在70℃下搅拌2.5小时。在此时间后,将混合物冷却至室温,过滤,并将浓缩的残余物用meoh(30.0ml)在15℃下研磨30分钟。然后过滤固体,用mtb洗涤并干燥,以得到作为淡黄色固体的2-((5-氯-4-氧代-7-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-3,4-二氢酞嗪-1-基)甲基)异吲哚啉-1,3-二酮(910mg,1.95mmol,63%产率)。lcms[m 1]
=383.9;1h nmr(400mhz,dmso-d6)δ12.5(s,1h),8.20(s,1h),7.79(s,1h),7.96-7.94(m,2h),7.91-7.89(m,2h),5.17(s,2h),1.35(s,12h)。
[0594]
中间体dl
[0595][0596]
按照用于合成中间体dk的相同程序,在7个步骤中从1-(5-溴-3-氟-2-甲基苯基)乙-1-酮作为白色固体(200mg,0.42mmol,2.1%产率)制备2-((5-氟-4-氧代-7-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-3,4-二氢酞嗪-1-基)甲基)异吲哚啉-1,3-二酮,中间体dl。lcms[m 1]=368.1;1h nmr(400mhz,dmso-d6)δ=12..51(s,1h),8.09(s,1h),7.96
–
7.89(m,4h),7.40(d,1h),5.17(s,2h),1.36(s,12h)。
[0597]
中间体dm
[0598][0599]
步骤1:在20℃下,向在dmf(1.20l)的5-溴-2-甲基-3-新戊酰胺苯甲酸(120g,382mmol)的溶液中加入diea(98.7g,764mmol,133ml)、hatu(189g,497mmol),然后加入n,o-二甲基羟胺(55.9g,573mmol,hcl)。将所得的溶液在20℃下搅拌2小时,并且在此时间后,将反应混合物倒入冰水(5.0l)中。混合物用乙酸乙酯(2.0l
×
3)提取,并将合并的有机相用盐水(1.0l)洗涤,用无水na2so4干燥,过滤,并将滤液在减压下浓缩至干燥,以得到作为棕色油状物的5-溴-n-甲氧基-n,2-二甲基-3-新戊酰胺苯甲酰胺(135g,378mmol,99%产率)。1h nmr:400mhz,dmso-d6δ9.06(s,1h),7.45(d,j=2.0hz,1h),7.35(d,j=2.0hz,1h),3.43(s,3h),3.27(s,3h),2.01(s,3h),1.23(s,9h)。
[0600]
步骤2:在0℃下,向在thf(1.5l)中的5-溴-n-甲氧基-n,2-二甲基-3-新戊酰胺苯甲酰胺(135g,378mmol)的溶液中加入me mgbr(3.0m,315ml)。允许所得的溶液加热至20℃并搅拌12小时。在此时间后,加入再一份me mgbr(3m,63.0ml),并将混合物搅拌另外的4小
(384mg,524mmol)的溶液。将反应在100℃下搅拌10小时。将三个批次合并,并通过硅藻土过滤。浓缩滤液,并通过制备型hplc(phenomenex luna c18 250x 150mm x 15μm;流动相:[水(0.1%tfa)-meoh];b%:30%-60%,20分钟)纯化残余物,以得到作为淡黄色固体的6-溴-4-(羟甲基)-8-甲基酞嗪-1(2h)-酮(1.1g,4.06mmol,26%产率)。lcms[m 1]
=271;1h nmr 400mhz,dmso-d6δ12.44(s,1h),8.10(s,1h),7.82(s,1h),4.63(s,3h),2.81(s,3h)。
[0607]
步骤9:在70℃下,将在socl2(13ml)中的6-溴-4-(羟甲基)-8-甲基酞嗪-1(2h)-酮(1.20g,4.46mmol)的溶液搅拌2小时。在此时间后,将混合物浓缩并将残余物在石油醚中研磨0.5小时,过滤并干燥,以得到作为淡黄色固体的6-溴-4-(氯甲基)-8-甲基酞嗪-1(2h)-酮(1.20g,4.17mmol,94%产率)。lcms[m 1]
=289;1h nmr 400mhz,dmso-d6δ12.70(s,1h),8.08(s,1h),7.88(s,1h),5.03(s,2h),2.81(s,3h)。
[0608]
步骤10:在0℃下在n2下,向在dmf(30ml)中的得到的6-溴-4-(氯甲基)-8-甲基酞嗪-1(2h)-酮(1.10g,3.83mmol)的混合物中加入一份异吲哚啉-1,3-二酮钾(850mg,4.59mmol)。将混合物在25℃下搅拌1小时,并且在此时间后,将混合物缓慢倒入冰水(100ml)中,并过滤所形成的白色固体,用水洗涤并干燥,以得到作为白色固体的粗产物2-((7-溴-5-甲基-4-氧代-3,4-二氢酞嗪-1-基)甲基)异吲哚啉-1,3-二酮(1.10g,2.32mmol,61%产率)。lcms[m 1]
=400;1h nmr 400mhz,dmso-d6δ12.37(s,1h),8.20(d,j=1.32hz,1h),7.97-7.87(m,5h),5.12(s,2h),2.81(s,3h)。
[0609]
步骤11:在二噁烷中的2-((7-溴-5-甲基-4-氧代-3,4-二氢酞嗪-1-基)甲基)异吲哚啉-1,3-二酮(1.10g,2.76mmol)、pd(dppf)cl2(202mg,276μmol)、koac(542mg,5.52mmol)和双(频哪醇基)二硼(1.05g,4.14mmol)用氮气脱气,然后在80℃下加热10小时。在此时间后,通过硅藻土过滤反应,并用meoh(10ml)洗涤滤饼,并且浓缩滤液。然后将残余物用meoh(10ml)研磨1小时,过滤并用meoh洗涤滤饼并干燥,以得到作为灰色固体的2-((5-甲基-4-氧代-7-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-3,4-二氢酞嗪-1-基)甲基)异吲哚啉-1,3-二酮,中间体dm(510mg,1.15mmol,42%产率)。lcms:硼酸[m 1]
=364;硼酸酯[m 1]
=446)。1h nmr 400mhz,dmso-d6δ12.27(s,1h),8.06(s,1h),7.92-7.82(m,5h),5.11(s,2h),2.80(s,3h),1.31(s,12h)。
[0610]
中间体dn
[0611][0612]
步骤1:向在dmf(10ml)中的5-(氯甲基)-1-甲基-吡唑(584mg,3.50mmol,1.00当量)和2-苯乙腈(819mg,6.99mmol,2.00当量)的溶液中加入碳酸钾(966mg,6.99mmol,2.00当量)。将混合物在120℃下搅拌4小时,然后在减压下浓缩。残余物通过柱色谱法(sio2,石油醚/乙酸乙酯10-50%)纯化,以得到作为棕色油状物的3-(2-甲基吡唑-3-基)-2-苯基-丙腈(300mg,1.42mmol,41%产率)。lcms[m 1]
=212.0;1h nmr(400mhz,cdcl3)δ=7.35-7.22
(m,4h),7.18-7.10(m,2h),6.11(d,j=1.6hz,1h),3.98(t,j=6.8hz,1h),3.41(s,3h),3.26-3.18(m,1h),3.16-3.05(m,1h)。
[0613]
步骤2:向在干燥的乙腈(2.0ml)中的3-(2-甲基吡唑-3-基)-2-苯基-丙腈(160mg,0.76mmol,1.00当量)的混合物中加入几份nbs(121mg,0.68mmol,0.90当量)。将混合物在15℃下搅拌2小时。在此时间后,加入乙酸乙酯(40ml)和水(40ml),并且分离层。水相用乙酸乙酯(30ml
×
2)提取,并且合并的有机提取物用盐水(50ml)洗涤,用无水硫酸钠干燥,过滤,并在真空中浓缩。通过制备型hplc(phenomenex gemini-nx c18 75
×
30mm
×
3μm;流动相:[水(10mm nh4hco3)-acn];b%:30%-60%,8分钟)纯化残余物,以得到作为黄色油状物的3-(4-溴-2-甲基-吡唑-3-基)-2-苯基-丙腈(90.0mg,0.31mmol,41%产率)。lcms[m 1]
=289.8;1h nmr(400mhz,cdcl3)δ=7.37(s,1h),7.35-7.26(m,3h),7.20-7.14(m,2h),4.04(t,j=7.6hz,1h),3.40(s,3h),3.30(dd,j=7.2,14.8hz,1h),3.07(dd,j=8.0,14.8hz,1h)。
[0614]
中间体do
[0615][0616]
步骤1:将正丁基锂(在己烷中的2.5m,959μl,1.50当量)在5分钟内滴加到在保持在0℃的thf(3ml)中的2,2,6,6-四甲基哌啶(2.40mmol,407μl,1.50当量)的溶液中。在30分钟后,将反应混合物冷却至-78℃,并在10分钟内滴加在thf(1.00ml)中的5-氯萘-1-甲腈(300mg,1.60mmol,1.00当量)的溶液。将所得的深色溶液在-78℃下保持2小时。然后在10分钟内滴加在thf(3ml)中的碘(609mg,2.40mmol,1.50当量)的溶液。将反应混合物在-78℃下保持2小时,然后允许加热至20℃持续3小时。用水(1ml)淬灭反应混合物,并将所得的混合物用乙酸乙酯(150ml)稀释。混合物依次用饱和硫代硫酸钠水溶液(3
×
150ml)、1m hcl(2
×
150ml)和盐水(1
×
150ml)洗涤。用无水硫酸钠干燥有机层,过滤并浓缩。残余物通过柱色谱法(sio2,石油醚:乙酸乙酯5%)纯化,以得到作为黄色固体的5-氯-2-碘-1-萘腈(180mg,574μmol,36%产率)。gcms[m h]
=312.9;1h nmr(400mhz,cdcl3)δ=8.55(d,j=8.8hz,1h),8.01-7.97(m,1h),7.73-7.69(m,1h),7.67-7.64(m,1h),7.63-7.58(m,1h)。
[0617]
步骤2:在二噁烷(3ml)和水(0.6ml)中的1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-1h-吡唑(104mg,498μmol,1.30当量)、5-氯-2-碘-1-萘腈(120mg,383μmol,1.00当量)、pd(dtbpf)cl2(25mg,38μmol,0.10当量)和碳酸钠(81mg,766μmol,2.00当量)的混合物用氮气脱气,然后在80℃下搅拌1小时。然后将混合物浓缩,并且残余物通过制备型tlc(sio2,石油醚:乙酸乙酯30%)纯化,以得到作为黄色固体的5-氯-2-(2-甲基吡唑-3-基)萘-1-甲腈(90mg,336μmol,87%产率)。lcms[m 1]
=268.2;1h nmr(400mhz,cdcl3)δ=8.62(d,j=8.8hz,1h),8.30(d,j=8.4hz,1h),7.81-7.77(m,1h),7.73-7.67(m,1h),7.67-7.63(m,2h),6.61(d,j=2.0hz,1h),3.91(s,3h)。
[0618]
步骤3:向在乙腈(3ml)中的5-氯-2-(2-甲基吡唑-3-基)萘-1-甲腈(170mg,635μmol,1.00当量)的溶液中加入nbs(124mg,699μmol,1.10当量)。将混合物在35℃下搅拌2小
7.69(m,1h),7.59(d,j=8.4hz,1h)。
[0624]
中间体dq
[0625][0626]
步骤1:在-78℃下,向在thf(10ml)中的lda(2.00m,0.587ml,1.10当量)的溶液中以滴加方式加入在thf(5ml)中的4-氯-2-萘腈(200mg,1.07mmol,1.00当量)的溶液。然后将混合物在-78℃下搅拌1小时。在此时间后,在-78℃下滴加将在thf(2ml)中的碘(285mg,1.12mmol,1.05当量)的溶液。然后允许混合物加热至室温,并在20℃下搅拌2小时。在此时间后,通过加入饱和氯化铵溶液(15ml)和饱和次硫酸钠溶液(10ml
×
3)淬灭反应混合物。然后用乙酸乙酯(20ml
×
2)提取混合物,并将合并的有机层用无水硫酸钠干燥,过滤,浓缩,并且残余物通过快速色谱法(sio2,石油醚:乙酸乙酯0-5%)纯化,以得到作为白色固体的4-氯-3-碘-2-萘腈(200mg,0.606mmol,30%产率)。1h nmr(400mhz,cdcl3)δ=8.35(d,j=8.4hz,1h),8.13(s,1h),7.93-7.87(m,1h),7.77(ddd,j=1.2,7.2,8.4hz,1h),7.72-7.65(m,1h)。
[0627]
步骤2:在25℃下,向在二噁烷(30ml)和水(6ml)中的4-氯-3-碘-2-萘腈(320mg,1.02mmol,1.00当量)和1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(319mg,1.53mmol,1.50当量)的溶液中加入碳酸钾(283mg,2.04mmol,2.00当量)和pd(dppf)cl2(75mg,0.102mmol,0.10当量)。混合物用氮气脱气,然后在100℃下搅拌16小时。然后用水(20ml)淬灭反应混合物,并用乙酸乙酯(30ml
×
4)提取。合并的有机层用盐水(25ml
×
2)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且残余物通过快速色谱法(sio2,石油醚:乙酸乙酯0-5%)纯化,以得到作为黄色固体的4-氯-3-(1-甲基-1h-吡唑-5-基)-2-萘腈(50mg,0.178mmol,30%产率)。lcms[m 1]
=268.0/270.0;1h nmr(400mhz,cdcl3)δ=8.48-8.39(m,1h),8.34-8.27(m,1h),8.04-7.95(m,1h),7.90-7.81(m,1h),7.78(br t,j=7.6hz,1h),7.70-7.63(m,1h),6.52-6.43(m,1h),3.80-3.72(m,3h)。
[0628]
步骤3:在25℃下,向在乙腈(10ml)中的4-氯-3-(1-甲基-1h-吡唑-5-基)-2-萘腈(100mg,0.374mmol,1.00当量)的溶液中加入n-碘代琥珀酰亚胺(504mg,2.24mmol,6.00当量),并将混合物在80℃下搅拌16小时。在此时间后,将反应混合物在0℃下用水(2ml)淬灭,然后用乙酸乙酯(3ml
×
3)提取。合并的有机层用盐水(5ml
×
2)洗涤,用无水硫酸钠干燥,过滤并浓缩。通过制备型tlc(sio2,石油醚:乙酸乙酯30%)纯化形成的残余物,以得到作为白色固体的4-氯-3-(4-碘-1-甲基-1h-吡唑-5-基)-2-萘腈(50mg,0.121mmol,32%产率)。lcms[m 1]
=393.9/395.9;1h nmr(400mhz,cdcl3)δ=8.46(d,j=8.4hz,1h),8.35(s,1h),8.04(d,j=8.0hz,1h),7.92-7.86(m,1h),7.84-7.79(m,1h),7.71(s,1h),3.81(s,3h)。
[0629]
中间体dr
[0630][0631]
步骤1:将在二氯乙烷(50ml)中的4-氯-2,5-二氟苄腈(2.00g,11.5mmol,1.00当量)、n-溴代琥珀酰亚胺(4.10g,23.1mmol,2.00当量)、乙酸钯(259mg,1.15mmol,0.10当量)和对甲苯磺酸(992mg,5.76mmol,0.50当量)的混合物用氮气脱气,然后在75℃下搅拌12小时。在此时间后,将冷却的混合物用二氯甲烷(50ml
×
3)提取,用盐水(50ml)洗涤,用无水硫酸钠干燥,过滤,在减压下浓缩,并且将残余物用柱色谱法(sio2,石油醚:乙酸乙酯0-3%)纯化,以得到作为白色固体的2-溴-4-氯-3,6-二氟-苄腈(1.10g,4.36mmol,38%产率)。1h nmr(400mhz,cdcl3)δ=7.38-7.31(m,1h)。
[0632]
步骤2:将在dmf(10ml)中的2-溴-4-氯-3,6-二氟-苄腈(1.10g,4.36mmol,1.00当量)、环丙醇(380mg,6.54mmol,1.50当量)和碳酸钾(1.51g,10.9mmol,2.50当量)的混合物用氮气脱气,然后在75℃下搅拌2小时。在此时间后,将混合物浓缩,并且残余物通过制备型tlc(sio2,石油醚:乙酸乙酯7%)纯化,以得到作为白色固体的2-溴-4-氯-6-(环丙氧基)-3-氟-苄腈(600mg,2.07mmol,47%产率)。1h nmr(400mhz,cdcl3)δ=7.36(d,j=5.6hz,1h),3.88-3.79(m,1h),0.91(d,j=4.8hz,4h)。
[0633]
步骤3:将在二噁烷(20ml)和水(4ml)中的1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(1.29g,6.20mmol,3.00当量)、2-溴-4-氯-6-(环丙氧基)-3-氟-苄腈(600mg,2.07mmol,1.00当量)、碳酸氢钠水溶液(694mg,8.26mmol,0.321ml,4.00当量)、二叔丁基(环戊基)膦;二氯钯-铁(135mg,0.207mmol,0.10当量)的混合物用氮气脱气,并将混合物在80℃下搅拌16小时。在此时间后,将混合物浓缩,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯5-20%)纯化,以得到作为黄色固体的4-氯-6-(环丙氧基)-3-氟-2-(2-甲基吡唑-3-基)苄腈(180mg,0.524mmol,25%产率)。lcms[m 1]
=292.1;1h nmr(400mhz,cdcl3)δ=7.62(d,j=2.0hz,1h),7.49(d,j=6.0hz,1h),6.50(d,j=2.0hz,1h),3.92-3.85(m,1h),3.81(d,j=1.2hz,3h),0.96-0.92(m,4h)。
[0634]
步骤4:将在乙腈(10ml)中的4-氯-6-(环丙氧基)-3-氟-2-(2-甲基吡唑-3-基)苄腈(180mg,0.617mmol,1.00当量)和n-溴代琥珀酰亚胺(220mg,1.23mmol,2.00当量)的混合物在40℃下在氮气氛下搅拌2小时。在此时间后,将混合物浓缩,并且残余物通过制备型tlc(sio2,石油醚:乙酸乙酯20%)纯化,以得到作为白色固体的2-(4-溴-2-甲基-吡唑-3-基)-4-氯-6-(环丙氧基)-3-氟-苄腈(170mg,0.455mmol,74%产率)。lcms[m 1]
=371.8;1h nmr(400mhz,cdcl3)δ=7.61(s,1h),7.55(d,j=6.0hz,1h),3.93-3.85(m,1h),3.80(s,4h),
0.97-0.94(m,4h)。
[0635]
中间体ds
[0636][0637]
将在二噁烷(3ml)中的2-(4-溴-2-甲基-吡唑-3-基)萘-1-甲腈(150mg,0.48mmol,1.00当量)、4,4,5,5-四甲基-2-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-1,3,2-二氧硼杂环戊烷(134mg,0.528mmol,1.10当量)、乙酸钾(141mg,1.44mmol,3.00当量)和二叔丁基(环戊基)膦;二氯钯-铁(31.3mg,0.048mmol,0.10当量)的混合物用氮气脱气,然后在80℃下搅拌2小时。在此时间后,反应混合物在减压下浓缩,以得到作为棕色液体的2-[2-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑-3-基]萘-1-甲腈(160mg,粗品),其被用于下一步骤而无需进一步纯化。lcms[m 1]
=360.2。
[0638]
中间体dt
[0639][0640]
步骤1:在0℃下,向在甲醇(10ml)中的4-溴-2-甲基-吡唑-3-甲醛(1.00g,5.29mmol,1.00当量)和硝基甲烷(420mg,6.88mmol,0.37ml,1.30当量)以滴加方式加入在水(1ml)中的氢氧化钠(466mg,11.6mmol,2.20当量)的溶液。然后将反应混合物在0℃下搅拌0.5小时。在此时间后,通过加入hcl(1.00m,5ml)淬灭反应混合物,过滤,并且将滤液在减压下浓缩,以得到作为黄色固体的4-溴-1-甲基-5-[(e)-2-硝基乙烯基]吡唑(627mg,粗品),其被用于下一步骤而无需进一步纯化。1h nmr(400mhz,cdcl3)δ=8.10(d,j=13.6hz,1h),7.93(d,j=13.6hz,1h),7.57(s,1h),4.03(s,3h)。
[0641]
步骤2:将在二氯乙烷(30ml)中的2-吡啶-1-鎓-1-基乙腈氯化物(627mg)和ms(1.00g,0.215mmol)的悬浮液冷却至0℃,然后加入2,6-二甲基吡啶(1.45g,13.5mmol,1.57ml,5.00当量)。在搅拌15分钟后,加入4-溴-1-甲基-5-[(e)-2-硝基乙烯基]吡唑(627mg,2.70mmol,1.00当量),然后加入乙酸铜(736mg,4.05mmol,1.50当量)。然后将该混合物在0℃下搅拌15分钟,然后加热至25℃并在25℃下搅拌5小时。在此时间后,用水(300ml)稀释反应混合物,并用etoac(100ml
×
3)提取。将合并的有机层用无水硫酸钠干燥,过滤,浓缩,并将残余物通过柱色谱法(sio2,石油醚:乙酸乙酯10-20%)纯化,以得到作为黄色固体的2-(4-溴-2-甲基-吡唑-3-基)吲哚嗪-3-甲腈(380mg,1.26mmol,47%产率)。
lcms[m 1]
=301.0;1h nmr(400mhz,cdcl3)δ=8.34(d,j=6.0hz,1h),7.62-7.53(m,2h),7.18-7.11(m,1h),6.96(dt,j=1.2,6.8hz,1h),6.62(s,1h),3.91(s,3h)。
[0642]
中间体du
[0643][0644]
步骤1:将在乙酸(5ml)中的6-(4-溴-1-甲基-1h-吡唑-5-基)喹啉-5-甲腈,中间体a-25(120mg,0.38mmol,1.00当量)、n-碘代琥珀酰亚胺(517mg,2.30mmol,6.00当量)的混合物在氮气气氛下在80℃下搅拌48小时。然后浓缩混合物,并且向残余物中加入饱和亚硫酸钠溶液(10ml)。然后用乙酸乙酯(5ml)提取混合物,并用盐水(10ml)洗涤有机相,用无水硫酸钠干燥并浓缩。残余物通过制备型tlc(sio2,石油醚:乙酸乙酯50%)纯化,以得到作为白色固体的6-(4-溴-1-甲基-1h-吡唑-5-基)-3-碘喹啉-5-甲腈(38mg,0.086mmol,22%产率)。lcms[m 1]
=441.1;1h nmr(400mhz,cdcl3)δ=9.26(d,j=2.0hz,1h),9.03(dd,j=0.8,2.0hz,1h),8.43(dd,j=0.8,8.8hz,1h),7.77(d,j=8.8hz,1h),7.67(s,1h),3.87(s,3h)。
[0645]
步骤2:将在甲醇(1ml)中的6-(4-溴-1-甲基-1h-吡唑-5-基)-3-碘喹啉-5-甲腈(35mg,0.080mmol,1.00当量)、甲醇钠(13mg,0.24mmol,3.00当量)、碘化亚铜(1.5mg,0.008mmol,0.10当量)的混合物用氮气脱气,然后在105℃下搅拌16小时。在此时间后,过滤混合物,并浓缩滤液,并且残余物通过制备型tlc(sio2,石油醚:乙酸乙酯50%)纯化,以得到作为白色固体的6-(4-溴-1-甲基-1h-吡唑-5-基)-3-甲氧基喹啉-5-甲腈(12mg,0.035mmol,44%产率)。lcms[m 1]
=345.1;1h nmr(400mhz,cdcl3)δ=8.86(d,j=2.8hz,1h),8.40(d,j=8.4hz,1h),7.76(d,j=2.8hz,1h),7.66(s,1h),7.58(d,j=8.4hz,1h),4.07(s,3h),3.87(s,3h)。
[0646]
中间体dv
[0647][0648]
将在thf(5ml)中的6-(4-溴-2-甲基-吡唑-3-基)-3-氯-2-甲基-苄腈,中间体d-18(400mg,1.29mmol,1.00当量)的混合物加入锂二异丙基胺(2.00m,1.29ml,2.00当量)并在-78℃下搅拌30分钟。然后在-78℃下加入甲基碘(5.15mmol,0.32ml,4.00当量),并将混合物搅拌2小时。然后将反应混合物用氯化铵溶液(10ml)淬灭,并用二氯甲烷(20ml
×
3)提取,并且将合并的有机提取物用盐水(50ml)洗涤,用无水硫酸钠干燥,过滤并浓缩。残余物通过制备型tlc(sio2,石油醚:乙酸乙酯20%)纯化,以得到作为黄色油状物的6-(4-溴-2-甲基-吡唑-3-基)-3-氯-2-乙基-苄腈(280mg,0.86mmol,67%产率)。lcms[m 1]
=326.0;1h nmr(400mhz,cdcl3)δ=7.71(d,j=8.4hz,1h),7.59(s,1h),7.24(d,j=8.4hz,1h),3.80(s,
3h),3.14-3.11(m,2h),1.35-1.32(m,3h)。
[0649]
中间体dw
[0650][0651]
使用中间体d-19代替中间体d-18,使用与用于制备中间体dv相同的方法来制备2-(4-溴-1-甲基-1h-吡唑-5-基)-4-氯-6-乙基苄腈,作为白色固体(30mg,0.074mmol,23%)。lcms[m 1]
=419.2;1h nmr(400mhz,dmso-d6)δ=12.88(s,1h),8.38(br s,3h),8.28(s,1h),8.11(d,j=8.4hz,1h),7.85(d,j=2.0hz,1h),7.82(d,j=2.0hz,1h),7.75(d,j=1.2hz,1h),7.42(dd,j=1.6,8.4hz,1h),4.39-4.22(m,2h),3.75(s,3h),2.83(q,j=7.6hz,2h),1.21(t,j=7.6hz,3h)。
[0652]
中间体dx
[0653][0654]
在20℃下在氮气气氛下,向在甲醇(2ml)中的2-(4-溴-2-甲基-吡唑-3-基)-4-氯-6-乙基-苄腈,中间体dw(270mg,0.83mmol,1.00当量)的混合物中加入一份甲醇钠(449mg,8.32mmol,10.0当量)。将混合物在密封管中在100℃下搅拌2小时,并且形成淡黄色溶液。然后将混合物浓缩,并且将残余物溶解在乙酸乙酯(10ml)和水(5ml)中。分离各层,并且水相用乙酸乙酯(5ml
×
2)提取。合并的有机层用盐水(20ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩,以得到残余物。残余物通过制备型tlc(sio2,石油醚:乙酸乙酯25%)纯化,以得到作为白色固体的2-(4-溴-2-甲基-吡唑-3-基)-6-乙基-4-甲氧基-苄腈(220mg,约70%纯度)。lcms[m 1]
=321.9;1h nmr(400mhz,cdcl3)δ=7.58(s,1h),6.97(d,j=2.4hz,1h),6.77(d,j=2.4hz,1h),3.91(s,3h),3.81(s,3h),2.97-2.92(m,2h),1.37-1.34(t,j=6.8hz 3h)。
[0655]
中间体dy
[0656][0657]
步骤1:将在二噁烷(30ml)和水(6ml)中的2-溴-5-甲氧基-萘-1-醇(2.60g,10.3mmol,1.00当量)、1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(3.21g,15.4mmol,1.50当量)、二叔丁基(环戊基)膦;二氯钯;铁(670mg,1.03mmol,0.10当量)和碳酸钠(2.18g,20.6mmol,2.00当量)的混合物用氮气脱气,然后在100℃下搅拌0.5小时。在此时间后,在减压下浓缩反应混合物,并且残余物通过柱色谱法(sio2,石油醚:乙酸
乙酯10-100%)纯化,以得到作为黄色固体的5-甲氧基-2-(2-甲基吡唑-3-基)萘-1-醇(720mg,2.83mmol,28%产率)。1h nmr(400mhz,dmso-d6)δ=9.57(s,1h),7.86(d,j=8.6hz,1h),7.72(d,j=8.6hz,1h),7.50(d,j=1.6hz,1h),7.48-7.42(m,1h),7.26(d,j=8.6hz,1h),7.03(d,j=7.6hz,1h),6.33(d,j=1.6hz,1h),3.97(s,3h),3.69(s,3h)。
[0658]
步骤2:在-40℃下在氮气下,向在二氯甲烷(20ml)中的5-甲氧基-2-(2-甲基吡唑-3-基)萘-1-醇(650mg,2.56mmol,1.00当量)、分子筛(1.00g)和三乙胺(7.67mmol,1.07ml,3.00当量)的溶液中以逐滴方式加入tf2o(3.83mmol,0.63ml,1.50当量)。将反应混合物在-40℃下搅拌0.5小时,然后在减压下浓缩,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯0-15%)纯化,以得到作为黄色油状物的[5-甲氧基-2-(2-甲基吡唑-3-基)-1-萘基]三氟甲磺酸酯(341mg,0.79mmol,30%产率)。lcms[m 1]
=387.1;1h nmr(400mhz,cdcl3)δ=8.40(dd,j=0.8,8.8hz,1h),7.76(d,j=8.8hz,1h),7.64(d,j=8.0hz,1h),7.61(d,j=2.0hz,1h),7.43(d,j=8.8hz,1h),7.00(d,j=7.6hz,1h),6.45(d,j=2.0hz,1h),4.07(s,3h),3.82(s,3h)。
[0659]
步骤3:将在dmf(10ml)中的[5-甲氧基-2-(2-甲基吡唑-3-基)-1-萘基]三氟甲磺酸酯(290mg,0.67mmol,1.00当量)、氰化锌(0.81mmol,51.1μl,1.20当量)、pd2(dba)3(612mg,0.067mmol,0.10当量)、dppf(74mg,0.134mmol,0.20当量)和锌粉(4.4mg,0.067mmol,0.10当量)的混合物用氮气脱气,然后在120℃下搅拌1小时。然后用水(100ml)稀释反应混合物,并用乙酸乙酯(100ml
×
3)提取。用盐水(200ml)洗涤合并的有机层,用无水硫酸钠干燥,过滤并在减压下浓缩,并且残余物用柱色谱法(sio2,石油醚:乙酸乙酯10-50%)纯化,以得到作为灰白色固体的5-甲氧基-2-(2-甲基吡唑-3-基)萘-1-甲腈(156mg,0.59mmol,88%产率)。lcms[m 1]
=264.1;1h nmr(400mhz,cdcl3)δ=8.59(dd,j=0.8,8.8hz,1h),7.90(d,j=8.4hz,1h),7.68(t,j=8.4hz,1h),7.64(d,j=2.0hz,1h),7.49(d,j=8.4hz,1h),7.01(d,j=7.6hz,1h),6.58(d,j=2.0hz,1h),4.07(s,3h),3.89(s,3h)。
[0660]
步骤4:向在乙腈(2ml)中的5-甲氧基-2-(2-甲基吡唑-3-基)萘-1-甲腈(180mg,0.68mmol,1.00当量)的溶液中加入n-溴代琥珀酰亚胺(146mg,0.82mmol,1.20当量)。将混合物在35℃下搅拌0.5小时,然后在减压下浓缩,并且残余物通过制备型tlc(sio2,石油醚:乙酸乙酯30%)纯化,以得到作为灰白色固体的2-(4-溴-2-甲基-吡唑-3-基)-5-甲氧基-萘-1-甲腈(174mg,0.51mmol,74%产率)。lcms[m 1]
=342.0;1h nmr(400mhz,cdcl3)δ=8.64(dd,j=0.8,8.8hz,1h),7.92(d,j=8.4hz,1h),7.70(t,j=8.4hz,1h),7.64(s,1h),7.47(d,j=8.8hz,1h),7.04(d,j=7.6hz,1h),4.08(s,3h),3.84(s,3h)。
[0661]
中间体dz
[0662][0663]
中间体dz,2-(4-溴-1-甲基-1h-吡唑-5-基)-4-氯-1-萘腈根据制备中间体dx所述的方法从2-溴-4-氯-萘-1-醇开始被制备为黄色固体(25mg,0.072mmol,经4步产率为2%)。lcms[m 1]
=347.8;1h nmr(400mhz,cdcl
3-d)δ=8.48-8.43(m,1h),8.42-8.38(m,1h),
7.91-7.82(m,2h),7.65(d,j=4.4hz,2h),3.88(s,3h)。
[0664]
中间体ea
[0665][0666]
步骤1:将在dmf(1.0ml)中的[4-氯-2-(2-甲基吡唑-3-基)-1-萘基]三氟甲磺酸酯(38mg,0.097mmol,1.00当量)、氰化锌(22mg,190μmol,12.4μl,2.00当量)、dppf(5.4mg,9.7μmol,0.10当量)、锌粉(640μg,9.7μmol,0.10当量)和pd2(dba)3(4.5mg,4.86μmol,0.05当量)的混合物用氮气脱气,然后在100℃下搅拌4小时。然后浓缩混合物,并且残余物通过制备型tlc(sio2,石油醚:乙酸乙酯20%)纯化,以得到作为黄色固体的2-(2-甲基吡唑-3-基)萘-1,4-二甲腈(30mg,93.4μmol,96%产率)。lcms[m 1]
=259.0;1h nmr(400mhz,cdcl3)δ=8.48-8.44(m,1h),8.44-8.39(m,1h),7.96(s,1h),7.96-7.94(m,1h),7.94-7.92(m,1h),7.67(d,j=2.0hz,1h),6.62(d,j=2.0hz,1h),3.92(s,3h)。
[0667]
步骤2:将在乙腈(2.0ml)中的2-(2-甲基吡唑-3-基)萘-1,4-二甲腈(30mg,0.093mmol,1.00当量)、n-溴代琥珀酰亚胺(41mg,0.23mmol,2.00当量)的混合物用脱气氮气,然后在35℃下搅拌2小时。然后浓缩混合物,并且残余物用制备型tlc(sio2,石油醚:乙酸乙酯25%)纯化,以得到作为黄色固体的2-(4-溴-2-甲基-吡唑-3-基)萘-1,4-二甲腈(25mg,0.067mmol,58%产率)。lcms[m 1]
=339.0;1h nmr(400mhz,cdcl
3-d)δ=8.52-8.41(m,2h),8.01-7.96(m,2h),7.95(s,1h),7.68(s,1h),3.88(s,3h)。
[0668]
中间体eb
[0669][0670]
步骤1:在0℃下,将正丁基锂(2.50m,1.87ml,1.00当量)的溶液在30分钟内滴加到在thf(10ml)中的2,2,6,6-四甲基哌啶(660mg,4.67mmol,0.79ml,1.00当量)的溶液中,然后将混合物冷却至-78℃,并在15分钟内加入在thf(3ml)中的4-氟萘-1-甲腈(0.80g,4.67mmol,1.00当量)的溶液。然后将混合物在-78℃下搅拌2小时。在此时间后,在30分钟内加入在thf(3ml)中的碘(1.19g,4.67mmol,1.00当量)的溶液并将反应混合物在-78℃下搅拌2小时,然后允许加热至25℃并搅拌持续另外的12小时。然后用水(50ml)淬灭反应混合物,并用乙酸乙酯(30ml
×
2)提取。用饱和硫代硫酸钠(30ml
×
3)、1m盐酸(30ml
×
3)和盐水(50ml)洗涤合并的有机层,并用无水硫酸钠干燥并过滤。浓缩滤液,并且残余物通过快速硅胶色谱法(乙酸乙酯:石油醚0-5%)纯化,以得到作为白色固体的4-氟-3-碘-萘-1-甲腈(1.00g,3.37mmol,72%产率)。1h nmr(400mhz,cdcl3)δ=8.15(d,j=8.4hz,1h),8.13-8.07(m,2h),7.72(dt,j=1.2,7.7hz,1h),7.68-7.61(m,1h)。
[0671]
步骤2:向在二噁烷(10ml)和水(2ml)中的4-氟-3-碘代-萘-1-甲腈(900mg,
3.03mmol,1.00当量)、1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(1.58g,7.57mmol,2.50当量)和磷酸钾(1.29g,6.06mmol,2.00当量)的溶液中加入二叔丁基(环戊基)膦;二氯钯-铁(197mg,0.30mmol,0.10当量)。在氮气气氛下,将反应在80℃下搅拌18小时。然后将反应混合物在水(20ml)和乙酸乙酯(10ml)之间分配,用乙酸乙酯(10ml
×
2)提取,并且将合并的有机层用无水硫酸镁干燥,过滤并浓缩。然后通过快速硅胶色谱法(0-25%乙酸乙酯:石油醚梯度)纯化残余物,以得到作为白色固体的4-氟-3-(2-甲基吡唑-3-基)萘-1-甲腈(0.80g,2.87mmol,95%产率)。1h nmr(400mhz,cdcl3)δ=8.33-8.25(m,2h),7.91(s,1h),7.88-7.82(m,1h),7.82-7.75(m,1h),7.63(d,j=2.0hz,1h),6.46(d,j=2.0hz,1h),3.89(d,j=1.6hz,3h)。
[0672]
步骤3:向在乙腈(5ml)中的4-氟-3-(2-甲基吡唑-3-基)萘-1-甲腈(200mg,0.80mmol,1.00当量)的溶液中加入1-溴吡咯烷-2,5-二酮(212mg,1.19mmol,1.50当量)并将反应在25℃下搅拌12小时。然后浓缩反应,并且残余物通过快速硅胶色谱法(0-15%乙酸乙酯:石油醚)纯化,以得到作为灰色固体的3-(4-溴-2-甲基-吡唑-3-基)-4-氟-萘-1-甲腈(0.20g,0.61mmol,76%产率)。lcms[m 1]
=332.1/300.1;1h nmr(400mhz,cdcl3)δ=8.32(dd,j=8.4,13.1hz,2h),7.95-7.86(m,2h),7.84-7.76(m,1h),7.64(s,1h),3.85(d,j=1.2hz,3h)。
[0673]
中间体ec
[0674][0675]
步骤1:在20℃下在氮气气氛下,向在二噁烷(15ml)和水(3ml)中的6-溴吡啶甲醛(1.00g,5.38mmol,1.00当量)和1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-1h-吡唑(1.12g,5.38mmol,1.00当量)的溶液中加入碳酸钾(1.49g,10.8mmol,2.00当量)和pd(dppf)cl2(393mg,0.538mmol,0.10当量)。然后将混合物在80℃下搅拌6小时。在此时间后,用水(50ml)稀释反应混合物,并用二氯甲烷(50ml
×
2)提取。合并的有机层用盐水(15ml
×
2)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯25-50%)纯化,以得到作为黄色固体的6-(1-甲基-1h-吡唑-5-基)吡啶甲醛(800mg,4.27mmol,80%产率)。1h nmr(400mhz,cdcl3)δ=10.13(d,j=0.8hz,1h),7.99-7.89(m,2h),7.83(dd,j=1.6,7.2hz,1h),7.55(d,j=2.0hz,1h),6.69(d,j=2.0hz,1h),4.35(s,3h)。
[0676]
步骤2:在20℃下,向在乙腈(12ml)中的6-(1-甲基-1h-吡唑-5-基)吡啶甲醛(800mg,4.27mmol,1.00当量)的溶液中加入n-溴代琥珀酰亚胺(1.14g,6.41mmol,1.50当量),并将混合物搅拌16小时。在此时间后,将混合物浓缩,并且残余物通过制备型tlc(sio2,石油醚:乙酸乙酯25%)纯化,以得到作为白色固体的6-(4-溴-1-甲基-1h-吡唑-5-基)吡啶甲醛(750mg,2.82mmol,66%产率)。1h nmr(400mhz,cdcl3)δ=10.13(s,1h),8.08-7.98(m,3h),7.58(s,1h),4.15(s,3h)。
[0677]
步骤3:在20℃下,向在dmf(3ml)中的6-(4-溴-1-甲基-1h-吡唑-5-基)吡啶甲醛
(250mg,0.94mmol,1.00当量)的溶液中加入2-氨基乙酸(78mg,1.03mmol,1.10当量)、碘(238mg,0.940mmol,0.19ml,1.00当量)、碳酸氢钠(158mg,1.88mmol,2.00当量)。然后将混合物在60℃下搅拌6小时,然后用水(20ml)稀释并用乙酸乙酯(20ml
×
2)提取。合并的有机层用盐水(10ml
×
2)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且残余物通过制备型tlc(sio2,乙酸乙酯)纯化,以得到作为黄色固体的5-(4-溴-1-甲基-1h-吡唑-5-基)咪唑并[1,5-a]吡啶(35mg,0.126mmol,13%产率)。1h nmr(400mhz,cdcl3)δ=7.77(s,1h),7.68(s,1h),7.64-7.59(m,2h),6.87(dd,j=6.4,9.2hz,1h),6.66(d,j=6.4hz,1h),3.79(s,3h)。
[0678]
中间体ed
[0679][0680]
步骤1:向在乙腈(20ml)中的4-溴-5-氯-1h-吡唑(1.00g,5.51mmol,1.00当量)、2-(溴甲基)苄腈(1.08g,5.51mmol,1.00当量)的溶液中加入碳酸钾(914mg,6.61mmol,1.20当量),并将混合物在氮气气氛下在80℃下搅拌10小时。在此时间后,用水(200ml)淬灭反应,然后用乙酸乙酯(150ml
×
3)提取。合并的有机提取物用盐水(200ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且形成的残余物通过柱色谱法(sio2,石油醚:乙酸乙酯=10:1)纯化,以得到作为白色固体的2-((4-溴-3-氯-1h-吡唑-1-基)甲基)苄腈(1.00g,3.37mmol,61%产率)。lcms[m 1]
=297.9;1h nmr(400mhz,dmso-d6)δ=8.27(s,1h),7.89(dd,j=0.8,7.6hz,1h),7.77-7.68(m,1h),7.61-7.49(m,1h),7.37(d,j=7.6hz,1h),5.52(s,2h)。
[0681]
步骤2:在氮气氛下,向在二噁烷(10ml)和水(1ml)中的2-((4-溴-3-氯-1h-吡唑-1-基)甲基)苄腈(400mg,1.35mmol,1.00当量)、1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-1h-吡唑(561mg,2.70mmol,2.00当量)和碳酸氢钠(227mg,2.70mmol,2.00当量)的溶液中加入pd(dppf)cl2(99mg,0.135mmol,0.10当量)。将混合物在110℃下搅拌10小时,然后通过加入水(200ml)淬灭反应,然后用乙酸乙酯(150ml
×
3)提取。合并的有机相用盐水(200ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯30%)纯化,以得到作为白色固体的2-((3'-氯-2-甲基-1'h,2h-[3,4'-双吡唑]-1'-基)甲基)苄腈(200mg,0.672mmol,50%产率)。lcms[m 1]
=298.0;1h nmr(400mhz,
dmso-d6)δ=8.41(s,1h),7.91(d,j=7.6hz,1h),7.79-7.70(m,1h),7.62-7.52(m,1h),7.50-7.42(m,2h),6.42(d,j=2.0hz,1h),5.58(s,2h),3.81(s,3h)。
[0682]
步骤3:向在乙腈(10ml)中的2-((3'-氯-2-甲基-1'h,2h-[3,4'-双吡唑]-1'-基)甲基)苄腈(200mg,0.672mmol,1.00当量)的溶液中加入n-溴代琥珀酰亚胺(132mg,0.739mmol,1.10当量)并将混合物在氮气气氛下在25℃下搅拌10小时。在此时间后,用水(50ml)淬灭反应,并用乙酸乙酯(40ml
×
3)提取。合并的有机相用盐水(50ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯5%)纯化,以得到作为黄色固体的2-((4-溴-3'-氯-2-甲基-1'h,2h-[3,4'-双吡唑]-1'-基)甲基)苄腈(130mg,0.345mmol,51%产率)。lcms[m 1]
=377.9;1h nmr(400mhz,dmso-d6)δ=8.37(s,1h),7.92(d,j=7.6hz,1h),7.83-7.71(m,1h),7.67(s,1h),7.62-7.55(m,1h),7.45(d,j=8.0hz,1h),5.61(s,2h),3.73(s,3h)。
[0683]
步骤4:在氮气气氛下,向在水(0.5ml)和二噁烷(5.0ml)中的((4-氧代-7-(4,4,5-三甲基-1,3,2-二氧硼杂环戊烷-2-基)-3,4-二氢酞嗪-1-基)甲基)氨基甲酸叔丁酯(256mg,0.637mmol,2.00当量)、2-((4-溴-3'-氯-2-甲基-1'h,2h-[3,4'-双吡唑]-1'-基)甲基)苄腈(120mg,0.319mmol,1.00当量)、碳酸氢钠(54mg,0.637mmol,25ml,2.00当量)的溶液中加入pd(dtbpf)cl2(21mg,32μmol,0.10当量),然后将混合物在110℃下搅拌10小时。然后用水(50ml)淬灭反应,用乙酸乙酯(40ml
×
3)提取,将合并的有机相用盐水(50ml)洗涤,用无水硫酸钠干燥,过滤并在真空中浓缩。残余物通过柱色谱法(sio2,石油醚:乙酸乙酯15%)纯化,以得到作为黑褐色油状物的((7-(3'-氯-1'-(2-氰基苄基)-2-甲基-1'h,2h-[3,4'-双吡唑]-4-基)-4-氧代-3,4-二氢酞嗪-1-基)甲基)氨基甲酸叔丁酯(115mg,0.201mmol,63%产率)。lcms[m 1]
=571.1;1h nmr(400mhz,dmso-d6)δ=12.48(s,1h),11.94(s,1h),8.42(s,1h),8.13-8.05(m,2h),7.92(d,j=7.6hz,1h),7.80-7.72(m,1h),7.62-7.55(m,2h),7.47(d,j=8.0hz,1h),7.40-7.31(m,1h),5.64(s,2h),4.36(br d,j=5.6hz,2h),3.74(s,3h),1.38(s,9h)。
[0684]
中间体ee
[0685][0686]
步骤1:向在二氯甲烷(30ml)中的苯基硼酸(1.92g,15.8mmol,2.00当量)和3-氯-4-碘-1h-吡唑(1.80g,7.88mmol,1.00当量)的溶液中加入一份吡啶(1.86g,23.5mmol,1.90ml,2.99当量)和乙酸铜(1.72g,9.46mmol,1.20当量)。将混合物在20℃下搅拌16小时,然后过滤并浓缩,并且将残余物通过快速硅胶色谱法(0-5%乙酸乙酯:石油醚)纯化,以得到作为黄色液体的3-氯-4-碘-1-苯基-吡唑(1.50g,4.93mmol,63%产率)。lcms[m 1]
=305.0;1h nmr(400mhz,cdcl3)δ7.91(s,1h),7.63-7.59(m,2h),7.49-7.43(m,2h),7.36-7.30(m,1h)。
[0687]
步骤2:将在二噁烷(20ml)和水(4ml)中的1-甲基-5-(4,4,5,5-四甲基-1,3,2-二
氧硼杂环戊烷-2-基)吡唑(1.23g,5.91mmol,1.50当量)、3-氯-4-碘-1-苯基-吡唑(1.20g,3.94mmol,1.00当量)、磷酸钾(1.67g,7.88mmol,2.00当量)和二叔丁基(环戊基)膦;二氯钯-铁(256mg,0.39mmol,0.10当量)的混合物脱气,然后在氮气氛下加热至80℃持续16小时。然后浓缩反应混合物,并用水(10ml)稀释残余物,并用乙酸乙酯(10ml
×
3)提取,用硫酸钠干燥,在减压下浓缩,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯10-15%)纯化,以得到作为黄色油状物的3-氯-4-(2-甲基吡唑-3-基)-1-苯基-吡唑,中间体ee-1(0.80g,3.09mmol,79%产率)。lcms[m 1]
=258.9;1h nmr(400mhz,cdcl3)δ7.97(s,1h),7.71-7.67(m,2h),7.55(d,j=2.0hz,1h),7.49(t,j=8.0hz,2h),7.39-7.34(m,1h),6.43(d,j=2.0hz,1h),3.91(s,3h)。
[0688]
步骤3:将在二甲基乙酰胺(6ml)和水(3ml)中的3-氯-4-(2-甲基吡唑-3-基)-1-苯基-吡唑(210mg,0.811mmol,1.00当量)、四钾-六氰基铁(4-)三水合物(1.03g,2.44mmol,3.00当量)和[2-(2-氨基苯基)苯基]-甲基磺酰氧基-钯-二环己基-[3,6-二甲氧基-2-(2,4,6-三异丙基苯基)苯基]膦(73.6mg,0.081mmol,0.10当量)的混合物在氮气氛下加热至100℃持续16小时。然后用水(10ml)稀释反应混合物,并用乙酸乙酯(10ml
×
3)提取。用盐水(15ml)洗涤合并的有机层,用硫酸钠干燥,过滤,在减压下浓缩,并且残余物用柱色谱法(sio2,石油醚:乙酸乙酯10-15%)纯化,以得到作为黄色固体的4-(2-甲基吡唑-3-基)-1-苯基-吡唑-3-甲腈(200mg,0.80mmol,99%产率)。lcms[m 1]
=249.9;1h nmr(400mhz,cdcl3)δ=8.09(s,1h),7.76-7.72(m,2h),7.56(d,j=2.0hz,1h),7.51-7.56(m,2h),7.43-7.48(m,1h),6.59(d,j=2.0hz,1h),3.98(s,3h)。
[0689]
步骤4:向在乙腈(5ml)中的4-(2-甲基吡唑-3-基)-1-苯基-吡唑-3-甲腈(180mg,0.722mmol,1.00当量)的混合物中加入n-溴代琥珀酰亚胺(192mg,1.08mmol,1.50当量)。将混合物在20℃下搅拌16小时。然后用饱和亚硫酸钠(15ml)淬灭反应混合物,用乙酸乙酯(15ml
×
3)提取,用无水硫酸钠干燥,浓缩,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯10-20%)纯化,以得到作为黄色固体的4-(4-溴-2-甲基-吡唑-3-基)-1-苯基-吡唑-3-甲腈(220mg,0.67mmol,93%产率)。lcms[m 1]
=327.9;1h nmr(500mhz,cdcl3)d=8.17(s,1h),7.78-7.74(m,2h),7.59(s,1h),7.58-7.54(m,2h),7.49-7.45(m,1h),3.95(s,3h)。
[0690]
中间体ef
[0691][0692]
在20℃下,向在乙腈(1ml)中的3-氯-4-(2-甲基吡唑-3-基)-1-苯基-吡唑,中间体ee-1(200mg,0.773mmol,1.00当量)的混合物中加入一份1-溴吡咯烷-2,5-二酮(165mg,0.927mmol,1.20当量)。混合物在20℃下搅拌16小时。然后浓缩反应混合物,并且残余物通过快速硅胶色谱法(0-17%乙酸乙酯:石油醚)纯化,以得到作为黄色油状物的4-溴-5-(3-氯-1-苯基-吡唑-4-基)-1-甲基-吡唑(200mg,0.592mmol,77%产率)。1h nmr(500mhz,
cdcl3)δ=8.07-8.04(m,1h),7.72(dd,j=1.2,8.4hz,2h),7.58(s,1h),7.54-7.49(m,2h),7.42-7.35(m,1h),3.88(s,3h)。
[0693]
中间体eg
[0694][0695]
步骤1-6:按照与中间体dk的前6步所述相同的程序,从1-(5-溴-2-甲基-3-(三氟甲基)苯基)乙烷-1-酮开始,将2-((7-溴-4-氧代-5-(三氟甲基)-3,4-二氢酞嗪-1-基)甲基)异吲哚啉-1,3-二酮作为白色固体制备(0.50g,1.11mmol,经6步产率为6%)。lcms[m 1]
=454.0;1h nmr(400mhz,dmso-d6)δ=12.75(s,1h),8.74(d,j=1.6hz,1h),8.41(s,1h),7.97-7.92(m,2h),7.91-7.86(m,2h),5.22(s,2h)。
[0696]
步骤7:将在二噁烷(2ml)中的2-((7-溴-4-氧代-5-(三氟甲基)-3,4-二氢酞嗪-1-基)甲基)异吲哚啉-1,3-二酮(50mg,0.111mmol,1.00当量)、双(频哪醇基)二硼(34mg,0.133mmol,1.20当量)、pd(dppf)cl2(8mg,0.011mmol,0.10当量)和乙酸钾(22mg,0.221mmol,2.00当量)的混合物用氮气脱气,并在100℃下搅拌1小时。然后在减压下浓缩反应混合物,以得到作为棕色固体的[4-[(1,3-二氧杂异二氢吲哚-2-基)甲基]-1-氧代-8-(三氟甲基)-2h-酞嗪-6-基]硼酸(46.0mg,粗品)。lcms[m-81]
=418.1。
[0697]
中间体eh
[0698][0699]
使用与用于制备中间体dy相同的4步程序,但以7-溴色原烷-8-醇开始,将7-(4-溴-1-甲基-1h-吡唑-5-基)色满-8-甲腈,中间体eh作为白色固体制备(21mg,0.049mmol,84%产率)。lcms[m 1]
=413.2;1h nmr(400mhz,dmso-d6)δ=12.40(br s,1h),8.17(s,1h),8.12(d,j=8.4hz,1h),7.70(dd,j=1.6,8.0hz,1h),7.60(d,j=8.0hz,1h),7.58(d,j=1.6hz,1h),7.14(d,j=7.6hz,1h),4.35(br t,j=4.8hz,2h),3.72(s,3h),3.68(d,j=2.0hz,2h),2.89(br t,j=6.0hz,2h),2.05-2.00(m,2h)。
[0700]
中间体ei
[0701]
[0702]
按照与用于制备中间体dc所述的相同程序,从2-溴-6-氟-1-萘甲醛开始,将2-(4-溴-1-甲基-1h-吡唑-5-基)-6-氟-1-萘腈,中间体ei作为白色固体制备(60mg,0.182mmol,经2步产率为31%)。lcms[m 1]
=329.8/331.8;1h nmr(400mhz,ccdcl
3-d)δ=8.39(dd,j=5.2,9.2hz,1h),8.15(d,j=8.6hz,1h),7.68-7.63(m,2h),7.62-7.56(m,1h),7.54(d,j=8.6hz,1h),3.86(s,3h)。
[0703]
中间体ej
[0704][0705]
按照与用于制备中间体dc所述的相同程序,从3-溴-1-氯-2-萘甲醛开始,将3-(4-溴-1-甲基-1h-吡唑-5-基)-1-氯-2-萘腈,中间体ej作为淡黄色固体制备(35mg,0.101mmol,经2步产率为18%)。1h nmr(400mhz,ccdcl
3-d)δ=10.60(s,1h),8.47-8.41(m,1h),8.11(s,1h),7.89-7.77(m,1h),7.74-7.66(m,2h)。
[0706]
中间体ek
[0707][0708]
步骤1:向在乙酸(20ml)中的6-溴喹啉-5-甲腈(1.00g,4.29mmol,1.00当量)的溶液中加入n-氯琥珀酰亚胺(5.73g,42.9mmol,10.0当量)。将混合物在135℃下搅拌24小时。然后用2n氢氧化钠水溶液(5ml)将反应混合物的ph调节至7,用水(50ml)稀释,并用二氯甲烷(30ml
×
3)提取。合并的有机层用盐水(100ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯10-15%)纯化,以得到作为灰白色固体的6-溴-3-氯-喹啉-5-甲腈(512mg,1.91mmol,45%产率)。lcms[m 1]
=269.0;1h nmr(400mhz,cdcl3)δ=8.94(s,1h),8.49(dd,j=0.8,2.4hz,1h),8.18(s,1h),7.93(d,j=9.2hz,1h)。
[0709]
步骤2:将在二噁烷(10ml)和水(2ml)中的6-溴-3-氯-喹啉-5-甲腈(512mg,1.91mmol,1.00当量)、1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(398mg,1.91mmol,1.00当量)、二叔丁基(环戊基)膦;二氯钯-铁(125mg,0.19mmol,0.10当量)、碳酸氢钠(322mg,3.83mmol,0.15ml,2.00当量)的混合物用氮气脱气,并在80℃下搅拌0.5小时。在此时间后,反应混合物在减压下浓缩,并且残余物通过制备型tlc(sio2,石油醚:乙酸乙酯30%)纯化,以得到作为黄色固体的3-氯-6-(2-甲基吡唑-3-基)喹啉-5-甲腈(250mg,0.930mmol,49%产率)。lcms[m 1]
=269.1;1h nmr(400mhz,cdcl3)δ=9.00(d,j=
2.4hz,1h),8.61(d,j=2.0hz,1h),8.42(d,j=8.8hz,1h),7.78(d,j=8.8hz,1h),7.66(d,j=1.6hz,1h),6.63(d,j=1.6hz,1h),3.92(s,3h)。
[0710]
步骤3:向在乙腈(5ml)中的3-氯-6-(2-甲基吡唑-3-基)喹啉-5-甲腈(249mg,0.927mmol,1.00当量)的溶液中加入n-溴代琥珀酰亚胺(214mg,1.20mmol,1.30当量)。将混合物在35℃下搅拌0.5小时。在减压下浓缩反应混合物,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯10-15%)纯化,以得到作为黄色固体的6-(4-溴-2-甲基-吡唑-3-基)-3-氯-喹啉-5-甲腈(289mg,0.831mmol,90%产率)。lcms[m 1]
=349.0;1h nmr(400mhz,cdcl3)δ=9.04(d,j=2.4hz,1h),8.64(dd,j=0.8,2.4hz,1h),8.49-8.46(m,1h),7.76(d,j=8.8hz,1h),7.67(s,1h),3.87(s,3h)。
[0711]
中间体el-a和el-b
[0712][0713]
步骤1:在-30℃下在氮气下,向在甲苯(1500ml)中的1,3-二溴-2-氯-5-氟-苯(61.0g,212mmol,1.00当量)和1-甲基吡咯(34.3g,423mmol,37.7ml,2.00当量)的溶液中滴加正丁基锂(在thf中的2.50m,88.9ml,1.05当量)。然后将混合物在-30℃下搅拌0.5小时,然后允许加热至25℃并搅拌12小时。在此时间后,用水(20ml)淬灭反应混合物,并在减压下浓缩,以得到残余物。残余物用乙酸乙酯(1000ml)稀释,用盐水(1000ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯10-50%)纯化,以得到作为棕色液体的3-溴-5-氟-11-甲基-11-氮杂三环并[6.2.1.02,7]十一烷-2(7),3,5,9-四烯(30.0g,118mmol,56%产率)。1h nmr(400mhz,cdcl3)δ=7.10-6.65(m,4h),4.83-4.44(m,2h),2.31-2.09(m,3h)。
[0714]
步骤2:向在氯仿(1300ml)中的3-溴-5-氟-11-甲基-11-氮杂三环并[6.2.1.02,7]十一烷-2(7),3,5,9-四烯(61.5g,242mmol,1.00当量)的溶液中小心分次加入m-cpba(98.2g,484mmol,85%纯度,2.00当量),将内部温度保持低于40℃。在2小时后,棕色溶液变为黄色,并将混合物在25℃下搅拌持续另外的24小时。在此时间后,混合物用二氯甲烷
(1000ml)稀释,并用饱和亚硫酸钠(1500ml
×
2)洗涤,然后用盐水(1500ml)洗涤,然后用无水硫酸钠干燥,过滤,浓缩,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯0-10%)纯化,以得到作为无色液体的1-溴-3-氟-萘(37.8g,168mmol,70%产率)。1h nmr(400mhz,cdcl3)δ=8.25-8.18(m,1h),7.75(br d,j=3.2hz,1h),7.63(dd,j=2.4,8.0hz,1h),7.58-7.52(m,2h),7.47-7.40(m,1h)。
[0715]
步骤3:将在dmf(400ml)中的1-溴-3-氟-萘(34.8g,155mmol,1.00当量)、pd2(dba)3(14.2g,15.5mmol,0.10当量)、氰化锌(45.4g,387mmol,24.5ml,2.50当量)、dppf(17.1g,30.9mmol,0.20当量)和zn粉(1.01g,15.5mmol,0.10当量)的混合物用氮气脱气,然后将混合物在115℃下搅拌4小时。在此时间后,过滤混合物,用乙酸乙酯(1000ml)稀释,用盐水(1000ml
×
2)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且残余物用柱色谱法(sio2,石油醚:乙酸乙酯0-10%)纯化,以得到作为黄色固体的3-氟萘-1-甲腈(21.5g,126mmol,81%产率)。1h nmr(400mhz,cdcl3)δ=8.26-8.21(m,1h),7.92-7.85(m,1h),7.76-7.65(m,4h)。
[0716]
步骤4:在-70℃下,将正丁基锂(在己烷中的2.50m,2.83ml,1.10当量)加入到在thf(15ml)中的n-异丙基丙-2-胺(845mg,8.35mmol,1.18ml,1.30当量)的溶液中,并将反应混合物在-70℃下搅拌15分钟,然后在-70℃下,将在thf(2ml)中的3-氟萘-1-甲腈(1.10g,6.43mmol,1.00当量)加入到混合物中,并将反应混合物在-70℃下搅拌30分钟。然后,在-70℃下,将在thf(2.00ml)中的碘(2.12g,8.35mmol,1.30当量)的溶液加入到反应混合物中,并将溶液在-70℃下搅拌持续另外的30分钟,然后将混合物加热至25℃并在25℃下搅拌10小时。在此时间后,用水(100ml)淬灭反应,并用乙酸乙酯(250ml)稀释,用饱和硫代硫酸钠(100ml
×
2)和盐水(250ml)洗涤。有机相用无水硫酸钠干燥,过滤,浓缩,并将形成的残余物通过柱色谱法(sio2,石油醚:乙酸乙酯0-15%)纯化,以得到作为白色固体的3-氟-2-碘-萘-1-甲腈(1.70g,5.72mmol,89%产率)。1h nmr(400mhz,cdcl3)δ=8.36-8.24(m,1h),7.83-7.71(m,1h),7.59-7.48(m,3h)。
[0717]
步骤5:将在二噁烷(10ml)和水(2ml)中的3-氟-2-碘-萘-1-甲腈(800mg,2.69mmol,1.00当量)、1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(1.23g,5.92mmol,2.20当量)、pd(dtbpf)cl2(176mg,0.269mmol,0.10当量)、碳酸氢钠(679mg,8.08mmol,3.00当量)的混合物用氮气脱气,并在80℃下搅拌12小时。在此时间后,将混合物浓缩,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯5-50%)纯化,以得到作为黄色固体的3-氟-2-(2-甲基吡唑-3-基)萘-1-甲腈(500mg,1.99mmol,74%产率)。lcms[m 1]
=252.1;1h nmr(400mhz,cdcl3)δ=8.35-8.27(m,1h),8.00-7.92(m,1h),7.87(d,j=9.6hz,1h),7.79-7.70(m,2h),7.68(d,j=2.0hz,1h),6.62(d,j=2.0hz,1h),3.85(d,j=1.2hz,3h)。
[0718]
步骤6:向在乙腈(8ml)中的3-氟-2-(2-甲基吡唑-3-基)萘-1-甲腈(500mg,1.99mmol,1.00当量)的溶液中加入n-溴代琥珀酰亚胺(638mg,3.58mmol,1.80当量)。将混合物在25℃下搅拌3小时。在此时间后,浓缩混合物,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯10-50%)纯化,以得到作为黄色固体的2-(4-溴-2-甲基-吡唑-3-基)-3-氟-萘-1-甲腈(550mg,1.56mmol,78%产率)。lcms[m 1]
=331.9;1h nmr(400mhz,cdcl3)δ=8.40-8.31(m,1h),8.01-7.95(m,1h),7.91(d,j=9.6hz,1h),7.79-7.73(m,2h),7.68(s,1h),3.84(s,3h)。
[0719]
步骤7:向在乙腈(300ml)中的3-氟-2-(2-甲基吡唑-3-基)萘-1-甲腈(20.0g,79.6mmol,1.00当量)的溶液加入n-碘代琥珀酰亚胺(89.5g,398mmol,5.00当量)。将混合物在80℃下搅拌12小时。在此时间后,将混合物浓缩,并且残余物在25℃下用甲醇(100ml)研磨30分钟,并将混合物过滤并干燥,以得到作为黄色固体的3-氟-2-(4-碘-2-甲基-吡唑-3-基)萘-1-甲腈(25.2g,66.8mmol,84%产率)。lcms[m 1]
=378.0;1h nmr(400mhz,cdcl3)δ=8.35(br d,j=8.4hz,1h),7.98(br d,j=8.4hz,1h),7.92(d,j=9.2hz,1h),7.82-7.74(m,2h),7.74-7.67(m,1h),3.92-3.82(m,3h)。
[0720]
中间体em
[0721][0722]
将在dmf(10ml)中的2-(2-羟基苯基)乙腈(182mg,1.36mmol,1.20当量)、3-溴-5-氟-吡啶(200mg,1.14mmol,1.00当量)、碳酸钾(393mg,2.84mmol,2.50当量)的混合物在氮气氛下在75℃下搅拌3小时。将混合物浓缩,并且将残余物通过制备型tlc(sio2,石油醚:乙酸乙酯15%)纯化,以得到作为黄色油状物的2-[2-[(5-溴-3-吡啶基)氧基]苯基]乙腈(200mg,0.43mmol,38%产率)。lcms[m 1]
=289.0。
[0723]
中间体en
[0724][0725]
步骤1:在25℃下,向在二噁烷(20ml)和水(0.4ml)中的6-溴-3-环丙氧基吡啶腈(800mg,3.35mmol,1.00当量)和1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-1h-吡唑(732mg,3.51mmol,1.05当量)的溶液中加入二叔丁基(环戊基)膦-二氯钯-铁(218mg,0.335mmol,0.10当量)和碳酸钠(709mg,6.69mmol,2.00当量。将混合物脱气并用氮气吹扫3次,然后在80℃下搅拌2小时。在此时间后,反应混合物用水(20ml)淬灭,然后用乙酸乙酯(30ml
×
3)提取。合并的有机层用盐水(20ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且残余物用快速硅胶色谱法(sio2,石油醚:乙酸乙酯0-10%)纯化,以得到作为白色固体的3-环丙氧基-6-(1-甲基-1h-吡唑-5-基)吡啶腈(750mg,2.97mmol,89%产率)。1h nmr(400mhz,cd3od)δ=7.77(s,2h),7.51(d,j=2.0hz,1h),6.57(d,j=2.0hz,1h),4.22(s,3h),3.96-3.91(m,1h),0.98-0.92(m,4h)。
[0726]
步骤2:在0℃下,向在乙腈(20ml)中的3-环丙氧基-6-(1-甲基-1h-吡唑-5-基)吡啶腈(650mg,2.71mmol,1.00当量)的溶液中加入n-溴琥珀酰亚胺(723mg,4.06mmol,1.50当量),并将混合物在25℃下搅拌16小时。用水(2ml)淬灭反应混合物,并用乙酸乙酯(3ml
×
3)提取。合并的有机层用盐水(10ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且残余物通过制
备型tlc(sio2,石油醚:乙酸乙酯=1:1)纯化,以得到作为黄色固体的6-(4-溴-1-甲基-1h-吡唑-5-基)-3-环丙氧基吡啶腈(1.1g,粗品)。lcms[m 1]=318.9/320.9;1h nmr(400mhz,cdcl3)δ=8.00(d,j=8.8hz,1h),7.84(d,j=9.2hz,1h),7.52(s,1h),4.05(s,3h),3.99-3.92(m,1h),0.99-0.92(m,4h)。
[0727]
步骤3:在25℃下,向在thf(20ml)中的6-(4-溴-1-甲基-1h-吡唑-5-基)-3-环丙氧基吡啶腈(300mg,0.94mmol,1.00当量)的溶液中加入dibal-h(1.00m,5.64ml,6.00当量),并将混合物在25℃下搅拌3小时。在此时间后,通过加入硫代硫酸钠溶液(20ml)来淬灭反应。混合物用乙酸乙酯(30ml
×
3)提取,并将合并的有机层用盐水(20ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过制备型tlc(sio2,石油醚:乙酸乙酯1:1)纯化,以得到作为黄色固体的(6-(4-溴-1-甲基-1h-吡唑-5-基)-3-环丙氧基吡啶-2-基)甲胺(160mg,0.495mmol)。将在甲酸乙酯(3ml)中的(6-(4-溴-1-甲基-1h-吡唑-5-基)-3-环丙氧基吡啶-2-基)甲胺(160mg,0.495mmol,1.00当量)的溶液在25℃下搅拌2小时,然后加入水(2ml)。然后混合物用乙酸乙酯(3ml
×
3)提取,并将合并的有机层用盐水(10ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过制备型tlc(sio2,石油醚:乙酸乙酯0-10%)纯化,以得到作为黄色固体的n-((6-(4-溴-1-甲基-1h-吡唑-5-基)-3-环丙氧基吡啶-2-基)甲基)甲酰胺(140mg,0.359mmol,73%产率)。lcms[m 1]
=351.0/353.0;1h nmr(400mhz,cdcl3)δ=8.36(s,1h),7.68-7.61(m,2h),7.55-7.52(m,1h),7.03(br s,1h),4.62(d,j=4.4hz,2h),3.99(s,3h),3.85(tt,j=3.2,5.6hz,1h),0.92-0.85(m,4h)。
[0728]
步骤4:在-40℃下,向在二氯甲烷(8ml)中的n-((6-(4-溴-1-甲基-1h-吡唑-5-基)-3-环丙氧基吡啶-2-基)甲基)甲酰胺(140mg,0.359mmol,1.00当量)和二异丙基乙胺(104mg,0.80mmol,0.14ml,2.00当量)的溶液中加入tf2o(225mg,0.078mmol,0.13ml,2.00当量),然后允许加热至环境温度,并在25℃下搅拌6小时。在此时间后,加入水(2ml),并将混合物用乙酸乙酯(3ml
×
3)提取。合并的有机层用盐水(10ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过制备型tlc(sio2,石油醚:乙酸乙酯0-10%)纯化,以得到作为黄色固体的5-(4-溴-1-甲基-1h-吡唑-5-基)-8-环丙氧基咪唑并[1,5-a]吡啶(110mg,0.314mmol,79%产率)。lcms[m 1]
=332.9/334.9;1h nmr(400mhz,cdcl3)δ=7.72-7.60(m,3h),6.61(d,j=7.6hz,1h),6.49(d,j=7.4hz,1h),3.98-3.92(m,1h),3.77(s,3h),0.98-0.87(m,4h)。
[0729]
中间体eo
[0730][0731]
步骤1:向在thf(6ml)中的1-(2-甲基吡唑-3-基)乙酮(400mg,3.22mmol,1.00当量)的溶液中加入1-溴吡咯烷-2,5-二酮(1.43g,8.06mmol,2.50当量),并将混合物在25℃下搅拌12小时。在此时间后,浓缩反应混合物,并且将残余物通过制备型tlc(sio2,石油醚:乙酸乙酯20%)纯化,以得到作为黄色油状物的2-溴-1-(4-溴-2-甲基-吡唑-3-基)乙酮
(800mg,2.84mmol,88%产率)。lcms[m 1]
=282.9;1h nmr(400mhz,cdcl3)δ=7.54(s,1h),4.62(s,2h),4.16(s,3h)。
[0732]
步骤2:将在乙腈(6ml)中的2-溴-1-(4-溴-2-甲基-吡唑-3-基)乙酮(400mg,1.42mmol,1.00当量)和2-(2-吡啶基)乙腈(335mg,2.84mmol,0.31ml,2.00当量)的溶液在70℃下搅拌11小时,然后加入三乙胺(431mg,4.26mmol,0.59ml,3.00当量)并在70℃下搅拌持续另外的1小时。然后浓缩反应混合物,并且将残余物通过制备型tlc(sio2,石油醚:乙酸乙酯30%)纯化,以得到作为黄色固体的2-(4-溴-2-甲基-吡唑-3-基)吲哚嗪-1-甲腈(100mg,0.332mmol,23%产率)。lcms[m 1]
=301.0;1h nmr(400mhz,cdcl3)δ=8.10(d,j=6.8hz,1h),7.72(d,j=9.2hz,1h),7.59(s,1h),7.44(s,1h),7.22-7.15(m,1h),6.89(t,j=6.4hz,1h),3.96(s,3h)。
[0733]
中间体ep
[0734][0735]
向在乙酸(1.0ml)中的4-氯-2-(环丙氧基)-6-(2-甲基吡唑-3-基)苄腈(150mg,0.55mmol,1.00当量)的溶液中加入n-碘代琥珀酰亚胺(247mg,1.10mmol,2.00当量)并将混合物在25℃下搅拌1小时。然后用乙酸乙酯(30ml)稀释反应混合物,并用盐水(30ml
×
3)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过制备型tlc(sio2,石油醚:乙酸乙酯20%)纯化,以得到作为黄色固体的4-氯-2-(环丙氧基)-6-(4-碘-2-甲基-吡唑-3-基)苄腈(135mg,0.33mmol,61%产率)。lcms[m h]
=399.9;1h nmr(400mhz,cdcl3)δ=7.53(s,1h),7.41(d,j=2.0hz,1h),6.94(d,j=2.0hz,1h),3.90-3.79(m,1h),3.75(s,3h),0.99-0.76(m,4h)。
[0736]
中间体eq
[0737][0738]
步骤1:将在dmf(10ml)和水(2ml)中的3-溴吡啶-2-甲醛(1.00g,5.38mmol,1.00当量)、1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(1.12g,5.38mmol,1.00当量)、碳酸氢钠(1.13g,13.4mmol,0.52ml,2.50当量)和三苯基膦(141mg,0.54mmol,0.10当量)的混合物脱气并用氮气吹扫3次,然后将乙酸钯(60mg,0.27mmol,0.05当量)加入到混合物中,并在80℃下搅拌16小时。在此试剂后,过滤反应溶液,倒入水(2ml)中,并用乙酸乙酯(10ml
×
3)提取。合并的有机层用盐水(5ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过柱色谱法(sio2,石油醚:乙酸乙酯20-100%)纯化,以得到作为棕色固体的3-(2-甲基吡唑-3-基)吡啶-2-甲醛(637mg,3.40mmol,63%产率)。lcms[m 1]
=188.0;1h nmr(400mhz,cdcl3)δ=10.14-10.06(m,1h),8.93(dd,j=1.6,4.8hz,1h),7.79(dd,j=1.2,7.6hz,1h),7.64-7.58(m,2h),6.30(d,j=2.0hz,1h),3.67(s,3h)。
[0739]
步骤2:向在乙腈(5ml)中的3-(2-甲基吡唑-3-基)吡啶-2-甲醛(200mg,1.07mmol,1.00当量)的溶液中加入n-碘代琥珀酰亚胺(480mg,2.14mmol,2.00当量)并将混合物在20℃下搅拌16小时。用乙酸乙酯(35ml)稀释反应,用饱和硫代硫酸钠(5ml
×
2)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过柱色谱法(sio2,石油醚:乙酸乙酯20-100%)纯化,以得到作为白色固体的3-(4-碘-2-甲基-吡唑-3-基)吡啶-2-甲醛(290mg,0.93mmol,87%产率)。lcms[m 1]
=313.8;1h nmr(400mhz,cdcl3)δ=10.07(s,1h),8.97(dd,j=1.6,4.8hz,1h),7.79-7.73(m,1h),7.68(dd,j=4.8,7.6hz,1h),7.63(s,1h),3.69(s,3h)。
[0740]
步骤3:向在dmf(5ml)中的3-(4-碘-2-甲基-吡唑-3-基)吡啶-2-甲醛(290mg,0.93mmol,1.00当量)的任一种中加入2-氨基乙酸(77mg,1.02mmol,1.10当量)、碘(235mg,0.93mmol,0.18ml,1.00当量)和碳酸氢钠(155mg,1.85mmol,2.00当量)。然后将混合物在60℃下搅拌6小时。反应混合物用乙酸乙酯(35ml)稀释,用饱和硫代硫酸钠溶液(2ml
×
3)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过柱色谱法(sio2,石油醚:乙酸乙酯20-100%)纯化,以得到作为黄色胶状物的8-(4-碘-2-甲基-吡唑-3-基)咪唑并[1,5-a]吡啶(100mg,0.31mmol,33%产率)。lcms[m-1]-=324.9;1h nmr(400mhz,cdcl3)δ=8.24(s,1h),8.05(d,j=6.4hz,1h),7.65(s,1h),7.19(s,1h),6.78-6.69(m,2h),3.82(s,3h)。
[0741]
中间体er
[0742][0743]
步骤1:将在二噁烷(2ml)中的4-氯-6-(环丙氧基)-3-氟-2-(2-甲基吡唑-3-基)苄腈(200mg,0.69mmol,1.00当量)、甲基硼酸(205mg,3.43mmol,5.00当量)、二叔丁基(环戊基)膦-二氯钯-铁(45mg,0.069mmol,0.10当量)和碳酸钾(284mg,2.06mmol,3.00当量)的混合物脱气,用氮气吹扫3次,并在100℃下搅拌2小时。然后将混合物浓缩并通过制备型tlc(sio2,石油醚:乙酸乙酯25%)纯化,以得到作为黄色油状物的6-(环丙氧基)-3-氟-4-甲基-2-(2-甲基吡唑-3-基)苄腈(35mg,0.10mmol,15%产率)。lcms[m 1]
=274.3;1h nmr(400mhz,cdcl3)δ=7.60(d,j=2.0hz,1h),7.24(d,j=6.0hz,1h),6.46(d,j=2.0hz,1h),3.86(td,j=2.8,5.6hz,1h),3.80(s,3h),2.43(d,j=2.0hz,3h),0.93-0.88(m,4h)。
[0744]
步骤2:将在乙腈(3ml)的6-(环丙氧基)-3-氟-4-甲基-2-(2-甲基吡唑-3-基)苄腈(35mg,0.13mmol,1.00当量)、n-溴代琥珀酰亚胺(46mg,0.26mmol,2.00当量)的混合物在氮气气氛下在40℃下搅拌2小时。然后浓缩混合物,并且将残余物通过制备型tlc(sio2,石油醚:乙酸乙酯25%)纯化,得到作为白色固体的2-(4-溴-2-甲基-吡唑-3-基)-6-(环丙氧基)-3-氟-4-甲基-苄腈(25mg,0.040mmol,31%产率)。lcms[m 1]
=352.0;1h nmr(400mhz,cdcl3)δ=7.59(d,j=2.8hz,1h),7.31(br d,j=2.8hz,1h),3.90-3.83(m,1h),3.78(d,j=2.8hz,3h),2.44(br s,3h),0.92(br dd,j=3.2,6.4hz,4h)。
[0745]
中间体es
[0746][0747]
步骤1:向在二噁烷(4ml)和水(1ml)中的2-碘代苯并噻吩-3-甲腈(280mg,0.98mmol,1.00当量)、碳酸钠(312mg,2.95mmol,3.00当量)和1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(409mg,1.96mmol,2.00当量)的混合物中加入二叔丁基(环戊基)膦-二氯钯-铁(64mg,0.098mmol,0.10当量)和碳酸钠(312mg,2.95mmol,3.00当量)并将混合物在80℃下搅拌2小时。在此时间后,加入水(5ml),并用乙酸乙酯(10ml
×
3)提取混合物。合并的有机相用盐水(10ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过制备型tlc(sio2,石油醚:乙酸乙酯10%)纯化,以得到作为黄色固体的2-(2-甲基吡唑-3-基)苯并噻吩-3-甲腈(150mg,64%产率)。1h nmr(400mhz,cdcl3)δ(ppm)=8.06-8.01(m,1h),7.94-7.89(m,1h),7.64-7.61(m,1h),7.61-7.51(m,2h),6.79(d,j=1.6hz,1h),4.09(s,3h)。
[0748]
步骤2:向在乙腈(2ml)中的2-(2-甲基吡唑-3-基)苯并噻吩-3-甲腈(150mg,0.63mmol,1.00当量)的混合物物加入n-溴代琥珀酰亚胺(112mg,0.63mmol,1.00当量)并将混合物在25℃下搅拌12小时。在此时间后,将反应混合物加入到饱和碳酸氢钠溶液(5ml)中,并用乙酸乙酯(10ml
×
3)提取。合并的有机相用盐水(15ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过柱色谱法(sio2,石油醚:乙酸乙酯0-100%)纯化,以得到作为黄色固体的2-(4-溴-2-甲基-吡唑-3-基)苯并噻吩-3-甲腈(160mg,75%产率)。lcms[m 1]
=319.9;1h nmr(400mhz,cdcl3)δ(ppm)=8.10-8.05(m,1h),7.98-7.93(m,1h),7.65(s,1h),7.63-7.56(m,2h),3.98(s,3h)。
[0749]
中间体et
[0750][0751]
中间体es,2-(4-溴-2-甲基-吡唑-3-基)噻吩并[2,3-b]吡啶-3-甲腈,按照中间体er所述的程序步骤,由噻吩并[2,3-b]吡啶-3-甲腈,作为黄色固体被制备(80.0mg,0.25mmol,经2个步骤产率为22%)。lcms[m 1]
=320.9;1h nmr(400mhz,cdcl3)δ(ppm)=8.78(dd,j=1.6,4.4hz,1h),8.34(dd,j=1.6,8.0hz,1h),7.66(s,1h),7.58(dd,j=4.4,8.0hz,1h),3.99(s,3h)。
[0752]
中间体eu
[0753][0754]
步骤1:在0℃下,向在dmf(30ml)中的2-甲基磺酰基乙醇(569mg,4.58mmol,1.20当量)的溶液中加入氢化钠(183mg,4.58mmol,60.0%纯度,1.20当量)。在搅拌0.5小时后,在0℃下以滴加方式加入在dmf(5ml)中的4-氯-2-氟-6-(2-甲基吡唑-3-基)苄腈(900mg,3.82mmol,1.00当量)。将反应混合物在25℃下搅拌1小时。在此时间后,用水(100ml)稀释混合物,用乙酸乙酯(100ml
×
3)提取,水相用hcl(10ml)调节至ph 1,并进一步用乙酸乙酯(100ml
×
3)提取。合并的有机层用无水硫酸钠干燥,过滤并浓缩,以得到作为黄色固体的4-氯-2-羟基-6-(2-甲基吡唑-3-基)苄腈(455mg,粗品),其被用于下一步骤而无需进一步纯化。lcms[m]
=234.1;1h nmr(400mhz,dmso-d6)δ=11.96(br s,1h),7.54(d,j=2.0hz,1h),7.16(d,j=2.0hz,1h),7.12(d,j=2.0hz,1h),6.50(d,j=2.0hz,1h),3.76(s,3h)。
[0755]
步骤2:向在dmf(2ml)和水(0.2ml)中的4-氯-2-羟基-6-(2-甲基吡唑-3-基)苄腈(150mg,0.642mmol,1.00当量)和2-氯-2,2-二氟-乙酸钠(392mg,2.57mmol,4.00当量)的溶液中加入碳酸铯(314mg,0.96mmol,1.50当量)。将混合物在100℃下搅拌1小时。然后通过加入水(40ml)淬灭反应混合物,并用乙酸乙酯(20ml
×
3)提取。合并的有机层用盐水(20ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过制备型tlc(sio2,石油醚:乙酸乙酯25%)纯化,以得到作为黄色固体的4-氯-2-(二氟甲氧基)-6-(2-甲基吡唑-3-基)苄腈(85mg,0.30mmol,47%产率)。lcms[m]
=284.0;1h nmr(400mhz,dmso-d6)δ(ppm)=7.76(s,1h),7.74(d,j=2.0hz,1h),7.72-7.71(m,1h),7.58(d,j=2.0hz,1h),7.54(s,1h),7.36(s,1h),6.60(d,j=2.0hz,1h),3.80(s,3h)。
[0756]
步骤3:向在乙酸(2ml)中的4-氯-2-(二氟甲氧基)-6-(2-甲基吡唑-3-基)苄腈(85mg,0.30mmol,1.00当量)的溶液中加入n-碘化琥珀酰亚胺(135mg,0.60mmol,2.00当量)。将混合物在25℃下搅拌1小时,然后通过加入水(40ml)淬灭反应混合物,并用乙酸乙酯(20ml
×
3)提取。合并的有机层用盐水(40ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过制备型tlc(sio2,石油醚:乙酸乙酯20%)纯化,以得到作为黄色固体的4-氯-2-(二氟甲氧基)-6-(4-碘-2-甲基-吡唑-3-基)苄腈(90mg,0.22mmol,73%产率)。lcms[m h]
=409.9;1h nmr(400mhz,cd3od-d4)δ(ppm)=7.72-7.68(m,1h),7.67(s,1h),7.52(d,j=2.0hz,1h),7.42-7.02(m,1h),3.83(s,3h)。
[0757]
中间体ev
[0758][0759]
步骤1:将在dmf(20ml)中的7-溴-1,3-苯并噻唑-6-胺(2.00g,8.73mmol,1.00当量)、氰化锌(1.54g,13.1mmol,1.50当量)、pd2(dba)3(80mg,0.87mmol,0.01当量)、dppf(97mg,0.175mmol,0.02当量)和锌粉(5.7mg,0.087mmol,0.01当量)的混合物脱气,用氮气
吹扫3次,然后在140℃下搅拌16小时。在此时间后,反应混合物用乙酸乙酯150ml(50ml
×
3)提取,并且合并的有机层用盐水(50ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且形成的残余物通过柱色谱法(sio2,石油醚:乙酸乙酯10-25%)纯化,以得到作为黄色固体的6-氨基-1,3-苯并噻唑-7-甲腈(1.05g,4.66mmol,53%产率)。lcms[m 1]
=176.1;1h nmr(400mhz,cdcl3-d)δ=8.79(s,1h),8.05(d,j=8.8hz,1h),6.90(d,j=8.8hz,1h),4.69(br s,2h)。
[0760]
步骤2:将在乙腈(15ml)中的6-氨基-1,3-苯并噻唑-7-甲腈(500mg,2.85mmol,1.00当量)、对甲苯磺酸(590mg,3.42mmol,1.20当量)、亚硝酸叔丁酯(353mg,3.42mmol,407ul,1.20当量)、四丁基溴化铵(1.84g,5.71mmol,2.00当量)和溴化铜(64mg,0.286mmol,0.10当量)的混合物用氮气脱气,并在25℃下搅拌6小时。然后将混合物在减压下浓缩,并将残余物通过柱色谱法(sio2,石油醚:乙酸乙酯10-25%)纯化,以得到作为黄色固体的6-溴-1,3-苯并噻唑-7-甲腈(300mg,1.25mmol,44%产率)。lcms[m 1]
=240.9;1h nmr(400mhz,cdcl3)δ=9.11(s,1h),8.20(d,j=8.8hz,1h),7.81(d,j=8.8hz,1h)。
[0761]
步骤3:将在二噁烷(10ml)和水(2ml)中的1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(261mg,1.25mmol,1.00当量)、6-溴-1,3-苯并噻唑-7-甲腈(300mg,1.25mmol,1.00当量)、二叔丁基(环戊基)膦;二氯钯铁(82mg,0.125mmol,0.10当量)和碳酸氢钠(316mg,3.76mmol,3.00当量)的混合物用氮气脱气,然后在氮气气氛下在80℃下搅拌3小时。然后将混合物浓缩,并将残余物通过柱色谱法(sio2,石油醚:乙酸乙酯5-25%)纯化,以得到作为黄色固体的6-(2-甲基吡唑-3-基)-1,3-苯并噻唑-7-甲腈(280mg,0.89mmol,71%产率)。lcms[m 1]
=241.0;1h nmr(400mhz,cdcl
3-d)δ=9.21(s,1h),8.43(d,j=8.4hz,1h),7.66-7.58(m,2h),6.58(d,j=2.0hz,1h),3.91(s,3h)。
[0762]
步骤4:将在乙腈(3ml)中的6-(2-甲基吡唑-3-基)-1,3-苯并噻唑-7-甲腈(140mg,0.58mmol,1.00当量)、n-溴代琥珀酰亚胺(207mg,1.17mmol,2.00当量)的混合物在40℃下在氮气氛下搅拌2小时。然后将混合物浓缩,并将残余物通过柱色谱法(sio2,石油醚:乙基5-20%)纯化,以得到作为白色固体的6-(4-溴-2-甲基-吡唑-3-基)-1,3-苯并噻唑-7-甲腈(300mg,0.47mmol,81%产率)。lcms[m 1]
=321.0;1h nmr(400mhz,cdcl
3-d)δ=9.25(s,1h),8.48(d,j=8.4hz,1h),7.65(s,1h),7.61(d,j=8.4hz,1h),3.85(s,3h)。
[0763]
中间体ew
[0764][0765]
步骤1:向在二氯甲烷(15ml)中的3-(羟甲基)-1-甲基吡啶-2(1h)-酮(650mg,4.67mmol,1.00当量)的溶液中加入亚硫酰氯(667mg,5.61mmol,407ul,1.20当量),并将混合物在25℃下搅拌2小时。在真空中浓缩混合物,以得到作为白色固体的3-(氯甲基)-1-甲基-吡啶-2-酮(650mg,粗品)。
[0766]
步骤2:向在乙腈(20ml)中的3-(氯甲基)-1-甲基-吡啶-2-酮(650mg,4.12mmol,1.00当量)、4-溴-5-氯-1h-吡唑(747mg,4.12mmol,1.00当量)的溶液中加入碳酸钾(683mg,4.94mmol,1.20当量),并将混合物在80℃下搅拌12小时。然后用水(100ml)淬灭反应,并用
乙酸乙酯(50ml
×
3)提取。合并的有机相用盐水(50ml)洗涤,用无水硫酸钠干燥,过滤并在真空中浓缩,以得到残余物。残余物通过柱色谱法(sio2,石油醚:乙酸乙酯5%)纯化,以得到作为黄色固体的3-[(4-溴-5-氯-吡唑-1-基)甲基]-1-甲基-吡啶-2-酮(270mg,0.89mmol,51%产率)。lcms[m 1]
=304.0。
[0767]
步骤3:向在二噁烷(10ml)和水(1ml)中的3-[(4-溴-5-氯-吡唑-1-基)甲基]-1-甲基-吡啶-2-酮(270mg,0.89mmol,1.00当量)、4-溴-1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(512mg,1.78mmol,2.00当量)的溶液中加入pd(dppf)cl2(65mg,0.089mmol,0.10当量)和碳酸氢钠(150mg,1.78mmol,69μml,2.00当量)。将混合物在110℃下搅拌10小时。然后通过加入水(50ml)淬灭反应混合物,并用乙酸乙酯(30ml
×
3)提取。合并的有机层用盐水(30ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩,以得到残余物。通过制备型hplc(phenomenex gemini-nx 80mm
×
40mm
×
3μm;流动相:[水(10mm nh4hco3)-acn];b%:5%-35%,8分钟)纯化残余物,以得到作为灰色固体的3-[[5-氯-4-(2-甲基吡唑-3-基)吡唑-1-基]甲基]-1-甲基-吡啶-2-酮(60.0mg,0.198mmol,22%产率)。lcms[m 1]
=304.1;1h nmr(400mhz,dmso-d6)δ=8.24(s,1h),7.73(d,j=2.0,6.8hz,1h),7.46(d,j=2.0hz,1h),7.32(d,j=5.2hz,1h),6.39(d,j=2.0hz,1h),6.25(t,j=6.8hz,1h),5.14(s,2h),3.79(s,3h),3.45(s,3h)
[0768]
步骤4:向在乙腈(1ml)中的3-((5'-氯-2-甲基-1'h,2h-[3,4'-双吡唑]-1'-基)甲基)-1-甲基吡啶-2(1h)-酮(47.0mg,0.155mmol,1.00当量)的溶液中加入n-溴代琥珀酰亚胺(26mg,0.147mmol,0.95当量)。将混合物在25℃下搅拌10小时。然后通过加入水(5ml)淬灭反应混合物,并用乙酸乙酯(5ml
×
3)提取。合并的有机层用盐水(5ml)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过制备型tlc(sio2,二氯甲烷:甲醇10%)纯化,以得到作为白色固体的3-((4-溴-5'-氯-2-甲基-1'h,2h-[3,4'-双吡唑]-1'-基)甲基)-1-甲基吡啶-2(1h)-酮(45mg,0.118mmol,76%产率)。lcms[m 1]
=383.9;1h nmr(400mhz,dmso-d6)δ=7.89(s,1h),7.71(d,j=6.8,1.2hz,1h),7.67(s,1h),6.93-6.96(m,1h),6.23(t,j=6.8hz,1h),5.22(s,2h),3.74(s,3h),3.47(s,3h)。
[0769]
中间体ex
[0770][0771]
步骤1-6:按照中间体dk的前6个步骤所述的相同的程序,从1-(5-溴-2-甲基-3-(甲氧基)苯基)乙-1-酮开始,将2-((7-溴-4-氧代-5-(甲氧基)-3,4-二氢酞嗪-1-基)甲基)异吲哚啉-1,3-二酮作为白色固体制备(4.22g,10.2mmol,经过6个步骤产率为8%)。lcms[m 1]
=414.0。
[0772]
步骤7:将在二噁烷(60ml)中的2-((7-溴-4-氧代-5-(甲氧基)-3,4-二氢酞嗪-1-基)甲基)异吲哚啉-1,3-二酮(4.22g,10.2mmol,1.0当量)、双(频哪醇基)二硼(3.88g,15.3mmol,1.5当量)、pd(dppf)cl2·
ch2cl2(745mg,1.02mmol,0.1当量)和乙酸钾(3.00g,
6-(2-甲基吡唑-3-基)苄腈(111mg,0.44mmol,68%产率)。lcms[m 1]
=254.1;1h nmr(400mhz,cdcl3)δ=7.98(d,j=2.0hz,1h),7.65(d,j=0.8hz,1h),7.27(s,1h),6.85(d,j=2.0hz,1h),4.35-4.29(m,1h),4.27(s,3h),2.91(s,3h),1.36-1.31(m,4h)。
[0782]
步骤2:向在乙酸(2ml)中的2-(环丙氧基)-4-甲基-6-(2-甲基吡唑-3-基)苄腈(100mg,0.40mmol,1.00当量)的溶液中加入n-碘代琥珀酰亚胺(178mg,0.79mmol,2.00当量)。将混合物在25℃下搅拌1小时,然后用水(20ml)稀释,并用乙酸乙酯(20ml
×
3)提取。用盐水(20ml)洗涤合并的有机层,用无水硫酸钠干燥,过滤,浓缩,并且将残余物用制备型tlc(sio2,石油醚:乙酸乙酯25%)纯化,以得到作为黄色固体的2-(环丙氧基)-6-(4-碘-2-甲基-吡唑-3-基)-4-甲基-苄腈(94mg,0.25mmol,63%产率)。lcms[m 1]
=380.0;1h nmr(400mhz,cdcl3)δ=7.66-7.55(m,1h),7.27(s,1h),6.80(s,1h),3.89(tt,j=3.2,6.0hz,1h),3.85-3.79(m,3h),2.50(s,3h),1.04-0.80(m,4h)。
[0783]
中间体fb
[0784][0785]
步骤1:向在二氯甲烷(8ml)中的2-氟萘-1-醇(0.50g,3.08mmol,1.00当量)的溶液中加入nbs(521mg,2.93mmol,0.95当量)并将混合物在-50℃下搅拌0.25小时。然后加入水(10ml),并且干燥、浓缩分离的有机相,并且将残余物通过柱色谱法(sio2,石油醚/乙酸乙酯1%)纯化,以得到作为淡黄色固体的4-溴-2-氟-萘-1-醇(500mg,2.07mmol,67%产率)。1h nmr(400mhz,cdcl3)δ=8.27-8.21(m,1h),8.19-8.11(m,1h),7.63(d,j=10.2hz,1h),7.61-7.54(m,2h),5.68(br d,j=4.0hz,1h)。
[0786]
步骤2:向在0℃的二氯甲烷(40ml)中的4-溴-2-氟-萘-1-醇(2.30g,9.54mmol,1.00当量)、diea(21.0mmol,3.66ml,2.20当量)和dmap(58mg,0.48mmol,0.05当量)的溶液中以逐滴方式加入乙酰氯(19.1mmol,1.36ml,2.00当量)。将混合物在28℃下搅拌1小时,然后浓缩混合物,并且将形成的残余物通过柱色谱法(sio2,石油醚/乙酸乙酯1%)纯化,以得到作为白色固体的(4-溴-2-氟-1-萘基)乙酸酯(2.50g,8.83mmol,93%产率)。1h nmr(400mhz,cdcl3)δ=8.26-8.18(m,1h),7.94-7.86(m,1h),7.72(d,j=9.2hz,1h),7.66-7.56(m,2h),2.51(s,3h)。
[0787]
步骤3:将在dma(40ml)中的(4-溴-2-氟-1-萘基)乙酸酯(2.50g,8.83mmol,1.00当量)、pd2(dba)3(809mg,0.88mmol,0.10当量)、zn(cn)2(9.71mmol,0.62ml,1.10当量)、锌(29mg,0.442mmol,0.05当量)和dppf(979mg,1.77mmol,0.20当量)的混合物用氮气脱气3次,然后在120℃下搅拌3小时。然后用乙酸乙酯(100ml)稀释反应混合物,过滤,并且将滤液用盐水(50ml
×
3)洗涤,干燥,浓缩,并且阿静残余物通过柱色谱法(sio2,石油醚/乙酸乙酯2-10%)纯化,以得到作为黄色固体的3-氟-4-羟基-萘-1-甲腈(980mg,5.24mmol,59%产
率)。1h nmr(400mhz,cdcl3)δ=8.36-8.27(m,1h),8.18(d,j=8.0hz,1h),7.76(d,j=9.6hz,1h),7.72-7.62(m,2h)。
[0788]
步骤4:在0℃下,向在二氯甲烷(20ml)中的3-氟-4-羟基-萘-1-甲腈(880mg,4.70mmol,1.00当量)的溶液中加入三乙胺(9.40mmol,1.31ml,2.00当量)和tf2o(8.46mmol,1.40ml,1.80当量)。然后将混合物在28℃下搅拌0.5小时。然后浓缩反应混合物,并且将残余物通过柱色谱法(sio2,石油醚/乙酸乙酯2%)纯化,以得到作为黄色固体的(4-氰基-2-氟-1-萘基)三氟甲磺酸酯(1.15g,3.60mmol,77%产率)。
[0789]
步骤5:将在甲苯(3.5ml)中的(4-氰基-2-氟-1-萘基)三氟甲磺酸酯(0.38g,1.19mmol,1.00当量)、pd(pph3)4(138mg,0.12mmol,0.10当量)、alme3(在phme中的2m,1.79ml,3.00当量)的混合物用氮气脱气3次,并在120℃下搅拌2小时。在此时间后,通过加入水(5ml)淬灭反应,然后用乙酸乙酯(40ml)稀释并过滤。用水(20ml
×
3)洗涤滤液,干燥,浓缩,并且将残余物通过制备型tlc(sio2,石油醚/乙酸乙酯5%)纯化,以得到作为白色固体的化合物3-氟-4-甲基-萘-1-甲腈(90mg,0.49umol,41%产率)。1h nmr(400mhz,cdcl3)δ=8.29-8.22(m,1h),8.11-8.03(m,1h),7.75-7.63(m,3h),2.66(d,j=2.4hz,3h)。
[0790]
步骤6:在-70℃下,向在thf(2ml)中的n-异丙基-丙-2-胺(0.86mmol,0.12ml,2.00当量)的溶液中以逐滴方式加入n-buli(在thf中的2.5m,0.31ml,1.80当量)。然后将混合物在-70℃下搅拌0.5小时,然后加入3-氟-4-甲基-萘-1-甲腈(80mg,0.43mmol,1当量),并搅拌持续另外的0.5小时,然后加入碘(0.87mmol,0.17ml,2.00当量)。在添加完成后,将混合物在30℃下搅拌1小时。然后通过添加水(2ml)淬灭反应混合物,并用乙酸乙酯(10ml
×
2)提取。将合并的有机相干燥并浓缩,以得到作为棕色固体的3-氟-2-碘-4-甲基-萘-1-甲腈(110mg,0.35mmol)。
[0791]
步骤7:将在正丁醇(2.8ml)中的3-氟-2-碘-4-甲基-萘-1-腈(110mg,0.35mmol,1.00当量)、1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(96mg,0.46mmol,1.30当量)、[2-(2-氨基苯基)苯基]钯(1 )-双(1-金刚烷基)-丁基-膦-甲磺酸盐(26mg,0.035mmol,0.10当量)、k3po4(1.50m,0.71ml,3.00当量)的混合物用氮气脱气3次,然后在60℃下搅拌6小时。然后过滤、浓缩反应混合物,并通过制备型tlc(sio2,石油醚/乙酸乙酯20%)纯化残余物,以得到作为棕色固体的3-氟-4-甲基-2-(2-甲基吡唑-3-基)萘-1-甲腈(50mg,0.19mmol,53%产率)。lcms[m 1]
266.1。
[0792]
步骤8:向在乙酸(2ml)中的3-氟-4-甲基-2-(2-甲基吡唑-3-基)萘-1-甲腈(50mg,0.19mmol,1.00当量)的溶液中加入nis(127mg,0.57mmol,3.00当量)。将混合物在30℃下搅拌12小时。然后用饱和碳酸氢钠水溶液将ph调节至ph 7,然后用乙酸乙酯(10ml
×
3)提取,并将合并的有机相干燥和浓缩。残余物通过制备型tlc(sio2,石油醚/乙酸乙酯20%)纯化,以得到作为棕色固体的化合物3-氟-2-(4-碘-2-甲基-吡唑-3-基)-4-甲基-萘-1-甲腈(30mg,0.076mmol,41%产率)。lcms[m 1]
392.0。
[0793]
中间体fc
[0794]
[0795]
步骤1:在氮气气氛下,向在thf(2ml)和(0.2ml)中的3-氯-2-(1-甲基-1h-吡唑-5-基)-1-萘腈(200mg,0.747mmol,1.00当量)、三氟(乙烯基)硼酸钾(120mg,0.896mmol,1.20当量)、碳酸铯(730mg,2.24mmol,3.00当量)和二环己基(2',6'-二异丙氧基-[1,1'-联苯]-2-基)磷化氢(34.9mg,0.074mmol,0.10当量)的溶液中加入氯化钯(ii)(13.3mg,0.074mmol,0.10当量)。将所得的混合物在90℃下搅拌16小时。然后用水(3ml)稀释混合物,并用乙酸乙酯(5ml
×
3)提取。合并的有机层用盐水(5ml
×
2)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过柱色谱法(sio2,石油醚/乙酸乙酯5-20%)纯化,以得到作为淡黄色固体的2-(1-甲基-1h-吡唑-5-基)-3-乙烯基-1-萘腈(130mg,0.049mmol,66%产率)。lcms[m 1]
=260.2。
[0796]
步骤2:将2-(1-甲基-1h-吡唑-5-基)-3-乙烯基-1-萘腈(130mg,491μmol,1.00当量)溶解在二氯甲烷(20ml)中,并冷却至-70℃。向反应溶液中鼓泡通入臭氧,同时搅拌15分钟。然后加入二甲基磺胺(8.46g,136mmol,10ml,277当量),并将混合物在-70℃下搅拌15分钟。在此时间后,浓缩混合物,然后通过柱色谱法(sio2,石油醚/乙酸乙酯5-20%)纯化,以得到作为白色固体的3-甲酰基-2-(1-甲基-1h-吡唑-5-基)-1-萘腈(60mg,222μmol,45.3%产率)。lcms[m 1]
=262.2。
[0797]
步骤3:将在二氯甲烷(1.0ml)中的3-甲酰基-2-(1-甲基-1h-吡唑-5-基)-1-萘腈(20mg,74.2μmol,1.00当量)和(双-(2-甲氧基乙基)氨基)三氟化硫(41mg,185μmol,41μl,2.50当量)的溶液在25℃下搅拌6小时。然后用饱和碳酸氢钠水溶液(2ml)淬灭反应,并用乙酸乙酯(5ml
×
3)提取。合并的有机层用盐水(3ml
×
3)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过制备型tlc(石油醚/乙酸乙酯20%)纯化,以得到作为白色固体的3-(二氟甲基)-2-(2-甲基吡唑-3-基)萘-1-甲腈(11.0mg,38.4μmol,52%产率)。lcms[m 1]
=284.2。
[0798]
步骤4:向在二氯甲烷(1.0ml)中的3-(二氟甲基)-2-(1-甲基-1h-吡唑-5-基)-1-萘腈(11mg,38μmol,1.00当量)的溶液中加入1-溴吡咯烷-2,5-二酮(10mg,58μmol,1.50当量)。将混合物在25℃下搅拌10小时。浓缩反应混合物,并通过制备型tlc(sio2,石油醚/乙酸乙酯20%)纯化,以得到作为无色油状物的2-(4-溴-1-甲基-1h-吡唑-5-基)-3-(二氟甲基)-1-萘腈(12mg,33μmol,86%产率)。lcms[m 1]
=362.1。
[0799]
中间体fd和fe
[0800][0801]
步骤1:在氮气下,在0℃下,将在dmf(3ml)中的氢化钠(51mg,1.28mmol,60%纯度,
1.20当量)和2-甲基磺酰基乙醇(158mg,1.28mmol,1.20当量)的混合物搅拌30分钟。然后,逐滴加入在dmf(2ml)中的2-(4-溴-2-甲基-吡唑-3-基)-4-氯-6-(环丙氧基)苄腈(375mg,1.06mmol,1当量)的溶液,并将反应混合物在25℃下搅拌2小时。然后用水(5ml)淬灭混合物,并用乙酸乙酯(3
×
10ml)提取。合并的有机层用硫酸钠干燥,过滤,浓缩并通过柱色谱法(sio2,石油醚/乙酸乙酯10-30%)纯化,以得到作为无色油状物的2-(4-溴-2-甲基-吡唑-3-基)-6-(环丙氧基)-4-羟基-苄腈(120mg,33%产率)。lcms[m 1]
=334.0;1h nmr(400mhz,cdcl3)δ=9.77-9.37(m,1h),7.54(s,1h),6.98(d,j=2.0hz,1h),6.51(d,j=2.0hz,1h),3.85-3.82(m,1h),3.80(s,3h),0.94-0.84(m,5h)。
[0802]
步骤2a:在0℃下在氮气下,向在dmf(0.5ml)中的2-(4-溴-2-甲基-吡唑-3-基)-6-(环丙氧基)-4-羟基-苄腈(20mg,59μmol,1.00当量)的混合物中加入氢化钠(4.8mg,119μmol,60%纯度,2.00当量),并将混合物在0℃下搅拌30分钟。然后,在0℃下,将二溴(二氟)甲烷(38mg,180μmol,17ul,3.00当量)加入到混合物中,并将混合物在25℃下搅拌1小时。然后加入水(3.00ml),并用乙酸乙酯(3
×
5ml)提取混合物。将合并的有机层用硫酸钠干燥,过滤,在真空中浓缩,并且将残余物通过制备型tlc(sio2,石油醚:乙醚乙酸酯20%)纯化,以得到作为白色固体的4-[溴(二氟)甲氧基]-2-(4-溴-2-甲基-吡唑-3-基)-6-(环丙氧基)苄腈(10.0mg,36%产率)。lcms[m 1]
=463.9步骤2b:向在dmf(1.0ml)和水(0.1ml)中的2-(4-溴-2-甲基-吡唑-3-基)-6-(环丙氧基)-4-羟基-苄腈(100mg,299μmol,1.00当量)和2-氯-2,2-二氟-乙酸钠(114mg,748μmol,2.50当量)的混合物中加入碳酸铯(146mg,449μmol,1.50当量)。将混合物在100℃下搅拌3小时。然后用水(5ml)淬灭反应混合物,并用乙酸乙酯(3
×
10ml)提取。合并的有机相用盐水(15ml)洗涤,用无水硫酸钠干燥,过滤,在真空中浓缩,并且将残余物通过柱色谱法(sio2,石油醚/乙酸乙酯0-30%)纯化,以得到作为无色油状物的2-(4-溴-2-甲基-吡唑-3-基)-6-(环丙氧基)-4-(二氟甲氧基)苄腈(70mg,61%产率)。lcms[m 1]
=386.0;1h nmr(400mhz,cdcl3)δ=7.57(s,1h),7.23(d,j=2.4hz,1h),6.87-6.43(m,2h),3.95-3.87(m,1h),3.82(s,3h),0.99-0.90(m,4h)
[0803]
步骤3:将在dce(2ml)中的4-[溴(二氟)甲氧基]-2-(4-溴-2-甲基-吡唑-3-基)-6-(环丙氧基)苄腈(100mg,216μmol,1.00当量)和四氟硼酸银(273mg,1.40mmol,6.50当量)的混合物在65℃下搅拌3小时。然后,用水(5ml)淬灭反应混合物,并用乙酸乙酯(3
×
10ml)提取。合并的有机相用盐水(15ml)洗涤,用无水硫酸钠干燥,过滤,在真空中浓缩,并且残余物通过反相闪蒸(0.1%fa条件)纯化,以得到作为黄色固体的2-(4-溴-2-甲基-吡唑-3-基)-6-(环丙氧基)-4-(三氟甲氧基)苄腈(55mg,63%产率)。lcms[m 1]
=402.1。
[0804]
在本发明的一个方面,本文提供了可以用于制备式(i)、式(i-a)、式(i-b)、式(i-c)和式(1-d)的化合物的中间体。在一个实施例中,中间体包括中间体a-1至fe。
[0805]
以下实例旨在进一步举例说明本发明的某些实施例,而非旨在限制本发明的范围。
[0806]
用于制备实例1-1至1-8的一般反应方法
[0807]
实例1-1和1-2
7.51(m,2h),7.50-7.44(m,1h),4.61(s,2h)。
[0812]
按照一般反应方案的教导、实例1-1和1-2的合成程序并使用本文公开的中间体,如表1所示制备实例1-3至1-8:
[0813]
表1
[0814][0815][0816]
实例2-1
[0817][0818]
步骤1:将在dmf(1.00ml)中的中间体d(150mg,429μmol,1.00当量)、噻唑-4-基硼酸(66mg,515μmol,1.20当量)、碳酸钠(91mg,858μmol,2.00当量)和pd(dppf)cl2(31mg,42.9μmol,0.10当量)的混合物用氮气吹扫3次,并在氮气下在100℃下搅拌12小时。在此时间后,用水(20ml)稀释反应混合物,并用乙酸乙酯(20ml
×
3)提取。合并的有机层用盐水(30ml)洗涤,用硫酸钠干燥,过滤并在减压下浓缩成残余物。然后通过柱色谱法(sio2,石油醚:乙酸乙酯5:1至1:1)纯化残余物,以得到4-(1-(苄氧基)-4-氯酞嗪-6-基)噻唑(76mg,214μmol,50%产率)。
[0819]
步骤2:将在dmf(1.00ml)中的4-(1-(苄氧基)-4-氯酞嗪-6-基)噻唑(76mg,214μmol,1.00当量)、氰化锌(38mg,321μmol,20μl,1.50当量)、dppf(12mg,21μmol,0.10当量),pd2(dba)3(10mg,10μmol,0.05当量)和锌粉(1mg,21μmol,0.10当量)的混合物脱气,并用氮气吹扫3次。然后将混合物在氮气气氛下在105℃下搅拌2小时。在此时间后,用水(20ml)稀释反应混合物,用乙酸乙酯(20ml
×
3)提取,并将合并的有机层用盐水(30ml)洗涤,干燥(无水na2so4),过滤并在减压下浓缩。残余物通过柱色谱法(sio2,石油醚:乙酸乙酯=5:1至1:1)纯化,以得到4-(苄氧基)-7-(噻唑-4-基)酞嗪-1-甲腈(51mg,148μmol,69%产率)。
[0820]
步骤3:在氮气下,向在meoh(10ml)中的4-(苄氧基)-7-(噻唑-4-基)酞嗪-1-甲腈(103mg,299μmol,1.00当量)、hcl(6.0m,1.00当量)的溶液中加入活性炭载钯(296μmol,10.0%纯度)。将悬浮液在真空下脱气,并用氢气吹扫数次。然后将混合物在氢气气氛(50.0psi)下在40℃下剧烈搅拌2小时。在此时间后,过滤反应混合物,在减压下浓缩,并通过制备型hplc(waters xbridge 150
×
25mm
×
5μm;流动相:[水(0.05%氢氧化氨v/v)-acn];b%:12%-42%,10分钟)纯化,以得到作为白色固体的4-(氨基甲基)-6-(噻唑-4-基)酞嗪-1(2h)-酮,实例2-1(3mg,12μmol,4%产率,97%纯度)。lcms[m 1]:259.2;1h nmr(400mhz,meod)δ=9.17(d,j=2.0hz,1h),8.56(s,1h),8.47-8.43(m,2h),8.33(d,j=2.0hz,1h),4.29(s,2h)。
[0821]
用于制备实例2-2至2-5的一般反应方法2
[0822][0823]
其中r1=芳基或杂芳基
[0824]
步骤1:将在甲苯(2ml)中的中间体e(429μmol,1.00当量)、合适的芳基/杂芳基-三丁基锡试剂(644μmol,1.50当量)和pd(pph3)4(43μmol,0.10当量)的混合物用氮气吹扫3次,并在100℃下搅拌12小时。在此时间后,用水(20ml)稀释混合物,并用乙酸乙酯(20ml
×
3)提取。合并的有机层用盐水(30.0ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩成残余物。然后通过柱色谱法(sio2,石油醚∶乙酸乙酯5∶1至1∶1)纯化残余物,以得到适当的r1偶联产物5e。
[0825]
步骤2:将在dmf(1.00ml)的r1偶联产物5e(214μmol,1.00当量)、氰化锌(321μmol,20μl,1.50当量)、dppf(21μmol,0.10当量)、pd2(dba)3(10μmol,0.05当量)和锌粉(21μmol,0.10当量)的混合物用氮气吹扫3次。然后将混合物在105℃下搅拌2小时。在此时间后,用水(20ml)稀释混合物,并用乙酸乙酯(20ml
×
3)提取。合并的有机层用盐水(30.0ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩成残余物。然后通过柱色谱法(sio2,石油醚∶乙酸乙酯5∶1至1∶1)纯化浓缩的残余物,以得到适当的r
1-氰化物6e,其被用于下一步骤而无需进一步纯化。
[0826]
步骤3:在氮气下,向在meoh(10ml)中的适当的r
1-氰化物6e(287μmol,1.00当量)、hcl(6.0m,1.00当量)的溶液中加入活性炭载钯(296μmol,10%pd)。将悬浮液在真空下脱气,并用氢气吹扫数次。然后在40℃下在氢气氛(50psi)下剧烈搅拌混合物2小时,然后过滤并在减压下浓缩。通过制备型hplc(waters xbridge 150
×
25mm
×
5μm;流动相:[水(0.05%氢氧化氨v/v)-acn];b%:12%-42%,10分钟)来纯化残余物,以返回表2所示的所需化合物。
[0827]
根据一般反应方案的教导、一般反应方法2和本文公开的中间体,如表2所示制备实例2-2至2-5。
[0828]
表2
[0829][0830]
用于制备实例3-1至3-61的一般偶联方法(cm)和纯化方法(pm)
[0831]
cm 3a
[0832][0833]
r1=芳基、杂芳基、烷基
[0834]
步骤1:将在二噁烷(1.00ml)和水(0.20ml)中的适当的芳基/杂芳基/烷基硼酸酯(390μmol,1.5当量)、中间体f(260μmol,1.00当量)、pd(dppf)cl2(26μmol,0.10当量)、碳酸氢钠(43mg,521μmol,20.3μl,2.00当量)的混合物用氮气吹扫3次。然后将混合物在80℃下搅拌2小时。在此时间后,过滤混合物,用二氯甲烷∶甲醇10∶1的混合物洗涤,并且将滤液在减压下浓缩。然后用甲醇(3.00ml)研磨浓缩的残余物,以得到作为黑色固体相应的铃木偶联产物15a。
[0835]
步骤2:向在乙醇(1.00ml)中的相应的铃木偶联产物15a的溶液中加入水合肼(242μmol,14μl)。将混合物在80℃下搅拌1小时,冷却并在减压下浓缩。然后根据本文所述的纯化方法3-1、3-2、3-3或3-4中的一种,通过制备型hplc来纯化浓缩的残余物,以提供7a。
[0836]
cm 3b:
[0837][0838]
r1=烷基、芳基或杂芳基
[0839]
步骤1:将在二噁烷(2ml)和水(0.40ml)中的中间体an、适当的烷基/芳基/杂芳基溴化物(464μmol)、碳酸氢钠(464μmol、18.0μl、2.00当量)和pd(dppf)cl2(17mg,23μmol,0.10当量)用氮气吹扫3次。然后将混合物在80℃下搅拌1小时。在此时间后,用水(2ml)稀释反应混合物,在减压下过滤,并用乙醇(3ml)研磨滤饼,以得到作为黑色固体的相应的r
1-铃木偶联产物15a,其被直接用于下一步骤而无需进一步纯化。
[0840]
步骤2:向在乙醇(1.00ml)中的相应的r
1-铃木偶联产物15a的溶液中加入水合肼(242μmol,14μl)。将混合物在80℃下搅拌1小时。在此时间后,在减压下浓缩混合物,并且根据纯化方法3-1至3-4中的一种通过制备型hplc来纯化残余物。
[0841]
cm 3c
[0842][0843]
r1=烷基、芳基、杂芳基
[0844]
步骤1:将在二噁烷(3.00ml)中的中间体f(312μmol,1.00当量)、合适的烷基/芳基/杂芳基三丁基锡或烷基/芳基/杂芳基三甲基硅试剂(625μmol,2.00当量)、pd(pph3)4(72mg,62μmol,0.20当量)的混合物用氮气吹扫3次。然后将混合物在100℃下搅拌1小时。在此时间后,用氟化钾溶液(3.0ml)稀释反应混合物以形成悬浮液。过滤悬浮液,并且将滤液用乙酸乙酯(8ml
×
3)提取。合并的有机层用盐水(10ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过制备型tlc(sio2,二氯甲烷:甲醇 10:1)纯化,以得到作为黑色固体的相应的c-c键形成化合物15a。
[0845]
步骤2:向在乙醇(1.0ml)中的15a的溶液中加入水合肼(242μmol,14μl)。将混合物在80℃下搅拌1小时。在此时间后,在减压下浓缩混合物,并根据纯化方法3-1至3-4中的一种通过制备型hplc来纯化残余物。
[0846]
纯化方法(pm)
[0847]
pm 3-1:柱:phenomenex synergi c18 150
×
25
×
10μm;流动相:[水(0.05%hcl)-acn];b%:5%-25%,11分钟。
[0848]
pm 3-2:柱:waters xbridge 150
×
25mm
×
5μm;流动相:[水(0.05%氢氧化氨v/v)-acn];b%:12%-42%,10分钟。
[0849]
pm 3-3:柱:waters xbridge 150
×
25mm
×
5μm;流动相:[水(10mm nh4hco3)-acn];b%:2%-32%,10分钟。
[0850]
pm 3-4:柱:phenomenex luna c18 75
×
10mm
×
3μm;流动相:[水(0.05%hcl)-acn];b%:11%-31%,6.5分钟。
[0851]
按照一般反应方案、偶联方法3a、3b和3c的教导,并使用本文公开的纯化方法3-1、3-2、3-3和3-4以及中间体,如表3所示制备实例3-1至3-61。
[0852]
表3
[0853]
[0854]
[0855]
[0856]
[0857]
[0858]
[0859]
[0860]
[0861]
[0862][0863]
实例4-1至4-180
[0864]
用于制备表4中的实例的偶联方法(cm)和纯化方法(pm)
[0865]
cm 4a:
[0866][0867]
其中r1=芳基或杂芳基并且hal=cl、br、i
[0868]
步骤1:将在二噁烷(1.0ml)和水(0.2ml)中的合适的芳基/杂芳基卤化物26(390μmol,1.5当量)、中间体an(260μmol,1.00当量)、pd(dppf)cl2(26μmol,0.10当量)、碳酸氢钠(43.7mg,521μmol,20.3μl,2.00当量)的混合物用氮气吹扫3次。然后将混合物在80℃下搅拌2小时。在此时间后,过滤混合物,用二氯甲烷∶甲醇10∶1的混合物洗涤,并且在减压下浓缩滤液,以得到残余物。将该浓缩的残余物用甲醇(3.0ml)研磨,过滤并干燥,以得到作为黑色固体的相应的偶联产物15a。
[0869]
步骤2:向在乙醇(1.00ml)中的相应偶联产物15a的溶液中加入水合肼(242μmol,14μl)。混合物在80℃下搅拌1小时。在此时间后,在真空中浓缩混合物,并且根据纯化方法4-1至4-13中的一种,通过制备型hplc来纯化残余物。
[0870]
cm 4b:
[0871][0872]
r1=芳基或杂芳基并且hal=cl、br、i
[0873]
步骤1:将在二噁烷(1ml)和水(0.20ml)中的中间体j(189mg,470μmol,1.00当量)、芳基/杂芳基卤化物26(564μmol,1.20当量)、pd(dppf)cl2(34mg,47μmol,0.10当量)、碳酸氢钠(79mg,940μmol,37μl,2.00当量)用氮气吹扫3次,并在80℃下搅拌2小时。在完成后,将反应混合物倒入水(40ml)中,过滤,并将滤饼在减压下干燥,以得到作为灰色固体的r
2-吡啶基-铃木偶联产物28-boc(71mg,粗品),并被直接用于下一步骤而无需进一步纯化。
[0874]
步骤2:向在二氯甲烷(1ml)中的n-[[4-氧代-7-(5-嘧啶-2-基氧基-3-吡啶基)-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯r
2-吡啶基-铃木偶联产物28-boc(60mg,粗品)的溶液中加入三氟乙酸(462mg,4.05mmol,0.30ml)。将混合物在30℃下搅拌0.5小时,在完成后在减压下浓缩成残余物。根据纯化方法4-1至4-13中的一种,通过制备型hplc来纯化浓缩的残余物29。
[0875]
cm 4c
[0876][0877]
其中r1=芳基或杂芳基
[0878]
步骤1:将在二噁烷(1ml)和水(0.20ml)中的适当的芳基/杂芳基硼酸酯(303μmol,1.16当量)、中间体f(100mg,260μmol,1.00当量)、pd(dppf)cl2(19mg,26μmol,0.10当量)、碳酸氢钠(66mg,781μmol,30μl,3.00当量)的混合物脱气并用氮气吹扫3次,并在氮气气氛下在80℃下搅拌1小时。在此时间后,过滤混合物并在减压下浓缩,以得到残余物。浓缩的残
余物通过柱色谱法(sio2,石油醚∶乙酸乙酯10∶1至0∶1)纯化,以得到作为黄色固体的相应的铃木偶联产物15a(12.0mg,粗品)。
[0879]
步骤2:向在乙醇(1.0ml)中的相应的铃木偶联产物15a(10mg,粗品)的溶液中加入水合肼(10mg,207μmol,10μl)。将混合物在80℃下搅拌1小时,冷却并在减压下浓缩。然后根据本文所述的纯化方法4-1至4-13之一,通过制备型hplc来纯化浓缩的残余物7a。
[0880]
cm 4d
[0881][0882]
r1=芳基或杂芳基并且hal=cl、br、i
[0883]
步骤1:将在二噁烷(1.5ml)和水(0.30ml)中的中间体j(69mg,17μmmol,1.30当量)、芳基/杂芳基卤化物26(132μmol,1.0当量)、pd(dtbpf)cl2(9mg,13μmol,0.10当量)、碳酸钠(28mg,263μmol,2.00当量)用氮气吹扫3次,并在80℃下搅拌2小时。在此时间后,将混合物浓缩,并且将残余物通过制备型tlc(sio2,ch2cl2∶meoh20∶1)纯化,以得到r
1-铃木偶联产物28-boc,并且被直接用于下一步骤而无需进一步纯化。
[0884]
步骤2:向在二氯甲烷(1.5ml)中的n-[[4-氧代-7-(r1)-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯铃木偶联产物28-boc(40mg)的溶液中加入三氟乙酸(5.4mmol,0.4ml)。将混合物在25℃下搅拌0.5小时,在完成后在减压下浓缩成残余物。根据纯化方法4-1至4-13之一,通过制备型hplc来纯化浓缩的残余物29。
[0885]
cm 4e
[0886][0887]
r1=芳基或杂芳基并且hal=cl、br、i
[0888]
步骤1:将在2-甲基-2-丁醇(2.00ml)和水(0.4ml)中的中间体j(80mg,0.20mmol,1.00当量)、芳基/杂芳基卤化物26(239μmol,1.2当量)、[2-(2-氨基苯基)苯基]-氯代钯;二环己基-[2-(2,6-二甲氧基苯基)苯基]膦(14.4mg,19.9μmol,0.10当量)、碳酸氢钠(34mg,398μmol,2.00当量)用氮气吹扫3次,并在80℃下搅拌3小时。在此时间后,用水(5ml)稀释混合物,并用乙酸乙酯(10ml
×
3)提取,并且将合并的有机提取物用无水硫酸钠干燥,过滤并在减压下浓缩。然后通过制备型tlc(sio2,石油醚∶乙酸乙酯=1∶1.5)纯化残余物,以得到r
1-铃木偶联产物28-boc,其被用于下一步骤。
[0889]
步骤2:将在hcl
·
二噁烷(2.00ml,101当量)中的n-[[4-氧代-7-(r1)-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯铃木偶联产物28-boc(0.08mmol,1.00当量)的溶液在25℃下搅拌12小时。在真空中浓缩反应,并且根据纯化方法4-1至4-13之一,通过制备型hplc来纯化残余物。
[0890]
cm 4f:
[0891][0892]
r1=芳基或杂芳基并且hal=cl、br、i
[0893]
步骤1:将在正丁醇(2.0ml)和水(0.4ml)中的中间体j(80mg,0.20mmol,1.00当量)、芳基/杂芳基卤化物26(0.24mmol,1.2当量)、甲磺酸盐(2-二环己基膦-2
′
,4
′
,6
′‑
三-1-丙基-1,1
′‑
联苯)(2
′‑
甲氨基-1,1
′‑
联苯-2-基)钯(ii)(20μmol,0.10当量)、磷酸钾(0.40mmol,2.00当量)用氮气吹扫3次,并在60℃下搅拌1小时。在此时间后,用水(5ml)稀释混合物,并用乙酸乙酯(10ml
×
3)提取,并且将合并的有机提取物用无水硫酸钠干燥,过滤并在减压下浓缩。然后通过制备型tlc(sio2,石油醚∶乙酸乙酯20%)纯化残余物,以得到r
1-铃木偶联产物28-boc,其被用于下一步骤。
[0894]
步骤2:向在二氯甲烷(1.5ml)中的n-[[4-氧代-7-(r1)-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯铃木偶联产物28-boc(40.0mg)的溶液中加入三氟乙酸(5.4mmol,0.40ml)。将混合物在25℃下搅拌0.5小时,并在完成后在减压下浓缩成残余物。根据纯化方法4-1至4-13之一,通过制备型hplc来纯化浓缩的残余物29。
[0895]
cm 4g:
[0896][0897]
r1=芳基或杂芳基并且hal=cl、br、i
[0898]
步骤1:将在二噁烷(1.5ml)和水(0.3ml)中的中间体j(40mg,0.10mmol,1.25当量)、芳基/杂芳基卤化物26(0.076mmol,1.0当量)、[2-(2-氨基苯基)苯基]钯(1 );双(1-金刚烷基)-丁基-膦甲磺酸盐(8μmol,0.10当量)、磷酸钾(0.23mmol,3.00当量)用氮气吹扫3次,并在90℃下搅拌2小时。在此时间后,过滤混合物,浓缩,并且然后通过制备型tlc(sio2,石油醚∶乙酸乙酯60%)纯化残余物,以得到r
1-铃木偶联产物28-boc,其被用于下一步骤。
[0899]
步骤2:向在二氯甲烷(2.0ml)中的n-[[4-氧代-7-(r1)-3h-酞嗪-1-基]甲基]氨基甲酸叔基酯铃木偶联产物28-boc(30.0mg)的溶液中加入三氟乙酸(0.2ml)。将混合物在25℃下搅拌0.5小时,并且在完成后在减压下浓缩成残余物。根据纯化方法4-1至4-13之一,通过制备型hplc来纯化浓缩的残余物29。
[0900]
纯化方法(pm)
[0901]
pm 4-1:柱:phenomenex synergi c18 150
×
25mm
×
10μm;流动相:[水(0.05%hcl)-acn];b%:5%-30%,10分钟。
[0902]
pm 4-2:柱:waters xbridge 150
×
25mm
×
5μm;流动相:[水(0.05%氢氧化氨v/v)-acn];b%:5%-40%,10分钟。
[0903]
pm 4-3:柱:waters atlantis t3 150
×
30mm
×
5μm;流动相:[水(0.225%fa)-acn];b%:1%-20%,10分钟。
[0904]
pm 4-4:柱:phenomenex luna c18 150
×
25mm
×
10μm;流动相:[水(0.1%tfa)-acn];b%:1%-30%,10分钟。
[0905]
pm 4-5:柱:phenomenex gemini nx-c18 75
×
30mm
×
3μm;流动相:[水(0.05%氢氧化氨v/v)-acn];b%:5%-40%,7分钟。
[0906]
pm 4-6:柱:phenomenex luna c18 75
×
30mm
×
3μm;流动相:[水(0.05%hcl)-acn];b%:10%-35%,6.5分钟。
[0907]
pm 4-7:柱:xtimate c18 150
×
40mm
×
10μm;流动相:[水(0.05%氢氧化氨v/v)-acn];b%:5%-35%,10分钟。
[0908]
pm 4-8:柱:waters xbridge beh c18 150
×
25mm
×
5μm;流动相:[水(0.05%nh4hco3v/v)-acn];b%:5%-40%,10分钟。
[0909]
pm 4-9:柱:nano-micro kromasil c18 100mm
×
40mm
×
10μm;流动相:[水(0.1%tfa)-acn];b%:1%-40%,8分钟。
[0910]
pm 4-10:sfc(柱:daicel chiralpak ig(250mm
×
30mm,10μm);流动相:[0.1%nh3h2o/meoh];b%:40%等度的,7.8分钟;109分钟)。
[0911]
pm 4-11:sfc(柱:phenomenex-cellulose-2(250mm
×
30mm,10μm);流动相:[0.1%nh3h2o/meoh];b%:50%等度的11.0分钟;95分钟)。
[0912]
pm-4-12:残余物用50%碳酸氢钠(20ml)稀释,并用二氯甲烷(15ml
×
3)提取。合并的有机层用无水硫酸钠干燥,过滤并在减压下浓缩,以得到标题化合物。
[0913]
pm 4-13:柱:welch xtimate c18 150mm
×
25mm
×
5μm;流动相:[水(0.05%hcl)-acn];b%:10%-40%,8分钟。
[0914]
根据一般反应方案的教导、偶联方法4a-g,并使用纯化方法4-1至4-13和本文公开的中间体,如表4所示制备实例4-1至4-252:
[0915]
表4
[0916]
[0917]
[0918]
[0919]
[0920]
[0921]
[0922]
[0923]
[0924]
[0925]
[0926]
[0927]
[0928]
[0929]
[0930]
[0931]
[0932]
[0933]
[0934]
[0935]
[0936]
[0937]
[0938]
[0939]
[0940]
[0941]
[0942]
[0943]
[0944]
[0945]
[0946]
[0947]
[0948]
[0949]
[0950]
[0951]
[0952]
[0953]
[0954]
[0955]
[0956]
[0957]
[0958]
[0959]
[0960]
[0961]
[0962]
[0963]
[0964]
[0965]
[0966]
[0967]
[0968]
[0969]
[0970]
[0971][0972]
实例4-253
[0973][0974]
步骤1:向在二噁烷(4ml)和水(0.80ml)中的中间体an(136mg,315μmol,1.00当量)的溶液中加入pd(dppf)cl2(23mg,32μmol,0.10当量)和碳酸氢钠(79mg,944μmol,37μl,3.00当量),并将反应混合物在80℃下搅拌2小时。在此时间后,过滤反应,将滤液在真空中浓缩成残余物,残余物通过制备型tlc(石油醚:乙酸乙酯10-100%)纯化,以得到作为棕色固体的2-[[4-氧代-7-[5-(2-三甲基甲硅烷基乙炔基)-3-吡啶基]-3h-酞嗪-1-基]甲基]异吲哚啉-1,3-二酮(100mg,209μmol,66%产率)。1h nmr(400mhz,dmso-d6)δ=12.32(s,1h),8.96(d,j=2.4hz,1h),8.55(d,j=2.0hz,1h),8.36-8.31(m,2h),8.14(s,2h),7.79-7.74(m,2h),7.73-7.69(m,2h),5.19(s,2h),0.09(s,9h)。
[0975]
步骤2:向在甲醇(2ml)和二氯甲烷(2ml)中的2-[[4-氧代-7-[5-(2-三甲基甲硅烷基乙炔基)-3-吡啶基]-3h-酞嗪-1-基]甲基]异吲哚啉-1,3-二酮(100mg,209μmol,1.00当量)的溶液中加入氟化钾(36mg,627μmol,14.7μl,3.00当量),并将反应在25℃下搅拌0.5小时。在真空下浓缩反应,并用水(5ml)研磨残余物,过滤,并在真空下干燥滤饼,以得到作为棕色固体的2-[[7-(5-乙炔基-3-吡啶基)-4-氧代-3h-酞嗪-1-基]甲基]异吲哚啉-1,3-二酮(80mg,197μmol,94%产率)。lcms[m 1]
=407.0。
[0976]
步骤3:将将甲胺水溶液(4ml)中的2-[[7-(5-乙炔基-3-吡啶基)-4-氧代-3h-酞嗪-1-基]甲基]异吲哚啉-1,3-二酮(80mg,197μmol,1.00当量)的混合物在60℃下搅拌0.5小时。在此时间后,在真空下浓缩反应,并且将残余物通过制备型hplc(柱:phenomenex synergi c18 150
×
25
×
10μm;流动相:[水(0.05%hcl)-乙腈];b%:0%-25%,10分钟)纯化并冻干,以得到作为黄色固体的4-(氨基甲基)-6-(5-乙炔基-3-吡啶基)-2h-酞嗪-1-酮,实例4-253(10mg,32.1μmol,16%产率)。lcms[m 1
]=277.2.1h nmr(400mhz,dmso-d6)δ=
13.01(s,1h),9.17(d,j=2.4hz,1h),8.81(d,j=1.6hz,1h),8.60-8.49(m,4h),8.41-8.37(m,1h),8.36-8.30(m,2h),4.65-4.55(m,3h)。
[0977]
实例4-254
[0978][0979]
步骤1:将在二氯甲烷(1.00ml)中的4-(氨基甲基)-6-(5-氯-1-甲基-吡唑-4-基)-2h-酞嗪-1-酮的混合物,实例4-49(45mg,155μmol,1.00当量)、二碳酸二叔丁酯(68mg,311μmol,71μl,2.00当量)和三乙胺(47mg,466μmol,65μl,3.00当量)的混合物用氮气吹扫3次,并在25℃下搅拌3小时。在此时间后,将混合物在减压下浓缩成残余物。用石油醚(3ml)研磨混合物并过滤,以得到作为黄色固体的n-[[7-(5-氯-1-甲基-吡唑-4-基)-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(40mg,96μmol,62%产率)。lcms[m 1]
=390.2.1h nmr(400mhz,meod)δ=8.41(d,j=8.4hz,1h),8.33(s,1h),8.19(br d,j=8.4hz,1h),8.05(s,1h),4.62(s,2h),3.96-3.92(s,3h),1.48-1.40(s,9h)。
[0980]
步骤2:将在二噁烷(3ml)和水(0.6ml)中的(4-乙氧基苯基)硼酸(16mg,98.5μmol,1.20当量)、n-[[7-(5-氯-1-甲基-吡唑-4-基)-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(32mg,82μmol,1.00当量)、碳酸钠(26mg,246μmol,3.00当量)和pd(dppf)cl2(6mg,8μmol,0.10当量)的混合物用氮气吹扫3次,并在110℃下搅拌12小时。将混合物在减压下浓缩,并且将残余物通过柱色谱法(sio2,石油醚/乙酸乙酯10-100%)纯化,以得到作为白色固体的n-[[7-[5-(4-乙氧基苯基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(28mg,45μmol,54%产率)。lcms[m 1]
=476.2。
[0981]
步骤3:将在二氯甲烷(3ml)中的n-[[7-[5-(4-乙氧基苯基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(28mg,59μmol,1.00当量)和三氟乙酸(1.08g,9.45mmol,700μl,161当量)的混合物用氮气吹扫3次,并在25℃下搅拌1小时。在此时间后,将混合物在减压下浓缩,并且将残余物通过制备型hplc(phenomenex gemini-nx c18 75
×
30mm
×
3μm;流动相:[水(0.1%tfa)-acn];b%:20%-30%,7分钟)纯化,以得到作为灰白色固体的4-(氨基甲基)-6-[5-(4-乙氧基苯基)-1-甲基-吡唑-4-基]-2h-酞嗪-1-酮,实例4-254(25mg,49μmol,83%产率,tfa盐)。lcms[m 1]
=376.1.1h nmr(400mhz,dmso-d6)δ=12.84(s,1h),8.34(br s,3h),8.12(s,1h),8.07(d,j=8.4hz,1h),7.79(d,j=1.2hz,1h),7.51(dd,j=1.6,8.4hz,1h),7.33(d,j=8.8hz,2h),7.08(d,j=8.8hz,2h),4.31(br d,j=4.4hz,2h),4.11(q,j=6.8hz,2h),3.72(s,3h),1.37(t,j=6.8hz,3h)。
[0982]
实例5-1和5-2
[0983]
用于制备实例5-1和5-2的一般偶联方法
[0984]
偶联方法5:
[0985][0986]
其中r1=环烷基或杂环烷基
[0987]
步骤1:将在二甲基亚砜(2.5ml)中的中间体f(200mg,521μmol,1.00当量)、r
1a-硼酸17(其中r
1a
是环烯基或杂环烯基)(781μmol,1.50当量)、二叔丁基(环戊基)膦;二氯钯;铁(34mg,52μmol,0.10当量)、磷酸钾(221mg,1.04mmol,2.00当量)的混合物用氮气吹扫3次,并将混合物在80℃下搅拌1小时并冷却至室温。然后加入水(50ml),并用乙酸乙酯(40ml x3)提取混合物。合并的有机提取物用盐水(50ml)洗涤,用无水硫酸钠干燥,过滤,并在真空中浓缩,并且将残余物通过柱色谱法(sio2,二氯甲烷/甲醇0-10%甲醇)纯化,以得到作为淡黄色固体的相应的偶联产物18。
[0988]
步骤2:向在甲醇(6ml)的相应偶联产物18(296μmol,1.00当量)的溶液中加入10%活性炭载钯(10mg)。用氢气吹扫混合物几次,并在25℃下在氢气气氛(15psi)下搅拌5小时。在此时间后,过滤并浓缩反应混合物,以得到作为白色固体的相应的还原产物19,其被用于下一步骤而无需进一步纯化。
[0989]
步骤3:将在乙醇(5ml)中的相应的还原产物19和水合肼(27mg,536μmol,26μl)的混合物在80℃下搅拌1小时。蒸发反应混合物,并且将残余物通过制备型hplc(phenomenex synergi c18 150
×
25
×
10μm;流动相:[水(0.05%hcl)-acn];b%:16%-36%,9分钟)纯化,以得到所需的r1氨基化合物,其中r1是环烷基或杂环烷基。
[0990]
按照一般反应方案的教导、偶联方法5和本文公开的中间体,如表5所示制备实例5-1至5-2:
[0991]
表5
[0992][0993]
实例6-1至6-5的制备
[0994]
实例6-1
[0995][0996]
步骤1:将在dmf(5ml)中的中间体an(86mg,200μmol,1.00当量)、咪唑(68mg,1.00mmol,5.00当量)、氯(羟基)铜-n,n,n',n'-四甲基乙烷-1,2-二胺(9mg,20μmol,0.10当量)和分子筛(10mg)脱气,并用氧气吹扫3次。然后在氧气气氛(15psi)下,将混合物在25℃下搅拌12小时。在此时间后,过滤混合物并在减压下浓缩,并且将残余物通过制备型hplc(phenomenex synergi c18 150
×
25
×
10μm;流动相:[水(0.225%fa)-acn];b%:3%-33%,10分钟)纯化,以得到作为白色固体的2-[(7-咪唑-1-基-4-氧代-3h-酞嗪-1-基)甲基]异吲哚啉-1,3-二酮(4mg,10.8μmol,5%产率)。lcms[m 1]
=372.1
[0997]
步骤2:向在乙醇(1.00ml)中的2-[(7-咪唑-1-基-4-氧代-3h-酞嗪-1-基)甲基]异吲哚啉-1,3-二酮(3mg,8μmol,1.00当量)的溶液中加入水合肼(4mg,81μmol,3μl,10.0当量),将混合物在80℃下搅拌1小时,然后在减压下浓缩。然后浓缩的残余物通过制备型hplc(phenomenex synergi c18 150
×
25
×
10μm;流动相:[水(0.05%hcl)-acn];b%:0%-20%,9分钟)纯化,以得到作为灰白色固体的4-(氨基甲基)-6-咪唑-1-基-2h-酞嗪-1-酮,实例6-1(1.4mg,5μmol,61%产率)。lcms[m 1]
=242.1.1h nmr(400mhz,dmso-d6)δ=13.12(s,1h),9.71-9.57(s,1h),8.70-8.61(brs,3h),8.49(d,j=8.8hz 1h),8.47(s,1h),8.44(s,1h),8.33(dd,j=2.0,8.8hz,1h),7.77(br s,1h),4.53(br d,j=5.6hz,2h)。
[0998]
实例6-2
[0999][1000]
步骤1:在氮气氛下,向在甲苯(2ml)中的中间体g(50mg,130μmol,1.00当量)和丙-1-胺(9mg,156μmol,13μl,1.20当量)的溶液中加入pd2(dba)3(24mg,26μmol,0.20当量)、叔丁醇钾(29mg,260μmol,2.00当量)和brettphos(140mg,260μmol,2.00当量)。将混合物在100℃下搅拌12小时。在此时间后,在真空中浓缩混合物,并将残余物溶解在水:甲醇2:1混合物(3ml)中并过滤。在真空中浓缩滤液,以得到作为黄色固体的2-[[4-氧代-6-(丙基氨基)-3h-酞嗪-1-基]甲基氨基甲酰基]苯甲酸(35mg,粗品),其被用于下一步骤而无需进一步纯化。lcms[m 1]
=381.1。
[1001]
实例6-3
[1002][1003]
步骤1:向在dme(3ml)中的中间体g(200mg,521μmol,1.00当量)和苯胺(58mg,624μmol,57.0μl,1.20当量)的溶液中加入碳酸铯(678mg,2.08mmol,4.00当量)、pd2(dba)3(48mg,52μmol,0.10当量)和xantphos(331mg,572μmol,1.10当量)。将混合物在氮气气氛下在95℃下搅拌12小时。在此时间后,在真空中浓缩混合物,并将残余物溶解在水(5ml)和甲醇(5ml)中,然后过滤。在真空中浓缩滤液,以得到作为黄色固体的2-[(6-苯胺基-4-氧代-3h-酞嗪-1-基)甲基氨基甲酰基]苯甲酸(200mg,粗品),其被用于下一步骤而无需进一步纯化。
[1004]
步骤2:向在乙醇(1ml)中的2-[(6-苯胺基-4-氧代-3h-酞嗪-1-基)甲基氨基甲酰基]苯甲酸(50mg,粗品)的溶液中加入水合肼(12.9mg,252μmol,12.5l)。将混合物在80℃下搅拌12小时。在此时间之后,在真空中浓缩混合物,并且将残余物通过制备型hplc(phenomenex synergi c18 150
×
25
×
10μm;流动相:[水(0.05%hcl)-acn];b%:2%-32%,10分钟)纯化,以得到作为黄色固体的4-(氨基甲基)-7-苯胺基-2h-酞嗪-1-酮,实例6-3(10mg,33μmol,24%产率)。lcms[m 1]
=267.0.1h nmr(400mhz,dmso-d6)δ=12.63(s,1h),9.17(s,1h),8.43(br s,3h),7.82(d,j=8.8hz,1h),7.77(d,j=2.4hz,1h),7.52(dd,j=2.4,8.8hz,1h),7.42-7.36(m,2h),7.28-7.23(m,2h),7.07(t,j=7.2hz,1h),4.37(br s,2h)。
[1005]
实例6-4
23%,9分钟)纯化,以得到作为白色固体的4-(氨基甲基)-6-吗啉代-2h-酞嗪-1-酮,实例6-5(9mg,28μmol,32%产率)。lcms[m 1]=261.0.1h nmr(400mhz,dmso-d6)δ=12.56(s,1h),8.50(br s,3h),8.08(d,j=9.2hz,1h),7.51(dd,j=2.4,9.2hz,1h),7.09(d,j=2.4hz,1h),4.38(q,j=5.6hz,2h),3.79-3.76(m,4h),3.47-3.41(m,4h)。
[1011]
用于制备实例7-1至7-6的一般偶联方法和纯化方法
[1012]
一般方法7
[1013][1014]
r2=o-芳基或o-杂芳基并且hal=cl、br、i
[1015]
步骤1:将在二噁烷(1ml)和水(0.2ml)中的中间体an(150mg,348μmol,1.00当量)、5-溴吡啶-3-醇(522μmol,1.5当量)、pd(dppf)cl2(26mg,35μmol,0.10当量)、碳酸氢钠(58mg,696μmol,27μl,2.00当量)的混合物脱气并用氮气吹扫3次。将混合物在氮气气氛下在80℃下搅拌3小时。在完成后,用水(30ml)稀释反应混合物,并用乙酸乙酯(30ml
×
3)提取。过滤水相,并将滤饼干燥,以得到相应的r
2-吡啶基-铃木偶联产物28-oh,其被用于下一步骤而无需进一步纯化。
[1016]
步骤2:向在dmf(1ml)中的吡啶基-铃木偶联产物28-oh(80mg,粗品)的溶液中加入碳酸钾(83mg,602μmol)和芳基/杂芳基取代的氟化物/溴化物26(54mg,402μmol)。将混合物在120℃下搅拌6小时,以得到r
2-吡啶基-snar偶联产物28。反应混合物被直接用于下一步骤而无需进一步纯化。
[1017]
步骤3:向在乙醇(10ml)中的相应的r
2-吡啶基-snar偶联产物28(50mg,粗品)的溶液中加入水合肼(11.0mg,210μmol,10μl)。混合物在80℃下搅拌2小时,并将冷却的混合物在真空中浓缩。根据纯化方法7-1至7-3之一,通过制备型hplc来纯化浓缩的残余物29,以返回表7所示的所需化合物。
[1018]
纯化方法(pm)
[1019]
pm 7-1:柱:phenomenex synergi c18 150
×
25mm
×
10μm;流动相:[水(0.05%hcl)-acn];b%:5%-25%,11分钟。
[1020]
pm 7-2:柱:waters xbridge 150
×
25mm
×
5μm;流动相:[水(10mm nh4hco3)-acn];b%:2%-32%,10分钟,
[1021]
pm 7-3:柱:shim-pack c18 150
×
25mm
×
10μm;流动相:[水(0.1%tfa)-acn];b%:1%-20%,10分钟。
[1022]
按照一般反应方案的教导、偶联方法7并使用纯化方法7-1至7-3和本文公开的中间体,如表7所示制备实例7-1至7-6。
[1023]
表7
[1024]
[1025][1026]
用于制备实例8-1至8-9的偶联方法(cm)和纯化方法
[1027]
cm 8a
[1028][1029]
步骤1:将在二甲基甲酰胺(2ml)中的中间体cb(100mg,217μmol,1.00当量)、合适的芳基/杂芳基硼酸酯(260μmol,1.20当量)、碳酸铯(141mg,434μmol,2.00当量)和pd(dppf)cl2(16.0mg,22μmol,0.10当量)的混合物用氮气吹扫3次,并在80℃下搅拌1小时。在完成后,将反应混合物倾入水(50ml)中,过滤并在减压下将滤饼干燥,以得到作为黄色固体的适当的r
2-吡啶基偶联产物84(113mg,粗品),其被用于下一步骤而无需进一步纯化。
[1030]
步骤2:向在乙醇(10ml)中的84(63mg,粗品)的溶液中加入水合肼(13mg,251μmol,12μl)。在35℃下将混合物搅拌1小时,并且在完成后用盐酸(1m,1ml)将混合物的ph调节至1,并在减压下浓缩。残余物用盐酸(1m,40.0ml)稀释,并用乙酸乙酯(30ml
×
3)洗涤,并且将水相在减压下浓缩。根据纯化方法8-1或8-2之一,通过制备型hplc来纯化残余物,以得到所需的化合物85。
[1031]
cm 8b
[1032][1033]
r2=芳基或杂芳基并且hal=cl、br或i
[1034]
步骤1:将在二噁烷(5ml)中的中间体cb(300mg,650μmol,1.00当量)、4,4,5,5-四甲基-2-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-1,3,2-二氧硼杂环戊烷(bpd)(198mg,780μmol,1.20当量)、pd(dppf)cl2(47mg,65μmol,0.10当量)和乙酸钾(128mg,1.30mmol,2.00当量)的混合物脱气,并用氮气吹扫3次,并且在氮气气氛下在100℃下搅拌2小时,以提供[5-[4-[(1,3-二氧代异吲哚啉-2-基)甲基]-1-氧代-2h-酞嗪-6-基]-3-吡啶基]硼酸89。反应混合物被直接用于下一步骤。lcms[m 1]
=427.2。
[1035]
步骤2:将在二噁烷(4ml)和水(0.8ml)中的[5-[4-[(1,3-二氧代异吲哚啉-2-基)甲基]-1-氧代-2h-酞嗪-6-基]-3-吡啶基]硼酸(130mg,305μmol,1.00当量)、适当的r2溴化物42(610μmol,2.00当量)、pd(dppf)cl2(22mg,31μmol,0.10当量)、碳酸氢钠(51mg,610μmol,24μl,2.00当量)的混合物脱气并用氮气吹扫3次,并且在氮气气氛下在80℃下搅拌0.5小时。在完成后,在减压下浓缩反应混合物,以得到残余物,该残余物通过柱色谱法(sio2,石油醚/乙酸乙酯10∶1至0∶1,然后二氯甲烷/甲醇10/1)纯化,以得到作为黑色固体的r
2-吡啶基偶联产物84(150mg,粗品)。
[1036]
步骤3:向在乙醇(3.0ml)中的r
2-吡啶偶联产物84(109mg,215μmol,1.00当量)的溶液中加入水合肼(110mg,2.15mmol,106μl,10.0当量)。将反应混合物在25℃下搅拌1小时。在完成后,将反应混合物在减压下浓缩,以得到残余物。残余物用盐酸(1m,2ml)酸化至ph 3,并用乙酸乙酯(2ml
×
3)提取。水相在减压下浓缩,以得到残余物。根据纯化方法8-1或8-2之一,通过制备型hplc来纯化残余物,以得到作为灰白色固体的所需化合物85。
[1037]
纯化方法
[1038]
pm 8-1:柱:phenomenex luna c18 75
×
30mm
×
3μm;流动相:[水(0.05%hcl)-acn];b%:10%-35%,6.5分钟。
[1039]
pm 8-2:柱:phenomenex luna c18 150
×
25mm
×
10μm;流动相:[水(0.1%tfa)-acn];b%:10%-40%,10分钟。
[1040]
按照一般反应方案的教导、偶联方法8a和8b并使用本文公开的纯化方法8-1和8-2和中间体,如表8所示制备实例8-1至8-9。
[1041]
表8
[1042]
[1043]
[1044][1045]
实例9-1至9-3的制备
[1046]
实例9-1
[1047][1048]
步骤1:在0℃下,在乙醇(150ml)中的硼氢化钠(382mg,10.1mmol,2.60当量)的搅拌溶液用7-溴-4-氧代-3h-酞嗪-1-羧酸甲酯11c(1.10g,3.89mmol,1.00当量)处理,然后滴加在乙醇(150ml)中的氯化钙(518mg,4.66mmol,1.20当量)的溶液。在0℃下继续搅拌额外3小时,然后在20℃下搅拌1小时。在此时间后,反应混合物在减压下浓缩,并且残余物用水(30ml)稀释,并用1n盐酸(5ml)调节至ph 5。过滤所得的固体,并用水(5ml
×
3)洗涤,然后用乙醇(20ml)研磨,以得到作为白色固体的6-溴-4-(羟甲基)-2h-酞嗪-1-酮12c(990mg,3.88mmol,100%产率)。
[1049]
步骤2:向在dce(10ml)中的6-溴-4-(羟甲基)-2h-酞嗪-1-酮12c(300mg,1.18mmol,1.00当量)的溶液中加入二氧化锰(1.02g,11.8mmol,10.0当量)并将混合物在80℃下搅拌12小时。在此时间后,过滤反应混合物,并且在减压下浓缩滤液以得到残余物。残余物通过柱色谱法(sio2,石油醚:乙酸乙酯10:1至1:1)纯化,以得到作为白色固体的7-溴-4-氧代-3h-酞嗪-1-甲醛101(73mg,288μmol,25%产率)。1h nmr(400mhz,dmso-d6)δ=13.66(br s,1h),9.82(s,1h),9.05(d,j=2.0hz,1h),8.22-8.18(d,j=8.4hz,1h),8.10(dd,j=2.0,8.4hz,1h)。
[1050]
步骤3:向在thf(50ml)中的7-溴-4-氧代-3h-酞嗪-1-甲醛101(300mg,1.19mmol,1.00当量)的溶液中加入异丙醇钛(674mg,2.37mmol,700μl,2.00当量)和2-甲基丙烷-2-亚
磺酰胺(216mg,1.78mmol,1.50当量)并将混合物在60℃下搅拌12小时。在此时间后,用水(1ml)淬灭反应混合物,并过滤所得的固体。用硫酸钠干燥滤液,过滤并浓缩,以得到残余物。残余物通过柱色谱法(sio2,石油醚/乙酸乙酯=5/1至1/1)纯化,以得到作为白色固体的n-[(7-溴-4-氧代-3h-酞嗪-1-基)亚甲基]-2-甲基-丙烷-2-亚磺酰胺102(100mg,171μmol,14%产率)。lcms[m 1]
=358.1.1h nmr(400mhz,dmso-d6)δ=13.58(br s,1h),9.32(d,j=2.0hz,1h),8.37(s,1h),8.23(d,j=8.4hz,1h),8.12-8.10(dd,j=2.0,8.4hz,1h),1.26(s,9h)。
[1051]
步骤4:在-78℃下,向在thf(5ml)中的n-[(7-溴-4-氧代-3h-酞嗪-1-基)亚甲基]-2-甲基-丙烷-2-亚磺酰胺102(100mg,281μmol,1.00当量)的溶液中滴加甲基溴化镁(3m,281μl,3.00当量)。然后将反应混合物在-78℃下搅拌2小时。在此时间后,用水(2ml)稀释反应混合物,并用乙酸乙酯(2ml
×
3)提取。合并的有机部分用盐水(2ml)洗涤,用无水硫酸钠干燥,过滤并浓缩,以得到残余物。残余物通过制备型tlc(石油醚/乙酸乙酯=10/1)纯化,以得到作为黄色固体的n-[1-(7-溴-4-氧代-3h-酞嗪-1-基)乙基]-2-甲基-丙烷-2-亚磺酰胺103(40mg,98.2μmol,35%产率)。lcms[m 1]
=374.2。
[1052]
步骤5:将在水(0.2ml)和二噁烷(1ml)中n-[1-(7-溴-4-氧代-3h-酞嗪-1-基)乙基]-2-甲基-丙烷-2-亚磺酰胺103(35mg,94μmol,1.00当量)、1-甲基-5-苯基-4-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑104(35mg,122μmol,1.30当量)、pd(dppf)cl2(7mg,9μmol,0.10当量)、碳酸钠(20mg,188μmol,2.00当量)的混合物脱气并用氮气吹扫3次,然后在80℃下搅拌2小时。在此时间后,用水(2ml)稀释反应混合物,并用乙酸乙酯(2ml
×
3)提取,并且合并的有机相用盐水(2ml)洗涤,用无水硫酸钠干燥,过滤并浓缩,以得到残余物。残余物通过制备型tlc(石油醚:乙酸乙酯1:1)纯化,以得到作为棕色油状物的2-甲基-n-[1-[7-(1-甲基-5-苯基-吡唑-4-基)-4-氧代-3h-酞嗪-1-基]乙基]丙烷-2-亚磺酰胺105(40mg,60μmol,63%产率)。lcms[m 1]
=450.4。
[1053]
步骤6:将2-甲基-n-[1-[7-(1-甲基-5-苯基-吡唑-4-基)-4-氧代-3h-酞嗪-1-基]乙基]丙烷-2-亚磺酰胺105(36mg,80μmol,1.00当量)和盐酸/二噁烷(4m,9ml)在25℃下搅拌1小时。反应混合物在减压下浓缩,以得到残余物。残余物通过制备型hplc(phenomenex luna c18 75
×
30mm
×
3μm;流动相:[水(0.05%盐酸)-acn];b%:12%-32%,6.5分钟)纯化,以得到作为白色固体的4-(1-氨基乙基)-6-(1-甲基-5-苯基-吡唑-4-基)-2h-酞嗪-1-酮,实例9-1(7mg,19μmol,23%产率,hcl)。lcms[m 1]
=346.1.1h nmr(400mhz,meod)δ=8.30(d,j=8.4hz,1h),8.13(s,1h),7.91(dd,j=1.6,8.4hz,1h),7.66-7.60(m,3h),7.55(d,j=1.6hz,1h),7.50-7.45(m,2h),4.66-4.53(m,1h),3.81(s,3h),1.32(d,j=6.8hz,3h)。
[1054]
实例9-2和9-3
[1055][1056]
步骤1:将在二噁烷(10ml)中的(r)-n-(1-(7-溴-4-氧代-3,4-二氢酞嗪-1-基)乙基)-2-甲基丙烷-2-亚磺酰胺103(410mg,1.10mmol,1.00当量)、4,4,5,5-四甲基-2-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-1,3,2-二氧硼杂环戊烷(839mg,3.30mmol,3.00当量)、pd(dppf)cl2(81mg,0.11mmol,0.10当量)和乙酸钾(324mg,3.30mmol,3.00当量)的混合物脱气并用氮气吹扫3次,然后将混合物在氮气气氛下在100℃下搅拌0.5小时。反应混合物在减压下浓缩,以得到残余物。残余物用石油醚(40ml)研磨,以得到作为灰色固体的(r)-2-甲基-n-(1-(4-氧代-7-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-3,4-二氢酞嗪-1-基)乙基)丙烷-2-亚磺酰胺(724mg,粗品),其被用于下一步骤而无需进一步纯化。lcms[m-81]-=338.2。
[1057]
步骤2:将在二噁烷(10ml)和水(2ml)中的(r)-2-甲基-n-(1-(4-氧代-7-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-3,4-二氢酞嗪-1-基)乙基)丙烷-2-亚磺酰胺(670mg,1.60mmol,1.00当量)、2-(4-溴-2-甲基-吡唑-3-基)-6-氯-苄腈(308mg,1.04mmol,0.65当量)、二叔丁基(环戊基)膦;二氯钯;铁(104mg,0.160mmol,0.10当量)、碳酸钠(339mg,3.20mmol,2.00当量)的混合物脱气并用氮气吹扫3次,然后将混合物在氮气气氛下在80℃下搅拌0.5小时。用水(200ml)稀释反应混合物,并用乙酸乙酯(150ml
×
3)提取。合并的有机层用盐水(100ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩,以得到残余物。残余物通过柱色谱法(sio2,石油醚:乙酸乙酯=1:1至0:1,二氯甲烷:甲醇=10:1)纯化,以得到作为棕色固体的(r)-n-(1-(7-(5-(3-氯-2-氰基苯基)-1-甲基-1h-吡唑-4-基)-4-氧代-3,4-二氢酞嗪-1-基)乙基)-2-甲基丙烷-2-亚磺酰胺(281mg,0.552mmol,34%产率)。lcms[m 1]
=509.2。
[1058]
步骤3:向在盐酸/二噁烷(4.00m,5.4ml)中的(r)-n-(1-(7-(5-(3-氯-2-氰基苯基)-1-甲基-1h-吡唑-4-基)-4-氧代-3,4-二氢酞嗪-1-基)乙基)-2-甲基丙烷-2-亚磺酰胺(140mg,0.275mmol,1.00当量)的溶液中,并将混合物在15℃下搅拌0.5小时。反应混合物在减压下浓缩,以得到残余物。残余物通过制备型hplc(phenomenex luna c18 75
×
30mm
×
3mm;流动相:[水(0.05%hcl)-acn];b%:12%-32%,7分钟)纯化,以得到作为黄色固体的2-[4-[4-(1-氨基乙基)-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]-6-氯-苄腈(40mg,0.097mmol,36%产率)。lcms[m 1]
=405.1;1h nmr(400mhz,cd3od)δ=8.33-8.23(m,1h),8.13(d,j=4.4hz,1h),8.02-7.84(m,2h),7.82-7.66(m,2h),7.64-7.57(m,1h),4.87(br s,1h),3.83(d,j=2.8hz,3h),1.54-1.41(m,3h)。
[1059]
步骤4:通过以下来分离对映异构体:手性sfc(daicel chiralpak ic(250mm
×
30mm,10μm);流动相:[0.1%nh4oh/etoh];b%:50%-50%,4.2分钟;46分钟),然后是手性sfc chiralpak ic-3(50
×
4.6mm i.d.,3μm);流动相:用于co2的a相,和用于etoh(0.05%dea)的b相;梯度洗脱:50%etoh(0.05%dea),co2流量:3ml/min;检测器:pda;柱温:35℃;背压:100巴,以得到峰1,作为黄色固体的实例9-2(11mg,0.025mmol,30%产率)和峰2,作为灰白色固体的实例9-3(18mg,0.444mmol,50%产率)。将每个实例转化为hcl盐。实例9-2,峰1,单一对映异构体,立体化学未指定:lcms[m 1]=405.1;1h nmr(400mhz,cd3od)δ=8.31(t,j=8.4hz,1h),8.12(d,j=6.4hz,1h),7.92-7.87(m,2h),7.80-7.67(m,3h),4.88-4.84(m,1h),3.83(d,j=1.2hz,3h),1.51-1.43(m,3h)。实例9-3,峰2,单一对映异构体,立体化学未指定:lcms[m 1]=405.1;1h nmr(400mhz,cd3od)δ=8.29(dd,j=8.2,10.4hz,1h),8.13(d,j=7.6hz,1h),7.90-7.85(m,2h),7.79-7.60(m,3h),4.91-4.85(m,1h),3.82(d,j=2.8hz,3h),1.52-1.41(m,3h)。
[1060]
实例9-4和9-5
[1061][1062]
步骤1:将在二噁烷(4ml)和水(0.8ml)中的2-[2-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑-3-基]萘-1-甲腈(80mg,0.222mmol,1.00当量)、n-[1-(7-溴-4-氧代-3h-酞嗪-1-基)乙基]-2-甲基-丙烷-2-亚磺酰胺(100mg,0.267mmol,1.20当量)、二叔丁基(环戊基)膦-二氯钯-铁(29mg,0.044mmol,0.20当量)、磷酸钾(142mg,0.668mmol,3.00当量)的混合物脱气,并用氮气吹扫,然后在100℃下搅拌1小时。在此时间后,反应混合物在减压下浓缩,并且将残余物通过制备型hplc(phenomenex synergi c18 150
×
30mm
×
4μm;流动相:[水(0.1%tfa)-acn];b%:35%-64%,11分钟)纯化,以得到作为白色固体的n-[1-[7-[5-(1-氰基-2-萘基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]乙基]-2-甲基-丙烷-2-亚磺酰胺(48mg,0.091mmol,41%产率)。lcms[m 1]
=525.2。
[1063]
步骤2:将在hcl/二噁烷(1ml,4m)和甲醇(1ml)中的n-[1-[7-[5-(1-氰基-2-萘基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]乙基]-2-甲基-丙烷-2-亚磺酰胺(40.mg,0.076mmol,1.00当量)的混合物在20℃下搅拌1小时。浓缩反应混合物,以得到作为白色固体的2-[4-[4-(1-氨基乙基)-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]萘-1-甲腈
(30mg,粗品),其被用于下一步骤而无需进一步纯化。lcms[m 1]
=421.2。
[1064]
步骤3:sfc纯化,chiralpak ig-34.6mm,3μm流动相:a:co2b:乙醇(0.05%dea)等度的:40%b。流量:4ml/min。柱温度35℃。abpr 1500psi得到峰1,实例9-4,作为白色固体的2-[4-[4-(1-氨基乙基)-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]萘-1-甲腈(12mg,29μmol,33%产率),1h nmr(400mhz,dmso-d6)δ=12.42(br s,1h),8.59-8.50(m,1h),8.30-8.22(m,2h),8.20-8.09(m,2h),7.78-7.54(m,5h),3.95
–
3.70(m,4h),0.50
–
0.80(m,3h);和峰2,实例9-5和作为白色固体的2-[4-[4-(1-氨基乙基)-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]萘-1-甲腈(12mg,29μmol,33%产率),1h nmr(400mhz,dmso-d6)δ=12.41(br s,1h),8.60-8.50(m,1h),8.30-8.23(m,2h),8.19-8.09(m,2h),7.92-7.54(m,6h),3.90
–
3.70(m,4h),0.83-0.55(m,3h)。
[1065]
实例9-6和9-7
[1066][1067]
步骤1:向在thf(2.0ml)中的n-[(7-溴-4-氧代-3h-酞嗪-1-基)亚甲基]-2-甲基-丙烷-2-亚磺酰胺(276mg,0.775mmol,1.00当量)和二氟甲基(三甲基)硅烷(289mg,2.32mmol,3.00当量)的溶液中加入叔丁醇钾(1m,2.3ml,3.00当量),并将混合物在-78℃下搅拌12小时。然后用水(2ml)淬灭反应混合物,并用乙酸乙酯(2ml
×
3)提取。然后用盐水(2ml)洗涤合并的有机相,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过制备型tlc(sio2,二氯甲烷:甲醇10:1)纯化,以得到作为黑色固体的n-[1-(7-溴-4-氧代-3h-酞嗪-1-基)-2,2-二氟-乙基]-2-甲基-丙烷-2-亚磺酰胺(107mg,0.182mmol,24%产率)。lcms[m 1]
=410.1;1h nmr(400mhz,cdcl
3-d)δ=10.58-10.26(m,1h),8.29-8.22(m,1h),8.06(s,1h),7.93-7.86(m,1h),6.22-5.86(m,1h),4.72(d,j=7.2hz,1h),1.30(s,9h)。
[1068]
步骤2:将在二噁烷(1.0ml)中的n-[1-(7-溴-4-氧代-3h-酞嗪-1-基)-2,2-二氟-乙基]-2-甲基-丙烷-2-亚磺酰胺(97mg,0.238mmol,1.00当量)、双(频哪醇基)二硼(78mg,0.309mmol,1.30当量)、pd(dppf)cl2(17mg,0.024mmol,0.10当量)、乙酸钾(67mg,0.713mmol,3.00当量)的混合物脱气并用氮气吹扫3次,然后在100℃下搅拌1小时。然后在减压下浓缩混合物,以得到作为黑色固体的[4-[1-(叔丁基亚磺酰氨基)-2,2-二氟-乙基]-1-氧代-2h-酞嗪-6-基]硼酸(100mg,粗品)。lcms[m 1]
=374.1。
[1069]
步骤3:将在二噁烷(3.0ml)和水(0.6ml)中的[4-[1-(叔丁基亚磺酰氨基)-2,2-二氟-乙基]-1-氧代-2h-酞嗪-6-基]硼酸(100mg,粗品)、2-(4-溴-2-甲基-吡唑-3-基)萘-1-甲腈(77mg,0.247mmol)、碳酸氢钠(62mg,0.740mmol)、二叔丁基(环戊基)膦的;二氯钯;铁(16mg,0.024mmol,0.10当量)的混合物脱气并用氮气吹扫3次,然后在氮气气氛下在100℃下搅拌2小时。然后在减压下浓缩混合物,并且将残余物通过制备型tlc(二氯甲烷:甲醇10:1)纯化,以得到作为黄色固体的n-[1-[7-[5-(1-氰基-2-萘基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]-2,2-二氟-乙基]-2-甲基-丙烷-2-亚磺酰胺(36mg,0.037mmol,15%产率)。lcms[m 1]
=561.2。
[1070]
步骤4:将在盐酸/二噁烷(1.0ml)中的n-[1-[7-[5-(1-氰基-2-萘基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]-2,2-二氟-乙基]-2-甲基-丙烷-2-亚磺酰胺(30mg,0.053mmol,1.00当量)的混合物脱气并用氮气吹扫3次,并将混合物在0℃下搅拌2小时。然后浓缩混合物,并且将残余物通过制备型hplc(phenomenex luna c18 75
×
30mm
×
3mm;流动相:[水(0.05%盐酸)-acn];b%:18%-38%,7分钟)纯化,然后用sfc(daicel chiralpak ig(250
×
30mm,10mm);流动相:[流动相:a:co2b:acn/etoh(0.1%nh3·
水)]等度60%,50分钟)进一步分离,以得到实例9-6,作为棕色固体的2-[4-[4-[(1s)-1-氨基-2,2-二氟-乙基]-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]萘-1-甲腈(5.2mg,0.011mmol,21%产率)和实例9-7,作为棕色固体的2-[4-[4-[(1r)-1-氨基-2,2-二氟-乙基]-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]萘-1-甲腈(4.3mg,0.009mmol,17%产率)。实例9-6:lcms[m 1]
=457.1;1h nmr(400mhz,dmso-d6)δ=12.61(br d,j=3.6hz,1h),8.53(dd,j=8.8,10.4hz,1h),8.29(s,1h),8.27(d,j=7.6hz,1h),8.14(dd,j=8.2,14.4hz,1h),8.07(dd,j=6.8,8.4hz,1h),7.92-7.74(m,4h),7.63(ddd,j=1.6,8.4,17.2hz,1h),6.14-5.59(m,1h),4.17-3.95(m,1h),3.78(d,j=1.6hz,3h),3.31(br s,2h).1h nmr(400mhz,meod)δ=8.43(dd,j=8.4,18.0hz,1h),8.30-8.11(m,4h),7.89-7.61(m,5h),5.95-5.29(m,1h),4.13-3.98(m,1h),3.84(d,j=2.4hz,3h)。实例9-7:lcms[m 1]
=457.0;1h nmr(400mhz,dmso-d6)δ=12.71-12.36(m,1h),8.58-8.48(m,1h),8.29(s,1h),8.27(d,j=7.6hz,1h),8.14(dd,j=8.0,14.4hz,1h),8.07(dd,j=6.8,8.4hz,1h),7.93-7.74(m,4h),7.63(ddd,j=1.6,8.4,17.2hz,1h),6.10-5.59(m,1h),4.10(q,j=5.6hz,1h),3.78(d,j=1.6hz,3h),3.31(br s,2h).1h nmr(400mhz,meod)δ=8.44(dd,j=8.4,17.6hz,1h),8.29-8.12(m,4h),7.90-7.62(m,5h),5.94-5.36(m,1h),4.12-4.06(m,1h),3.85(d,j=2.4hz,3h)。
[1071]
制备在表10中的实例的偶联方法(cm)和纯化方法(pm)
[1072]
一般偶联方法10a
[1073][1074]
r6=在中间体dk中的ci
[1075]
r6=在中间体dl中的f
[1076]
r6=在中间体dm中的ch3[1077]
r6=在中间体eg中的ch3[1078]
r6=在中间体ex中的och3[1079]
其中r1=芳基或杂芳基并且hal=cl、br、i
[1080]
步骤1:将在二噁烷(1.0ml)和水(0.2ml)中的合适的芳基/杂芳基卤化物26(390μmol,1.5当量)、中间体an(260μmol,1.00当量)、钯催化剂如pd(dppf)cl2、pd(dtbpf)cl2或ad2n-bup)-pd(26.0μmol,0.10当量)、碳酸氢钠(0.521μmol,2.0-3.0当量)的混合物用氮气吹扫3次。在此时间后,将混合物在80℃下搅拌2小时。在此时间后,使用针对cm 10a-1或cm 10a-2所述的方法来纯化混合物,以得到偶联产物15a。
[1081]
步骤2:向在乙醇(1.0ml)中的相应偶联产物15a的溶液中加入水合肼(20当量)。将混合物在80℃下搅拌1小时。在此时间后,在真空中浓缩混合物,并根据纯化方法(pm)4-1至4-13中的一种,通过制备型hplc来纯化残余物。
[1082]
cm 10a-1
[1083]
实例10-1
[1084][1085]
步骤1:将在二噁烷(2.0ml)和水(0.4ml)中的2-((5-氯-4-氧代-7-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-3,4-二氢酞嗪-1-基)甲基)异吲哚啉-1,3-二酮、中间体dk(35mg,0.75mmol,1.00当量)、2-(4-溴-2-甲基-吡唑-3-基)萘-1-甲腈(24mg,0.75mmol,1.00当量)、pd(dtbpf)cl2(4.9mg,0.08mmol,0.10当量)、碳酸氢钠(19mg,0.23mmol,3.00当量)的混合物脱气并用氮气吹扫3次,然后将混合物在80℃下搅拌2小时。然后将混合物在减压下浓缩,并且将残余物通过制备型tlc(sio2,二氯甲烷/甲醇10∶1)纯化,以得到作为黄色固体的2-[4-[8-氯-4-[(1,3-二氧杂异二氢吲哚-2-基)甲基]-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]萘-1-甲腈(20mg,0.035mmol,47%产率)。lcms[m 1]
=571.2。
[1086]
步骤2:将在乙醇(0.8ml)中的2-[4-[8-氯-4-[(1,3-二氧杂异二氢吲哚-2-基)甲基]-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]萘-1-甲腈(15mg,0.026mmol,1.00当量)和水合肼(0.525mmol,25μl,20.0当量)的混合物脱气并用氮气吹扫3次,然后将混合物在80℃下搅拌1小时。然后将混合物浓缩,并且将残余物通过制备型hplc方法pm4-6纯化,以得到作为灰白色固体的2-[4-[4-(氨基甲基)-8-氯-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]萘-1-甲腈,实例10-1(10mg,0.018mmol,69%产率)。
[1087]
cm 10a-2
[1088]
实例10-16
[1089][1090]
步骤1:将在水(0.2ml)和二噁烷(1.0ml)中的4-氯-2-(环丙氧基)-6-(4-碘-2-甲基-吡唑-3-基)苄腈,中间体dk(18mg,0.45mmol,1.00当量)、2-[[5-氯-4-氧代-7-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-3h-酞嗪-1-基]甲基]异吲哚啉-1,3-二酮(25mg,0.54mmol,1.20当量)、碳酸氢钠(11mg,0.13mmol,3.00当量)、[2-(2-氨基苯基)苯基]钯(1 );双(1-金刚烷基)-丁基膦;甲磺酸盐(ad
2 n-bup)-pd(3.3mg,0.005mmol,0.10当量)的混合物脱气并用氮气吹扫3次,然后将混合物在80℃下搅拌2小时。在此时间后,浓缩反应混合物,并且将残余物用乙酸乙酯(30ml)稀释,并用盐水(40ml
×
3)洗涤,用硫酸钠干燥,过滤,浓缩,并且将残余物通过制备型tlc(sio2,石油醚:乙酸乙酯=3:1)纯化,以得到作为黄色固体的4-氯-2-[4-[8-氯-4-[(1,3-二氧杂异二氢吲哚-2-基)甲基]-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]-6-(环丙基)苄腈(20mg,0.032mmol,73%产率)。lcms[m h]
=611.1。
[1091]
步骤2:向在乙醇(2ml)中的4-氯-2-[4-[8-氯-4-[(1,3-二氧杂异二氢吲哚-2-基)甲基]-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]-6-(环丙氧基)苄腈(15mg,0.025mmol,1.00当量)的溶液中加入水合肼(2.5mg,0.049mmol,2.00当量)。将混合物在25℃下搅拌2小时。然后用盐酸(6.0m,0.5ml)将反应混合物的ph调节至ph 7,然后浓缩,并且将残余物通过制备型hplc方法pm 4-6纯化,以得到作为黄色胶状物的2-[4-[4-(氨基甲基)-8-氯-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]-4-氯-6-(环丙氧基)苄腈(3mg,0.005mmol,21%产率,hcl)。
[1092]
按照一般反应方案、一般偶联方法cm 10a-1和cm 10a-2的教导,并使用纯化方法4-4至4-6,实例10-1、实例10-16和本文公开的中间体,如表10所示制备实例10-1至10-20。
[1093]
表10
[1094]
[1095]
[1096]
[1097]
[1098][1099]
实例11-1
[1100][1101]
步骤1:将在二噁烷(3.0ml)和水(0.6ml)中的2-((4-氧代-7-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-3,4-二氢酞嗪-1-基)甲基-d2)异吲哚啉-1,3-二酮,中间体dj(100mg,0.152mmol,1.00当量)、2-(4-溴-2-甲基-吡唑-3-基)-6-氯-苄腈(58mg,0.197mmol,1.30当量)、pd(dtbpf)cl2(10mg,0.015mmol,0.10当量)和碳酸氢钠(38mg,0.455mmol,3.00当量)中的混合物脱气并用氮气吹扫3次,并在80℃下搅拌2小时。在此时间后,浓缩混合物,并且将残余物通过柱色谱法(sio2,石油醚/乙酸乙酯10/1至0/1)纯化,以得到作为黄色固体的2-氯-6-(4-(4-((1,3-二氧杂异二氢吲哚-2-基)甲基-d2)-1-氧代-1,2-二氢酞嗪-6-基)-1-甲基-1h-吡唑-5-基)苄腈(50mg,0.089mmol,59%产率)。lcms[m 1]
=523.1。
[1102]
步骤2:将在乙醇(2ml)中的2-氯-6-(4-(4-((1,3-二氧杂异二氢吲哚-2-基)甲基-d2)-1-氧代-1,2-二氢酞嗪-6-基)-1-甲基-1h-吡唑-5-基)苄腈(50mg,0.089mmol,1.00当量)和水合肼(0.044ml,0.89mmol,10.0当量)的混合物在80℃下在氮气氛下搅拌1小时。在此时间后,在减压下浓缩混合物,并且将残余物通过制备型hplc(phenomenex luna c18 150
×
25mm
×
10mm;流动相:[水(0.1%三氟乙酸)-acn];b%:7%-37%,10分钟)纯化,以得到作为白色固体的2-(4-(4-(氨基甲基-d2)-1-氧代-1,2-二氢酞嗪-6-基)-1-甲基-1h-吡唑-5-基)-6-氯苯腈(31mg,0.059mmol,66%产率)。lcms[m 1]
=393.1;1h nmr(400mhz,dmso-d6)δ=12.88(s,1h),8.34(br s,3h),8.28(s,1h),8.12(d,j=8.4hz,1h),8.00-7.97
(dd,j=1.6,8.4hz,1h),7.97-7.92(t,j=7.2hz,1h),7.79-7.76(m,2h),7.43(dd,j=1.6,8.4hz,1h),3.76(s,3h)。
[1103]
实例11-2
[1104][1105]
按照与实例11-1相同的程序,使用中间体dj(60mg,0.138mol,1.00当量)和中间体dc 2-(4-溴-2-甲基-吡唑-3-基)萘-1-甲腈(56mg,0.18mmol,1.30当量),将2-(4-(4-(氨基甲基-d2)-1-氧代-1,2-二氢酞嗪-6-基)-1-甲基-1h-吡唑-5-基)-1-萘腈,实例11-2作为白色固体制备(19mg,0.046mmol,35%产率)。lcms[m 1]
=409.3;1h nmr(400mhz,dmso-d6)δ=12.85(s,1h),8.53(d,j=8.4hz,1h),8.33-8.27(m,4h),8.14(d,j=8.0hz,1h),8.00(d,j=8.0hz,1h),7.92-7.82(m,4h),7.32(dd,j=1.6,8.0hz,1h),3.78(s,3h)。
[1106]
实例12-1
[1107][1108]
步骤1:将在二噁烷(3ml)和水(0.6ml)中的6-(4-溴-2-甲基-吡唑-3-基)-3-氯-2-甲基-苄腈,中间体d-18(200mg,0.64mmol,1.00当量),中间体j(310mg,0.77mmol,1.20当量)、碳酸氢钠(108mg,1.29mmol,2.00当量)和pd(dtbpf)cl2(42mg,0.064mmol,0.10当量)的混合物用氮气脱气,并在80℃下搅拌1小时。在此时间后,将混合物浓缩,并且将残余物通过制备型tlc(sio2,二氯甲烷/甲醇20/1)纯化,以得到作为黄色固体的n-[[7-[5-(4-氯-2-氰基-3-甲基-苯基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯,中间体12-1(150mg,0.30mmol,46%产率)。lcms[m 1]
=505.2。
[1109]
步骤2:向在二氯甲烷(1.5ml)中的((7-(5-(4-氯-2-氰基-3-甲基苯基)-1-甲基-1h-吡唑-4-基)-4-氧代-3,4-二氢酞嗪-1-基)甲基)氨基甲酸叔丁酯(50mg,0.10mmol,1.00当量)的溶液中加入三氟乙酸(0.4ml)。将混合物在25℃下搅拌0.5小时,在真空中浓缩,以得到残余物。残余物通过制备型hplc(phenomenex gemini-nx c18 75
×
30mm
×
3μm;流动相:[水(0.1%tfa)-acn];b%:22%-32%,7分钟)纯化,以得到作为白色固体的6-(4-(4-(氨基甲基)-1-氧代-1,2-二氢酞嗪-6-基)-1-甲基-1h-吡唑-5-基)-3-氯-2-甲基苄腈,实
例12-1(14mg,0.026mol,27%产率)。lcms[m 1]
=405.2;1h nmr(400mhz,dmso-d6)δ=12.87(s,1h),8.55-8.34(br s,3h),8.28(s,1h),8.10(d,j=8.4hz,1h),7.99(d,j=8.4hz,1h),7.81(s,1h),7.61(d,j=8.4hz,1h),7.43(d,j=8.4hz,1h),4.35(br s,2h),3.73(s,3h),2.58(s,3h)。
[1110]
实例12-2
[1111][1112]
步骤1:将在二噁烷(2ml)中的中间体12-1(50mg,0.10mmol,1.00当量)、甲基硼酸(18mg,0.30mmol,3.00当量)、pd(dtbpf)cl2(6.5mg,0.010mmol,0.10当量)和碳酸钾(41mg,0.30mmol,3.00当量)的混合物用氮气脱气,并在100℃下搅拌1小时。在此时间后,将混合物浓缩,并且将残余物通过制备型tlc(sio2,二氯甲烷/甲醇20/1)纯化,以得到作为黄色固体的n-[[7-[5-(2-氰基-3,4-二甲基-苯基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(30mg,0.062mmol,63%产率)。lcms[m 1]
=485.3;1h nmr(400mhz,dmso-d6)δ=10.22(s,1h),8.25(d,j=8.4hz,1h),7.99(s,1h),7.60(s,1h),7.57-7.46(m,2h),7.20(d,j=7.6hz,1h),5.42-5.33(m,1h),3.81(s,3h),3.50(s,2h),2.59(s,3h),2.46(s,3h),1.49(s,9h)。
[1113]
步骤2:向在二氯甲烷(1.5ml)中的n-[[7-[5-(2-氰基-3,4-二甲基-苯基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(30mg,0.062mmol,1.00当量)的溶液中加入三氟乙酸(0.5ml)。将混合物在25℃下搅拌0.5小时,然后在真空中浓缩。所形成的残余物通过制备型hplc(柱:phenomenex luna c18 150
×
25mm
×
10μm;流动相:[水(0.1%tfa)-acn];b%:6%-36%,10分钟)纯化,以得到作为白色固体的6-(4-(4-(氨基甲基)-1-氧代-1,2-二氢酞嗪-6-基)-1-甲基-1h-吡唑-5-基)-2,3-二甲基苄腈,实例12-2(7.8mg,0.016mmol,25%产率)。lcms[m 1]
=385.2;1h nmr(400mhz,dmso-d6)δ=12.84(s,1h),8.32(br s,3h),8.26(s,1h),8.08(d,j=8.4hz,1h),7.74-7.65(m,2h),7.46(d,j=8.0hz,2h),4.26(br d,j=1.2hz,2h),3.70(s,3h),2.48(br s,3h),2.42(s,3h).。
[1114]
实例12-3
[1115][1116]
步骤1:向在thf(5ml)和水(0.5ml)中的n-[[7-[5-(5-氯-2-氰基-3-乙基-苯基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(80mg,0.154mmol,1.00当量)和三乙基硼烷(1.00mol,0.450mmol,3.00当量)的溶液中加入碳酸钾(64mg,0.462mmol,3.00当量)和xphos pd g3(13mg,15μmol,0.10当量)。将混合物在85℃下搅拌8小时,然后浓缩,并将残余物用水(10ml)稀释,并用乙酸乙酯(20ml
×
2)提取。用盐水(20ml)
洗涤合并的有机提取物,用无水硫酸钠干燥,过滤并浓缩,并且将残余物用制备型tlc(sio2,二氯甲烷:甲醇20:1)纯化,以得到作为白色固体的n-[[7-[5-(2-氰基-3,5-二乙基-苯基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(40mg粗品)。lcms[m 1]
=513.5。
[1117]
步骤2:在0℃下在氮气氛下,向在二氯甲烷(2ml)中的n-[[7-[5-(2-氰基-3,5-二乙基-苯基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(40mg,78μmol,1.00当量)的混合物中一次性加入三氟乙酸(0.8ml)。将混合物在20℃下搅拌1小时,然后在减压下浓缩,并且将形成的残余物通过制备型hplc(phenomenex luna c18 150
×
25mm
×
10μm;流动相:[水(0.1%tfa)-acn];b%:17%-47%,10分钟)纯化,并且通过sfc(daicel chiralcel od-h(250mm
×
30mm,5μm);流动相:[0.1%nh3h2o etoh];b%:40%)进一步纯化,以得到作为淡黄色固体的2-[4-[4-(氨基甲基)-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]-4,6-二乙基-苄腈,实例12-3(14mg,34μmol,70%产率)。lcms[m 1]
=413.3;1h nmr(400mhz,cdcl3)δ=8.27(br d,j=8.0hz,1h),7.93(s,1h),7.54(br d,j=8.4hz,1h),7.45(s,1h),7.36(s,1h),7.13(s,1h),3.88(br s,2h),3.82(s,3h),2.91(q,j=8.0hz,2h),2.74(q,j=7.6hz,2h),2.12-1.99(m,2h),1.32(br t,j=7.6hz,3h),1.28-1.23(m,3h)。
[1118]
实例12-4
[1119][1120]
步骤1:将在1,4-二噁烷(10ml)和水(2ml)中的2-(4-溴-2-甲基-吡唑-3-基)-5-氯-苄腈、中间体a-10(300mg,1.01mmol,1.00当量)、2-[[4-氧代-7-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-3h-酞嗪-1-基]甲基]异吲哚啉-1,3-二酮、中间体j(523mg,1.21mmol,1.20当量)、二叔丁基(环戊基)膦-二氯钯铁(66mg,0.101mmol,0.10当量)、碳酸氢钠(170mg,2.02mmol,79μml,2.00当量)的混合物脱气并用氮气吹扫3次,然后在80℃下搅拌2小时。在此时间后,通过加入水(30ml)在20℃下淬灭反应混合物,然后用二氯甲烷(30ml
×
2)提取。合并的有机层用盐水(30ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩,以得到作为棕色液体的5-氯-2-[4-[4-[(1,3-二氧杂异二氢吲哚-2-基)甲基]-1-氧代-2h-酞
嗪-6-基]-2-甲基-吡唑-3-基]苄腈,中间体12-4(300mg,粗品),其被用于下一步骤而无需进一步纯化。lcms[m 1]
=521.1
[1121]
步骤2:将在1,4-二噁烷(4ml)和水(0.4ml)中的4-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)异噻唑(39mg,0.184mmol,1.20当量)、5-氯-2-[4-[4-[(1,3-二氧杂异二氢吲哚-2-基)甲基]-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]苄腈(80mg,0.153mmol,1.00当量)、xphos预催化剂g2(36mg,0.046mmol,0.30当量)和磷酸钾(65mg,0.307mmol,2.00当量)的混合物脱气并用氮气吹扫3次,然后在110℃下搅拌1小时。在此时间后,将反应冷却至室温,用二氯甲烷(20ml)稀释,用水(5ml
×
2)洗涤,并且有机层用无水硫酸钠干燥,过滤并浓缩,以得到作为棕色油状物的2-[4-[4-[4-[(1,3-二氧杂异二氢吲哚-2-基)甲基]-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]-5-异噻唑-4-基-苄腈(66mg,粗品),其被用于下一步骤而无需进一步纯化lcms[m 1]
=570.1。
[1122]
步骤3:向在1,4-二噁烷(5ml)中的2-[4-[4-[(1,3-二氧杂异二氢吲哚-2-基)甲基]-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]-5-异噻唑-4-基-苄腈(60mg,0.105mmol,1.00当量)的溶液中加入水合肼(53mg,1.05mmol,51μl,10当量)。将混合物在20℃下搅拌15小时,然后在减压下浓缩。残余物通过制备型hplc(ymc-actus triart c18150
×
30mm
×
5μm;流动相:[水(0.1%tfa)-acn];b%:17%-43%,11分钟)纯化,以得到作为白色固体的2-[4-[4-(氨基甲基)-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]-5-异噻唑-4-基-苄腈,实例12-4(6mg,14%产率)。lcms[m 1]
=440.0;1h nmr(400mhz,dmso-d6)δ=12.87(s,1h),9.69(s,1h),9.27(s,1h),8.59(d,j=1.6hz,1h),8.37(br d,j=2.0hz,2h),8.40-8.24(m,4h),8.11(d,j=8.4hz,1h),7.89(d,j=8.0hz,1h),7.85-7.78(m,1h),7.45(dd,j=1.6,8.0hz,1h),4.39-4.26(m,2h),3.78(s,3h)。
[1123]
实例12-5
[1124][1125]
实例12-5,2-(4-(4-(氨基甲基)-1-氧代-1,2-二氢酞嗪-6-基)-1-甲基-1h-吡唑-5-基)-5-(1-甲基-1h-吡唑-4-基)苄腈由5-氯-2-[4-[4-[(1,3-二氧杂异二氢吲哚-2-基)甲基]-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]苄腈、中间体12-4和1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑,按照制备实施例12-4,步骤2和3所述的程序,被作为白色固体制备(6mg,13μmol,25%产率)。lcms[m 1]
=437.2.1h nmr(400mhz,cd3od)δ=8.24(s,1h),8.19(s,1h),8.16(d,j=1.6hz,1h),8.12(s,1h),8.09-8.04(m,1h),8.01(s,1h),7.72-7.64(m,3h),3.96(s,3h),3.88(s,2h),3.83(s,3h)。
[1126]
实例12-6
[1127][1128]
步骤1:向在1,4-二噁烷(5ml)和水(1ml)中的2-(4-溴-2-甲基-吡唑-3-基)-4-氯苯腈,中间体a-11(160mg,0.539mmol,1.00当量)、碳酸氢钠(91mg,1.08mmol,41.9ml,2.00当量)和n-[[4-氧代-7-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯,中间体j(281mg,0.701mmol,1.30当量)的溶液中加入二叔丁基(环戊基)膦-二氯钯铁(35mg,54μmol,0.10当量))并将混合物在氮气下在80℃下搅拌2小时。在此时间后,将反应混合物在乙酸乙酯(10ml)与水(10ml)之间分配。分离有机相,用盐水(10ml)洗涤,用无水硫酸钠干燥,过滤并浓缩。残余物通过快速硅胶色谱法(50-100%石油醚:乙酸乙酯梯度)纯化,以得到作为灰色固体的n-[[7-[5-(5-氯-2-氰基-苯基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯,中间体12-6(160mg,0.313mmol,58%产率)。lcms[m 1]
=491.2。
[1129]
步骤2:向在1,4-二噁烷(1.0ml)和水(0.1ml)中的n-[[7-[5-(5-氯-2-氰基-苯基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(50mg,0.102mmol,1.00当量)、碳酸钾(42mg,0.305mmol,3.00当量)和1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡唑(42mg,0.204mmol,2.00当量)的溶液中加入二叔丁基(环戊基)膦二氯钯铁(13mg,20.4μmol,0.20当量),并将混合物在氮气下在80℃下搅拌3小时。在此时间后,将反应冷却至10℃,并通过滤除去盐,并浓缩滤液。残余物通过制备型tlc(sio2,石油醚:乙酸乙酯1:1.5)纯化,以得到作为白色固体的n-[[7-[5-[2-氰基-5-(1-甲基吡唑-4-基)苯基]-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(40mg,64mmol,63%产率)。lcms[m 1]
=537.3。
[1130]
步骤3:向在甲醇(2ml)中的n-[[7-[5-[2-氰基-5-(1-甲基吡唑-4-基)苯基]-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(37mg,63μmol,1.00当量)的溶液中加入在1,4-二噁烷(4m,2ml)中的氯化氢的溶液,并将混合物在25℃下搅拌2小时。在此时间后,浓缩反应混合物,并且将残余物通过制备型hplc(phenomenex synergi c18 150
×
30mm
×
4μm;流动相:[水(0.05%hcl)-acn];b%:15%-35%,9分钟)纯化,以得到作为白
色固体的2-[4-[4-(氨基甲基)-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]-4-(1-甲基吡唑-4-基)苄腈,实例12-6(7mg,16μmmol,23%产率)。lcms[m 1]
=437.2;1h nmr(400mhz,cd3od)δ=8.26(s,1h),8.21-8.13(m,2h),8.09-8.04(m,1h),8.01-7.94(m,2h),7.92-7.87(m,1h),7.74(d,j=1.2hz,1h),7.58-7.55(m,1h),4.38(s,2h),3.96(s,3h),3.85(s,3h)。
[1131]
实例12-7
[1132][1133]
实例12-7,2-(4-(4-氨基甲基)-1-氧代-1,2-二氢酞嗪-6-基)-1-甲基-1h-吡唑-5-基)-4-(异噻唑-4-基)苄腈由n-[[7-[5-(5-氯-2-氰基-苯基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁基酯、中间体12-6和4-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)异噻唑,按照用于制备实例12-6,步骤2和3所述的程序,被作为白色固体制备(10mg,23μmol,21%产率)。lcms[m 1]
=440.2.1h nmr(400mhz,cd3od)δ=9.43(s,1h),9.05(s,1h),8.21-8.14(m,4h),8.00(d,j=8.0hz,1h),7.77(d,j=1.2hz,1h),7.58-7.56(m,1h),4.46-4.33(m,2h),3.87(s,3h)。
[1134]
实例12-8
[1135][1136]
步骤1:向在1,4-二噁烷(5ml)和水(1ml)中的n-[[7-[5-(5-氯-2-氰基-苯基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯,中间体12-6(100mg,0.204mmol,1.00当量)、碳酸钾(56mg,0.407mmol,2.00当量)和2-(2,5-二氢呋喃-3-基)-4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷(80mg,0.407mmol,2.00当量)的溶液中加入二叔丁
5-基)-5-氯-1-萘腈、中间体do(130mg,0.375mmol,1.00当量)、n-[[4-氧代-7-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯,中间体j(181mg,0.45mmol,1.20当量)、pd(dtbpf)cl2(24mg,38μmol,0.10当量)、碳酸钠(80mg,0.75mmol,2.00当量)的混合物用氮气将脱气,并在氮气气氛下在80℃下搅拌1小时。在此时间后,将混合物浓缩,并将残余物通过制备型tlc(sio2,二氯甲烷:甲醇20:1)纯化,以得到作为白色固体的n-[[7-[5-(5-氯-1-氰基-2-萘基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(120mg,0.222mmol,59%产率)。lcms[m 1]
=541.1。
[1142]
步骤2:将在二噁烷(2ml)中的n-[[7-[5-(5-氯-1-氰基-2-萘基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(70mg,129μmol,1.00当量)、甲基硼酸(23mg,0.388mmol,3.00当量)、pd(dtbpf)cl2(8.4mg,12μmmol,0.10当量)、碳酸钾(36mg,259μmol,2.00当量)的混合物脱气并用氮气吹扫,并在氮气气氛下100℃下搅拌1小时。浓缩混合物并通过制备型tlc(sio2,二氯甲烷:甲醇20:1)纯化,以得到作为白色固体的n-[[7-[5-(1-氰基-5-甲基-2-萘基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(50mg,96μmol,74%产率)。lcms[m 1]
=521.5。
[1143]
步骤3:向在二氯甲烷(1.5ml)中的n-[[7-[5-(1-氰基-5-甲基-2-萘基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(50mg,96μmol,1.00当量)的溶液中加入三氟乙酸(417μl),并将混合物在25℃下搅拌0.5小时。在此时间后,浓缩混合物,并通过制备型hplc(phenomenex luna c18 75
×
30mm
×
3μm;流动相:[水(0.05%hcl)-acn];b%:17%-37%,7分钟)纯化,以得到作为白色固体的2-(4-(4-(4-(氨基甲基)-1-氧代-1,2-二氢酞嗪-6-基)-1-甲基-1h-吡唑-5-基)-5-甲基-1-萘腈,实例12-9(21mg,45μmol,47%产率,hcl)。lcms[m 1]
=421.1;1h nmr(400mhz,dmso-d6)δ=12.83(s,1h),8.59(dd,j=0.8,8.8hz,1h),8.45(br s,3h),8.35(s,1h),8.05-7.96(m,2h),7.92(d,j=1.6hz,1h),7.85(d,j=8.8hz,1h),7.81-7.74(m,1h),7.68(d,j=7.2hz,1h),7.31(dd,j=1.6,8.4hz,1h),4.44-4.17(m,2h),3.77(s,3h),2.79(s,3h)。
[1144]
实例12-10
[1145][1146]
实例12-10,2-(4-(4-(氨基甲基)-1-氧代-1,2-二氢酞嗪-6-基)-1-甲基-1h-吡
唑-5-基)-4-甲基-1-萘腈由中间体j(346mg,0.863mmol,1.30当量)和中间体dz(230mg,0.664umol,1.00当量),根据实例12-9的合成所述的程序,被作为黄色固体制备(20mg,0.042mmol,最终步骤55%产率)。lcms[m 1]
=421.1;1h nmr(400mhz,dmso-d6)δ=12.83(s,1h),8.55-8.43(m,3h),8.36(s,1h),8.36-8.32(m,1h),8.18-8.12(m,1h),8.01(d,j=8.4hz,1h),7.93-7.86(m,3h),7.75(d,j=0.8hz,1h),7.37(dd,j=1.6,8.4hz,1h),4.45-4.11(m,2h),3.78(s,3h),2.86(s,3h)。
[1147]
实例12-11
[1148][1149]
2-(4-(4-(氨甲基)-1-氧代-1,2-二氢酞嗪-6-基)-1-甲基-1h-吡唑-5-基)-4,6-二甲基苄腈,实例12-11使用与实例12-9相同的方法从用于中间体d-19的中间体do开始,被作为白色固体制备(7.6mg,0.015mmol,37%产率)。lcms[m 1]
=385.2;1h nmr(400mhz,dmso-d6)δ=12.89-12.85(m,1h),8.36(br s,3h),8.28(s,1h),8.10(d,j=8.4hz,1h),7.69(d,j=1.6hz,1h),7.52(s,1h),7.49(dd,j=1.6,8.4hz,1h),7.41(s,1h),4.35-4.11(m,2h),3.71(s,3h),2.52-2.51(m,3h),2.44(s,3h)。
[1150]
实例12-12
[1151][1152]
步骤1:将在二噁烷(10ml)和水(2ml)中的4-溴-5-(1-氯-2-萘基)-1-甲基-吡唑(1.20g,3.73mmol,1.00当量)、n-[[4-氧代-7-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(1.50g,3.73mmol,1.00当量)、碳酸氢钠(627mg,7.46mmol,2.00当量)和二叔丁基(环戊基)膦-二氯钯;铁(243mg,0.373mmol,0.10当量)的混合物脱气并用氮气吹扫3次,并在80℃下搅拌0.5小时。然后过滤反应混合物并浓缩,并将残余物用水(30ml)稀释,并用乙酸乙酯(30ml
×
2)提取,用无水硫酸钠干燥,过滤并浓缩,并且将残余物通过柱色谱法(sio2,石油醚:乙酸乙酯=10:1至0:1)纯化,以得到作为白色固体的n-[[7-[5-(1-氯-2-萘基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(1.20g,2.33mmol,62%产率)。lcms[m 1]
=516.1;1h nmr(400mhz,cdcl3)δ=10.08(s,1h),8.41(d,j=8.0hz,1h),8.18-8.10(m,1h),8.04(s,1h),7.96(dd,j=8.4,
16.0hz,2h),7.84-7.77(m,1h),7.76-7.66(m,2h),7.47-7.39(m,1h),7.36(d,j=8.8hz,1h),5.27-5.15(m,1h),4.46-4.38(m,1h),4.33-4.26(m,1h),3.77(s,3h),1.49(s,9h)。
[1153]
步骤2:向在甲苯(2ml)中的n-[[7-[5-(1-氯-2-萘基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(100mg,0.194mmol,1.00当量)的溶液中加入磷酸钾(123mg,0.581mmol,3.00当量)、2,4,6-三甲基-1,3,5,2,4,6-trioxatriborinane(292mg,1.16mmol,50%纯度,6.00当量)和sphos pd g2(15mg,0.194mmol,0.10当量)并将混合物在氮气气氛下在100℃下搅拌10小时。在此时间后,过滤混合物,用水(5ml)稀释并用乙酸乙酯(5ml)提取,并将有机层用无水硫酸钠干燥,过滤并在减压下浓缩,以得到作为黄色固体的n-[[7-[1-甲基-5-(1-甲基-2-萘基)吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(150mg,粗品)。lcms[m 1]
=496.5。
[1154]
步骤3:向在二氯甲烷(1ml)中的n-[[7-[1-甲基-5-(1-甲基-2-萘基)吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(150mg,0.303mmol,1.00当量)的溶液中加入三氟乙酸(462mg,4.05mmol,0.30ml,13.4当量)。然后将混合物在25℃下搅拌0.5小时,然后浓缩,并将残余物通过制备型hplc(phenomenex synergi c18 150
×
30mm
×
4μm;流动相:[水(0.1%tfa)-acn];b%:23%-43%,10分钟)纯化,以得到作为灰白色固体的4-(氨基甲基)-6-[1-甲基-5-(1-甲基-2-萘基)吡唑-4-基]-2h-酞嗪-1-酮(16mg,0.038mmol,13%产率)。lcms[m 1]
=396.1;1h nmr(500mhz,meod)δ=8.23-8.21(m,1h),8.19-8.13(m,2h),8.03-7.96(m,2h),7.73-7.69(m,1h),7.68-7.64(m,2h),7.60-7.58(m,1h),7.41(d,j=8.5hz,1h),4.14(d,j=13.5hz,1h),3.98(d,j=13.0hz,1h),3.70(s,3h),2.43(s,3h)。
[1155]
实例12-13
[1156][1157]
实例12-13,6-(4-(4-(氨基甲基)-1-氧代-1,2-二氢酞嗪-6-基)-1-甲基-1h-吡唑-5-基)-2-甲基-3-(1-甲基-1h-吡唑-4-基)苄腈,按照与实例12-6所述相同的程序,从中间体j和中间体d-18开始,被作为白色固体制备(10mg,0.018mmol,33%产率)。lcms[m 1]
=451.2;1h nmr(500mhz,dmso-d6)δ=12.86(s,1h),8.33(br s,3h),8.27(s,1h),8.16(s,1h),8.10(d,j=8.5hz,1h),7.88(d,j=8.5hz,1h),7.86(d,j=0.5hz,1h),7.78(d,j=1.5hz,1h),7.58(d,j=8.5hz,1h),7.48(dd,j=1.5,8.5hz,1h),4.31(br t,j=6.0hz,
nmr(400mhz,cd3od)δ=8.20(d,j=8.4hz,1h),8.13(s,1h),7.75(d,j=1.6hz,1h),7.54-7.47(m,1h),7.33(s,1h),7.22(d,j=1.6hz,1h),4.41(s,2h),3.79(s,3h),2.53(s,3h),2.09-2.01(m,1h),1.18-1.11(m,2h),0.92-0.79(m,2h)。
[1163]
实例12-15
[1164][1165]
实例12-15,2-[4-[4-(氨基甲基)-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]-3-甲基-萘-1-腈,根据与实例12-9所述相同的方法,从中间体f-11和中间体j开始,被作为黄色胶状物制备(2.6mg,0.006mmol,经3个步骤产率为3%)。lcms[m h]
=421.2;1h nmr(400mhz,dmso-d6)δ=12.80(s,1h),8.43(d,j=8.0hz,2h),8.19-8.15(m,1h),8.13-8.10(m,1h),8.00(d,j=8.4hz,1h),7.86(s,1h),7.85-7.79(m,2h),7.26(d,j=8.4hz,1h),4.36-4.18(m,2h),4.09(s,2h),3.66(s,3h),2.21(s,3h)。
[1166]
实例12-16
[1167][1168]
步骤1:向在甲醇(3ml)中的n-[[7-[5-(1-氰基-3-氟-2-萘基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(100mg,0.19mmol,1.00当量)的溶液中加入甲醇钠(309mg,5.72mmol,30.0当量),并将混合物在110℃下搅拌5小时。在此时间后,混合物用乙酸乙酯(20ml)稀释,并用盐水(20ml
×
3)洗涤,用无水硫酸钠干燥,过滤,浓缩,并且将残余物通过制备型tlc(sio2,二氯甲烷:甲醇=5%)纯化,以得到作为黄色固体的n-[[7-[5-(1-氰基-3-甲氧基-2-萘基)-1-甲基-吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(30mg,0.056mmol,29%产率。)lcms[m 1]
=537.2。
[1169]
步骤2:向在二氯甲烷(1.5ml)中的n-[[7-[5-(1-氰基-3-甲氧基-2-萘基)-1-甲
吡唑-4-基]-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(66mg,0.127mmol,1.00当量)的溶液中加入三氟乙酸(0.3ml),并将混合物在25℃下搅拌0.5小时。然后浓缩反应混合物,并且将残余物通过制备型hplc(纯化方法4-6)纯化,以得到作为黄色固体的6-[4-[4-(氨基甲基)-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]-3-甲基-喹啉-5-甲腈(14mg,0.030mmol,24%产率,hcl)。lcms[m 1]
=422.1;1h nmr(400mhz,dmso-d6)δ=12.83(s,1h),9.08(d,j=2.0hz,1h),8.52(br d,j=8.0hz,4h),8.37(s,1h),8.33-8.30(m,1h),8.01(d,j=5.2hz,1h),7.99(d,j=5.2hz,1h),7.90(d,j=1.2hz,1h),7.34(dd,j=1.6,8.4hz,1h),4.33-4.23(m,2h),3.79(s,3h),2.61(s,3h)。
[1175]
实例12-18
[1176][1177]
实例12-18,2-(4-(4-(氨基甲基)-1-氧代-1,2-二氢酞嗪-6-基)-1-甲基-1h-吡唑-5-基)-6-环丙氧基-4-甲基苄腈,根据与实例12-17所述相同的方法,从实例4-118开始,被作为白色固体制备(11mg,0.022mmol,65%产率,经3个步骤产率为3%)。lcms[m 1]
=427.2;1h nmr(400mhz,dmso-d6)δ=12.85(s,1h),8.54(br s,3h),8.28(s,1h),8.11(d,j=8.4hz,1h),7.70(d,j=1.2hz,1h),7.58(s,1h),7.51(dd,j=1.6,8.4hz,1h),7.17(s,1h),4.34-4.10(m,3h),3.71(s,3h),2.50(br s,3h),0.94-0.85(m,2h),0.84-0.71(m,2h);1h nmr(400mhz,meod)δ=8.20(d,j=8.4hz,1h),8.12(s,1h),7.78(s,1h),7.56(s,1h),7.52(dd,j=1.6,8.4hz,1h),7.13(s,1h),4.54-4.35(m,2h),4.05(tt,j=2.8,6.0hz,1h),3.79(s,3h),2.55(s,3h),0.92(m,2h),0.86-0.73(m,2h)。
[1178]
实例13-1
[1179][1180]
步骤1:将在dmso(30ml)中的中间体g(1.00g,2.60mmol,1.00当量)、4-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)异噁唑(609mg,3.12mmol,1.20当量)、氟化钾(1.00m,7.81ml,3.00当量)和pd(dppf)cl2(170mg,0.26mmol,0.10当量)的混合物脱气,并用氮气吹扫3次,然后在130℃下搅拌16小时。在此时间后,用水(100ml)稀释反应混合物,并
用乙酸乙酯(30ml
×
3)提取。合并的有机提取物用盐水(80ml)洗涤,用无水硫酸钠干燥,过滤并在减压下浓缩。残余物通过柱色谱法(sio2、石油醚/乙酸乙酯1/1至1/0,然后甲醇/乙酸乙酯1/10,然后二氯甲烷/甲醇10/1)纯化,以得到作为红色固体的2-[(6-异噁唑-4-基-4-氧代-3h-酞嗪-1-基)甲基]异吲哚啉-1,3-二酮(239mg,0.642mmol,25%产率)。lcms[m 1
]=373.1。
[1181]
步骤2:向在乙醇(10ml)中的2-[(6-异噁唑-4-基-4-氧代-3h-酞嗪-1-基)甲基]异吲哚啉-1,3-二酮(200mg,0.537mmol,1.00当量)的溶液中加入水合肼(0.053ml,1.07mmol,2.00当量)并将混合物在80℃下搅拌1小时。在此时间后,用盐酸(1.00m,2.00ml)将冷却的反应混合物的ph调节至ph 1,并在减压下浓缩。残余物用盐酸(1.00m,40ml)稀释,并用乙酸乙酯(30ml
×
3)提取,并将水相在减压下浓缩。残余物通过制备型hplc(waters xbridge 150
×
25mm
×
5μm;流动相:[水(0.05%氢氧化氨v/v)-acn];b%:0%-20%,10分钟)纯化,以得到作为白色固体的2-[1-(氨基甲基)-4-氧代-3h-酞嗪-6-基]乙腈,实例13-1(32mg,0.145mmol,27%产率)。lcms[m 1]
=215.2;1h nmr(400mhz,dmso-d6)δ=8.27(d,j=1.2hz,1h),8.12(d,j=8.4hz,1h),7.87(dd,j=2.0,8.4hz,1h),4.26(s,2h),4.03(s,2h)。
[1182]
实例13-2
[1183][1184]
步骤1:向在二噁烷(4ml)和水(0.8ml)中的2-[[5-氟-4-氧代-7-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-3h-酞嗪-1-基]甲基]异吲哚啉-1,3-二酮、中间体dl(100mg,0.223mmol,1.00当量)、2-(4-溴-2-甲基-吡唑-3-基)萘-1-甲腈,中间体dc(70mg,0.223mmol,1.00当量)和碳酸氢钠(56mg,0.668mmol,26.0μl,3.00当量)的混合物中加入二叔丁基(环戊基)膦;二氯钯-铁(14.5mg,0.022mmol,0.10当量)并将反应混合物脱气并用氮气吹扫,并在80℃下搅拌1小时。在此时间后,反应混合物在减压下浓缩,并且残余物通过制备型tlc(sio2,二氯甲烷:甲醇=10:1)纯化,以得到作为白色固体的2-[4-[4-[(1,3-二氧杂异二氢吲哚-2-基)甲基]-8-氟-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]萘-1-甲腈(50mg,0.074mmol,34%产率)。lcms[m 1]
=555.2。
[1185]
步骤2:在20℃下在氮气气氛下,向在乙醇(2ml)中的2-[4-[4-[(1,3-二氧杂异二
基]-3-氟-萘-1-甲腈(10mg,0.005mmol,6%产率)。lcms[m 1]
=573.3。
[1190]
步骤2:在20℃下,在n2气氛下,向在乙醇(2.0ml)中的2-[4-[4-[(1,3-二氧杂异二氢吲哚-2-基)甲基]-8-氟-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]-3-氟-萘-1-甲腈(10mg,0.016mmol)的混合物中一次性加入新鲜制备的乙醇钠(在0.5ml etoh中的50mg)。将混合物在密封管中在110℃下搅拌2小时。然后用浓hcl淬灭反应,然后在减压下浓缩,以得到作为白色固体的2-[[7-[5-(1-氰基-3-乙氧基-2-萘基)-1-甲基-吡唑-4-基]-5-乙氧基-4-氧代-3h-酞嗪-1-基]甲基氨基甲酰基]苯甲酸(10mg,粗品),其被用于下一步骤而无需进一步纯化。lcms[m 1]
=643.6。
[1191]
步骤3:在20℃下在n2气氛下,向在乙醇(2.0ml)中的2-[[7-[5-(1-氰基-3-乙氧基-2-萘基)-1-甲基-吡唑-4-基]-5-乙氧基-4-氧代-3h-酞嗪-1-基]甲基氨基甲酰基]苯甲酸(10mg,0.016mmol,1.00当量)的混合物中一次性加入水合肼(0.155mmol,8ul,10当量)。然后将混合物在70℃下搅拌12小时,浓缩,并将残余物溶解在dmso(2.0ml)中,并且通过加入浓hcl将ph调节至ph 6。然后将所得的混合物通过制备型hplc(shim-pack c18 150x25mm x10μm;流动相:[水(0.1%tfa)-acn];b%:10%-40%,10分钟)纯化,以得到作为黄色固体的2-[4-[4-(氨基甲基)-8-乙氧基-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]-3-乙氧基-萘-1-甲腈(3mg,0.005mmol,31%产率)。lcms[m 1]
=495.4;1h nmr(400mhz,meod)δ=8.25(s,1h),8.10(t,j=8.0hz,2h),8.00(s,1h),7.79-7.73(m,1h),7.70-7.63(m,1h),7.37(d,j=1.2hz,1h),6.77(d,j=0.8hz,1h),4.45-4.27(m,4h),3.82(s,3h),3.68-3.60(m,1h),3.48-3.41(m,1h),1.37(s,4h),0.99(t,j=6.8hz,3h)。
[1192]
实例14-1
[1193][1194]
步骤1:将在二噁烷(4ml)和水(0.8ml)的2-[[7-(5-溴-3-吡啶基)-4-氧代-3h-酞嗪-1-基]甲基]异吲哚啉-1,3-二酮、中间体cb(300mg,0.650mmol,1.00当量)、环己烯-1-基硼酸(164mg,1.30mmol,2.00当量)、pd(dppf)cl2(48mg,65μmol,0.10当量)、碳酸氢钠(109mg,1.30mmol,51μl,2.00当量)的混合物脱气并用氮气吹扫3次,并在氮气气氛下在80℃下搅拌2小时。在此时间后,浓缩反应混合物,并且残余物通过柱色谱法(sio2,石油醚:乙酸乙酯5:1至0:1)然后通过制备型hplc(phenomenex luna c18 150x25mm x10μm;流动相:[水(0.1%tfa)-acn];b%:34%-54%,10分钟)纯化,以得到作为黄色固体的2-[[7-[5-(环
己烯-1-基)-3-吡啶基]-4-氧代-3h-酞嗪-1-基]甲基]异吲哚啉-1,3-二酮(20mg,43μmol,7%产率)。lcms[m 1]
=463.2。
[1195]
步骤2:向在甲醇(2ml)中的2-[[7-[5-(环己烯-1-基)-3-吡啶基]-4-氧代-3h-酞嗪-1-基]甲基]异吲哚啉-1,3-二酮(10mg,22μmol,1.00当量)的溶液中加入10%活性炭载钯(5mg,0.1当量),并将悬浮液脱气并用氢气吹扫3次。然后在25℃下在氢气(15psi)下将混合物搅拌2小时。在此时间后,过滤反应混合物并在减压下浓缩,以得到作为黄色固体的2-[[7-(5-环己基-3-吡啶基)-4-氧代-3h-酞嗪-1-基]甲基]异吲哚啉-1,3-二酮(10mg,粗品),其被直接用于下一步骤而无需进一步纯化。lcms[m 1]
=465.3。
[1196]
步骤3:向在乙醇(1ml)中的2-[[7-(5-环己基-3-吡啶基)-4-氧代-3h-酞嗪-1-基]甲基]异吲哚啉-1,3-二酮(10mg,22μmol,1.00当量)的溶液中加入水合肼(11mg,0.215mmol,11μl,10.0当量)并将反应混合物在80℃下搅拌0.5小时。在此时间后,将反应混合物在减压下浓缩并通过制备型hplc(phenomenex gemini-nx c18 75
×
30mm
×
3μm;流动相:[水(0.1%tfa)-acn];b%:15%-25%,7分钟)纯化,以得到作为黄色固体的4-(氨基甲基)-6-(5-环己基-3-吡啶基)-2h-酞嗪-1-酮(3.6mg,8μmmol,36%产率,tfa)。lcms[m 1]
=335.2;1h nmr(400mhz,dmso-d6)δ=12.99(s,1h),8.98(d,j=2.0hz,1h),8.60(d,j=2.0hz,1h),8.45(br s,3h),8.41-8.37(m,1h),8.33-8.29(m,1h),8.25(d,j=1.2hz,1h),8.18(t,j=2.0hz,1h),4.63(br d,j=5.6hz,2h),2.71-2.65(m,1h),1.92-1.81(m,4h),1.79-1.71(m,1h),1.66-1.51(m,2h),1.48-1.36(m,2h),1.34-1.23(m,1h)。
[1197]
实例15-1
[1198][1199]
步骤1:将在二噁烷(3.0ml)和水(0.5ml)中的中间体dk(60mg,0.129mmol,1.00当量)、2-(4-溴-2-甲基-吡唑-3-基)萘-1-甲腈(40mg,0.129mmol,1.00当量)、二叔丁基(环戊基)膦;二氯钯;铁(8.4mg,0.012mmol,0.10当量)、碳酸氢钠(33mg,0.39mmol,3.00当量)的混合物脱气并用氮气吹扫3次,然后在氮气气氛下在80℃下搅拌1小时。然后将混合物浓缩,并且将残余物通过制备型tlc(sio2,二氯甲烷:甲醇10:1)纯化,以得到作为黄色固体的2-[4-[8-氯-4-[(1,3-二氧杂异二氢吲哚-2-基)甲基]-1-氧代-2h-酞嗪-6-基]-2-甲基-吡
唑-3-基]萘-1-甲腈(40mg,0.064mmol,50%产率)。lcms[m 1]
=571.2。
[1200]
步骤2:将在水(0.6ml)和thf(3.0ml)中的2-[4-[8-氯-4-[(1,3-二氧杂异二氢吲哚-2-基)甲基]-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]萘-1-甲腈(40mg,0.070mmol,1.00当量)、三乙基硼烷(69mg,0.701mmol,0.101ml,10.0当量)、xantphos(4mg,0.007mmol,0.10当量)、碳酸钾(29mg,0.210mmol,3.00当量)的混合物脱气并用氮气吹扫3次,然后将混合物在80℃下在密封管中搅拌5小时。然后在减压下浓缩混合物,并通过加入盐酸(1m)水溶液将残余物的ph调节至ph 7,然后进一步浓缩,以得到作为黑色固体的2-[[7-[5-(1-氰基-2-萘基)-1-甲基-吡唑-4-基]-5-乙基-4-氧代-3h-酞嗪-1-基]甲基氨基甲酰基]苯甲酸(100mg,粗品),其被直接用于下一步骤而无需进一步纯化。lcms[m 1]
=583.0。
[1201]
步骤3:将在乙醇(5.0ml)中的2-[[7-[5-(1-氰基-2-萘基)-1-甲基-吡唑-4-基]-5-乙基-4-氧代-3h-酞嗪-1-基]甲基氨基甲酰基]苯甲酸(100mg,0.172mmol,1.00当量)、水合肼(3.43mmol,0.17ml,20.0当量)的混合物脱气并用氮气吹扫3次,然后将混合物在80℃下搅拌18小时。然后浓缩混合物,并将残余物用盐酸(1m)酸化至ph 6,用乙酸乙酯(8ml)稀释,并用水(5ml
×
3)提取。在减压下浓缩水层,并且将残余物通过制备型hplc(phenomenex luna c18 75
×
30mm
×
3μm;流动相:[水(0.05%盐酸)-acn];b%:18%-38%,7分钟)纯化,以得到作为黄色固体的2-[4-[4-(氨基甲基)-8-乙基-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]萘-1-甲腈(13mg,0.027mmol,16%产率,hcl盐)。lcms[m 1]
435.3;1h nmr(400mhz,dmso-d6)δ=12.61(s,1h),8.56(d,j=8.4hz,1h),8.48(br s,3h),8.39(s,1h),8.29(d,j=7.6hz,1h),8.14(d,j=8.4hz,1h),7.93-7.81(m,3h),7.72(d,j=1.6hz,1h),7.01(d,j=1.2hz,1h),4.38-4.09(m,2h),3.80(s,3h),3.09-2.81(m,2h),0.65(t,j=7.6hz,3h)。
[1202]
实例15-2
[1203][1204]
2-(4-(4-(氨基甲基)-8-乙基-1-氧代-1,2-二氢酞嗪-6-基)-1-甲基-1h-吡唑-5-基)-6-环丙氧基苄腈,实例15-2按照与实例15-1相同的3步程序从中间体h-2开始被作为白
基]-5-氟-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(30mg,0.055mmol,1.00当量)的溶液中加入乙醇钠(19mg,0.276mmol,5.00当量),并将混合物在密封管中在110℃下搅拌0.75小时。然后过滤冷却的反应混合物,浓缩,并且将残余物用mtbe(1ml)研磨,过滤并干燥,以得到作为黄色固体的化合物n-[[7-[5-(1-氰基-3-氟-2-萘基)-1-甲基-吡唑-4-基]-5-乙氧基-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(30mg,0.052mmol,96%产率)。lcms[m 1]
=569.3。
[1212]
步骤3:向在二氯甲烷(0.2ml)中的n-[[7-[5-(1-氰基-3-氟-2-萘基)-1-甲基-吡唑-4-基]-5-乙氧基-4-氧代-3h-酞嗪-1-基]甲基]氨基甲酸叔丁酯(30mg,0.052mmol,1.00当量)的溶液中加入tfa(0.75ml),并将混合物在30℃下搅拌0.25小时。然后浓缩反应混合物,并通过制备型hplc(纯化方法4-6)纯化残余物,然后通过sfc(daicel chiralpak ig(250mm
×
30mm,10μm);流动相:[庚烷-醇(0.1%nh3h2o)];b%:80%等度;7分钟循环,总计150分钟)分离立体异构体,然后通过制备型hplc(unisil 3-100 c18 ultra 150mm
×
50mm
×
3μm;流动相:[水(0.225%甲酸)-acn];b%:15%-35%,10分钟)进一步纯化每种立体异构体,以得到作为白色固体的实例16-3,2-[4-[4-(氨基甲基)-8-乙氧基-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]-3-氟-萘-1-甲腈(1.4mg,0.002mmol,20%产率)和实例16-4作为白色固体的2-[4-[4-(氨基甲基)-8-乙氧基-1-氧代-2h-酞嗪-6-基]-2-甲基-吡唑-3-基]-3-氟-萘-1-甲腈(1.7mg,0.003mmol,25%产率)。实例16-3的光谱数据:lcms[m 1]
=569.3;1h nmr(400mhz,meod)δ=8.53(br s,2h),8.33(d,j=10.0hz,1h),8.27(s,1h),8.25-8.18(m,2h),7.90-7.84(m,2h),7.35(s,1h),6.83(s,1h),4.38-4.19(m,2h),3.90(s,3h),3.77-3.66(m,1h),3.60-3.48(m,1h),1.03(t,j=6.8hz,3h)。实例16-4的光谱数据:lcms[m 1]
=569.3;1h nmr(400mhz,cd3od)δ=8.59-8.47(m,1h),8.31(d,j=10.0hz,1h),8.25(s,1h),8.24-8.16(m,2h),7.88-7.81(m,2h),7.32(s,1h),6.82(s,1h),4.33-4.13(m,2h),3.88(s,3h),3.76-3.64(m,1h),3.59-3.46(m,1h),1.01(t,j=6.8hz,3h)。
[1213]
实例16-5和16-6
[1214][1215]
通过sfc将实例16-5(49mg,0.112mmol,31%产率)和实例16-6(48mg,0.109mmol,30%产率)与实例4-229(160mg,0.324mmol)分离。向样品中加入meoh(20ml)。waters 80q仪器,超临界co2流量:80g/分钟,循环时间:7分钟,总时间:50分钟。单次注射体积:3.0ml。背压:100巴,以保持co2超临界流动。phenomenex-cellulose-2(250mm
×
30mm,10μm);流动相:[0.1%nh3h2o meoh];b%:60%等度)。实例16-5的光谱数据:lcms[m 1]
=441.2;1h nmr(400mhz,dmso-d6)δ=12.82(s,1h),8.94(s,1h),8.48(s,1h),8.44-8.39(m,1h),8.32(br d,j=8.0hz,1h),8.05-7.99(m,2h),7.98-7.89(m,2h),7.26(br d,j=8.4hz,1h),4.35(br s,2h),3.71(s,3h)。实例16-5的光谱数据:lcms[m 1]
=441.2;1h nmr(400mhz,dmso-d6)δ=12.39(br s,1h),8.92(s,1h),8.42(d,j=8.4hz,1h),8.34(s,1h),8.30(d,j=8.0hz,
biology corporation)与测试化合物在含有40nm组蛋白h4肽(氨基酸1-15)-生物素缀合物的测定缓冲液中在室温下预孵育20分钟。通过加入1μm氚化的s-腺苷甲硫氨酸(最终浓度)来引发酶促反应,并允许反应进行20分钟。停止反应,并使用闪烁计数器测定每个样品中结合的氚化h4肽的量。使用graphpad prism软件从样品加和减mta的每个10点剂量-应答曲线计算每种化合物的ic
50
值,并且式(i)的示例性化合物的结果显示在表9a中。
[1224]
表9a
[1225]
在存在和不存在mta的情况下,在闪板测定中,式(i)的示例性化合物对prmt5介导的酶活性的ic
50
值
[1226]
[1227]
[1228][1229][1230]
该测定使用重组全长组蛋白h2a作为prmt5底物。通过在闪烁计数器中测量来确定在存在和不存在化合物时prmt5酶的活性,氚化的甲基基团从s-腺苷-l-[甲基-3h]甲硫氨
酸到组蛋白h2a蛋白的酶促转移产生了放射性标记的组蛋白h2a4。测定反也在应存在和不存在mta的情况下进行,以确定化合物是否表现出mta协同活性。简而言之,本发明的化合物以10mm的最高浓度被溶解在100%dmso中。对于ic
50
测定,每种化合物的系列稀释物的初始起始浓度为50μm。还制备了不含化合物、prmt5/mep50复合物或各种反应组分的对照样品,并与化合物测试样品平行处理。sah被用作测定验证的阳性对照。为了测量prmt5抑制活性,将1nm prmt5/mep50复合物(reaction biology corporation)与测定化合物在含有5μm全长组蛋白h2a的测定缓冲液中在室温下预孵育20分钟。通过加入1μm氚化的s-腺苷甲硫氨酸(最终浓度)来引发酶促反应,并允许反应进行60分钟。停止反应并转移到滤纸上用于进行检测。使用闪烁计数器测定每个样品中氚化的h2a的量。使用graphpad prism软件从样品加和减mta的每个10点剂量-应答曲线计算每种化合物的ic
50
值,并且式(i)的示例性化合物的结果显示在表9b中。
[1231]
表9b
[1232]
在hotspot测定中,在存在和不存在mta的情况下,式(i)的示例性化合物对prmt5介导的酶活性的ic
50
值
[1233]
[1234]
[1235][1236]
实例b
[1237]
基于细胞的测定
[1238]
本实例说明了,本发明的示例性化合物能够抑制mtap缺陷细胞的增殖。
[1239]
1.hct116mtap敲除模型
[1240]
使用crispr/cas9系统和靶向mtap基因的sgrna对hct116细胞进行遗传工程改造,以敲除两个mtap等位基因的功能。在cas9/mtap sgrna转导后,筛选克隆以确认mtap基因的每个等位基因均已失活(即纯合的mtap敲除),从而产生mtap缺陷细胞。在基于细胞的测定中使用经确认具有纯合的mtap敲除的克隆,以评估对prmt5和抗增殖活性的抑制,并证明本发明化合物的mta协同性。
[1241]
2.增殖测定
[1242]
使用hct116亲本和hct116纯合mtap敲除细胞系进行增殖测定,以证明本发明的化合物在mtap缺陷细胞中的增加的效力。平行分析对照样品。
[1243]
简言之,在第0天,将250个hct116亲本或hct116纯合mtap敲除细胞接种于在mccoy’s 5a中的96孔板中,所述mccoy’s 5a补充有10%胎牛血清和pen/strep,并将细胞在37℃加5%co2下孵育过夜。
[1244]
第二天,用dmso赋形剂对照或prmt5抑制剂的剂量应答处理细胞,并在37℃加5%co2下孵育5天。在第6天,用胰蛋白酶消化细胞,并以1:10将细胞分离到新的96孔板(其含有相同浓度的prmt5抑制剂的新鲜培养基)中,并在37℃加5%co2下孵育额外的5天。
[1245]
在第11天,根据制造商的说明,使用ctg测定试剂盒(celltiter-glo;promega,目录编号g7573)来测量细胞的活力。使用graphpad prism软件来计算每种化合物在治疗10天后的ic
50
值。
[1246]
3.sym11细胞内蛋白质(sym11in-cell western)
[1247]
在hct116亲本和hct116纯合mtap敲除细胞系中进行细胞内蛋白质测定,以通过测量prmt5依赖性对称二甲基精氨酸信号来证明mtap缺陷细胞中增加的prmt5抑制。平行分析对照样品。
[1248]
简言之,在第0天,将2,000个hct116亲本或hct116纯合mtap敲除细胞接种于在mccoy’s 5a中的96孔板中,所述mccoy’s 5a补充有10%胎牛血清和pen/strep,并将细胞在37℃加5%co2下孵育过夜。第二天,用dmso媒介物对照或prmt5抑制剂的剂量应答处理细胞,并在37℃加5%co2下孵育4天。
[1249]
在处理4天后,通过向各孔中加入50μl的4%多聚甲醛溶液来固定细胞,并且细胞在室温下孵育20分钟。去移多聚甲醛溶液,加入150μl的冰冷的甲醇,并将板置于-20℃下持续10分钟。取出甲醇,加入150μl的odyssey blocking缓冲液 0.05%吐温20,并将板在室温下在振荡下孵育1小时。
[1250]
向每个测试孔中加入在odyssey blocking缓冲液 0.05%吐温20中以1:500稀释的50μl的sym11抗体(millipore 07-413),并将板置于4℃过夜。通过抽吸除去初级sym11抗体溶液,并用含0.1%吐温-20的磷酸盐缓冲盐水(pbst)连续洗涤孔三次。
[1251]
加入以1:800稀释的山羊抗兔irdye 800cw二级抗体(li-cor 926-32211)和在odyssey blocking缓冲液 draq5 0.05%吐温20中以1:10000稀释的核染色剂draq5(biostatus limited)的50μl等分试样,并将板在室温下在黑暗中储存2小时。通过抽吸除去二级抗体溶液,并用pbst连续洗涤孔三次。
[1252]
sym11信号和draq5信号分别使用在800nm和700nm处的li-cor odyssey机器读数进行定量。使用sym11/draq5比率来计算对称二甲基精氨酸的抑制作用,作为dmso对照的百分比。
[1253]
表11
[1254]
在hct116亲本和hct116纯合mtap敲除细胞系中抑制prmt5依赖性对称二甲基精氨酸(sym11)信号和增殖
[1255]
[1256]
[1257]
[1258]
[1259][1260]
虽然已经结合本发明的具体实施例描述了本发明,但是应当理解,本发明能够进行进一步的修改,并且本技术旨在覆盖本发明的任何变化、使用或修改,这些变化、使用或修改通常遵循本发明的原理,并且包括如在本发明所属领域内的已知或常规实践中的对本公开的此类偏离,并且可以应用于上文阐述的必要特征,并且在所附权利要求的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。