跨物种抗潜伏tgf-β
1抗体和使用方法
技术领域
1.本发明涉及抗潜伏tgf-β1抗体及其使用方法。
背景技术:
2.转化生长因子-β(转化生长因子β;tgf-β)是细胞因子tgf-β超家族的成员,该超家族由tgf-β同工型、激活素、抑制素、nodal、骨形态发生蛋白(bmp)、抗mullerian激素(amh)以及生长和分化因子(gdf)组成。该超家族的成员是具有保守结构的二聚体蛋白,并且具有体外和体内多向性功能(npl 1、2)。tgf-β同工型参与许多细胞过程,包括生长抑制、细胞迁移、侵袭、上皮间质转化(emt)、细胞外基质(ecm)重塑和免疫抑制(npl 3)。然而,尽管通常动态调节并参与维持组织稳态,但tgf-β同工型在疾病状态(包括癌症、纤维化和炎症)下经常长期过表达,并且这种tgf-β的过度产生通过调节细胞生长、迁移或表型而推动疾病进展。
3.已经在哺乳动物中鉴定出三种单独的tgf-β同工型(tgf-β1、tgf-β2和tgf-β3),并且在氨基酸水平上具有70-82%同源性(npl 4)。所有三种tgf-β同工型均以同源二聚体(它们的活性形式)与2型tgf-β受体(tgfr2)结合;然后tgfr2募集并激活1型tgf-β受体(tgfr1)以激活受体信号传导(npl 5)。然而,三种同工型的表达水平因组织而异(npl 6),并且它们的功能不同,如敲除小鼠的表型所阐明(npl 7-11)。
4.与tgf-β超家族的其他成员一样,tgf-β以前体蛋白合成,形成同源二聚体,该同源二聚体与其潜伏相关肽(lap)和潜伏tgf-β结合蛋白(ltbp)相互作用以形成更大复合体,称为大潜伏复合体(llc)。tgf-β基因编码由信号肽、以前蛋白转化酶(ppc)切割位点为末端的前肽和成熟tgf-β序列组成的前蛋白原序列。弗林蛋白酶水解ppc切割位点,产生单独的tgf-β同源二聚体和前肽衍生的同源二聚体。这两种同源二聚体保持非共价缔合并被分泌。这种潜伏复合体使tgf-β保持为无法与其受体结合的非活性形式(npl 12、13)。tgf-β激活过程涉及llc从ecm释放,然后进一步蛋白水解lap以释放活性tgf-β至其受体(npl 3)。潜伏tgf-β经多种蛋白酶(包括纤溶酶(pln)、血浆激肽释放酶(plk)、基质金属蛋白酶(mmp)2和mmp9(npl 14),以及血小板反应蛋白1(tsp-1)(npl 15))切割以释放活性tgf-β。不希望受任何理论束缚,mmp2以及mmp9蛋白酶解切割潜伏tgf-β1并从潜伏形式释放成熟tgf-β1。mmp2和mmp9均被合成为非活性pro-mmp。pro-mmp2被膜1型mmp(mt1-mmp/mmp14)和金属蛋白酶2组织抑制剂(timp-2)的复合体激活。pro-mmp9通过涉及纤溶酶和溶基质蛋白酶1(mmp-3)的相互作用蛋白酶级联被激活。纤溶酶从其酶原产生活性mmp-3。活性mmp-3从92-kda pro-mmp-9切割前肽,产生82-kda具有酶活性的酶。mmp的切割位点未具体确定;然而,据报道mmp3特异性切割潜伏tgf-β的79ala和80leu之间的位点,从而激活tgf-β(wo2005/023870)。可选地,在机械延伸时,整联蛋白可以通过与lap中存在的rgd基序结合来激活tgf-β,以诱导成熟tgf-β从其潜伏复合体中释放(npl 16、17)。
5.激活后,二聚体tgf-β配体与i型和ii型受体的细胞外结构域结合并诱导紧密接近,受体的细胞内丝氨酸/苏氨酸激酶结构域被置于促进i型受体磷酸化和随后激活的构象
中。i型受体的这种激活导致信号传导通过至少两个似乎非依赖性通路传播:smad依赖性经典通路和smad非依赖性或非经典通路。在smad依赖性通路中,tgfr1(也称为alk5)的激活导致smad蛋白磷酸化。smad2和smad3是tgfr1的底物。在被受体磷酸化后,smad与共同中介体smad4一起转移至细胞核,在细胞核中它们与其他转录因子相互作用以调节转录响应(npl 18)。在非经典通路中,激活的tgf-β受体复合体通过其他因子(例如肿瘤坏死因子(tnf)受体相关因子4(traf4)、traf6、tgf-β激活激酶1(tak1,也称为map3k7)、p38促分裂原激活蛋白激酶(p38 mapk)、rho、磷酸肌醇3-激酶(pi3k)、akt(也称为蛋白激酶b)、细胞外信号调节激酶(erk)、jun n端激酶(jnk)或核因子-κb(nf-κb))传递信号。因此,细胞对tgf-β信号传导的响应是由经典和非经典信号传导级联的动态组合所致。
6.纤维化,或构成疤痕组织的ecm分子的蓄积,是慢性组织损伤的常见特征。肺纤维化、肾纤维化和肝硬化是更常见的纤维化疾病,它们总体上代表了巨大未满足的临床需求。tgf-β强烈促进间充质细胞的细胞外基质的生成,同时抑制上皮细胞生长,这有助于硬化疾病的发病机制。转基因小鼠肝脏中活性形式的tgf-β1的过表达足以诱导多个器官发生纤维化疾病(npl 19)。另一方面,tgf-β在维持我们的健康方面也发挥重要作用。例如,tgf-β抑制肺中蛋白酶的过度生成,并防止导致肺气肿的肺组织破坏。此外,tgf-β1缺失的小鼠显示出产前致死率(在交配后10.5天时约50%)或它们的幼仔在出生后不久死亡,伴有许多器官中大量炎性病变,包括肺(血管炎、血管周围套囊和间质肺炎)和心脏(心内膜炎和心肌炎),这表明tgf-β1在维持免疫稳态中发挥至关重要的作用(npl 7)。
7.使用tgf-β中和抗体和动物模型的研究结果表明,可以通过抑制tgf-β的作用来预防或治愈硬化疾病。由于tgf-β以前体蛋白产生,因此有几种报道的方法可以防止潜伏形式的激活。另一种防止潜伏形式激活的方法是使用与潜伏tgf-β结合的抑制剂或抗体来阻断蛋白酶(例如plk和pln)的切割。几种使用这种抑制tgf-β激活方法的抗体被报道作为可预防或治疗肝纤维化/肝硬化(ptl 1)。此外,已经有一些文件提及用于治疗癌症的抗lap抗体(ptl 2)和用于治疗tgfβ1相关疾病的tgfβ1结合免疫球蛋白(ptl 3)。
8.引用列表
9.专利文献
10.[ptl 1]wo 2011102483
[0011]
[ptl 2]wo 2016115345
[0012]
[ptl 3]wo 2017156500
[0013]
非专利文献
[0014]
[npl 1]mccartney-francis,n.l.et al.int.rev.immunol.16,553-580(1998)
[0015]
[npl 2]massague,j.annu.rev.biochem.67,753-791(1998)
[0016]
[npl 3]derynck,r.&miyazono,k.cold spring harbor press(2008)
[0017]
[npl 4]yu,l.et al.kidney int.64,844-856(2003).
[0018]
[npl 5]xu,p.,liu,j.&derynck,r.et al.febs lett.586,1871-1884(2012).
[0019]
[npl 6]millan,f.a.et al.development 111,131-143(1991).
[0020]
[npl 7]kulkarni,a.b.et al.proc.natl acad.sci.usa 90,770-774(1993).
[0021]
[npl 8]shull,m.m.et al.nature 359,693-699(1992).
[0022]
[npl 9]dickson,m.c.et al.development 121,1845-1854(1995).
[0023]
[npl 10]sanford,l.p.et al.development 124,2659-2670(1997).
[0024]
[npl 11]proetzel,g.et al.nature genet.11,409-414(1995).
[0025]
[npl 12]dubois,c.m.et al.j.biol.chem.270,10618-10624(1995)
[0026]
[npl 13]nunes,i.et al.j.am.optom.assoc.69,643-648(1998)
[0027]
[npl 14]annes,j.et al.j.cell sci.116,217-224(2003).
[0028]
[npl 15]schultz-cherry,s.et al.j.biol.chem.269,26775-26782(1994).
[0029]
[npl 16]munger,j.s.et al.cell 96,319-328(1999).
[0030]
[npl 17]shi,m.et al.nature 474,343-349(2011).
[0031]
[npl 18]shi,y.&massague,et al.cell 113,685-700(2003).
[0032]
[npl 19]sanderson,n.et al.proc.natl acad.sci.usa 92,2572-2576(1995).
技术实现要素:
[0033]
技术问题
[0034]
本发明的目的是提供跨物种、人源化和优化的抗潜伏tgf-β1抗体,其抑制蛋白酶介导的潜伏tgf-β1激活而不抑制整联蛋白介导的潜伏tgf-β1激活。本发明还提供了包含抗潜伏tgf-β1抗体和一种或多种免疫检查点抑制剂的联合疗法。
[0035]
技术问题的解决方案
[0036]
本发明人在上述情况下开展专心研究,并因此构建了跨物种、人源化和优化的抗潜伏tgf-β1抗体,其抑制蛋白酶介导的tgf-β1激活而不抑制整联蛋白介导的潜伏tgf-β1激活。此外,当与一种或多种免疫检查点抑制剂联合施用时,抗潜伏tgf-β1抗体显示出抗肿瘤作用。
[0037]
本发明提供了:
[0038]
a1.一种抗潜伏tgf-β1抗体,包含:
[0039]
(a)分别包含seq id no:20、21和22的氨基酸序列的hvr-h1、hvr-h2和hvr-h3;
[0040]
(b)分别包含seq id no:26、27和28的氨基酸序列的hvr-h1、hvr-h2和hvr-h3;
[0041]
(c)分别包含seq id no:32、33和34的氨基酸序列的hvr-h1、hvr-h2和hvr-h3;或
[0042]
(d)分别包含seq id no:38、39和40的氨基酸序列的hvr-h1、hvr-h2和hvr-h3。
[0043]
a2.a1的抗潜伏tgf-β1抗体,其进一步包含:
[0044]
(a)分别包含seq id no:23、24和25的氨基酸序列的hvr-l1、hvr-l2和hvr-l3;
[0045]
(b)分别包含seq id no:29、30和31的氨基酸序列的hvr-l1、hvr-l2和hvr-l3;
[0046]
(c)分别包含seq id no:35、36和37的氨基酸序列的hvr-l1、hvr-l2和hvr-l3;和
[0047]
(d)分别包含seq id no:41、42和43的氨基酸序列的hvr-l1、hvr-l2和hvr-l3。
[0048]
a3.一种抗潜伏tgf-β1抗体,包含:
[0049]
(a)分别包含seq id no:20、21和22的氨基酸序列的hvr-h1、hvr-h2和hvr-h3,以及分别包含seq id no:23、24和25的氨基酸序列的hvr-l1、hvr-l2和hvr-l3;
[0050]
(b)分别包含seq id no:26、27和28的氨基酸序列的hvr-h1、hvr-h2和hvr-h3,以及分别包含seq id no:29、30和31的氨基酸序列的hvr-l1、hvr-l2和hvr-l3;
[0051]
(c)分别包含seq id no:32、33和34的氨基酸序列的hvr-h1、hvr-h2和hvr-h3,以及分别包含seq id no:35、36和37的氨基酸序列的hvr-l1、hvr-l2和hvr-l3;或
[0052]
(d)分别包含seq id no:38、39和40的氨基酸序列的hvr-h1、hvr-h2和hvr-h3,以及分别包含seq id no:41、42和43的氨基酸序列的hvr-l1、hvr-l2和hvr-l3。
[0053]
a4.a1至a3中任一项的抗潜伏tgf-β1抗体,包含:
[0054]
(a)(i)与seq id no:12的氨基酸序列具有至少95%序列同一性的vh序列,(ii)与seq id no:13的氨基酸序列具有至少95%序列同一性的vl序列,或(iii)如(i)中的vh序列和如(ii)中的vl序列;
[0055]
(b)(i)与seq id no:14的氨基酸序列具有至少95%序列同一性的vh序列,(ii)与seq id no:15的氨基酸序列具有至少95%序列同一性的vl序列,或(iii)如(i)中的vh序列和如(ii)中的vl序列;
[0056]
(c)(i)与seq id no:16的氨基酸序列具有至少95%序列同一性的vh序列,(ii)与seq id no:17的氨基酸序列具有至少95%序列同一性的vl序列,或(iii)如(i)中的vh序列和如(ii)中的vl序列;或
[0057]
(d)(i)与seq id no:18的氨基酸序列具有至少95%序列同一性的vh序列,(ii)与seq id no:19的氨基酸序列具有至少95%序列同一性的vl序列,或(iii)如(i)中的vh序列和如(ii)中的vl序列。
[0058]
a5.a4的抗潜伏tgf-β1抗体,包含seq id no:12、14、16或18的vh序列。
[0059]
a6.a4或a5的抗潜伏tgf-β1抗体,包含seq id no:13、15、17或19的vl序列。
[0060]
a7.a4至a6中任一项的抗潜伏tgf-β1抗体,包含:
[0061]
(a)seq id no:12的vh序列和seq id no:13的vl序列;
[0062]
(b)seq id no:14的vh序列和seq id no:15的vl序列;
[0063]
(c)seq id no:16的vh序列和seq id no:17的vl序列;或
[0064]
(d)seq id no:18的vh序列和seq id no:19的vl序列。
[0065]
a8.一种抗潜伏tgf-β1抗体,包含:
[0066]
(a)seq id no:12的vh序列和seq id no:13的vl序列;
[0067]
(b)seq id no:14的vh序列和seq id no:15的vl序列;
[0068]
(c)seq id no:16的vh序列和seq id no:17的vl序列;或
[0069]
(d)seq id no:18的vh序列和seq id no:19的vl序列。
[0070]
a9.a1至a8中任一项的抗潜伏tgf-β1抗体,其为人抗体、人源化抗体或嵌合抗体。
[0071]
a10.a1至a9中任一项的抗潜伏tgf-β1抗体,其为全长igg抗体,优选为全长igg1抗体。
[0072]
a11.a1至a9中任一项的抗潜伏tgf-β1抗体,其为双特异性抗体。
[0073]
a12.a1至a11中任一项的抗潜伏tgf-β1抗体,其中所述抗潜伏tgf-β1抗体包含修饰的igg1 fc区,与野生型igg1 fc区相比,所述修饰的igg1 fc区具有降低的效应子功能。
[0074]
a13.a12的抗潜伏tgf-β1抗体,其中根据eu索引,所述修饰的igg1 fc区包含在eu235和/或eu236位置处的氨基酸取代。
[0075]
a14.a12或a13的抗潜伏tgf-β1抗体,其中根据eu索引,所述修饰的igg1 fc区包含l235r和g236r的氨基酸取代。
[0076]
a15.a12至a14中任一项的抗潜伏tgf-β1抗体,其中与野生型igg1 fc区相比,所述修饰的igg1 fc区进一步具有增强的fcrn结合活性。
[0077]
a16.a15的抗潜伏tgf-β1抗体,其中根据eu索引,所述修饰的igg1 fc区在选自由以下组成的组的位置处包含一个或多个氨基酸取代:eu428、eu434、eu438和eu440。
[0078]
a17.a15或a16中任一项的抗潜伏tgf-β1抗体,其中所述修饰的igg1 fc区包含m428l、n434a、q438r和s440e的氨基酸取代。
[0079]
a18.a1至a11中任一项的抗潜伏tgf-β1抗体,其中所述抗潜伏tgf-β1抗体包含修饰的igg1 fc区,其中所述修饰的igg1 fc区包含k214r、l235r和g236r的氨基酸取代。
[0080]
a19.a1至a11中任一项的抗潜伏tgf-β1抗体,其中所述抗潜伏tgf-β1抗体包含修饰的igg1 fc区,其中所述修饰的igg1 fc区包含k214r、l235r、g236r、m428l、n434a、q438r和s440e的氨基酸取代。
[0081]
a20.a1至a11中任一项的抗潜伏tgf-β1抗体,其为抗体片段。
[0082]
a21.一种抗潜伏tgf-β1抗体,包含:
[0083]
(a)seq id no:47的全长重链序列和seq id no:60的全长轻链序列;
[0084]
(b)seq id no:48的全长重链序列和seq id no:61的全长轻链序列;
[0085]
(c)seq id no:49的全长重链序列和seq id no:62的全长轻链序列;
[0086]
(d)seq id no:50的全长重链序列和seq id no:63的全长轻链序列;
[0087]
(e)seq id no:51的全长重链序列和seq id no:64的全长轻链序列;
[0088]
(f)seq id no:52的全长重链序列和seq id no:65的全长轻链序列;
[0089]
(g)seq id no:53的全长重链序列和seq id no:66的全长轻链序列;或
[0090]
(h)seq id no:54的全长重链序列和seq id no:67的全长轻链序列。
[0091]
a22.a1至a21中任一项的抗潜伏tgf-β1抗体,其中潜伏tgfβ-1是人潜伏tgfβ-1、小鼠潜伏tgfβ-1或食蟹猴潜伏tgfβ-1
[0092]
a23.a1至a22中任一项的抗潜伏tgf-β1抗体,其中所述抗潜伏tgf-β1抗体与人潜伏tgf-β1、小鼠潜伏tgf-β1和食蟹猴潜伏tgf-β1结合。
[0093]
a24.a1至a23中任一项的抗潜伏tgf-β1抗体,其中所述抗潜伏tgf-β1抗体与潜伏tgf-β1的潜伏相关肽(lap)区结合。
[0094]
a25.一种免疫缀合物,包含a1至a24中任一项的抗潜伏tgfβ-1抗体和细胞毒性剂。
[0095]
a26.一种分离的核酸,编码a1至a24中任一项的抗潜伏tgfβ-1抗体。
[0096]
a27.一种载体,包含a26的核酸。
[0097]
a28.一种宿主细胞,包含a26的核酸或a27的载体。
[0098]
a29.一种产生抗潜伏tgfβ-1抗体的方法,包括培养a28的宿主细胞以产生所述抗体。
[0099]
a30.a29的方法,进一步包括从所述宿主细胞回收所述抗体。
[0100]
b1.a1至a24中任一项的抗潜伏tgfβ-1抗体或a25的免疫缀合物,用作药物。
[0101]
b2.a1至a24中任一项的抗潜伏tgfβ-1抗体或a25的免疫缀合物,用于治疗纤维化或癌症。
[0102]
b3.a1至a24中任一项的抗潜伏tgfβ-1抗体或a25的免疫缀合物在生产用于治疗纤维化或癌症的药物中的用途。
[0103]
b4.a1至a24中任一项的抗潜伏tgfβ-1抗体或a25的免疫缀合物,与另外的治疗剂联合使用,所述另外的治疗剂优选为免疫检查点抑制剂,用于治疗癌症。
[0104]
b5.b4的抗潜伏tgfβ-1抗体或免疫缀合物,其中所述免疫检查点抑制剂为pd-1轴结合拮抗剂,优选为抗pd-1抗体或抗pd-l1抗体。
[0105]
b6.b4的抗潜伏tgfβ-1抗体或免疫缀合物,其中所述免疫检查点抑制剂为抗pd-l1抗体。
[0106]
b7.b4至b6中任一项的抗潜伏tgfβ-1抗体或免疫缀合物,其中所述免疫检查点抑制剂与所述抗潜伏tgfβ-1抗体或免疫缀合物同时施用。
[0107]
b8.b4至b6中任一项的抗潜伏tgfβ-1抗体或免疫缀合物,其中所述免疫检查点抑制剂在所述抗潜伏tgfβ-1抗体或免疫缀合物施用之前或之后施用。
[0108]
c1.一种药物制剂,包含a1至a24中任一项的抗潜伏tgfβ-1抗体或a25的免疫缀合物,以及药学上可接受的载体。
[0109]
c2.c1的药物制剂,进一步包含另外的治疗剂,优选为免疫检查点抑制剂。
[0110]
c3.c2的药物制剂,其中所述免疫检查点抑制剂为pd-1轴结合拮抗剂,优选为抗pd-1抗体或抗pd-l1抗体。
[0111]
c4.c2的药物制剂,其中所述免疫检查点抑制剂为抗pd-l1抗体。
[0112]
c5.c1至c4中任一项的药物制剂,用于治疗纤维化或癌症。
[0113]
c6.c1至c4中任一项的药物制剂,其与另外的治疗剂联合使用,所述另外的治疗剂剂优选为免疫检查点抑制剂,用于治疗癌症。
[0114]
c7.c6的药物制剂,其中所述免疫检查点抑制剂为pd-1轴结合拮抗剂,优选为抗pd1抗体或抗pd-l1抗体。
[0115]
c8.c6的药物制剂,其中所述免疫检查点抑制剂为抗pd-l1抗体。
[0116]
c9.c6至c8中任一项的药物制剂,其中所述免疫检查点抑制剂与药物制剂同时施用。
[0117]
c10.c6至c8中任一项的药物制剂,其中所述免疫检查点抑制剂在所述药物制剂施用之前或之后施用。
[0118]
d1.一种药物制剂,包含免疫检查点抑制剂和药学上可接受的运载体,与权利要求a1至a24任一项的抗潜伏tgfβ-1抗体或权利要求a25的免疫缀合物联合使用,用于治疗癌症。
[0119]
d2.d1的药物制剂,其中所述免疫检查点抑制剂为pd-1轴结合拮抗剂,优选为抗pd1抗体或抗pd-l1抗体。
[0120]
d3.d1的药物制剂,其中所述免疫检查点抑制剂为抗pd-l1抗体。
[0121]
d4.d1至d3中任一项的药物制剂,其中所述抗潜伏tgfβ-1抗体或免疫缀合物与所述药物制剂同时施用。
[0122]
d5.d1至d3中任一项的药物制剂,其中所述抗潜伏tgfβ-1抗体或免疫缀合物在所述药物制剂施用之前或之后施用。
[0123]
e1.一种治疗患有纤维化或癌症的个体的方法,包括向所述个体施用有效量的a1至a24中任一项的抗潜伏tgfβ-1抗体或a25的免疫缀合物。
[0124]
e2.e1的方法,进一步包括向所述个体施用另外的治疗剂,优选为免疫检查点抑制剂。
[0125]
e3.e1或e2的方法,其中所述免疫检查点抑制剂为pd-1轴结合拮抗剂,优选为抗
pd-1抗体或抗pd-l1抗体。
[0126]
e4.e3的方法,其中所述免疫检查点抑制剂为抗pd-l1抗体。
[0127]
e5.e1至e4中任一项的方法,其中所述免疫检查点抑制剂与所述抗潜伏tgfβ-1抗体或免疫缀合物同时施用。
[0128]
e6.e1至e4中任一项的方法,其中所述免疫检查点抑制剂在所述抗潜伏tgfβ-1抗体或免疫缀合物施用之前或之后施用。
附图说明
[0129]
[图1a]图1a显示了抗体与baf3细胞上细胞表面潜伏tgf-β1结合的结果。ic17-higg1代表作为阴性对照的抗klh抗体。ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191和ht0947ae09-sg191代表抗潜伏tgf-β1抗体。
[0130]
[图1b]图1b显示了抗体与freestyle
tm 293-f细胞上细胞表面潜伏tgf-β1结合的结果。ic17-higg1代表作为阴性对照的抗klh抗体。ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191和ht0947ae09-sg191代表抗潜伏tgf-β1抗体。
[0131]
[图2a]图2a显示了抗体与小鼠成熟tgf-β1结合的结果。gc1008-f1332m代表作为阳性对照的抗成熟tgf-β抗体。ic17-higg1代表作为阴性对照的抗klh抗体。ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191和ht0947ae09-sg191代表抗潜伏tgf-β1抗体。
[0132]
[图2b]图2b显示了抗体与人成熟tgf-β1结合的结果。gc1008-f1332m代表作为阳性对照的抗成熟tgf-β抗体。ic17-higg1代表作为阴性对照的抗klh抗体。ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191和ht0947ae09-sg191代表抗潜伏tgf-β1抗体。
[0133]
[图2c]图2c显示了抗体与小鼠lap结合的结果。gc1008-f1332m代表抗成熟tgf-β抗体。ic17-higg1代表作为阴性对照的抗klh抗体。ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191和ht0947ae09-sg191代表抗潜伏tgf-β1抗体。
[0134]
[图3a]图3a显示了针对自发性小鼠潜伏tgf-β1激活的抗体活性结果。mslc代表重组小鼠潜伏tgf-β1。ic17-higg1代表作为阴性对照的抗klh抗体。ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191和ht0947ae09-sg191代表抗潜伏tgf-β1抗体。
[0135]
[图3b]图3b显示了针对自发性人潜伏tgf-β1激活的抗体活性结果。hslc代表重组人潜伏tgf-β1。ic17-higg1代表作为阴性对照的抗klh抗体。ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191和ht0947ae09-sg191代表抗潜伏tgf-β1抗体。
[0136]
[图4a]图4a显示了针对纤溶酶(pln)介导的小鼠潜伏tgf-β1激活的抗体活性结果。mslc代表重组小鼠潜伏tgf-β1。ic17-higg1代表作为阴性对照的抗klh抗体。ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191和ht0947ae09-sg191代表抗潜伏tgf-β1抗体。
[0137]
[图4b]图4b显示了针对纤溶酶(pln)介导的人潜伏tgf-β1激活的抗体活性结果。hslc代表重组人潜伏tgf-β1。ic17-higg1代表作为阴性对照的抗klh抗体。ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191和ht0947ae09-sg191代表抗潜伏tgf-β1抗体。
[0138]
[图5a]图5a显示了针对激肽释放酶(plk)介导的小鼠潜伏tgf-β1激活的抗体活性结果。mslc代表重组小鼠潜伏tgf-β1。ic17-higg1代表作为阴性对照的抗klh抗体。ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191和ht0947ae09-sg191代表抗潜伏tgf-β1抗体。
[0139]
[图5b]图5b显示了针对激肽释放酶(plk)介导的人潜伏tgf-β1激活的抗体活性结果。hslc代表重组人潜伏tgf-β1。ic17-higg1代表作为阴性对照的抗klh抗体。ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191和ht0947ae09-sg191代表抗潜伏tgf-β1抗体。
[0140]
[图6a]图6a显示了针对基质金属蛋白酶(mmp)2介导的人潜伏tgf-β1激活的抗体活性的结果。hslc代表重组人潜伏tgf-β1。ic17-higg1代表作为阴性对照的抗klh抗体。ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191和ht0947ae09-sg191代表抗潜伏tgf-β1抗体。
[0141]
[图6b]图6b显示了针对基质金属蛋白酶(mmp)9介导的人潜伏tgf-β1激活的抗体活性结果。hslc代表重组人潜伏tgf-β1。ic17-higg1代表作为阴性对照的抗klh抗体。ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191和ht0947ae09-sg191代表抗潜伏tgf-β1抗体。
[0142]
[图7a]图7a显示了针对纤溶酶(pln)介导的小鼠潜伏tgf-β1切割的抗体活性结果。cam代表卡莫司他,其是用作对照的蛋白酶抑制剂。ae04(ht0947ae04-sg191)、ae07(ht0947ae07-sg191)、ae08(ht0947ae08-sg191)和ae09(ht0947ae09-sg191)代表抗潜伏tgf-β1抗体。
[0143]
[图7b]图7b显示了针对纤溶酶(pln)介导的人潜伏tgf-β1切割的抗体活性的结果。cam代表卡莫司他,其是用作对照的蛋白酶抑制剂。ae04(ht0947ae04-sg191)、ae07(ht0947ae07-sg191)、ae08(ht0947ae08-sg191)和ae09(ht0947ae09-sg191)代表抗潜伏tgf-β1抗体。
[0144]
[图8]图8显示了小鼠pbmc中针对整联蛋白介导的小鼠tgf-β1激活的抗体活性的结果。ic17-higg1代表作为阴性对照的抗klh抗体。gc1008-f1332m代表作为阳性对照的抗成熟tgf-β抗体。rge代表rge肽。rgd代表作为阳性对照的rgd肽。ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191和ht0947ae09-sg191代表抗潜伏tgf-β1抗体。
[0145]
[图9]图9显示了同种型对照处理组(实心圆)、抗pd-l1处理组(实心正方形)、ht0947ae04-mf18处理组(实心三角形)和ht0947ae04-mf18联合抗pd-l1处理组(叉形)的肿瘤生长曲线。每个点代表每组的平均肿瘤体积。(n=10)
[0146]
[图10]图10显示了同种型对照处理组(实心圆)、抗pd-l1处理组(实心正方形)、ht0947ae04-mf18处理组(实心三角形)和ht0947ae04-mf18联合抗pd-l1处理组的肿瘤生长曲线(叉形)。每个点代表每组的平均肿瘤体积。(n=10)
[0147]
[图11]图11显示了运载体处理组(实心圆)、抗pd-l1处理组(实心正方形)、ht0947ae04-mf18联合抗pd-l1处理组(x)ht0947ae07-sg181联合抗pd-l1处理组(实心三角形)和ht0947ae08-sg181联合抗pd-l1处理组(空心圆)的肿瘤生长曲线。每个点代表每组的平均肿瘤体积。(n=10)
[0148]
[图12]图12显示了肾脏中羟脯氨酸含量的结果。在单侧输尿管梗阻(uuo)诱导的
小鼠肾纤维化模型中评价单克隆抗体。假手术组代表非疾病诱导的对照组。ic17dk-sg181是用作阴性对照的抗klh抗体。ht0947ae04-sg191、ht0947ae07-sg191和ht0947ae08-sg191代表抗潜伏tgf-β1抗体。
[0149]
[图13]图13显示了运载体处理组(实心圆)、抗小鼠pd-l1抗体处理组(实心正方形)、ht0947ae07-sg191(10mg/kg)联合抗小鼠pd-l1抗体处理组(实心三角形)和ht0947ae07-sg191(30mg/kg)联合抗小鼠pd-l1抗体处理组(空心圆)的肿瘤生长曲线。每个点代表相应组的平均肿瘤体积。(每组n=10)
具体实施方式
[0150]
i.定义
[0151]
用于本文目的的“受体人构架”是包含源自人免疫球蛋白构架或人共有构架的轻链可变结构域(vl)构架或重链可变结构域(vh)构架的氨基酸序列的构架,如下定义。“源自”人免疫球蛋白构架或人共有构架的受体人构架可以包含其相同的氨基酸序列,或它可以含有氨基酸序列变化。在一些实施方案中,氨基酸变化数是10个或更少、9个或更少、8个或更少、7个或更少、6个或更少、5个或更少、4个或更少、3个或更少、或2个或更少。在一些实施方案中,vl受体人构架在序列上与vl人免疫球蛋白构架序列或人共有构架序列具有同一性。
[0152]
术语“结合活性”是指分子(例如,抗体)的一个或多个结合位点与其结合配偶体(例如,抗原)之间的非共价相互作用总和的强度。在本文中,“结合活性”不严格限于结合对的成员(例如,抗体和抗原)之间的1:1相互作用。例如,当结合对的成员反映单价1:1相互作用时,结合活性特别称为内在结合亲和力(affinity)。当结合对的成员能够进行单价结合和多价结合时,结合活性是每种结合强度的总和。分子x与其配偶体y的结合活性通常可以由解离常数(kd)或“每单位量配体的分析物结合量”(下文中可称为“结合量”)表示。本领域技术人员将理解,通常,解离常数(kd)的值越低表示结合活性越高,并且“每单位配体量的分析物结合量”或“结合量”的值越高表示结合活性越高。结合活性可以通过本领域已知的常用方法测量,包括本文所述的那些方法。以下描述了用于测量结合活性的具体说明性和示例性实施方案。
[0153]“结合活性成熟的”、“亲和力成熟的”抗原结合分子或抗体,“结合活性增加的(增强的)”、或“亲和力增加的(增强的)”抗原结合分子或抗体,是指在一个或多个高变区(hvr)中具有一个或多个改变(例如,取代)的抗体,与不携带此类改变的亲本抗原结合分子或亲本抗体相比,这种改变导致抗原结合分子或抗体对抗原的结合活性提高。
[0154]
术语“抗潜伏tgf-β1抗体”和“可与潜伏tgf-β1结合的抗体”是指能够以足够的结合活性结合潜伏tgf-β1从而使该抗体可作为靶向潜伏tgf-β1的诊断和/或治疗剂的抗体。在一个实施方案中,“可与潜伏tgf-β1结合的抗体”是与潜伏tgf-β1特异性结合的抗体。在一个实施方案中,抗潜伏tgf-β1抗体与无关的非潜伏tgf-β1蛋白的结合活性程度小于该抗体与潜伏tgf-β1的结合活性的约10%,例如,通过放射免疫测定(ria)测量。在某些实施方案中,可与tgf-β1结合的抗体的解离常数(kd)为1微摩尔或更小、100nm或更小、10nm或更小、1nm或更小、0.1nm或更小、0.01nm或更小、或0.001nm或更小(例如10-8
m或更小,例如10-8
m至10-13
m,例如10-9
m至10-13
m)。在某些实施方案中,抗潜伏tgf-β1抗体与在来自不同物种
的潜伏tgf-β1中保守的潜伏tgf-β1表位结合。
[0155]
术语“抗体”在本文中以最广义使用并且涵盖各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们表现出期望的抗原结合活性。术语“抗体”还包括任何包含免疫球蛋白可变重链和/或可变轻链结构的抗原结合分子。
[0156]“抗体片段”是指除完整抗体之外的分子,其包含结合完整抗体所结合抗原的完整抗体的一部分。抗体片段的实例包括但不限于fv、fab、fab'、fab'-sh、f(ab')2;双抗体;线性抗体;单链抗体分子(例如scfv);和由抗体片段形成的多特异性抗体。
[0157]
作为参考抗体的“与相同表位结合的抗体”是指在竞争测定中阻断参考抗体与其抗原结合达50%或更多的抗体,并且相反地,在竞争测定中参考抗体阻断抗体与其抗原的结合达50%或更多。本文提供了示例性竞争测定。
[0158]
术语“癌症”和“癌性”是指或描述哺乳动物中通常以不受调节的细胞生长/增殖为特征的生理状况。癌症的实例包括但不限于癌(carcinoma)、淋巴瘤(例如,霍奇金淋巴瘤和非霍奇金淋巴瘤)、母细胞瘤、肉瘤和白血病。此类癌症的更具体实例包括鳞状细胞癌、小细胞肺癌、非小细胞肺癌、肺腺癌、肺鳞癌、腹膜癌、肝细胞癌、胃肠癌、胰腺癌、神经胶质瘤、宫颈癌、卵巢癌、肝癌(liver cancer)、膀胱癌、肝细胞瘤(hepatoma)、乳腺癌、结肠癌、结直肠癌、子宫内膜癌或子宫癌、唾液腺癌、肾癌、肝癌(liver cancer)、前列腺癌、外阴癌、甲状腺癌、肝癌(hepatic carcinoma)、白血病等淋巴组织增生性疾病,以及各种类型头颈癌。在一个实例中,癌症对免疫检查点抑制剂具有抗性和/或对免疫检查点抑制剂的反应有限。
[0159]
术语“嵌合”抗体是指重链和/或轻链的一部分源自特定来源或物种的抗体,而重链和/或轻链的其余部分来自不同的来源或物种。
[0160]
抗体的“类别”是指抗体的重链所具有的恒定结构域或恒定区的类型。有五个主要类别的抗体:iga、igd、ige、igg和igm,并且其中一些可以进一步分为亚类(同种型),例如,igg1、igg2、igg3、igg4、iga1和iga2。对应于不同类别免疫球蛋白的重链恒定结构域分别称为α、δ、ε、γ和μ。
[0161]
如本文所用,术语“细胞毒性剂”是指抑制或阻止细胞功能和/或导致细胞死亡或破坏的物质。细胞毒性剂包括但不限于放射性同位素(例如,
211
at、
131
i、
125
i、
90
y、
186
re、
188
re、
153
sm、
212
bi、
32
p、
212
pb和lu的放射性同位素);化疗剂或药物(例如,甲氨蝶呤、阿霉素、长春花生物碱(长春新碱、长春碱、依托泊苷)、多柔比星、美法仑、丝裂霉素c、苯丁酸氮芥、柔红霉素或其他嵌入剂);生长抑制剂;酶及其片段,例如核酸分解酶;抗生素;毒素,例如细菌、真菌、植物或动物来源的小分子毒素或酶活性毒素,包括其片段和/或变体;以及下文公开的各种抗肿瘤剂或抗癌剂。
[0162]“效应子功能”是指可归因于抗体fc区的那些生物活性,其随抗体同种型而变化。抗体效应子功能的实例包括:clq结合和补体依赖性细胞毒性(cdc);fc受体结合;抗体依赖性细胞介导的细胞毒性(adcc);吞噬作用;下调细胞表面受体(例如b细胞受体);和b细胞激活。
[0163]“有效量”的药剂(例如,药物制剂)是指在必要的剂量和时间段内实现期望的治疗或预防结果的有效量。
[0164]
术语“fc区”在本文中用于定义含有至少一部分恒定区的免疫球蛋白重链的c端
区。该术语包括天然序列fc区和变异fc区。在一个实施方案中,人igg重链fc区自cys226,或自pro230延伸至重链的羧基端。然而,fc区的c端赖氨酸(lys447)或甘氨酸-赖氨酸(残基446-447)可以存在,也可以不存在。除非本文另有说明,否则fc区或恒定区中氨基酸残基的编号是根据eu编号系统,也称为eu索引,如kabat等人,免疫学目标蛋白序列,第5版公共卫生服务,国立卫生研究院,bethesda,md,1991所述。
[0165]“构架”或“fr”是指高变区(hvr)残基以外的可变结构域残基。可变结构域的fr通常由四个fr结构域组成:fr1、fr2、fr3和fr4。因此,在vh(或vl)中hvr和fr序列通常以以下列序列出现:fr1-h1(l1)-fr2-h2(l2)-fr3-h3(l3)-fr4。
[0166]
术语“全长抗体”、“完整抗体”和“全抗体”在本文中可互换使用,是指具有与天然抗体结构基本相似的结构或具有含有本文定义的fc区的重链的抗体。
[0167]
术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可互换使用,是指已引入外源核酸的细胞,包括此类细胞的子代。宿主细胞包括“转化体”和“转化细胞”,包括原代转化细胞和由其衍生的子代,不考虑传代次数。子代在核酸含量上可能与亲本细胞不完全相同,而可能含有突变。具有与在最初转化的细胞中筛选或选择的功能或生物活性相同的功能或生物活性的突变子代包括在本文中。
[0168]“人抗体”是具有与由人或人细胞产生的或源自利用人抗体库或其他人抗体编码序列的非人来源的抗体的氨基酸序列相对应的氨基酸序列的抗体。人抗体的这一定义特别排除包含非人抗原结合残基的人源化抗体。
[0169]“人共有构架”是代表人免疫球蛋白vl或vh构架序列选择中最常出现的氨基酸残基的构架。通常,人免疫球蛋白vl或vh序列来自可变结构域序列的亚组。通常,序列亚组是如kabat等人,免疫学目标蛋白序列,第五版,nih出版91-3242,bethesda md(1991),第1-3卷的亚组。在一个实施方案中,对于vl,该亚组是如kabat等人(同上)的亚组κi。在一个实施方案中,对于vh,该亚组是如kabat等人(同上)的亚组iii。
[0170]“人源化”抗体是指包含来自非人hvr的氨基酸残基和来自人fr的氨基酸残基的嵌合抗体。在某些实施方案中,人源化抗体将包含基本上所有的至少一个,并且通常两个可变结构域,其中所有或基本上所有的hvr(例如,cdr)对应于非人抗体的那些,并且所有或基本上所有的fr对应于人抗体的那些。人源化抗体可以任选地包含源自人抗体的抗体恒定区的至少一部分。抗体的“人源化形式”,例如非人抗体,是指经过人源化的抗体。
[0171]
如本文所用,术语“高变区”或“hvr”是指其序列具有高变性(“互补决定区”或“cdr”)和/或形成结构限定的环(“高变环”)和/或含有抗原接触残基(“抗原接触”)的抗体可变结构域的每个区。通常,抗体包含六个hvr:三个在vh(h1、h2、h3)中,并且三个在vl(l1、l2、l3)中。本文的示例性hvr包括:
[0172]
(a)高变环出现在氨基酸残基26-32(l1)、50-52(l2)、91-96(l3)、26-32(h1)、53-55(h2)和96-101(h3)(chothia和lesk,j.mol.biol.196:901-917(1987));
[0173]
(b)cdr出现在氨基酸残基24-34(l1)、50-56(l2)、89-97(l3)、31-35b(h1)、50-65(h2)和95-102(h3)(kabat等人,免疫学目标蛋白序列,第5版公共卫生服务,国立卫生研究院,bethesda,md(1991));
[0174]
(c)抗原接触出现在氨基酸残基27c-36(l1)、46-55(l2)、89-96(l3)、30-35b(h1)、47-58(h2)和93-101(h3)(maccallum等人j.mol.biol.262:732-745(1996));和
[0175]
(d)(a)、(b)和/或(c)的组合,包括hvr氨基酸残基46-56(l2)、47-56(l2)、48-56(l2)、49-56(l2)、26-35(h1)、26-35b(h1)、49-65(h2)、93-102(h3)和94-102(h3)。
[0176]
除非另有说明,否则可变结构域中的hvr残基和其他残基(例如,fr残基)在本文中根据kabat等人(同上)编号。
[0177]“免疫缀合物”是与一种或多种异源分子(包括但不限于细胞毒性剂)缀合的抗体。
[0178]“个体”或“受试者”是哺乳动物。哺乳动物包括但不限于驯养动物(例如,牛、绵羊、猫、犬和马)、灵长类动物(例如,人和非人灵长类动物,例如猴)、兔和啮齿动物(例如,小鼠和大鼠)。在某些实施方案中,个体或受试者是人。
[0179]“分离的”抗体是已与其天然环境的组分分开的抗体。在一些实施方案中,抗体被纯化至大于95%或99%的纯度,如通过例如电泳(例如,sds-page、等电聚焦(ief)、毛细管电泳)或色谱法(例如,离子交换或反向相hplc)确定。有关抗体纯度评估方法的综述,参见,例如,flatman等人,j.chromatogr.b 848:79-87(2007)。
[0180]“分离的”核酸是指已与其天然环境的组分分开的核酸分子。分离的核酸包括常规含有核酸分子的细胞中所含有的核酸分子,但该核酸分子存在于染色体外或位于不同于其天然染色体位置的染色体位置。
[0181]“编码抗潜伏tgf-β1抗体的分离的核酸”或“编码抗潜伏tgf-β1抗体的核酸”是指编码抗体重链和轻链(或其片段)的一种或多种核酸分子,在单一载体或分开的载体中包括此类核酸分子,并且此类核酸分子存在于宿主细胞中的一个或多个位置。
[0182]
如本文所用,术语“单克隆抗体”是指从基本上均质的抗体群中获得的抗体,即,组成该群的单个抗体是相同的和/或结合相同表位,除了可能的变异抗体,例如,含有天然发生的突变或在单克隆抗体制剂的生产过程中产生的突变,此类变体通常以少量存在。与多克隆抗体制剂相反(多克隆抗体制剂通常包括针对不同决定簇(表位)的不同抗体),单克隆抗体制剂的每个单克隆抗体针对抗原上的单个决定簇。因此,修饰语“单克隆”表示从基本上均质的抗体群中获得的抗体的特征,并且不应被解释为需要通过任何特定方法产生抗体。例如,根据本发明使用的单克隆抗体可以通过多种技术制备,包括但不限于杂交瘤方法、重组dna方法、噬菌体展示方法和利用含有全部或部分人免疫球蛋白基因座的转基因动物的方法,用于制备本文描述的单克隆抗体的此类方法和其他示例性方法。
[0183]“裸抗体”是指未与异源部分(例如,细胞毒性部分)或放射性标记缀合的抗体。裸抗体可以存在于药物制剂中。
[0184]“天然抗体”是指具有不同结构的天然存在的免疫球蛋白分子。例如,天然igg抗体是约150,000道尔顿的异源四聚体糖蛋白,由二硫键连接的两条相同的轻链和两条相同的重链组成。从n端至c端,每条重链均具有可变区(vh),也称为可变重链结构域或重链可变结构域,后接三个恒定结构域(ch1、ch2和ch3)。类似地,从n端至c端,每条轻链均具有可变区(vl),也称为可变轻链结构域或轻链可变结构域,后接恒定轻链(cl)结构域。基于其恒定结构域的氨基酸序列,抗体的轻链可被指定为两种类型中的一种,称为κ(kappa)和λ(lambda)。
[0185]
术语“包装插页”用于指通常在治疗产品的市售包装中所包括的说明,其中包含有关适应症,有关使用此类治疗产品的用法、剂量、施用、联合治疗、禁忌症和/或警告的信息。
[0186]
相对于参考多肽序列的“氨基酸序列同一性百分比(%)”定义为在比对序列并引
入空位(如有必要)以实现最大序列同一性百分比后,并且不考虑任何保守取代作为序列同一性的一部分,候选序列中与参考多肽序列中的氨基酸残基相同的氨基酸残基的百分比。可以以本领域技术范围内的各种方式(例如,使用公开可用的计算机软件,例如blast、blast-2、align、megalign(dnastar)软件,或genetyx(注册商标)(genetyx co.,ltd.))实现用于确定氨基酸序列同一性百分比的比对。本领域技术人员可以确定用于比对序列的合适参数,包括在被比较序列的全长上实现最大比对所需的任何算法。
[0187]
align-2序列比较计算机程序由genentech,inc.编写,源代码已与用户文档一起存档在美国版权局,华盛顿特区,20559,它以美国版权注册号txu510087注册。align-2程序可从加利福尼亚州南旧金山的genentech,inc.公开获得,或者可以从源代码编译。align-2程序应经编译以在unix操作系统(包括数字unix v4.0d)上使用。所有序列比较参数均由align-2程序设置并且保持不变。在采用align-2进行氨基酸序列比较的情况下,给定氨基酸序列a对、与或针对给定氨基酸序列b的氨基酸序列同一性%(可以可选地表述为给定氨基酸序列a具有或包含对、与或针对给定氨基酸序列b的特定氨基酸序列同一性%)计算如下:
[0188]
x/y分数的100倍
[0189]
其中x是序列比对程序align-2在该程序的a和b比对中评分为相同匹配的氨基酸残基数,并且其中y是b中氨基酸残基的总数。应当理解,当氨基酸序列a的长度不等于氨基酸序列b的长度时,a与b的氨基酸序列同一性%将不等于b与a的氨基酸序列同一性%。除非另外特别说明,否则本文所用的所有氨基酸序列同一性%值均如前段所述使用align-2计算机程序获得。
[0190]
术语“药物制剂”是指其形式使得其中所含的活性成分的生物活性有效,并且不含对该制剂所施用的受试者具有不可接受毒性的另外的组分的制剂。
[0191]“药学上可接受的载体”是指药物制剂中除活性成分之外的对受试者无毒的成分。药学上可接受的载体包括但不限于缓冲剂、赋形剂、稳定剂或防腐剂。
[0192]
除非另有说明,否则本文所用术语“tgf-β1”是指来自任何脊椎动物来源(包括哺乳动物,例如灵长类动物(例如人)和啮齿动物(例如小鼠和大鼠))的任何天然tgf-β1。该术语涵盖“全长”未加工的tgf-β1以及在细胞中加工产生的任何形式的tgf-β1。该术语还涵盖天然存在的tgf-β1变体,例如剪接变体或等位基因变体。示例性人tgf-β1前蛋白原的氨基酸序列在seq id no:68(ncbi refseq:np_000651.3)中显示,并且编码示例性人tgf-β1的核酸序列在seq id no:69(ncbi refseq:nm_000660.6)中显示。示例性小鼠tgf-β1前蛋白原的氨基酸序列在seq id no:70(ncbi refseq:np_035707.1)中显示,并且编码示例性小鼠tgf-β1的核酸序列在seq id no:71(ncbi参考序列:nm_011577.2)中显示。示例性食蟹猴tgf-β1前蛋白原的氨基酸序列在seq id no:72(ncbi refseq:xp_005589396.1)中显示,并且编码示例性食蟹猴tgf-β1的核酸序列在seq id no:73(ncbi refseq:xm_005589339.2)中显示。术语“tgf-β1”包括潜伏tgf-β1和成熟的tgf-β1。
[0193]
如本文所用,术语“潜伏tgf-β1”是指形成潜伏tgf-β1复合体(“细胞表面潜伏tgf-β1”、llc或slc(见下文))和/或不能与其受体结合的任何tgf-β1。转化生长因子-β1(tgf-β1)是tgf-β的成员,它是tgf-β超家族的成员。与tgf-β超家族的其他成员一样,tgf-β以前体蛋白合成,其形成同源二聚体,该同源二聚体与其潜伏相关肽(lap)和潜伏tgf-β结合蛋白
(ltbp)相互作用以形成更大复合体,称为大潜伏复合体(llc)。示例性潜伏人tgf-β1(tgf-β同源二聚体及其lap)的氨基酸序列是seq id no:68的氨基酸30-390。示例性小鼠潜伏tgf-β1(tgf-β同源二聚体及其lap)的氨基酸序列是seq id no:70的氨基酸30-390。示例性潜伏食蟹猴tgf-β1(tgf-β同源二聚体及其lap)的氨基酸序列是seq id no:72的氨基酸30-390。
[0194]
由tgf-β同源二聚体及其lap形成的复合体称为小潜伏复合体(slc)。这种潜伏复合体使tgf-β保持非活性形式,不能与其受体结合。slc可以与另外的蛋白(潜伏tgf-β结合蛋白(ltbp))共价连接,形成大潜伏复合体(llc)。已知有四种不同的ltbp同种型,ltbp-1、ltbp-2、ltbp-3和ltbp-4。已报道ltbp-1、ltbp-3和ltbp-4与slc结合(参见,例如,rifkin等人,j biol chem.2005mar 4;280(9):7409-12)。slc还可以与其他另外的蛋白(例如糖蛋白a重复优势蛋白(garp)或富含亮氨酸重复的蛋白33(lrrc33))共价连接。garp和lrrc具有跨膜结构域并与细胞表面上的lap缔合(参见,例如,wang等人,mol biol cell.2012mar;23(6):1129-39)。对于llc,已报道llc通过ltbp的n端与细胞外基质(ecm)共价缔合(参见,例如,saharinen等人,cytokine growth factor rev.1999jun;10(2):99-117.)。在一些实施方案中,与细胞表面上的ecm缔合的潜伏tgf-β1被称为“细胞表面潜伏tgf-β1”。
[0195]
如本文所用,术语“活性tgf-β1”、“成熟tgf-β1”或“活性成熟tgf-β1”是指不形成潜伏tgf-β1复合体(llc或slc)并且能够与其受体结合的任何tgf-β1同源二聚体。tgf-β1激活过程涉及llc从ecm释放,然后进一步蛋白水解lap以释放活性tgf-β至其受体。已知广泛的蛋白酶,包括纤溶酶(pln)、前激肽释放酶(plk)、基质金属蛋白酶(mmp)2、mmp9、mmp13、mmp14、凝血酶、类胰蛋白酶和钙蛋白酶,可切割潜伏tgf-β并释放活性tgf-β。在本发明的上下文中,这些蛋白酶可以统称为“(潜伏)tgf-β-切割蛋白酶”或“(潜伏)tgf-β1-切割蛋白酶”。除了蛋白酶外,血小板反应蛋白1(tsp-1)、神经毡蛋白-1(nrp1)、adamsts1和底板反应蛋白(f-spondin)也可激活潜伏tgf-β。备选地,在机械延伸时,整联蛋白(优选整联蛋白αvβ8和/或整联蛋白αvβ6)可以通过与lap中存在的rgd基序结合并诱导成熟tgf-β从其潜伏复合体形式中释放以激活tgf-β。
[0196]
如本文所用,“治疗(treatment)”(及其语法变体,例如“治疗(treat或treating)”)是指试图改变被治疗个体的自然病程的临床干预,并且可以用于预防或在临床病理病程中进行。治疗的期望效果包括但不限于预防疾病的发生或复发、缓解症状、减少疾病的任何直接或间接病理后果、防止转移、降低疾病进展速度、改善或缓解疾病状态,以及缓解或改善预后。在一些实施方案中,本发明的抗体用于延迟疾病发展或减缓疾病进展。
[0197]
术语“可变区”或“可变结构域”是指参与抗体与抗原结合的抗体重链或轻链的结构域。天然抗体的重链和轻链可变结构域(分别为vh和vl)通常具有相似结构,每个结构域包含四个保守构架区(fr)和三个高变区(hvr)。(参见,例如,kindt等人,kuby immunology,第6版,w.h.freeman and co.,第91页(2007))。单一vh或vl结构域可足以赋予抗原结合特异性。此外,结合特定抗原的抗体可以使用来自结合抗原的抗体的vh或vl结构域分离以分别筛选互补vl或vh结构域的文库。参见,例如,portolano等人,j.immunol.150:880-887(1993);clarkson等人,nature352:624-628(1991)。
[0198]
如本文所用,术语“载体”是指能够增殖与其连接的另一种核酸的核酸分子。该术语包括作为自我复制核酸结构的载体,以及整合至已将其引入的宿主细胞基因组中的载体。某些载体能够指导与它们可操作地连接的核酸的表达。此类载体在本文中称为“表达载
体”。
[0199]
ii.组合物和方法
[0200]
一方面,本发明部分基于抗潜伏tgf-β1抗体及其用途。在某些实施方案中,提供了与tgf-β1结合的抗体。本发明的抗体可用于,例如,诊断或治疗纤维化,优选心肌纤维化、肺纤维化、肝纤维化、肾纤维化、皮肤纤维化、眼部纤维化和骨髓纤维化。本发明的抗体还可用于,例如,癌症的诊断或治疗。癌症的实例包括但不限于癌、淋巴瘤(例如,霍奇金淋巴瘤和非霍奇金淋巴瘤)、母细胞瘤、肉瘤和白血病。此类癌症的更具体实例包括鳞状细胞癌、小细胞肺癌、非小细胞肺癌、肺腺癌、肺鳞癌、腹膜癌、肝细胞癌、胃肠癌、胰腺癌、神经胶质瘤、宫颈癌、卵巢癌、肝癌、膀胱癌、肝细胞瘤、乳腺癌、结肠癌、结直肠癌、子宫内膜癌或子宫癌、唾液腺癌、肾癌、肝癌、前列腺癌、外阴癌、甲状腺癌、肝癌、白血病等淋巴组织增生性疾病,以及各种类型头颈癌。
[0201]
a.示例性抗潜伏tgf-β1抗体
[0202]
一方面,本发明提供了与潜伏tgf-β1结合的分离的抗体。在进一步的实施方案中,抗潜伏tgf-β1抗体与潜伏tgf-β1的潜伏相关蛋白(lap)区结合。lap区的实例包含人tgf-β1前蛋白原(seq id no:1)的氨基酸30-278。如上所述,lap是潜伏tgf-β1的组分。在一些实施方案中,抗潜伏tgf-β1抗体以10-8
nm或更小、10-9
nm或更小、或10-10
nm或更小的解离常数(kd)与潜伏tgf-β1结合。
[0203]
一方面,抗潜伏tgf-β1抗体与潜伏tgf-β1形成llc,和/或潜伏tgf-β1与garp或lrrc33形成的复合体结合。在某些实施方案中,抗潜伏tgf-β1抗体与细胞表面潜伏tgf-β1结合,该细胞表面潜伏tgf-β1是与细胞表面上的细胞外基质(ecm)缔合的潜伏tgf-β1。另一方面,抗潜伏tgf-β1抗体与潜伏tgf-β1结合,其中潜伏tgf-β1的lap区不与ltbp连接,形成小潜伏复合体(slc)。在某些实施方案中,slc以可溶形式存在。在一些实施方案中,抗潜伏tgf-β1抗体以10-8
nm或更小、10-9
nm或更小、或10-10
nm或更小的解离常数(kd)与潜伏tgf-β1(细胞表面潜伏tgf-β1、llc或slc)结合。
[0204]
一方面,抗潜伏tgf-β1抗体抑制潜伏tgf-β1激活。如本文所用,术语潜伏tgf-β1“激活”是指成熟tgf-β1从lap释放的任何过程,其是潜伏tgf-β1的组成部分。潜伏tgf-β1激活可以,例如,通过使用本领域已知或本文所述的各种技术测量成熟tgf-β1和/或测量成熟tgf-β1活性进行检测。在一些实施方案中,抗潜伏tgf-β1抗体抑制成熟tgf-β1从潜伏tgf-β1释放。如上所述,已报道成熟tgf-β1通过激活剂(例如蛋白酶、整联蛋白和其他非蛋白酶激活剂)从潜伏tgf-β1释放。激活潜伏tgf-β1的蛋白酶的非限制性实例包括纤溶酶(pln)、前激肽释放酶(plk)、基质金属蛋白酶(mmp)2和mmp9。在一些实施方案中,抗潜伏tgf-β1抗体抑制蛋白酶介导和/或整联蛋白介导的成熟tgf-β1从潜伏tgf-β1释放。如上所述,蛋白酶切割潜伏tgf-β1的lap区,导致成熟tgf-β1释放。在一些实施方案中,pln和/或plk的切割位点位于由lap多肽的氨基酸56-59组成的片段内。
[0205]
一方面,抗潜伏tgf-β1抗体抑制成熟tgf-β1从潜伏tgf-β1的蛋白酶介导的释放而不抑制蛋白酶介导的潜伏tgf-β1的lap部分的切割。在一些实施方案中,抗潜伏tgf-β1抗体抑制成熟tgf-β1从潜伏tgf-β1的蛋白酶介导的释放并允许蛋白酶切割lap区,同时抗潜伏tgf-β1抗体与潜伏tgf-β1的lap区结合。在一些实施方案中,抗潜伏tgf-β1抗体不阻断蛋白酶接近潜伏tgf-β1,特别是接近pln和/或plk的切割位点。在其他实施方案中,抗潜伏tgf-β
1抗体不与潜伏tgf-β1的lap部分的蛋白酶切割位点,尤其是pln和/或plk的切割位点结合。
[0206]
在一些实施方案中,抑制蛋白酶介导的成熟tgf-β1从潜伏tgf-β1释放的抗潜伏tgf-β1抗体是(i)抑制由一种或多种蛋白酶介导的lap区切割的抗体,但(ii)不抑制由其他蛋白酶介导的lap区的切割。例如,抗潜伏tgf-β1抗体(1-i)通过抑制mmp2和/或mmp9介导的潜伏tgf-β1的lap部分的切割来抑制mmp2和/或mmp9介导的成熟tgf-β1释放,以及(1-ii)抑制pln和/或plk介导的成熟tgf-β1释放而不抑制pln和/或plk介导的潜伏tgf-β1的lap部分的切割。备选地,抗潜伏tgf-β1抗体(2-i)通过抑制pln和/或plk介导的潜伏tgf-β1的lap部分的切割来抑制pln和/或plk介导的成熟tgf-β1释放,以及(2-ii)抑制mmp2和/或mmp9介导的成熟tgf-β1释放而不抑制mmp2和/或mmp9介导的潜伏tgf-β1的lap部分的切割。备选地,抗潜伏tgf-β1抗体(3-i)抑制pln和/或plk介导的成熟tgf-β1释放而不抑制pln和/或plk介导的潜伏tgf-β1的lap部分的切割,以及(3-ii)抑制mmp2和/或mmp9介导的成熟tgf-β1释放而不抑制mmp2和/或mmp9介导的潜伏tgf-β1的lap部分的切割。
[0207]
在一些实施方案中,“抑制潜伏tgf-β1激活”的抗体包括导致tgf-β1激活减少至少5%、10%、15%、20%、25%、30%、35%或40%或更多的抗体。在其他实施方案中,“抑制蛋白酶介导的成熟tgf-β1从潜伏tgf-β1释放”的抗体包括导致蛋白酶介导的成熟tgf-β1从潜伏tgf-β1释放减少至少5%、10%、15%、20%、25%、30%、35%或40%或更多的抗体。在进一步的实施方案中,抑制蛋白酶介导的成熟tgf-β1从潜伏tgf-β1释放“而不抑制蛋白酶介导的潜伏tgf-β1的lap区的切割”的抗体包括导致蛋白酶介导的潜伏tgf-β1的lap区切割减少50%或更少、45%或更少、40%或更少、35%或更少、30%或更少、25%或更少、20%或更少、15%或更少、10%或更少、5%或更少的抗体。
[0208]
在一些实施方案中,抗潜伏tgf-β1抗体稳定潜伏tgf-β1的lap区的结构而不抑制蛋白酶介导的潜伏tgf-β1的lap区的切割。当抗潜伏tgf-β1抗体“稳定”lap区的结构时,如本文所用,由抗潜伏tgf-β1抗体包围的lap区保持在特定结构中,由此成熟tgf-β1无法释放。在进一步的实施方案中,由抗潜伏tgf-β1抗体稳定的潜伏tgf-β1可以被整联蛋白(优选整联蛋白αvβ8和/或整联蛋白αvβ6)激活。在某些实施方案中,由抗潜伏tgf-β1抗体稳定的lap区已经蛋白酶切割或未切割。在一些实施方案中,抗潜伏tgf-β1抗体稳定潜伏tgf-β1的lap区的结构并允许蛋白酶切割lap区,同时抗潜伏tgf-β1抗体与潜伏tgf-β1的lap区结合。在一些实施方案中,抗潜伏tgf-β1抗体稳定潜伏tgf-β1的lap区的结构而不阻断蛋白酶接近潜伏tgf-β1,尤其是pln和/或plk切割位点。在其他实施方案中,抗潜伏tgf-β1抗体稳定潜伏tgf-β1的lap区的结构而不阻断蛋白酶接近潜伏tgf-β1,尤其是mmp2和/或mmp9的切割位点。
[0209]
一方面,抗潜伏tgf-β1抗体不与成熟tgf-β1结合。在一些实施方案中,抗潜伏tgf-β1抗体以比成熟tgf-β1更高的结合活性与潜伏tgf-β1结合。在某些实施方案中,本发明的抗体以比成熟tgf-β1高至少2、3、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、400、1000、10000或更多倍的结合活性与潜伏tgf-β1结合。
[0210]
一方面,抗潜伏tgf-β1抗体不抑制或不显著抑制整联蛋白介导的tgf-β1激活,即,整合蛋白介导的成熟tgf-β1从潜伏tgf-β1释放。优选地,此处的整联蛋白是整联蛋白αvβ8和/或整联蛋白αvβ6。在一些实施方案中,“不抑制或不显著抑制整联蛋白介导的tgf-β1激活”的抗体包括导致整合蛋白介导的tgf-β1激活(即,整合蛋白介导的成熟tgf-β1从潜伏
tgf-β1释放)减少50%或更少、45%或更少、40%或更少、35%或更少、30%或更少、25%或更少、20%或更少、15%或更少、10%或更少、5%或更少的抗体。
[0211]
一方面,抗潜伏tgf-β1抗体导致与抗tgf-β拮抗剂相关的毒性和/或副作用降低或减少。在一些实施方案中,与诱发对成熟tgf-β1活性的活性剂或诱发对潜伏tgf-β1的活性但抑制蛋白酶和整联蛋白介导的潜伏tgf-β1激活的活性剂相比,抗潜伏tgf-β1抗体,例如本文所述的那些,具有优越的安全性-疗效特征。在一些实施方案中,本公开内容的抗潜伏tgf-β1抗体具有降低的心脏毒性,同时具有比抗成熟tgf-β1抗体更好或相当的疗效。不受任何理论的束缚,本公开内容的抗潜伏tgf-β1抗体不抑制或不显著抑制整联蛋白介导的tgf-β1激活,因此具有降低或减少的由以下引起的毒性和/或副作用:(i)整合蛋白介导的tgf-β1激活或(ii)在tgf-β1被整合蛋白激活的位点的tgf-β1信号传导抑制。因此,本公开内容的抗潜伏tgf-β1抗体可以以治疗有效剂量施用至有需要的受试者而不引起副作用,尤其是心脏毒性。因此,这种方法将扩大剂量范围,在该剂量范围内,患者可以获得疗效和安全性/耐受性。因此,本发明提供了治疗与tgf-β1信号传导相关的疾病的方法,通过向受试者施用有效量的抗潜伏tgf-β1抗体,该抗体不抑制或不显著抑制整联蛋白介导的tgf-β1激活。本发明涵盖了抗潜伏tgf-β1抗体用于降低受试者中与tgf-β1抑制相关的毒性和/或副作用的用途。在一些实施方案中,毒性和/或副作用可以包括心血管毒性、胃肠道毒性、免疫毒性、骨/软骨毒性、生殖毒性和肾毒性。在一些实施方案中,心血管毒性包括但不限于:心脏瓣膜病变,例如,瓣膜间质细胞的出血、炎症、变性和增殖。在一些实施方案中,毒性和/或副作用可以包括出血。在一些实施方案中,毒性和/或副作用可以包括皮肤损伤或肿瘤。在一些实施方案中,毒性和/或副作用可以包括肿瘤进展。
[0212]
在一些实施方案中,本发明的抗潜伏tgf-β1抗体:
[0213]
与潜伏tgf-β1结合;
[0214]
与潜伏tgf-β1形成slc结合;
[0215]
与潜伏tgf-β1形成llc结合;
[0216]
与潜伏tgf-β1与garp或lrrc33形成的复合体结合;
[0217]
与细胞表面潜伏tgf-β1结合;
[0218]
与潜伏tgf-β1的lap区结合;
[0219]
与lap结合;
[0220]
以10-8
nm或更低、10-9
nm或更低、或10-10
nm或更低的解离常数(kd)与潜伏tgf-β1结合;
[0221]
抑制蛋白酶介导的成熟tgf-β1从潜伏tgf-β1释放;
[0222]
不抑制蛋白酶介导的潜伏tgf-β1的lap区的切割;
[0223]
不抑制或不显著抑制整联蛋白介导的成熟tgf-β1从潜伏tgf-β1释放;和/或
[0224]
导致与抗tgf-β1拮抗剂(例如,抗成熟tgf-β抗体)相关的毒性和/或副作用降低或减少。
[0225]
在进一步的实施方案中,本发明的抗潜伏tgf-β1抗体是:
[0226]
单克隆抗体;
[0227]
人抗体、人源化抗体或嵌合抗体;
[0228]
全长igg抗体;和/或
[0229]
抗体片段。
[0230]
一方面,本发明提供了一种抗潜伏tgf-β1抗体,其包含至少一个、两个、三个、四个、五个或六个选自以下的hvr:
[0231]
(a)包含seq id no:20的氨基酸序列的hvr-h1;
[0232]
(b)包含seq id no:21的氨基酸序列的hvr-h2;
[0233]
(c)包含seq id no:22的氨基酸序列的hvr-h3;
[0234]
(d)包含seq id no:23的氨基酸序列的hvr-l1;
[0235]
(e)包含seq id no:24的氨基酸序列的hvr-l2;和
[0236]
(f)包含seq id no:25的氨基酸序列的hvr-l3。
[0237]
一方面,本发明提供了一种抗潜伏tgf-β1抗体,其包含至少一个、两个、三个、四个、五个或六个选自以下的hvr:
[0238]
(a)包含seq id no:26的氨基酸序列的hvr-h1;
[0239]
(b)包含seq id no:27的氨基酸序列的hvr-h2;
[0240]
(c)包含seq id no:28的氨基酸序列的hvr-h3;
[0241]
(d)包含seq id no:29的氨基酸序列的hvr-l1;
[0242]
(e)包含seq id no:30的氨基酸序列的hvr-l2;和
[0243]
(f)包含seq id no:31的氨基酸序列的hvr-l3。
[0244]
一方面,本发明提供了一种抗潜伏tgf-β1抗体,包含至少一个、两个、三个、四个、五个或六个选自以下的hvr:
[0245]
(a)包含seq id no:32的氨基酸序列的hvr-h1;
[0246]
(b)包含seq id no:33的氨基酸序列的hvr-h2;
[0247]
(c)包含seq id no:34的氨基酸序列的hvr-h3;
[0248]
(d)包含seq id no:35的氨基酸序列的hvr-l1;
[0249]
(e)包含seq id no:36的氨基酸序列的hvr-l2;和
[0250]
(f)包含seq id no:37的氨基酸序列的hvr-l3。
[0251]
一方面,本发明提供了一种抗潜伏tgf-β1抗体,包含至少一个、两个、三个、四个、五个或六个选自以下的hvr:
[0252]
(a)包含seq id no:38的氨基酸序列的hvr-h1;
[0253]
(b)包含seq id no:39的氨基酸序列的hvr-h2;
[0254]
(c)包含seq id no:40的氨基酸序列的hvr-h3;
[0255]
(d)包含seq id no:41的氨基酸序列的hvr-l1;
[0256]
(e)包含seq id no:42的氨基酸序列的hvr-l2;和
[0257]
(f)包含seq id no:43的氨基酸序列的hvr-l3。
[0258]
一方面,本发明提供了一种抗潜伏tgf-β1抗体,包含:
[0259]
(a)包含seq id no:20的氨基酸序列的hvr-h1;
[0260]
(b)包含seq id no:21的氨基酸序列的hvr-h2;
[0261]
(c)包含seq id no:22的氨基酸序列的hvr-h3;
[0262]
(d)包含seq id no:23的氨基酸序列的hvr-l1;
[0263]
(e)包含seq id no:24的氨基酸序列的hvr-l2;和
[0264]
(f)包含seq id no:25的氨基酸序列的hvr-l3。
[0265]
一方面,本发明提供了一种抗潜伏tgf-β1抗体,包含:
[0266]
(a)包含seq id no:26的氨基酸序列的hvr-h1;
[0267]
(b)包含seq id no:27的氨基酸序列的hvr-h2;
[0268]
(c)包含seq id no:28的氨基酸序列的hvr-h3;
[0269]
(d)包含seq id no:29的氨基酸序列的hvr-l1;
[0270]
(e)包含seq id no:30的氨基酸序列的hvr-l2;和
[0271]
(f)包含seq id no:31的氨基酸序列的hvr-l3。
[0272]
一方面,本发明提供了一种抗潜伏tgf-β1抗体,包含:
[0273]
(a)包含seq id no:32的氨基酸序列的hvr-h1;
[0274]
(b)包含seq id no:33的氨基酸序列的hvr-h2;
[0275]
(c)包含seq id no:34的氨基酸序列的hvr-h3;
[0276]
(d)包含seq id no:35的氨基酸序列的hvr-l1;
[0277]
(e)包含seq id no:36的氨基酸序列的hvr-l2;和
[0278]
(f)包含seq id no:37的氨基酸序列的hvr-l3。
[0279]
一方面,本发明提供了一种抗潜伏tgf-β1抗体,包含:
[0280]
(a)包含seq id no:38的氨基酸序列的hvr-h1;
[0281]
(b)包含seq id no:39的氨基酸序列的hvr-h2;
[0282]
(c)包含seq id no:40的氨基酸序列的hvr-h3;
[0283]
(d)包含seq id no:41的氨基酸序列的hvr-l1;
[0284]
(e)包含seq id no:42的氨基酸序列的hvr-l2;和
[0285]
(f)包含seq id no:43的氨基酸序列的hvr-l3。
[0286]
一方面,本发明提供了一种抗潜伏tgf-β1抗体,包含seq id no:12中所示的vh序列的hvr-h1、hvr-h2和hvr-h3,以及seq id no:13中所示的vl序列的hvr-l1、hvr-l2和hvr-l3,其中hvr由(a)chothia;(b)kabat;(c)maccallum;或(d)(a)、(b)和/或(c)的组合所定义。
[0287]
一方面,本发明提供了一种抗潜伏tgf-β1抗体,包含seq id no:14中所示的vh序列的hvr-h1、hvr-h2和hvr-h3,以及seq id no:15中所示的vl序列的hvr-l1、hvr-l2和hvr-l3,其中hvr由(a)chothia;(b)kabat;(c)maccallum;或(d)(a)、(b)和/或(c)的组合所定义。
[0288]
一方面,本发明提供了一种抗潜伏tgf-β1抗体,包含seq id no:16中所示的vh序列的hvr-h1、hvr-h2和hvr-h3,以及seq id no:17中所示的vl序列的hvr-l1、hvr-l2和hvr-l3,其中hvr由(a)chothia;(b)kabat;(c)maccallum;或(d)(a)、(b)和/或(c)的组合所定义。
[0289]
一方面,本发明提供了一种抗潜伏tgf-β1抗体,包含seq id no:18中所示的vh序列的hvr-h1、hvr-h2和hvr-h3,以及seq id no:19中所示的vl序列的hvr-l1、hvr-l2和hvr-l3,其中hvr由(a)chothia;(b)kabat;(c)maccallum;或(d)(a)、(b)和/或(c)的组合所定义。
[0290]
在任何上述实施方案中,抗潜伏tgf-β1抗体经人源化。在一个实施方案中,抗潜伏
tgf-β1抗体包含上述实施方案中任一项的hvr,并且进一步包含受体人构架,例如人免疫球蛋白构架或人共有构架。
[0291]
在另一方面,抗潜伏tgf-β1抗体包含重链可变结构域(vh)序列,其与seq id no:12、14、16或18的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性。在某些实施方案中,具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的vh序列包含相对于参考序列的取代(例如,保守取代)、插入或缺失,但是包含该序列的抗潜伏tgf-β1抗体保留了与潜伏tgf-β1结合的能力。在某些实施方案中,在seq id no:12、14、16或18中总共有1至10个氨基酸已被取代、插入和/或缺失。在某些实施方案中,取代、插入或缺失发生在hvr之外的区域中(即,在fr中)。任选地,抗潜伏tgf-β1抗体包含seq id no:12、14、16或18中的vh序列,包括该序列的翻译后修饰。在特定实施方案中,vh包含一个、两个或三个选自以下的hvr:(a)包含seq id no:20、26、32或38的氨基酸序列的hvr-h1,(b)包含seq id no:21、27、33或39的氨基酸序列的hvr-h2,和(c)包含seq id no:22、28、34或40的氨基酸序列的hvr-h3。翻译后修饰包括但不限于通过焦谷氨酰化将重链或轻链n端的谷氨酰胺或谷氨酸修饰为焦谷氨酸。
[0292]
在另一方面,提供了一种抗潜伏tgf-β1抗体,其中该抗体包含轻链可变结构域(vl),其与seq id no:13、15、17或19的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性。在某些实施方案中,具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的vl序列包含相对于参考序列的取代(例如,保守取代)、插入或缺失,但是包含该序列的抗潜伏tgf-β1抗体保留了与潜伏tgf-β1结合的能力。在某些实施方案中,在seq id no:13、15、17或19中总共有1至10个氨基酸已被取代、插入和/或缺失。在某些实施方案中,取代、插入或缺失发生在hvr之外的区域中(即,在fr中)。任选地,抗潜伏tgf-β1抗体包含seq id no:13、15、17或19中的vl序列,包括该序列的翻译后修饰。在特定实施方案中,vl包含一个、两个或三个选自以下的hvr:(a)包含seq id no:23、29、35或41的氨基酸序列的hvr-l1;(b)包含seq id no:24、30、36或42的氨基酸序列的hvr-l2;和(c)包含seq id no:25、31、37或43的氨基酸序列的hvr-l3。翻译后修饰包括但不限于通过焦谷氨酰化将重链或轻链n端的谷氨酰胺或谷氨酸修饰为焦谷氨酸。
[0293]
在另一方面,提供了一种抗潜伏tgf-β1抗体,其中该抗体包含如以上提供的任何实施方案中的vh和如以上提供的任何实施方案中的vl。在一个实施方案中,该抗体包含分别在seq id no:12和seq id no:13中所示的vh和vl序列,包括那些序列的翻译后修饰。翻译后修饰包括但不限于通过焦谷氨酰化将重链或轻链n端的谷氨酰胺或谷氨酸修饰为焦谷氨酸。
[0294]
在一个实施方案中,该抗体包含分别在seq id no:14和seq id no:15中所示的vh和vl序列,包括那些序列的翻译后修饰。翻译后修饰包括但不限于通过焦谷氨酰化将重链或轻链n端的谷氨酰胺或谷氨酸修饰为焦谷氨酸。
[0295]
在一个实施方案中,该抗体包含分别在seq id no:16和seq id no:17中所示的vh和vl序列,包括那些序列的翻译后修饰。翻译后修饰包括但不限于通过焦谷氨酰化将重链或轻链n端的谷氨酰胺或谷氨酸修饰为焦谷氨酸。
[0296]
在一个实施方案中,该抗体包含分别在seq id no:18和seq id no:19中所示的vh
和vl序列,包括那些序列的翻译后修饰。翻译后修饰包括但不限于通过焦谷氨酰化将重链或轻链n端的谷氨酰胺或谷氨酸修饰为焦谷氨酸。
[0297]
还一方面,本发明提供了与本文提供的抗潜伏tgf-β1抗体结合相同表位的抗体。例如,在某些实施方案中,提供了与如下所示抗体结合相同表位的抗体:
[0298]
(1)一种抗潜伏tgf-β1抗体,包含:
[0299]
(a)包含seq id no:20的氨基酸序列的hvr-h1,
[0300]
(b)包含seq id no:21的氨基酸序列的hvr-h2,
[0301]
(c)包含seq id no:22的氨基酸序列的hvr-h3,
[0302]
(d)包含seq id no:23的氨基酸序列的hvr-l1,
[0303]
(e)包含seq id no:24的氨基酸序列的hvr-l2,和
[0304]
(f)包含seq id no:25的氨基酸序列的hvr-l3;
[0305]
(2)一种抗潜伏tgf-β1抗体,包含:
[0306]
(a)包含seq id no:26的氨基酸序列的hvr-h1,
[0307]
(b)包含seq id no:27的氨基酸序列的hvr-h2,
[0308]
(c)包含seq id no:28的氨基酸序列的hvr-h3,
[0309]
(d)包含seq id no:29的氨基酸序列的hvr-l1,
[0310]
(e)包含seq id no:30的氨基酸序列的hvr-l2,和
[0311]
(f)包含seq id no:31的氨基酸序列的hvr-l3;
[0312]
(3)一种抗潜伏tgf-β1抗体,包含:
[0313]
(a)包含seq id no:32的氨基酸序列的hvr-h1,
[0314]
(b)包含seq id no:33的氨基酸序列的hvr-h2,
[0315]
(c)包含seq id no:34的氨基酸序列的hvr-h3,
[0316]
(d)包含seq id no:35的氨基酸序列的hvr-l1,
[0317]
(e)包含seq id no:36的氨基酸序列的hvr-l2,和
[0318]
(f)包含seq id no:37的氨基酸序列的hvr-l3;或
[0319]
(4)一种抗潜伏tgf-β1抗体,包括:
[0320]
(a)包含seq id no:38的氨基酸序列的hvr-h1,
[0321]
(b)包含seq id no:39的氨基酸序列的hvr-h2,
[0322]
(c)包含seq id no:40的氨基酸序列的hvr-h3,
[0323]
(d)包含seq id no:41的氨基酸序列的hvr-l1,
[0324]
(e)包含seq id no:42的氨基酸序列的hvr-l2,和
[0325]
(f)包含seq id no:43的氨基酸序列的hvr-l3。
[0326]
还一方面,本发明提供了与人、猴、小鼠和/或大鼠的潜伏tgf-β1结合的抗体。在某些实施方案中,本发明提供了与人、猴和小鼠的潜伏tgf-β1结合的抗体。在某些实施方案中,本发明提供了与人、猴和小鼠的潜伏tgf-β1形成slc结合的抗体。在某些实施方案中,本发明提供了与人、猴和小鼠的潜伏tgf-β1形成llc结合的抗体。在某些实施方案中,本发明提供了与人、猴和小鼠的潜伏tgf-β1形成llc结合的抗体。在某些实施方案中,本发明提供了与人、猴和小鼠的潜伏tgf-β1与garp或lrrc33形成的复合体结合的抗体。在某些实施方案中,本发明提供了与人、猴和小鼠的细胞表面潜伏tgf-β1结合的抗体。
[0327]
在另一方面,本发明提供了与本文提供的任何一种抗潜伏tgf-β1抗体结合相同表位的抗体。该表位可以存在于人、猴、小鼠和/或大鼠的tgf-β1上。例如,在某些实施方案中,本发明提供了与参考抗体结合相同表位的抗体,其中该参考抗体是:
[0328]
(1)一种抗潜伏tgf-β1抗体,包含:
[0329]
(a)包含seq id no:20的氨基酸序列的hvr-h1,
[0330]
(b)包含seq id no:21的氨基酸序列的hvr-h2,
[0331]
(c)包含seq id no:22的氨基酸序列的hvr-h3,
[0332]
(d)包含seq id no:23的氨基酸序列的hvr-l1,
[0333]
(e)包含seq id no:24的氨基酸序列的hvr-l2,和
[0334]
(f)包含seq id no:25的氨基酸序列的hvr-l3;
[0335]
(2)一种抗潜伏tgf-β1抗体,包含:
[0336]
(a)包含seq id no:26的氨基酸序列的hvr-h1,
[0337]
(b)包含seq id no:27的氨基酸序列的hvr-h2,
[0338]
(c)包含seq id no:28的氨基酸序列的hvr-h3,
[0339]
(d)包含seq id no:29的氨基酸序列的hvr-l1,
[0340]
(e)包含seq id no:30的氨基酸序列的hvr-l2,和
[0341]
(f)包含seq id no:31的氨基酸序列的hvr-l3;
[0342]
(3)一种抗潜伏tgf-β1抗体,包含:
[0343]
(a)包含seq id no:32的氨基酸序列的hvr-h1,
[0344]
(b)包含seq id no:33的氨基酸序列的hvr-h2,
[0345]
(c)包含seq id no:34的氨基酸序列的hvr-h3,
[0346]
(d)包含seq id no:35的氨基酸序列的hvr-l1,
[0347]
(e)包含seq id no:36的氨基酸序列的hvr-l2,和
[0348]
(f)包含seq id no:37的氨基酸序列的hvr-l3;或
[0349]
(4)一种抗潜伏tgf-β1抗体,包含:
[0350]
(a)包含seq id no:38的氨基酸序列的hvr-h1,
[0351]
(b)包含seq id no:39的氨基酸序列的hvr-h2,
[0352]
(c)包含seq id no:40的氨基酸序列的hvr-h3,
[0353]
(d)包含seq id no:41的氨基酸序列的hvr-l1,
[0354]
(e)包含seq id no:42的氨基酸序列的hvr-l2,和
[0355]
(f)包含seq id no:43的氨基酸序列的hvr-l3。
[0356]
还一方面,本发明提供了与本文提供的抗潜伏tgf-β1抗体竞争结合人、猴、小鼠和/或大鼠的tgf-β1的抗体。例如,在某些实施方案中,提供的抗体与以下抗体竞争结合人、猴、小鼠和/或大鼠的tgf-β1:
[0357]
(1)一种抗潜伏tgf-β1抗体,包含:
[0358]
(a)包含seq id no:20的氨基酸序列的hvr-h1,
[0359]
(b)包含seq id no:21的氨基酸序列的hvr-h2,
[0360]
(c)包含seq id no:22的氨基酸序列的hvr-h3,
[0361]
(d)包含seq id no:23的氨基酸序列的hvr-l1,
[0362]
(e)包含seq id no:24的氨基酸序列的hvr-l2,和
[0363]
(f)包含seq id no:25的氨基酸序列的hvr-l3;
[0364]
(2)一种抗潜伏tgf-β1抗体,包含:
[0365]
(a)包含seq id no:26的氨基酸序列的hvr-h1,
[0366]
(b)包含seq id no:27的氨基酸序列的hvr-h2,
[0367]
(c)包含seq id no:28的氨基酸序列的hvr-h3,
[0368]
(d)包含seq id no:29的氨基酸序列的hvr-l1,
[0369]
(e)包含seq id no:30的氨基酸序列的hvr-l2,和
[0370]
(f)包含seq id no:31的氨基酸序列的hvr-l3;
[0371]
(3)一种抗潜伏tgf-β1抗体,包含:
[0372]
(a)包含seq id no:32的氨基酸序列的hvr-h1,
[0373]
(b)包含seq id no:33的氨基酸序列的hvr-h2,
[0374]
(c)包含seq id no:34的氨基酸序列的hvr-h3,
[0375]
(d)包含seq id no:35的氨基酸序列的hvr-l1,
[0376]
(e)包含seq id no:36的氨基酸序列的hvr-l2,和
[0377]
(f)包含seq id no:37的氨基酸序列的hvr-l3;或
[0378]
(4)一种抗潜伏tgf-β1抗体,包含:
[0379]
(a)包含seq id no:38的氨基酸序列的hvr-h1,
[0380]
(b)包含seq id no:39的氨基酸序列的hvr-h2,
[0381]
(c)包含seq id no:40的氨基酸序列的hvr-h3,
[0382]
(d)包含seq id no:41的氨基酸序列的hvr-l1,
[0383]
(e)包含seq id no:42的氨基酸序列的hvr-l2,和
[0384]
(f)包含seq id no:43的氨基酸序列的hvr-l3。
[0385]
在本发明的还一方面,根据以上实施方案中任一项的抗潜伏tgf-β1抗体是单克隆抗体,包括嵌合抗体、人源化抗体或人抗体。在一个实施方案中,抗潜伏tgf-β1抗体是抗体片段,例如,fv、fab、fab'、scfv、双抗体或f(ab')2片段。在另一个实施方案中,抗体是全长抗体,例如,完整iggl、igg2、igg3或igg4抗体或者本文定义的其他抗体类别或同种型。还一方面,抗潜伏tgf-β1抗体还包括任何包含免疫球蛋白可变重链和/或可变轻链结构的抗原结合分子。
[0386]
还一方面,根据上述实施方案中任一项的抗潜伏tgf-β1抗体可以单独或组合地并入任何特征,如下面第1-7节所述:
[0387]
1.抗体结合活性
[0388]
在某些实施方案中,本文提供的抗体的解离常数(kd)为1微摩尔或更小、100nm或更小、10nm或更小、1nm或更小、0.1nm或更小、0.01nm或更小、或0.001nm或更小(例如10-8
m或更小,例如10-8
m至10-13
m,例如10-9
m至10-13
m)。
[0389]
在一个实施方案中,抗体的结合活性通过放射性标记的抗原结合测定(ria)测量并由kd表示。在一个实施方案中,使用目标抗体的fab形式及其抗原进行ria。例如,fab对抗原的溶液结合活性通过在一滴定系列的未标记抗原存在下用最小浓度的(
125
i)标记抗原平衡fab,然后用抗fab抗体包被的板捕获结合的抗原进行测量(参见,例如,chen等人,
j.mol.biol.293:865-881(1999))。为建立测定条件,将microtiter(注册商标)多孔板(thermo scientific)用在50mm碳酸钠(ph 9.6)中的5微克/ml捕获抗fab抗体(cappel labs)包被过夜,随后在室温(约23摄氏度(℃))下用在pbs中的2%(w/v)牛血清白蛋白封闭两至五个小时。在非吸附板(nunc#269620)中,100pm或26pm[
125
i]-抗原与目标fab的系列稀释液混合(例如,与抗vegf抗体fab-12的评估一致,presta等人,cancer res.57:4593-4599(1997))。然后将目标fab温育过夜;然而,温育可以持续更长时间(例如,约65小时)以确保达到平衡。此后,将混合物转移至捕获板以在室温下温育(例如,一小时)。然后弃液并用在pbs中的0.1%聚山梨醇酯20(tween-20(注册商标))将板洗涤八次。当板干燥后,加入150微升/孔的闪烁剂(microscint-20tm;packard),并且板在topcounttm伽马计数器(packard)上计数十分钟。选择产生小于或等于最大结合20%的每种fab的浓度用于竞争性结合测定。
[0390]
在一个实施方案中,为了测量抗体的结合活性,使用配体捕获方法,例如,使用biacore(注册商标)t200或biacore(注册商标)4000(ge healthcare,uppsala,sweden),该方法依赖于表面等离振子共振分析方法作为测量原理。biacore(注册商标)控制软件用于设备的操作。在一个实施方案中,根据生产商的说明使用胺偶联试剂盒(ge healthcare,uppsala,sweden)以使分子用于配体捕获,例如,抗标签抗体、抗igg抗体、蛋白a等固定在包被羧甲基葡聚糖的传感器芯片(ge healthcare,uppsala,sweden)上。配体捕获分子在适当的ph值下用10mm乙酸钠溶液稀释,并以适当的流速进样且持续适当的进样时间。结合活性测量使用含有0.05%聚山梨醇酯20(另称为吐温(注册商标)-20)的缓冲液作为测量缓冲液,流速为10-30微升/分钟,并且测定温度优选在25摄氏度或37摄氏度。对于以被配体捕获分子捕获的抗体作为配体进行的测量,进样抗体以使得目标量的抗体被捕获,然后进样使用测量缓冲液制备的抗原和/或fc受体(分析物)的连续稀释液。对于以被配体捕获分子捕获的抗原和/或fc受体作为配体进行的测量,进样抗原和/或fc受体以使其目标量被捕获,然后进样使用测量缓冲液制备的抗体(分析物)的连续稀释液。
[0391]
在一个实施方案中,使用biacore(注册商标)评估软件分析测量结果。动力学参数计算通过使用1:1结合模型同时拟合缔合和解离的传感图进行,并且可以计算缔合速率(kon或ka)、解离速率(koff或kd)和平衡解离常数(kd)。对于结合活性较弱的情况,特别是解离较快且动力学参数难以计算的情况,可以采用稳态模型计算平衡解离常数(kd)。作为关于结合活性的另外的参数,“每单位配体量的分析物的结合量”可以通过将特定浓度的分析物的结合量(共振单位:ru)除以捕获的配体的量进行计算。
[0392]
2.抗体片段
[0393]
在某些实施方案中,本文提供的抗体是抗体片段。抗体片段包括,但不限于fab、fab'、fab'-sh、f(ab')2、fv和scfv片段,以及下文所述的其他片段。有关某些抗体片段的综述,参见hudson等人,nat.med.9:129-134(2003)。有关scfv片段的综述,参见,例如,pluckthun,in the pharmacology of monoclonal antibodies,vol.113,rosenburg和moore编辑,(springer-verlag,new york),pp.269-315(1994);另见wo 93/16185;和美国专利号5,571,894和5,587,458。有关包含补救受体结合表位残基并具有增加的体内半衰期的fab和f(ab')2片段的讨论,参见美国专利号5,869,046。
[0394]
双抗体是具有两个抗原结合位点的抗体片段,其可以是二价的或双特异性的。参见,例如,ep 404,097;wo 1993/01161;hudson等人,nat.med.9:129-134(2003);和
hollinger等人,proc.natl.acad.sci.usa 90:6444-6448(1993)。三抗体和四抗体也描述于hudson等人,nat.med.9:129-134(2003)。
[0395]
单域抗体是包含抗体的全部或部分重链可变结构域或者全部或部分轻链可变结构域的抗体片段。在某些实施方案中,单域抗体是人单域抗体(domantis,inc.,waltham,ma;参见,例如,美国专利号6,248,516b1)。
[0396]
抗体片段可以通过各种技术制备,包括但不限于完整抗体的蛋白水解消化以及通过重组宿主细胞(例如大肠杆菌或噬菌体)产生,如本文所述。
[0397]
本发明还涉及与tgf-β1结合的抗原结合分子,包括但不限于,例如,微抗体(低分子量抗体)和支架蛋白。在本发明中,任何支架蛋白均是可接受的,只要它是具有稳定三维结构并且能够至少结合抗原的肽。此类肽包括,例如,抗体可变区、纤连蛋白、蛋白a结构域、ldl受体a结构域、脂质运载蛋白以及nygren等人(current opinion in structural biology,(1997)7:463-469;journal of immunol methods,(2004)290:3-28)、binz等人(nature biotech.(2005)23:1257-1266)和hosse等人(protein science,(2006)15:14-27)描述的其他分子的片段。当提及此类抗体时,例如,在本说明书的上下文中,“抗潜伏tgf-β1抗体”应替换为“抗潜伏tgf-β1抗原结合分子”。
[0398]
3.嵌合抗体和人源化抗体
[0399]
在某些实施方案中,本文提供的抗体是嵌合抗体。某些嵌合抗体在例如美国专利号4,816,567;和morrison等人,proc.natl.acad.sci.usa,81:6851-6855(1984)中描述。在一个实例中,嵌合抗体包含非人可变区(例如,源自小鼠、大鼠、仓鼠、兔或非人灵长类动物(例如猴)的可变区)和人恒定区。在另一个实例中,嵌合抗体是“类别转换的”抗体,其中类别或亚类已从亲本抗体的类别或亚类改变。嵌合抗体包括其抗原结合片段。
[0400]
在某些实施方案中,嵌合抗体是人源化抗体。通常,非人抗体经人源化以降低对人的免疫原性,同时保留亲本非人抗体的特异性和结合活性。通常,人源化抗体包含一个或多个可变结构域,其中hvr,例如cdr(或其部分)源自非人抗体,并且fr(或其部分)源自人抗体序列。人源化抗体任选地还将包含人恒定区的至少一部分。在一些实施方案中,人源化抗体中的一些fr残基被来自非人抗体(例如,hvr残基来源的抗体)的相应残基取代,例如,以恢复或改善抗体特异性或结合活性。
[0401]
人源化抗体及其制备方法,例如,在almagro和fransson,front.biosci.13:1619-1633(2008)中综述,并例如,在riechmann等人,nature332:323-329(1988);queen等人,proc.nat'l acad.sci.usa 86:10029-10033(1989);美国专利号5,821,337、7,527,791、6,982,321和7,087,409;kashmiri等人,methods 36:25-34(2005)(描述特异性决定区(sdr)移植);padlan,mol.immunol.28:489-498(1991)(描述“表面重塑”);dall'acqua等人,methods 36:43-60(2005)(描述“fr改组”);和osbourn等人,methods36:61-68(2005)和klimka等人,br.j.cancer,83:252-260(2000)(描述fr改组的“向导选择”方法)中进一步描述。
[0402]
可用于人源化的人构架区包括但不限于:使用“最佳拟合”方法选择的构架区(参见,例如,sims等人j.immunol.151:2296(1993));源自特定的轻链或重链可变区亚组的人抗体共有序列的构架区(参见,例如,carter等人proc.natl.acad.sci.usa,89:4285(1992);和presta等人j.immunol.,151:2623(1993));人成熟(体细胞突变)构架区或人种
系构架区(参见,例如,almagro和fransson,front.biosci.13:1619-1633(2008));和源自筛选fr文库的构架区(参见,例如,baca等人,j.biol.chem.272:10678-10684(1997)和rosok等人,j.biol.chem.271:22611-22618(1996))。
[0403]
4.人抗体
[0404]
在某些实施方案中,本文提供的抗体是人抗体。可以使用本领域已知的各种技术产生人抗体。人抗体在van dijk和van de winkel,curr.opin.pharmacol.5:368-74(2001)和lonberg,curr.opin.immunol.20:450-459(2008)中常规描述。
[0405]
可以通过向转基因动物施用免疫原来制备人抗体,该转基因动物已经修饰以响应抗原攻击产生完整人抗体或具有人可变区的完整抗体。此类动物通常含有全部或部分人免疫球蛋白基因座,其替代内源性免疫球蛋白基因座,或存在于染色体外或随机整合至动物染色体中。在此类转基因小鼠中,内源性免疫球蛋白基因座通常已失活。有关从转基因动物获得人抗体的方法的综述,参见lonberg,nat.biotech.23:1117-1125(2005)。另见,例如,美国专利号6,075,181和6,150,584描述了xenomouse
tm
技术;美国专利号5,770,429描述了humab(注册商标)技术;美国专利号7,041,870描述了k-m mouse(注册商标)技术,和美国专利申请公开号us 2007/0061900描述了velocimouse(注册商标)技术。来自由此类动物产生的完整抗体的人可变区可以经进一步修饰,例如,通过与不同的人恒定区组合。
[0406]
人抗体还可以通过基于杂交瘤的方法制备。已经描述了用于生产人单克隆抗体的人骨髓瘤和小鼠-人异源骨髓瘤细胞系。(参见,例如,kozbor j.immunol.,133:3001(1984);brodeur等人,monoclonal antibody production techniques and applications,pp.51-63(marcel dekker,inc.,new york,1987);和boerner等人,j.immunol.,147:86(1991)。)通过人b细胞杂交瘤技术产生的人抗体还在li等人,proc.natl.acad.sci.usa,103:3557-3562(2006)中描述。另外的方法包括,例如,在美国专利号7,189,826(描述了从杂交瘤细胞系生产单克隆人igm抗体)和ni,xiandai mianyixue,26(4):265-268(2006)(描述了人-人杂交瘤)中描述的方法。人杂交瘤技术(trioma技术)还在vollmers和brandlein,histology and histopathology,20(3):927-937(2005)以及vollmers和brandlein,methods and findings in experimental and clinical pharmacology,27(3):185-91(2005)中描述。
[0407]
还可以通过分离选自人源噬菌体展示文库的fv克隆可变结构域序列产生人抗体。然后可以将此类可变结构域序列与期望的人恒定结构域组合。从抗体文库中选择人抗体的技术如下所述。
[0408]
5.文库来源的抗体
[0409]
本发明的抗体可以通过筛选具有期望活性的抗体的组合文库进行分离。例如,本领域已知多种方法用于产生噬菌体展示文库并筛选具有期望结合特性的抗体的此类文库。此类方法在,例如,hoogenboom等人分子生物学方法178:1-37(o'brien等人,编辑,human press,totowa,nj,2001)中综述并,例如,在mccafferty等人,nature 348:552-554;clackson等人,nature 352:624-628(1991);marks等人,j.mol.biol.222:581-597(1992);marks和bradbury,分子生物学方法248:161-175(lo,编辑,human press,totowa,nj,2003);sidhu等人,j.mol.biol.338(2):299-310(2004);lee等人,j.mol.biol.340(5):1073-1093(2004);fellouse,proc.natl.acad.sci.usa 101(34):12467-12472(2004);和
lee等人,j.immunol.methods284(1-2):119-132(2004)中进一步描述。
[0410]
在某些噬菌体展示方法中,vh和vl基因库分别通过聚合酶链反应(pcr)克隆并在噬菌体文库中随机重组,然后其可以筛选抗原结合噬菌体,如winter等人,ann.rev.immunol.,12:433-455(1994)所述。噬菌体通常以单链fv(scfv)片段或fab片段的形式展示抗体片段。来自免疫来源的文库提供针对免疫原的高结合活性抗体,而无需构建杂交瘤。备选地,可以(例如,从人)克隆初始文库以提供针对多种非自身和自身抗原的单一抗体来源,无需任何免疫接种,如griffiths等人,embo j,12:725-734(1993)所述。最后,还可以通过从干细胞克隆未重排的v基因片段以合成制备初始文库,并使用含有随机序列的pcr引物编码高度可变的cdr3区并在体外完成重排,如hoogenboom和winter,j.mol.biol.,227:381-388(1992)所述。描述人抗体噬菌体文库的专利公开包括,例如:美国专利号5,750,373,和美国专利公开号2005/0079574、2005/0119455、2005/0266000、2007/0117126、2007/0160598、2007/0237764、2007/0292936和2009/0002360。
[0411]
从人抗体文库中分离的抗体或抗体片段在本文中被认为是人抗体或人抗体片段。
[0412]
6.多特异性抗体
[0413]
在某些实施方案中,本文提供的抗体是多特异性抗体,例如,双特异性抗体。多特异性抗体是对至少两个不同位点具有结合特异性的单克隆抗体。在某些实施方案中,结合特异性中的一者针对tgf-β1而另一者针对任何其他抗原。在某些实施方案中,双特异性抗体可以与tgf-β1的两个不同表位结合。双特异性抗体还可用于将细胞毒性剂定位于表达tgf-β1的细胞。可以将双特异性抗体制备为全长抗体或抗体片段。
[0414]
用于制备多特异性抗体的技术包括,但不限于具有不同特异性的两个免疫球蛋白重链-轻链对的重组共表达(参见milstein和cuello,nature 305:537(1983))、wo 93/08829和traunecker等人,embo j.10:3655(1991)),和“杵臼”工程改造(参见,例如,美国专利号5,731,168)。多特异性抗体还可以通过工程改造静电转向效应来制备以制备抗体fc-异二聚体分子(wo 2009/089004a1);交联两个或多个抗体或片段(参见,例如,美国专利号4,676,980和brennan等人,science,229:81(1985));使用亮氨酸拉链产生双特异性抗体(参见,例如,kostelny等人,j.immunol.,148(5):1547-1553(1992));使用“双抗体”技术制备双特异性抗体片段(参见,例如,hollinger等人,proc.natl.acad.sci.usa,90:6444-6448(1993));和使用单链fv(scfv)二聚体(参见,例如gruber等人,j.immunol.,152:5368(1994));以及制备三特异性抗体,例如如tutt等人j.immunol.147:60(1991)所述。
[0415]
具有三个或更多个功能性抗原结合位点的工程改造抗体,包括“octopus抗体”,也包括在本文中(参见,例如,us 2006/0025576a1)。
[0416]
本文的抗体或片段还包括“双作用fab”或“daf”,其包含与tgf-β1以及另一种不同抗原结合的抗原结合位点(例如,参见,us 2008/0069820)。
[0417]
7.抗体变体
[0418]
在某些实施方案中,设想了本文提供的抗体的氨基酸序列变体。例如,可能期望改进抗体的结合活性和/或其他生物学特性。抗体的氨基酸序列变体可以通过向编码抗体的核苷酸序列中引入适当的修饰或通过肽合成进行制备。此类修饰包括,例如,抗体氨基酸序列中残基的缺失和/或插入和/或取代。可以进行缺失、插入和取代的任意组合以达到最终构建体,前提是最终构建体具有期望的特征,例如抗原结合。
[0419]
a)取代、插入和缺失变体
[0420]
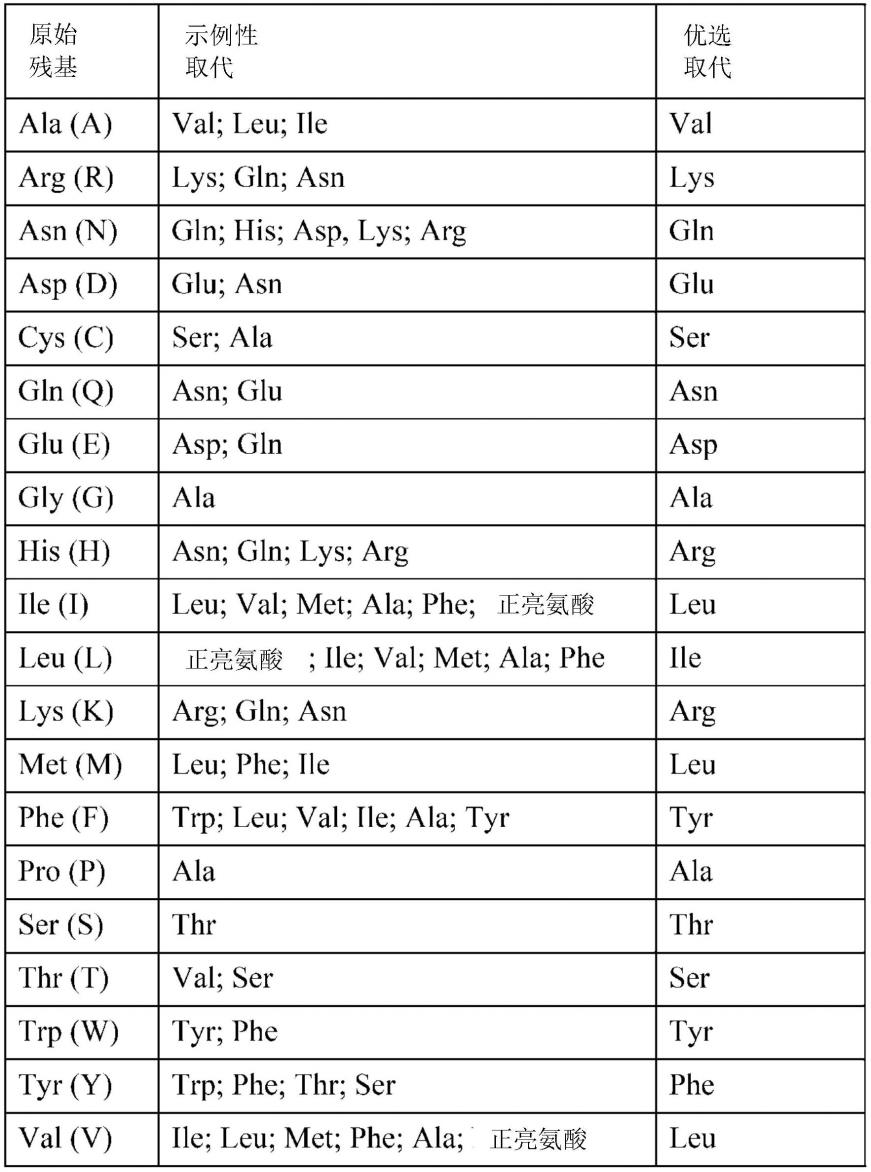
在某些实施方案中,提供了具有一个或多个氨基酸取代的抗体变体。取代诱变的目标位点包括hvr和fr。保守取代在表1中“优选取代”的标题下显示。在表1中“示例性取代”标题下提供了更实质性的变化,并且如下文参考氨基酸侧链类别进一步描述。可以将氨基酸取代引入目标抗体中,并筛选具有期望活性的产物,例如,保留/改善的抗原结合、降低的免疫原性或者改善的adcc或cdc。
[0421]
(表1)
[0422]
[0423]
氨基酸可以根据常见侧链特性进行分组:
[0424]
(1)疏水性:正亮氨酸、met、ala、val、leu、ile;
[0425]
(2)中性亲水性:cys、ser、thr、asn、gln;
[0426]
(3)酸性:asp、glu;
[0427]
(4)碱性:his、lys、arg;
[0428]
(5)影响链取向的残基:gly、pro;
[0429]
(6)芳香性:trp、tyr、phe。
[0430]
非保守取代将需要将这些类别中的一类的成员交换为另一类。
[0431]
一种类型的取代变体涉及取代亲本抗体(例如人源化抗体或人抗体)的一个或多个高变区残基。通常,选择用于进一步研究的所得变体相对于亲本抗体在某些生物学特性(例如,增加的结合活性、降低的免疫原性)方面将具有修饰(例如,改进)和/或将基本上保留亲本抗体的某些生物学特性。示例性取代变体是结合活性成熟的抗体,其可以方便地产生,例如,使用基于噬菌体展示的结合活性成熟技术,例如本文所述的那些。简言之,一个或多个hvr残基发生突变,并且变异抗体展示在噬菌体上并筛选特定的生物活性(例如结合活性)。
[0432]
可以对hvr进行改变(例如,取代),例如,以提高抗体结合活性。可以对hvr“热点”进行此类改变,所述热点即,由在体细胞成熟过程中经历高频突变的密码子编码的残基(参见,例如,chowdhury,methods mol.biol.207:179-196(2008)),和/或接触抗原的残基,以及测试由此产生的变体vh或vl的结合活性。例如,在hoogenboom等人分子生物学方法178:1-37(o'brien等人,编辑,human press,totowa,nj,(2001))中已经描述了通过构建和从二级文库中重新选择来使结合活性成熟。在结合活性成熟的一些实施方案中,通过多种方法(例如,易错pcr、链改组或寡核苷酸定向诱变)中的任一种将多样性引入被选择用于成熟的可变基因中。然后构建二级文库。然后筛选文库以鉴定具有期望结合活性的任何抗体变体。另一种引入多样性的方法涉及hvr定向方法,其中几个hvr残基(例如,一次4-6个残基)被随机化。参与抗原结合的hvr残基可以被特异性鉴定,例如,使用丙氨酸扫描诱变或建模。尤其是cdr-h3和cdr-l3经常被靶向。
[0433]
在某些实施方案中,取代、插入或缺失可以发生在一个或多个hvr内,只要此类改变基本上不降低抗体结合抗原的能力。例如,可以对hvr进行不显著降低结合活性的保守改变(例如,本文提供的保守取代)。例如,此类改变可以在hvr中的抗原接触残基之外。在上文提供的变体vh和vl序列的某些实施方案中,每个hvr或者未改变,或者包含不超过一个、两个或三个氨基酸取代。
[0434]
如cunningham和wells(1989)science,244:1081-1085所述,用于鉴定可作为诱变靶标的抗体的残基或区域的有用方法称为“丙氨酸扫描诱变”。在该方法中,一个残基或一组靶标残基(例如,带电残基,例如arg、asp、his、lys和glu)被鉴定并被中性或带负电的氨基酸(例如,丙氨酸或聚丙氨酸)取代,以确定抗体与抗原的相互作用是否受影响。可以在显示对初始取代具有功能灵敏度的氨基酸位置处引入进一步取代。备选地,或另外地,可以分析抗原-抗体复合体的晶体结构以鉴定抗体和抗原之间的接触点。此类接触残基和相邻残基可以作为取代候选物被靶向或消除。可以筛选变体以确定它们是否包含期望的特性。
[0435]
氨基酸序列插入包括长度从一个残基到含有一百个或更多残基的多肽的氨基端
和/或羧基端融合,以及单个或多个氨基酸残基的序列内插入。末端插入的实例包括具有n端甲硫氨酰残基的抗体。抗体分子的其他插入变体包括增加抗体血浆半衰期的酶(例如对于adept)或多肽与抗体的n端或c端的融合。
[0436]
b)糖基化变体
[0437]
在某些实施方案中,本文提供的抗体经改变以增加或减少抗体被糖基化的程度。抗体添加或缺失糖基化位点可以方便地通过改变氨基酸序列来实现,从而产生或去除一个或多个糖基化位点。
[0438]
在抗体包含fc区的情况下,附接于其上的碳水化合物可以被改变。哺乳动物细胞产生的天然抗体通常包含分支的双触角寡糖,其通常通过n键附接至fc区ch2结构域的asn297。参见,例如,wright等人tibtech 15:26-32(1997)。寡糖可以包括各种碳水化合物,例如,甘露糖、n-乙酰葡糖胺(glcnac)、半乳糖和唾液酸,以及在双触角寡糖结构的“茎”中附接至glcnac的岩藻糖。在一些实施方案中,可以对本发明的抗体中的寡糖进行修饰以产生具有某些改进特性的抗体变体。
[0439]
在一个实施方案中,提供了具有碳水化合物结构的抗体变体,该碳水化合物结构缺乏附接(直接或间接)至fc区的岩藻糖。例如,此类抗体中岩藻糖的量可以为1%至80%、1%至65%、5%至65%、或20%至40%。岩藻糖的量通过计算相对于通过maldi-tof质谱法测量的附接至asn 297的所有糖结构(例如复合、杂合和高甘露糖结构)的总和,asn297处糖链内岩藻糖的平均量确定,例如,如wo 2008/077546中所述。asn297是指位于fc区约第297位的天冬酰胺残基(fc区残基的eu编号);然而,由于抗体中的微小序列变化,asn297还可以位于第297位的上游或下游约 /-3个氨基酸处,即第294和300位之间。此类岩藻糖基化变体可以具有改善的adcc功能。参见,例如,美国专利公开号us 2003/0157108(presta,l.);us 2004/0093621(kyowa hakko kogyo co.,ltd)。与“去岩藻糖基化”或“岩藻糖缺陷”抗体变体相关的公开实例包括:us 2003/0157108;wo 2000/61739;wo 2001/29246;us 2003/0115614;us 2002/0164328;us 2004/0093621;us 2004/0132140;us 2004/0110704;us 2004/0110282;us 2004/0109865;wo 2003/085119;wo 2003/084570;wo 2005/035586;wo 2005/035778;wo2005/053742;wo2002/031140;okazaki等人j.mol.biol.336:1239-1249(2004);yamane-ohnuki等人biotech.bioeng.87:614(2004)。能够产生去岩藻糖基化抗体的细胞系的实例包括蛋白岩藻糖基化缺陷的lec13 cho细胞(ripka等人arch.biochem.biophys.249:533-545(1986);美国专利申请号us 2003/0157108 a1,presta,l;和wo 2004/056312 a1,adams等人,尤其是在实施例11),和敲除细胞系,例如α-1,6-岩藻糖基转移酶基因、fut8、敲除cho细胞(参见,例如,yamane-ohnuki等人biotech.bioeng.87:614(2004);kanda,y.等人,biotechnol.bioeng.,94(4):680-688(2006);和wo2003/085107)。
[0440]
进一步提供了具有平分寡糖的抗体变体,例如,其中附接至抗体fc区的双触角寡糖被glcnac平分。此类抗体变体可以具有降低的岩藻糖基化和/或改善的adcc功能。此类抗体变体的实例描述于,例如,wo 2003/011878(jean-mairet等人);美国专利号6,602,684(umana等人);和us 2005/0123546(umana等人)。还提供了在附接至fc区的寡糖中具有至少一个半乳糖残基的抗体变体。此类抗体变体可以具有改善的cdc功能。此类抗体变体描述于,例如,wo 1997/30087(patel等人);wo 1998/58964(raju,s.);和wo 1999/22764(raju,
s.)。
[0441]
c)fc区变体
[0442]
在某些实施方案中,可以将一种或多种氨基酸修饰引入本文提供的抗体的fc区,从而产生fc区变体。fc区变体可以包含在一个或多个氨基酸位置处包含氨基酸修饰(例如取代)的人fc区序列(例如,人iggl、igg2、igg3或igg4 fc区)。在另一个实施方案中,人fc变体可以包含嵌合人fc区序列(例如人igg1/4或人igg2/4fc区),或嵌合人fc区序列,其进一步包含在一个或多个氨基酸位置处的氨基酸修饰(例如取代)。
[0443]
在某些实施方案中,本发明考虑具有一些但不是全部效应子功能的抗体变体,这使其成为某些应用中的理想候选者,在所述应用中,抗体体内半衰期很重要但某些效应子功能(例如补体和adcc)为非必要的或有害的。可以进行体外和/或体内细胞毒性测定以确证cdc和/或adcc活性的减少/耗竭。例如,可以进行fc受体(fcr)结合测定以确保抗体缺乏fcγr结合(因此可能缺乏adcc活性),但保留fcrn结合能力。介导adcc的原代细胞nk细胞仅表达fcγriii,而单核细胞表达fcγri、fcγrii和fcγriii。造血细胞上的fcr表达总结在ravetch和kinet,annu.rev.immunol.9:457-492(1991)第464页的表3中。评估目标分子的adcc活性的体外测定的非限制性实例在美国专利号5,500,362中描述(参见,例如hellstrom,i.等人proc.nat'l acad.sci.usa 83:7059-7063(1986))和hellstrom,i等人,proc.nat'l acad.sci.usa 82:1499-1502(1985);5,821,337(参见bruggemann,m.等人,j.exp.med.166:1351-1361(1987))。备选地,可以采用非放射性测定方法(参见,例如,流式细胞术的act1
tm
非放射性细胞毒性测定(celltechnology,inc.mountain view,ca;和cytotox 96(注册商标)非放射性细胞毒性测定(promega,madison,wi)。可用于此类测定的效应细胞包括外周血单核细胞(pbmc)和自然杀伤(nk)细胞。备选地,或另外地,可以在体内(例如在动物模型中,例如clynes等人proc.nat'l acad.sci.usa95:652-656(1998)所公开的动物模型)评估目标分子的adcc活性。还可以进行c1q结合测定以确证抗体不能结合c1q并因此缺乏cdc活性。参见,例如,wo 2006/029879和wo 2005/100402中的clq和c3c结合elisa。为了评估补体激活,可以进行cdc分析(参见,例如,gazzano-santoro等人,j.immunol.methods 202:163(1996);cragg,ms等人,blood 101:1045-1052(2003);以及cragg,ms和mj glennie,blood 103:2738-2743(2004))。fcrn结合和体内清除率/半衰期测定也可以使用本领域已知的方法进行(参见,例如,petkova,sb等人,int'l.immunol.18(12):1759-1769(2006))。
[0444]
效应子功能降低的抗体包括具有一个或多个fc区残基238、265、269、270、297、327和329取代的抗体(美国专利号6,737,056)。此类fc突变体包括在第265、269、270、297和327位氨基酸中的两个或更多处发生取代的fc突变体,包括将残基265和297取代为丙氨酸的所谓“dana”fc突变体(美国专利号7,332,581)。
[0445]
描述了与fcr结合增加或减少的某些抗体变体。(参见,例如,美国专利号6,737,056;wo 2004/056312和shields等人,j.biol.chem.9(2):6591-6604(2001))。
[0446]
在某些实施方案中,抗体变体包含具有改善adcc的一个或多个氨基酸取代,例如,在fc区的第298、333和/或334位取代(残基的eu编号)的fc区。
[0447]
在一些实施方案中,对fc区进行改变导致改变的(即增加的或减少的)clq结合和/或补体依赖性细胞毒性(cdc),例如,如美国专利号6,194,551、wo 99/51642和idusogie等
人j.immunol.164:4178-4184(2000)所述。
[0448]
具有增加的半衰期和增加与新生儿fc受体(fcrn)结合的抗体,其负责将母体igg转移至胎儿(guyer等人,j.immunol.117:587(1976)和kim等人,j.immunol.24:249(1994)),在us2005/0014934a1(hinton等人)中描述。那些抗体包含其中具有一个或多个取代的fc区,这些取代增加fc区与fcrn的结合。此类fc变体包括在以下一个或多个fc区残基处发生取代的变体:238、256、265、272、286、303、305、307、311、312、317、340、356、360、362、3787 380、382、413、424或434,例如,fc区残基434的取代(美国专利号7,371,826)。
[0449]
关于fc区变体的其他实例另见duncan&winter,nature 322:738-40(1988);美国专利号5,648,260;美国专利号5,624,82;以及wo 94/29351。
[0450]
d)半胱氨酸工程改造的抗体变体
[0451]
在某些实施方案中,可能期望产生半胱氨酸工程改造的抗体,例如,“thiomab”,其中抗体的一个或多个残基被半胱氨酸残基取代。在特定实施方案中,取代的残基出现在抗体的可及位点。通过用半胱氨酸取代那些残基,反应性硫醇基团由此位于抗体的可及位点并且可用于将抗体缀合至其他部分,如本文进一步描述的药物部分或接头-药物部分,以产生免疫缀合物。在某些实施方案中,以下残基中的任何一个或多个可以被半胱氨酸取代:轻链的v205(kabat编号);重链的a118(eu编号);和重链fc区的s400(eu编号)。半胱氨酸工程改造的抗体可以如美国专利号7,521,541中所述产生。
[0452]
e)抗体衍生物
[0453]
在某些实施方案中,本文提供的抗体可以经进一步修饰以含有本领域已知且容易获得的另外的非蛋白部分。适用于抗体衍生化的部分包括但不限于水溶性聚合物。水溶性聚合物的非限制性实例包括,但不限于聚乙二醇(peg)、乙二醇/丙二醇的共聚物、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、聚-1,3-二氧戊环、聚-1,3,6-三噁烷、乙烯/马来酸酐共聚物、聚氨基酸(均聚物或无规共聚物)和葡聚糖或聚(n-乙烯基吡咯烷酮)聚乙二醇、聚丙二醇均聚物、聚环氧丙烷/环氧乙烷共聚物、聚氧乙烯化多元醇(例如甘油)、聚乙烯醇及其混合物。由于其在水中具有稳定性,聚乙二醇丙醛在生产中可能具有优势。聚合物可以具有任何分子量,并且可以是支化的或非支化的。附接至抗体的聚合物的数量可不同,并且如果附接了多于一种聚合物,它们可以是相同或不同的分子。通常,用于衍生化的聚合物的数量和/或类型可以基于以下考虑进行确定,所述考虑包括但不限于待改善抗体的特定性质或功能、在定义的条件下抗体衍生物是否将用于治疗中等。
[0454]
在另一个实施方案中,提供了可以通过暴露于辐射而被选择性加热的抗体和非蛋白部分的缀合物。在一个实施方案中,非蛋白部分是碳纳米管(kam等人,proc.natl.acad.sci.usa 102:11600-11605(2005))。辐射可以是任何波长,包括但不限于不伤害普通细胞的波长,但是将非蛋白部分加热至接近抗体-非蛋白部分的细胞被杀死的温度。
[0455]
b.重组方法和组合物
[0456]
可以使用重组方法和组合物产生抗体,例如,如美国专利号4,816,567中所述。在一个实施方案中,提供了编码本文所述的抗潜伏tgf-β1抗体的分离的核酸。此类核酸可以编码包含抗体的vl的氨基酸序列和/或包含抗体的vh的氨基酸序列(例如,抗体的轻链和/或重链)。在进一步的实施方案中,提供了包含此类核酸的一种或多种载体(例如,表达载
体)。在另一个实施方案中,提供了包含此类核酸的宿主细胞。在一个此类实施方案中,宿主细胞包含(例如,已被转化):(1)包含编码包含抗体的vl的氨基酸序列和包含抗体的vh的氨基酸序列的核酸的载体,或(2)包含编码包含抗体的vl的氨基酸序列的核酸的第一载体和包含编码包含抗体的vh的氨基酸序列的核酸的第二载体。在一个实施方案中,宿主细胞是真核细胞,例如中国仓鼠卵巢(cho)细胞或淋巴细胞(例如,y0、ns0、sp2/0细胞)。在一个实施方案中,提供了制备抗潜伏tgf-β1抗体的方法,其中该方法包括在适合表达抗体的条件下培养包含编码抗体的核酸的宿主细胞,如上文所提供,并且任选地从宿主细胞(或宿主细胞培养基)中回收该抗体。
[0457]
为了重组产生抗潜伏tgf-β1抗体,分离编码抗体的核酸,例如,如上所述,并将其插入一种或多种载体中,用于在宿主细胞中进一步克隆和/或表达。可以使用常规程序(例如,通过使用能够与编码抗体重链和轻链的基因特异性结合的寡核苷酸探针)容易地分离和测序此类核酸。
[0458]
用于克隆或表达抗体编码载体的合适宿主细胞包括本文所述的原核或真核细胞。例如,抗体可以在细菌中产生,特别是当不需要糖基化和fc效应子功能时。对于抗体片段和多肽在细菌中的表达,参见,例如,美国专利号5,648,237、5,789,199和5,840,523。(另见charlton,methods in molecular biology,vol.248(b.k.c.lo,ed.,humana press,totowa,nj,2003),pp.245-254,描述了抗体片段在大肠杆菌中的表达)。表达后,抗体可以从细菌细胞糊中以可溶级分分离,并可进一步纯化。
[0459]
除了原核生物外,真核微生物例如丝状真菌或酵母也是抗体编码载体的合适克隆或表达宿主,包括糖基化途径已经“人源化”的真菌和酵母菌株,导致产生具有部分或完全人糖基化模式的抗体。参见gerngross,nat.biotech.22:1409-1414(2004),和li等人,nat.biotech.24:210-215(2006)。
[0460]
用于表达糖基化抗体的合适宿主细胞还源自多细胞生物(无脊椎动物和脊椎动物)。无脊椎动物细胞的实例包括植物和昆虫细胞。已鉴定许多杆状病毒株,它们可以与昆虫细胞结合使用,特别是用于草地夜蛾细胞的转染。
[0461]
植物细胞培养物也可用作宿主。参见,例如,美国专利号5,959,177、6,040,498、6,420,548、7,125,978和6,417,429(描述了用于在转基因植物中产生抗体的plantibodies
tm
技术)。
[0462]
脊椎动物细胞也可用作宿主。例如,适于悬浮生长的哺乳动物细胞系可能是有用的。其他有用的哺乳动物宿主细胞系的实例是由sv40(cos-7)转化的猴肾cv1系;人胚胎肾系(293或293细胞,例如,如graham等人,j.gen virol.36:59(1977)所述);幼仓鼠肾细胞(bhk);小鼠支持细胞(tm4细胞,例如,如mather,biol.reprod.23:243-251(1980)中所述);猴肾细胞(cv1);非洲绿猴肾细胞(vero-76);人宫颈癌细胞(hela);犬肾细胞(mdck);水牛鼠肝细胞(brl 3a);人肺细胞(w138);人肝细胞(hep g2);小鼠乳腺肿瘤(mmt 060562);tri细胞,例如,如在mather等人,annals n.y.acad.sci.383:44-68(1982)中所述;mrc 5细胞;和fs4细胞。其他有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(cho)细胞,包括dhfr-cho细胞(urlaub等人,proc.natl.acad.sci.usa77:4216(1980));和骨髓瘤细胞系,例如y0、ns0和sp2/0。有关适用于抗体产生的某些哺乳动物宿主细胞系的综述,参见,例如,yazaki和wu,分子生物学方法,第248卷(b.k.c.lo,ed.,humana press,totowa,nj),第255-268页
(2003)。
[0463]
c.测定
[0464]
本文提供的抗潜伏tgf-β1抗体可以通过本领域已知的各种测定来鉴定、筛选或表征它们的物理/化学特性和/或生物活性。
[0465]
1.结合测定和其他测定
[0466]
一方面,例如,通过已知方法,例如elisa、western印迹、表面等离振子共振(例如biacore(注册商标))或类似技术(例如kinexa或octet(注册商标))等检测本发明的抗体的抗原结合活性。
[0467]
在另一方面,竞争测定可用于鉴定与本文所述的任何抗潜伏tgf-β1抗体(优选ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191或ht0947ae09-sg191)竞争结合潜伏tgf-β1的抗体。在某些实施方案中,此类竞争抗体结合与本文所述的任何抗潜伏tgf-β1抗体(优选ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191或ht0947ae09-sg191)结合的表位相同的表位(例如,线性或构象表位)。morris(1996)“表位映射方案”,分子生物学方法第66卷(humana press,totowa,nj)中提供了抗体结合的表位作图的详细示例性方法。表位作图的方法包括但不限于x射线晶体学和丙氨酸扫描诱变方法。
[0468]
在某些实施方案中,当此类竞争抗体过量存在时,其阻断(例如,降低)参考抗体与潜伏tgf-β1的结合至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%或更多。在一些情况下,结合被抑制至少80%、85%、90%、95%或更多。在某些实施方案中,此类竞争性抗体结合与本文所述的抗潜伏tgf-β1抗体结合的表位相同的表位(例如,线性表位或构象表位)。在进一步的方面,参考抗体是ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191或ht0947ae09-sg191。
[0469]
在示例性竞争测定中,固定的潜伏tgf-β1在溶液中温育,该溶液包含与潜伏tgf-β1结合的第一标记抗体(参考抗体)(例如,ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191或ht0947ae09-sg191.)和正在检测其与第一抗体竞争结合潜伏tgf-β1的能力的第二未标记抗体。第二抗体可以存在于杂交瘤上清液中。作为对照,固定的潜伏tgf-β1在包含第一标记抗体但不包含第二未标记抗体的溶液中温育。在允许第一抗体与潜伏tgf-β1结合的条件下温育后,去除过量未结合的抗体,并测量与固定的潜伏tgf-β1缔合的标记的量。如果检测样品中与固定的潜伏tgf-β1缔合的标记的量相对于对照样品显著减少,则表明第二抗体与第一抗体竞争结合潜伏tgf-β1。参见harlow和lane(1988)抗体:实验室手册第14章(cold spring harbor laboratory,cold spring harbor,ny)。
[0470]
在某些实施方案中,可以通过已知方法例如elisa、western印迹、biacore、流式细胞术等来检测抗潜伏tgf-β1抗体与细胞表面潜伏tgf-β1的结合。例如,可以使表达潜伏tgf-β1的细胞与直接与pe-或apc-缀合的抗潜伏tgf-β1抗体接触,或与未缀合的抗潜伏tgf-β1抗体接触,然后接触pe-或apc-缀合的二抗,并可以检测细胞表面潜伏tgf-β1的染色。参见,例如,oida等人,plos one.2010nov 24;5(11):e15523;su等人,hum mol genet.2015jul 15;24(14):4024-36。
[0471]
2.活性测定
[0472]
一方面,提供了用于鉴定其具有生物活性的抗潜伏tgf-β1抗体的测定法。生物活性可以包括,例如,抑制潜伏tgf-β1激活、抑制成熟tgf-β1从潜伏tgf-β1释放、抑制蛋白酶
介导的成熟tgf-β1从潜伏tgf-β1释放、抑制蛋白酶介导的成熟tgf-β1从潜伏tgf-β1释放而不抑制蛋白酶介导的潜伏tgf-β1的lap区的切割、抑制蛋白酶介导的成熟tgf-β1从潜伏tgf-β1释放而不阻断蛋白酶接近潜伏tgf-β1、抑制蛋白酶介导的成熟tgf-β1从潜伏tgf-β1释放同时允许蛋白酶切割潜伏tgf-β1的lap区、抑制蛋白酶介导的成熟tgf-β1从潜伏tgf-β1释放而不抑制或部分抑制整联蛋白介导的tgf-β1激活等。还提供了在体内和/或体外具有这种生物活性的抗体。
[0473]
在某些实施方案中,检测本发明的抗体的此类生物活性。
[0474]
在一些实施方案中,检测抗体是否抑制潜伏tgf-β1的激活,即抑制成熟tgf-β1从潜伏tgf-β1释放,通过在存在或不存在检测抗体的情况下,使潜伏tgf-β1激活剂(例如蛋白酶、整联蛋白、其他非蛋白酶激活剂等)与潜伏tgf-β1接触后,使用本领域已知的方法例如电泳、色谱、免疫印迹分析、酶联免疫吸附测定(elisa)或质谱法,检测成熟tgf-β1进行确定。在一个实例中,激活剂可以是分离的(例如,分离的蛋白酶或整联蛋白)和/或非分离的(例如,包含整联蛋白的小鼠、猴或人pbmc)。还已知激活潜伏tgf-β1,即成熟tgf-β1从潜伏tgf-β1释放,也在没有激活剂的情况下发生(潜伏tgf-β1的自发激活)。在一些实施方案中,在潜伏tgf-β1与或不与检测抗体一起温育之后,通过使用上述方法检测成熟tgf-β1来确定检测抗体是否抑制潜伏tgf-β1的自发激活。在一些实施方案中,与在不存在检测抗体的情况下检测到的量相比,在存在检测抗体(或接触后)的情况下检测到成熟tgf-β1的量减少时,检测抗体被鉴定为可以抑制潜伏tgf-β1激活的抗体。在实例中,成熟tgf-β1的量,无论是减少还是增加,均可以根据成熟tgf-β1的浓度(例如,g/ml、mg/ml、微克/ml、ng/ml或pg/ml等)进行测量。在另一个实例中,成熟tgf-β的量,无论是减少还是增加,均可以根据与成熟tgf-β直接或间接缔合的标记的光密度(o.d.)(例如,以mm或nm为单位的波长等)进行测量。
[0475]
在某些实施方案中,与类似条件下的阴性对照相比,在测定中抑制tgf-β1激活包括成熟tgf-β1的量减少至少5%、10%、15%、20%、25%、30%、35%或40%或更多。在一些实施方案中,它是指抑制tgf-β1激活,即抑制成熟tgf-β1释放至少45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%或更多。
[0476]
在一些实施方案中,还通过检测在表达tgf-β1受体的细胞中的成熟tgf-β1活性,例如,与tgf-β1受体结合的活性,或介导信号转导的活性等来确定检测抗体是否抑制潜伏tgf-β1激活,即抑制成熟tgf-β1从潜伏tgf-β1的释放。在一些实施方案中,成熟tgf-β1与tgf-β1受体的结合可以使用受体结合测定进行检测。在一些实施方案中,介导tgf-β1信号转导的活性可以通过检测tgf-β1/smad通路的激活进行确定。可用于此类测定的细胞可以是表达内源性tgf-β1受体的细胞或通过用tgf-β1受体基因转染细胞产生的细胞。例如,可以使用在本文所述的工作实施例中使用的hek-blue
tm tgf-β细胞,或那些经瞬时或稳定遗传修饰以表达编码tgf-β1受体的转基因的细胞。tgf-β1介导的信号转导可以在信号转导通路的任何水平上检测到,例如,通过检查smad多肽的磷酸化,检查tgf-β1调节基因(包括报告基因)的表达,或测量tgf-β1依赖性细胞的增殖。
[0477]
在一些实施方案中,介导tgf-β1信号转导的活性还可以通过检测tgf-β1/smad通路的激活,通过检查smad多肽磷酸化(参见,例如,fukasawa等人,kidney international.65(1):63-74(2004)和ganapathy等人,molecular cancer 26;9:122
(2010))进行确定。在其他实施方案中,介导tgf-β1信号转导的活性可以通过检查tgf-β在bae细胞的“受伤”单层培养物中抑制细胞迁移的能力、检查tgf-β抑制细胞生长的能力、检查tgf-β抑制纤溶酶原激活物(pa)活性的能力、检查tgf-β上调纤溶酶原激活物抑制剂-1(pai-1)的能力等(参见mazzieri等人,methods in molecular biology 142:13-27(2000))进行确定
[0478]
还可以使用工作实施例中阐述和举例说明的方法检测和/或测量对tgf-β1激活的抑制。使用这些或其他合适类型的测定,可以筛选检测抗体中能够抑制tgf-β1激活的抗体。在某些实施方案中,与类似条件下的阴性对照相比,抑制tgf-β1激活包括在测定中tgf-β1激活减少至少5%、10%、15%、20%、25%、30%、35%或40%或更多。在一些实施方案中,它是指抑制tgf-β1激活至少45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%或更多。在某些实施方案中,与类似条件下的阴性对照相比,抑制tgf-β1激活包括在测定中检测到的成熟tgf-β1的量减少至少5%、10%、15%、20%、25%、30%、35%或40%或更多。在一些实施方案中,它是指成熟tgf-β1的量减少至少45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%或更多。
[0479]
在一些实施方案中,通过在存在或不存在检测抗体的情况下,使蛋白酶与潜伏tgf-β1接触后,使用本领域已知的各种方法例如电泳、色谱、免疫印迹分析、酶联免疫吸附测定(elisa)或质谱法,检测潜伏tgf-β1的切割产物和/或未切割的潜伏tgf-β1来确定检测抗体是否抑制潜伏tgf-β1的lap部分的切割。例如,在将蛋白标签(例如,flag-标签等)添加至潜伏tgf-β1的lap区的n端的情况下,当蛋白酶介导的切割发生时,添加蛋白标签的部分被切除。因此,潜伏tgf-β1的切割产物可以通过检测无蛋白标签的潜伏tgf-β1(或潜伏tgf-β1的lap区)进行检测,和/或未切割的潜伏tgf-β1可以通过检测带有蛋白标签的潜伏tgf-β1进行检测。
[0480]
再例如,其中蛋白标签(例如,flag-标签等)被添加到潜伏tgf-β1的lap区的n端,并且其中蛋白酶切割位点的位置不靠近潜伏tgf-β1的lap区的n端,当蛋白酶介导的切割发生时,带有蛋白标签的lap区变短。因此,通过检测带有蛋白标签的具有变短lap区(或潜伏tgf-β1的变短lap区)的潜伏tgf-β1,可以检测潜伏tgf-β1的切割产物。
[0481]
在一些实施方案中,与在不存在检测抗体的情况下检测到的量相比,在存在(或接触后)检测抗体的情况下检测到的潜伏tgf-β1切割产物的量减少时,检测抗体被鉴定为可以抑制潜伏tgf-β1切割的抗体。相反,与不存在检测抗体的情况下检测到的量相比,在存在(或接触后)检测抗体的情况下检测到的潜伏tgf-β1切割产物的量没有显著减少时,检测抗体被鉴定为不抑制潜伏tgf-β1切割的抗体。在一些实施方案中,与在不存在检测抗体的情况下检测到的量相比,在存在(或接触后)检测抗体的情况下检测到增加的量的未切割的潜伏tgf-β1时,检测抗体被鉴定为可以抑制潜伏tgf-β1切割的抗体。相反,与在不存在检测抗体的情况下检测到的量相比,在存在(或接触后)检测抗体的情况下未切割的潜伏tgf-β1的量没有显著增加时,检测抗体被鉴定为不抑制潜伏tgf-β1切割的抗体。在某些实施方案中,检测抗体是否阻断蛋白酶接近潜伏tgf-β1通过检测蛋白酶和潜伏tgf-β1之间蛋白质相互作用的方法,例如,elisa或表面等离振子共振(例如biacore(注册商标))或类似技术(例如kinexa或octet(注册商标))进行确定。与在不存在检测抗体的情况下检测到的相互作用相比,在存在(或接触后)检测抗体的情况下检测到蛋白酶和潜伏tgf-β1之间的相互作用降低
时,检测抗体被鉴定为可以阻断蛋白酶接近潜伏tgf-β1的抗体。
[0482]
在某些实施方案中,与类似条件下的阴性对照相比,未抑制潜伏tgf-β1的切割包括在测定中潜伏tgf-β1的切割产物的量增加至少5%、10%、15%、20%、25%、30%、35%或40%或更多。在一些实施方案中,与类似条件下的阴性对照相比,未抑制潜伏tgf-β1的切割包括在测定中未切割的潜伏tgf-β1的量增加至少50%或更少、45%或更少、40%或更少、35%或更少、30%或更少、25%或更少、20%或更少、15%或更少、10%或更少、5%或更少。
[0483]
在一些实施方案中,可以对抗潜伏tgf-β1抗体进行其他生物活性测定,例如,以评价其作为治疗剂的有效性。此类测定是本领域已知的并且依赖于靶抗原和抗体的预期用途。例如,可以在单侧输尿管梗阻(uuo)诱导的小鼠肾纤维化模型(例如,如chevalier rl等人,ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy.kidney int.2009jun;75(11):1145-1152)、胆碱缺乏的l-氨基酸限定的高脂肪饮食(cdahfd)诱导的nash/肝纤维化小鼠模型、博来霉素(blm)诱导的肺纤维化小鼠模型和/或同系肿瘤模型(例如,如mariathasan s等人,tgf-beta attenuates tumour response to pd-l1 blockade by contributing to exclusion of t cells.nature.2018feb 22;554(7693):544-548所述)中评估抗潜伏tgf-β1抗体阻断tgf-β1的生物学效应。在进一步的实施方案中,可以对抗潜伏tgf-β1抗体进行本文所述的生物活性测定。
[0484]
3.筛选方法
[0485]
一方面,筛选本发明抗体的方法包括本文所述和本领域已知的各种测定。例如,筛选抗潜伏tgf-β1抗体的方法包括:
[0486]
(a)使包含潜伏tgf-β1和蛋白酶的生物样品与检测抗体接触;
[0487]
(b)检测(i)检测抗体是否抑制潜伏tgf-β1的lap区的切割和(ii)检测抗体是否抑制潜伏tgf-β1的激活;以及
[0488]
(c)选择抑制潜伏tgf-β1激活而不抑制蛋白酶介导的潜伏tgf-β1的lap部分切割的检测抗体。
[0489]
备选地,除了上述步骤(b)和(c),筛选抗潜伏tgf-β1抗体的方法包括例如以下步骤(b)和(c):
[0490]
(b)测量(i)未切割的潜伏tgf-β1的量和(ii)成熟tgf-β1的量;以及
[0491]
(c)如果与不存在检测抗体时相比,未切割的潜伏tgf-β1的量没有显著增加并且成熟tgf-β1的量减少,选择抑制蛋白酶介导的成熟tgf-β1从潜伏tgf-β1释放而不抑制蛋白酶介导的潜伏tgf-β1的lap区切割的检测抗体。
[0492]
备选地,除了上述步骤(b)和(c),筛选抗潜伏tgf-β1抗体的方法包括例如以下步骤(b)和(c):
[0493]
(b)测量(i)潜伏tgf-β1切割产物的量和(ii)成熟tgf-β1活性的水平;以及
[0494]
(c)如果与不存在检测抗体时相比,切割产物的量没有显著降低并且成熟tgf-β1活性水平降低,选择抑制蛋白酶介导的潜伏tgf-β1激活而不抑制蛋白酶介导的潜伏tgf-β1的lap区切割的检测抗体。
[0495]
此外,本发明提供了一种用于产生抗潜伏tgf-β1抗体的方法,除了上述步骤(a)至(c)之外,还包括例如以下步骤(d)和(e):
[0496]
(d)获得步骤(c)中选择的抗潜伏tgf-β1抗体的氨基酸序列信息;以及
[0497]
(e)将编码抗潜伏tgf-β1抗体的基因引入宿主细胞。
[0498]
在这种情况下,术语“没有显著增加/减少”,例如,在短语“未切割的潜伏tgf-β1的量没有显著增加”和“(潜伏tgf-β1的)切割产物的量没有显著减少”中,意指增加/减少的水平/程度可以为零,或者可以不为零但接近于零,或者可以非常低以致于能够在技术上被忽略或被本领域技术人员实际/基本上认为为零。例如,在免疫印迹分析中,当研究人员无法检测或观察到未切割的潜伏tgf-β1的任何显著信号/条带(或相对较高或较强的信号)时,则认为未切割的潜伏tgf-β1的量“没有显著增加”,或(潜伏tgf-β1的)切割产物的量“没有显著减少”。此外,术语“没有显著增加/减少”与术语“没有实质上增加/减少”可互换使用。
[0499]
在一些实施方案中,检测抗体是否抑制潜伏tgf-β1的lap区的切割,以及检测抗体是否抑制潜伏tgf-β1的激活可以通过本文描述的和本领域已知的各种测定进行确定。
[0500]
d.免疫缀合物
[0501]
本发明还提供了免疫缀合物,其包含与一种或多种细胞毒性剂(例如化疗剂或药物、生长抑制剂、毒素(例如蛋白质毒素、细菌、真菌、植物或动物来源的酶活性毒素,或其片段)或放射性同位素)缀合的本文的抗潜伏tgf-β1抗体。
[0502]
在一个实施方案中,免疫缀合物是抗体-药物缀合物(adc),其中抗体缀合到一种或多种药物,包括但不限于美登木素生物碱(参见美国专利号5,208,020、5,416,064和欧洲专利ep 0 425 235b1);澳瑞他汀,例如单甲基澳瑞他汀药物部分de和df(mmae和mmaf)(参见美国专利号5,635,483和5,780,588以及7,498,298);多拉司他丁;加利车霉素或其衍生物(参见美国专利号5,712,374、5,714,586、5,739,116、5,767,285、5,770,701、5,770,710、5,773,001和5,877,296;hinman等人,cancer res.53:3336-3342(1993);以及lode等人,cancer res.58:2925-2928(1998));蒽环类药物,例如道诺霉素或多柔比星(参见kratz等人,current med.chem.13:477-523(2006);jeffrey等人,bioorganic&med.chem.letters16:358-362(2006);torgov等人,bioconj.chem.16:717-721(2005);nagy等人,proc.natl.acad.sci.usa 97:829-834(2000);dubowchik等人,bioorg.&med.chem.letters 12:1529-1532(2002);king等人,j.med.chem.45:4336-4343(2002);和美国专利号6,630,579);甲氨蝶呤;长春地辛;紫杉烷,例如多西他赛、紫杉醇、拉洛他赛、替司他赛和奥他赛;单端孢霉烯;以及cc1065。
[0503]
在另一个实施方案中,免疫缀合物包含与酶促活性毒素或其片段缀合的如本文所述的抗体,该酶活性毒素或其片段包括但不限于白喉a链、白喉毒素的非结合活性片段、外毒素a链(来自铜绿假单胞菌)、蓖麻毒蛋白a链、相思豆毒蛋白a链、蒴莲根毒素a链、α-帚曲霉素、油桐蛋白、香石竹(dianthin)毒蛋白、美洲商陆蛋白(papi、papii和pap-s)、苦瓜抑制物、麻风树毒蛋白、巴豆毒蛋白、肥皂草(sapaonaria officinalis)抑制物、白树毒蛋白(gelonin)、丝林霉素(mitogellin)、局限曲菌素(restrictocin)、酚霉素(phenomycin)、依诺霉素(enomycin)和单端孢菌素(trichothecenes)。
[0504]
在另一个实施方案中,免疫缀合物包含与放射性原子缀合以形成放射性缀合物的如本文所述的抗体。多种放射性同位素可用于产生放射性缀合物。实例包括
211
at、
131
i、
125
i、
90
y、
186
re、
188
re、
153
sm、
212
bi、
32
p、
212
pb和lu的放射性同位素。当放射性缀合物用于检测时,它可以包含用于闪烁扫描研究的放射性原子,例如tc-99m或
123
i,或用于核磁共振(nmr)成
像(也称为磁共振成像,mri)的自旋标记,又如碘-123、碘-131、铟-111、氟-19、碳-13、氮-15、氧-17、钆、锰或铁。
[0505]
抗体和细胞毒性剂的缀合物可以使用多种双功能蛋白偶联剂制备,例如n-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(spdp)、琥珀酰亚胺基-4-(n-马来酰亚胺甲基)环己烷-1-羧酸基(smcc)、亚氨基硫烷(it)、亚氨酸酯的双功能衍生物(例如己二酸二甲酯盐酸盐)、活性酯(例如辛二酸二琥珀酰亚胺酯)、醛类(例如戊二醛)、双叠氮化合物(例如双(对叠氮基苯甲酰基)己二胺)、双重氮衍生物(例如双-(对重氮苯甲酰基)-乙二胺)、二异氰酸酯(例如甲苯2,6-二异氰酸酯)和双活性氟化合物(例如1,5-二氟-2,4-二硝基苯)。例如,蓖麻蛋白免疫毒素可以如vitetta等人,science238:1098(1987)中所述制备。碳-14标记的1-异硫氰基苄基-3-甲基二亚乙基三胺五乙酸(mx-dtpa)是用于将放射性核素与抗体缀合的示例性螯合剂。参见wo94/11026。接头可以是促进细胞中毒性药物释放的“可切割接头”。例如,可以使用酸不稳定接头、肽酶敏感接头、光不稳定接头、二甲基接头或含二硫化物接头(chari等人,cancer res.52:127-131(1992);美国专利号5,208,020)。
[0506]
本文中的免疫缀合物或adc明确考虑但不限于用交联试剂制备的此类缀合物,包括但不限于bmps、emcs、gmbs、hbvs、lc-smcc、mbs、mpbh、sbap、sia、siab、smcc、smpb、smph、磺基-emcs、磺基-gmbs、磺基-kmus、磺基-mbs、磺基-siab、磺基-smcc、磺基-smpb和svsb(琥珀酰亚胺基-(4-乙烯基砜)苯甲酸酯),它们可商购获得(例如,获自pierce biotechnology,inc.,rockford,il,u.s.a)。
[0507]
e.用于诊断和检测的方法和组合物
[0508]
在某些实施方案中,本文提供的任何抗潜伏tgf-β1抗体可用于检测生物样品中tgf-β1(例如潜伏tgf-β1)的存在。如本文所用,术语“检测”包括定量或定性检测/测量。在某些实施方案中,生物样品包括细胞或组织,例如血清、全血、血浆、活检样品、组织样品、细胞悬液、唾液、痰、口腔液、脑脊液、羊水、腹水、乳汁、初乳、乳腺分泌物、淋巴液、尿液、汗液、泪液、胃液、滑液、腹膜液、晶状体液和粘液。
[0509]
在一个实施方案中,提供了一种用于诊断或检测方法中的抗潜伏tgf-β1抗体。还一方面,提供了一种检测生物样品中tgf-β1(例如,潜伏tgf-β1)存在的方法。例如,检测潜伏tgf-β1存在的方法包括:
[0510]
(a)在允许抗潜伏tgf-β1抗体与潜伏tgf-β1结合的条件下使生物样品与本文所述的本发明的抗潜伏tgf-β1抗体接触;以及
[0511]
(b)检测在抗潜伏tgf-β1抗体和潜伏tgf-β1之间是否形成复合体。
[0512]
此类方法可以是体外或体内方法。在一个实施方案中,抗潜伏tgf-β1抗体用于选择符合接受抗潜伏tgf-β1抗体治疗的受试者,例如,其中tgf-β1,例如潜伏tgf-β1是用于选择患者的生物标志物。即,抗潜伏tgf-β1抗体可用作靶向tgf-β1的诊断剂。
[0513]
更具体地,抗潜伏tgf-β1抗体可用于诊断纤维化,优选心肌纤维化、肺部/肺纤维化、肝纤维化、肾纤维化、皮肤纤维化、眼纤维化和骨髓纤维化。本发明的抗潜伏tgf-β1抗体还可用于诊断癌症。
[0514]
在一些实施方案中,本发明提供了一种抑制生物样品中成熟tgf-β1从潜伏tgf-β1释放而不抑制蛋白酶介导的潜伏tgf-β1的lap区切割的方法,包括在允许抗体与潜伏tgf-β1结合的条件下使含有潜伏tgf-β1的生物样品与本发明的抗潜伏tgf-β1抗体接触。
[0515]
在某些实施方案中,例如,为了检测/诊断目的,提供了标记的抗潜伏tgf-β1抗体。标记包括,但不限于直接检测的标记或部分(例如荧光标记、发色标记、电子致密标记、化学发光标记和放射性标记),以及间接检测的部分,例如酶或配体,例如通过酶促反应或分子相互作用。示例性标记包括,但不限于放射性同位素
32
p、
14
c、
125
i、3h和
131
i,荧光团例如稀土螯合物或荧光素及其衍生物,罗丹明及其衍生物,丹磺酰,伞形酮,萤光素酶,例如,萤火虫萤光素酶和细菌萤光素酶(美国专利号4,737,456),萤光素,2,3-二氢酞嗪二酮,辣根过氧化物酶(hrp),碱性磷酸酶,β-半乳糖苷酶,葡糖淀粉酶,溶菌酶,糖氧化酶,例如,葡萄糖氧化酶、半乳糖氧化酶和葡萄糖-6-磷酸脱氢酶,杂环氧化酶例如尿酸酶和黄嘌呤氧化酶,其与采用过氧化氢氧化染料前体例如hrp、乳过氧化物酶或微过氧化物酶、生物素/抗生物素蛋白、自旋标记、噬菌体标记、稳定自由基等的酶偶联。
[0516]
f.药物制剂
[0517]
如本文所述的抗潜伏tgf-β1抗体的药物制剂通过将具有期望纯度的此类抗体与一种或多种任选的药学上可接受的载体混合以冻干制剂或水溶液的形式进行制备(雷明顿制药科学第16版,osol,a.编辑(1980))。药学上可接受的载体在所采用的剂量和浓度下对接受者通常是无毒的,并且包括但不限于:缓冲剂,例如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和蛋氨酸;防腐剂(例如十八烷基二甲基苄基氯化铵;氯己双铵;苯扎氯铵;苄索氯铵;苯酚、丁醇或苯甲醇;对羟基苯甲酸烷基酯例如对羟基苯甲酸甲酯或丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白,例如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂例如edta;糖类,例如蔗糖、甘露糖醇、海藻糖或山梨糖醇;形成盐的反离子,例如钠;金属复合体(例如zn-蛋白复合体);和/或非离子表面活性剂,例如聚乙二醇(peg)。本文的示例性药学上可接受的载体进一步包括间质药物分散剂,例如可溶性中性活性透明质酸酶糖蛋白(shasegp)、例如,人可溶性ph-20透明质酸酶糖蛋白,例如rhuph20(hylenex(注册商标),baxter international,inc.)。某些示例性shasegp和使用方法(包括rhuph20)在美国专利公开号2005/0260186和2006/0104968中描述。一方面,shasegp与一种或多种另外的糖胺聚糖酶(例如软骨素酶)组合。
[0518]
示例性冻干抗体制剂在美国专利号6,267,958中描述。水性抗体制剂包括美国专利号6,171,586和wo2006/044908中描述的那些,后者包括组氨酸-乙酸盐缓冲液。
[0519]
一方面,本发明提供了包含抗潜伏tgf-β1抗体的药物制剂,用于治疗纤维化,优选心肌纤维化、肺纤维化、肝纤维化、肾纤维化、皮肤纤维化、眼部纤维化和骨髓纤维化。本发明还提供了包含抗潜伏tgf-β1抗体的药物制剂,用于治疗癌症。
[0520]
由于所治疗的特定适应症所必需的,本文的制剂还可以含有多于一种活性成分,优选具有不相互产生不利影响的互补活性的活性成分。例如,可以期望需要进一步提供免疫检查点抑制剂,其在下文“iii.联合疗法”中描述。
[0521]
活性成分可以被包裹在制备的微胶囊,例如,通过凝聚技术或界面聚合制备,例如,分别在胶体药物递送系统(例如,脂质体、白蛋白微球、微乳液、纳米颗粒和纳米胶囊)或粗乳液中的羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊。此类技术在雷明顿制药科学第16版osol,a.编辑(1980)中公开。
[0522]
可以制备缓释制剂。缓释制剂的合适实例包括含有抗体的固体疏水聚合物的半透性基质,所述基质是成型制品的形式,例如薄膜或微胶囊。
[0523]
用于体内施用的制剂通常是无菌的。无菌可以容易地实现,例如通过无菌过滤膜过滤。
[0524]
g.治疗方法和组合物
[0525]
本文提供的任何抗潜伏tgf-β1抗体均可以在治疗方法中使用。一方面,提供了用作药物的抗潜伏tgf-β1抗体。在进一步的方面,提供了用于治疗癌症或纤维化(例如肝纤维化、肾纤维化或肺纤维化)等的抗潜伏tgf-β1抗体。在某些实施方案中,提供了用于治疗方法中的抗潜伏tgf-β1抗体。在某些实施方案中,本发明提供了用于治疗患有癌症或纤维化(例如肝纤维化、肾纤维化或肺纤维化)等的个体的方法的抗潜伏tgf-β1抗体,包括向个体施用有效量的抗潜伏tgf-β1抗体。在一个此类实施方案中,该方法进一步包括向个体施用有效量的至少一种另外的治疗剂,例如,如下所述。在进一步的实施方案中,本发明提供了用于抑制蛋白酶介导的潜伏tgf-β1激活的抗潜伏tgf-β1抗体。在某些实施方案中,本发明提供了抗潜伏tgf-β1抗体,用于抑制个体中蛋白酶介导的潜伏tgf-β1激活的方法,该方法包括向个体施用有效的抗潜伏tgf-β1抗体以抑制蛋白酶介导的潜伏tgf-β1的激活。根据任何上述实施方案的“个体”优选地是人。
[0526]
还一方面,本发明提供了抗潜伏tgf-β1抗体在生产或制备药物中的用途。在一个实施方案中,该药物用于治疗癌症或纤维化(例如肝纤维化、肾纤维化或肺纤维化)等。在还一个实施方案中,该药物用于治疗癌症或纤维化(例如肝纤维化、肾纤维化或肺纤维化)等的方法,包括向患有癌症或纤维化(例如肝纤维化、肾纤维化或肺纤维化)等的个体施用有效量的药物。在一个此类实施方案中,该方法进一步包括向个体施用有效量的至少一种另外的治疗剂,例如,如下所述。在进一步的实施方案中,药物用于抑制蛋白酶介导的潜伏tgf-β1的激活。在进一步的实施方案中,该药物用于抑制个体中蛋白酶介导的潜伏tgf-β1激活的方法,包括向该个体施用有效量的药物以抑制蛋白酶介导的潜伏tgf-β1的激活。根据任何上述实施方案的“个体”可以是人。
[0527]
还一方面,本发明提供了一种治疗癌症或纤维化(例如肝纤维化、肾纤维化或肺纤维化)等的方法。在一个实施方案中,该方法包括向患有此类癌症或纤维化(例如肝纤维化、肾纤维化或肺纤维化)等的个体施用有效量的抗潜伏tgf-β1抗体。在一个此类实施方案中,该方法进一步包括向个体施用有效量的至少一种另外的治疗剂,如下所述。在一些实施方案中,抗体和药剂同时施用。根据任何上述实施方案的“个体”可以是人。
[0528]
还一方面,本发明提供了一种用于抑制个体中蛋白酶介导的潜伏tgf-β1激活的方法。在一个实施方案中,该方法包括向个体施用有效量的抗潜伏tgf-β1抗体以抑制蛋白酶介导的潜伏tgf-β1激活。在一个实施方案中,“个体”是人。
[0529]
还一方面,本发明提供了包含本文提供的任何抗潜伏tgf-β1抗体的药物制剂,例如用于任何上述治疗方法。在一个实施方案中,药物制剂包含本文提供的任何抗潜伏tgf-β1抗体和药学上可接受的载体。在另一个实施方案中,药物制剂包含本文提供的任何抗潜伏tgf-β1抗体和至少一种另外的治疗剂,例如,如下所述。
[0530]
本发明的抗体(和任何另外的治疗剂)可以通过任何合适的方式施用,包括肠胃外、肺内和鼻内,以及,如果需要局部治疗,病灶内施用。肠胃外输注包括肌内、静脉内、动脉
内、腹膜内或皮下施用。施用可以通过任何合适的途径,例如通过注射,例如静脉内注射或皮下注射,部分取决于施用是短暂的还是长期的。本文设想了各种施用方案,包括但不限于在各时间点单次或多次施用、推注施用和脉冲输注。
[0531]
本发明的抗体将以符合良好医学实践的方式配制、给药和施用。在该背景下考虑的因素包括所治疗的特定病症、所治疗的特定哺乳动物、个体患者的临床状况、病因、药剂的递送部位、施用方法、施用时间计划,以及医生已知的其他因素。抗体不需要,但任选地与一种或多种目前用于预防或治疗所讨论的病症的药剂一起配制。此类其他药剂的有效量取决于制剂中存在的抗体量、病症或治疗的类型以及上述其他因素。
[0532]
对于疾病的预防或治疗,本发明抗体的适当剂量(当单独使用或与一种或多种其他另外的治疗剂联合使用时)将取决于待治疗疾病的类型、抗体的类型、疾病的严重程度和病程、施用抗体是否为了预防还是治疗目的、既往治疗、患者的临床病史和对抗体的应答,以及主治医生的判断力。将抗体一次性或在一系列治疗中适当地施用于患者。
[0533]
应理解,本文所述的任何制品可以包括本发明的免疫缀合物以代替抗潜伏tgf-β1抗体或除抗潜伏tgf-β1抗体外,本文所述的任何制品还可以包括本发明的免疫缀合物。
[0534]
iii.联合疗法
[0535]
本发明的抗潜伏tgfβ-1抗体可以单独使用或与其他药剂联合用于治疗,优选用于治疗癌症或纤维化,更优选用于治疗癌症。例如,本发明的抗体可以与至少一种另外的治疗剂共同施用。在一些实施方案中,抗体和药剂同时施用。在某些实施方案中,另外的治疗剂是一种或多种免疫检查点抑制剂,例如ctla-4、pd-1、pd-l1、pd-l2、cd160、cd57、cd244、lag-3、cd272、klrg1、cd26、cd39、cd73、cd305、tigit、tim-3和/或vista的抑制剂。在一些实施方案中,免疫检查点抑制剂是,例如,抗ctla-4抗体、抗pd-1抗体、抗pd-l1抗体、抗pd-l2抗体、抗cd160抗体、抗cd57抗体、抗cd244抗体、抗lag-3抗体、抗cd272抗体、抗klrg1抗体、抗cd26抗体、抗cd39抗体、抗cd73抗体、抗cd305抗体、抗tigit抗体、抗tim-3抗体和/或抗vista抗体。优选地,免疫检查点抑制剂是pd-1轴结合拮抗剂。更优选地,免疫检查点抑制剂是抗pd-1抗体或抗pd-l1抗体。在一些实施方案中,抗pd-1抗体是纳武利尤单抗(nivolumab)、帕博利珠单抗(pembrolizumab)或西米普利单抗(cemiplimab)。在一些实施方案中,抗pd-l1抗体是阿替利珠单抗(atezolizumab)、阿维单抗(avelumab)或度伐利尤单抗(durvalumab),优选阿替利珠单抗。优选地,联合疗法包含本发明的抗潜伏tgfβ-1抗体和阿替利珠单抗。在一些实施方案中,与抗tgfβ抗体单药治疗或免疫检查点抑制剂单药治疗相比,包含本发明的抗潜伏tgfβ-1抗体和一种或多种免疫检查点抑制剂的联合疗法具有叠加或协同疗效,例如,叠加、联合或协同抗肿瘤作用。
[0536]
一方面,本发明的联合疗法用于治疗癌症或纤维化,优选癌症。在一个实施方案中,癌症对免疫检查点抑制剂具有抗性和/或对免疫检查点抑制剂的应答有限。不受任何理论的束缚,某些免疫检查点抗性癌症缺乏应答和/或显示对免疫检查点抑制剂的应答有限与成纤维细胞中的tgf-β信号传导特征相关,尤其是在cd8 t细胞被排除在肿瘤实质之外而在富含成纤维细胞和胶原蛋白的肿瘤周围基质中发现的患者中。因此,抗潜伏tgf-β1抗体与免疫检查点抑制剂联合使用可以减少基质细胞中的tgf-β信号传递,促进t细胞渗透进入肿瘤中心,并可以表现出增强的抗肿瘤活性。
[0537]
程序性细胞死亡蛋白1(pd-1;也称为cd274或b7-h1)是i型膜蛋白,属于t细胞调节
剂的cd28/ctla-4家族。pd-1具有两个配体,即属于b7家族的pd-l1和pd-l2。人们认为pd-1和配体负向调节免疫应答,例如t细胞应答。pd-l1和pd-1在几种类型的癌症中高表达,并被认为在癌症免疫逃逸中起作用。抑制剂,例如抑制pd-1和pd-l1之间相互作用的“(免疫)检查点抑制剂”,可以增强t细胞应答并增加抗肿瘤活性。
[0538]
术语“pd-1轴结合拮抗剂”是指一种分子,其抑制pd-1轴结合配偶体与其一个或多个结合配偶体相互作用,从而消除由pd-1信号传导轴上的信号传导导致的t细胞功能障碍-结果是恢复或增强t细胞功能(例如,增殖、细胞因子产生、靶细胞杀伤)。如本文所用,pd-1轴结合拮抗剂包括pd-1结合拮抗剂、pd-l1结合拮抗剂和pd-l2结合拮抗剂。
[0539]
术语“pd-1结合拮抗剂”是指减少、阻断、抑制、消除或干扰由pd-1与其一种或多种结合配偶体(例如pd-l1、pd-l2)相互作用产生的信号转导的分子。在一些实施方案中,pd-1结合拮抗剂是抑制pd-1与其一种或多种结合配偶体结合的分子。在具体方面,pd-1结合拮抗剂抑制pd-1与pd-l1和/或pd-l2的结合。例如,pd-1结合拮抗剂包括抗pd-1抗体,其抗原结合片段,免疫黏附素,融合蛋白,寡肽以及其他降低、阻断、抑制、消除或干扰由pd-1与pd-l1和/或pd-l2相互作用引起的信号转导的分子。在一个实施方案中,pd-1结合拮抗剂降低由或通过在通过pd-1信号传导介导的t淋巴细胞上表达的细胞表面蛋白介导的负共刺激信号,从而使功能失调的t细胞功能障碍减少(例如,增强对抗原识别的效应子应答)。在具体方面,pd-1结合拮抗剂是mdx-1106(纳武利尤单抗)、mk-3475(lambrolizumab)、ct-011(匹地利珠单抗,pidilizumab)或amp-224或amp-514(medi0680)。在另一个具体方面,pd-1拮抗剂选自由pdr001、regn2810、bgb a317和shr-1210组成的组。
[0540]
术语“pd-l1结合拮抗剂”是指减少、阻断、抑制、消除或干扰由pd-l1与其一个或多个结合配偶体(例如pd-1、b7-1)相互作用产生的信号转导的分子。在一些实施方案中,pd-l1结合拮抗剂是抑制pd-l1与其结合配偶体结合的分子。在具体方面,pd-l1结合拮抗剂抑制pd-l1与pd-1和/或b7-1的结合。在一些实施方案中,pd-l1结合拮抗剂包括抗pd-l1抗体,其抗原结合片段,免疫黏附素,融合蛋白,寡肽和其他减少、阻断、抑制、消除或干扰由pd-l1与其一个或多个结合配偶体(例如pd-1、b7-1)相互作用引起的信号转导的分子。在一个实施方案中,pd-l1结合拮抗剂减少由或通过在通过pd-l1信号传导介导的t淋巴细胞上表达的细胞表面蛋白介导的负共刺激信号,从而使功能失调的t细胞功能失调程度降低(例如,增强对抗原识别的效应子应答)。在一些实施方案中,pd-l1结合拮抗剂是抗pd-l1抗体。在具体方面,抗pd-l1抗体是yw243.55.s70(阿替利珠单抗)、mdx-1105、阿维单抗(avelumab)、mpdl3280a或medi4736(度伐利尤单抗,durvalumab))。
[0541]
术语“pd-l2结合拮抗剂”是指减少、阻断、抑制、消除或干扰由pd-l2与其一种或多种结合配偶体(例如pd-1)相互作用产生的信号转导的分子。在一些实施方案中,pd-l2结合拮抗剂是抑制pd-l2与其一种或多种结合配偶体结合的分子。在具体方面,pd-l2结合拮抗剂抑制pd-l2与pd-1的结合。在一些实施方案中,pd-l2拮抗剂包括抗pd-l2抗体,其抗原结合片段,免疫黏附素,融合蛋白,寡肽和其他减少、阻断、抑制、消除或干扰由pd-l2与其一个或多个结合配偶体(例如pd-1)相互作用引起的信号转导的分子。在一个实施方案中,pd-l2结合拮抗剂减少由或通过在通过pd-l1信号传导介导的t淋巴细胞上表达的细胞表面蛋白介导的负共刺激信号,从而使功能失调的t细胞功能失调减少(例如,增强对抗原识别的效应子应答)。在一些实施方案中,pd-l2结合拮抗剂是免疫黏附素。
[0542]
上述此类联合疗法涵盖联合施用(其中两种或多种治疗剂被包括在相同或单独的制剂中),和单独施用,在这种情况下,本发明的抗体可以在施用另外的一种或多种治疗剂之前、同时和/或之后施用。在一个实施方案中,抗潜伏tgf-β1抗体的施用和另外的治疗剂的施用彼此发生在约一个月内,或约一、二或三周内,或约一、二、三、四、五或六天内。本发明的抗体还可以与放疗联合使用。
[0543]
一方面,当上述联合疗法涵盖联合施用且两种或更多种治疗剂被包括在相同药物制剂中时,本文的药物制剂包含,例如,本发明的抗潜伏tgfβ-1抗体和一种或多种上述免疫检查点抑制剂。优选地,本文的药物制剂包含本发明的抗潜伏tgfβ-1抗体、pd-1轴结合拮抗剂(优选抗pd-l1抗体,更优选阿替利珠单抗)和药学上可接受的载体。
[0544]
一方面,本发明提供了与另外的治疗剂联合使用以治疗一种或多种疾病的抗潜伏tgf-β1抗体。另一方面,本发明提供了包含抗潜伏tgf-β1抗体的药物制剂,其与另外的治疗剂联合使用以治疗一种或多种疾病。在一个实施方案中,一种或多种疾病是癌症和/或纤维化,优选癌症。在一个实施方案中,另外的治疗剂是一种或多种上述的一种或多种免疫检查点抑制剂。优选地,本发明提供了与pd-1轴结合拮抗剂(优选抗pd-l1抗体,更优选阿替利珠单抗)联合使用的抗潜伏tgf-β1抗体,用于治疗癌症。
[0545]
一方面,本发明提供与抗潜伏tgf-β1抗体联合使用的pd-1轴结合拮抗剂(优选抗pd-l1抗体,更优选阿替利珠单抗),用于治疗一种或多种疾病。另一方面,本发明提供了一种药物制剂,包含与抗潜伏tgf-β1抗体联合使用的pd-1轴结合拮抗剂(优选抗pd-l1抗体,更优选阿替利珠单抗),用于治疗一种或多种疾病。另一方面,该一种或多种疾病是癌症和/或纤维化,优选为癌症。
[0546]
iv.制品,试剂盒
[0547]
a.制品
[0548]
在本发明的另一方面,提供了含有可用于治疗、预防和/或诊断上述病症(例如,纤维化和癌症)的材料的制品。制品包含容器和在容器上的标签或与容器相关的包装插页。合适的容器包括,例如,瓶子、小瓶、注射器、iv溶液袋等。容器可以由多种材料形成,例如玻璃或塑料。容器容纳组合物,该组合物单独使用或与另一种有效治疗、预防和/或诊断病症(例如,纤维化和癌症)的组合物联合使用并且可以具有无菌进入口(例如容器可以是静脉内溶液袋或带有可被皮下注射针头刺穿的塞子的小瓶)。组合物中的至少一种活性成分是本发明的抗体或免疫缀合物。标签或包装插页表明该组合物用于治疗选择的病症(例如,纤维化和癌症)。此外,制品可以包含(a)其中装有组合物的第一容器,其中该组合物包含本发明的抗体/免疫缀合物;和(b)其中装有组合物的第二个容器,其中该组合物包含另外的细胞毒性剂或其他治疗剂。本发明的该实施方案中的制品可以进一步包含包装插页,表明该组合物可用于治疗特定病症(例如,纤维化和癌症)。备选地,或另外地,制品可以进一步包含第二(或第三)容器,其包含药学上可接受的缓冲液,例如抑菌注射用水(bwfi)、磷酸盐缓冲盐水、林格氏液和葡萄糖溶液。从商业和用户的角度来看,它可以进一步包括其他期望的材料,包括其他缓冲液、稀释剂、过滤器、针头和注射器。
[0549]
应理解,任何上述制品可以包括本发明的免疫缀合物以代替抗潜伏tgf-β1抗体或除抗潜伏tgf-β1抗体外,任何上述制品可以还包括本发明的免疫缀合物。
[0550]
b.试剂盒
[0551]
本公开内容提供了用于治疗、预防和/或诊断本文所述的病症,特别是治疗患有纤维化或癌症的个体的方法中的试剂盒,该试剂盒含有抗潜伏tgf-β1抗体、包含抗潜伏tgf-β1抗体的免疫缀合物、编码抗潜伏tgf-β1抗体的分离的核酸、或包含本公开内容的核酸的载体,或通过本公开内容的方法产生的载体。试剂盒可以另外包含本文“iii.联合疗法”中示例的任何治疗剂,例如免疫检查点抑制剂,包括抗pd-l1抗体。试剂盒可以与本文公开的另外的药学上可接受的载体或介质,或描述如何使用试剂盒的说明书等一起包装。与本文所述的制品一样,试剂盒可以含有用于治疗纤维化或癌症的材料;容器和容器上的标签或与容器相关的包装插页;单独使用或与另一种有效治疗纤维化或癌症的组合物联合使用的组合物;无菌进入口等。试剂盒可以进一步包括标签或包装插页,表明该组合物可用于治疗纤维化或癌症。备选地,或另外地,试剂盒可以进一步包括第二(或第三)容器,其包含药学上可接受的缓冲液,例如抑菌注射用水(bwfi)、磷酸盐缓冲盐水、林格氏溶液和葡萄糖溶液。从商业和用户的角度来看,试剂盒可以进一步包括其他材料,包括其他缓冲液、稀释剂、过滤器、针头和注射器。
[0552]
实施例
[0553]
以下是本发明的方法和组合物的实例。应理解,鉴于以上提供的一般描述,可以实践各种其他实施方案。
[0554]
实施例1:抗原的表达和纯化
[0555]
(1-1)潜伏tgf-β1的表达和纯化
[0556]
用于表达和纯化的序列是:带flag-标签的人潜伏tgf-β1(seq id no:1、2)和带flag-标签的小鼠潜伏tgf-β1(seq id no:3、4)和带flag-标签的食蟹猴潜伏tgf-β1(seq id no:5、6)。这些带有flag-标签的潜伏tgf-β1中的每一个从其n端至c端均具有源自大鼠血清白蛋白的信号序列(seq id no:7)、flag-标签和潜伏tgf-β1的序列。在这些带有flag-标签的潜伏tgf-β1中的每一个中的第三十位(第30位)的cys残基被ser取代,其对应于“c33s突变”(参见,例如,yoshinaga k等人,perturbation of transforming growth factor(tgf)-beta1 association with latent tgf-beta binding protein yields inflammation and tumors.proc natl acad sci u s a.2008;105(48):18758-18763)。
[0557]
带有flag-标签的人潜伏tgf-β1(以下称为“人潜伏tgf-β1(slc)”或“人潜伏tgf-β1”)、带有flag-标签的小鼠潜伏tgf-β1(以下称为“小鼠潜伏tgf-β1(slc)”或“小鼠潜伏tgf
‑‑
β1”)、或带有flag-标签的食蟹猴潜伏tgf-β1(以下称为“猴潜伏tgf-β1(slc)”或“猴潜伏tgf-β1”)使用freestyle293-f或expi293f细胞系(thermo fisher schientific)瞬时表达。将表达人、小鼠或猴潜伏tgf-β1(slc)的条件培养基施加到装有抗flag m2亲和树脂(sigma)的柱子上,并用flag肽(sigma)洗脱潜伏tgf-β1(slc)。收集含有人、小鼠或猴潜伏tgf-β1(slc)的级分,随后将其置于用1
×
pbs平衡的superdex 200凝胶过滤柱(ge healthcare)中。然后将含有人、小鼠或猴潜伏tgf-β1(slc)的级分合并并储存在-80摄氏度下。
[0558]
(1-2)小鼠潜伏相关肽(lap)的表达与纯化
[0559]
用于表达和纯化的序列是:带有flag-标签的小鼠lap(seq id no:8、9),其从其n端至c端具有源自大鼠血清白蛋白的信号序列(seq id no:7)、flag-标签和潜伏相关蛋白(lap)的序列。在带有flag-标签的lap中的第三十位(第30位)的cys残基被ser取代,其对应
于“c33s突变”。带flag-标签的小鼠lap(seq id no:8、9)(以下称为“重组小鼠潜伏相关蛋白(lap)”)的表达和纯化与实施例(1-1)中描述的完全相同。
[0560]
实施例2.抗tgf-β1抗体的人源化和优化
[0561]
(2-1)人源化
[0562]
如下对亲本抗tgf-β抗体tba0947(嵌合抗体)进行人源化。首先,使用tba0947的可变区和人种系构架设计人源化抗体的重链和轻链的可变区。然后,分别将每个设计的重链可变区和轻链可变区的多核苷酸克隆到含有重链恒定区sg181序列(seq id no:10)和轻链恒定区sk1序列(seq id no:11)的表达载体中。人源化抗体在freestyle 293-f细胞(thermo fisher scientific)中瞬时表达,并进行biacore分析。选择显示至少与亲本抗体相似的biacore结合活性的人源化抗体。
[0563]
(2-2)优化
[0564]
将实施例(2-1)中获得的人源化抗体优化为ht0947ae04、ht0947ae07、ht0947ae08和ht0947ae09,其具有对潜伏tgf-β1(slc)的改善的结合活性。简言之,对重链和轻链的互补决定区(cdr)中的所有残基进行全面诱变。每个氨基酸均被18个其他天然存在的氨基酸取代,不包括原始氨基酸和半胱氨酸。变体在freestyle 293-f细胞(thermo fisher scientific)中瞬时表达,并从培养上清液中纯化以供biacore评估。选择对人和鼠潜伏tgf-β1(slc)具有提高的结合活性的目标变体。然后产生在cdr中具有这些突变组合的抗体。
[0565]
(2-3)优化抗体的氨基酸序列
[0566]
ht0947ae04、ht0947ae07、ht0947ae08和ht0947ae09可变区的氨基酸序列鉴定如下:
[0567]-ht0947ae04的重链可变区包含seq id no:12的氨基酸序列(ht0947ae04h),以及ht0947ae04的轻链可变区包含seq id no:13的氨基酸序列(ht0947ae04l)。
[0568]-ht0947ae07的重链可变区包含seq id no:14的氨基酸序列(ht0947ae07h),以及ht0947ae07的轻链可变区包含seq id no:15的氨基酸序列(ht0947ae07l)。
[0569]-ht0947ae08的重链可变区包含seq id no:16(ht0947ae08h)的氨基酸序列,以及ht0947ae08的轻链可变区包含seq id no:17的氨基酸序列(ht0947ae08l)。
[0570]-ht0947ae09的重链可变区包含seq id no:18的氨基酸序列(ht0947ae09h),以及ht0947ae09的轻链可变区包含seq id no:19的氨基酸序列(ht0947ae09l)。
[0571]
ht0947ae04、ht0947ae07、ht0947ae08和ht0947ae09的cdr(hvr)的氨基酸序列根据kabat鉴定如下:
[0572]-ht0947ae04包含分别包含seq id no:20、21和22的氨基酸序列的重链cdr1、cdr2和cdr3,以及分别包含seq id no:23、24和25的氨基酸序列的轻链cdr1、cdr2和cdr3。
[0573]-ht0947ae07包含分别包含seq id no:26、27和28的氨基酸序列的重链cdr1、cdr2和cdr3,以及分别包含seq id no:29、30和31的氨基酸序列的轻链cdr1、cdr2和cdr3。
[0574]-ht0947ae08包含分别包含seq id no:32、33和34的氨基酸序列的重链cdr1、cdr2和cdr3,以及分别包含seq id no:35、36和37的氨基酸序列的轻链cdr1、cdr2和cdr3。
[0575]-ht0947ae09包含分别包含seq id no:38、39和40的氨基酸序列的重链cdr1、cdr2和cdr3,以及分别包含seq id no:41、42和43的氨基酸序列的轻链cdr1、cdr2和cdr3。
[0576]
(2-4)全长重链和轻链的构建
[0577]
向重链恒定区sg1(seq id no:44)引入多个氨基酸取代。sg1是野生型人igg1重链恒定区,缺失最后两个c端氨基酸gly-lys(gk)。结果,产生了sg181(seq id no:10)和sg191(seq id no:45)。根据eu索引,sg181包括氨基酸取代l235r/g236r(氨基酸取代以降低效应子功能)和k214r。根据eu索引,sg191包括氨基酸取代l235r/g236r(氨基酸取代以降低效应子功能)、m428l/n434a(氨基酸取代以增强与fcrn的结合活性)、q438r/s440e(氨基酸取代以降低与类风湿因子的结合)和k214r。此外,产生了mf18(seq id no:46),小鼠igg重链恒定区,其包括p235k/s239k(氨基酸取代以降低效应子功能)。
[0578]
每个重链可变区与重链恒定区sg181(seq id no:10)、sg191(seq id no:45)或mf18(seq id no:46)组合。因此,构建了具有以下氨基酸序列的全长重链序列:
[0579]
(a1)包含seq id no:47的氨基酸序列的全长重链,其包含ht0947ae04h(重链可变区)和sg181(重链恒定区)
[0580]
(a2)包含seq id no:48的氨基酸序列的全长重链,其包含ht0947ae07h(重链可变区)和sg181(重链恒定区)
[0581]
(a3)包含seq id no:49的氨基酸序列的全长重链,其包含ht0947ae08h(重链可变区)和sg181(重链恒定区)
[0582]
(a4)包含seq id no:50的氨基酸序列的全长重链,其包含ht0947ae09h(重链可变区)和sg181(重链恒定区)
[0583]
(b1)包含seq id no:51的氨基酸序列的全长重链,其包含ht0947ae04h(重链可变区)和sg191(重链恒定区)
[0584]
(b2)包含seq id no:52的氨基酸序列的全长重链,其包含ht0947ae07h(重链可变区)和sg191(重链恒定区)
[0585]
(b3)包含seq id no:53的氨基酸序列的全长重链,其包含ht0947ae08h(重链可变区)和sg191(重链恒定区)
[0586]
(b4)包含seq id no:54的氨基酸序列的全长重链,其包含ht0947ae09h(重链可变区)和sg191(重链恒定区)
[0587]
(c1)包含seq id no:55的氨基酸序列的全长重链,其包含ht0947ae04h(重链可变区)和mf18(重链恒定区)
[0588]
(c2)包含seq id no:56的氨基酸序列的全长重链,其包含ht0947ae07h(重链可变区)和mf18(重链恒定区)
[0589]
(c3)包含seq id no:57的氨基酸序列的全长重链,其包含ht0947ae08h(重链可变区)和mf18(重链恒定区)
[0590]
(c4)包含seq id no:58的氨基酸序列的全长重链,其包含ht0947ae09h(重链可变区)和mf18(重链恒定区)。
[0591]
每个轻链可变区与人igg轻链恒定区(κ)sk1(seq id no:11)或小鼠igg轻链恒定区(κ)mk1(seq id no:59)组合。因此,构建了具有以下氨基酸序列的全长轻链序列:
[0592]
(d1)包含seq id no:60的氨基酸序列的全长轻链,其包含ht0947ae04l(轻链可变区)和sk1(轻链恒定区)
[0593]
(d2)包含seq id no:61的氨基酸序列的全长轻链,其包含ht0947ae07l(轻链可变
区)和sk1(轻链恒定区)
[0594]
(d3)包含seq id no:62的氨基酸序列的全长轻链,其包含ht0947ae08l(轻链可变区)和sk1(轻链恒定区)
[0595]
(d4)包含seq id no:63的氨基酸序列的全长轻链,其包含ht0947ae09l(轻链可变区)和sk1(轻链恒定区)
[0596]
(e1)包含seq id no:64的氨基酸序列的全长轻链,其包含ht0947ae04l(轻链可变区)和mk1(轻链恒定区)
[0597]
(e2)包含seq id no:65的氨基酸序列的全长轻链,其包含ht0947ae07l(轻链可变区)和mk1(轻链恒定区)
[0598]
(e3)包含seq id no:66的氨基酸序列的全长轻链,其包含ht0947ae08l(轻链可变区)和mk1(轻链恒定区)
[0599]
(e4)包含seq id no:67的氨基酸序列的全长轻链,其包含ht0947ae09l(轻链可变区)和mk1(轻链恒定区)。
[0600]
然后,将各自的全长重链和轻链组合,并构建表2所示的抗体。构建的抗体的命名如表2所示,在本说明书中称为它们各自的名称。
[0601]
(表2)
[0602][0603]
实施例3.用于评估抗潜伏tgf-β1抗体结合活性的biacore分析
[0604]
使用biacore 8k仪器(ge healthcare)测量抗潜伏tgf-β1抗体(ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191和ht0947ae09-sg191)对人、食蟹猴或小鼠的潜伏tgf-β1(slc)的结合活性。使用胺偶联试剂盒(ge healthcare)将小鼠抗人igκ轻链抗体(bd pharmingen)固定在cm5传感器芯片的所有流动池上。抗体以约20ru(共振单位)的捕获水平被捕获到抗κ传感器表面,然后将实施例(1-1)中制备的人、食蟹猴或小鼠的潜伏tgf-β1(slc)注射到流动池上方。所有抗体和分析物均在含20mm aces、150mm nacl、0.05%吐温20、0.005%nan3的aces ph 7.4中制备。测定温度设置为37摄氏度。传感器表面在每个循环中均用10mm甘氨酸-hcl,ph2.1进行再生。通过使用biacore insight软件,版本1.1.1.7442(ge healthcare)处理数据并将其拟合到1:1结合模型以确定结合活性。
[0605]
表3显示了抗潜伏tgf-β1抗体对人、食蟹猴或小鼠的潜伏tgf-β1的结合活性(ka、kd和kd)。
[0606]
(表3)
[0607][0608]
实施例4.抗潜伏tgf-β1抗体的表征
[0609]
(4-1)与细胞表面潜伏tgf-β1结合的抗潜伏tgf-β1抗体
[0610]
抗潜伏tgf-β1抗体(ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191或ht0947ae09-sg191)与细胞表面潜伏tgf-β1的结合活性通过facs使用表达小鼠潜伏tgf-β1的ba/f3细胞或表达人潜伏tgf-β1的freestyle
tm 293-f细胞(thermofisher)进行检测。将抗潜伏tgf-β1抗体(各10微克/ml)与每种细胞系在4摄氏度下温育30分钟,并用facs缓冲液(2%fbs,2mm edta的pbs溶液)洗涤。具有不结合小鼠潜伏tgf-β1和人潜伏tgf-β1的人igg1 fc区(ic17-higg1)的抗klh抗体用作阴性对照抗体。然后添加山羊f(ab')2抗人igg、小鼠ads-pe(southern biotech,cat.2043-09)并在4℃下温育30分钟,并用facs缓冲液洗涤。在facs verse(becton dickinson)上进行数据采集,然后使用flowjo软件(tree star)和graphpad prism软件(graphpad)分析和计算平均荧光强度(mfi)。如图1所示,所有抗潜伏tgf-β1抗体均与ba/f3细胞上表达的小鼠细胞表面潜伏tgf-β1和freestyle
tm 293-f细胞上表达的人细胞表面潜伏tgf-β1结合。
[0611]
(4-2)抗潜伏tgf-β1抗体不与成熟tgf-β1结合但与小鼠lap结合
[0612]
通过elisa检测抗潜伏tgf-β1抗体(ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191或ht0947ae09-sg191)与成熟tgf-β1的结合活性。384孔板用小鼠或人成熟tgf-β1在4摄氏度下包被过夜,然后用pbs-t洗涤四次。洗涤后,将板在室温下用封闭缓冲液(1
×
tbs/吐温-20 0.5%bsa 1
×
block ace)封闭至少1小时,然后用pbs-t洗涤四次。洗涤后,向板中加入抗体溶液并在室温下温育2小时,然后用pbs-t洗涤四次。洗涤后,将稀释的二抗(山羊抗人igg-hrp,abcam,cat.ab98624)加入板中并在室温下温育1小时,然后用pbs-t洗涤四次。洗涤后,向板中加入tmb溶液并在室温下温育15分钟,然后加入1n硫酸终止反应。在450nm/570nm处测量吸光度(光密度;od)。抗klh抗体(ic17-igg1)用作阴性对照抗体,具有人igg1 fc区(gc1008-f1332m)的抗成熟tgf-β抗体gc1008(如美国专利号us8,383,780中所述)用作阳性对照抗体。如图2a和2b所示,抗潜伏tgf-β1抗体不与小鼠成熟tgf-β1也不与人成熟tgf-β1结合。
[0613]
此外,如上所述通过elisa检测抗潜伏tgf-β1抗体(ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191或ht0947a09-sg191)与小鼠潜伏相关蛋白(lap)的结合活性。如图2c所示,抗潜伏tgf-β1抗体与小鼠lap结合。
[0614]
(4-3)抗潜伏tgf-β1抗体抑制自发潜伏tgf-β1激活
[0615]
在存在或不存在抗潜伏tgf-β1抗体(ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191或ht0947ae09-sg191)的情况下,将实施例(1-1)中制备的小鼠潜伏tgf-β1(mslc)和人潜伏tgf-β1(hslc)于37摄氏度下各自温育1小时。抗klh抗体(ic17-igg1)用作阴性对照。根据生产商的程序,通过成熟tgf-β1elisa(人tgf-β1quantikine elisa试剂盒,r&d systems)分析自发潜伏tgf-β1激活和自发潜伏tgf-β1激活的抗体介导的抑制。
[0616]
如图3所示,抗潜伏tgf-β1抗体抑制潜伏tgf-β1的自发激活。
[0617]
(4-4)抗潜伏tgf-β1抗体抑制纤溶酶(pln)介导的潜伏tgf-β1激活
[0618]
在存在或不存在抗潜伏tgf-β1抗体(ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191或ht0947ae09-sg191)的情况下,将实施例(1-1)中制备的小鼠潜伏tgf-β1(mslc)和人潜伏tgf-β1(hslc)各自与人纤溶酶(calbiochem)于37摄氏度下温育1小时。在与纤溶酶温育之前,抗体与小鼠或人潜伏tgf-β1(slc)在室温下预温育30分钟。抗klh抗体(ic17-higg1)用作阴性对照。根据生产商的程序,通过成熟tgf-β1elisa(人tgf-β1quantikine elisa试剂盒,r&d systems)分析纤溶酶介导的潜伏tgf-β1激活和抗体介导的抑制。如图4所示,抗潜伏tgf-β1抗体抑制纤溶酶介导的潜伏tgf-β1激活。
[0619]
(4-5)抗潜伏tgf-β1抗体抑制血浆激肽释放酶(plk)介导的潜伏tgf-β1激活
[0620]
在存在或不存在抗潜伏tgf-β1抗体(ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191或ht0947ae09-sg191)的情况下,将实施例(1-1)中制备的小鼠潜伏tgf-β1(mslc)和人潜伏tgf-β1(hslc)各自与人激肽释放酶(enzyme research laboratories)于37摄氏度下温育2小时。在与激肽释放酶温育之前,抗体与小鼠或人潜伏tgf-β1(slc)在室温下预温育30分钟。抗klh抗体(ic17-higg1)用作阴性对照。根据生产商的程序,通过成熟tgf-β1elisa(人tgf-β1quantikine elisa试剂盒,r&d systems)分析激肽释放酶介导的潜伏tgf-β1激活和抗体介导的抑制。如图5所示,抗潜伏tgf-β1抗体抑制激肽释放酶介导的潜伏tgf-β1激活。
[0621]
(4-6)抗潜伏tgf-β1抗体抑制mmp2和mmp9介导的人类潜伏tgf-β1激活
[0622]
在存在或不存在抗潜伏tgf-β1抗体(ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191或ht0947ae09-sg191)的情况下,将实施例(1-1)中制备的人潜伏tgf-β1(slc)与激活的金属蛋白酶2(mmp2)或mmp9(r&d systems)于37摄氏度下温育2小时。在与mmp2或mmp9温育之前,抗体与人潜伏tgf-β1(slc)在室温下预温育30分钟。抗klh抗体(ic17-higg1)用作阴性对照。根据生产商的程序,通过成熟tgf-β1elisa(人tgf-β1quantikine elisa试剂盒,r&d systems)分析mmp2和mmp9介导的人潜伏tgf-β1激活和抗体介导的抑制。如图6所示,抗潜伏tgf-β1抗体抑制mmp2介导的人类潜伏tgf-β1激活和mmp9介导的人类潜伏tgf-β1激活。
[0623]
(4-7)抗潜伏tgf-β1抗体抑制潜伏tgf-β1激活而不阻止潜伏tgf-β1前肽通过纤溶酶(pln)的切割
[0624]
在存在或不存在抗潜伏tgf-β1抗体(ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191或ht0947ae09-sg191)的情况下,将实施例(1-1)中制备的小鼠潜伏tgf-β1(mslc)和人潜伏tgf-β1(hslc)各自与人纤溶酶(calbiochem)于37摄氏度下温育1小时。在与纤溶酶温育前,抗体与小鼠或人潜伏tgf-β1(slc)在室温下预温育30分钟。甲磺酸卡莫
司他(tocris)用作对照,其是丝氨酸蛋白酶抑制剂,已知可抑制纤溶酶的活性。将样品与4
×
sds-page样品缓冲液(wako)混合,然后在95摄氏度下加热5分钟,然后上样进行sds凝胶电泳。通过trans-blot(注册商标)turbo
tm transfer system(bio-rad)将蛋白转移到膜上。使用小鼠抗flag、m2-hrp抗体(sigma-aldrich)检测潜伏tgf-β1前肽。膜与ecl底物温育,图像通过imagequant las 4000(ge healthcare)采集。
[0625]
如图7所示,抗潜伏tgf-β1抗体不抑制潜伏tgf-β1前肽通过纤溶酶的切割。
[0626]
(4-8)抗潜伏tgf-β1抗体没有显著抑制小鼠pbmc中整联蛋白介导的潜伏tgf-β1激活
[0627]
进行小鼠pbmc和hek-blue
tm tgf-β细胞共培养测定以检测整联蛋白介导的潜伏tgf-β1激活。通过使用histopaque-1083密度梯度培养基(sigma-aldrich)从小鼠血液中分离小鼠pbmc。hek-blue
tm tgf-β细胞(invivogen)(其表达smad3/4结合元件(sbe)诱导型seap报告基因)允许通过监测smad3/4的激活来检测生物活性tgf-β1(小鼠tgf-β1和人tgf-β1)。活性tgf-β1刺激seap产生及其分泌到细胞上清液中。分泌的seap量通过使用quanti-blue
tm
试剂(invivogen)评估。
[0628]
hek-blue
tm tgf-β细胞维持在补充有10%胎牛血清、50u/ml链霉素、50微克/ml青霉素、100微克/ml normocin、30微克/ml杀稻瘟素、200微克/ml hygrogold和100微克/ml zeocin的dmem培养基(gibco)中。在功能测定过程中,将细胞培养基更换为测定培养基(rpmi1640,含10%fbs)并接种到96孔板中。然后将抗潜伏tgf-β1抗体(ht0947ae04-sg191、ht0947ae07-sg191、ht0947ae08-sg191或ht0947ae09-sg191)和小鼠pbmc施加到孔中,并与hek-blue
tm tgf-β细胞温育过夜。然后将细胞上清液与quanti-blue
tm
混合,并在比色板读数器中测量620nm处的光密度(od)。已知rgd肽(grrgdlatih,genscript)与整联蛋白结合并作为诱饵整联蛋白配体抑制整联蛋白介导的tgf-β1激活。因此,rgd肽被用作阳性对照。此外,已知不用作诱饵整联蛋白配体的rge对照肽(grrgelatih,genscript)用作阴性对照。抗klh抗体(ic17-higg1)用作阴性对照。抗成熟tgf-β1抗体(gc1008-f1332m)用作阳性对照。f1332m是人igg1重链恒定区,其包括氨基酸取代以降低效应子功能。
[0629]
如图8所示,抗潜伏tgf-β1抗体没有显著抑制小鼠pbmc中整联蛋白介导的tgf-β1激活。
[0630]
实施例5.抗潜伏tgf-β1抗体的抗肿瘤活性(1)
[0631]
在使用emt6鼠乳腺癌细胞和balb/c小鼠的小鼠同系模型中评价抗潜伏tgf-β1单克隆抗体ht0947ae04-mf18单独使用或与抗pd-l1抗体联合使用的体内疗效,其中,免疫检查点抑制剂治疗单独对肿瘤生长和存活的影响有限(参见nature.2018feb 22;554(7693):544-548.)。
[0632]
(5-1)小鼠同系模型的建立
[0633]
emt6鼠乳腺癌细胞系获自美国典型培养物保藏中心(atcc crl-2755)。细胞在加有2mm l-谷氨酰胺(sigma)和10%胎牛血清(fbs;sigma)的rpmi-1640培养基(sigma)中培养。6周龄无特定病原体balb/c雌性小鼠购自日本charles river inc.,并在接种前适应环境2周。收获对数期生长的emt6细胞并用hank平衡盐溶液(hbss;sigma)洗涤,以1
×
106个细胞/ml的浓度重新悬浮于50%hbss和50%matrigel(corning)中。在小鼠的左侧乳腺脂肪垫#5中接种在100微升hbss:matrigel(1:1)中的1
×
105个emt6细胞。
[0634]
当平均肿瘤体积达到约100-300mm3(接种后7天)时,根据肿瘤体积和体重将小鼠随机分组。用卡尺测量肿瘤体积,如下计算肿瘤体积:
[0635]
肿瘤体积(mm3)=(1/2)
×
长(mm)
×
宽(mm)2[0636]
(5-2)抗肿瘤活性的评价
[0637]
实施例(5-1)中小鼠模型建立后,小鼠接受同种型对照抗体(小鼠igg1抗体联合大鼠igg2b抗体,购自bio x cell)、抗小鼠pd-l1抗体(大鼠igg2b克隆10f.9g2,购自bio x cell)、ht0947ae04-mf18或ht0947ae04-mf18联合抗小鼠pd-l1抗体的处理,如表4所示。每周施用抗体3次,持续3周。首次剂量静脉内施用,第二次剂量和之后剂量为腹腔施用。
[0638]
(表4)
[0639][0640]
每周两次测量肿瘤体积。结果如图9所示。
[0641]
还通过肿瘤生长抑制(tgi[%])评价抗肿瘤活性。如下计算在特定天的特定组的tgi[%]:
[0642]
tgi[%]={1-(t-t0)/(c-c0)}
×
100
[0643]
其中“t”是测量当天该组的平均肿瘤体积,“t0”是随机化当天该组的平均肿瘤体积,“c”是测量当天第1组(同种型对照)的平均肿瘤体积,“c0”是随机化当天第1组(同种型对照)的平均肿瘤体积。
[0644]
结果,首次剂量后第14天抗小鼠pd-l1抗体(第2组)、ht0947ae04-mf18(第3组)和ht0947ae04-mf18联合抗小鼠pd-l1抗体(第4组)的tgi[%]值分别为51、12和83。因此,观察到抗潜伏tgf-β1(ht0947ae04-mf18)和抗pd-l1抗体之间的协同抗肿瘤作用。
[0645]
还绘制了存活曲线以评价每组的存活率。“存活”小鼠的定义如下:其肿瘤体积不超过1955mm3。如图10所示,与抗小鼠pd-l1抗体处理的小鼠(第2组)和ht0947ae04-mf18处理的小鼠(第3组)相比,ht0947ae04-mf18与抗小鼠pd-l1抗体(第4组)的联合处理显著增加了小鼠的存活率。
[0646]
实施例6.抗潜伏tgf-β1抗体的抗肿瘤活性(2)
[0647]
抗潜伏tgf-β1单克隆抗体ht0947ae04-mf18、ht0947ae07-sg181或ht0947ae08-sg181联合抗pd-l1抗体的体内疗效在使用emt6鼠乳腺癌细胞和balb/c小鼠的小鼠同系模型中进行评价。
[0648]
(6-1)小鼠同系模型的建立
[0649]
emt6鼠乳腺癌细胞系获自美国典型培养物保藏中心(atcc crl-2755)。细胞在加有2mm l-谷氨酰胺(sigma)和10%胎牛血清(fbs;sigma)的rpmi-1640培养基(sigma)中培养。7周龄无特定病原体balb/c雌性小鼠购自日本charles river inc.,并在接种前适应环境1周。收获对数期生长的emt6细胞并用hank平衡盐溶液(hbss;sigma)洗涤,以1
×
106个细胞/ml的浓度重新悬浮于50%hbss和50%matrigel(corning)中。在小鼠的左侧乳腺脂肪垫#5中接种在100微升hbss:matrigel(1:1)中的1
×
105个emt6细胞。
[0650]
当平均肿瘤体积达到约100-300mm3(接种后7天)时,根据肿瘤体积和体重将小鼠随机分组。用卡尺测量肿瘤体积,如下计算肿瘤体积:
[0651]
肿瘤体积(mm3)=(1/2)
×
长(mm)
×
宽(mm)2[0652]
(6-2)抗肿瘤活性评价
[0653]
实施例(6-1)中小鼠模型建立后,小鼠用运载体(150mm nacl/20mm his-hcl缓冲液ph6.0)、抗小鼠pd-l1抗体(大鼠igg2b克隆10f.9g2,购自bio x cell)、ht0947ae04-mf18联合抗小鼠pd-l1抗体、ht0947ae07-sg181联合抗小鼠pd-l1抗体、或ht0947ae08-sg181联合抗小鼠pd-l1抗体的治疗,如表5所示。每周施用抗体3次,持续3周。首次剂量是静脉内施用,第二次剂量和之后剂量是腹膜内施用。
[0654]
(表5)
[0655][0656]
每周两次测量肿瘤体积。结果如图11所示。
[0657]
还通过肿瘤生长抑制(tgi[%])评价抗肿瘤活性。(tgi[%])计算为{1-(t-t0)/(c-c0)}
×
100,与实施例(5-2)相同。
[0658]
首次剂量后第14天抗小鼠pd-l1抗体单独使用(第2组)、ht0947ae04-mf18联合抗
小鼠pd-l1抗体(第3组)、ht0947ae07-sg181联合抗小鼠pd-l1抗体(第4组)和ht0947ae08-sg181联合抗小鼠pd-l1抗体(第5组)的tgi[%]分别为64、89、86和76。因此,抗潜伏tgf-β1抗体显示出与抗pd-l1抗体的联合疗效。
[0659]
实施例7.抗潜伏tgf-β1抗体在uuo诱导的小鼠肾纤维化模型中的体内疗效
[0660]
在单侧输尿管梗阻(uuo)小鼠模型中评价单克隆抗体ht0947ae04-sg191、ht0947ae07-sg191和ht0947ae08-sg191的体内疗效,该模型已知诱导进行性肾纤维化。
[0661]
(7-1)uuo诱导的小鼠肾纤维化模型的建立
[0662]
在诱导进行性肾纤维化的单侧输尿管梗阻(uuo)小鼠模型中评价单克隆抗体ht0947ae04-sg191、ht0947ae07-sg191和ht0947ae08-sg191的体内疗效。
[0663]
6周龄无特定病原体c57bl/6ntac雄性小鼠购自invivos pte ltd(新加坡),并在处理开始前适应环境1周。将动物保持在20至26摄氏度,12:12小时的光照/黑暗循环,并喂食商业标准饲料(5p75;pmi nutrition int'l(labdiet),missouri,united states)和自由饮用自来水。
[0664]
uuo手术在异氟醚麻醉条件下进行。腹部左侧剃毛,穿过皮肤行垂直切口。穿过腹膜行第二切口,并还拉伸该皮肤以露出肾脏。使用镊子,将肾脏拉至表面,在肾脏下方将左输尿管用手术线系住两次。将结扎的肾脏轻轻放回其正确的解剖位置,然后缝合腹膜和皮肤。给予镇痛剂以减少动物的痛苦。在假手术组中,仅切开并缝合腹膜和皮肤。
[0665]
(7-2)体内疗效评价
[0666]
从手术前一天开始,所有单克隆抗体以15mg/kg静脉内注射施用,每周三次。抗klh抗体(ic17dk-sg181)在本研究中用作阴性对照。假手术组施用抗klh抗体(ic17dk-sg181)。手术后7天称重动物并在异氟醚麻醉下放血处死。从心腔或后腔静脉采集血样并保持在-80摄氏度直至测定。迅速取出肾脏。部分肾组织在液氮或干冰中速冻用于分子分析。
[0667]
测量肾脏中的羟脯氨酸含量,羟脯氨酸是胶原蛋白中包含的氨基酸之一,用于评价组织的基质外沉积。湿肾脏组织在95℃下干燥3小时并称重。然后,将6n hcl(100微升/1mg干组织)加入干组织中并煮沸过夜。样品通过过滤器净化,并将每个样品10微升接种到96孔板中。将含样品的板在60摄氏度下干燥,并使用羟脯氨酸测定试剂盒(biovision)测量羟脯氨酸。该实验的结果如图12所示。在疾病诱导的肾脏中观察到羟脯氨酸含量显著增加,并且所有抗体(ht0947ae04-sg191、ht0947ae07-sg191和ht0947ae08-sg191)均抑制肾脏纤维化。数据表示为平均值 /-平均值的标准误(sem)。使用斯氏t检验分析进行统计学分析。当p值《0.05时,差异被认为是显著的。
[0668]
实施例8.抗潜伏tgf-β1抗体的毒性评价
[0669]
与抗成熟tgf-β抗体gc1008-mf18(具有小鼠igg fc区mf18的抗成熟tgf-β抗体gc1008(如美国专利号us 8,383,780中所述))相比,在正常小鼠和食蟹猴中重复剂量毒性研究中评价抗潜伏tgf-β1抗体的潜在毒性。由于抗潜伏tgf-β1抗体在小鼠和食蟹猴中发生交叉反应,因此在体内毒理学研究中选择小鼠和食蟹猴作为动物物种进行评价。有关所有毒理学研究的总结,参见表6。
[0670]
(表6)毒理学研究总结
[0671][0672]
iv=静脉内;q2d=每2天一次;q2w=每2周一次;noael=未观察到不良反应的水平;
[0673]
a-运载体,150mmol/l nacl,20mmol/l组氨酸
·
hcl,ph 6.0
[0674]b–
noael带有下划线
[0675]c–
运载体,20mmol/l组氨酸,150mmol/l精氨酸
·
天冬氨酸,ph 6.0
[0676]
在小鼠3个月研究中(iv;5或20mg/kg,q2d,总共46剂),观察到贫血变化(ht0947ae04-mf18组为20mg/kg;gc1008-mf18组为5和20mg/kg)和心脏损伤(gc1008-mf18组中5和20mg/kg;见表7)。这些发现被认为是由tgf-β抑制的上靶(on-target)毒性引起的。考虑到小鼠3个月研究中的上靶(on-target)毒性,ht0947ae04-mf18的noael为5mg/kg iv q2d。此外,由于gc1008-mf18 5mg/kg组的不良反应,在小鼠3个月研究的条件下未确定gc1008-mf18的noael。
[0677]
(表7)小鼠3个月毒性研究的组织病理学的主要发现
[0678][0679][0680]
在猴6周研究中(iv;10、30或100mg/kg,q2w,总共4剂),未观察到因静脉内施用ht0947ae07-sg191引起的毒理学相关变化,并且noael是最高测试剂量100mg/kg q2w。
[0681]
实施例9.抗潜伏tgf-β1抗体的抗肿瘤活性(3)
[0682]
在emt6鼠乳腺癌balb/c小鼠同系模型中评价抗潜伏tgf-β1单克隆抗体
ht0947ae07-sg191联合抗小鼠pd-l1抗体的体内疗效。
[0683]
emt6鼠乳腺癌细胞系获自美国典型培养物保藏中心。细胞在含10%胎牛血清(fbs;nichirei biosciences inc)的rpmi-1640培养基(sigma)中培养。6周龄无特定病原体balb/c雌性小鼠购自日本charles river inc.,并在接种前适应环境1周。收获对数期生长的emt6细胞并用hank平衡盐溶液(hbss;sigma)洗涤,以1
×
106个细胞/ml的浓度重新悬浮于50%hbss和50%matrigel(corning)中。在小鼠的左侧乳腺脂肪垫#5中接种在100微升hbss:matrigel(1:1)中的1
×
105个emt6细胞。
[0684]
当平均肿瘤体积达到约100-300mm3(接种后7天)时,根据肿瘤体积和体重将小鼠随机分组。用卡尺测量肿瘤体积,肿瘤体积计算为1/2
×
l
×
w2,l=长度,w=宽度。
[0685]
小鼠接受运载体(150mm nacl/20mm his-hcl缓冲液ph6.0)、抗小鼠pd-l1抗体(大鼠igg2b克隆10f.9g2,购自bio x cell,10mg/kg首次剂量,随后5mg/kg)、ht0947ae07-sg191(10mg/kg)联合抗小鼠pd-l1抗体或ht0947ae07-sg191(30mg/kg)联合抗小鼠pd-l1抗体治疗。抗体每周施用3次,持续2周,首次剂量是静脉内施用,之后剂量是腹膜内施用。
[0686]
每周两次测量肿瘤体积。通过计算为{1-(t-t0)/(c-c0)}
×
100的肿瘤生长抑制(tgi[%])评价抗肿瘤活性,其中各组的平均肿瘤体积在测量当天为t,在随机化当天为t0,同样运载体对照组的用c和c0代表。
[0687]
该实验的结果如图13所示。
[0688]
抗小鼠pd-l1抗体单独使用、ht0947ae07-sg191(10mg/kg)与抗小鼠pd-l1抗体联合使用,以及ht0947ae07-sg191(30mg/kg)与抗小鼠pd-l1抗体联合使用在首次剂量后14天的tgi[%]分别为60、77和80。ht0947ae07-sg191显示出与抗小鼠pd-l1抗体的联合疗效。
[0689]
尽管出于清楚理解的目的,本文通过说明和示例的方式对本发明进行了一些详细描述,但是这些描述和实施例不应被解释为限制本发明的范围。本文引用的所有专利和科学文献的公开内容通过引用以其全文明确并入。
[0690]
工业适用性
[0691]
本发明提供了跨物种抗潜伏tgf-β1抗体,其抑制蛋白酶介导的潜伏tgf-β1激活而不抑制整联蛋白介导的潜伏tgf-β1激活。本发明还提供了包含抗潜伏tgf-β1抗体和检查点抑制剂的联合疗法。本发明的抗潜伏tgf-β1抗体(其可与检查点抑制剂联合施用)预期可用于治疗tgf-β1相关疾病,例如纤维化和癌症。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
