1.本发明涉及生物技术领域,具体涉及一种初生仔猪肠神经胶质细胞的分离和原代培养方法。
背景技术:
2.早期断奶仔猪肠道等器官尚未发育成熟,导致其消化能力和抗逆能力较差,加上心理、营养与环境的突然转变,断奶仔猪表现为采食量下降、消化功能紊乱、腹泻、生长受阻等为主要特征的“早期断奶综合症”,给生猪养殖业带来重大经济损失,成为制约生猪规模化养殖的关键问题之一。
3.小肠参与机体应激时的病理生理改变,被认为是“多器官功能障碍的发动机”,因此也被称为“机体应激的中心器官”。在应激反应中,动物机体为保证心、脑等重要器官的血液供应,通过复杂的神经-内分泌系统介导,调节全身血流重新分配,产生选择性内脏血管痉挛,如肠道缺血、缺氧等,进一步引起肠黏膜屏障受损、肠道细菌变化、内毒素群移位、炎性反应及多种细胞因子表达升高。与身体其他器官不同,动物胃肠道具有广泛的内在神经系统,其内在神经系统(被称为肠神经系统,也叫作“肠脑”)可独立于脑和外周自主神经系统对胃肠功能进行调控,具有明显的自律性和稳定性(vanner et al.,2016;yoo and mazmanian,2017)。而且研究表明肠神经系统紊乱会破坏肠道黏膜稳态的平衡进而导致肠道炎症的发生。以往关于仔猪肠道健康的调控研究主要集中于对仔猪肠道屏障功能、免疫细胞、炎症因子以及炎症相关信号通路,但是针对“仔猪肠神经系统-肠道功能”的研究几乎是空白。肠神经胶质细胞作为肠神经系统的重要组成部分,与肠肠神经胶质细胞构成了肌间神经丛、肠黏膜下层神经丛、肠黏膜固有层神经丛、肠绒毛神经丛等胃肠道内广泛分布的神经网络系统,肠神经胶质细胞的数量大约为肠肠神经胶质细胞4-10倍(drokhlyansky et al.,2020;seguella and gulbransen,2021)。近年来,有研究将肠神经胶质细胞称为肠道的“小脑”,以凸显其对肠神经系统乃至整个肠道稳态的重要性(rao and gershon,2018;seguella and gulbransen,2021)。
4.困难1:肠神经胶质细胞存在于消化道壁内,提取困难。
5.困难2:现有技术中,针对胶质细胞的培养基经过验证,均无法很好的培养肠神经胶质细胞。
6.现有的胶质细胞的培养基可见:
7.d1:新生大鼠视神经少突胶质细胞原代培养及其对视神经损伤修复研究的意义(英文),来源:中国临床康复第8卷第4期,2004-02-05出版;
8.其materials and methods记载(申请人译文):从第三军医院附属医院野战外科动物中心获得10只2日龄新生wistar大鼠,雌雄不限。向基质中加入磷酸盐缓冲液(pbs)、d-hanks溶液、dmem/f12培养基(按照说明配制)、青霉素和链霉素(100ku/l、100mg/l)。然后过滤基质以去除细菌,并将其冷冻备用。聚赖氨酸(西格玛):1mg/l母液通过pbs配制,然后保持在-20℃。化学培养液配方:反式铁蛋白(100mg/l)、甲状腺素(0.4mg/l)、亚硒酸钠(40μg/
l)、腐胺购自sigma公司;谷氨酰胺(3g/l)由华美公司提供;孕酮(0.62mg/l)和胰岛素(0.234ku/l)是我国常用药物。然后用dmem/f12底物(hyclone)与青霉素和链霉素(100ku/l,100mg/l)配制上述配方,经过滤去除细菌后冷冻备用。
9.d2:cn201810569605.0公开了一种用于体外培养星形胶质细胞的培养基及培养方法,属于细胞培养领域。本发明通过在星形胶质细胞培养基中添加表皮生长因子,成纤维细胞生长因子,sag和purmorphamine,可以明显的延长星形胶质细胞体外培养时间、增加传代次数、提高纯度、并能保持星形胶质细胞原有特性。发明人研究发现,本发明的培养基可以隔代使用,并维持星形胶质细胞传代至13代;
10.其培养基为:所述培养基是在基础培养基的基础上添加表皮生长因子(egf)、成纤维细胞生长因子(fgf)、smo蛋白激动剂smoothened agonist和hh激动剂purmorphamine;
11.所述基础培养基中包含有下述组分:5%v/v胎牛血清,gibco mem无血清培养基glutamax,1m葡萄糖,50g/l nahco3,1%v/v青霉素混合盘尼西林双抗。
12.本专利旨在建立一种初生仔猪肠神经胶质细胞的分离和原代培养方法。
技术实现要素:
13.本发明的目的是在于提供一种初生仔猪肠神经胶质细胞的分离和原代培养方法,该方法可成功率高的从仔猪肠道提取得到胶质细胞并原代培养。
14.为实现上述目的,本发明提供如下技术方案:一种初生仔猪肠神经胶质细胞的分离和原代培养方法,所述方法具体为:
15.步骤1:从屠宰的仔猪上取出空肠前段,进行清洗;
16.步骤2:采用消化培养基消化肠道,收集细胞沉淀;
17.步骤3:向步骤2得到的细胞沉淀中加入胰酶消化肠道,收集细胞沉淀;
18.步骤4:用肠神经胶质细胞培养基重悬步骤3得到的细胞,并接种到用层粘连蛋白和poly-d赖氨酸包被的多孔细胞培养爬片上;
19.所述肠神经胶质细胞培养基的配方:
20.基础培养基:dmem/f12培养基;
21.fbs 9-11vol%;
22.双抗适量;
23.gdnf 95-105ng/ml;
24.100x规格的glutamax 0.9-1.1倍体积;
25.pdgf 8-12ng/ml;
26.在步骤4的培养过程中,在培养2天后采用无血清的肠神经胶质细胞培养基继续培养;所述无血清的肠神经胶质细胞培养基在肠神经胶质细胞培养基的基础上去除了fbs;
27.然后再换回肠神经胶质细胞培养基继续培养。
28.在上述的初生仔猪肠神经胶质细胞的分离和原代培养方法中,所述肠神经胶质细胞培养基的配方:
29.基础培养基:dmem/f12培养基;
30.fbs 10vol%;
31.双抗适量;
32.gdnf 100ng/ml;
33.100x规格的glutamax 1倍体积;
34.pdgf 10ng/ml。
35.在上述的初生仔猪肠神经胶质细胞的分离和原代培养方法中,所述步骤1具体为:
36.从屠宰的仔猪上取出空肠前段,使用含3%双抗的pbs清洗3-5遍,直至培养基上清液清亮无杂物,将其置于含1倍体积的gentamicin/amphotericin b solution(500x)的含有95%氧气,5%的二氧化碳的kerbs溶液的培养皿中;kerbs溶液含126mm nacl,2.5mm kcl,2.5mm cacl2,1.2mm nah2po4,1.2mm mgcl2,kerbs溶液的ph为7.0-7.4。
37.在上述的初生仔猪肠神经胶质细胞的分离和原代培养方法中,所述步骤2具体为:
38.取出高压灭菌后的剪刀,小心剪掉肠管浆膜层及周围结缔组织,接着用眼科剪剪碎肠组织,然后加入预热至37℃的消化液在37℃恒温孵箱中200rpm消化1h,将70μm的细胞过滤膜放置在50ml离心管上,将消化的组织加入70μm的细胞过滤膜中过滤,丢弃过滤膜,过滤液4℃400g离心8min,去上清收集细胞沉淀;
39.消化液的配方为:在pbs中加入1mg/ml胶原酶i、1mg/ml牛血清白蛋白、20μg/ml dna酶i、1mm hepes、1mm glutamax。
40.在上述的初生仔猪肠神经胶质细胞的分离和原代培养方法中,所述步骤3具体为:
41.加入0.25%含edta的胰酶,移液枪轻轻吹打均匀,在37℃恒温孵箱中消化7min,然后加入等量的含有10%fbs的dmem终止消化,然后将70μm的细胞过滤膜放置在50ml离心管上,将消化的组织加入70μm的细胞过滤膜,用无菌注射器活塞部轻轻研磨组织,收集滤液,丢弃过滤膜,过滤液4℃500g离心8min,去上清收集细胞沉淀。
42.在上述的初生仔猪肠神经胶质细胞的分离和原代培养方法中,所述步骤4中,层粘连蛋白和poly-d赖氨酸包被的多孔细胞培养爬片的制备方法为:
43.实验前一天将-20℃储存的层粘连蛋白和poly-d赖氨酸置于4℃缓慢解冻,实验当天将无菌的细胞爬片置于24孔板中,先用100μg/ml poly-d赖氨酸100μl/每孔覆盖细胞爬片,室温孵育1h,用ddh2o清洗爬片后室温干燥1h,然后再用60μg/ml层粘连蛋白100μl/每孔覆盖细胞爬片,37℃培养箱中孵育1h,吸走残留的层粘连蛋白溶液,用无菌pbs漂洗两遍,后置于37℃培养箱待用。
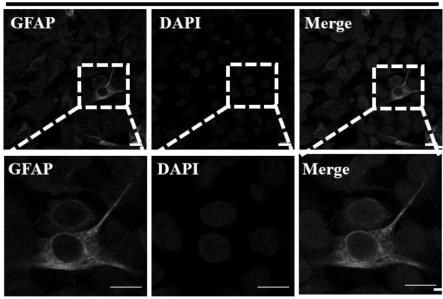
44.在上述的初生仔猪肠神经胶质细胞的分离和原代培养方法中,在步骤4中,实验采用每两天换液,有利于及时减少细胞不良代谢产物,维持肠神经胶质细胞的充分营养,不断提高肠神经胶质细胞纯度,期间显微镜观察细胞生长状态,3天后收集检测,做细胞蛋白染色。
45.与现有技术相比,本发明的有益效果是:
46.本发明提供一种初生仔猪肠神经胶质细胞的分离和原代培养方法;通过上述方法分离得到的初生仔猪肠神经胶质细胞,不仅可以为研究大型哺乳动物腹泻及肠道健康等提供了模型,也可以为机体天然神经免疫反应提供模型,还可以为深入探究营养素或相关基因在中发挥的调控作用提供研究工具。
附图说明
47.图1为本发明的实施例1的操作过程图;
48.图2为本发明的实施例1的第一天的显微镜下细胞生长状态图;
49.图3为本发明的实施例1的第三天的显微镜下细胞生长状态图;
50.图4为本发明的实施例1的细胞蛋白染色图。
具体实施方式
51.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
52.实施例1
53.参考图1,本发明涉及的初生仔猪肠神经胶质细胞的分离和原代培养方法如下:
54.(1)层粘连蛋白和poly-d赖氨酸包被细胞培养爬片:实验前一天将-20℃储存的层粘连蛋白和poly-d赖氨酸置于4℃缓慢解冻,实验当天将无菌的细胞爬片置于24孔板中,先用100μg/ml poly-d赖氨酸100μl/每孔覆盖细胞爬片,室温孵育1h,用ddh2o清洗爬片后室温干燥1h。然后再用60μg/ml层粘连蛋白100μl/每孔覆盖细胞爬片,37℃培养箱中孵育1h,吸走残留的层粘连蛋白溶液,用无菌pbs漂洗两遍,后置于37℃培养箱待用。
55.(2)仔猪肠道采集:从屠宰的仔猪上取出空肠前段,使用含3%双抗的pbs清洗3-5遍,直至培养基上清液清亮无杂物,将其置于含1倍体积的gentamicin/amphotericin b solution(500x)的含有95%氧气,5%的二氧化碳的kerbs溶液(126mm nacl,2.5mm kcl,2.5mm cacl2,1.2mm nah2po4,1.2mm mgcl2,ph 7.0-7.4)的培养皿中。
56.(3)去除肠道浆膜和纵肌层:将洗净的肠道用镊子轻轻套入2ml注射器的活塞部,然后用无菌手术刀沿着肠系膜的附着的肠子纵向划两道划痕,注意不要划破肠子。然后用浸湿pbs的棉签,沿着肌肉纵向摩擦湿润的肠道,以去除肠道浆膜和纵肌层,然后将剥离好的肠道放在4℃pbs中备用。
57.(4)消化培养基消化肠道:取出高压灭菌后的剪刀,用眼科剪将剥离好的肠组织剪成0.3-0.5cm左右的小块,然后加入预热至37℃的消化液(pbs、1mg/ml胶原酶i、1mg/ml牛血清白蛋白、20μg/ml dna酶i、1mm hepes、1mm glutamax)在37℃恒温孵箱中200rpm消化1h。将70μm的细胞过滤膜放置在50ml离心管上,将消化的组织加入70μm的细胞过滤膜中过滤,丢弃过滤膜,过滤液4℃400g离心8min,去上清收集细胞沉淀。
58.(5)胰酶消化肠道:加入0.25%含edta的胰酶,移液枪轻轻吹打均匀,在37℃恒温孵箱中消化7min,然后加入等量的含有10%fbs的dmem终止消化,然后将70μm的细胞过滤膜放置在50ml离心管上,将消化的组织加入70μm的细胞过滤膜,用无菌注射器活塞部轻轻研磨组织,收集滤液,丢弃过滤膜,过滤液4℃500g离心8min,去上清收集细胞沉淀。
59.(6)接种肠神经胶质细胞:用肠神经胶质细胞培养基重悬细胞,接种到步骤(1)中用层粘连蛋白和poly-d赖氨酸包被的24孔细胞培养爬片上,原代肠神经胶质细胞前两天培养基配方为:dmem/f12培养基,10%fbs,1倍体积的penicillin&streptomycin solution(100x),100ng/ml gdnf,10ng/ml pdgf,1x glutamax(100x);原代肠神经胶质细胞两天后培养基配方为:dmem/f12培养基,1x penicillin&streptomycin solution(100x),100ng/ml gdnf,10ng/ml pdgf,1x glutamax(100x)(两天后采用无血清的培养基,有助于与消除
成纤维细胞的污染,然后换回有血清培养基即可)。
60.(7)实验采用每两天换液,有利于及时减少细胞不良代谢产物,维持肠神经胶质细胞的充分营养,不断提高肠神经胶质细胞纯度,期间显微镜观察细胞生长状态(图2-3),3天后收集检测,做细胞蛋白染色(图4)。
61.备注:
62.1.本案所述实施例以及对比例中所涉及的1倍体积的含义释义如下:
63.1x glutamax(100x)是指将商品glutamax稀释100倍,即在100ml基础培养基中加入1ml glutamax。
64.2.未做特殊说明的情况下,本案的mm代表毫摩尔/l;%代表体积百分比。
65.本实施例1经过5次重复实验,成功5次。
66.对比例1
67.本对比例的操作步骤同实施例1的步骤1-7,不同之处在于:肠神经胶质细胞培养基的配方为:dmem/f12培养基,10%fbs,1倍体积的penicillin&streptomycin solution(100x),100ng/ml gdnf,10ng/ml egf,1x glutamax(100x)。
68.本对比例1经过5次重复性实验,成功2次。
69.对比例2
70.本对比例的操作步骤同实施例1的步骤1-7,不同之处在于:肠神经胶质细胞培养基的配方为:dmem/f12培养基,10%fbs,1倍体积的penicillin&streptomycin solution(100x),20ng/ml fgf,20ng/ml egf,1x glutamax(100x)。
71.对比例2经过5次重复性实验,成功1次。
72.对比例3
73.本对比例的操作步骤同实施例1的步骤2-7,不同之处在于:细胞培养爬片未包被。
74.对比例2经过5次重复性实验,成功1次。
75.结论:
76.1.细胞培养爬片经过包被利于贴壁培养;
77.2.gdnf胶质细胞源性神经营养因子大剂量使用,配合pdgf血小板来源的生长因子可提高猪肠神经胶质细胞的原代生长。
78.实验过程由同一人在相同环境下进行操作,已经排除了多种环境因素。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。