一种一步法合成
α
‑
硒氰酮类化合物的方法
技术领域
1.本技术属于有机合成技术领域,具体涉及一种一步法合成α
‑
硒氰酮类化合物的方法。
背景技术:
2.α
‑
硒氰酮在许多生物分子的合成,新材料的研究,药物分子等领域应用极其广泛,尤其在动物模型系统中,该类化合物作为一个整体似乎起着化学保护剂的作用,以对抗多种化学致癌物。此外,α
‑
硒氰酮类衍生物具有很大的应用价值,这类化合物在合成中可以作为一类非常有用的中间体,可以用来合成一系列硒三氟甲基以及二硒醚的分子。因此自上世纪一直以来,该类化合物的合成和性质受到越来越多的相关领域的有机合成化学家的广泛关注。在参照前人的工作和我们课题组类似对单质硒的高效插入工作的深入学习后,利用含有α
‑
h的酮类衍生物与单质硒以及tmscn作为氰基源直接引入硒氰基,得到良好的产率,并且底物范围较宽广。最终得到一个方便可行、易于操作、收率较高、绿色环保的合成α
‑
硒氰酮方法。
技术实现要素:
3.本发明的目的在于提供一种一步法合成α
‑
硒氰酮类化合物的方法,在无金属、无添加的条件下,含有α
‑
h的酮类化合物与单质硒以及三甲基氰硅烷(tmscn)构建α
‑
硒氰酮类化合物的反应。该新策略具有单质硒参与、无需额外添加剂促进,广泛的底物范围和良好的官能团兼容性,以高度简洁的方式为多种α
‑
硒氰酮类化合物的制备提供了一个高效和绿色的途径。
4.根据本发明提供的一种一步法合成α
‑
硒氰酮类化合物的方法,包括如下步骤:
5.向配备磁力搅拌的反应器中加入式i所示的酮类化合物、硒粉、tmscn和有机溶剂,随后将反应混合物在60
‑
120℃搅拌反应,反应完全后经后处理得到式ii所示的α
‑
硒氰酮类化合物;反应式如下:
[0006][0007]
上述反应式中,r1选自c1‑
20
烷基、c1‑
20
烷氧基、取代或未取代的c6‑
20
芳基、取代或未取代的c2‑
20
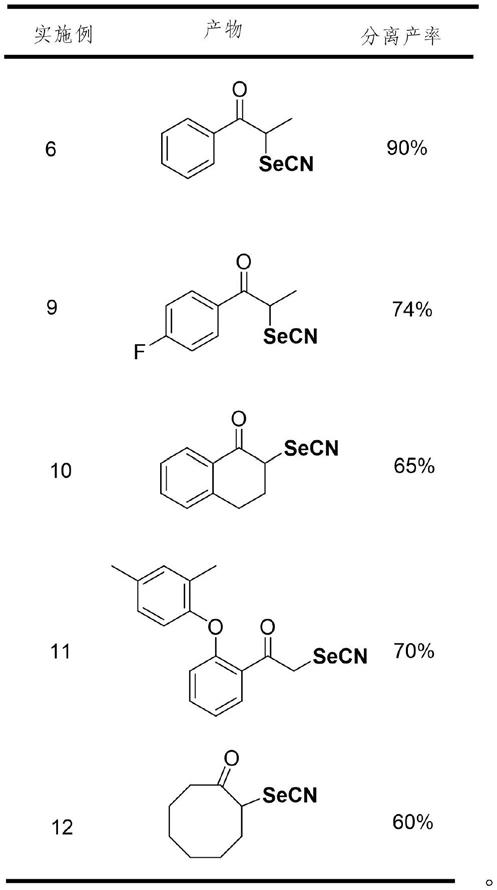
杂芳基、取代或未取代的c3‑
20
环烷基;
[0008]
r2选自氢、卤素、c1‑
20
烷基、取代或未取代的c6‑
20
芳基、取代或未取代的c7‑
20
芳烷基;或者,
[0009]
r1和r2彼此连接成含或不含杂原子的饱和或不饱和的c3‑
20
环状结构,该环状结构任选地被取代基所取代。
[0010]
在本文的任意部分中,所述“取代的”中的取代基选自卤素(包括氟、氯、溴、碘)、甲基、乙基、叔丁基、甲氧基、乙氧基、叔丁氧基、
‑
cn、
‑
no2、苯基、乙酰基、乙酰氧基、2,4
‑
二甲
基苯氧基;和/或相邻的两个取代基一起形成c3‑7的碳环结构,该碳环结构任选地被一个或多个c1‑6烷基取代。
[0011]
在本文的任意部分中,具有所示碳原子烷基(包括烷氧基、芳烷基中的烷基部分)可以选自例如甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、己基等。具有所示碳原子数目的芳基(包括芳烷基中的芳基部分)可以选自例如苯基、萘基、蒽基、菲基、芘基等。具有所示碳原子数目的杂芳基可以选自例如噻吩基、呋喃基、吡啶基、吡唑基、喹啉基、噻唑基、恶唑基等。具有所示碳原子数目的环烷基可以选自例如环丙基、环丁基、环戊基、环己基、环庚基、以及桥联环烷基如金刚烷基等。
[0012]
因此,优选地,r1选自取代或未取代的c6‑
12
芳基、取代或未取代的c2‑
12
杂芳基;
[0013]
r2选自氢、c1‑6烷基、取代或未取代的c6‑
20
芳基;或者,
[0014]
r1和r2彼此连接成含或不含杂原子的饱和或不饱和的c6‑
12
环状结构。
[0015]
进一步优选地,r1选自其中,m选自1,2,3,4或5;各个r
a
彼此独立地氢、氟、氯、溴、甲基、乙基、叔丁基、甲氧基、乙氧基、硝基、氰基、乙酰基、乙酰氧基、2,4
‑
二甲基苯氧基;
[0016]
r2选自氢、甲基、乙基、丙基、叔丁基、苯基;或者,
[0017]
r1和r2彼此连接成如下结构:
[0018]
根据本发明前述的方法,其中,所述的有机溶剂选自dmso。
[0019]
根据本发明前述的方法,其中,所述式i所示的酮类化合物、硒粉、tmscn的投料摩尔比为(2
‑
4):(5
‑
9):(8
‑
10)。
[0020]
根据本发明前述的方法,其中,反应温度优选为80
‑
100℃;最优选为90℃;反应时间为5
‑
20h,优选为12h。
[0021]
根据本发明前述的方法,其中,反应气氛为空气气氛。
[0022]
根据本发明前述的方法,其中,所述的后处理操作如下:反应完全后,向反应体系中加水淬灭,随后将反应液用乙酸乙酯萃取,分离有机相,有机相浓缩,将残余物通过硅胶快速色谱纯化,得到式ii所示的α
‑
硒氰酮类化合物。
[0023]
本发明的方法取得了如下的有益效果:
[0024]
本发明提供了一种一步法合成α
‑
硒氰酮类化合物的方法,在无金属、无添加的条件下,含有α
‑
h的酮类化合物与单质硒以及三甲基氰硅烷(tmscn)构建α
‑
硒氰酮类化合物的反应。该新策略具有单质硒参与、无需额外添加剂促进,广泛的底物范围和良好的官能团兼容性,以高度简洁的方式为多种α
‑
硒氰酮类化合物的制备提供了一个高效和绿色的途径。
附图说明
[0025]
图1实施例6制备的产物核磁氢谱图。
[0026]
图2实施例6制备的产物核磁碳谱图。
[0027]
图3实施例9制备的产物核磁氢谱图。
[0028]
图4实施例9制备的产物核磁碳谱图。
[0029]
图5实施例9制备的产物核磁氟谱图。
[0030]
图6实施例10制备的产物核磁氢谱图。
[0031]
图7实施例10制备的产物核磁碳谱图。
[0032]
图8实施例11制备的产物核磁氢谱图。
[0033]
图9实施例11制备的产物核磁碳谱图。
[0034]
图10实施例12制备的产物核磁氢谱图。
[0035]
图11实施例12制备的产物核磁碳谱图。
具体实施方式
[0036]
以下结合具体实施例,对本发明作进一步详述。在下文中,如无特殊说明,所使用的方法均为本领域常规方法,所使用的试剂均可以通过常规商业途径购买获得和/或借鉴已知合成方法制备获得。
[0037]
实施例1
‑
8反应条件优化试验
[0038]
以苯丙酮为模板底物,筛选最优反应条件(表1),反应式如下:
[0039][0040]
具体操作如下:
[0041]
在装有搅拌磁子的10ml压力管中加入式ia所示的苯丙酮(0.2mmol)、硒粉(0.6mmol)、tmscn(0.8mmol)和dmso(1ml)。将反应混合物在90℃下搅拌12小时。反应后,加入2ml水,将反应溶液用20ml乙酸乙酯萃取3次,分离有机相,减压浓缩,然后将残余物通过硅胶(200
‑
500目)快速色谱纯化,得到iib的目标产物。1h nmr(400mhz,cdcl3)δ7.94
‑
7.91(m,2h),7.69
‑
7.65(m,1h),7.56
‑
7.52(m,2h),5.41(q,j=7.3hz,1h),2.05(d,j=7.3hz,3h);
13
c nmr(126mhz,cdcl3)δ197.1,134.7,132.8,129.2,129.0,102.7,49.02,21.4。
[0042]
表1:
[0043]
实施例温度/℃分离产率/%10nr220234010460305808069090710077812020
[0044]
表1实验结果表明,模板反应在不同温度表现出不同的反应性,在90℃模板反应的产率普遍较高,在二甲亚砜作为溶剂的情况下,以90%的收率得到目标产物。最后,考虑到经济和高效的因素,选择dmso作为反应溶剂,在空气条件下,90℃反应12h,作为最优条件。
[0045]
在优化反应条件(实施例6)的基础上,我们拓展了其他含有α
‑
h的酮类的底物范围。我们发现电子效应、位阻效应影响较小,产率都保持在60%以上。值得一提的是,非芳环的硼酸也具有较高的收率。结果如表2所示:
[0046]
表2:
[0047][0048]
产物结构表征:
[0049]
实施例9:1h nmr(400mhz,cdcl3)δ8.03
‑
7.99(m,2h),7.27
‑
7.23(m,2h),5.39(q,j=7.2hz,1h),2.08(d,j=7.2hz,3h);
13
c nmr(126mhz,cdcl3)δ195.5(s),166.5(d,j=258.1hz),131.9(d,j=9.7hz),129.3(d,j=3.0hz),116.5(d,j=22.2hz),102.5(s),48.47(s),21.2(s);
19
f nmr(471mhz,cdcl3)δ
‑
101.8.。
[0050]
实施例10:1h nmr(400mhz,cdcl3)δ8.01
‑
7.99(m,1h),7.60
‑
7.56(m,1h),7.39
‑
7.31(m,2h),5.03
‑
4.98(m,1h),3.19
‑
3.18(m,2h),2.92
‑
2.89(m,1h),2.57
‑
2.52(m,1h);
13
c nmr(126mhz,cdcl3)δ194.2,144.1,135.0,130.5,129.1,127.8,127.4,102.5,53.2,32.6,30.3.。
[0051]
实施例11:1h nmr(500mhz,cdcl3)δ8.01
‑
8.00(m,1h),7.47
‑
7.42(m,1h),7.16
‑
7.04(m,3h),6.87
‑
6.86(m,1h),6.66
‑
6.64(m,1h),4.96(s,2h),2.36(s,3h),2.19(s,3h);
13
c nmr(126mhz,cdcl3)δ192.6,158.8,149.9,135.89,135.6,132.6,131.4,129.9,128.3,123.9,122.4,120.6,115.8,102.3,42.7,20.7,16.1。
[0052]
实施例12:1h nmr(500mhz,cdcl3)δ4.81
‑
4.79(m,1h),2.78
‑
2.69(m,2h),2.47
‑
2.43(m,1h),2.33
‑
2.30(m,1h),1.99
‑
1.93(m,2h),1.76
‑
1.73(m,3h),1.56
‑
1.54(m,1h),1.47
‑
1.41(m,1h),0.98
‑
0.95(m,1h);
13
c nmr(126mhz,cdcl3)δ212.8,102.8,58.8,39.2,29.3,28.4,25.9,24.9,23.8.。
[0053]
以上所述实施例仅为本发明的优选实施例,而并非本发明可行实施的穷举。对于本领域技术人员而言,在不背离本发明原理和精神的前提下,对其所作出的任何显而易见的改动,都应当被认为包含在本发明的权利要求保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。