猪伪狂犬病病毒ge/gi/tk基因缺失疫苗株及其构建方法和应用
技术领域
1.本发明属于病毒领域,具体涉及一种猪伪狂犬病病毒ge/gi/tk基因缺失疫苗株及其构建方法和应用。
背景技术:
2.伪狂犬病毒属于α疱疹病毒,能感染多种哺乳动物和少数禽类,猪是伪狂犬病毒的主要宿主,伪狂犬病毒会引起妊娠母猪流产、死胎,公猪不育,新生仔猪死亡,育肥猪呼吸困难、生长停滞等伪狂犬病症状,是危害养殖业的重大传染病之一。目前伪狂犬病的防治主要依赖疫苗,其中最为经典,也是目前国内外使用最广泛的是来源于1961年匈牙利学者bartha分离的k61传代致弱株,简称bartha k61株。以该毒株为基础的疫苗在伪狂犬病的防控上发挥了十分重要的作用,部分国家和区域实现了伪狂犬病的净化,目前国内使用的伪狂犬病毒疫苗也主要来源于该毒株。bartha k61毒株在中国的伪狂犬病防控上也发挥了重要作用,1990年以来,有超过80%的养殖猪只免疫了该毒株,有效控制了伪狂犬病在中国的传播。但是近几年国内流行的伪狂犬毒株可能出现了变异,导致bartha k61疫苗免疫失败。从基因序列分析来看,全球伪狂犬病毒可以分为两个大的分支,其中以bartha株为代表的基因1型毒株主要分布在欧美,而国内的毒株属于基因2型,位于另一个大的分支上;国内毒株又可以进一步分为以ea毒株为代表的经典毒株分支和近年出现的变异毒株分支。从基因分析数据也可以看出,虽然伪狂犬病毒还属于一个血清型,但国内外的伪狂犬毒株已经出现了基因序列上的分化,国内毒株则进一步分化为新旧两个分支,提示国内的毒株在免疫原性上与以bartha为代表的国外毒株可能已经出现了差异,也解释了近年国内出现bartha株疫苗保护不完全的情况。
3.另一方面,部分猪场出于生物安全防控的考虑,为了减少人员和猪群的接触、避免对猪群的刺激,会大大减少疫苗的使用,这也导致这两年伪狂犬病的发病率进一步提高。这两方面的因素,都对伪狂犬疫苗的研制工作提出了更高的要求和挑战,一方面需要疫苗株能提供针对国内流行变异毒株的高效的保护作用,要解决这个问题,需要筛选出国内流行的,有代表性的,毒力较强的prv变异野毒株作为疫苗候选毒株;另一方面则需要更加稳定、安全、可靠,免疫效率更高,使用方便,对猪群刺激小的伪狂犬疫苗,这方面则需要通过更加安全可靠的基因缺失疫苗构建、筛选方法,以及对免疫剂型和免疫方式的调整来实现。
4.综上所述,目前国内伪狂犬毒株流行和净化的趋势,一方面十分需要针对流行伪狂犬变异株的疫苗,另一个方面对疫苗候选毒株的筛选和基因缺失疫苗的构建都提出了更高的要求。而目前国内伪狂犬疫苗的毒株主要是传统的bartha-k61株疫苗,新疫苗毒株的安全性,有效性,以及是否有地域流行毒株的针对性还未得到市场充分的验证。
技术实现要素:
5.本发明的目的在于提供一种基于猪伪狂犬病毒prv gd0304的猪伪狂犬病毒ge/
gi/tk基因缺失株及其在制备疫苗中的应用。
6.本发明所采取的技术方案是:
7.本发明的第一方面,提供一株猪伪狂犬病毒ge/gi/tk基因缺失株,所述猪伪狂犬病病毒ge/gi/tk基因缺失株是ge、gi和tk基因缺失的猪伪狂犬病毒prv gd0304;;所述猪伪狂犬病prv gd0304的保藏编号为cctcc no:v201946,保藏时间为:2019.8.15,保藏单位:中国典型培养物保藏中心,保藏地址:中国.武汉.武汉大学。
8.在本发明的一些实施方式中,所述猪伪狂犬病毒ge/gi/tk基因缺失株命名为:猪伪狂犬病毒prv gd0304 ge-gi-tk-株,保藏编号为cctcc no:v201955,保藏时间为:2019.8.15,保藏单位:中国典型培养物保藏中心,保藏地址:中国.武汉.武汉大学。
9.本发明的第二方面,提供一种治疗或预防猪伪狂犬病的产品,包含本发明第一方面所述的基因缺失株或猪伪狂犬病prv gd0304。
10.在本发明的一些实施方式中,所述产品还包括药学上可接受的佐剂、载体、稀释剂或赋形剂。
11.在本发明的一些实施方式中,所述佐剂为gel 01pr、isa 201vg或可以应用于兽用疫苗的铝盐类佐剂、蛋白类佐剂和核酸类佐剂。
12.在本发明的一些实施方式中,所述疫苗为灭活疫苗或活疫苗。
13.在本发明的一些实施方式中,所述疫苗以生理可给药的形式提供,并且适合于口服、滴鼻、肌内、静脉内、皮下或皮肤注射应用。
14.在本发明的一些实施方式中,所述灭活疫苗中猪伪狂犬病病毒ge/gi/tk基因缺失株采用甲醛或β-丙内酯等灭活剂灭活。
15.本发明的第三方面,提供以本发明第一方面所述的猪伪狂犬病毒ge/gi/tk基因缺失株为免疫原制备的抗体。
16.本发明还提供上述在制备用于检测猪伪狂犬病毒感染的诊断试剂及试剂盒中的应用。本发明的第三方面,提供本发明第一方面所述猪伪狂犬病毒ge/gi/tk基因缺失株或猪伪狂犬病prv gd0304在制备预防或治疗猪伪狂犬病药物中的用途。
17.本发明的第四方面,提供本发明第一方面所述猪伪狂犬病毒ge/gi/tk基因缺失株或猪伪狂犬病prv gd0304在制备诊断或检测猪伪狂犬病药物中的用途。
18.本发明的第五方面,提供本发明第一方面所述猪伪狂犬病毒ge/gi/tk基因缺失株或猪伪狂犬病prv gd0304在猪伪狂犬病病毒攻毒发病模型中的应用。
19.本发明的第六方面,提供一种制备预防或治疗猪伪狂犬病疫苗的方法,包括以下步骤:制备本发明第一方面所述的猪伪狂犬病毒ge/gi/tk基因缺失株病毒液,然后加入佐剂即得。
20.在本发明的一些实施方式中,所述制备猪伪狂犬病毒ge/gi/tk基因缺失株病毒液后进行灭活。
21.本发明的有益效果是:
22.本发明筛选出一株毒力较强,基因型、血清学水平等方面都有特点和代表性的伪狂犬变异毒株,命名为猪伪狂犬病prv gd0304,并以此毒株为基础,用同源重组的方法构建了该毒株的ge-/gi-/tk-三基因缺失毒株,命名为猪伪狂犬病毒prv gd0304 ge-/gi-/tk-作为疫苗候选毒株。从小鼠和仔猪的免疫攻毒试验都可以看出,以本发明中的三基因缺失伪
狂犬变异毒株制备的灭活或者活病毒疫苗,相比于经典的bartha k61毒株,针对变异毒株均有较好的攻毒保护效果,可以有效降低发病率和死亡率,血清中和效价也更高。本三基因缺失毒株在针对伪狂犬变异毒株的防控上有较高的应用和商业价值,是一株有希望应用于当前prv流行防控工作的疫苗株。
附图说明
23.图1为筛选猪伪狂犬病毒流行变异毒株的技术路线。
24.图2为gd0304株(p3)感染vero细胞cpe情况。
25.图3为prvgd0304病毒粒子电镜图。
26.图4为数据库中伪狂犬基因序列构建的系统发育树。图4a为9个prv病毒基因组使用mp法构建的进化树;图4b为gb基因序列使用nj法构建的进化树;图4c为gc基因序列使用nj法构建的进化树。
27.图5为基因敲除前、敲除中、及敲除后伪狂犬病毒gd0304株感染vero细胞时的细胞病变情况。图5a为gd0304野毒株感染vero细胞36小时后的细胞病变情况,200倍;图5b为绿色荧光蛋白基因替换病毒tk基因以后的重组病毒感染vero细胞48小时后细胞中表达绿色荧光蛋白的情况,200倍;图5c为在tk基因缺失的基础上,红色荧光蛋白基因替换病毒ge基因和部分gi基因以后的重组病毒感染vero细胞48小时后细胞中表达红色荧光蛋白的情况,100倍;图5d为去除红色荧光蛋白基因后的伪狂犬gd0304 tk、ge、部分gi三基因缺失株感染vero细胞72小时候后的细胞病变情况,200倍。
28.图6为pcr鉴定tk和ge基因凝胶电泳图。图6a为tk基因缺失后毒株在vero细胞上连续传代6次,6个代次病毒的tk基因和ge基因pcr检测结果,1~6:第1代~第6代病毒,pc:阳性对照(野毒基因组),m:dl2000 marker;图6b三基因缺失后毒株在vero细胞上连续传代6次,6个代次病毒的ge基因检测结果,1~6:第1代~第6代病毒,pc:阳性对照(野毒基因组),m:dl2000 marker。
29.图7为死亡小鼠及其剖检情况。图7a为死亡小鼠腹部抓绕痕迹;图7b为肝脏肿大;图7c为脾脏萎缩充血;图7d为肾脏点状出血;图7e为肺部充血;图7f为脑膜充血。
30.图8为各实验组攻毒后仔猪不同组织病理变化。其中图8a中攻毒毒株为gd0304株(106tcid
50
/ml),疫苗种类为三基因缺失灭活病毒 佐剂1;图8b中攻毒毒株为gd0304株(106tcid
50
/ml),疫苗种类为三基因缺失灭活病毒 佐剂2;图8c中攻毒毒株为gd0304株(106tcid
50
/ml),疫苗种类为商品化bartha株灭活疫苗;图8d为中攻毒毒株为gd0304株(106tcid
50
/ml),pbs处理;图8e中的仔猪不进行任何处理。
具体实施方式
31.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
32.实施例1猪伪狂犬病毒流行变异毒株(prv 0304株)的分离鉴定和毒力试验
33.技术路线如图1所示。
34.1、gd0304株伪狂犬病毒的来源
35.2017年4月,广东河源某猪场发生prv疑似疫情,采集濒死猪脑、脾、肺、肺门淋巴结等组织进行实验室检测,prv野毒核酸阳性,同时还在病料中检出猪圆环病毒2型核酸和猪繁殖与呼吸综合征核酸阳性;据调查,该猪场按照商品化prv疫苗(bartha k61株)免疫程序进行过免疫,检测prv gi抗体(idexx试剂盒)阳性率87.7%;综合各诊断指标推断,prv疫苗未能有效抵御该流行毒感染。流行病学调查发现,与该猪场密切接触的猪场普遍存在不同程度的prv发病案例。
36.2、伪狂犬病毒的分离鉴定及纯化
37.1)prv兔体回归
38.将组织匀浆上清注射新西兰大白兔,利用兔体感染除去或减少组织样本中潜在的其他病原。取prv阳性的脑组织处理液(离心、除菌、稀释10倍),于颈部皮下接种新西兰大白兔(0.5ml/只),实验兔16小时后出现神经症状,48h濒亡;对濒死兔实施安乐死,取脑组组,实时荧光pcr(qpcr)检测prv ge核酸强阳性(ct≤18),未检出猪繁殖与呼吸综合征病毒(prrsv)、猪瘟病毒(csfv)、猪圆环病毒2型(pcv2)和猪细小病毒(ppv)核酸。
39.2)prv分离纯化
40.利用易感细胞“蚀斑法”试验纯化prv,去除潜在的prv疫苗毒。将经兔体纯化的prv阳性组织接种vero细胞(ccl-81
tm
),做6轮“蚀斑法”试验,每次蚀斑均挑取位置单一,细胞病变形态典型且病变速度较快的蚀斑进行下一轮筛选,对最终轮挑取的10个病毒蚀斑重新接种vero细胞后,图2为gd0304株(p3)感染vero细胞cpe情况,分别为24和36小时感染后蚀斑;分别对收取病毒的gd和ge基因进行qpcr鉴定,选取病变速度最快,病毒含量最高的毒株,命名为prv 0304株;该病毒接种vero细胞后cpe出现较快、细胞病变形态典型,且细胞上清中病毒含量较高;浆病毒扩大培养,经超速离心纯化,电镜观察病毒颗粒呈球形,直径100-150nm,有囊膜,囊膜外有放射状纤突,为典型prv病毒形态(图3)。将超离纯化的病毒进行ngs二代测序,最终拼接得到132307bp病毒全长序列(ncbi序列号:mh582511)。并将猪伪狂犬病毒株送到保藏机构进行保藏,保藏于中国典型培养物保藏中心(武汉大学保藏中心,cctcc),命名为猪伪狂犬病毒prv gd0304,保藏号为:cctcc no:v201946,保藏时间为:2019.8.15。
41.在vero细胞上对prv 0304株连续传代至30代,参考《中华人民共和国兽药典》对10、20和30代病毒进行特异性和纯净性检验,病毒特异且无细菌、霉菌、支原体和外源病毒污染。
42.3)prv gd0304株滴度测定
43.应用reed-muench测定prv gd0304株在vero细胞上的病毒滴度(tcid50)为:p10代10-6.2
/ml,p20代10-6.57
/ml,p30代10-6.6
/ml。prv gd0304株低代次病毒在vero细胞上滴度略低,传代20次后稳定;相对于已报道其他prv流行毒株,prv gd0304株的tcid50较低,但对vero细胞感染速度更快,细胞病变情况更明显。与barth k61相比,在同等1 moi感染剂量下,gd0304株感染的细胞在接种后5h左右就能观察到明显的细胞病变,12h左右能观察到病毒蚀斑形成,24-36h左右就能导致感染细胞完全崩解脱落。prv gd0304株滴度显著低于过国内已报道prv流行株滴度(108~109tcid50/ml),但细胞病变速度更快,可能意味着病毒有更强的复制和感染能力。
44.4)prv gd0304株回归试验
45.经蚀斑纯化后的prv gd0304株p30代vero细胞培养上清以1
×
106tcid50/ml浓度滴鼻接种5头spf仔猪进行回归试验,接种仔猪在接种1天后开始出现体温升高的临床症状(41.4℃),4天后开始出现呼吸困难、狂躁、全身颤抖、划水运动等神经症状,并在第5天陆续全部死亡(100%死亡率),对照组正常。对死亡仔猪解剖后取脑、脾、肺、肺门淋巴结等组织对prv ge、gb、gc、gd和tk基因进行pcr检测并扩增测序,序列与gd0304株一致。回归试验说明gd0304株可以诱发易感动物出现伪狂犬症状,且毒株序列稳定。
46.5)prv gd0304保存期试验
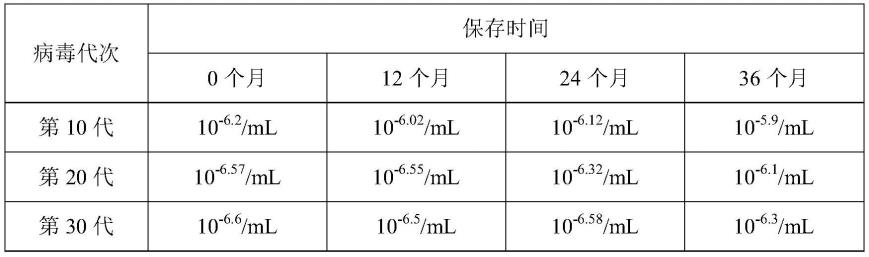
47.定期将-80℃保存的病毒(第10、20、30代)取出,接种无外源病毒感染的vero细胞。分别检测保存0、12、24、36个月后的prv病毒滴度。结果见表1,不同代次的prv gd0304病毒在-80℃保存36个月后,在vero细胞上的病毒滴度未出现明显变化,说明该毒株能稳定保存,符合疫苗毒株保存要求。
48.表1不同保存时间下3个代次病毒在vero细胞上的滴度(tcid
50
)
[0049][0050]
2、全基因组测序及主要毒力基因分析
[0051]
应用分离鉴定纯化获得的猪伪狂犬病病毒prv gd0304株dna经illumina平台测序后,进行数据组装,最终获得1条全基因组序列。结果显示prv gd0304基因组全长为142307bp,该序列长度与代表国内传统伪狂犬毒株ea株的142334bp较为接近,比代表国内伪狂犬变异株的js-2012株的145312bp短,gc含量为73.6%,共编码69个开放阅读框,其中含ir及tr两个重复序列区域。将gd0304全基因组与其他几个代表毒株,如代表国外疫苗株的bartha株,代表国内较早野毒株的ea株,和代表国内prv变异株的js-2012株的全基因组进行进化分析,分析结果如图4所示,其中gd0304株与ea株进化关系较近,与代表变异株的js-2012株相对较远。而保守基因gc和gb两个保守基因的进化树在整体结构上与全基因组进化树相似,均显示prv各毒株可以划分为两个明显的分支,以bartha株为代表的欧美株单独属于同一分支,包括prv gd0304株在内的中国株属于另一分支;而进一步对中国毒株的分析发现,在保守基因上,prv gd0304株与中国2012年以来分离的hb1201、hen1、js2012等流行毒株进化关系最近,在国内毒株中形成一个相对独立的分支,而代表国内经典流行毒株的ea株,fa株,sc株等则形成另外一个相对独立的分支,这与全基因组的分析结果有差异。以上序列分析结果表明gd0304株在基因组上更接近过去的国内流行毒株,如ea株,但在保守基因序列上却更接近国内新的流行变异株;这提示gd0304株可能与其他的国内流行prv变异株有不同的起源(部分研究显示国内prv变异株可能起源于bartha株,但gd0304株从基因组上来看与ea株关系更近),但在传播过程中流行毒株之间可能出现了基因重组。这一方面说明国内prv流行毒株的复杂性,gd0304株在研究国内流行毒株的起源和进化关系
上有十分重要的研究价值,另一方面也体现了本毒株在伪狂犬流行变异毒株中的独特性,以及作为疫苗候选毒株的潜力。
[0052]
3、病毒毒力试验
[0053]
3.1对小鼠的毒力
[0054]
3.1.1小鼠半数致死剂量
[0055]
将5-6周龄雌性balb/c小鼠50只,随机分成5组,10只/组。1-4组分别颈背部皮下注射0.1ml各含有102tcid50/ml,103tcid50/ml,104tcid50/ml,105tcid50/ml的prv gd0304株(实验组)vero细胞培养病毒液;第5组颈背部皮下注射0.1ml dmem培养基作为阴性对照组。攻毒后2周内连续观察记录小鼠的临床症状、死亡情况等,死亡小鼠及时剖检取组织,对prv gd和ge基因进行pcr检测,并固定部分组织用于病理切片。
[0056]
攻毒后第3-7天,105tcid50/ml组和104tcid50/ml组实验小鼠均出现不同程度的精神萎靡,食欲下降等临床症状,严重的还会出现不断抓绕接种部位,导致毛发脱落,皮肤出血,最终死亡。103tcid50/ml组在攻毒后第4天才开始出现精神萎靡,食欲下降等轻微临床症状,并有部分小鼠出现抓绕等神经症状并死亡。7天后上述各组存活小鼠基本恢复正常,无明显临床症状出现。阴性对照组小鼠在整个实验期均表现正常。经统计,小鼠死亡时间主要集中在攻毒后第3-7天。105、104、103、102tcid50/ml攻毒组小鼠死亡数量分别是10、9、5、1只;根据实验结果计算得出prv gd0304株对小鼠的ld50为:10
3.2
tcid50/ml,与中国经典强毒株sc株对小鼠的ld50(10
5.16
tcid50/ml)相比,本毒株对小鼠的毒力明显增强。
[0057]
3.1.2小鼠交叉免疫保护试验
[0058]
40只6-8周龄雌性balb/c小鼠,随机分为4组,每组10只,颈背部皮下接种免疫。第1组每只免疫0.1ml含104tcid50的bartha-k61株甲醛灭活病毒,第2组每只免疫含104tcid50的gd0304株甲醛灭活病毒,第3、4组每只小鼠接种0.1ml的dmem培养基分别作为阴性对照组和空白对照组;每隔一周使用相同的剂量和方法加强免疫一次,3次免疫后,第1、2、3组分别使用10ld50的gd0304株vero细胞培养活病毒颈背部皮下攻毒,连续14天观察小鼠临床症状和死亡情况。第3组小鼠在攻毒后第3天开始出现pr症状,发病鼠出现抓绕现象,导致局部被毛脱落,皮肤出血,并在4-7天内全部出现严重pr症状并陆续死亡,存活率为0%;第1组小鼠在攻毒第4天开始出现pr症状,并在5-8天陆续出现死亡,最终存活率20%;第2组小鼠在第4天部分出现pr症状,在5-7天出现少量死亡,最终存活率50%;第4组小鼠在观察期无明显症状。
[0059]
3.2对猪的毒力
[0060]
3.2.1仔猪半数致死剂量
[0061]
将20头15日龄健康仔猪随机分成5组,每组5头,第1-3组分别通过滴鼻接种2ml 106tcid50/ml,105tcid50/ml,104tcid50/ml和103tcid50/ml的prv gd0304株vero细胞培养病毒液,第5组滴鼻接种2ml dmem培养基作为阴性对照组。隔离饲养,自由采食,连续观察14天,记录体温、临床症状;并对死亡猪及时进行剖检,取组织对prv gd和ge基因进行pcr检测,固定部分组织用于病理切片。攻毒后第2天,106tcid50/ml组仔猪即出现明显体温升高,第3天达到最高,其平均体温为:41.4℃。
[0062]
四个攻毒试验组仔猪在攻毒后均出现不同程度的体温升高,食欲减退,呼吸急促,嗜睡等临床症状;106tcid50/ml组仔猪在攻毒后第4天出现呼吸困难,呈犬坐姿势,随后出
现狂躁,不断用头撞柱栏现象,后期出现全身颤抖,倒地划水等严重临床症状,第5天全部死亡,致死率为100%。105tcid50/ml组,104tcid50/ml组和103tcid50/ml组在攻毒后第4天也陆续出现相似的临床症状,第5天开始出现死亡,最终在攻毒后14天,105tcid50/ml组全部死亡,104tcid50/ml组剩余一头,103tcid50/ml组剩余4头仔猪未死亡。阴性对照组在整个实验期内均表现正常。计算得到prv gd0304株对仔猪的半数致死量为:10
3.2
tcid50/ml。
[0063]
剖检攻毒试验组死亡及耐过仔猪发现攻毒组仔猪脑组织有出血,水肿现象,脑脊液增多;肺脏水肿,出现实质性肉样病变;肺门淋巴结肿大,出现白色点状病变;脾脏充血,边缘有梗死灶;肾脏表面可见弥散分布的针尖大小的点状出血;腹股沟淋巴结肿大,充血。阴性对照组仔猪各组织脏器未见显著病理变化。
[0064]
对死亡仔猪脑部组织进行pcr检测,prv ge和gd基因均呈阳性,扩增片段测序结果与gd0304株一致。对各病变脏器采用荧光pcr方法,以构建的pmd18-gd重组质粒作为标准质粒,梯度稀释后绘制标准曲线并计算各组织中的病毒拷贝数,计算结果显示死亡仔猪的脑中病毒含量最高,可达3.2x105copies/g。
[0065]
3.2.2猪免疫血清中和能力比较试验
[0066]
随机选取10份bartha-k61免疫后,经idexx试剂盒检测gb抗体阳性,ge抗体阴性的猪血清,分别测试免疫血清对bartha-k61株、gd0304株以及其他几株广东广西地区分离的野毒中和能力。
[0067]
结果显示,bartha-k61免疫血清对bartha-k61株的平均中和抗体滴度为1:57;而对gd0304株的中和抗体滴度最高能达到1:13,平均为1:18,二者有显著差异(p<0.01);其他几株野毒的平均中和抗体滴度在1:20-1:40之间。这个试验结果也说明bartha-k61免疫血清对gd0304株以及其他几个野毒株的中和能力有所下降,这也解释了免疫过bartha-k61的猪场依然会发生伪狂犬病的原因。
[0068]
在小鼠和仔猪上的毒力试验表明,本发明中新分离鉴定的prv gd0304株在毒力上要远强于经典的prv标准强毒株(sc株ld50:10
5.16
tcid50/ml),说明prv野毒在国内流行过程中毒力发生了比较明显的变化,也解释了bartha-k61疫苗免疫保护不完全的原因,同时说明我们分离的gd0304株在作为针对现在国内prv流行毒株的候选疫苗株上的潜力。
[0069]
实施例2三基因缺失毒株的构建
[0070]
1、目的及技术路线:
[0071]
目前伪狂犬疫苗中使用最广泛的bartha-k61株为自然缺失ge和部分gi基因,其他疫苗毒株多为人工缺失ge和gi基因,部分疫苗毒株为了提高安全性还会额外缺失tk基因。在三个经常缺失的基因中,tk基因,即编码病毒胸苷激酶的基因,主要参与核苷酸的补救合成途径以维持并促进病毒复制,是伪狂犬病毒的主要毒力基因之一,与病毒潜伏感染及在中枢神经系统中的增殖相关,tk基因的缺失,可以使伪狂犬病毒对神经细胞的侵染力及猪的毒力明显降低,但免疫源性不受影响;ge和gi基因是编码病毒囊膜蛋白的基因之一,是也是伪狂犬病毒的主要毒力基因之一,与病毒在神经细胞中的组装和运输相关,缺失ge和gi基因以后病毒毒力大幅下降,免疫源性不受影响。
[0072]
因gd0304株在流行地域、毒力和基因进化上的特殊性,有作为优良的疫苗候选株的潜力。为了测试本毒株作为疫苗株的免疫性能和安全性,选用人工同源重组的方法构建了gd0304株的tk/ge/gi三基因缺失毒株。其中tk基因和ge基因为完全缺失,gi基因为模仿
bartha-k61株缺失基因前半部分。
[0073]
本实施例先使用表2中的同源臂扩增引物,分别扩增gd0304株tk基因和ge、gi基因上下游同源序列,再分别酶切连入带绿色荧光蛋白(tk基因重组质粒)和红色荧光蛋白(ge、gi基因重组质粒)的表达载体,构建出含各基因两侧同源臂并带有荧光蛋白筛选标记的重组质粒。利用带绿色荧光蛋白及tk基因两侧同源臂的重组质粒筛选出了带绿色荧光标记的tk基因缺失gd0304株,然后再利用不含荧光蛋白,只带有两侧同源臂的重组质粒去除插入的绿色荧光片段;下一步再在gd0304 tk基因缺失株的基础上,利用含红色荧光蛋白和ge及部分gi基因两侧同源臂的重组质粒筛选出带红色荧光的tk基因和ge、部分gi基因缺失的gd0304三基因缺失毒株,最后再利用不含荧光蛋白,只带有两侧同源臂的重组质粒去除其中插入的红色荧光基因片段,最终再通过3次蚀斑纯化,得到一株不含荧光标记的三基因缺失毒株,申请人称其为为伪狂犬gd0304 tk-ge-gi-株。荧光筛选结果如图5所示,最终筛选得到的毒株,经pcr及测序鉴定,全部的tk、ge基因和部分gi基因已经完全缺失,未检出野毒株污染。
[0074]
表2伪狂犬gd0304株tk及ge、gi两侧同源臂扩增引物
[0075][0076]
注:序列下划线部分为酶切位点。
[0077]
2、基因缺失毒株鉴定
[0078]
2.1pcr缺失基因鉴定
[0079]
通过tk、ge特异性基因检测引物扩增构建的三基因缺失毒株,tk和ge基因均完全无扩增,说明ge和tk基因已成功缺失,如图6。使用tk和ge、gi基因的外侧引物扩增缺失株缺失位点片段,并通过测序确认,目标基因缺失位点与设计缺失位点一致。
[0080]
2.2缺失毒株细胞生长性能鉴定
[0081]
在vero细胞上测定三基因缺失毒株的tcid50结果为10-6.29
/ml,与原野毒株的tcid50=10-6.2
/ml几乎无差异。但在细胞病变速度上,三基因缺失毒株比起野毒株相对较慢,在tcid50测定中,高稀释度下三基因缺失毒株在vero细胞上出现明显cpe的时间比野毒株晚8-12小时,且病变后的细胞形态也有差异,野毒株在vero细胞上的cpe在初期会呈现大量细胞融合现象,而三基因缺失毒株融合相对较少,从而呈现明显的细胞圆缩现象,如图5中的图5a和图5d所示,三基因缺失毒株隐去的细胞cpe形态与自然缺失ge和gi基因的bartha k61毒株类似,从侧面反映出ge和gi基因已经成功缺失。从以上病毒在细胞上的生
长特性来看,三个基因缺失以后,毒株的tcid50几乎不受影响,说明这几个基因缺失并未影响病毒在细胞上的复制,基本满足了疫苗生产的条件,而从细胞出现cpe的时间和cpe形态上来看,基因缺失后毒株对细胞的毒力有变弱的迹象,这点也与bartha k61毒株比较相似;在细胞培养层面表明本发明构建的三基因缺失毒株有作为疫苗毒株的潜力。
[0082]
2.3细胞传代稳定性
[0083]
构建的三基因缺失毒株在vero细胞上盲传30代以后,测定病毒的tcid50,并通过pcr扩增ge和tk基因,鉴定缺失毒株的稳定性。
[0084]
在盲传30代以后,三基因缺失毒株的tcid50为10-6.67
/ml,与初始代次相比稍有增加,可能是毒株适应细胞所致。pcr鉴定无tk和ge基因,证明缺失毒株在vero细胞上能稳定传代,无基因重组,且毒株纯净,无野毒污染。
[0085]
将三基因缺失毒株伪狂犬gd0304 tk-ge-gi-株送至中国典型培养物保藏中心(武汉大学保藏中心,cctcc)进行保藏,命名为猪伪狂犬病毒prv gd0304 ge-gi-tk-,保藏号为:cctcc no:v201955,保藏时间为:2019.8.15。
[0086]
2.4耐药性测试
[0087]
在gd0304野毒株的分离阶段发现该毒株有对常规的抗疱疹病毒药物阿昔洛韦(acyclovir)和更昔洛韦(ganciclovir)有严重的耐药性,而这两种药物的作用机理与病毒tk基因表达的胸腺激酶相关。因此,在三基因缺失完成后,又对缺失毒株的耐药性进行了测试。测试方法为在相同的1moi感染系数下,分别将gd0304野毒株、gd0304 tk-ge-gi-株和bartha k61毒株接种到vero细胞中,然后在细胞上清中加入梯度稀释的抗病毒药物至终浓度在0-200mg/ml之间,通过观察细胞cpe情况,评价毒株的耐药性,结果见表3。
[0088]
表3不同毒株对抗疱疹病毒药物的敏感性
[0089][0090][0091]
注:“ ”表示细胞出现cpe,
“‑”
代表细胞无cpe。
[0092]
从测试结果来看,在200mg/ml的最高浓度下,gd0304野毒株和其三基因缺失毒株均能出现明显的cpe,且出现时间和cpe形态与未加药物的对照组无明显的差异,而作为对比的bartha k61组在2mg/ml的药物浓度下,病毒在细胞上的生长就受到了完全抑制,在缺失tk基因后,三基因缺失毒株依然出现了和野毒株一样对阿昔洛韦和更昔洛韦的强烈耐药性,说明该毒株产生耐药性的机理与tk基因无关,其耐药机制有待进一步研究。这反应了gd0304毒株在疱疹病毒耐药机制研究中的价值,同时说明本三基因缺失毒株作为疫苗株,对流行的耐药毒株也可能会起到一定的保护作用。
[0093]
2.5小鼠安全性试验
[0094]
分别以10-6.67
/ml tcid50的三基因缺失病毒培养液、10ld50的gd0304野毒株、以及细胞培养液对照组,以100μl剂量滴鼻攻毒6周龄小鼠,7天后,野毒组小鼠全部死亡,对照组和三基因缺失组小鼠全部存活,说明基因缺失后,病毒毒力降低,在小鼠上有较高的安全性。
[0095]
2.6小鼠免疫攻毒试验
[0096]
为了验证三基因缺失毒株作为疫苗的保护作用,在小鼠上设计了免疫攻毒试验。免疫方案为如表4所示,三基因缺失灭活病毒与活病毒上清的免疫剂量均为104tcid
50
/只,商品化疫苗组按照说明书进行稀释后,每只小鼠免疫剂量大于104tcid
50
。其中病毒灭活方法为终浓度0.2%的甲醛,灭活24h,并通过接毒vero细胞验证灭活完全;佐剂1为seppic公司的montanide
tm gel 01pr佐剂,将灭活病毒上清稀释至所需浓度后,按照佐剂说明书进行配制(病毒上清稀释液:佐剂=9:1);佐剂2为seppic公司的montanide
tm isa201vg佐剂,将灭活病毒上清稀释至所需浓度后,按照说明书进行配制(病毒上清稀释液:佐剂=1:1);活病毒上清实验组为vero细胞培养病毒上清以dmem培养基稀释至所需免疫剂量以后直接用于免疫;以商品化bartha k61活毒疫苗(四川海林格生物制药有限公司,伪狂犬病活疫苗(bartha-k61株),按照使用说明书进行稀释使用)作为对照实验组,vero细胞培养上清作为空白对照组,以腹部皮下注射的方式进行3次免疫。免疫完成后,部分小鼠进行野毒株攻毒试验,攻毒方案如表5所示,剩余小鼠采血进行病毒中和试验。
[0097]
表4三基因缺失疫苗免疫分组表
[0098][0099][0100]
表5攻毒方式及剂量
[0101][0102]
攻毒后,连续7天观察小鼠死亡情况,死亡小鼠及时进行剖检,并取脑、肝、脾、肺、肾等组织器官,提取核酸后使用实时荧光pcr方法检测病毒gd基因和ge基因在各组织中的分布情况。攻毒后的小鼠死亡情况如表6所示,死亡小鼠剖检情况如图7所示,死亡小鼠各脏
ge-gi-株制备的灭活疫苗针对野毒gd0304有较高的中和效价,不过本次试验中活病毒免疫组可能因为缺乏佐剂刺激免疫,血清中和效价较低。
[0111]
2.7仔猪免疫攻毒试验
[0112]
为了测试本发明中的三基因缺失毒株作为疫苗候选毒株的性能,在小鼠试验的基础上,设计了仔猪免疫攻毒试验,三基因缺失灭活疫苗制备方法同小鼠免疫攻毒试验b1、b2组,商品化灭活疫苗(海博莱,猪伪狂犬病灭活疫苗(bartha k61株))按疫苗说明书进行免疫,试验分组及设计见表9,因试验条件限制,本次免疫攻毒试验未设置活毒组。
[0113]
表9仔猪免疫攻毒试验分组
[0114][0115][0116]
攻毒前采血用于血清中和效价检测,各实验组血清针对gd0304株的中和效价见表10。攻毒后14天内观察实验猪的临床症状,包括发热,行动和采食变化,死亡率等,结果如表11所示,14天后剖杀剩余猪只,观察各器官病变情况,各器官病变情况见图8。可以看出除对照组d组各猪伪狂犬病主要靶器官有较为明显的充血病变外,其余各实验组均未观察到明显的器官病变。
[0117]
表10不同疫苗组仔猪血清对prv gd0304野毒株的中和效价
[0118]
分组疫苗种类免疫剂量/ml免疫次数中和效价a三基因缺失灭活病毒 佐剂12229.9b三基因缺失灭活病毒 佐剂22225.8c商品化bartha株灭活疫苗2211.2dpbs22<2
[0119]
表11猪伪狂犬灭活疫苗免疫效果的对比
[0120][0121]
注:此处保护率为针对仔猪出现典型猪伪狂犬病临床症状的保护率。
[0122]
从以上仔猪免疫攻毒试验结果可以看出,以本发明中的三基因缺失毒株制备的灭活疫苗能刺激仔猪产生更高的针对野毒株的血清中和抗体,在攻毒实验中也能产生较好的攻毒保护作用,不仅可以保护仔猪免于死亡,也能有效避免仔猪出现伪狂犬病的临床症状。剖检结果也证明疫苗组可以保护仔猪各主要器官免受病毒攻击。同时从商品化bartha株疫苗组的攻毒结果也可以看出,经典的bartha k61毒株对变异毒株的保护效果已经有所减弱,商品化疫苗组中的2头仔猪出现了体温升高、呼吸急促等明显的伪狂犬病临床症状,虽然最后并未导致该猪只死亡,但在实际养殖过程中必然导致猪只生产性能降低,若受到应激或其他疫病共同感染可能会加剧病症反应,增加死亡风险。
[0123]
2.8免疫攻毒试验总结
[0124]
从小鼠和仔猪的免疫攻毒试验都可以看出,以本发明中的三基因缺失伪狂犬变异毒株制备的灭活或者活病毒疫苗,相比于经典的bartha k61毒株,针对变异毒株均有较好的攻毒保护效果,可以有效降低发病率和死亡率,血清中和效价也更高。本三基因缺失毒株在针对伪狂犬变异毒株的防控上有较高的应用和商业价值,可以作为优秀的伪狂犬疫苗候选毒株。
[0125]
上述具体实施方式对本发明作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。