1.本发明涉及以基因组编辑技术为主的农业生物技术领域和作物遗传育种领域,具体涉及一种植物母本单倍体诱导系的制备方法及其应用,特别涉及一种利用基因编辑技术得到的孤雌生殖单倍体诱导基因dmp突变体作为植物单倍体诱导系在诱导植物产生母本单倍体中的应用。
背景技术:
2.大田作物生产是维持人类生存的重要物质基础,在植物学上可以分为单子叶作物和双子叶作物两大类,单子叶作物主要包括水稻、小麦和玉米等,双子叶主要包括大豆、油菜、棉花及番茄、黄瓜等作物。无论是对于单子叶作物还是双子叶作物,纯系创制均是其育种过程的关键环节。单倍体育种技术可加速纯系选育进程,且与基因编辑技术结合可实现对自交系的快速定向改良,能够极大地提高育种效率,是作物育种中的共性关键技术。目前,单倍体育种技术已在玉米育种中得到了大规模应用,且控制玉米单倍体诱导的关键基因已被克隆,这为以杂交诱导为基础的单倍体育种技术体系在其他作物中的构建提供了可鉴路径。目前,磷脂酶基因zmpla1已在水稻、小麦上成功获得了单倍体。但该基因仅在单子叶作物中具有较高保守性,由此在双子叶作物上的应用存在一定限制。
3.目前,在双子叶作物上单倍体的产生主要依靠的还是花药离体培养,效率低下且对材料的基因型依赖性较高,很难实现规模化的应用。虽然将遗传修饰的着丝粒特异组蛋白cenh3导入拟南芥cenh3突变体中可诱导单倍体的产生,但该方式在诱导过程中产生大量的整倍体,这在一定程度上限制了该方法在育种中的应用。
技术实现要素:
4.本发明首先提供了b1)或b2)或b3)或b4)所示的蛋白质的新用途;
5.b1)氨基酸序列是序列2或序列4或序列6或序列8或序列10或序列12或序列14或序列16或序列18或序列20或序列22或序列24或序列26或序列28或序列30或序列32或序列34或序列36或序列38或序列40或序列42或序列44或序列46或序列48或序列50或序列52或序列54或序列56或序列58或序列60或序列62或序列64或序列66或序列68或序列70所示的蛋白质;
6.b2)在序列2或序列4或序列6或序列8或序列10或序列12或序列14或序列16或序列18或序列20或序列22或序列24或序列26或序列28或序列30或序列32或序列34或序列36或序列38或序列40或序列42或序列44或序列46或序列48或序列50或序列52或序列54或序列56或序列58或序列60或序列62或序列64或序列66或序列68或序列70所示的蛋白质的n端和/或c端连接标签得到的融合蛋白质;
7.b3)将序列2或序列4或序列6或序列8或序列10或序列12或序列14或序列16或序列18或序列20或序列22或序列24或序列26或序列28或序列30或序列32或序列34或序列36或序列38或序列40或序列42或序列44或序列46或序列48或序列50或序列52或序列54或序列
56或序列58或序列60或序列62或序列64或序列66或序列68或序列70所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质;
8.b4)与序列2或序列4或序列6或序列8或序列10或序列12或序列14或序列16或序列18或序列20或序列22或序列24或序列26或序列28或序列30或序列32或序列34或序列36或序列38或序列40或序列42或序列44或序列46或序列48或序列50或序列52或序列54或序列56或序列58或序列60或序列62或序列64或序列66或序列68或序列70所示的氨基酸序列具有75%或75%以上同源性且具有相同功能的蛋白质。
9.本发明提供了b1)或b2)或b3)或b4)所示的蛋白质在调控植物单倍体诱导能力或果实数目中的应用。
10.所述调控植物单倍体诱导能力体现为:当植物中的上述蛋白质活性被抑制时,所述植物变成植物单倍体诱导系,当植物中的上述蛋白质被表达或活性提高时,所述植物单倍体诱导能力降低或缺失。所述蛋白质活性被抑制为不表达该蛋白质或该蛋白质没有活性。所述植物单倍体诱导能力降低或缺失具体体现为所述植物果实(如角果)数目增加。
11.所述调控植物果实数目体现为:当植物中的上述蛋白质活性被抑制时,所述植物果实(如角果)数目减少,当植物中的上述蛋白质被表达或活性提高时,所述植物果实(如角果)数目增加。所述蛋白质活性被抑制为不表达该蛋白质或该蛋白质没有活性。
12.上述b2)中,所述标签是指利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和/或纯化。所述蛋白标签可为flag标签、his标签、mbp标签、ha标签、myc标签、gst标签和/或sumo标签等。
13.上述b3)中,所述一个或几个氨基酸残基的取代和/或缺失和/或添加为不超过10个氨基酸残基的取代和/或缺失和/或添加。
14.上述b4)中,所述75%或75%以上同源性,可为80%以上或85%以上或90%以上或91%以上或92%以上或93%以上或94%以上或95%以上或96%以上或97%以上或98%以上或99%以上的同源性。
15.本发明又提供了与上述蛋白质相关的生物材料的新用途;
16.所述生物材料为下述a1)至a12)中的任一种:
17.a1)编码上述蛋白质的核酸分子;
18.a2)含有a1)所述核酸分子的表达盒;
19.a3)含有a1)所述核酸分子的重组载体;
20.a4)含有a2)所述表达盒的重组载体;
21.a5)含有a1)所述核酸分子的重组微生物;
22.a6)含有a2)所述表达盒的重组微生物;
23.a7)含有a3)所述重组载体的重组微生物;
24.a8)含有a4)所述重组载体的重组微生物;
25.a9)含有a1)所述核酸分子的转基因植物细胞系;
26.a10)含有a2)所述表达盒的转基因植物细胞系;
27.a11)含有a3)所述重组载体的转基因植物细胞系;
28.a12)含有a4)所述重组载体的转基因植物细胞系。
29.本发明提供了与上述蛋白质相关的生物材料在调控植物单倍体诱导能力或果实
数目中的应用。
30.上述a1)中,所述核酸分子为如下c1)或c2)或c3)或c4)所示的基因:
31.c1)序列1或序列3或序列5或序列7或序列9或序列11或序列13或序列15或序列17或序列19或序列21或序列23或序列25或序列27或序列29或序列31或序列33或序列35或序列37或序列39或序列41或序列43或序列45或序列47或序列49或序列51或序列53或序列55或序列57或序列59或序列61或序列63或序列65或序列67第33-767位或序列69第32-434位所示的cdna分子或基因组dna分子;
32.c2)与c1)限定的核苷酸序列具有70%或70%以上同一性的cdna分子或基因组dna分子;
33.c3)来源于双子叶植物且与c1)限定的核苷酸序列具有70%或70%以上同一性的cdna分子或基因组dna分子;
34.c4)在严格条件下与c1)或c2)或c3)限定的核苷酸序列杂交的cdna分子或基因组dna分子。
35.上述基因具有如下功能:当植物中的上述基因被抑制或敲除时,所述植物变成植物单倍体诱导系;当植物中的上述基因被表达时,所述植物的单倍体诱导能力下降,果实数目增加。所述抑制为完全抑制。
36.这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码序列2或序列4或序列6或序列8或序列10或序列12或序列14或序列16或序列18或序列20或序列22或序列24或序列26或序列28或序列30或序列32或序列34或序列36或序列38或序列40或序列42或序列44或序列46或序列48或序列50或序列52或序列54或序列56或序列58或序列60或序列62或序列64或序列66或序列68或序列70所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
37.本发明还提供了m1或m2所示的物质的新用途:
38.m1、抑制植物中上述蛋白质活性的物质;
39.m2、抑制植物中编码上述蛋白质的基因表达的物质或敲除植物中编码上述蛋白质的基因的物质。
40.本发明提供了m1或m2所示的物质在培育植物单倍体诱导系或培育植物单倍体或提高植物单倍体诱导能力中的应用。
41.上述应用中,所述抑制植物中上述蛋白质活性的物质可为任何能够使植物中上述蛋白质活性缺失的物质,如抑制上述蛋白质合成或促进上述蛋白质降解或抑制上述蛋白质功能的蛋白质、多肽或小分子化合物(如蛋白活性抑制剂);
42.所述抑制植物中编码上述蛋白质的基因表达的物质可为任何能够使植物中编码上述蛋白质的基因无法表达的物质,如沉默植物中编码上述蛋白质的基因的物质(如mirna、sirna、dsrna、shrna等);
43.所述敲除意味着携带敲除物质的宿主细胞不产生该基因的功能性蛋白质产物,敲除物质可以是以任何方式实现宿主细胞不产生该基因的功能性蛋白质产物的物质,具体方式如去除全部或部分编码基因序列、引入移码突变使得不产生功能性蛋白质、去除或改变
调节组分(例如启动子编辑)使得编码基因序列不被转录、通过与mrna的结合阻止翻译等。通常,敲除在基因组dna水平上进行,使得细胞的后代也永久地携带敲除。进一步的,所述敲除植物中编码上述蛋白质的基因的物质可为任何能够使植物中编码上述蛋白质的基因发生突变(所述突变形式可为缺失突变和/或插入突变和/或碱基替换)从而失去活性的物质,如锌指蛋白zfn基因编辑系统或talens基因编辑系统或crispr/cas9基因编辑系统等。更进一步的,所述敲除植物中编码上述蛋白质的基因的物质为crispr/cas9基因编辑系统。
44.本发明还提供了一种植物单倍体诱导系的制备方法。
45.本发明提供的植物单倍体诱导系的制备方法为如下d1)或d2):
46.d1)抑制受体植物中上述蛋白质的活性,得到植物单倍体诱导系;
47.d2)抑制受体植物中编码上述蛋白质的基因的表达或敲除受体植物中编码上述蛋白质的基因,得到植物单倍体诱导系。
48.本发明还提供了一种植物单倍体诱导系的制备方法。
49.本发明提供的植物单倍体诱导系的制备方法包括将按照上述植物单倍体诱导系制备方法制备得到的植物单倍体诱导系进行自交的步骤。
50.本发明还提供了一种提高植物单倍体诱导能力的方法。
51.本发明提供的提高植物单倍体诱导能力的方法包括如下步骤:抑制受体植物中上述蛋白质的活性,或抑制受体植物中编码上述蛋白质的基因的表达,或敲除受体植物中编码上述蛋白质的基因,得到植物单倍体诱导系;所述植物单倍体诱导系的单倍体诱导能力高于所述受体植物。
52.上述植物单倍体诱导系的制备方法中,所述自交的次数至少为一次,具体可为一次。
53.上述植物单倍体诱导系的制备方法还包括筛选纯合突变体的步骤。所述纯合突变体为编码上述蛋白质的基因的两条同源染色体发生了相同突变的植物个体。
54.进一步的,当所述受体植物为油菜时,所述基因为bndmp1a基因和/或bndmp2a基因和/或bndmp1c基因和/或bndmp2c基因;所述方法为抑制油菜中bndmp1a基因和/或bndmp2a基因和/或bndmp1c基因和/或bndmp2c基因的表达或敲除油菜中bndmp1a基因和/或bndmp2a基因和/或bndmp1c基因和/或bndmp2c基因,得到转基因油菜,即为油菜单倍体诱导系;
55.当所述受体植物为烟草时,所述基因为ntdmp1基因和/或ntdmp2基因和/或ntdmp3基因;所述方法为抑制烟草中ntdmp1基因和/或ntdmp2基因和/或ntdmp3基因的表达或敲除烟草中ntdmp1基因和/或ntdmp2基因和/或ntdmp3基因,得到转基因烟草,即为烟草单倍体诱导系;
56.当所述受体植物为棉花时,所述基因为ghdmp1基因和/或ghdmp2基因;所述方法为抑制棉花中ghdmp1基因和/或ghdmp2基因的表达或敲除棉花中ghdmp1基因和/或ghdmp2基因,得到转基因棉花,即为棉花单倍体诱导系。
57.当所述受体植物为大豆时,所述基因为gmdmp1基因和/或gmdmp2基因;所述方法为抑制大豆中gmdmp1基因和/或gmdmp2基因的表达或敲除大豆中gmdmp1基因和/或gmdmp2基因,得到转基因大豆,即为大豆单倍体诱导系。
58.更进一步的,所述敲除受体植物中编码上述蛋白质的基因的方式均为crispr/cas9。
59.所述敲除受体植物中编码上述蛋白质的基因的方法包括如下步骤:将含有靶序列的crispr/cas9载体导入受体植物中,得到转基因植物。所述靶序列靶向受体植物中的靶基因。
60.所述编码上述蛋白质的基因为序列1或序列3或序列5或序列7或序列9或序列11或序列13或序列15或序列17或序列19或序列21或序列23或序列25或序列27或序列29或序列31或序列33或序列35或序列37或序列39或序列41或序列43或序列45或序列47或序列49或序列51或序列53或序列55或序列57或序列59或序列61或序列63或序列65或序列67第33-767位或序列69第32-434位所示的dna分子。
61.在本发明的一个具体实施例中,当所述受体植物为油菜时,所述crispr/cas9的靶序列为序列67第26-45位、序列63第4-23位、序列67第56-75位和序列63第159-178位。所述含有靶序列的crispr/cas9载体具体为将序列71所示的dna分子插入pdirect-22c载体后得到的载体。所述植物单倍体诱导系具体可为bndmp基因突变纯合型株系bndmp-1或bndmp基因突变纯合型株系bndmp-2。所述bndmp基因突变纯合型株系bndmp-1与野生型油菜westar的基因组dna的差异仅在于在编码bndmp1a的基因的两条同源染色体上均发生了碱基g的插入,该碱基g插入位置位于序列63第162-163位之间,且在编码bndmp2a的基因的两条同源染色体上均发生了碱基g和碱基a的插入,该插入碱基g位于序列67第42-43位之间,该插入碱基a位于序列67第72-73位之间,且在编码bndmp2c的基因的两条同源染色体上均发生了碱基a的插入,该插入碱基a位于序列69第42-43位之间和序列69第72-73位之间。所述bndmp基因突变纯合型株系bndmp-2与野生型油菜westar的基因组dna的差异仅在于在编码bndmp1a的基因的两条同源染色体上均发生了碱基g的插入,该碱基g插入位置位于序列63第162-163位之间,且在编码bndmp2a的基因的两条同源染色体上均发生了碱基替换和碱基t的插入,该碱基替换为将序列67第43-53位所示的dna分子替换为如下序列:tataaca,该碱基t插入位置位于序列67第72-73位之间,且在编码bndmp2c的基因的两条同源染色体上均发生了碱基a的插入,该插入碱基a位于序列69第42-43位之间和序列69第72-73位之间。
62.在本发明的另一个具体实施例中,当所述受体植物为烟草时,所述crispr/cas9的靶序列为序列59第111-130位、序列59第278-297位、序列57第88-107位和序列57第383-402位。所述含有靶序列的crispr/cas9载体具体为将序列72所示的dna分子插入pdirect-22c载体后得到的载体。所述植物单倍体诱导系具体可为ntdmp基因突变纯合型株系ntdmp-1或ntdmp基因突变纯合型株系ntdmp-2。所述ntdmp基因突变纯合型株系ntdmp-1与野生型烟草k326的基因组dna的差异仅在于在编码ntdmp1的基因的两条同源染色体上均发生了碱基g缺失和片段缺失,该缺失碱基g位于序列57第91位,该缺失片段位于序列57第115-399位,且在编码ntdmp2的基因的两条同源染色体上均发生了片段缺失,该缺失片段位于序列59第116-281位,且在编码ntdmp3的基因的两条同源染色体上均发生了碱基g缺失和片段缺失,该缺失碱基g位于序列61第91位,该缺失片段位于序列61第115-399位。所述ntdmp基因突变纯合型株系ntdmp-2与野生型烟草k326的基因组dna的差异仅在于在编码ntdmp1的基因的两条同源染色体上均发生了碱基g缺失和碱基a缺失,该缺失碱基g位于序列57第91位,该缺失碱基a位于序列57第114位,且在编码ntdmp2的基因的两条同源染色体上均发生了碱基替换,该碱基替换为将序列59第111-280位所示的dna分子替换为碱基t,且在编码ntdmp3的基因的两条同源染色体上均发生了碱基a插入,该插入碱基a位于序列61第400-401位之间。
63.在本发明的再一个具体实施例中,当所述受体植物为棉花时,所述crispr/cas9的靶序列为序列53、55的第42-61位、序列53、55的第79-98位、序列53、55的第316-335位和序列53第326-345位。所述含有靶序列的crispr/cas9载体具体为将序列73所示的dna分子插入pdirect-22c载体后得到的载体。所述植物单倍体诱导系具体可为ghdmp基因突变纯合型株系ghdmp-1或ghdmp基因突变纯合型株系ghdmp-2。所述ghdmp基因突变纯合型株系ghdmp-1与野生型华棉1号的基因组dna的差异仅在于在编码ghdmp1的基因的两条同源染色体上均发生了碱基c缺失,该缺失碱基c位于序列53第342位,且在编码ghdmp2的基因的两条同源染色体上均发生了片段缺失,该缺失片段位于序列55第54-58位。所述ghdmp基因突变纯合型株系ghdmp-2与野生型华棉1号的基因组dna的差异仅在于在编码ghdmp1的基因的两条同源染色体上均发生了碱基替换和片段缺失,该碱基替换为将序列53第345位碱基t替换成碱基a,该缺失片段位于序列53第358-359位,且在编码ghdmp2的基因的两条同源染色体上均发生了片段缺失,该缺失片段位于序列55第59-83位。
64.在本发明的最后一个具体实施例中,当所述受体植物为大豆时,所述crispr/cas9的靶序列为序列43第96-115位、序列43第112-131位(序列45第112-131位)、序列45第168-187位、序列43第350-369位(序列45第350-369位)。所述含有靶序列的crispr/cas9载体的核苷酸序列具体如序列表中序列74所示。所述植物单倍体诱导系具体可为gmdmp基因突变纯合型株系gmdmp-1或gmdmp基因突变纯合型株系gmdmp-2。所述gmdmp基因突变纯合型株系gmdmp-1与野生型大豆威廉姆斯82的基因组dna的差异仅在于在编码gmdmp1的基因的两条同源染色体上均发生了226bp片段缺失和2个碱基缺失,缺失片段和缺失碱基分别位于序列43第85-310位和第367-368位,且在编码gmdmp2的基因的两条同源染色体上均发生了192bp片段缺失,该缺失片段位于序列45第175-366位。所述gmdmp基因突变纯合型株系gmdmp-2与野生型威廉姆斯82的基因组dna的差异仅在于在编码gmdmp1的基因的两条同源染色体上均发生了267bp片段缺失,该缺失片段位于序列43第101-367位,且在编码gmdmp2的基因的两条同源染色体上均发生了195bp片段缺失,该缺失片段位于序列45第171-365位。
65.本发明还提供了一种植物单倍体的制备方法。
66.本发明提供的植物单倍体的制备方法包括如下步骤:将按照上述植物单倍体诱导系的制备方法制备的植物单倍体诱导系或其后代进行自交或者作为父本与其他植物材料进行杂交,得到自交后代或杂交后代,即为所述植物单倍体。
67.进一步的,上述植物单倍体的制备方法还包括如下步骤:将所述自交后代或所述杂交后代单株进行荧光标记鉴定和/或单倍体性状鉴定和/或叶片倍性鉴定和/或分子标记鉴定,选取至少一种方法鉴定为单倍体的后代单株为植物单倍体。
68.更进一步的,所述荧光标记鉴定方法可按照如下方法进行:将携带荧光蛋白表达元件的上述植物单倍体诱导系作为父本与母本杂交,得到杂交子代,通过检测杂交子代种子是否具有荧光信号判断待测种子为单倍体还是四倍体(二倍体):若待测种子无荧光或弱荧光,则该种子为或候选为单倍体;若待测种子表现出强荧光,则该种子为或候选为四倍体(二倍体)。进一步的,通过荧光灯检测待测种子是否具有荧光。更进一步的,所述父本携带有由启动子atoleo1驱动的tagrfp荧光蛋白表达元件,可以根据杂交后代种子是否具有红色荧光判断其为单倍体还是四倍体(二倍体)。
69.所述单倍体性状鉴定方法可按照如下方法进行:若待测植株具有植株矮小,叶片
较窄,且上冲,株型紧凑,雄性不育等特征,则该植株为或候选为单倍体;若待测植株具有植株高大,叶片宽大,披散,育性正常等特征,则该植株为或候选为四倍体(二倍体)。
70.所述叶片倍性鉴定方法可按照如下方法进行:提取待测植株幼嫩叶片的细胞核,以四倍体(二倍体)植物叶片作为对照;再用流式细胞仪器检测信号,首先检测四倍体(二倍体)细胞核信号,并将四倍体(二倍体)细胞核信号峰位设为100(由于四倍体(二倍体)细胞内的遗传物质是单倍体细胞内遗传物质的两倍,因此,单倍体细胞核信号峰位在50附近出现)。若待测植株细胞核信号峰出现在50附近,则该植株为或候选为单倍体;若待测植株的信号峰出现在100附近,其与四倍体(二倍体)细胞核信号强度富集位置相同,则该植株为或候选为四倍体(二倍体)。
71.所述分子标记鉴定可按照如下方法进行:采用父本(母本单倍体诱导系)和母本间多态性引物进行pcr扩增,根据pcr扩增产物判断待测植株为单倍体还是四倍体(二倍体):若待测植株的扩增产物仅具有母本的带型,不存在父本的带型,则该植株为或候选为单倍体;若待测植株的扩增产物具有父本和母本的杂合带型,则该植株为或候选为四倍体(二倍体)。
72.上述任一所述应用或方法,所述植物为双子叶植物;进一步的,所述双子叶植物可为胡萝卜、向日葵、番木瓜、甜菜、甜瓜、苜蓿、核桃、芝麻、橡胶树、木薯、荷花、甜樱桃、月季、马铃薯、葡萄、大豆、番茄、黄瓜、辣椒、棉花、烟草或油菜;更进一步的,所述油菜具体可为野生型油菜westar或hau-a;所述烟草具体可为野生型烟草k326;所述棉花具体可为野生型棉花华棉1号;所述大豆具体可为野生型威廉姆斯82。
73.本发明最后提供了一种单倍体诱导能力降低或果实数目提高的转基因植物的制备方法。
74.本发明提供的单倍体诱导能力降低或果实数目提高的转基因植物的制备方法包括如下步骤:提高植物单倍体诱导系中上述蛋白质的表达量和/或活性,得到转基因植物;所述转基因植物的单倍体诱导能力低于所述植物单倍体诱导系,所述转基因植物的果实数目高于所述植物单倍体诱导系。
75.进一步的,所述提高植物单倍体诱导系中上述蛋白质的表达量和/或活性的方法为在植物单倍体诱导系中过表达上述蛋白质。
76.所述过表达的方法为将编码上述蛋白质的基因导入植物单倍体诱导系中。
77.更进一步的,所述编码上述蛋白质的基因为序列1或序列3或序列5或序列7或序列9或序列11或序列13或序列15或序列17或序列19或序列21或序列23或序列25或序列27或序列29或序列31或序列33或序列35或序列37或序列39或序列41或序列43或序列45或序列47或序列49或序列51或序列53或序列55或序列57或序列59或序列61或序列63或序列65或序列67第33-767位或序列69第32-434位所示的dna分子。
78.所述植物单倍体诱导系为敲除基因atdmp8(atdmp8基因序列如序列表中序列75第95-826位所示)和atdmp9(atdmp9基因序列如序列表中序列76第141-875位所示)的拟南芥突变体,如拟南芥dmp基因突变体dmp8dmp9(t2-19-1),与野生型拟南芥col-0的基因组dna相比,拟南芥dmp基因突变体dmp8dmp9(t2-19-1)的差异仅在于在编码atdmp8蛋白的基因的两条同源染色体上均发生了片段缺失,该缺失的片段位于序列75第115-511位,且在编码atdmp9蛋白的基因的两条同源染色体上均发生了片段缺失,该缺失的片段位于序列76第
maternal haploid induction system in the dicotyledonous arabidopsis[j].nature plants,2020,6(5):466-472.”中,公众可从申请人处获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
[0088]
下述实施例中的野生型油菜westar记载于文献“silva n f,stone s l,christie l n,et al.expression of the s receptor kinase in self-compatible brassica napus cv.westar leads to the allele-specific rejection of self-incompatible brassica napus pollen[j].molecular genetics and genomics:mgg,2001,265(3):552-559.”中,公众可从申请人处获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
[0089]
下述实施例中的野生型油菜hau-a记载于文献“陈凤仪.甘蓝型油菜hau cms蛋白质组学研究[d].华中农业大学,2017.”中,公众可从申请人处获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
[0090]
下述实施例中的野生型烟草k326记载于文献“kov
á
m,vos
á
tka m,rossi l,et al.effects of arbuscular mycorrhizal inoculation on cadmium accumulation by different tobacco(nicotiana tabacum l.)types[j].applied soil ecology,2007,35(3):502-510.”中,公众可从申请人处获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
[0091]
下述实施例中的野生型棉花华棉1号记载于文献“wang,p.and j.zhang,et al.(2018)."high efficient multisites genome editing in allotetraploid cotton(gossypium hirsutum)using crispr/cas9 system."plant biotechnology journal 16(1):137-150.”中,公众可从申请人处获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
[0092]
下述实施例中的野生型大豆威廉姆斯82记载于文献“林志豪.大豆根部特异表达的磷转运子基因gmpt4的功能分析[d].华南农业大学,2016.”中,公众可从申请人处获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
[0093]
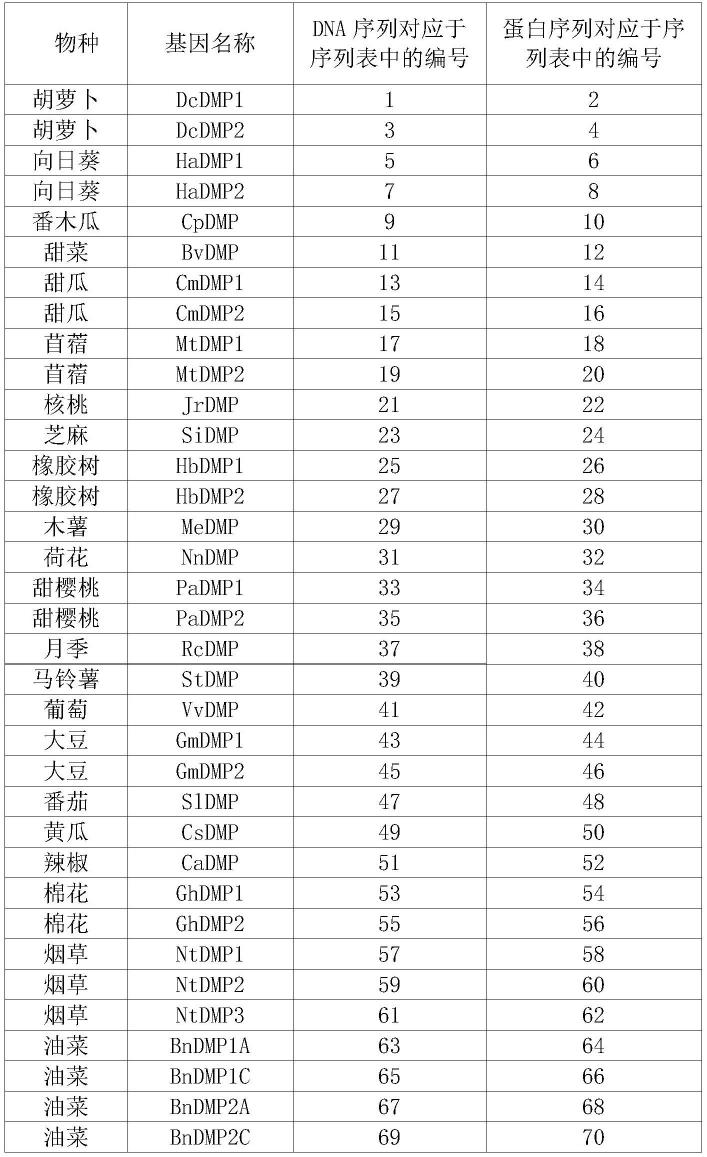
本发明涉及的基因和蛋白及其序列如表1所示。表1中的dna序列除序列67和序列69外均为对应基因的cds序列,编码对应的蛋白序列。序列67第33-767位为序列68所示蛋白的cds序列,序列69第32-434位为序列70所示蛋白的cds序列。
[0094]
表1、本发明涉及的基因序列和蛋白序列
[0095][0096]
实施例1、不同双子叶作物中dmp同源基因的单倍体诱导功能的保守性验证
[0097]
一、dmp同源基因氨基酸序列的获取
[0098]
利用ncbi网站的blastp工具(https://blast.ncbi.nlm.nih.gov/blast.cgi?program=blastp&page_type=blastsearch&blast_spec=&link_loc=blasttab)对dmp蛋白的氨基酸序列进行比对,选择默认参数,最大比对数量设置为250,从中下载非冗余且相似度大于50%的氨基酸序列。从这些序列中,选择22个具有代表性物种的dmp基因序列进行合成或者pcr扩增的方式进行克隆。其中,胡萝卜、向日葵、番木瓜、甜菜、甜瓜、苜蓿、核
桃、芝麻、橡胶树、木薯、荷花、甜樱桃、月季、马铃薯和葡萄中的dmp同源基因的序列交由金斯瑞生物科技股份有限公司进行合成。大豆、番茄、黄瓜、辣椒、棉花、烟草和油菜中的dmp同源基因序列则以pcr扩增的方式进行克隆。
[0099]
大豆gmdmp1和gmdmp2基因高度同源,所用的扩增引物相同,设计扩增引物进行pcr扩增并克隆至载体,然后挑取单克隆测序后分别与gmdmp1和gmdmp2基因序列进行比对,从而获得gmdmp1和gmdmp2基因序列。gmdmp1和gmdmp2基因扩增引物如下:
[0100]
gmdmp1/2-cds1f1:tttgaagacaaaatggatctaaacgaacaacaaatcgg;
[0101]
gmdmp1/2-cds1r1:tttgaagacaacgaggcccctcggggtgacg;
[0102]
gmdmp1/2-cds1f2-annealing:ctcgccgtgttcaagcccgccgtggccgtcccggaggacga;
[0103]
gmdmp1/2-cds1r2-annealing:cctgtcgtcctccgggacggccacggcgggcttgaacacgg;
[0104]
gmdmp1/2-cds1f3:tttgaagacaacaggtttaaggtcgggttcac;
[0105]
gmdmp1/2-cds1r3:tttgaagacaaaagcctaggcagacatgcaaccaa。
[0106]
番茄sldmp基因扩增引物的序列如下:
[0107]
sldmp-cds1f1:tttgaagacaaaatggagcaaactagtgaagga;
[0108]
sldmp-cds1r1:tttgaagacaaacctttcatcttttggcacatc;
[0109]
sldmp-cds1f2:tttgaagacaaaggtacattgtgggagtgaca;
[0110]
sldmp-cds1r2:tttgaagacaaaagcctaagcagacatacatccaac。
[0111]
黄瓜csdmp基因扩增引物的序列如下:
[0112]
csdmp-cds1f1:tttgaagacaaaatggacgaacacacagtaacc;
[0113]
csdmp-cds1r1:tttgaagacaacaccgacggcagaagcatttc;
[0114]
csdmp-cds1f2:tttgaagacaaggtgtccgggaagggggagtg;
[0115]
csdmp-cds1r2:tttgaagacaaaagctcaattagccatacaaccaataccat。
[0116]
辣椒cadmp基因扩增引物的序列如下:
[0117]
cadmp-cds1f1:tttgaagacaaaatggagcaaagtagtgaggga;
[0118]
cadmp-cds1r1:tttgaagacaagatgaagaattatcgacgcgctttg;
[0119]
cadmp-cds1f2:tttgaagacaacatcttcaatgtaccctactagtttac;
[0120]
cadmp-cds1r2:tttgaagacaaacctttcatcttttgggatttcg;
[0121]
cadmp-cds1f3:tttgaagacaaaggtacattgtgggattgacaga;
[0122]
cadmp-cds1r3:tttgaagacaaaagcttaagcagacatacatccaacacc。
[0123]
棉花ghdmp1和ghdmp2基因高度同源,所用的扩增引物相同,设计扩增引物进行pcr扩增并克隆至载体,然后挑取单克隆测序后分别与ghdmp1和ghdmp2基因序列进行比对,从而获得ghdmp1和ghdmp2基因序列。ghdmp1和ghdmp2基因扩增引物如下:
[0124]
ghdmp1/2-cds1f:tttgaagacaaaatggagcaaacccaccatgg;
[0125]
ghdmp1/2-cds1r:tttgaagacaaaagctcaagcagccatgcaacc。
[0126]
烟草ntdmp1、ntdmp2和ntdmp3基因高度同源,所用的扩增引物相同,设计扩增引物进行pcr扩增并克隆至载体,挑取单克隆测序后分别与ntdmp1、ntdmp2和ntdmp3基因序列进行比对,从而获得ntdmp1、ntdmp2和ntdmp3基因序列。ntdmp1、ntdmp2和ntdmp3基因扩增引物如下:
[0127]
ntdmp-cds1f1:tttgaagacaaaatggagcaaagtactgagggaattg;
[0128]
ntdmp1-cds1r1:tttgaagacaaacctcttatcttttggcacatcca;
[0129]
ntdmp2/3-cds1r1:tttgaagacaaacctctcatcttttggcacatcca;
[0130]
ntdmp-cds1f2:tttgaagacaaaggtacgtcgtgggatttac;
[0131]
ntdmp-cds1r2:tttgaagacaaaagcttaagcagacatacatccaataccat。
[0132]
油菜bndmp1a、bndmp1c、bndmp2a和bndmp2c基因高度同源,所用的扩增引物相同,设计扩增引物进行pcr扩增并克隆至载体,挑取单克隆测序后分别与bndmp1a、bndmp1c、bndmp2a和bndmp2c基因序列进行比对,从而获得bndmp1a、bndmp1c、bndmp2a和bndmp2c基因序列。bndmp1a、bndmp1c、bndmp2a和bndmp2c基因扩增引物如下:
[0133]
bndmp1a/1c-cds1f:tttgaagacaaaatggagaaaacagaggaaagt;
[0134]
bndmp1a/1c-cds1r:tttgaagacaaaagctcaagcagacatgcatccaac;
[0135]
bndmp2a/c-cds1f:tttgaagacaaaatggagaaaacagaggaaagc;
[0136]
bndmp2a/c-cds1r:tttgaagacaaaagctcaagcggacatgcatccaac;
[0137]
bndmp2c-cds1r1:tttgaagacaactctcttcctcctcctgcggcg;
[0138]
bndmp2c-cds1f2:tttgaagacaaagagattccggtaagtgatgata。
[0139]
二、dmp同源基因互补载体构建及转化
[0140]
1、将以上获得的不同作物中dmp同源基因的片段通过golden gate方法分别克隆至level0载体pich41308中,得到携带不同dmp基因序列的载体pl0-dmp-cds1(图1b)。
[0141]
2、以拟南芥col-0的基因组dna为模板,利用引物对dmp9-prof/r对atdmp9基因的启动子序列进行扩增,并克隆至level 0载体pich41295中,获得载体pl0-atdmp9-pro(图1a);
[0142]
拟南芥atdmp9基因启动子扩增引物的序列如下:
[0143]
dmp9-prof:tttgaagacaaggagccttccaagactcgga;
[0144]
dmp9-pror:tttgaagacaacatttttcgtgtgtttctctctgttttt。
[0145]
3、以携带atunos终止子序列的载体质粒为模板,利用引物对teratunosf/r对atunos终止子序列进行扩增,并克隆至level 0载体pich41276中,得到载体pl0-teratunos(图1c);
[0146]
atunos终止子扩增引物的序列如下:
[0147]
teratunosf:tttgaagacaagcttgtcaagcagatcgttca;
[0148]
teratunosr:tttgaagacaaagcgtcgatctagtaacatag。
[0149]
4、通过酶切连接的方式,分别将不同作物dmp同源基因的载体pl0-dmp-cds1中的bsai酶切位点间的片段(dmp基因cds序列)、与载体pl0-atdmp9-pro中的bsai酶切位点间的片段(atdmp9基因基因的启动子)、载体pl0-teratunos中的bsai酶切位点间的片段(atunos终止子序列)连接至level 1载体pich47742中,获得不同作物dmp同源基因的level 1载体pl1-f2-pdmp9::dmp-teratunos(图1d)。
[0150]
5、通过酶切连接的方式,分别将不同作物dmp同源基因的level 1载体pl1-f2-pdmp9::dmp-teratunos中的bbsi酶切位点间的片段(atdmp9基因基因的启动子 dmp基因cds序列 atunos终止子序列)、载体pl1-f1-fastr中的bbsi酶切位点间的片段(fastr片段)和载体pich41744的bbsi酶切位点间的片段(l2e片段)连接至level 2载体picsl4723中,获得最终的互补载体pl2-fastr pdmp9::dmp(图1e)。
[0151]
6、分别将不同作物的dmp同源基因互补载体转化至农杆菌gv3101中,然后利用蘸花法转化至拟南芥dmp基因突变体dmp8dmp9(t2-19-1)中,再通过rfp荧光对转化种子进行筛选,最终获得阳性转基因种子。
[0152]
7、将阳性转基因种子种植并自交,选择自交后代中携带荧光与不携带荧光种子比例约为3:1的植株用于下一步的分析。
[0153]
三、携带dmp同源基因互补载体的转基因植株的结实数分析
[0154]
由于拟南芥单倍体诱导基因dmp突变体dmp8dmp9(t2-19-1)的自交和杂交角果结实数均比野生型拟南芥col-0低。如果其它作物中dmp同源基因具有相同的单倍体诱导功能,则理论上携带dmp同源基因互补载体的转基因植株的角果结实数会高于突变体dmp8dmp9(t2-19-1)。因此,为了验证其它作物中dmp同源基因的功能,分别对突变体dmp8dmp9和携带不同作物dmp同源基因互补载体的转基因植株自交角果结实数进行统计和分析,具体操作步骤如下:
[0155]
1、将需要观察的角果固定于粘有双面胶带的载玻片上;
[0156]
2、在体式镜下,使用1ml注射器的尖端轻轻将角果两侧划开,再用尖镊子将角果的果皮撕掉;
[0157]
3、对角果中正常种子的数目进行统计,计算角果平均结实数。
[0158]
结果显示:与突变体dmp8dmp9相比,携带不同作物dmp同源基因互补载体的转基因植株自交角果的结实数均显著升高(表2)。这些结果表明,外源的dmp同源基因可以互补突变体dmp8dmp9的表型,说明这些作物中的dmp同源基因均具备调控植物单倍体诱导能力的功能。
[0159]
表2、突变体dmp8dmp9和携带dmp同源基因的转基因植株的自交角果结实数目统计表
[0160]
[0161][0162]
注:a表示结实数与dmp8dmp9相比有显著差异;每种基因型材料取3个以上独立的转基因植株。
[0163]
实施例2、bndmp基因敲除的油菜突变体的制备及其应用
[0164]
一、利用crispr/cas9系统敲除bndmp基因
[0165]
利用crispr/cas9系统敲除油菜中的bndmp基因(bndmp表示bndmp1a、bndmp2a、bndmp1c和bndmp2c四个基因),获得bndmp基因敲除的突变体。由于油菜westar中只存在bndmp1a、bndmp2a和bndmp2c三个dmp的同源基因。因此,只对这三个基因进行敲除,具体步骤如下:
[0166]
1、sgrna序列的选择
[0167]
分别在bndmp1a、bndmp2a和bndmp2c基因上设计靶位点序列,长度为20bp。
[0168]
靶位点1位于序列67第26-45位,序列69第26-45位,靶位点1序列为cacgaaaatggagaaaacag。
[0169]
靶位点2位于序列63第4-23位,靶位点2序列为gagaaaacagaggaaagtgt。
[0170]
靶位点3位于序列67第56-75位,序列69第56-75位,靶位点3序列为tgggatcagagtttacacga。
[0171]
靶位点4位于序列63第159-178位,靶位点4序列为gaactccttgagcgaccatg。
[0172]
2、crispr/cas9载体的构建
[0173]
crispr/cas9载体为将序列71所示的dna分子插入pdirect-22c载体后得到的载体。
[0174]
3、转基因植株的获得
[0175]
将步骤2获得的crispr/cas9载体通过热激转化至农杆菌感受态细胞gv3101(农杆菌gv3101感受态细胞购自北京奥森鼎信生物技术有限公司,公众可通过购买获得),得到重
组菌gv3101/crispr/cas9。
[0176]
再将重组菌gv3101/crispr/cas9采用农杆菌侵染方法转化至野生型油菜westar(重组农杆菌进行28℃扩繁,扩繁后的菌液用于侵染油菜westar)中,经过卡那抗性筛选后获得t0代转基因油菜植株。
[0177]
4、bndmp基因发生突变的转基因植株鉴定
[0178]
采集步骤3获得的t0代转基因油菜植株叶片,并提取基因组dna作为模板,采用如下引物进行pcr扩增,得到不同株系的pcr扩增产物。
[0179]
bndmp1a基因突变序列检测引物的序列如下:
[0180]
bndmp1af1:cttcttgattccagagatcac;
[0181]
bndmp1ar1:gaagaagaagcaggaggttg。
[0182]
bndmp2a基因突变序列检测引物的序列如下:
[0183]
bndmp2af1:ccaccactggttaagcgatact;
[0184]
bndmp2ar1:catgcgacgttttcgacctc。
[0185]
bndmp2c基因突变序列检测引物的序列如下:
[0186]
bndmp2cf2:cccttaggactaacgaactcgc;
[0187]
bndmp2cr1:cacttaccggaatctctgcctc。
[0188]
将不同株系的pcr扩增产物进行sanger测序,根据测序结果分别与野生型油菜westar相应的bndmp基因进行比对。根据以下原则分别对各个bndmp的基因型进行鉴定。
[0189]
自靶位点序列起具有双峰特征的序列,则该株系的基因型为杂合基因型(2条同源染色体中的1条染色体上的bndmp基因突变,且另1条染色体上的bndmp基因未突变),该株系为t0代转基因油菜杂合突变型株系;
[0190]
自靶位点序列起具有特异单峰特征的序列,若与野生型油菜westar的bndmp基因序列相同,则该株系的基因型为野生型,即bndmp基因序列没有发生突变;若与野生型油菜westar的bndmp基因序列不同,则该株系的基因型为纯合基因型(2条同源染色体上的bndmp基因发生突变),该株系为t0代转基因油菜纯合突变型株系。
[0191]
5、t1代油菜的基因型鉴定
[0192]
将步骤4获得的t0代转基因油菜bndmp基因突变株系自交,收获种子后再播种,得到t1代转基因油菜。鉴定t1代转基因油菜的bndmp基因的基因型,具体方法如下:以t1代转基因油菜的基因组dna为模板,分别利用bndmp1a、bndmp2a和bndmp2c基因的突变序列检测引物按照步骤4中的方法鉴定t1代转基因油菜3个bndmp基因的基因型。
[0193]
最终获得t1代转基因油菜bndmp基因突变纯合株系bndmp-1和bndmp-2。具体突变情况如下:
[0194]
t1代转基因油菜3个bndmp基因突变纯合型株系bndmp-1与野生型油菜westar的基因组dna的差异仅在于在编码bndmp1a的基因的两条同源染色体上均发生了碱基g的插入,该碱基g插入位置位于序列63第162-163位之间,且在编码bndmp2a的基因的两条同源染色体上均发生了碱基g和碱基a的插入,该插入碱基g位于序列67第42-43位之间,该插入碱基a位于序列67第72-73位之间,且在编码bndmp2c的基因的两条同源染色体上均发生了碱基a的插入,该插入碱基a位于序列69第42-43位之间和序列69第72-73位之间。
[0195]
t1代转基因油菜3个bndmp基因突变纯合型株系bndmp-2与野生型油菜westar的基
因组dna的差异仅在于在编码bndmp1a的基因的两条同源染色体上均发生了碱基g的插入,该碱基g插入位置位于序列63第162-163位之间,且在编码bndmp2a的基因的两条同源染色体上均发生了碱基替换和碱基t的插入,该碱基替换为将序列67第43-53位所示的dna分子替换为如下序列:tataaca,该碱基t插入位置位于序列67第72-73位之间,且在编码bndmp2c的基因的两条同源染色体上均发生了碱基a的插入,该插入碱基a位于序列69第42-43位之间和序列69第72-73位之间。
[0196]
取上述t1代转基因油菜突变株系用于下述单倍体诱导能力分析实验。
[0197]
二、bndmp基因敲除的油菜突变体在诱导产生单倍体中的应用
[0198]
(一)bndmp基因敲除的油菜突变体的单倍体自交诱导能力鉴定
[0199]
由于野生型油菜westar为纯合的自交系,在此背景上敲除bndmp基因所获得突变体自交后代无法通过分子标记去鉴定单倍体。因此,将bndmp基因所获得不同类型组合的突变体自交所获得的种子种植,用如下方法对自交后代进行单倍体鉴别。
[0200]
1、植株表型鉴别
[0201]
将自交种子种植后,观察单株表型,单倍体具有植株矮小,叶片较窄,且上冲,株型紧凑,雄性不育等特征,四倍体则表现为植株高大,叶片宽大,披散,育性正常(图2a,c)。
[0202]
2、流式细胞检测叶片鉴别
[0203]
将上述步骤1中获得的表现为单倍体性状植株进行流式细胞检测,具体方法如下:提取待测植株幼嫩叶片的细胞核,以四倍体油菜叶片作为对照;再用流式细胞仪器检测信号,首先检测四倍体细胞核信号,并将四倍体细胞核信号峰位设为100(由于四倍体细胞内的遗传物质是其单倍体细胞内遗传物质的两倍,因此,单倍体细胞核信号峰位在50附近出现)。若待测植株细胞核信号峰出现在50附近,则认为该待测植株为单倍体。若待测植株的信号峰出现在100附近,则认为其与四倍体细胞核信号强度富集位置相同,该待测植株为四倍体(图2b)。
[0204]
bndmp基因突变纯合型株系自交的后代单株中,若按照上述2种方法鉴定结果均为单倍体,则该植株为单倍体植株;若上述任一种方法鉴定结果不为单倍体,则该植株不为单倍体植株。
[0205]
统计上述鉴定结果并按照如下公式计算单倍体诱导率:单倍体诱导率(%)=(单倍体株数/总株数)
×
100。从表3中可以看出,油菜bndmp基因突变后,在自交后代中可获得单倍体。
[0206]
表3、bndmp突变体自交后代中单倍体诱导率统计
[0207]
基因型总株数单倍体株数单倍体诱导率(%)wt34300bndmp-19711.03bndmp-24524.44
[0208]
注:wt为油菜野生型材料westar。
[0209]
(二)bndmp基因敲除的油菜突变体的单倍体杂交诱导能力鉴定
[0210]
将bndmp基因所获得不同类型组合的突变体分别与油菜hau-a材料进行杂交获得后代,通过如下方法对后代中的单倍体进行鉴别。
[0211]
1、荧光标记鉴别
[0212]
crispr/cas9载体上携带启动子atoleo1驱动tagrfp(entacmaea quadricolor)的表达元件。由于启动子atoleo1在成熟的种子胚中特异表达,可通过荧光灯对tagrfp的荧光信号进行观察。因此,用携带该表达元件的突变体为父本与其它不携带荧光的母本材料杂交,所得到的种子中,四倍体种子的胚由于具有父本的基因组而表现出红色荧光,而单倍体种子的胚由于来源于母本而表现为弱荧光。
[0213]
2、分子标记鉴别
[0214]
将上述步骤1鉴定出的弱荧光的种子进一步种植,提取其基因组dna,采用油菜hau-a材料和转基因油菜突变株系间多态性引物(a07f a07r)进行pcr扩增,并将扩增产物进行琼脂糖带型检测,若待测单株的扩增产物表现为1条带,认为该单株条带为油菜hau-a材料带型,不存在父本材料的带型,则该单株是单倍体。若待测单株的扩增产物表现为2条带,认为该单株条带为油菜hau-a材料和转基因油菜突变株系杂合带型,则该单株是正常杂交的后代,是四倍体。
[0215]
油菜单倍体鉴别引物序列如下:
[0216]
a07f:cggggccataaaaacagtgaag;
[0217]
a07r:gccttcagcgacttgaacatc。
[0218]
3、植株表型鉴别
[0219]
对上述步骤2鉴定出的单倍体植株进一步观察其表型,单倍体具有植株矮小,叶片较窄,且上冲,株型紧凑,雄性不育等特征,四倍体则表现为植株高大,叶片宽大,披散,育性正常(图2a,c)。
[0220]
4、流式细胞检测叶片鉴别
[0221]
将上述步骤3获得的表现为单倍体性状植株进行流式细胞检测,具体方法如下:提取待测植株幼嫩叶片的细胞核,以四倍体油菜叶片作为对照;再用流式细胞仪器检测信号,首先检测四倍体细胞核信号,并将四倍体细胞核信号峰位设为100(由于四倍体细胞内的遗传物质是其单倍体细胞内遗传物质的两倍,因此,单倍体细胞核信号峰位在50附近出现)。若待测植株细胞核信号峰出现在50附近,则认为该待测植株为单倍体。若待测植株的信号峰出现在100附近,则认为其与四倍体细胞核信号强度富集位置相同,该待测植株为四倍体(图2b)。
[0222]
bndmp基因突变纯合型株系与油菜hau-a材料杂交的后代单株中,若按照上述4种方法鉴定结果均为单倍体,则该植株为单倍体植株;若上述任一种方法鉴定结果不为单倍体,则该植株不为单倍体植株。
[0223]
统计上述鉴定结果并按照如下公式计算单倍体诱导率:单倍体诱导率(%)=(单倍体株数/总株数)
×
100。从表4统计结果中可以看出,bndmp基因突变纯合型株系与其他材料杂交,在后代中可获得单倍体。
[0224]
表4、bndmp突变体杂交后代中单倍体诱导率统计
[0225]
杂交组合总植株数单倍体数单倍体诱导率(%)hau-a
×
wt55700.00hau-a
×
bndmp-1570223.86hau-a
×
bndmp-29111.10
[0226]
注:wt为油菜野生型材料westar。
[0227]
实施例3、ntdmp基因敲除的烟草突变体的制备及其应用
[0228]
一、利用crispr/cas9系统敲除ntdmp基因
[0229]
利用crispr/cas9系统敲除烟草中的ntdmp基因(ntdmp表示ntdmp1、ntdmp2和ntdmp3三个基因),获得ntdmp基因敲除的烟草突变体。具体步骤如下:
[0230]
1、sgrna序列的选择
[0231]
分别在ntdmp1、ntdmp2和ntdmp3基因上设计靶位点序列,长度为20bp。
[0232]
靶位点1位于序列59第111-130位,靶位点1序列为ttgctggttgaggcaattcg。
[0233]
靶位点2位于序列59第278-297位,靶位点2序列为aatcattagtgtagtgacag。
[0234]
靶位点3位于序列57第88-107位,序列61第88-107位,靶位点3序列为atcggaacatcgttatctgg。
[0235]
靶位点4位于序列57第383-402位,序列59第383-402位,序列61第383-402位,靶位点4序列为atggatttgtgacaccaaga。
[0236]
2、crispr/cas9载体的构建
[0237]
crispr/cas9载体为将序列72所示的dna分子插入pdirect-22c载体后得到的载体。
[0238]
3、转基因植株的获得
[0239]
将步骤2获得的crispr/cas9载体通过热激转化至农杆菌感受态细胞gv3101(农杆菌gv3101感受态细胞购自北京奥森鼎信生物技术有限公司,公众可通过购买获得),得到重组菌gv3101/crispr/cas9。
[0240]
再将重组菌gv3101/crispr/cas9采用农杆菌侵染方法转化至野生型烟草k326(重组农杆菌进行28℃扩繁,扩繁后的菌液用于烟草k326侵染)中,经过卡那抗性筛选后获得t0代转基因烟草植株。
[0241]
4、ntdmp基因发生突变的转基因植株鉴定
[0242]
采集步骤3获得的t0代转基因烟草植株叶片,并提取基因组dna作为模板,采用如下引物进行pcr扩增,得到不同株系的pcr扩增产物。
[0243]
ntdmp1基因突变序列检测引物的序列如下:
[0244]
ntdmp1 3f2:actgaaaacttcattcgtgatcatt;
[0245]
ntdmp1r1:tcgccacaaatattaatccacatga。
[0246]
ntdmp2基因突变序列检测引物的序列如下:
[0247]
ntdmp3f:gcaaagtactgagggaattggg;
[0248]
ntdmp2r:agacgatcggtctggtgata。
[0249]
ntdmp3基因突变序列检测引物的序列如下:
[0250]
ntdmp1 3f2:actgaaaacttcattcgtgatcatt;
[0251]
ntdmp3r2:tcaacccacatggatgaattctg。
[0252]
将不同株系的pcr扩增产物进行sanger测序,根据测序结果分别与野生型烟草k326相应的ntdmp基因进行比对。根据以下原则分别对各个ntdmp的基因型进行鉴定。
[0253]
自靶位点序列起具有双峰特征的序列,则该株系的基因型为杂合基因型(2条同源染色体中的1条染色体上的ntdmp基因突变,且另1条染色体上的ntdmp基因未突变),该株系为t0代转基因烟草杂合突变型株系;
[0254]
自靶位点序列起具有特异单峰特征的序列,若与野生型烟草k326的ntdmp基因序列相同,则该株系的基因型为野生型,即ntdmp基因序列没有发生突变;若与野生型烟草k326的ntdmp基因序列不同,则该株系的基因型为纯合基因型(2条同源染色体上的ntdmp基因发生突变),该株系为t0代转基因烟草纯合突变型株系。
[0255]
5、t1代转基因烟草的基因型鉴定
[0256]
将步骤4获得的t0代转基因烟草ntdmp基因突变株系自交,收获种子后再播种,得到t1代转基因烟草。鉴定t1代转基因烟草的ntdmp基因的基因型,具体方法如下:以t1代转基因烟草的基因组dna为模板,分别利用ntdmp1、ntdmp2和ntdmp3基因的突变序列检测引物按照步骤4中的方法鉴定t1代转基因烟草ntdmp1、ntdmp2和ntdmp3基因的基因型。
[0257]
最终获得t1代转基因烟草ntdmp基因突变纯合株系ntdmp-1和ntdmp-2。具体突变情况如下:
[0258]
t1代转基因烟草3个ntdmp基因突变纯合型株系ntdmp-1与野生型烟草k326的基因组dna的差异仅在于在编码ntdmp1的基因的两条同源染色体上均发生了碱基g缺失和片段缺失,该缺失碱基g位于序列57第91位,该缺失片段位于序列57第115-399位,且在编码ntdmp2的基因的两条同源染色体上均发生了片段缺失,该缺失片段位于序列59第116-281位,且在编码ntdmp3的基因的两条同源染色体上均发生了碱基g缺失和片段缺失,该缺失碱基g位于序列61第91位,该缺失片段位于序列61第115-399位。
[0259]
t1代转基因烟草3个ntdmp基因突变纯合型株系ntdmp-2与野生型烟草k326的基因组dna的差异仅在于在编码ntdmp1的基因的两条同源染色体上均发生了碱基g缺失和碱基a缺失,该缺失碱基g位于序列57第91位,该缺失碱基a位于序列57第114位,且在编码ntdmp2的基因的两条同源染色体上均发生了碱基替换,该碱基替换为将序列59第111-280位所示的dna分子替换为碱基t,且在编码ntdmp3的基因的两条同源染色体上均发生了碱基a插入,该插入碱基a位于序列61第400-401位之间。
[0260]
取上述t1代转基因烟草突变株系用于下述单倍体诱导能力分析实验。
[0261]
二、ntdmp基因敲除的烟草突变体在诱导产生单倍体中的应用
[0262]
(一)ntdmp基因敲除的烟草突变体的单倍体自交诱导能力鉴定
[0263]
由于野生烟草k326为纯合的自交系,在此背景上敲除ntdmp基因所获得突变体自交后代无法通过分子标记去鉴定单倍体。因此,将ntdmp基因所获得几种类型突变体自交所获得的种子种植,用如下方法对自交后代进行单倍体鉴别。
[0264]
1、植株表型鉴别
[0265]
将自交种子种植后,观察单株表型,单倍体具有植株矮小,叶片较窄,且上冲,株型紧凑,雄性不育等特征,四倍体则表现为植株高大,叶片宽大,披散,育性正常(图3a)。
[0266]
2、流式细胞检测叶片鉴别
[0267]
将上述步骤1获得的表现为单倍体性状植株进行流式细胞检测,具体方法如下:提取待测植株幼嫩叶片的细胞核,以四倍体烟草叶片作为对照;再用流式细胞仪器检测信号,首先检测四倍体细胞核信号,并将四倍体细胞核信号峰位设为100(由于四倍体细胞内的遗传物质是单倍体细胞内遗传物质的两倍,因此,单倍体细胞核信号峰位在50附近出现)。若待测植株细胞核信号峰出现在50附近,则认为该待测植株为单倍体。若待测植株的信号峰出现在100附近,则认为其与四倍体细胞核信号强度富集位置相同,该待测植株为四倍体
(图3b)。
[0268]
ntdmp基因突变纯合株系自交的后代单株中,若按照上述2种方法鉴定结果均为单倍体,则该植株为单倍体植株;若上述任一种方法鉴定结果不为单倍体,则该植株不为单倍体植株。
[0269]
统计上述鉴定结果并按照如下公式计算单倍体诱导率:单倍体诱导率(%)=(单倍体株数/总株数)
×
100。从表5中可以看出,ntdmp基因突变后,在自交后代中可获得单倍体。
[0270]
表5、ntdmp突变体自交后代中单倍体诱导率统计
[0271]
基因型总株数单倍体株数单倍体诱导率(%)wt32900ntdmp-1111180.72ntdmp-229131.03
[0272]
注:wt为烟草野生型材料k326。
[0273]
(二)ntdmp基因敲除的烟草突变体的单倍体杂交诱导能力鉴定
[0274]
将ntdmp基因所获得不同类型组合的突变体分别与野生型烟草k326材料进行杂交获得后代,通过如下方法对后代中的单倍体进行鉴别。
[0275]
1、荧光标记鉴别
[0276]
crispr/cas9载体上携带启动子atoleo1驱动tagrfp(entacmaea quadricolor)的表达元件。由于启动子atoleo1在成熟的种子胚中特异表达,可通过荧光灯对tagrfp的荧光信号进行观察。因此,用携带该表达元件的突变体为父本与其它不携带荧光的母本材料杂交,所得到的种子中,四倍体种子的胚由于具有父本的基因组而表现出红色荧光,而单倍体种子的胚由于来源于母本而表现为弱荧光。
[0277]
2、分子标记鉴别
[0278]
将上述步骤1鉴定出的弱荧光的种子进一步种植,提取其基因组dna,采用野生型烟草k326材料和转基因烟草突变株系间多态性引物(ntdmp3f ntdmp2r)进行pcr扩增,并将扩增产物进行琼脂糖带型检测,若待测单株的扩增产物表现为1条带,认为该单株条带为野生型烟草k326材料带型,不存在父本材料的带型,则该单株是单倍体。若待测单株的扩增产物表现为2条带,认为该单株条带为野生型烟草k326材料和转基因烟草突变株系杂合带型,则该单株是正常杂交的后代,是四倍体。
[0279]
3、植株表型鉴别
[0280]
对上述步骤2鉴定出的植株进一步观察其表型,单倍体具有植株矮小,叶片较窄,且上冲,株型紧凑,雄性不育等特征,四倍体则表现为植株高大,叶片宽大,披散,育性正常(图3a,c)。
[0281]
4、流式细胞检测叶片鉴别
[0282]
将上述步骤3获得的表现为单倍体性状植株进行流式细胞检测,具体方法如下:提取待测植株幼嫩叶片的细胞核,以四倍体烟草叶片作为对照;再用流式细胞仪器检测信号,首先检测四倍体细胞核信号,并将四倍体细胞核信号峰位设为100(由于四倍体细胞内的遗传物质是单倍体细胞内遗传物质的两倍,因此,单倍体细胞核信号峰位在50附近出现)。若待测植株细胞核信号峰出现在50附近,则认为该待测植株为单倍体。若待测植株的信号峰
出现在100附近,则认为其与四倍体细胞核信号强度富集位置相同,该待测植株为四倍体(图3b)。
[0283]
ntdmp基因突变纯合株系与野生型烟草k326材料杂交的后代单株中,若按照上述4种方法鉴定均为单倍体,则该植株为单倍体植株;若上述任一种方法鉴定结果不为单倍体,则该植株不为单倍体植株。
[0284]
统计上述鉴定结果并按照如下公式计算单倍体诱导率:单倍体诱导率(%)=(单倍体株数/总株数)
×
100。从表6中可以看出,ntdmp基因突变后与其他材料杂交,在后代中可获得单倍体。
[0285]
表6、ntdmp突变体杂交后代中单倍体诱导率统计
[0286]
杂交组合总植株数单倍体数单倍体诱导率(%)k326
×
wt52100.00k326
×
ntdmp-135630.84k326
×
ntdmp-2675111.63
[0287]
注:wt为烟草野生型材料k326。
[0288]
实施例4、ghdmp基因敲除的棉花突变体的制备及其应用
[0289]
一、利用crispr/cas9系统敲除ghdmp基因
[0290]
利用crispr/cas9系统敲除棉花中的ghdmp基因(ghdmp基因表示ghdmp1和ghdmp2两个基因),获得ghdmp基因敲除的棉花突变体。具体步骤如下:
[0291]
1、sgrna序列的选择
[0292]
分别在ghdmp1和ghdmp2基因上设计靶位点序列,长度为20bp。
[0293]
靶位点1位于序列53第42-61位,序列55第42-61位,靶位点1序列为tactgcaacaccacccccag。
[0294]
靶位点2位于序列53第79-98位,序列55第79-98位,靶位点2序列为agtcgagggagggaagagag。
[0295]
靶位点3位于序列53第316-335位,序列55第316-335位,靶位点3序列为catttcaccgatagtttccg。
[0296]
靶位点4位于序列53第326-345位,靶位点4序列为atagtttccgaggccccgat。
[0297]
2、crispr/cas9载体的构建
[0298]
crispr/cas9载体为将序列73所示的dna分子插入pdirect-22c载体后得到的载体。
[0299]
3、转基因植株的获得
[0300]
将步骤2获得的crispr/cas9载体通过热激转化至农杆菌感受态细胞gv3101(农杆菌gv3101感受态细胞购自北京奥森鼎信生物技术有限公司,公众可通过购买获得),得到重组菌gv3101/crispr/cas9。
[0301]
再将重组菌gv3101/crispr/cas9采用农杆菌侵染方法转化野生型棉花华棉1号(重组农杆菌进行28℃扩繁,扩繁后的菌液用于野生型棉花华棉1号侵染)中,经过卡那抗性筛选后获得t0代转基因棉花植株。
[0302]
4、ghdmp基因发生突变的转基因植株鉴定
[0303]
采集步骤3获得的t0代转基因棉花植株叶片,并提取基因组dna作为模板。采用如
下引物进行pcr扩增,得到不同株系的pcr扩增产物。
[0304]
ghdmp1基因突变序列检测引物的序列如下:
[0305]
ghdmp1f:acattaacaccaagaatggctcaa;
[0306]
ghdmp1r:caacaccgacatcacggcat。
[0307]
ghdmp2基因突变序列检测引物的序列如下:
[0308]
ghdmp2f:tggctgcttcattcatacttatcg;
[0309]
ghdmp2r:gacgccgaatctagtctttgga。
[0310]
将不同株系的pcr扩增产物进行sanger测序,根据测序结果分别与野生型棉花华棉1号相应的ghdmp基因进行比对。根据以下原则分别对各个ghdmp的基因型进行鉴定。
[0311]
自靶位点序列起具有双峰特征的序列,则该株系的基因型为杂合基因型(2条同源染色体中的1条染色体上的ghdmp基因突变,且另1条染色体上的ghdmp基因未突变),该株系为t0代转基因棉花杂合突变型株系;
[0312]
自靶位点序列起具有特异单峰特征的序列,若与野生型华棉1号的ghdmp基因序列相同,则该株系的基因型为野生型,即ghdmp基因序列没有发生突变;若与野生型华棉1号的ghdmp基因序列不同,则该株系的基因型为纯合基因型(2条同源染色体上的ghdmp基因发生突变),该株系为t0代转基因棉花纯合突变型株系。
[0313]
5、t1代转基因棉花的基因型鉴定
[0314]
将步骤4获得的t0代转基因棉花ghdmp基因突变株系自交,收获种子后再播种,得到t1代转基因棉花。鉴定t1代转基因棉花的ghdmp基因的基因型,具体方法如下:以t1代转基因棉花的基因组dna为模板,分别利用ghdmp1和ghdmp2基因的突变序列检测引物按照步骤4中的方法鉴定t1代转基因棉花ghdmp1和ghdmp2基因的基因型。
[0315]
最终获得t1代转基因棉花ghdmp基因突变纯合株系ghdmp-1和ghdmp-2。具体突变情况如下:
[0316]
t1代转基因棉花ghdmp基因突变纯合型株系ghdmp-1与野生型华棉1号的基因组dna的差异仅在于在编码ghdmp1的基因的两条同源染色体上均发生了碱基c缺失,该缺失碱基c位于序列53第342位,且在编码ghdmp2的基因的两条同源染色体上均发生了片段缺失,该缺失片段位于序列55第54-58位。
[0317]
t1代转基因棉花ghdmp基因突变纯合型株系ghdmp-2与野生型华棉1号的基因组dna的差异仅在于在编码ghdmp1的基因的两条同源染色体上均发生了碱基替换和片段缺失,该碱基替换为将序列53第345位碱基t替换成碱基a,该缺失片段位于序列53第358-359位,且在编码ghdmp2的基因的两条同源染色体上均发生了片段缺失,该缺失片段位于序列55第59-83位。
[0318]
取上述t1代转基因棉花突变株系用于下述单倍体诱导能力分析实验。
[0319]
二、ghdmp基因敲除的棉花突变体在诱导产生单倍体中的应用
[0320]
(一)ghdmp基因敲除的棉花突变体的单倍体自交诱导能力鉴定
[0321]
由于野生棉花华棉1号为纯合的自交系,在此背景上敲除ghdmp基因所获得突变体自交后代无法通过分子标记去鉴定单倍体。因此,将ghdmp基因所获得不同类型组合的突变体自交所获得的种子种植,用如下方法对自交后代进行单倍体鉴别。
[0322]
1、植株表型鉴别
[0323]
将自交种子种植后,观察单株表型,单倍体具有植株矮小,叶片较窄,且上冲,株型紧凑,雄性不育等特征,四倍体则表现为植株高大,叶片宽大,披散,育性正常。
[0324]
2、流式细胞检测叶片鉴别
[0325]
将上述步骤1中获得的表现为单倍体性状植株进行流式细胞检测,具体方法如下:提取待测植株幼嫩叶片的细胞核,以四倍体棉花叶片作为对照;再用流式细胞仪器检测信号,首先检测四倍体细胞核信号,并将四倍体细胞核信号峰位设为100(由于四倍体细胞内的遗传物质是单倍体细胞内遗传物质的两倍,因此,单倍体细胞核信号峰位在50附近出现)。若待测植株细胞核信号峰出现在50附近,则认为该待测植株为单倍体。若待测植株的信号峰出现在100附近,则认为其与四倍体细胞核信号强度富集位置相同,该待测植株为四倍体。
[0326]
ghdmp基因突变纯合型株系自交的后代单株中,若按照上述2种方法鉴定结果均为单倍体,则该植株为单倍体植株;若上述任一种方法鉴定结果不为单倍体,则该植株不为单倍体植株。
[0327]
统计上述鉴定结果并按照如下公式计算单倍体诱导率:单倍体诱导率(%)=(单倍体株数/总株数)
×
100。从表7中可以看出,ghdmp基因突变后,在自交后代中可获得单倍体。
[0328]
表7、ghdmp突变体自交后代中单倍体诱导率统计
[0329]
基因型总株数单倍体株数单倍体诱导率(%)wt26100ghdmp-120310.49ghdmp-223620.85
[0330]
注:wt为棉花野生型材料华棉1号。
[0331]
(二)ghdmp基因敲除的棉花突变体的单倍体杂交诱导能力鉴定
[0332]
将ghdmp基因所获得不同类型组合的突变体分别与野生型华棉1号进行杂交获得后代,通过如下方法对后代中的单倍体进行鉴别。
[0333]
1、荧光标记鉴别
[0334]
crispr/cas9载体上携带启动子atoleo1驱动tagrfp(entacmaea quadricolor)的表达元件。由于启动子atoleo1在成熟的种子胚中特异表达,可通过荧光灯对tagrfp的荧光信号进行观察。因此,用携带该表达元件的突变体为父本与其它不携带荧光的母本材料杂交,所得到的种子中,四倍体种子的胚由于具有父本的基因组而表现出红色荧光,而单倍体种子的胚由于来源于母本而表现为弱荧光。
[0335]
2、分子标记鉴别
[0336]
将上述步骤1鉴定出的弱荧光的种子进一步种植,提取其基因组dna,采用野生型华棉1号和转基因棉花突变株系间多态性引物(ghdmp1f ghdmp1r)进行pcr扩增,并将扩增产物进行琼脂糖带型检测后进行测序,若待测单株的扩增产物测序峰图结果表现为单一峰且与野生型华棉1号序列一致,认为该单株为野生型华棉1号带型,不存在父本材料的带型,则该单株是单倍体。若待测单株的扩增产物测序峰图结果为杂合峰,认为该单株为野生型华棉1号和转基因棉花突变株系杂合带型,则该单株是正常杂交的后代,是四倍体。
[0337]
3、植株表型鉴别
[0338]
对上述步骤2鉴定出的植株进一步观察其表型,单倍体具有植株矮小,叶片较窄,且上冲,株型紧凑,雄性不育等特征,四倍体则表现为植株高大,叶片宽大,披散,育性正常。
[0339]
4、流式细胞检测叶片鉴别
[0340]
将上述步骤3中获得的表现为单倍体性状植株进行流式细胞检测,具体方法如下:提取待测植株幼嫩叶片的细胞核,以四倍体棉花叶片作为对照;再用流式细胞仪器检测信号,首先检测四倍体细胞核信号,并将四倍体细胞核信号峰位设为100(由于四倍体细胞内的遗传物质是单倍体细胞内遗传物质的两倍,因此,单倍体细胞核信号峰位在50附近出现)。若待测植株细胞核信号峰出现在50附近,则认为该待测植株为单倍体。若待测植株的信号峰出现在100附近,则认为其与四倍体细胞核信号强度富集位置相同,该待测植株为四倍体。
[0341]
ghdmp基因突变纯合型株系与野生型华棉1号杂交的后代单株中,若按照上述4种方法鉴定结果均为单倍体,则该植株为单倍体植株;若上述任一种方法鉴定结果不为单倍体,则该植株不为单倍体植株。
[0342]
统计上述鉴定结果并按照如下公式计算单倍体诱导率:单倍体诱导率(%)=(单倍体株数/总株数)
×
100。从表8中可以看出,ghdmp基因突变后与其他材料杂交,在后代中可获得单倍体。
[0343]
表8、ghdmp突变体杂交后代中单倍体诱导率统计
[0344]
基因型总株数单倍体株数单倍体诱导率(%)华棉1号
×
wt33100华棉1号
×
ghdmp-116410.61华棉1号
×
ghdmp-231610.32
[0345]
注:wt为棉花野生型材料华棉1号。
[0346]
实施例5、gmdmp基因敲除的大豆突变体的制备及其应用
[0347]
一、利用crispr/cas9系统敲除大豆的gmdmp基因
[0348]
利用crispr/cas9系统敲除大豆中的gmdmp基因(gmdmp基因表示gmdmp1和gmdmp2两个基因),获得gmdmp基因敲除的大豆突变体。具体步骤如下:
[0349]
1、sgrna序列的选择
[0350]
分别在gmdmp1和gmdmp2基因上设计靶位点序列,长度为20bp。
[0351]
靶位点1位于序列43第96-115位,靶位点1序列为gatgtttcttgggttgtgga。
[0352]
靶位点2位于序列43第112-131位,序列45第112-131位,靶位点2序列为catcgtgccctaatggcaaa。
[0353]
靶位点3位于序列45第168-187位,靶位点3序列为ctgtggggaggaagttaccg。
[0354]
靶位点4位于序列43第350-369位,序列45第350-369位,靶位点4序列为actatggcttcgtcaccccg。
[0355]
2、crispr/cas9载体的构建
[0356]
crispr/cas9载体的核苷酸序列如序列表中序列74所示。其中,序列74的第227-1826位为bar抗性筛选标记表达元件p35s:bar,第1851-7084位为cas9表达元件p35s:cas9,第7143-9456位为启动子atoleo1驱动tagrfp的表达元件,第9481-10882位为gmdmp1和gmdmp2基因的grna表达元件。
[0357]
3、转基因植株的获得
[0358]
将步骤2获得的crispr/cas9载体通过热激转化至农杆菌感受态细胞eha105(农杆菌eha105感受态细胞购自北京奥森鼎信生物技术有限公司,公众可通过购买获得),得到重组菌eha105/crispr/cas9。
[0359]
再将重组菌eha105/crispr/cas9采用农杆菌侵染方法转化野生型大豆威廉姆斯82(重组农杆菌进行28℃扩繁,扩繁后的菌液用于野生型大豆威廉姆斯82侵染)中,经过bar抗性筛选后获得t0代转基因大豆植株。
[0360]
4、gmdmp基因发生突变的转基因植株鉴定
[0361]
采集步骤3获得的t0代转基因大豆植株叶片,并提取基因组dna作为模板。由于gmdmp1与gmdmp2基因高度同源,无法设计各自特异性扩增的引物。因此先采用引物对(gmdmpf/r)进行pcr扩增,得到不同株系的pcr扩增产物连接t载体后转化大肠杆菌感受态细胞(t载体和大肠杆菌感受态细胞购自北京全式金生物,公众可通过购买获得),挑取鉴定单克隆。
[0362]
gmdmp1基因和gmdmp2基因突变序列检测引物的序列如下:
[0363]
gmdmpf:tctaaacgaacaacaaatcggca;
[0364]
gmdmpr:cgaccttaaacctgtcgtct。
[0365]
每个t0代转基因大豆植株叶片至少挑取10个以上的正确单克隆进行sanger测序,根据测序结果分别与野生型大豆威廉姆斯82的gmdmp1基因和gmdmp2基因进行比对。根据以下原则分别对各个gmdmp的基因型进行鉴定。
[0366]
野生型大豆威廉姆斯82的gmdmp1基因和gmdmp2基因靶点外的序列间存在snp(表9),具体根据snp可以区分单克隆的序列是来源于gmdmp1基因还是gmdmp2基因。根据以下原则确定gmdmp基因突变情况。
[0367]
表9、gmdmp1基因和gmdmp2基因靶点外的序列间snp表
[0368]
snp的位置gmdmp1基因(序列43)gmdmp2基因(序列45)58cg77tc90ca396ct
[0369]
若所有单克隆都与野生型威廉姆斯82的gmdmp基因序列相同,则该株系的基因型为野生型,即gmdmp基因序列没有发生突变;若部分单克隆与野生型威廉姆斯82的gmdmp基因序列不同,则该株系的基因型为杂合基因型(2条同源染色体中的1条染色体上的ghdmp基因突变,且另1条染色体上的ghdmp基因未突变),该株系为t0代转基因大豆杂合突变型株系;若所有单克隆与野生型威廉姆斯82的gmdmp基因序列不同,则该株系的基因型为纯合基因型(2条同源染色体上的gmdmp基因发生突变),该株系为t0代转基因大豆纯合突变型株系。
[0370]
5、t1代转基因大豆的基因型鉴定
[0371]
将步骤4获得的t0代转基因大豆gmdmp基因突变株系自交,收获种子后再播种,得到t1代转基因大豆。鉴定t1代转基因大豆的gmdmp基因的基因型,具体方法如下:以t1代转基因大豆的基因组dna为模板,分别利用gmdmp1和gmdmp2基因的突变序列检测引物按照步
骤4中的方法鉴定t1代转基因大豆gmdmp1和gmdmp2基因的基因型。
[0372]
最终获得t1代转基因大豆gmdmp基因突变纯合株系gmdmp-1和gmdmp-2。具体突变情况如下:
[0373]
t1代转基因大豆gmdmp基因突变纯合型株系gmdmp-1与野生型威廉姆斯82的基因组dna的差异仅在于在编码gmdmp1的基因的两条同源染色体上均发生了226bp片段缺失和2个碱基缺失,缺失片段和缺失碱基分别位于序列43第85-310位和第367-368位,且在编码gmdmp2的基因的两条同源染色体上均发生了192bp片段缺失,该缺失片段位于序列45第175-366位。
[0374]
t1代转基因大豆gmdmp基因突变纯合型株系gmdmp-2与野生型威廉姆斯82的基因组dna的差异仅在于在编码gmdmp1的基因的两条同源染色体上均发生了267bp片段缺失,该缺失片段位于序列43第101-367位,且在编码gmdmp2的基因的两条同源染色体上均发生了195bp片段缺失,该缺失片段位于序列45第171-365位。
[0375]
取上述t1代转基因大豆突变株系用于下述单倍体诱导能力分析实验。
[0376]
二、gmdmp基因敲除的大豆突变体在诱导产生单倍体中的应用
[0377]
(一)gmdmp基因敲除的大豆突变体的单倍体自交诱导能力鉴定
[0378]
t1代转基因大豆gmdmp基因突变纯合型株系gmdmp-1和gmdmp-2自交后代中均出现大量败育的种子(图4a),这表明敲除gmdmp基因影响了正常双受精,有可能诱导单倍体产生。由于野生大豆威廉姆斯82为纯合的自交系,在此背景上敲除gmdmp基因所获得突变体自交后代无法通过分子标记去鉴定单倍体。因此,将gmdmp基因所获得不同类型组合的突变体自交所获得的种子种植,用如下方法对自交后代进行单倍体鉴别。
[0379]
1、植株表型鉴别
[0380]
将自交种子种植后,观察单株表型,单倍体具有植株矮小,叶片较窄,且上冲,株型紧凑,雄性不育等特征,二倍体则表现为植株高大,叶片宽大,披散,育性正常(图4b)。
[0381]
2、流式细胞检测叶片鉴别
[0382]
将上述步骤1中获得的表现为单倍体性状植株进行流式细胞检测,具体方法如下:提取待测植株幼嫩叶片的细胞核,以二倍体大豆叶片作为对照;再用流式细胞仪器检测信号,首先检测二倍体细胞核信号,并将二倍体细胞核信号峰位设为100(由于二倍体细胞内的遗传物质是单倍体细胞内遗传物质的两倍,因此,单倍体细胞核信号峰位在50附近出现)。若待测植株细胞核信号峰出现在50附近,则认为该待测植株为单倍体。若待测植株的信号峰出现在100附近,则认为其与二倍体细胞核信号强度富集位置相同,该待测植株为二倍体。
[0383]
gmdmp基因突变纯合型株系自交的后代单株中,若按照上述2种方法鉴定结果均为单倍体,则该植株为单倍体植株;若上述任一种方法鉴定结果不为单倍体,则该植株不为单倍体植株。
[0384]
统计上述鉴定结果并按照如下公式计算单倍体诱导率:单倍体诱导率(%)=(单倍体株数/总株数)
×
100。从表10中可以看出,gmdmp基因突变后,在自交后代中可获得单倍体。
[0385]
表10、gmdmp突变体自交后代中单倍体诱导率统计
[0386]
基因型总株数单倍体株数单倍体诱导率(%)
wt20500gmdmp-113510.74gmdmp-29311.1
[0387]
注:wt为大豆野生型材料威廉姆斯82。
[0388]
(二)gmdmp基因敲除的大豆突变体的单倍体杂交诱导能力鉴定
[0389]
将gmdmp基因所获得不同类型组合的突变体分别与野生型威廉姆斯82进行杂交获得后代,通过如下方法对后代中的单倍体进行鉴别。
[0390]
1、荧光标记鉴别
[0391]
crispr/cas9载体上携带启动子atoleo1驱动tagrfp(entacmaea quadricolor)的表达元件。由于启动子atoleo1在成熟的种子胚中特异表达,可通过荧光灯对tagrfp的荧光信号进行观察。因此,用携带该表达元件的突变体为父本与其它不携带荧光的母本材料杂交,所得到的种子中,二倍体种子的胚由于具有父本的基因组而表现出红色荧光,而单倍体种子的胚由于来源于母本而表现为弱荧光。
[0392]
2、分子标记鉴别
[0393]
将上述步骤1鉴定出的弱荧光的种子进一步种植,提取其基因组dna,采用野生型威廉姆斯82和转基因大豆突变株系间多态性引物(gmdmpf gmdmpr)进行pcr扩增,并将扩增产物进行琼脂糖带型检测,若待测单株的扩增产物表现为1条带,认为该单株条带为野生型威廉姆斯82材料带型,不存在父本材料的带型,则该单株是单倍体。若待测单株的扩增产物表现为2条带,认为该单株条带为野生型威廉姆斯82和转基因大豆突变株系杂合带型,则该单株是正常杂交的后代,是二倍体。
[0394]
3、植株表型鉴别
[0395]
对上述步骤2鉴定出的植株进一步观察其表型,单倍体具有植株矮小,叶片较窄,且上冲,株型紧凑,雄性不育等特征,二倍体则表现为植株高大,叶片宽大,披散,育性正常(图4b)。
[0396]
4、流式细胞检测叶片鉴别
[0397]
将上述步骤3中获得的表现为单倍体性状植株进行流式细胞检测,具体方法如下:提取待测植株幼嫩叶片的细胞核,以二倍体大豆叶片作为对照;再用流式细胞仪器检测信号,首先检测二倍体细胞核信号,并将二倍体细胞核信号峰位设为100(由于二倍体细胞内的遗传物质是单倍体细胞内遗传物质的两倍,因此,单倍体细胞核信号峰位在50附近出现)。若待测植株细胞核信号峰出现在50附近,则认为该待测植株为单倍体。若待测植株的信号峰出现在100附近,则认为其与二倍体细胞核信号强度富集位置相同,该待测植株为二倍体。
[0398]
gmdmp基因突变纯合型株系与野生型威廉姆斯82杂交的后代单株中,若按照上述4种方法鉴定结果均为单倍体,则该植株为单倍体植株;若上述任一种方法鉴定结果不为单倍体,则该植株不为单倍体植株。
[0399]
统计上述鉴定结果并按照如下公式计算单倍体诱导率:单倍体诱导率(%)=(单倍体株数/总株数)
×
100。从表11中可以看出,gmdmp基因突变后与其他材料杂交,在后代中可获得单倍体。
[0400]
表11、gmdmp突变体杂交后代中单倍体诱导率统计
[0401]
基因型总株数单倍体株数单倍体诱导率(%)威廉姆斯82
×
wt10600威廉姆斯82
×
gmdmp-19311.1威廉姆斯82
×
gmdmp-212110.83
[0402]
注:wt为大豆野生型材料威廉姆斯82。
[0403]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。