1.本发明属于基因工程技术领域,尤其是一种突变型水杨酸脱羧酶sdc-p191a和sdc-y64t在银杏酸降解中的应用。
背景技术:
2.白果既是一种中药,其中含有多种活性成分,通常用来止咳、润肺、祛痰、治带浊和缩小便等,还用于肺结核等的治疗;又是一种保健食品,可以养生,曾被推崇为皇家贡品,深受人们喜爱。
3.在现代的研究中发现,白果中含有较多的亚油酸,它对高血脂和高血压都有一定的改善作用,而且可以防止心血管疾病,同时还可以在一定程度上毒杀癌细胞的培养物;有研究发现白果中维生素e的存在可以加强人体抗氧化和清除自由基的能力,同时也对细胞膜有一定的保护作用,还可以延长红细胞的存活时间;也有研究证明白果中的β-胡萝卜素对脂质有极强的抗氧化性,同时还可以起到预防癌症、心血管疾病和白内障的作用;而白果蛋白的存在,使白果具有以下特性:(1)抗氧化、抗衰老;(2)增加体内的血清溶血素;(3)提高人体抗辐射损伤的功能、造血功能和体内免疫功能;(4)对羟基自由基和超氧阴离子等的体外活性氧有较强的清除功能;(5)对dna损伤有一定的保护作用。尽管白果有很强的医用和食用价值,并且不断有研究人员对其进行研究,但白果的利用率依然很低,这是由于其中有毒成分——银杏酸得不到很好的处理,因而严重限制了白果的开发和利用。因此,去除白果中的有毒物质银杏酸成为当今研究中的一大热点。
4.有关银杏酸的提取测定方法的报道已有很多,脱羧降解银杏酸是其中一种重要手段,且已有生物研究方法表明来自丝孢酵母的水杨酸脱羧酶(sdc)对银杏酸具有脱羧降解功能,可使银杏酸脱羧为无毒产物,但之前的研究表明野生型水杨酸脱羧酶降解银杏酸的性能较低。因此,本发明选取部分突变位点,利用定点突变技术对水杨酸脱羧酶进行定向改造,以研究能够高效降解银杏酸的新型菌株。这对于我国特有银杏资源的开发利用、银杏产品的安全生产以及降低生产成本等都具有重要意义。
5.通过检索,发现如下一篇与本发明专利申请相关的专利公开文献:
6.1、一种水杨酸脱羧酶降解银杏酸的应用(cn104770624a),所述酶的基因序列如序列1所述,该酶为水杨酸脱羧酶(sdc),含有sdc的pet21a( )-sdc/e.coli-bl21(de3)的细胞破碎液可明显降低银杏酸的含量,本发明的酶可以在较广的温度和ph范围内发挥对银杏酸的降解作用,为银杏中取出银杏酸提供更加快捷便利的方法,为银杏的广泛利用提供更多可能性。
7.通过对比,上述公开文献为野生型sdc对银杏酸的降解,但其降解能力相对较低,本发明以pcr技术为基础,选择部分位点对野生型sdc进行突变改造,获得两株相较于野生型sdc具有高降解银杏酸能力的突变菌株。因此,本发明专利申请与上述专利公开文献存在本质的不同。
技术实现要素:
8.本发明的目的在于克服现有技术的不足之处,提供一种突变型水杨酸脱羧酶sdc-p191a和sdc-y64t在银杏酸降解中的应用。
9.本发明解决技术问题所采用的技术方案是:
10.一种高效降解银杏酸的突变型水杨酸脱羧酶,所述突变型水杨酸脱羧酶为突变酶sdc-p191a和/或突变酶sdc-y64;
11.所述突变酶sdc-p191a是氨基酸序列为seq id no.1的水杨酸脱羧酶sdc的第191位氨基酸由脯氨酸改变为丙氨酸,所述突变酶sdc-p191a的氨基酸序列如seq id no.2所示;所述突变酶sdc-y64t氨基酸序列为seq id no.1的水杨酸脱羧酶sdc的第64位氨基酸由酪氨酸改变为苏氨酸,所述突变酶sdc-y64t的氨基酸序列如seq id no.3所示。
12.进一步地,所述突变酶sdc-p191a最适作用ph为5.5,最适作用温度为50℃,且4h后仍具有降解银杏酸的活性,与野生型sdc相比其温度稳定性稍有提高,且与未突变的野生型sdc相比,其银杏酸的降解能力提高了116.74%。
13.进一步地,所述突变酶sdc-y64t最适作用ph为5.5,最适作用温度为40℃,比野生型sdc最适作用温度降低了10℃,在40℃下能够在1-4h内内保持较强的银杏酸降解能力;且与未突变的野生型sdc相比,其银杏酸的降解能力提高了105.18%。
14.编码如上所述的高效降解银杏酸的突变型水杨酸脱羧酶的基因,所述突变酶sdc-p191a基因的核苷酸序列如seq id no.4所示,所述突变酶sdc-y64t基因的核苷酸序列如seq id no.5所示。
15.用于在宿主细胞内表达如权利要求1至3任一项所述的突变型水杨酸脱羧酶的重组质粒,所述重组质粒为适于在大肠杆菌中表达的载体。
16.进一步地,所述重组质粒为含有seq id no.4和/或seq id no.5的基因。
17.一种包括如上所述的重组质粒的突变工程菌株。
18.进一步地,所述突变工程菌株是以大肠杆菌e.coli bl21(de3)为宿主菌,将对应的重组质粒转化到宿主菌后得到的重组菌。
19.如上所述的突变型水杨酸脱羧酶在高效降解银杏酸中的应用。
20.进一步地,所述银杏酸是指一类2-羟基-6-烷基苯甲酸类化合物,具体为银杏酸r=c13:0、银杏酸r=c15:0、银杏酸r=c15:1、银杏酸r=c17:1、银杏酸r=c17:2。
21.本发明取得的有益效果是:
22.1、本发明选择部分氨基酸进行定点突变,并成功构建得到两种突变型水杨酸脱羧酶sdc-p191a和sdc-y64t,得到了两株相较于野生型sdc高效降解银杏酸的突变酶sdc-p191a和sdc-y64t。
23.通过将191位的脯氨酸改变为丙氨酸,成功构建得到突变酶sdc-p191a,该突变酶最适作用ph为5.5,最适作用温度为50℃,且4h后仍具有一定的降解银杏酸的活性,与野生型sdc相比其温度稳定性稍有提高,且与未突变的野生型sdc相比,其银杏酸的降解能力提高了116.74%。证明该突变酶对银杏酸的降解能力有所提高。
24.通过将64位的酪氨酸改变为苏氨酸,成功构建得到突变酶sdc-y64t,该突变酶最适作用ph为5.5,最适作用温度为40℃,比野生型sdc最适作用温度降低了10℃,在40℃下可在较长时间内保持较强的降解银杏酸的能力。且与未突变的野生型sdc相比,其银杏酸的降
解能力提高了105.18%。证明该酶对银杏酸的降解能力有所提高。
附图说明
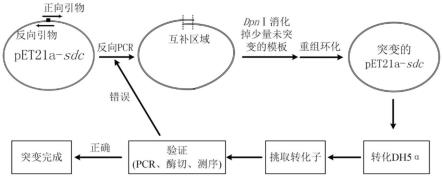
25.图1为本发明中定点突变路线图;
26.图2为本发明中基因sdc和突变基因的序列比对图;
27.图3为本发明中突变酶的sds-page结果图;其中,m为蛋白分子量标准,control为对照菌株诱导后的粗酶,p-sdc为野生型菌株诱导后的粗酶,p-y64t为突变菌株y64t诱导后的粗酶,p-p191a为突变菌株p191a诱导后的粗酶;
28.图4为本发明中野生型sdc和突变sdc对银杏酸的脱羧性能检测图;
29.图5为本发明中不同温度下sdc及其突变酶的脱羧性能图;
30.图6为本发明中不同ph下sdc及其突变酶的脱羧性能图;
31.图7为本发明中温度对sdc及其突变酶的稳定性的影响图;其中,a:40℃;b:50℃;
32.图8为本发明中突变质粒的pcr鉴定图;
33.图9为本发明中突变质粒的双酶切鉴定图。
具体实施方式
34.为更好理解本发明,下面结合实施例对本发明做进一步地详细说明,但是本发明要求保护的范围并不局限于实施例所表示的范围。
35.本发明中所使用的的原料,如无特殊说明,均为常规市售产品,本发明中所使用的方法,如无特殊说明,均为本领域常规方法,本发明所使用的各物质质量均为常规使用质量。
36.一种高效降解银杏酸的突变型水杨酸脱羧酶,所述突变型水杨酸脱羧酶为突变酶sdc-p191a和/或突变酶sdc-y64;
37.所述突变酶sdc-p191a是氨基酸序列为seq id no.1的水杨酸脱羧酶sdc的第191位氨基酸由脯氨酸改变为丙氨酸,所述突变酶sdc-p191a的氨基酸序列如seq id no.2所示;所述突变酶sdc-y64t氨基酸序列为seq id no.1的水杨酸脱羧酶sdc的第64位氨基酸由酪氨酸改变为苏氨酸,所述突变酶sdc-y64t的氨基酸序列如seq id no.3所示。
38.较优地,所述突变酶sdc-p191a最适作用ph为5.5,最适作用温度为50℃,且4h后仍具有降解银杏酸的活性,与野生型sdc相比其温度稳定性稍有提高,且与未突变的野生型sdc相比,其银杏酸的降解能力提高了116.74%。
39.较优地,所述突变酶sdc-y64t最适作用ph为5.5,最适作用温度为40℃,比野生型sdc最适作用温度降低了10℃,在40℃下可在1-4h内内保持较强的银杏酸降解能力;且与未突变的野生型sdc相比,其银杏酸的降解能力提高了105.18%。
40.编码如上所述的高效降解银杏酸的突变型水杨酸脱羧酶的基因,所述突变酶sdc-p191a基因的核苷酸序列如seq id no.4所示,所述突变酶sdc-y64t基因的核苷酸序列如seq id no.5所示。
41.用于在宿主细胞内表达如权利要求1至3任一项所述的突变型水杨酸脱羧酶的重组质粒,所述重组质粒为适于在大肠杆菌中表达的载体。
42.较优地,所述重组质粒为含有seq id no.4和/或seq id no.5的基因。
43.一种包括如上所述的重组质粒的突变工程菌株。
44.较优地,所述突变工程菌株是以大肠杆菌e.coli bl21(de3)为宿主菌,将对应的重组质粒转化到宿主菌后得到的重组菌。
45.如上所述的突变型水杨酸脱羧酶在高效降解银杏酸中的应用。
46.较优地,所述银杏酸是指一类2-羟基-6-烷基苯甲酸类化合物,具体为银杏酸r=c13:0、银杏酸r=c15:0、银杏酸r=c15:1、银杏酸r=c17:1)、银杏酸r=c17:2。
47.具体地,相关的制备及检测如下:
48.本发明从丝孢酵母中提取了sdc基因,采用基于pcr的反向pcr改造方法,以质粒pet21a-sdc为模板,设计一对部分碱基反向互补的引物,经过一次pcr反应完成突变过程,使用dpnⅰ将残留的少量的模板消化,然后进行重组环化,经转化、筛选,最后对突变质粒进行验证。得到突变完成的突变菌株。突变流程如图1所示。
49.之后使用pet21a作为突变sdc基因的表达载体,e.coil-bl21(de3)作为宿主菌。构建各个pet21a-sdc突变质粒,并在e.coli bl21(de3)中进行表达,以未突变的pet21a-sdc表达蛋白作为对照,进行蛋白表达及酶活性测定,研究经定点突变后的sdc酶的活性和酶学性质的变化情况。
50.其中,银杏酸是指一类2-羟基-6-烷基苯甲酸类化合物,包括银杏酸(r=c13:0)、银杏酸(r=c15:0)、银杏酸(r=c15:1)银杏酸(r=c17:1)银杏酸(r=c17:2)等。
[0051][0052]
具体操作方式及步骤如下:
[0053]
1、确定突变位点:本发明共确定如图4所示的32个突变位点。
[0054]
2、构建突变质粒:本发明按照图1定点突变路线图构建定点突变质粒,主要包括三个步骤。
[0055]
(1)反向pcr扩增,以本实验室构建好的质粒pet21a( )-sdc为模板(本发明中简称为pet21a-sdc),分别使用表1中的突变引物进行反向pcr(表中只给出了本发明中最终确定的几株菌株的构建引物。),反应结束后,取2μl扩增产物进行1%琼脂糖凝胶电泳检测,结果如图8所示。结果验证正确,则进行下一步。
[0056]
(2)模板质粒的去除
[0057]
pcr扩增反应结束后,为了防止少量剩余的模板质粒影响后期的筛选,在进行下一步之前必须使用限制性内切酶dpnⅰ消化去除,以免形成假阳性转化子。取上述pcr扩增产物,按表2配制反应体系,混合均匀后,37℃消化10min。
[0058]
(3)重组反应
[0059]
经pcr介导的定点突变产物是线性的,需要用t4连接酶进行环化后,才可以用于突
变子的筛选,反应体系见表3,将各成分混匀后,置22℃金属浴中孵育1h,将管壁上的溶液瞬间离心收集到管底,70℃孵育5min使t4连接酶失活,终产物可以直接用于转化或保存于-20℃备用。
[0060]
为了提高突变反应的成功率,在保证反向pcr能够正确地对质粒进行扩增的前提下,尽可能减少模板质粒的使用量。dpnⅰ消化产物经1%的琼脂糖电泳检测,检测结果均与图8结果一致,条带大小正确。如果几乎没有杂带,说明产物扩增特异,则可直接用于后续的重组环化,若杂带较多,则需要先将目的条带进行纯化,纯化操作参照生工生物dna胶回收试剂盒说明书进行。
[0061]
3、菌落验证与测序:利用化学转化法将重组连接产物转入e.coli dh5α中;从转化后的平板上随机挑取3-5个转化子,接种到约5ml含amp(100μg
·
ml-1
)的lb液体培养基中,37℃,180rpm摇床振荡培养12-16h,收集培养物用于质粒提取,对提取的各个突变质粒分别进行pcr和酶切鉴定,以检测突变质粒中是否含有相应大小的目的基因片段。将pcr和双酶切鉴定均正确的突变质粒送样测序。
[0062]
4、导入受体细胞:将成功进行定点突变的质粒通过化学转化法转化到e.coli bl21(de3)中,构建突变sdc基因表达菌株,命名格式为“p-突变名”,同时,将pet21a空质粒和未突变的pet21a-sdc质粒也转化入e.coli bl21(de3)中作为对照,分别命名为p-control和p-sdc。并进行pcr验证及酶切验证,酶切验证结果如图9所示。
[0063]
5、蛋白诱导表达:将突变菌株接种于amp浓度为100μg
·
ml-1
的lb液体培养基中,37℃,160rpm的转速条件下摇床培养12h作为种子液;将种子液按1%的比例接种于新的amp浓度为100μg
·
ml-1
的lb液体培养基中,37℃、160rpm培养大约4h,使其od600到达约0.6,加入iptg使其终浓度为0.1mm,在25℃、120rpm的条件下诱导18h。
[0064]
6、制备粗酶液:培养液经5000rpm、4℃离心l0 min,收集菌体,然后用超声破碎缓冲液重悬,在冰浴中进行超声破碎,超声条件为:功率40%,工作3s,间歇7s,总超声时间为10min。破碎后的细胞破碎液在4℃、14000rpm的条件下离心15min,上清即为粗酶液。
[0065]
7、突变酶sds-page分析:对得到的粗酶液进行sds-page分析,结果是野生sdc和各个突变sdc均有一条大小约为40kda的条带,与经predictprotein预测的水杨酸脱羧酶的理论分子量39.9kda一致。因为每个突变酶的大小均是一致的,在图3中仅显示未突变的sdc和其中两个突变sdc酶的sds-page结果。
[0066]
8、制备标品:准确称取标准品银杏酸a和银杏酸b各1.0mg,用10ml甲醇溶解,按a:b为1:2的体积比混匀,即为浓度为0.1mg
·
ml-1
的银杏总酸标准溶液。
[0067]
9、底物与酶液反应:取粗酶液1ml,与2ml的pbs缓冲液混匀,反应体系总体积为4ml,其中银杏酸的量为0.1mg
·
ml-1
,调ph 5.5,通氧5min,在40℃条件下反应4h,加入100μl 12m hcl终止反应。
[0068]
10、制样与检测:反应结束后真空冷冻干燥至恒重,加入甲醇溶解,0.22μm滤膜过滤后,用hplc检测银杏酸的含量。
[0069]
11、酶活性的测定:突变对酶活性影响各不同,结果如图4所示,突变酶sdc-e8a、sdc-h169a、sdc-h224a和sdc-d298a对银杏酸几乎没有降解能力,而突变菌株sdc-y64t和sdc-p191a的酶活性增加明显,突变菌株sdc-y64t和sdc-p191a与野生型sdc碱基序列变化如图2所示。
[0070]
12、对酶活有明显增加的突变酶sdc-p191a和突变酶sdc-y64t进行纯化,然后对突变酶进行最适ph(图6)、最适温度(图5)以及温度稳定性(图7)测定:sdc-p191a和sdc-y64t突变酶在最适ph5.5,最适温度40℃的条件下,与未突变的野生型sdc相比,对银杏酸的降解能力分别提高了116.74%和105.18%。
[0071]
表1
[0072][0073]
表2
[0074][0075]
表3
[0076][0077]
丝孢酵母中的水杨酸脱羧酶sdc:
[0078]
[0079][0080]
突变酶sdc-p191a:
[0081][0082]
[0083]
突变酶sdc-y64t:
[0084]
[0085][0086]
突变酶sdc-p191a基因的核苷酸序列:
[0087][0088][0089]
突变酶sdc-y64t基因的核苷酸序列:
[0090][0091]
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。