1.本发明涉及细胞生物学领域,尤其涉及一种基因转染方法和基因转染装置。
背景技术:
2.转染,指将外源遗传物质(dna或rna)引入真核细胞内部并表达其特有功能的过程。基因转染方法可被分为病毒载体方法和非病毒载体方法两大类。病毒载体利用其将dna片段注入宿主细胞的能力来实现基因转染,希望被递送的基因需要事先被包装到复制缺陷型病毒颗粒中,目前所使用的病毒包括逆转录病毒、慢病毒、腺病毒、腺相关病毒和单纯疱疹病毒等。然而,病毒载体只能转染分子量较小的dna片段,且制备过程复杂,成本高昂,并且存在随机插入位点、细胞毒性和诱发基因突变等风险。非病毒载体方法既包括化学方法,如脂质体转染、聚合物转染等,也包括物理方法,如电穿孔、声穿孔、光穿孔、显微注射、机械压迫等。化学方法中,以lipofectamine
tm
2000试剂的应用范围最广,是脂质体转染技术的代表。但是,它存在一旦进入体内很难排出体外的弊端,并有可能产生生物毒性或免疫反应。物理方法中,以电穿孔技术的应用最为广泛,被认为是所有转染技术中心转染能力最强的,可以转染多种极难转染的原代细胞(如免疫细胞、干细胞、神经细胞等)。但其采用高能量电场作用于活体细胞,具有较高的细胞伤害性,极易出现细胞存活率低或细胞失能等问题,极大地限制了其进一步拓展应用范围。因此,探索更加经济、易操控、低毒性和高转染效率的新型基因转染技术仍至关重要。
3.目前,最常用的非病毒载体基因转染方法是电穿孔技术和阳离子脂质体lipofectamine
tm
2000技术。基于超声的声穿孔技术也见于报道,但大都需要依赖微米级的超声微泡来实现。同时,部分基于热效应的光热穿孔技术也被提出,但需要使用金属纳米颗粒来实现。
4.此前,本团队申请了一种基因转染系统及方法(申请号为:cn201810831296.x),该方法利用超声发生器件产生的热效应,通过超声波的强度建立温度梯度,不同的温度梯度产生不同的热效应,进而令受体细胞产生热穿孔。但是,仅利用热效应进行基因转染存在转染率低和细胞存活率低的缺点。
技术实现要素:
5.本发明的目的在于克服现有技术存在的上述缺陷,提供一种基因转染方法和基因转染装置,可以提升基因转染率和细胞存活率。
6.本发明第一方面保护一种基因转染方法,包括以下过程:
7.提供超声发生器件和热发生器件,所述超声发生器件能发出超声波,所述热发生器件能直接对待转染生物体系加热;所述超声波和所述热发生器件同时激励所述待转染生物体系发生转染。
8.本发明第二方面保护一种基因转染装置,包括超声发生器件、热发生器件、转染容器和衬底,所述转染容器用于存储待转染生物体系,所述超声发生器件和所述热发生器件
均设置在所述衬底上,所述超声发生器件和所述热发生器件均与所述转染容器相连接;
9.所述超声发生器件能产生超声波,所述超声波能作用在所述转染容器上;
10.所述热发生器件能对所述转染容器加热,所述超声波和所述热发生器同时作用在所述转染容器上,使所述转染容器内的所述待转染生物体系发生转染。
11.实施本发明实施例,将具有如下有益效果:
12.本发明通过设置超声发生器件和热发生器件,使超声波和热量复合作用在待转染生物体系上,对待转染生物体系产生包括力学效应、空化效应、微流体效应等多种效应的复合作用,进一步缩短细胞转染所需的时间,对细胞造成更少的伤害,从而提高其转染后的存活率。本发明可实现无需微泡参与,兼具高转染效率和高细胞存活率的基因转染。
附图说明
13.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
14.其中:
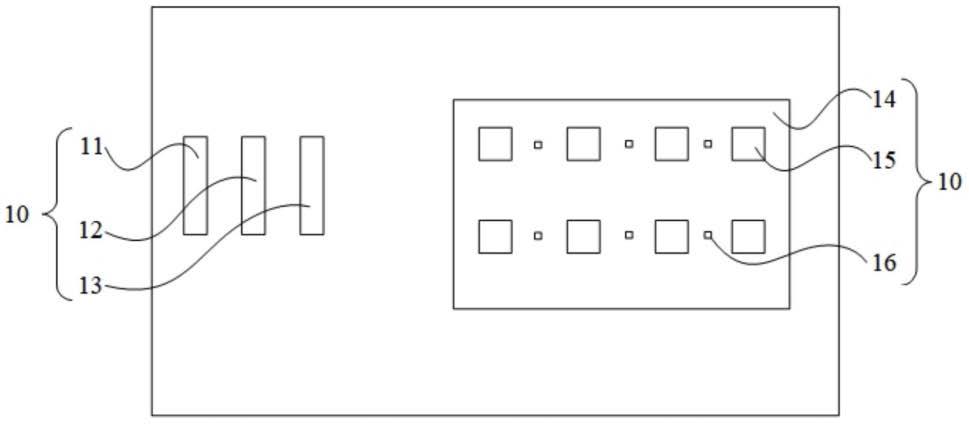
15.图1为本发明一具体实施例的结构示意图。
16.图2为本发明一具体实施例中超声发生器件的结构示意图。
17.图3为本发明一具体实施例中热发生器件的结构示意图。
18.图4为本发明中装置工作的流程示意图。
19.图中,10、基因转染装置;11、主控模块;12、信号发生模块;13、功率放大模块;14、衬底;15、超声发生器件;16、热发生器件;17、容纳腔;151、压电基底;152、叉指焕能器。
具体实施方式
20.下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
21.参见图1,本发明第一方面公开了一种基因转染方法,包括以下过程:
22.步骤1:提供超声发生器件15和热发生器件16,超声发生器件15能发出超声波,热发生器件16能直接对待转染生物体系加热。
23.步骤2:超声波和热发生器件16同时激励待转染生物体系发生转染。
24.超声波和热同时作用在待转染生物体系上,可以有效激励待转染生物体系。
25.本发明通过设置超声发生器件15和热发生器件16,使超声波和热复合作用在待转染生物体系上,对待转染生物体系产生包括力学效应、空化效应、微流体效应等多种效应的复合作用,进一步缩短细胞转染所需的时间,对细胞造成更少的伤害,从而提高其转染后的存活率。本发明可实现无需微泡参与,兼具高转染效率和高细胞存活率的基因转染。
26.待转染生物体系包括待转染细胞、培养待转染细胞的培养基和待转入至待转染细胞的基因物质(如dna质粒或mrna等)。待转染生物体系在超声波的作用下能产生膨胀、收
缩、振荡、崩溃等物理过程,所引起的冲击波、微激流等效应可以导致待转染细胞的细胞膜表面产生孔状结构,待转入的药物和基因物质从孔状结构进入,当超声波的参数合适时,停止超声波作用后细胞膜的结构可以完全恢复,待转染细胞可继续存活,表示转染成功,为可逆穿孔,否则为不可逆穿孔,不可逆穿孔可导致细胞死亡。同样,待转染生物体系在热的作用下受体细胞能产生热穿孔效应,从而改变受体细胞膜的通透性,提高质粒进入受体细胞中的成功率,使得基因转染的效率变高,当温度合适时,停止热作用后细胞膜的结构可以完全恢复,待转染细胞可继续存活,表示转染成功,为可逆穿孔,否则为不可逆穿孔,不可逆穿孔可导致细胞死亡。
27.声场的时间和空间分布可以通过调整各超声波的幅值、波形、占空比、激励时间等参数以及调整各超声波的排列方式来实现。
28.热发生器件16可以选择为微电阻丝加热器,热量的分布可以通过精密设计微电阻丝加热器的形状和排列方式,进而获得适合基因转染需要的升温能力和精细的温度调控能力。比如,将数微米宽的金属丝盘绕成环形。
29.在一个具体实施例中,作用在待转染生物体系的超声波的具体参数包括幅值、占空比和单次激励信号长度,其中幅值为15v~55v、占空比为25%~75%、单次激励信号长度为1s~15s。作用在待转染生物体系的时间/空间平均温度为25℃~75℃。此数值范围的超声波和温度可以提升待转染生物体系的转染效率和细胞存活率。
30.参见图1,本发明第二方面公开了一种基因转染装置10,,包括超声发生器件15、热发生器件16、转染容器(图中未示出)和衬底14,超声发生器件15为超声表面波发生器或者超声体波发生器。热发生器件16选自电阻丝、薄膜或半导体等可以通电发热的物质。转染容器的形状和材质均不受限制,可以容纳待转染的生物体系即可。超声发生器件15和热发生器件16均设置在衬底14上,超声发生器件15和热发生器件16均与转染容器相连,超声发生器件15和热发生器件16可以同时设置在转染容器的底部,也可以同时设置在转染容器的侧壁,还可以分别设置在转染容器的底部和侧壁,具体根据待转染的细胞而选择不同的设置方式。
31.超声发生器件15能产生超声波,超声波能作用在转染容器上;
32.热发生器件16能对转染容器加热,超声波和热发生器件16同时作用在转染容器上,使转染容器内的待转染生物体系发生转染。单独设置超声波和单独设置一定的热量均可以提高细胞转染的效率和存活率,本发明通过复合超声波和热量进一步提升细胞转染效率和存活率。
33.参见图2,在一个具体实施例中,超声发生器件15包括压电基底151和叉指换能器152,压电基底151选自铌酸单晶、锆钛酸铅压电陶瓷(pzt)、氧化锌压电薄膜和氮化铝压电薄膜中的一种,为了获得较大的机电耦合系数,本实施例选用128
°
yx双面抛光的铌酸锂作为压电基底151。叉指换能器152接收激励信号驱动压电基底151振动,压电基底151振动带动转染容器振动,产生超声波。通常,在压电基底151上镀上叉指电极层,采用微纳加工技术,刻蚀叉指电极层形成叉指换能器152。通过设置适当的涂胶厚度、曝光时间、镀膜厚度及角度等加工工艺参数,以及选择合适的金属膜材料、指条对数、声孔径尺寸等器件结构参数,制备能够产生所需要的超声声表面波的叉指换能器152,使其发射频率、插入损耗、器件带宽等指标能够满足基因转染的需要。压电基底151设置在衬底14上;
34.叉指换能器152设置在压电基底151上,转染容器与压电基底151相连接,叉指换能器152驱动压电基底151振动,压电基底151产生超声波,所产生的超声波作用在转染容器上。
35.参见图2,在一个具体实施例中,超声发生器件15数量为两个以上,各超声发生器件15环绕待转染体系设置,热发生器件16设置在待转染体系下方,各超声发生器件15产生的超声波叠加作用在转染体系中,热发生器件16产生温度梯度场作用在转染体系中。
36.转染容器设置在超声发生器件15的上方,相邻超声发生器件15发出的超声波在热发生器件16所在区域叠加。这样,转染容器内既有叠加的超声波作用,又有热发生器件16加热作用,两种作用复合。
37.超声波叠加的区域为图中第一列至第三列的圆圈标记的位置。使超声发生器件15发出的超声波叠加后与热发生器件16共同作用在转染容器上。
38.参见图2和图4,在一个具体实施例中,超声发生器件15以矩阵排列的方式设置在衬底14上,每行超声发生器件15中,相邻的超声发生器件15之间设置有一个热发生器件16;
39.转染容器包括容器体,容器体上设有数个容纳腔17,容纳腔17与热发生器件16一一对应设置。
40.参见图1,在一个具体实施例中,还包括主控模块11和信号发生模块12,主控模块11与信号发生模块12电连接,信号发生模块12分别与超声发生器件15和热发生器件16电连接;主控模块11用于分别设定超声发生器件15的第一参数和热发生器件16的第二参数,第一参数具体可以是超声发生器件15产生的超声波的幅值、波形、占空比和激励时间等;;信号发生模块12用于根据第一参数产生第一激励信号,根据第二参数产生第二激励信号,并向超声发生器件15输出第一激励信号,向热发生器件16输出第二激励信号;
41.超声发生器件15将第一激励信号进行转换,产生超声波,热发生器件16将第二激励信号进行转换,对转染容器加热。
42.第一参数包括超声波的幅值、波形、占空比、单次激励信号长度和中心频率,超声波的幅值为0.001v-1000v;超声波的波形分别选自正弦波、方波、三角波、梯形波或不规则波形;超声波的占空比为0.001%-99.999%;超声波的单次激励信号长度为0.001s-100min;超声波的中心频率为0.001hz-1000mhz。
43.在一个具体实施例中,还包括功率放大模块13,功率放大模块13与信号发生模块12电连接,功率放大模块13还分别与超声发生器件15和热发生器件16电连接;功率放大模块13用于放大信号发生模块12发出的第一激励信号和第二激励信号。
44.参见图3,在一个具体实施例中,热发生器件16为微电阻丝,微电阻丝排列形成类回字型加热主体。
45.在一个具体实施例中,还包括频率检测模块和温度检测模块,频率检测模块和温度检测模块均设置在转染容器内,频率检测模块和温度检测模块均与主控模块电连接。频率检测模块检测转染容器内的超声波频率,并将超声波的频率的数值传输给主控模块11,温度检测模块检测转染容器内的温度,并将温度的数值传输给主控模块11。
46.以下为具体实施例。
47.实施例1
48.超声发生器件15的制作方法,包括如下步骤:
49.(1)涂胶:在完全清洗干净的压电基底151材料的表面,将正光刻胶az4620以5000rpm旋涂30s,涂胶后放置在120℃加热板上烘烤3min。利用台阶仪对光刻胶的厚度进行测试,光刻胶的厚度大概为5μm。
50.(2)曝光和显影:根据超声发生器件15中叉指换能器152的形状及结构,设计带有相应图案的菲林片。将菲林片覆盖光刻胶上方进行曝光,透光部分被固化,采用az400显影溶解非固化部分后放在150℃的加热板上烘烤10min。
51.(3)溅射:对已完成图形转移的基底片进行磁控溅射,使其表面形成厚度约为200nm的金属膜。
52.(4)去胶:将生长有金属膜的基底片放在丙酮溶液中,利用超声清洗机产生的超声波震荡来剥离光刻胶,完成微纳尺度超声发生器件15的制作。
53.热发生器件16的制作方法,包括如下步骤:
54.(1)涂胶:在完全清洗干净的压电基底151材料的表面,将正光刻胶az4620以5000rpm旋涂30s,涂胶后放置在120℃加热板上烘烤3min。利用台阶仪对光刻胶的厚度进行测试,光刻胶的厚度大概为5μm。
55.(2)曝光和显影:根据热发生器件16的形状及结构,设计带有相应图案的菲林片。将菲林片覆盖光刻胶上方进行曝光,透光部分被固化,采用az400显影溶解非固化部分后放在150℃的加热板上烘烤10min。
56.(3)溅射:对已完成图形转移的基底片进行磁控溅射,使其表面形成厚度约为200nm的金属膜。
57.(4)去胶:将生长有金属膜的基底片放在丙酮溶液中,利用超声清洗机产生的超声波震荡来剥离光刻胶,完成微纳尺度热发生器件16的制作。
58.根据上述制作方法,本实施例一次性在衬底14上完成多个超声发生器件15和热发生器件16的制作。这些超声发生器件15和热发生器件16的空间分布方式为处于同一水平面内,超声发生器件15所产生的超声波形成一个梯度声场区域,该区域与热发生器件16所产生的梯度温度场区域互相重合,转染容器被置于重合范围内,同时收到声场和温度场的作用,并因此最终实现细胞的基因转染效果。其中,两个超声发生器件15和一个热发生器件16为一组,每组超声发生器件15的距离为1.5cm。
59.本实施例中的主控模块11为计算机,在本实施例中,计算机设置第一参数,将信号传给信号发生模块12,信号发生模块12产生幅度为10mv,占空比为50%,长度为5秒,中心频率为24mhz的第一激励信号。信号发生模块12将第一激励信号发送给功率放大模块13,功率放大模块13为一台额定放大功率为2w的双通道数字功率放大器。功率放大模块13将上述低压正弦波信号放大为幅值为20v,其他参数与原信号一致的两个高压正弦波信号,并输出。这两个高压正弦波信号作为激励信号,被输出到超声发生器件15,分别激励其工作。超声发生器件15将其对应的激励信号进行转换,产生超声波。所发出的超声波,在位于两个超声发生器件16中间的区域发生相干叠加,形成梯度声场。
60.在本实施例中,计算机同时控制一台额定电流100ma的恒流电源,该电源的输出激励热发生器件16工作。热发生器件16在受到持续激励时,形成34℃~39℃的梯度温度场。
61.本实施例中还包括频率检测模块,采用时间门控电脉冲信号频率测量器件对上述正弦波信号的实际频率进行测量,并将频率读数反馈给计算机,由计算机判断是否需要调
整用来生成正弦波信号的参数。参数调整包括,略微增加或降低参数中的激励信号频率设置数值,以使正弦波激励信号的实际频率更接近超声发生器件15的固有中心频率。
62.本实施例中还包括温度检测模块,采用半导体温度传感器对温度场范围内的实际温度进行测量,并将温度读数反馈给计算机。
63.本实施例中的待转染生物体系包括作为转染目标的人类乳腺癌细胞mda-mb-231,以及作为转染物质的绿色荧光dna质粒。
64.对比例1
65.本对比例与实施例1相比仅使用热发生器件16,不使用超声发生器件15,其他条件与实施例1中相同。
66.对比例2
67.本对比例与实施例1相比仅使用超声发生器件15,不使用热发生器件16,其他条件与实施例1中相同。
68.对实施例1、对比例1和对比例2中的细胞转染效率和细胞存活率检测结果为:
69.实施例1中的细胞转染效率为95%,细胞存活率为90%。
70.对比例1中的细胞转染效率为10%,细胞存活率为97%。
71.对比例2中的细胞转染效率为80%,细胞存活率为93%。
72.上述结果可知,超发生声器件15和热发生器件16同时作用,显著增加细胞转染效率,同时具有较高的细胞存活率,性能优于单独设置超发生声器件15或单独设置热发生器件16。
73.以上所揭露的仅为本发明较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。