一种含n-oh键的
β-榄香烯衍生物及其制备方法和应用
技术领域
1.本发明属于β-榄香烯衍生物的制备及应用领域,具体涉及一种含n-oh键的β-榄香烯衍生物及其制备方法和应用。
背景技术:
2.榄香烯是从姜科植物温郁金中提取分离出来的倍半萜类化合物,具有广谱的抗肿瘤活性。目前,榄香烯口服乳/注射液已被国家批准为二类抗癌新药,并在临床上得到比较广泛地应用。然而由于其结构中只含有碳和氢两种元素,属于萜类挥发油,具有水溶性差,不易被机体吸收,生物利用度低及体外抑制肿瘤细胞增殖的活性有限等缺点,限制了其在临床上的最大应用。因此,对榄香烯中的主要活性成分(-)-β-榄香烯进行结构修饰以改善水溶性,提高生物活性及生物利用度,增强临床抗肿瘤的药效是非常有必要的。
3.据文献报道,β-榄香烯(β-elemene,简写为β-ele)的衍生化主要是通过烯丙位卤代合成β-榄香烯氯代物,再通过双分子亲核取代反应(sn2反应),在β-榄香烯骨架及其双键不受破坏的前提下,引入羟基、氨基等极性基团。目前,β-榄香烯衍生物根据取代基的不同大致分为胺类、酯类、氨基酸类、醚类、醇类、糖苷类及有机金属复合物等几大类。纵然关于β-榄香烯结构修饰的研究报道比较多,然而通过含n-oh键的β-榄香烯衍生物一直未曾报道,因此开展了此项研究工作。这一工作的开展:(1)有望搞清楚长期以来困惑人们的β-榄香烯的抗肿瘤机制;(2)有望开发出新一代的,抗肿瘤效果优于β-榄香烯的抗癌新药;(3)与以往只对β-榄香烯本身进行简单的结构修饰相比,本研究工作具有开创性。
技术实现要素:
4.本发明的第一个目的是针对现有技术的不足,提供一种含n-oh键的β-榄香烯衍生物。
5.含n-oh键的β-榄香烯衍生物,或其光学异构体、消旋体、单一对映异构体、可能的非对映异构体,或其药学上可接受的盐、前药、氘代衍生物、水合物、溶剂化物,其特征在于,所述衍生物的结构如式(i)所示:
[0006][0007]
式(i)中:
[0008]
n为0,1,2,3;
[0009]-l-键为
[0010]
为5-至10-元芳基、5-至10-元杂芳基;
[0011]
r1选自以下结构片段:氢、c
1-6
烷基、c
3-6
环烷基、5-10元的芳基、5-10元的杂芳基、-oc
1-6
烷基、-cf3、-cn、-nh2;
[0012]
若n为2,3时,相邻r1与0-3个杂原子构成一个环状结构,其中杂原子选自o、s、n。
[0013]
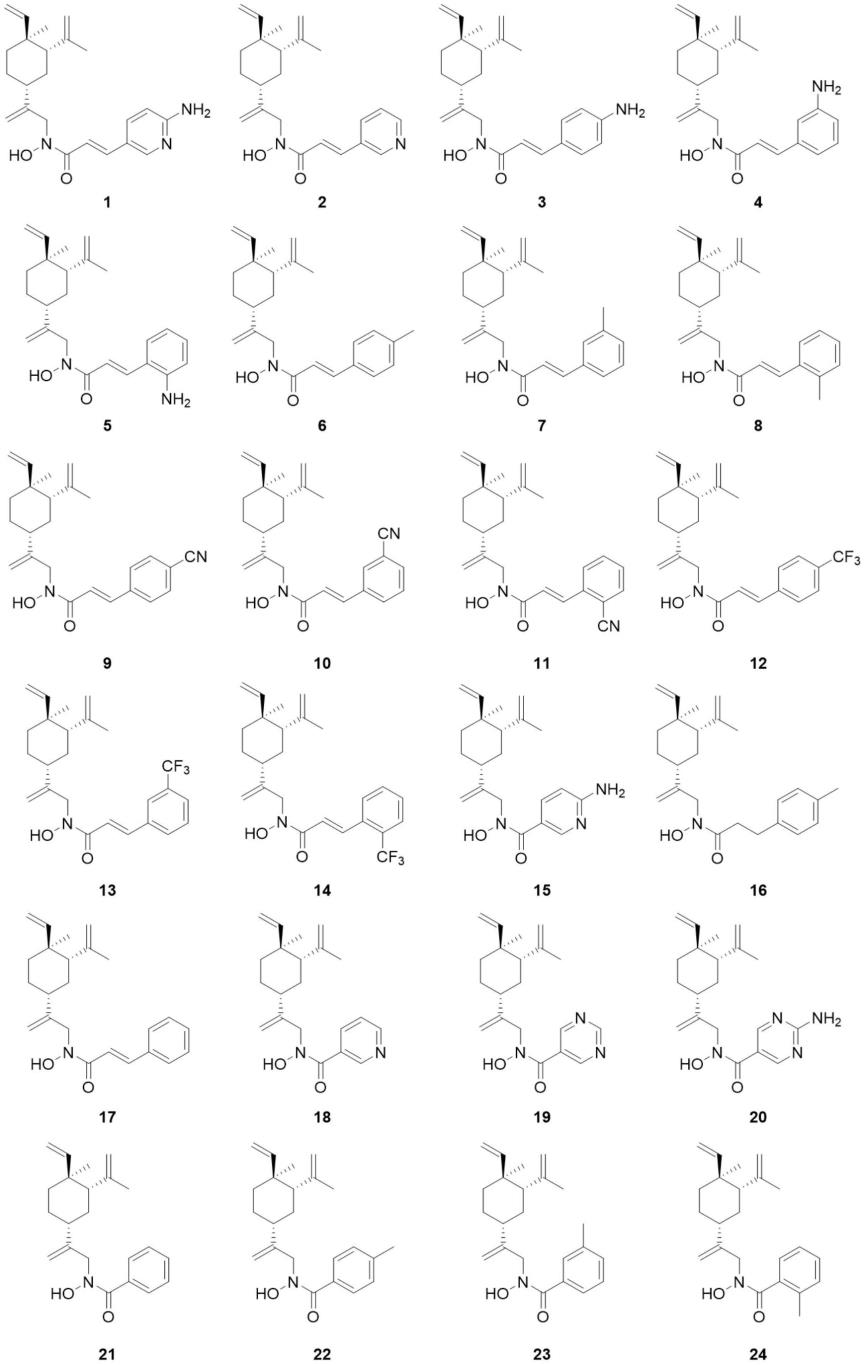
进一步地,所述含n-oh键的β-榄香烯衍生物为如下结构所示的化合物1~44中的任一种:
[0014]
[0015][0016]
本发明的第二个目的是提供含n-oh键的β-榄香烯衍生物的制备方法。
[0017]
对于式(i)结构的一类结构新颖的含n-oh键的β-榄香烯衍生物,其合成路线如下:
[0018][0019]
具体包括步骤:
[0020]
(1)首先将含有l、和r1结构片段的酸a-1与h2nothp(a-2)通过酰胺缩合反应,得到中间体a-3;
[0021]
(2)然后将β-榄香烯a-4进行烯丙位溴代反应得中间体β-榄香烯13位溴代产物a-5;
[0022]
(3)再将中间体a-3通过亲核取代反应连接到β-榄香烯13位溴代产物a-5上,得到中间体a-6;
[0023]
(4)最后对中间体a-6去保护,得终产物式(i)。
[0024]
本发明式(i)所示化合物可通过如上的方法制得,然而该方法的条件,如反应物、溶剂、所用化合物的量、反应温度、反应所需时间等不限于上面的解释。本发明化合物还可以任选将在本说明书中描述的或本领域已知的各种合成方法组合起来而方便的制得,这样的组合可由本发明所属领域的技术人员容易地进行。
[0025]
本发明合成路线的步骤(2)可采用现有技术,如公开号为cn110683932a中公开的方法。
[0026]
本发明的第三个目的是提供了所述的一类结构新颖的含n-oh键的β-榄香烯衍生物,或其光学异构体、消旋体、单一对映异构体、可能的非对映异构体,或其药学上可接受的盐、前药、氘代衍生物、水合物、溶剂化物在制备抗肿瘤药物中的应用。
[0027]
本发明的第四个目的是提供了一种抗肿瘤药物,含有安全有效量的所述的一类结构新颖的含n-oh键的β-榄香烯衍生物,或其光学异构体、消旋体、单一对映异构体、可能的非对映异构体,或其药学上可接受的盐、前药、氘代衍生物、水合物、溶剂化物。
[0028]
作为优选,所述抗肿瘤药物还可以包括药学上可以接受的载体。
[0029]
作为优选,所述应用和所述抗肿瘤药物中,所述肿瘤包括肺癌。
[0030]
由于本发明化合物具有抑制各种肿瘤细胞株增殖的活性,因此,本发明化合物及其各种晶型、药学上可接受的无机或有机盐、水合物或溶剂合物,以及含有本发明化合物为主要活性成分的药物组合物可用于治疗、预防以及缓解各种疾病,包括各种癌症。
[0031]
本发明的药物组合物包含安全有效量范围内的本发明化合物或其药理上可接受的盐及药理上可以接受的赋形剂或载体。其中“安全有效量”指的是:化合物的量足以明显改善病情,而不至于产生严重的副作用。通常,药物组合物含有1-2000mg本发明化合物/剂,更佳地,含有5-1000mg本发明化合物/剂。较佳地,所述的“一剂”为一个胶囊或药片。
[0032]“药学上可以接受的载体”指的是:一种或多种相容性固体或液体填料或凝胶物
质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。“相容性”在此指的是组合物中各组分能和本发明的化合物以及它们之间相互掺和,而不明显降低化合物的药效。药学上可以接受的载体部分例子有纤维素及其衍生物(如羧甲基纤维素钠、乙基纤维素钠、纤维素乙酸酯等)、明胶、滑石、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂(如)、润湿剂(如十二烷基硫酸钠)、着色剂、调味剂、稳定剂、抗氧化剂、防腐剂、无热原水等。
[0033]
本发明化合物或药物组合物的施用方式没有特别限制,代表性的施用方式包括(但并不限于):口服、瘤内、直肠、肠胃外(静脉内、肌肉内或皮下)和局部给药。
[0034]
用于口服给药的固体剂型包括胶囊剂、片剂、丸剂、散剂和颗粒剂。在这些固体剂型中,活性化合物与至少一种常规惰性赋形剂(或载体)混合,如柠檬酸钠或磷酸二钙,或与下述成分混合:(a)填料或增溶剂,如淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;(b)粘合剂,如羟甲基纤维素、藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和阿拉伯胶;(c)保湿剂,如甘油;(d)崩解剂,如琼脂、碳酸钙、马铃薯淀粉或木薯淀粉、藻酸、某些复合硅酸盐和碳酸钠;(e)缓溶剂,如石蜡;(f)吸收加速剂,如季胺化合物;(g)润湿剂,如鲸蜡醇和单硬脂酸甘油酯;(h)吸附剂,如高岭土;(i)润滑剂,如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠或其混合物。胶囊剂、片剂和丸剂中,剂型也可包含缓冲剂。
[0035]
固体剂型,如片剂、糖丸、胶囊剂、丸剂和颗粒剂可采用包衣和壳材制备,如肠衣和其它本领域公知的材料。它们可包含不透明剂,并且这种组合物中活性化合物或化合物的释放可以延迟的方式在消化道内的某一部位中释放。可采用的包埋组分的实例是聚合物质和蜡类物质。必要时,活性化合物也可与上述赋形剂中的一种或多种形成微胶囊形式。
[0036]
用于口服给药的液体剂型,包括药学上可接受的乳液、溶液、悬浮液、糖浆或酊剂。除了活性化合物外,液体剂型可包含本领域中常规采用的惰性稀释剂,如水或其它溶剂,增溶剂和乳化剂,如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、丙二醇、1,3-丁二醇、二甲基甲酰胺以及油,特别是棉籽油、花生油、玉米胚油、橄榄油、蓖麻油和芝麻油或这些物质的混合物等。
[0037]
除了这些惰性稀释剂外,组合物也可包含助剂,如润湿剂、乳化剂和悬浮剂、甜味剂、矫味剂和香料。
[0038]
除了活性化合物外,悬浮液可包含悬浮剂,如乙氧基化异十八烷醇、聚氧乙烯山梨醇和脱水山梨醇酯、微晶纤维素、甲醇铝和琼脂或这些物质的混合物等。
[0039]
用于肠胃外注射的组合物可包含生理上可接受的无菌含水或无水溶液、分散液、悬浮液或乳液和用于重新溶解成无菌的可注射溶液或分散液的无菌粉末。适宜的含水和非水载体、稀释剂、溶剂或赋形剂,包括水、乙醇、多元醇及其适宜的混合物。
[0040]
用于局部给药的本发明化合物的剂型包括软膏剂、散剂、贴剂、喷射剂和吸入剂。活性成分在无菌条件下与生理上可接受的载体及任何防腐剂、缓冲剂,或必要时可能需要推进剂一起混合。
[0041]
本发明化合物可以单独给药,或者与其他药学上可接受的化合物联合给药。
[0042]
使用药物组合物时,是将安全有效量的本发明化合物适用于需要治疗的哺乳动物(如人),其中施用时剂量为药学上认为的有效给药剂量,对于60kg体重的人而言,日给药剂量通常为1~5000mg,优选5~2000mg。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
[0043]
本发明与现有技术相比,主要优点包括:本发明提供了式(i)所示结构的一类结构新颖的含n-oh键的β-榄香烯衍生物、含有式(i)化合物的药物组合物及水合物,以及这些化合物的同位素衍生物、手性异构体、变构体、不同的盐、前药和制剂等。本发明还提供了所述一类结构新颖的含n-oh键的β-榄香烯衍生物的制备方法、用途,以及这些化合物对各种肿瘤细胞株增殖抑制的活性。本发明中的一类结构新颖的含n-oh键的β-榄香烯衍生物有望成为抗肿瘤候选药物,治疗肺癌。
附图说明
[0044]
图1化合物诱导h460细胞凋亡结果;其中(a)为空白组,(b)为化合物1,(c)为阳性对照药β-榄香烯(β-ele,1d),(d)为阳性对照药伏立诺他(vorinostat,saha)。
[0045]
图2化合物对人肺癌细胞nci-h460裸鼠移植瘤肿瘤体积的影响。
具体实施方式
[0046]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的操作方法,通常按照常规条件,或按照制造厂商所建议的条件。
[0047]
实施例1:化合物1的制备
[0048][0049]
中间体1c
[0050]
室温下,向化合物1a(398.9mg,2.43mmol)的dmf(5ml)溶液里,依次加入nh2othp(1b,219.1mg,1.87mmol)、dipea(362.5mg,2.81mmol)、1-乙基-3-(3-二甲基丙胺)碳二亚胺盐酸盐(edci,931.7mg,4.86mmol)和1-羟基苯并三唑(hobt,328.3mg,2.43mmol)。将反应液在室温下搅拌5h。完全转化后,向反应液加水(20ml)终止反应,再用乙酸乙酯萃取(3
×
15ml)。合并的有机相用饱和食盐水(2
×
15ml)洗涤,并用无水硫酸钠干燥。干燥剂经过滤除去,滤液在减压条件下浓缩,所得的粗品经硅胶柱层析(甲醇:二氯甲烷=13:87)纯化,得黄色固体1c(350mg,收率71.1%)。1h nmr(400mhz,cdcl3)δ9.29(s,1h),8.19(s,1h),7.60(d,j
=14.7hz,2h),6.49(d,j=8.6hz,1h),6.23(s,1h),4.96(d,j=41.5hz,3h),3.99(t,j=10.2hz,1h),3.66(dd,j=10.9,5.5hz,1h),1.96
–
1.77(m,4h),1.68
–
1.62(m,1h),1.60
–
1.54(m,1h).[m h]
:264.4.
[0051]
中间体1e
[0052]
冰浴下,向β-ele(1d,210.1mg,1.03mmol)的乙酸(3ml)溶液中,加入n-溴代琥珀酰亚胺(nbs,183.3mg,1.03mmol)。冰浴条件下搅拌6h。tlc监测原料未完全反应,故将反应液升至室温搅拌过夜(25~28℃)。完全转化后,向反应液中缓慢滴加饱和碳酸氢钠溶液终止反应,再用乙酸乙酯萃取(3x10ml)。合并的有机相用饱和食盐水(2x10ml)洗涤,并用无水硫酸钠干燥。干燥剂经过滤除去,滤液在减压条件下浓缩,所得的粗品经硅胶柱层析(洗脱剂:正己烷)纯化,得到无色油状液体1e(72mg,收率25.4%)。1h nmr(400mhz,cdcl3)δ5.89
–
5.76(m,1h),5.21(s,1h),5.04(t,j=1.1hz,1h),4.97
–
4.81(m,3h),4.59(dt,j=1.9,0.9hz,1h),4.04(d,j=0.7hz,2h),2.33
–
2.17(m,1h),2.06(dd,j=12.6,3.5hz,1h),1.74
–
1.70(m,3h),1.69
–
1.39(m,6h),1.01(s,3h)。
[0053]
中间体1f
[0054]
室温下,向中间体1e(367.9mg,1.30mmol)的dmf(5ml)溶液里,依次加入中间体1c(410.7mg,1.56mmol)和碳酸铯(cs2co3,990.5mg,3.04mmol)。将反应液在60℃下搅拌6h。完全转化,向反应液中加水(20ml)终止反应,再用乙酸乙酯萃取(3
×
15ml)。合并的有机相用饱和食盐水(2
×
15ml)洗涤,并用无水硫酸钠干燥。干燥剂经过滤除去,滤液在减压条件下浓缩,所得的粗品经硅胶柱层析(石油醚:乙酸乙酯=1:3)纯化,得无色油状化合物1f(121.7mg,收率20.1%)。1h nmr(400mhz,cdcl3)δ8.17(d,j=2.3hz,1h),7.62
–
7.49(m,2h),6.85(d,j=15.7hz,1h),6.44(d,j=8.6hz,1h),5.74(dd,j=17.4,10.9hz,1h),4.96
–
4.79(m,5h),4.77
–
4.59(m,4h),4.51(t,j=2.9hz,1h),4.22(dd,j=19.6,16.5hz,1h),3.98
–
3.87(m,1h),3.52(dd,j=11.5,6.5hz,1h),1.97
–
1.86(m,2h),1.82
–
1.64(m,4h),1.63(d,j=3.5hz,3h),1.59
–
1.46(m,5h),1.46
–
1.33(m,3h),0.93(s,3h).[m h]
:466.8.
[0055]
化合物1
[0056]
室温下,向中间体1f(110.3mg,0.24mmol)的甲醇(3ml)溶液里,加入对甲苯磺酸一水化合物(tsoh
·
h2o,137.0mg,0.72mmol)。将反应液在室温下搅拌8h。完全转化后,向反应液加饱和碳酸氢钠溶液和水(10ml)终止反应,再用二氯甲烷萃取(3
×
10ml)。合并的有机相用饱和食盐水(2
×
10ml)洗涤,并用无水硫酸钠干燥。干燥剂经过滤除去,滤液在减压条件下浓缩,所得的粗品经c18柱层析(乙腈:水=1:1)纯化,得白色固体(64.2mg,收率70.3%)。1h nmr(500mhz,dmso-d6)δ9.74(s,1h),8.12(d,j=2.4hz,1h),7.73(dd,j=8.7,2.5hz,1h),7.39(d,j=15.7hz,1h),6.99(d,j=15.8hz,1h),6.46(q,j=8.0,7.4hz,3h),5.85
–
5.75(m,1h),4.99
–
4.84(m,4h),4.78(t,j=1.9hz,1h),4.59(d,j=2.2hz,1h),4.26(s,2h),1.97(dt,j=13.8,6.9hz,2h),1.70
–
1.52(m,6h),1.50
–
1.32(m,3h),0.96(s,3h).
13
c nmr(126mhz,dmso-d6)δ161.12,150.54,150.48,149.02,147.56,139.70,135.30,119.71,112.71,112.40,110.49,108.77,52.39,41.54,32.79,27.04,25.07,16.78.[m h]
:381.2.
[0057]
实施例2:化合物2的制备
[0058][0059]
中间体2b
[0060]
参照实施例1里面中间体1c的合成步骤,得白色固体2b(711.1mg,收率66.6%)。1h nmr(500mhz,cdcl3)δ9.22(s,1h),8.77(s,1h),8.59(s,1h),7.92
–
7.60(m,2h),7.32(dd,j=7.9,4.8hz,1h),6.49(s,1h),5.06(s,1h),3.99(t,j=9.5hz,1h),3.66(dtd,j=11.2,4.2,2.0hz,1h),1.96
–
1.82(m,3h),1.74
–
1.56(m,3h).[m h]
:249.0.
[0061]
中间体2c
[0062]
参照实施例1里面中间体1f的合成步骤,得无色油状液体2c(102mg,收率16%)。1h nmr(500mhz,cdcl3)δ8.80(s,1h),8.58(d,j=3.8hz,1h),7.82(dt,j=8.0,2.0hz,1h),7.70(d,j=15.9hz,1h),7.33(dd,j=7.9,4.8hz,1h),7.21(d,j=15.8hz,1h),5.81(dd,j=17.3,11.0hz,1h),5.03
–
4.87(m,5h),4.82(q,j=1.5hz,1h),4.69(dd,j=33.3,16.3hz,1h),4.58(s,1h),4.34(dd,j=23.1,16.4hz,1h),4.00(dt,j=11.2,4.8hz,1h),3.63
–
3.54(m,1h),2.04
–
1.94(m,2h),1.91
–
1.72(m,5h),1.69
–
1.55(m,7h),1.53
–
1.41(m,3h),1.01(s,3h).
[0063]
化合物2
[0064]
参照实施例1里面化合物1的合成步骤,得无色油状液体2(70.6mg,收率91.7%)。1h nmr(500mhz,dmso-d6)δ9.97(s,1h),8.84(d,j=2.2hz,1h),8.57(dd,j=4.8,1.6hz,1h),8.12(dt,j=8.0,2.0hz,1h),7.57(d,j=15.9hz,1h),7.48
–
7.36(m,2h),5.81(dd,j=17.8,10.5hz,1h),5.02
–
4.84(m,4h),4.78(s,1h),4.59(s,1h),4.28(s,2h),2.04
–
1.91(m,2h),1.74
–
1.33(m,10h),0.97(s,3h).
13
c nmr(126mhz,dmso-d6)δ150.81,150.45,149.99,147.54,138.36,134.68,131.21,124.42,119.81,112.72,110.94,110.51,52.39,52.14,41.58,32.78,27.03,25.06,16.78.[m h] :389.2.
[0065]
实施例3:化合物3的制备
[0066][0067]
中间体3b
[0068]
参照实施例1里面中间体1c的合成步骤,得黄色固体3b(522.4mg,收率65.0%)。1h nmr(500mhz,cdcl3)δ8.43(s,1h),7.65(d,j=15.6hz,1h),7.34(d,j=8.2hz,2h),6.72
–
6.58(m,2h),6.26(s,1h),4.99(s,1h),4.17
–
3.73(m,3h),3.66(ddt,j=9.4,5.2,2.7hz,1h),1.93
–
1.79(m,3h),1.74
–
1.61(m,3h).
[0069]
中间体3c
[0070]
参照实施例1里面中间体1f的合成步骤,得淡黄色固体3c(107.3mg,收率20.2%)。1h nmr(500mhz,cdcl3)δ7.65(d,j=15.7hz,1h),7.39
–
7.34(m,2h),6.91
–
6.83(m,1h),6.68
–
6.63(m,2h),5.80(dd,j=17.4,10.9hz,1h),5.03
–
4.86(m,5h),4.84
–
4.70(m,2h),4.61
–
4.56(m,1h),4.27(dd,j=22.5,16.5hz,1h),4.00(tt,j=8.3,1.8hz,1h),3.91(s,2h),3.62
–
3.56(m,1h),2.00(tdd,j=14.7,12.1,8.3hz,2h),1.89
–
1.71(m,5h),1.67
–
1.54(m,7h),1.51
–
1.41(m,3h),1.00(s,3h).[m h]
:381.0.
[0071]
化合物3
[0072]
参照实施例1里面化合物1的合成步骤,得黄色固体3(25mg,收率50.6%)。1h nmr(500mhz,dmso-d6)δ9.73(s,1h),7.43
–
7.32(m,3h),6.96(d,j=16.1hz,1h),6.60(d,j=8.5hz,2h),5.85(dd,j=17.9,10.4hz,1h),5.65(d,j=8.4hz,1h),5.01
–
4.87(m,4h),4.85
–
4.80(m,1h),4.62(d,j=2.3hz,1h),4.28(s,2h),2.09
–
1.94(m,2h),1.77
–
1.35(m,9h),1.00(s,3h).
13
c nmr(126mhz,dmso-d6)δ155.96,155.24,153.88,152.33,147.47,134.73,127.54,118.89,118.85,117.46,115.79,115.23,57.14,46.29,37.54,31.78,29.83,21.53.[m h] :381.2.
[0073]
实施例4:化合物6的制备
[0074]
[0075]
中间体6b
[0076]
参照实施例1里面中间体1c的合成步骤,得类白色胶状固体6b(959.3mg,收率84.4%)。1h nmr(500mhz,cdcl3)δ8.45(s,1h),7.71(d,j=15.6hz,1h),7.41(d,j=7.8hz,2h),7.18(d,j=7.8hz,2h),6.41(s,1h),5.01(s,1h),3.98(t,j=9.6hz,1h),3.67(dtd,j=11.3,4.2,1.8hz,1h),2.37(s,3h),1.93
–
1.79(m,3h),1.72
–
1.62(m,2h),1.59
–
1.52(m,1h).[m h] :262.0.
[0077]
中间体6c
[0078]
参照实施例1里面中间体1f的合成步骤,得无色油状化合物6c(126.7mg,收率20.3%)。1h nmr(500mhz,cdcl3)δ7.71(d,j=15.8hz,1h),7.44(d,j=7.9hz,2h),7.18(d,j=7.8hz,2h),7.03(d,j=15.7hz,1h),5.81(dd,j=17.4,10.9hz,1h),5.04
–
4.87(m,5h),4.85
–
4.70(m,2h),4.58(d,j=3.8hz,1h),4.30(dd,j=22.6,16.5hz,1h),4.05
–
3.95(m,1h),3.59(m,1h),2.37(s,3h),2.05
–
1.96(m,2h),1.90
–
1.72(m,5h),1.69
–
1.41(m,10h),1.00(s,3h).[m h] :464.5.
[0079]
化合物6
[0080]
参照实施例1里面化合物1的合成步骤,得白色固体化合物6(40.1mg,收率70.8%)。1h nmr(500mhz,dmso-d6)δ9.83(s,1h),7.58
–
7.46(m,3h),7.23(d,j=7.9hz,3h),5.81(dd,j=17.9,10.5hz,1h),4.97(s,1h),4.94
–
4.84(m,3h),4.80
–
4.77(m,1h),4.59(d,j=2.3hz,1h),4.27(s,2h),2.33(s,3h),1.98(dt,j=13.8,7.1hz,2h),1.71
–
1.52(m,6h),1.49
–
1.33(m,3h),0.97(s,3h).
[0081]
实施例5:化合物7的制备
[0082][0083]
中间体7b
[0084]
参照实施例1里面中间体1c的合成步骤,得白色固体7b(1.07g,收率70.5%)。1h nmr(500mhz,cdcl3)δ9.00(s,1h),7.71(d,j=15.7hz,1h),7.31(d,j=6.4hz,2h),7.24(t,j=7.9hz,1h),7.17(d,j=7.5hz,1h),6.42(s,1h),5.03(s,1h),4.00(t,j=9.1hz,1h),3.66(ddt,j=9.6,5.5,2.9hz,1h),2.34(s,3h),1.85(dq,j=12.7,4.7,4.1hz,3h),1.71
–
1.55(m,3h).[m h] :262.0.
[0085]
中间体7c
[0086]
参照实施例1里面中间体1f的合成步骤,得无色油状液体7c(100mg,收率15.4%)。1h nmr(500mhz,cdcl3)δ7.70(d,j=15.8hz,1h),7.38
–
7.31(m,2h),7.27(t,j=7.6hz,1h),7.18(d,j=7.4hz,1h),7.06(d,j=15.5hz,1h),5.81(dd,j=17.4,10.9hz,1h),5.04
–
4.86
(m,5h),4.84
–
4.69(m,2h),4.59(dd,j=4.9,2.0hz,1h),4.30(dd,j=22.4,16.5hz,1h),4.04
–
3.95(m,1h),3.62
–
3.56(m,1h),2.37(s,3h),2.06
–
1.94(m,2h),1.89
–
1.72(m,5h),1.69
–
1.53(m,7h),1.53
–
1.39(m,3h),1.01(s,3h).
[0087]
化合物7
[0088]
参照实施例1里面化合物1的合成步骤,得无色油状液体7(74mg,收率94.0%)。1h nmr(500mhz,dmso-d6)δ9.91(s,1h),7.56
–
7.43(m,3h),7.37
–
7.20(m,3h),5.82(dd,j=17.9,10.5hz,1h),4.99(s,1h),4.95
–
4.85(m,3h),4.80(t,j=1.9hz,1h),4.60(s,1h),4.29(s,2h),2.35(s,3h),1.99(dt,j=13.7,6.8hz,2h),1.75
–
1.53(m,6h),1.52
–
1.34(m,3h),0.98(s,3h).[m h]
:380.2.
[0089]
实施例8:化合物8的制备
[0090][0091]
中间体8b
[0092]
参照实施例1里面中间体1c的合成步骤,得白色固体8b(1.35g,收率83.8%)。1h nmr(500mhz,cdcl3)δ8.01(d,j=15.8hz,1h),7.50(d,j=7.3hz,1h),7.40
–
7.08(m,4h),6.33(s,1h),5.03(s,1h),3.99(t,j=9.3hz,1h),3.66(dtd,j=11.3,4.1,1.8hz,1h),2.42(s,3h),1.92
–
1.78(m,3h),1.73
–
1.55(m,3h).
[0093]
中间体8c
[0094]
参照实施例1里面中间体1f的合成步骤,得无色油状液体8c(186.0mg,收率24.5%)。1h nmr(500mhz,cdcl3)δ8.01(d,j=15.7hz,1h),7.56(d,j=7.3hz,1h),7.28
–
7.24(m,1h),7.21(t,j=6.8hz,2h),7.00(d,j=16.0hz,1h),5.81(dd,j=17.4,10.9hz,1h),5.07
–
4.86(m,5h),4.84
–
4.68(m,2h),4.60
–
4.57(m,1h),4.30(dd,j=21.2,16.5hz,1h),4.05
–
3.95(m,1h),3.59(ddt,j=12.9,6.7,3.1hz,1h),2.45(s,3h),2.05
–
1.95(m,2h),1.91
–
1.71(m,5h),1.69
–
1.55(m,7h),1.54
–
1.41(m,3h),1.01(s,3h).
[0095]
化合物8
[0096]
参照实施例1里面化合物1的合成步骤,得无色油状液体8(95.7mg,收率73.1%)。1h nmr(500mhz,methanol-d4)δ7.92(d,j=15.8hz,1h),7.59(d,j=7.6hz,1h),7.26
–
7.16(m,4h),5.80(dd,j=17.5,10.8hz,1h),4.99(d,j=24.1hz,2h),4.92
–
4.76(m,5h),4.58(s,1h),4.35(s,2h),2.41(s,3h),2.01(dp,j=13.5,6.8,6.0hz,2h),1.74
–
1.60(m,6h),1.55
–
1.39(m,3h),1.00(s,3h).
13
c nmr(126mhz,methanol-d4)δ150.13,148.09,147.45,140.18,137.31,133.87,130.40,129.44,126.07,125.89,117.05,111.37,110.30,109.03,52.62,52.02,42.04,39.79,39.46,32.88,26.86,24.00,18.45,15.74.[m h] :380.0.
[0097]
实施例7:化合物9的制备
[0098][0099]
中间体9b
[0100]
参照实施例1里面中间体1c的合成步骤,得黄色固体9b(733.7mg,收率85.6%)。1h nmr(500mhz,cdcl3)δ8.96(s,1h),7.86
–
7.39(m,5h),6.66
–
6.34(m,1h),5.04(s,1h),3.98(q,j=10.6hz,1h),3.72
–
3.62(m,1h),1.86(qt,j=10.6,7.6,3.5hz,3h),1.64(ddd,j=32.1,10.6,6.9hz,3h).
[0101]
中间体9c
[0102]
参照实施例1里面中间体1f的合成步骤,得无色油状液体9c(110.0mg,收率17.3%)。1h nmr(500mhz,cdcl3)δ7.78
–
7.56(m,5h),7.21(d,j=15.2hz,1h),5.80(dd,j=17.3,11.0hz,1h),5.09
–
4.78(m,6h),4.75
–
4.56(m,2h),4.35(dd,j=23.1,16.4hz,1h),4.00(dt,j=11.1,5.1hz,1h),3.58(dd,j=11.9,5.6hz,1h),2.07
–
1.92(m,2h),1.90
–
1.60(m,12h),1.54
–
1.42(m,3h),1.01(s,3h).[m h]
:475.2.
[0103]
化合物9
[0104]
参照实施例1里面化合物1的合成步骤,得黄色油状液体9(68.0mg,收率83.2%)。1h nmr(500mhz,dmso-d6)δ9.99(s,1h),7.87(s,4h),7.59(d,j=15.9hz,1h),7.42(d,j=15.9hz,1h),5.80(dd,j=17.8,10.5hz,1h),5.06
–
4.74(m,5h),4.58(s,1h),4.28(s,2h),2.07
–
1.87(m,2h),1.76
–
1.31(m,9h),0.96(s,3h).
[0105]
实施例8:化合物12的制备
[0106][0107]
中间体12b
[0108]
参照实施例1里面中间体1c的合成步骤,得白色固体12b(967.2mg,收率91.3%)。1h nmr(500mhz,cdcl3)δ8.89(s,1h),7.75(d,j=15.8hz,1h),7.62(s,4h),6.67
–
6.29(m,
1h),5.03(s,1h),3.98(d,j=11.8hz,1h),3.76
–
3.60(m,1h),2.01
–
1.47(m,6h).
[0109]
中间体12c
[0110]
参照实施例1里面中间体1f的合成步骤,得淡黄色油状液体12c(108.0mg,收率14.4%)。1h nmr(500mhz,cdcl3)δ7.72(d,j=15.8hz,1h),7.63(s,4h),7.18(d,j=12.3hz,1h),5.81(dd,j=17.3,11.0hz,1h),5.06
–
4.79(m,6h),4.78
–
4.56(m,2h),4.34(dd,j=23.1,16.4hz,1h),4.03
–
3.97(m,1h),3.59(dq,j=9.3,4.1,3.0hz,1h),2.08
–
1.93(m,2h),1.90
–
1.59(m,12h),1.53
–
1.42(m,3h),1.01(s,3h).
[0111]
化合物12
[0112]
参照实施例1里面化合物1的合成步骤,得黄色油状液体12(65.7mg,收率79.1%)。1h nmr(500mhz,dmso-d6)δ9.96(s,1h),7.91(d,j=8.1hz,2h),7.78(d,j=8.0hz,2h),7.63(d,j=16.0hz,1h),7.44(d,j=15.9hz,1h),5.82(dd,j=17.6,10.7hz,1h),5.05
–
4.84(m,4h),4.80(s,1h),4.60(s,1h),4.30(s,2h),1.99(dt,j=11.5,5.6hz,2h),1.75
–
1.34(m,9h),0.98(s,3h).
[0113]
实施例9:化合物15的制备
[0114][0115]
中间体15b
[0116]
参照实施例1里面中间体1c的合成步骤,得白色固体15b(1.38g,收率88.8%)。1h nmr(400mhz,cd3od)δ8.36(d,j=2.4hz,1h),7.82(dd,j=8.8,2.4hz,1h),6.57(d,j=8.8hz,1h),5.02
–
4.99(m,1h),4.11(td,j=10.9,3.1hz,1h),3.69
–
3.57(m,1h),1.96
–
1.56(m,6h).[m h]
:238.3。
[0117]
中间体15c
[0118]
参照实施例1里面中间体1f的合成步骤,得无油状液体15c(210.3mg,收率31.0%)。1h nmr(400mhz,cdcl3)δ8.52(d,j=2.2hz,1h),7.83(dd,j=8.6,2.3hz,1h),6.48(d,j=8.6hz,1h),5.80(dd,j=17.8,10.5hz,1h),5.09
–
4.71(m,8h),4.58(dd,j=6.9,2.0hz,1h),4.32(dd,j=16.4,13.3hz,1h),3.79(tdd,j=10.9,6.8,2.8hz,1h),3.58
–
3.47(m,1h),2.08
–
1.94(m,2h),1.81
–
1.35(m,15h),1.00(s,3h).[m h]
:440.2。
[0119]
化合物15
[0120]
参照实施例1里面化合物1的合成步骤,得白色固体15(170mg,收率80.3%)。1h nmr(500mhz,dmso-d6)δ9.72(s,1h),8.37(d,j=2.4hz,1h),7.73(dd,j=8.7,2.4hz,1h),6.53
–
6.32(m,3h),5.81(dd,j=17.8,10.5hz,1h),5.06
–
4.83(m,4h),4.78(t,j=1.9hz,1h),4.58(d,j=2.3hz,1h),4.26(s,2h),2.00(ddd,j=12.0,9.9,3.7hz,2h),1.72
–
1.32
(m,9h),0.96(s,3h).
13
c nmr(126mhz,dmso-d6)δ167.52,161.24,150.46,150.16,148.93,147.56,138.35,118.29,112.71,110.72,110.50,106.69,53.33,52.41,41.78,39.94,32.86,27.04,25.08,16.79.[m h]
:356.5。
[0121]
实施例10:对实施例1制备的化合物进行体外抗肿瘤活性评价
[0122]
1.实验材料与仪器
[0123]
实验材料:dmem(浙江森瑞生物科技有限公司);rpmi 1640(浙江森瑞生物科技有限公司);fatal bovine serum(bi);pbs(浙江森瑞生物科技有限公司);trypsin(浙江森瑞生物科技有限公司);dmso(coolaber);cck-8(coolaber)。
[0124]
实验仪器:生物安全柜(上海百基生物科技有限公司);恒温二氧化碳培养箱(thermo);酶联免疫分析仪(spark);倒置显微镜(nikon);移液枪一套(eppendorf);离心机(beckman coulter)。
[0125]
不同类型的人肺癌细胞株:h1975、h460和a549。
[0126]
2.实验步骤
[0127]
1)取对数生长期的受试细胞,经胰酶消化、计数后,将肿瘤细胞悬浮液稀释至5
×
104个/ml的浓度接种于96孔培养板中,除了空白组加100μl不含细胞的培养基外,其余每孔加入含有细胞的培养基100μl(每孔5
×
103个细胞);
[0128]
2)在湿润的含5%co2培养箱中37℃孵育8h后,吸掉96孔板中原有的培养基,除了对照和空白组加100μl不含待测化合物的培养基,其余每孔加入100μl含待测化合物的培养基(使用10%fbs/rpmi 1640完全培养基),每个浓度设置6个复孔,不加细胞不加化合物的孔为空白组,加细胞不加化合物的孔为对照组,加细胞加待测化合物的为实验组。实验选取β-ele和saha作为阳性对照;
[0129]
3)于37℃、5%co2湿润的培养箱中继续培养72h;
[0130]
4)避光条件下,每孔加入cck-8溶液10μl,于37℃、5%co2湿润的培养箱中继续培养1-4h,在酶标仪450nm处测定每个孔的吸光度值(od值);
[0131]
5)用以下公式计算存活率和抑制率
[0132]
细胞存活率=[(as-ab)/(ac-ab)]
×
100%
[0133]
抑制率=[(ac-as)/(ac-ab)]
×
100%
[0134]
应用excel计算单浓度抑制率;应用graphpad prism 7.0软件,使用非线性回归模型绘制s型剂量-存活率曲线并计算ic
50
值。
[0135]
as:实验孔(含有细胞的培养基、cck-8、待测药物)的吸光度
[0136]
ac:对照孔(含有细胞的培养基、cck-8、溶媒(dmso))的吸光度
[0137]
ab:空白孔(不含细胞的培养基、cck-8、溶媒(dmso))的吸光度
[0138]
3.实验结果
[0139]
按上述实验方法测定了实施例1制备的化合物以及阳性对照药β-ele和saha对3种肺癌细胞株的增殖抑制作用,结果如表1所示。
[0140]
表1目标化合物在体外对实体瘤细胞株的抗增殖活性结果
[0141][0142]a表中数值为三次试验的平均值,
“±”
后的数值表示标准偏差;b当浓度在10μμ时,抑制率低于10%用“n.a.-notactive”表示。
[0143]
4.结果讨论
[0144]
在细胞水平上:1)化合物1表现出明显强于阳性对照β-ele的抑制细胞增殖的活性;2)化合物1表现出与阳性对照药saha相当的抑制活性。
[0145]
实施例11:对实施例1制备的化合物进行细胞凋亡实验
[0146]
1.实验材料与仪器
[0147]
实验材料:dmem(浙江森瑞生物科技有限公司);rpmi 1640(浙江森瑞生物科技有限公司);fatal bovine serum(bi);pbs(浙江森瑞生物科技有限公司);trypsin(浙江森瑞生物科技有限公司);dmso(coolaber);细胞凋亡试剂盒(联科生物);双蒸水。
[0148]
实验仪器:生物安全柜(上海百基生物科技有限公司);恒温二氧化碳培养箱(thermo);酶联免疫分析仪(spark);倒置显微镜(nikon);移液枪一套(eppendorf);离心机(beckman coulter);流式细胞仪。
[0149]
人肺癌细胞株:h460。
[0150]
2.实验步骤
[0151]
1)取对数生长期的受试细胞,经胰酶消化、计数后,将肿瘤细胞悬浮液稀释至5
×
104个/ml的浓度接种于4个6cm培养皿中;
[0152]
2)在湿润的含5%co2培养箱中37℃孵育8h后,吸掉6cm培养皿中原有的培养基,空白组加4ml不含待测化合物的培养基,其余三组加入4ml含待测化合物的培养基(使用10%fbs/rpmi 1640完全培养基;待测化合物浓度为10μm)。实验选取β-ele和saha作为阳性对照;
[0153]
3)于37℃、5%co2湿润的培养箱中继续培养72h,诱导细胞凋亡;
[0154]
4)培养72h后,先将原细胞培养液全部转移到一个10ml的离心管中,然后用胰酶消化培养皿中的细胞,待消化完全,再将含有细胞的胰酶一起转移至上述10ml的离心管中,1000r离心5min,弃上清;
[0155]
5)加入1
×
pbs离心洗涤,后弃去pbs;
[0156]
6)用双蒸水稀释细胞凋亡试剂盒中的5
×
binding buffer为1
×
binding buffer,取500μl 1
×
binding buffer重悬细胞;
[0157]
7)每管加入细胞凋亡试剂盒中的annexinv 5μl和pi 10μl;
[0158]
8)轻柔涡旋混匀后,室温避光孵育5min;
[0159]
9)在流式细胞仪上,通过fitc通道检测annexin v-fitc和通过pi通道检测pi。
[0160]
3.实验结果
[0161]
按上述实验方法测定了实施例1制备的化合物以及阳性对照药β-ele和saha诱导
肺癌细胞株h460凋亡的作用,结果如图1(a)-(d)所示。
[0162]
4.结果讨论
[0163]
1)与空白组和阳性对照β-ele组相比,化合物1能明显地诱导h460细胞凋亡;2)化合物1与阳性对照saha组相比,诱导h460细胞凋亡的作用相当。
[0164]
实施例12:对实施例1制备的化合物进行体内抗肿瘤活性评价
[0165]
1.模型的制备
[0166]
收集培养的人肺癌nci-h460细胞悬液,浓度为1
×
107个/ml,以每只0.1ml接种于裸鼠右侧腋窝皮下。
[0167]
2.分组与给药
[0168]
裸鼠移植瘤用游标卡尺测量移植瘤直径,接种18天后,肿瘤体积达到80-100mm3时将动物随机分组,每组5只。同时,各组裸鼠开始给药,给药方案见组别与给药方案,使用测量瘤径的方法,动态观察受试样品的抗肿瘤效应。实验结束后,随即处死裸鼠,手术剥取瘤块称重。
[0169]
3.观测指标
[0170]
肿瘤体积(tumor volume,tv)的计算公式为:
[0171]
tv=1/2
×a×
b2其中a、b分别表示长、宽。
[0172]
根据测量的结果计算出相对肿瘤体积(relative tumor volume,rtv),计算公式为:
[0173]
rtv=v
t
/v0[0174]
其中v0为分笼给药时(即d0)测量所得肿瘤体积,v
t
为每一次测量时的肿瘤体积。抗肿瘤活性的评价指标:相对肿瘤增殖率t/c(%),计算公式如下:
[0175]
t/c(%)=(t
rtv
/c
rtv
)
×
100%
[0176]
其中t
rtv
:治疗组rtv;c
rtv
:模型组rtv。
[0177]
抗肿瘤活性的评价指标:肿瘤生长抑制率(%),计算公式如下:
[0178]
肿瘤生长抑制率=[(模型组平均瘤重-给药组平均瘤重)/模型组平均瘤种]
×
100%
[0179]
4.统计处理
[0180]
均值用x
±
sd表示,组间分析用t检验进行统计学处理,应用spss(staffstical package for the social science)17.0对结果进行统计分析。
[0181]
5.实验结果
[0182]
按上述实验方法测定了实施例1制备的化合物1以及阳性对照药β-ele和saha对人肺癌细胞nci-h460裸鼠移植瘤肿瘤体积的影响,结果如图2所示。
[0183]
表1具体实验方案
[0184]
(x
±
sd,n=5)
[0185][0186]
与空白组比较,
*
p<0.05,
**
p<0.01
[0187]
表2待测化合物对人肺癌细胞nci-h460裸鼠移植瘤肿瘤生长的影响
[0188]
(x
±
sd,n=5)
[0189][0190]
与空白组比较,*p<0.05,**p<0.01
[0191]
6.结果讨论
[0192]
在人肺癌细胞nci-h460裸鼠移植瘤模型上,化合物1表现出明显强于阳性对照β-ele和saha的抑制肿瘤增殖的效果。
[0193]
此外应理解,在阅读了本发明的上述描述内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。