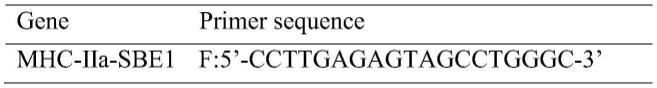
mhc-iia基因调控位点及突变体及其应用
技术领域:
1.本发明涉及生物领域,具体涉及mhc-iia基因启动子区域转录的保守调控位点及其应用。
背景技术:
2.根据肌球蛋白重链(myosin heavy chain,mhc)不同亚单位,骨骼肌纤维分为四种亚型:mhc-i,mhc-iia,mhc-iid,mhc-iib,上述四种肌纤维亚型具备不同的收缩方式和代谢特征:mhc-i为慢收缩性肌纤维,以有氧代谢为主要供能方式,收缩速率较慢,但不易疲劳;mhc-iia为快收缩性肌纤维,以有氧代谢为主要供能方式,收缩速率较快且不易疲劳;mhc-iid和mhc-iib均为快收缩性肌纤维,以无氧酵解为主要供能方式,收缩速率较快但容易疲劳。因此,上述四种亚型肌纤维在肌肉中的含量和比例是影响人运动速度和耐力的关键因素。
3.骨骼肌具有极强的可塑性,在失重、制动、去神经、长期卧床或运动减少导致的肌萎缩形成过程中,肌纤维类型沿mhc-i
→
mhc-iia
→
mhc-iid
→
mhc-iib顺序转变(bodine sc,et al.science,294:1704-1708,2001;foletta vc,et al.pflugers arch-eur j physiol,461:325
–
335,2011),即以有氧代谢为主的纤维亚型逐渐转变为以无氧酵解为主的纤维亚型,是废用性肌萎缩的特征性改变之一,也是引起肌肉萎缩后运动耐力下降的直接因素。研究表明,在废用性肌萎缩形成过程中,以肌纤维亚型mhc-iia下降幅度以及mhc-iib的增加幅度最为显著。因此,逆转或阻断mhc-iia的下降或mhc-iib的增加可以作为缓解肌萎缩及其运动耐力下降的一种有效策略。
4.基因的表达受到转录起始位点上游启动子区域的调控,在转录因子以及rna聚合酶组成的转录前起始复合物的作用下,启动下游基因表达。真核生物在长期的进化过程中,部分碱基序列被保留下来,而这些保守性序列往往是调控基因转录的关键位点,筛选并鉴定出这些保守性位点对于实现关键基因的精准调控至关重要。
5.综上所述,在肌萎缩形成过程中,筛选并鉴定出mhc-iia基因启动子区域有功能活性的保守性位点,通过对该位点突变和改造,实现对mhc-iia基因的精准调控,对于缓解肌萎缩的形成以及改善肌肉生理功能具有重要意义。
技术实现要素:
6.本发明的目的是筛选出调控mhc-iia基因转录活性的功能结合位点,通过突变该位点部分碱基,逆转外界刺激对于该基因的转录抑制效应。
7.本发明人利用生物信息学手段,通过对多物种mhc-iia基因启动子区域序列进行比对,首先筛选到该基因启动子区域存在多个保守结合位点,通过染色质免疫共沉淀实验证实,距离转录起始位点最近的保守位点可以和转录因子smad相结合,该位点位于人类mhc-iia基因上游-719~-711区域,碱基序列为atatagac;位于小鼠mhc-iia基因上游-54~-44区域,碱基序列为ttgccagacaa。人和小鼠序列共有的核心关键位点为agac。在此基础
上利用小鼠基因组序列为基础完成了本发明。
8.在构建携带有该基因启动子保守位点的野生型报告载体基础上,利用点突变试剂盒将保守碱基序列的关键核心位点由agac突变为tttc,体内转染后证实,smad对mhc-iia基因的转录抑制效应消失,证实该位点具备转录调控功能。
9.本发明的碱基序列是dna形式,为功能调控区域,不具备编码mrna进而翻译成多肽信息的功能,dna可以是单链的或是双链的。该发明还涉及该位点的多个碱基突变体,理论上,对于该序列位点的单点或多点突变均可以减弱或完全阻断该位点的功能活性。
10.本发明mhc-iia基因转录调控位点通常可以用pcr扩增法或碱基合成的方法获得。
11.一旦获得了有关的序列,就可用重组载体将该序列转染至宿主细胞,增加该序列在原始宿主的拷贝数,增强该基因的转录抑制作用;或者突变该序列,沉默或阻断外界刺激或上游转录因子对该基因的转录抑制作用。
12.本领域一般技术人员清楚,通过碱基点突变试剂盒,可针对本发明提供的保守位点序列,突变并同源重组宿主细胞mhc-iia基因的启动子位点;或者以此位点设计互补核苷酸序列,对该位点的封闭阻断,实现对mhc-iia基因的转录调控。
13.筛选出调控mhc-iia基因转录活性的功能结合位点,通过突变该位点任一基因有助于制备干预骨骼肌肌纤维类型转变的制剂。所述干预骨骼肌肌纤维类型转变,包括提升慢肌纤维含量及改善肉质作用。
附图说明
14.图1为携带mhc-iia基因转录起始位点上游3000bp碱基的野生型荧光素酶报告载体(pgl-mhc-iia wt)图谱。
15.图2为smad3对mhc-iia基因的转录调控作用。
16.图3为染色质免疫共沉淀检测smad3在mhc-iia基因启动子区域的结合位点。
17.图4为pgl-mhc-iia点突变载体(pgl-mhc-iia mut)的构建示意图。
18.图5为smad3对pgl-mhc-iia mut载体转录活性的影响。
具体实施方式
19.下面结合具体实施例,进一步阐述本发明。这些实施例仅用于举例说明本发明的方法,而不用于限制本发明的范围。凡未注明具体实验条件的,均为按照本领域技术人员熟知的常规条件。
20.实施例1携带mhc-iia基因转录起始位点上游3000bp碱基的野生型荧光素酶报告载体(pgl-mhc-iia wt)的构建
21.在ucsc网站检索mhc-iia基因转录起始位点上游3000bp启动子序列,设计pcr扩增引物,在mhc-iia基因启动子扩增引物上下游分别加入saci和nhei酶切位点,上游引物序列为5
’‑
gagctccgggagtgataaggaagaga-3’,下游引物序列为5
’‑
gctagctggaaacaatgcgactgcct-3’,之后利用pcr扩增目的片段,pcr产物切胶回收后,连接到pgl-3basic载体上。
22.利用氯化钙转化法,将重组质粒转化dh5α感受态细胞中,涂布于含氨苄青霉素的的lb固体培养基上,37℃培养12小时。
23.挑取单克隆菌落,接种于3ml lb 氨苄青霉素的液体培养基,37℃培养,碱裂解法提取重组质粒,根据测序结果挑取无任何突变的载体命名为pgl-mhc-iia wt载体(图1)。
24.实施例2 smad3对mhc-iia基因的转录调控作用
25.为了检测p-smad3是否参与对mhc-iia的转录调控,我们将pgl-3-mhc-iia载体与pcmv-myc-smad3表达载体共同转染到hek293细胞中,以prl-tk为内参,转染24小时后给予或不给予tgf-β1因子(5ng/ml)刺激,24小时后检测双荧光素酶的活性。具体方法步骤如下:
26.a.将生长状态良好的hef293细胞以1
×
105/每孔的密度接种到12孔培养板。37℃培养箱培养24小时。细胞密度生长至80-90%。
27.b.质粒共转染:将pcmv-myc-smad3表达质粒及prl-tk分别与pgl3-mhc-iia,pgl3-mhc-iia mut,pgl3-mhc-iib或pgl3-mhc-iib mut混合(按照1:0.1:1比例),利用不含血清的高糖dmed稀释至1ug/100ul混匀。
28.c.将x-tremegene hp dna转染试剂放置室温平衡至15-25℃,按照1ul转染试剂/1ug质粒的剂量加入到上述质粒混合液中混匀,室温放置15-20min。
29.d.按照每孔0.5ug pcmv-myc-smad3 0.1ug prl-tk 0.5ug pgl3-mhc-luc质粒的剂量加入上述转染试剂-质粒混合液。
30.e.作用24小时后加入tgf-β1(10ng/ml)因子刺激12小时,对照组加入等体积pbs,检测双荧光素酶表达。
31.结果如图2所示,单纯tgf-β1因子刺激就可以使pgl-3-mhc-iia的荧光素酶活性下降15.6%(**p《0.01),与smad3表达质粒共转染后,pgl-3-mhc-iia的荧光素酶活性下降程度更加明显,与对照组相比下降了53.3%(**p《0.01)(图2)。该结果直接证明,smad3过表达或激活可以抑制mhc-iia基因的转录活性。
32.实施例3染色质免疫共沉淀检测smad3在mhc-iia基因启动子区域的结合位点
33.为了研究p-smad3是否直接发挥了对mhc-iia的转录调控作用,我们首先用生物信息学(http://mulan.dcode.org/)的方法预测了mhc-iia基因的启动子区域是否存在smad结合位点(smad binding element,sbe)。根据我们对小鼠和人mhc-ii基因启动子区域的比对结果表明,在mhc-iia基因转录起始位点上游3000bp区域内存在3个保守的sbe,分别是位于-1550~-1542位点的“atggtgtct”(sbe1),-228~-218位点的“ctggctggcca”(sbe2)以及-54~-44位点的“ttgccagacaa”(sbe3)。
34.为了证实smad3是否与上述预测的sbe存在直接结合作用,我们应用骨骼肌组织染色质免疫共沉淀的方法对smad3与上述sbe的直接结合作用进行了检测分析。具体方法步骤如下:
35.(1)固定与超声破碎
36.a.取每只小鼠两侧新鲜比目鱼肌组织于1.5ml ep管中冰上剪碎;
37.b.加入终浓度为1%的甲醛(27ul 37%甲醛/1ml pbs)37℃孵育10分钟;
38.c.加10
×
甘氨酸至终浓度为0.125m,混匀后室温下放置5分钟终止交联;
39.d.4℃3000rpm离心5min后弃上清,再用加入蛋白酶抑制剂的预冷pbs清洗2次弃上清;
40.e.上步沉淀加1ml含蛋白酶抑制剂的预冷pbs,混匀后冰上利用组织匀浆器匀浆,4℃3000rpm离心5min后弃上清;
41.f.在收集的组织沉淀中加入500ul含蛋白酶抑制剂的ripa裂解液,充分混匀吹散,冰上裂解20分钟;
42.g.将裂解后的样本放置冰上,利用cpx750超声破碎仪,60%功率,每超声5s间歇25s,共30次,超声总时长为150s;
43.h.dna片段鉴定:取50ul上述超声裂解液,4℃12000rpm离心后加入5ul(20ug/ul)蛋白酶k,65℃水浴4h后进行琼脂糖凝胶水平电泳,观察dna片段大小,如片段集中于200-1000bp大小,按步骤进行下一步实验,如大于1000bp继续进行超声破碎。
44.(2)免疫共沉淀
45.a.将上述超声裂解液,4℃12000rpm离心取上清至新的ep管中;此上清即组织内的dna-pro复合物;
46.b.取50ul上清用作input;
47.c.取150ul上清用dilutin buffer稀释10倍,加入50ul蛋白a/鲑精dna琼脂,4℃摇动30分钟;
48.d.4℃1000rpm离心1min以沉淀琼脂,转移上清,分为3等份;
49.e.将上述3份上清中分别加入2ug目的蛋白抗体、同源igg(阴性对照)、或50ul蛋白a/鲑精dna琼脂(背景对照);目的蛋白抗体及同源igg 4℃摇动孵育过夜,背景对照4℃摇动1h后直接进入步骤g;
50.f.目的蛋白抗体及同源igg孵育过夜后加入50ul蛋白a/鲑精dna琼脂,4℃摇动1h,收集抗体/转录因子/dna复合体;
51.g.4℃1000rpm离心1min以沉淀琼脂,尤其小心祛除上清,按照下列顺序洗涤沉淀,每种缓冲液加入1ml,室温摇动3-5min,4℃1000rpm离心1min;
52.a.低盐免疫复合物缓冲液,1次
53.b.高盐免疫复合物缓冲液,1次
54.c.licl免疫复合物缓冲液,1次
55.d.te缓冲液,2次
56.h.此样本为蛋白a/抗体/转录因子/dna复合体。
57.(3)洗脱
58.a.配制新鲜的洗脱缓冲液elution buffer(10%sds和0.1m nahco3按照1:9体积配制);
59.b.每管加入250ul洗脱缓冲液,室温摇15min,使转录因子/dna复合体与蛋白a/抗体解离;
60.c.4℃1000rpm离心1min小心吸取上清,转移至新的1.5ml ep管中;
61.d.重复步骤b和c,将上清收集在同一ep管中;
62.e.将input、阴性对照、背景对照及目的片段样本各自加入20ul 5m nacl及5ul(20ug/ul)蛋白酶k,放置65℃水浴4h,解除转录因子/dna交联;
63.(4)dna片段纯化回收
64.a.将试剂盒中的spin column安置于collection tube上。
65.b.将上述10.3e中解交联后的洗脱液转移至spin column中,12,000rpm离心1min,弃滤液。
66.c.将滤液再加入spin column中离心一次,以提高dna片段的回收率。
67.d.将spin column置于新的1.5ml无菌ep管上,在spin column膜中央处加入30μl灭菌蒸馏水,室温静置1min后,12,000rpm离心1min洗脱dna片段。
68.(5)pcr检测转录因子在靶基因启动子区域的结合
69.a.chip实验所应用引物序列:
[0070][0071][0072]
b.pcr反应体系,按照下列组分,依次加入pcr反应体系:
[0073]
试剂使用量2
×
pcr mix或sybr10ul上游引物0.5ul下游引物0.5ul灭菌水4uldna片段5ul
[0074]
c.pcr反应条件:
[0075][0076]
d.将pcr产物用2%的琼脂糖进行凝胶电泳,凝胶成像或利用δct法计算相对结合丰度。
[0077]
结果表明,在将比目鱼肌组织固定裂解以及超声破碎后,利用chip级的smad3抗体进行免疫共沉淀,经过洗脱以及dna片段回收后,利用各自sbe位点上下游的引物对上述可能的sbe位点进行pcr扩增,成功的将mhc-iia的sbe3位点扩增出来,该结果表明,smad3直接的结合到mhc-iia基因启动子区域-54~-44的位点(图3)。
[0078]
实施例4 pgl-mhc-iia点突变载体(pgl-mhc-iia mut)的构建及smad3对pgl-mhc-iia mut载体转录活性的影响。
[0079]
在明确了smad3在mhc-iia基因启动子区域的直接结合位点之后,为了确认smad3
是通过结合mhc-iia的sbe3位点发挥了对mhc-iia基因的转录抑制作用,我们用transgen公司的点突变试剂盒对pgl-3-mhc-iia的sbe3将位点由ttgccagacaa突变为ttgtttttcaa,将其命名为pgl-mhc-iia mut。测序鉴定无误后进行后续试验(图4)。
[0080]
具体方法如下:
[0081]
a.合成突变用引物
[0082][0083]
b.以pgl-3-mhc-iia为模板,利用快速点突变试剂盒,按照下列体系扩增:
[0084][0085]
c.pcr反应条件:
[0086][0087]
d.加1μl dmt酶于pcr产物中,混匀,37℃孵育1h。
[0088]
e.按照上述步骤,将pcr产物转化、挑取单克隆后摇菌提取质粒测序,挑选成功进行突变后的质粒,命名为pgl-3-mhc-iia mut。
[0089]
结果表明,将pgl-3-mhc-iia mu载体分别与pcmv-myc-smad3表达载体或其空载体共同转染到hek293细胞中,以prl-tk为内参,转染24小时后给予或不给予tgf-β1因子(5ng/ml)刺激,24小时后检测双荧光素酶的活性。结果表明(图5),即使在共转染smad3表达质粒的情况下,tgf-β1因子刺激对pgl-3-mhc-iia mut的荧光素酶活性也没有影响。该结果证明,在突变掉smad3在mhc-iia基因启动子区域的直接结合位点之后,逆转了smad3对mhc-iia基因的转录抑制,明确了smad3是通过结合mhc-iia的sbe3发挥了对mhc-iia基因的转录
抑制作用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
