1.本发明涉及生物技术领域,尤其涉及一种目的基因可调控的工程化免疫细胞及其制备方法和应用。
背景技术:
2.当前,肿瘤的免疫细胞治疗已经成为手术、放疗、化疗外的第四种治疗肿瘤的手段,并将成为未来肿瘤治疗必选手段。免疫细胞治疗是采集患者外周静脉血,在gmp实验室内分离外周血单个核细胞,在多种细胞因子诱导下,大量扩增出具有高效抗瘤活性的免疫效应细胞,再通过静脉、皮内注射、介入等回输到患者体内,达到增强患者免疫功能和杀伤肿瘤细胞的目的,常用的免疫细胞治疗手段包括tcr-t,nk,car-t,cik、dc、til、dc cik细胞等。
3.在基因编辑技术的crispr-cas9系统中,crrna(crispr-derived rna)通过碱基配对与tracrrna结合形成双链rna,引导cas9蛋白至靶序列上,cas9蛋白的两个功能域可以发挥内切酶的切割作用,即hnh和ruvc结构域,分别切割基因组上与crrna的互补链和非互补链,造成dna的双链断裂(doublestrandbreak,dsb),从而启动细胞内的dna损伤修复机制,导致修复后发生插入/缺失(indel),达到移码突变的效果,最终实现基因敲除的目的,目前该技术已经成熟的运用于原核及真核生物的基因组编辑中。
4.然而随着car-t细胞治疗技术的不断研究和应用,发现了该细胞治疗技术还存在一些问题,例如在血液瘤中存在细胞因子释放综合征和神经毒性,有相当大比例的患者可能会复发,高昂的价格等副作用;实体瘤主要面临问题包括taa特异性及可接触性、肿瘤异质性、恶劣肿瘤微环境(tme)及t细胞归巢等问题。因此如何对car-t细胞进行优化,从而增强car-t细胞的功能是非常重要的。
5.文献报道,有科学家通过2a将il-15、il-12、il-18、il-21、il-7、il-23、ccl19等基因和car相连,如图1和2所示;共同转入免疫细胞中,让免疫细胞表达car的同时表达这些细胞因子,趋化因子等,有利于达到免疫细胞在体内的扩增、使免疫细胞分化表型处于早期、利于免疫细胞向肿瘤组织的迁移、克服肿瘤微环境等作用,从而提高car-t治疗肿瘤的疗效。例如,分泌il-15的car-t细胞在不含细胞因子的培养基中进行培养时,细胞扩增明显,到达100天时,依旧扩增,结果如图3。这样的扩增是不正常的,成瘤性风险大大增加。因此任何外源基因的过表达都是存在风险的,需要多方验证其安全性。
6.目前被广泛使用的诱导表达系统皆是将简化的内源启动子,如nfat-il2mini启动子系统,整合到病毒载体中,然后递送到细胞中,事实上内源基因的表达是一个及其复杂的调控过程,启动子往往包括几千个甚至更长的dna碱基序列,而且基因组的表观调控、反式调控和染色体高级结构都会影响目的基因的表达,因此现有表达系统存在诸多缺点,远不能实现对目的基因的精确表达。
7.综上所述,如何更好的控制外源基因的表达,既要保留其功能优势,又要避免过度表达造成的潜在危害,对提高免疫细胞治疗的有效性和安全性至关重要。
技术实现要素:
8.基于上述问题,本发明提供的是一种可以让外源基因实现精确诱导表达的方法,通过该方法可以一方面通过外源基因的表达增强免疫细胞的功能,如抗肿瘤;另一方面避免了外源基因持续表达所造成的潜在危害,如慢性、急性炎症或恶性转化等。具体是利用基因编辑技术,将目的基因精确插入到基因组相应位点,从而利用内源启动子系统控制该基因表达。
9.为解决上述技术问题,本发明目的之一采取以下技术方案:
10.一种目的基因可调控的工程化免疫细胞,即在所述免疫细胞的tcr应答基因位置插入目的基因,且所述tcr应答基因与目的基因共用相同的启动子;所述tcr应答基因为ifn-γ、pd-1、il-2、4-1bb、tim3或ctla-4中的一种;所述目的基因为il-15、il-12、il-21、il-18、il-21、il-7、il-23、ccl19或抗体scfv中的一种或几种。
11.在其中一个实施例,所述工程化免疫细胞中,所述目的基因插入所述tcr应答基因位置时,是利用crispr、zincfinger或talen中任一基因编辑手段,在tcr应答基因组相应位点制造双链断裂切口,并利用携带目的基因的aav、质粒或者pcr amplicon作为模板,将目的基因插入相应位点。
12.在其中一个实施例,所述工程化免疫细胞中,所述目的基因由t2a或者ires驱动来表达,并由tcr应答基因的启动子系统精准控制外源基因的表达。
13.在其中一个实施例,所述工程化免疫细胞中,所述目的基因在插入所述tcr应答基因位点为基因的3’utr、5’utr或者基因内部。
14.在其中一个实施例,所述工程化免疫细胞中,所述目的基因插入到tcr应答基因插入到tcr应答基因ifn-γ、pd-1、il-2、4-1bb、tim3及ctla-4中任一基因位置中。
15.在其中一个实施例,所述工程化免疫细胞中,所述免疫细胞为tcr-t细胞、t细胞、til细胞、nk细胞、nkt细胞、γ-δt细胞及巨噬细胞中的一种或几种,所述免疫细胞是靶向任何靶点的第一代car细胞、第二代car细胞、第三代car细胞、第四代car细胞或者双car细胞。
16.在其中一个实施例,所述工程化免疫细胞中,所述靶点为血液瘤靶点和实体瘤靶点;其中,所述血液瘤靶点包括cd19、bcma、cd20及cd22中一个或多个;所述实体瘤靶点cea、gpc3、cd171、claudin18.2及psma中的一个或多个。
17.本发明还提供上述工程化免疫细胞的制备方法,包括如下步骤:
18.外周血pbmc的分离和免疫细胞的扩增:从外周血分离出单个核细胞,并分选出免疫细胞进行激活培养,同时加入靶向claudin18.2的car的慢病毒,将car基因转导至免疫细胞基因组,培养和扩增;
19.工程化免疫细胞改造:设计好靶向tcr应答基因的grna,目的基因的模板利用aav将其带入细胞,电转grna和cas9蛋白至免疫细胞;:往免疫细胞中加入moi为10e3-10e6的aav病毒,将目的基因插入tcr应答基因中;
20.工程化免疫细胞细胞培养:对免疫细胞培养换液处理,用免疫细胞完全培养基培养免疫细胞,收获工程化免疫细胞。
21.本发明还提供了一种生物制剂,该生物制剂含有上述任一项所述的工程化免疫细胞。
22.本发明还提供上述生物制剂在制备预防和/或治疗癌症或肿瘤的药物中应用,如,
生物制剂具体为药学上可接受的载体、稀释剂或赋形剂上的应用;肿瘤选自血液肿瘤、实体瘤或其组合;所述血液肿瘤选自急性髓细胞白血病(aml)、多发性骨髓瘤(mm)、慢性淋巴细胞白血病(cll)、急性淋巴白血病(all)、弥漫性大b细胞淋巴瘤(dlbcl)或其组合;所述实体瘤选自胃癌、胃癌腹膜转移、肝癌、白血病、肾脏肿瘤、肺癌、小肠癌、骨癌、前列腺癌、结直肠癌、乳腺癌、大肠癌、宫颈癌、卵巢癌、淋巴癌、鼻咽癌、肾上腺肿瘤、膀胱肿瘤、非小细胞肺癌(nsclc)、脑胶质瘤、子宫内膜癌或其组合。
23.与现有技术相比,本发明取得以下有益效果:
24.工程化免疫细胞,当含有目的基因的免疫细胞与靶细胞结合后,除了免疫细胞本身发挥杀伤作用及细胞因子正常分泌外,免疫细胞经过基因编辑插入的目的基因会被激活后进行表达,从而增强免疫细胞的功能,提高免疫细胞治疗的安全性。
25.当含有目的基因的免疫细胞与阳性靶细胞结合后,会刺激下游通路,使得tcr应答基因ifn-γ、pd-1、il-2、4-1bb、tim3、ctla-4中任意基因被激活,从而目的基因进行高表达,这是由于目的基因与被tcr应答基因共用相同的启动子,进而增强了免疫细胞的杀伤作用、提高了安全性;而当没有阳性靶细胞的刺激时,目的基因不会进行表达,从而实现目的基因的表达受到调控。
附图说明
26.图1为现有技术中claudin18.2 car il-15结构图;
27.图2为现有技术中claudin18.2 car结构图;
28.图3为背景技术中claudin18.2 il-15car-t细胞的扩增曲线;
29.图4为实施例中的过表达细胞系hgc-27-claudin18.2流式检测图;
30.图5为实施例中的制备car-t细胞的扩增曲线;
31.图6为实施例中培养过程中的t细胞的car表达;
32.图7a、7b分别为实施例中的t细胞磁珠刺激24h后ifn-γ和il-15因子分泌量;
33.图8为实施例中的car-t细胞24h杀伤实验数据;
34.图9a、9b分别为实施例中的杀伤实验上清中ifn-γ和il-15因子分泌量;
35.图10a、10b分别为实施例中的car-t细胞和靶细胞共培养24h后ifn-γ和il-15因子分泌量;
36.图11a、11b分别为实施例中的car-t细胞和靶细胞共培养48h后ifn-γ和il-15因子分泌量;
37.图12为实施例中的car-t细胞和靶细胞共培养组无靶细胞时il-15因子分泌量;
38.图13为实施例1的小鼠生存率曲线。
具体实施方式
39.本发明提供的一种目的基因可调控的工程化免疫细胞,即免疫细胞的tcr应答基因位置插入目的基因,且所述tcr应答基因与目的基因共用相同的启动子;所述tcr应答基因包括ifn-γ、pd-1、il-2、4-1bb、t m3及ctla-4中的一种;所述目的基因包括il-15、il-12、il-18、il-21、il-7、il-23及ccl19中的一种。
40.在其中一个实施例,所述工程化免疫细胞中,所述目的基因插入所述tcr应答基因
位置时,是利用crispr-cas9技术通过sgrna将目的基因插入tcr应答基因位置中的。
41.在其中一个实施例,所述工程化免疫细胞中,所述sgrna将目的基因插入tcr应答基因位置时,是采用aav载体将带有所述目的基因的模板递送到免疫细胞中。该递送方式相比于电转质粒或者单链、双链dna的形式递送,具有更高的编辑效率,其效率可达到70%-80%。
42.在其中一个实施例,所述工程化免疫细胞中,所述免疫细胞是将il-15目的基因插入到ifn-γ基因位置中,使il-15的表达利用ifn-γ的启动子,受ifn-γ的启动子的调控。
43.在其中一个实施例,所述工程化免疫细胞中,所述免疫细胞是将il-15目的基因插入到pd-1基因位置,使il-15的表达利用pd-1的启动子,受pd-1的启动子的调控。
44.在其中一个实施例,所述工程化免疫细胞中,所述免疫细胞是将il-15目的基因插入到il-2基因位置,使il-15的表达利用il-2的启动子,受il-2的启动子的调控。
45.在其中一个实施例,所述工程化免疫细胞中,所述免疫细胞是将il-15目的基因插入到4-1bb基因位置,使il-15的表达利用4-1bb的启动子,受4-1bb的启动子的调控。
46.在其中一个实施例,所述工程化免疫细胞中,所述免疫细胞是将il-15目的基因插入到tim3基因位置,使il-15的表达利用tim3的启动子,受tim3的启动子的调控。
47.在其中一个实施例,所述工程化免疫细胞中,所述免疫细胞是将il-15目的基因插入到ctla-4基因位置,使il-15的表达利用ctla-4的启动子,受ctla-4的启动子的调控。
48.在其中一个实施例,所述工程化免疫细胞中,所述免疫细胞是将il-18目的基因插入到ifn-γ基因位置中,使il-18的表达利用ifn-γ的启动子,受ifn-γ的启动子的调控。
49.在其中一个实施例,所述工程化免疫细胞中,所述免疫细胞是将il-18目的基因插入到pd-1基因位置,使il-18的表达利用pd-1的启动子,受pd-1的启动子的调控。
50.在其中一个实施例,所述工程化免疫细胞中,所述免疫细胞是将il-18目的基因插入到il-2基因位置,使il-18的表达利用il-2的启动子,受il-2的启动子的调控。
51.在其中一个实施例,所述工程化免疫细胞中,所述免疫细胞是将il-18目的基因插入到4-1bb基因位置,使il-18的表达利用4-1bb的启动子,受4-1bb的启动子的调控。
52.在其中一个实施例,所述工程化免疫细胞中,所述免疫细胞是将il-18目的基因插入到tim3基因位置,使il-18的表达利用tim3的启动子,受tim3的启动子的调控。
53.在其中一个实施例,所述工程化免疫细胞中,所述免疫细胞是将il-18目的基因插入到ctla-4基因位置,使il-18的表达利用ctla-4的启动子,受ctla-4的启动子的调控。
54.在其中一个实施例,所述工程化免疫细胞中,所述免疫细胞为外周血中的tcr-t细胞、t细胞、til细胞、nk细胞、nkt细胞、γ-δt细胞及巨噬细胞中的一种或几种。
55.在其中一个实施例,所述工程化免疫细胞中,所述免疫细胞是靶向任何靶点的第一代car细胞、第二代car细胞、第三代car细胞、第四代car细胞或者双car细胞。
56.在其中一个实施例,所述工程化免疫细胞中,所述靶点为血液瘤靶点和实体瘤靶点;其中,所述血液瘤靶点包括cd19、bcma、cd20、cd22;所述实体瘤靶点cea、gpc3、cd171、claudin18.2及psma。
57.本发明还提供了一种生物制剂,该生物制剂含有上述任一项所述的工程化免疫细胞。
58.本发明还提供了一种制备方法,该制备方法可制备上述任一项所述的工程化免疫
细胞。
59.本发明还提供上述生物制剂在制备预防和/或治疗癌症或肿瘤的药物中应用,如,生物制剂具体为药学上可接受的载体、稀释剂或赋形剂上的应用;肿瘤选自血液肿瘤、实体瘤或其组合;所述血液肿瘤选自急性髓细胞白血病(aml)、多发性骨髓瘤(mm)、慢性淋巴细胞白血病(cll)、急性淋巴白血病(all)、弥漫性大b细胞淋巴瘤(dlbcl)或其组合;所述实体瘤选自胃癌、胃癌腹膜转移、肝癌、白血病、肾脏肿瘤、肺癌、小肠癌、骨癌、前列腺癌、结直肠癌、乳腺癌、大肠癌、宫颈癌、卵巢癌、淋巴癌、鼻咽癌、肾上腺肿瘤、膀胱肿瘤、非小细胞肺癌(nsclc)、脑胶质瘤、子宫内膜癌或其组合。
60.下面结合附图,对本发明的较佳实施例作进一步详细说明。
61.本发明以car-t细胞为例,代表性地对本发明的免疫细胞进行详细说明。本发明的免疫细胞不限于上下文所述的car-t细胞,本发明的免疫细胞具有与上下文所述的car-t细胞相同或类似的技术特征和有益效果。具体地,当免疫细胞表达嵌合抗原受体car时,nk细胞、nkt细胞、til、γ-δt细胞等同于t细胞(或t细胞可替换nk细胞)。
62.(一)工程化免疫细胞制备
63.il-15目的基因插入免疫细胞的tcr应答基因位置制备工程化免疫细胞,步骤如下:
64.步骤一:外周血pbmc的分离和car-t细胞的扩增
65.从供体外周血中分离单个核细胞,使用ficol分离技术,进行密度梯度离心,并用t细胞分选试剂盒富集t细胞(cd3 microbeads,human-lyophilized,130-097-043),使用偶联anti-cd3/anti-cd28的磁珠激活培养和扩增t细胞;培养基使用x-vivo培养基且含10%fbs及300iu/ml rh-il2,所有细胞均置于37℃,5%co2恒温培养箱中培养。
66.步骤二:细胞系培养
67.表达claudin18.2的细胞系:hgc-27-claudi n18.2,自己构建。
68.不表达claudin18.2的细胞系:hgc-27(人胃癌细胞系),购自atcc。
69.包装用细胞:293t(人胚肾细胞系),购自atcc。
70.过表达肿瘤细胞系的建立:将表达claudin18.2的碱基序列克隆至慢病毒载体骨架中,设计含有该序列的质粒,将该质粒利用三质粒包装系统和使用lipofectamine3000转入包装用细胞293t中,制备慢病毒完整表达载体;分别在48h和72h收集病毒上清,超速离心后进行浓缩(merck millipore)处理;浓缩后的病毒即可用于感染hgc-27,最终得到过表达claudin18.2的hgc-27细胞系,命名为hgc-27-claudin18.2。如图4为hgc-27-claudin18.2细胞表达claudin18.2的检测图;由图可知,hgc-27-claudin18.2细胞完全表达claudin18.2。
71.培养基培养:hgc-27-lv035、hgc-27、293t等三种细胞使用dmem培养基培养,三种细胞中的所有培养基中均添加10%(v/v)胎牛血清。
72.步骤三:car结构设计与慢病毒包装
73.claudin18.2 car结构,即靶向claudin18.2的car结构:
74.本发明使用的car-t类型为第二代car。靶细胞的基因编辑所用到的car的核心结构包括分泌信号肽序列、来自anti-claudin18.2的抗体的scfv、cd8跨膜区及胞内段刺激信号icos-cd3ζ(命名为claudin18.2 car),如图2所示。阳性对照细胞结构如图2所示,命名为
claudin18.2 car il-15。
75.将上述两种结构(即claudin18.2 car结构及claudin18.2 car il-15)的表达框克隆至慢病毒载体骨架中,设计含有该序列的质粒,将该质粒利用四质粒包装系统和使用lipofectamine3000转入包装用细胞293t中,制备慢病毒完整表达载体;分别在48h和72h收集病毒上清,超速离心进行浓缩(merck millipore)处理;浓缩后的病毒即可用于感染t细胞。
76.步骤四:car-t细胞制备与改造
77.4.1慢病毒感染
78.4.1.1将分离纯化的原代t细胞在激活1天后,利用步骤三包装设计的claudin18.2 car、claudin18.2 car il-15的慢病毒,按moi(1-10)进行慢病毒载体感染。将claudin18.2 car、claudin18.2 car il-15的慢病毒分别转移至两个细胞培养瓶,置于37℃,5%co2恒温培养箱中培养;
79.4.1.2分离纯化的原代t细胞在第0天,利用步骤三包装的claudin18.2 car的慢病毒,按moi(1-10)进行慢病毒载体感染,转移至细胞培养瓶,置于37℃,5%co2恒温培养箱中培养。
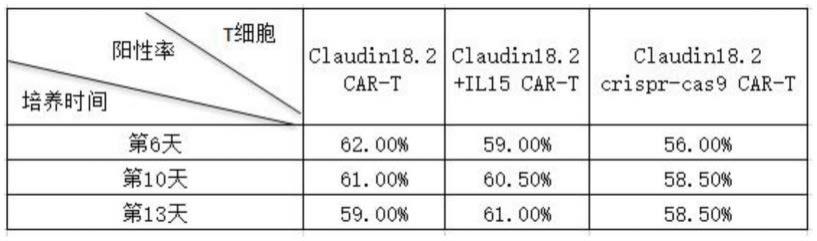
80.4.2电转
81.在4.1.2步骤中慢病毒感染的t细胞激活2天后,进行去磁珠操作,利用pga、ifn-γ-grna和cas9蛋白进行电转敲除操作,利用aav将il-15目的基因片段转入靶细胞内的tcr应答基因中,之后将该靶细胞转移至24孔板,置于37℃,5%co2恒温培养箱中继续培养。
82.(二)、工程化免疫细胞培养与试验检测
83.1、细胞增殖及car阳性率检测
84.慢病毒感染后第6、10、13天,每天取样检测细胞数量,第6、10、13天分别检测t细胞的car阳性率。每隔1-2天传代补加培养基。
85.利用两种慢病毒载体,即claudin18.2 car、claudin18.2 car il-15的慢病毒,成功构建了三种car-t细胞,分别命名为claudin18.2 car-t,claudin18.2 il15 car-t、claudin18.2 crispr-cas9 car-t,以不感染慢病毒的t细胞为对照(nt)。
86.如图5所示,四种t细胞的增殖速率;其中,由图可知插入il-15目的基因序列对于细胞的增值速率无显著影响。
87.如图6和表1所示,分别是培养第6、10、13天后三种t细胞car的表达情况,由图6和表1可见,插入il-15目的基因后对阳性率无影响,即目的基因受调控对car阳性率无显著影响,表现为正常。
88.表1三种t细胞car的表达情况
89.90.2、磁珠刺激前后检测ifn-γ、il-15因子分泌量
91.分别取培养的第10天的四中t细胞各0.5
×
106个,分为两组,其中一组按照3:1的比例加入激活磁珠,另外一组不加磁珠激活;激活的一组在激活后24h进行上清中ifn-γ和il-15的检测;24h两种因子检测结果如图7a、7b和表2所示,其中il-15因子,在未刺激前claudin18.2 il15 car-t细胞的分泌量高于其他细胞,刺激(即激活)后claudin18.2 il15 car-t、claudin18.2crispr-cas9 car-t该因子分泌量较高;ifn-γ因子的分泌量,在刺激前后四种细胞的分泌量相差较小,刺激后显著升高。
92.表2检测出细胞因子il-15和ifn-γ的含量
[0093][0094]
由检测结果可知,改造的car-t细胞经过磁珠刺激后其il-15的分泌量显著增加,ifn-γ的分泌量正常,未受到插入序列的影响。
[0095]
3、细胞体外杀伤实验
[0096]
3.1对步骤四获得的四种t细胞,分别为claudi n18.2 car-t、claudin18.2 il15 car-t、claudin18.2 crispr-cas9 car-t、不感染慢病毒的t细胞为对照(nt)等进行体外杀伤实验。rtca dp多功能实时无标记细胞分析仪检测car-t细胞的杀伤效应,hgc-27-claudin18.2过表达系细胞按照效靶比1:1、1:3、1:9进行杀伤实验,48h后杀伤效率明显。hgc-27-claudin18.2过表达系细胞24h杀伤结果,如图8所示;car-t细胞与hgc-27-claudin18.2细胞的杀伤率可达到80.00%以上,并且存在较小的非特异性杀伤,即10%左右。
[0097]
3.2杀伤实验后检测ifn-γ、il-15因子分泌量
[0098]
对于3.1步骤中进行的杀伤实验,在实验结束后收集上清,离心后取上清检测细胞因子ifn-γ、il-15的释放水平,采用elisa试剂盒进行检测;hgc-27-claudin18.2过表达系细胞两种因子检测结果,如图9a、9b、表3和表4所示;其中,图9a对应表3;图9b对应表4,其细胞因子ifn-γ和il-15的分泌量均与效靶比呈正相关,即效靶比越高,分泌量越多,同一种细胞,效靶比为1:1的分泌量最多;不同种细胞中,hgc-27-claudin18.2过表达系细胞对应的细胞因子分泌量都优于其他细胞。
[0099]
表3 ifn-γ细胞因子释放量
[0100][0101]
表4 il-15细胞因子释放量
[0102][0103]
4、共培养实验后因子检测
[0104]
将car-t细胞(步骤四获得)2.0
×
106个与hgc-27-claudin18.2细胞分别以1:1效靶比混合(设置nt对照组),置于dmem完全培养基中,共培养24h、48h,收集上清,离心后取上清检测细胞因子ifn-γ、il-15的释放水平,采用elisa试剂盒进行检测,检测结果如图10a、10b、11a、11b、表5、表6、表7和表8所示(其中,图10a对应表5,图10b对应表6;图11a对应表7,图11b对应表8),car-t细胞与hgc-27-claudin18.2靶细胞共培养后,claudin18.2 crispr-cas9 car t细胞会释放大量il-15,ifn-γ的分泌量未受到影响;单独培养组,car-t细胞只少量分泌il-5,表明car-t细胞上il-15的表达受到调控,能被肿瘤表面抗原有效且特异性的激活;此外,当car-t细胞与hgc-27-claudin18.2靶细胞共培养后,均释放大量ifn-γ因子。
[0105]
当共培养组的实验处于末期,即共培养组无hgc-27-claudin18.2细胞存在时,取每组的细胞上清进行il-15释放水平的检测,检测结果如图12、表9所示,由实验结果可知,
当无hgc-27-claudin18.2细胞存在时,claudin18.2crispr-cas9 car t组的il-15释放量恢复到单独培养组释放量水平,即分泌量减少,由此可见il-15的表达受到了调控。
[0106]
表5 ifn-γ细胞因子分泌量
[0107][0108]
表6 il-15细胞因子分泌量
[0109][0110]
表7 ifn-γ细胞因子分泌量
[0111][0112]
表8 il-15细胞因子分泌量
[0113][0114]
表9 il-15细胞因子分泌量
[0115][0116]
5、体内药效学实验
[0117]
将靶细胞hgc-27-claudin18.2对4-6周ncg免疫缺陷小鼠进行皮下注射后,待小鼠7天左右体身体内出现明显肿瘤硬块后,静脉注射不同的car-t细胞(步骤四获得),并持续观察肿瘤生长情况及小鼠生存情况。试验结果如图13所示,注射claudin18.2 crispr-cas9 car t细胞后显著延长小鼠生存时间。
[0118]
本发明提供的工程化免疫细胞,当含有目的基因的免疫细胞与靶细胞结合后,除了免疫细胞本身发挥杀伤作用及细胞因子正常分泌外,免疫细胞经过tcr应答基因编辑插入的目的基因会被激活后进行表达,从而增强免疫细胞的功能,提高免疫细胞治疗的安全性。当含有目的基因的免疫细胞与靶细胞结合后,会刺激下游通路,使得tcr应答基因ifn-γ、pd-1、il-2、4-1bb、tim3、ctla-4中任意基因被激活,从而进行高表达,这是由于目的基因与被tcr应答基因共用相同的启动子,所以目的基因进行表达、增强了免疫细胞的杀伤作用、提高了安全性;而当没有靶细胞的刺激时,目的基因不会进行表达,从而实现目的基因的表达受到调控。
[0119]
以上所述实施例仅表达了本发明的一种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。