1.本发明涉及镍催化合成技术领域,具体而言,涉及一种镍催化合成多取代联烯的方法。
背景技术:
2.联烯是有机合成中常用的合成子,可以进行各种形式多样的官能团转化反应。此外,联烯骨架还广泛存在于天然产物、药物分子以及先进功能材料分子结构中。因此,通过廉价易得的原料,通过简单高效的催化体系,发展出高效构建多取代联烯一直是有机合成中重要的研究课题之一。
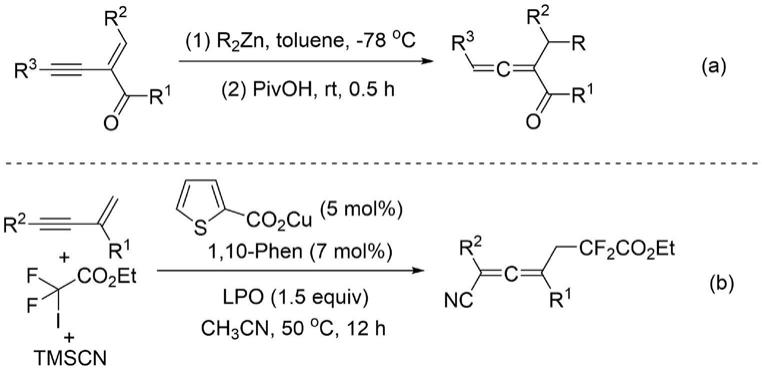
3.在众多的合成方法中,1,3-烯炔的官能团化反应是合成联烯的常用策略。在离子途径下,烷基锌试剂和1,3-烯炔可以在低温下反应,得到多取代1,2-联烯基酮(如a式所示)。另外,在铜催化条件下,烷基自由基和 1,3-烯炔也可以高效合成四取代联烯(如b式所示)。
[0004][0005]
离子和自由基途径合成联烯
[0006]
在上述两种策略下,以还原型“自由基—离子”交错反应为策略,在可见光催化条件下,1,3-烯炔和碳中心自由基以还原型“自由基—离子”交错为主要历程,也有多取代联烯合成的报道,如下式所示:
[0007][0008]
还原型“自由基—离子”交错途径合成联烯
[0009]
和离子途径和自由基途径相比,“自由基—离子”交错途径合成联烯的报道还不多。此外,现有的可见光催化的“自由基—离子”交错反应中,烷基自由基主要局限于伯碳自由基,而且高价硅的自由基前体的原子经济性较差,这些都限制了该方法的进一步应用,且操作复杂、成本较高,不易于进行推广使用。
技术实现要素:
[0010]
本发明所要解决的技术问题是,克服现有还原型“自由基—离子”交错反应合成联烯的方法中,自由基局限于伯碳自由基、原子经济性差等缺点,提供一种操作简单、经济性好且底物普适性广的高产率多取代联烯合成新方法。
[0011]
为解决上述问题,本发明提供一种镍催化合成多取代联烯的方法,包括以下步骤:
[0012]
s1:往具有搅拌子的反应管中加入镍催化剂、联吡啶配体、1,3-烯炔、锌粉、溴代烷烃以及n,n-二甲基乙酰胺得到混合液;
[0013]
s2:将s1处理后的混合液进行搅拌操作得到反应液;
[0014]
s3:将步骤s2处理后的反应液进行萃取后提取有机相,将有机相洗涤并干燥后再次进行过滤并通过旋转蒸发仪除去溶剂;
[0015]
s4:用石油醚和乙酸乙酯的混合液作为淋洗剂对步骤s3处理后的有机相进行柱层析分离,经旋转蒸发仪蒸馏后得到多取代联烯化合物。
[0016]
作为优选的方案:所述步骤s1中,所述联吡啶配体为2,2
’‑
联吡啶。
[0017]
作为优选的方案:所述步骤s1中,所述1,3-烯炔为2-酰基-1,3-烯炔。
[0018]
作为优选的方案:所述1,3-烯炔、镍催化剂、联吡啶配体、锌粉、溴代烷烃、n,n-二甲基乙酰胺的摩尔配比为1:(0.01-0.03):(0.1-0.3): (2-3):(2-3):(400-450)。
[0019]
作为优选的方案:所述镍催化剂为乙二醇二甲醚溴化镍。
[0020]
作为优选的方案:所述步骤s2的反应通式如下:
[0021][0022]
作为优选的方案:所述步骤s2中,所述搅拌的操作为:在20-30℃的条件下进行搅拌24h。
[0023]
作为优选的方案,所述步骤s3中,萃取的方式为:在反应液中加入饱和氯化铵水溶液后通过乙酸乙酯萃取。
[0024]
作为优选的方案,所述步骤s4中,所述的淋洗剂为体积比(25-100) ︰1石油醚和乙酸乙酯混合后的所得混合液。
[0025]
作为优选的方案,所述柱层析分离中硅胶柱的长度为20cm。
[0026]
本发明的有益效果是:本发明首次发展了在镍催化体系下,通过烷基自由基和2-酰基-1,3-烯炔的加成/还原/异构化,合成了一系列多取代联烯;本发明具有反应条件温和、操作简单、反应经济性好、底物普适性好、官能团兼容性强的优点,克服了现有还原型“自由基—离子”交错反应合成联烯的方法中,自由基局限于伯碳自由基、原子经济性差的缺点。
具体实施方式
[0027]
下面将对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0028]
下面用具体实施例对本发明做进一步详细说明,但本发明不仅局限于以下具体实施例。
[0029]
实施例一
[0030]
s1:加入乙二醇二甲醚溴化镍(6.2mg,0.02mmol,0.1equiv),2-苯甲酰基-1,3-烯炔(57.6mg,0.2mmol,1.0equiv),锌粉(39mg,0.6mmol,3.0 equiv),2,2
’‑
联吡啶(4.7mg,0.03mmol,0.15equiv),往反应管中放入磁子,称完后将反应管进行抽真空-放氮气循环3次,随后在氮气下向反应管中加入干燥的n,n-二甲基乙酰胺(2ml)和溴代物(108.4mg,0.4mmol),用封口膜将橡胶塞封紧。
[0031]
s2:将s1处理后的反应管置于室温搅拌反应24h后,停止反应;
[0032]
s3:将步骤s2处理后的反应液加入6ml的饱和氯化铵溶液搅拌30 min,分层后的水相用乙酸乙酯(4
×
10ml)萃取,有机相合并用5ml的饱和食盐水洗涤,有机相用mgso4干燥15min后过滤,滤液旋蒸除去溶剂
[0033]
s4:然后用石油醚与乙酸乙酯的混合液(v
石油醚
:v
乙酸乙酯
=25:1)柱层析,柱层析分离中硅胶柱的长度为20cm,得目标联烯85.5mg,测得收率为89%(dr=49:51)。
[0034]
上述步骤s2中,处理的反应式如下:
[0035][0036]
分析数据如下:
[0037]1h nmr(500mhz,cdcl3)δ8.03-8.00(m,2h),7.65-7.63(m,1h), 7.56-7.51(m,2h),7.47-7.39(m,5h),7.36-7.25(m,4h),7.24-7.20(m, 1h),[5.47(d,j=0.9hz,0.45h),5.46(d,j=1.0hz,0.55h)],4.49-4.39(m,2h), [4.26(s,0.45h),4.23(s,0.55h)],2.05-1.80(m,2h),1.16-1.13(m,6h),[0.95(s, 4.95h),0.69(s,4.05h)].
13
c nmr(126mhz,cdcl3)δ213.4,212.5,196.2, 195.5,166.6(0),166.5(8),141.0,140.9,138.5(2),138.4(7),132.8,131.2,131.0, 130.5,130.4(5),130.4(1),129.5,128.7,128.5,128.3(1),128.2(6),127.6(3), 127.5(5),127.4(6),126.5(2),126.5(0),111.5,111.3,108.7,108.5,62.3,52.4, 51.7,38.7,38.3,38.0,36.8,33.6,33.3,29.5,29.1,25.8,25.4,25.1,24.9.hrms (esi)[m h]
:calculated for c
33h37
o3:481.2743,found 481.2733.
[0038]
实施例二:
[0039]
s1:往反应管中放入磁子,加入乙二醇二甲醚溴化镍(6.2mg,0.02mmol, 0.1equiv),2-苯甲酰基-1,3-烯炔(63.7mg,0.2mmol,1.0equiv),锌粉(39mg, 0.6mmol,3.0equiv),2,2
’‑
联吡啶(4.7mg,0.03mmol,0.15equiv)。称完后将反应管进行抽真空-放氮气循环3次,随后在氮气下向反应管中加入干燥的n,n-二甲基乙酰胺(2ml)和叔丁基溴
(54.8mg,0.4mmol),用封口膜将橡胶塞封紧;
[0040]
s2:将s1处理后的反应管置于室温搅拌反应24h后,停止反应;
[0041]
s3:将步骤s2处理后的反应液加入6ml的饱和氯化铵溶液搅拌30 min,分层后的水相用乙酸乙酯(4
×
10ml)萃取,有机相用5ml的饱和食盐水洗一次,合并有机相用mgso4干燥15min,过滤,滤液旋蒸除去溶剂;
[0042]
s4:用石油醚与乙酸乙酯的混合液(v
石油醚
:v
乙酸乙酯
=100:1)快速柱层析,柱层析分离中硅胶柱的长度为20cm,得目标联烯60.2mg,测得收率为80%(dr=14:86)。
[0043]
上述步骤s2处理的反应式如下:
[0044][0045]
分析数据如下:
[0046]1h nmr(500mhz,cdcl3)δ7.64-7.51(m,2h),7.43-7.38(m,1h), 7.37-7.29(m,4h),6.83-6.78(m,2h),[5.43(d,j=0.9hz,0.38h),5.40(d,j= 1.1hz,0.62h)],[4.08(s,0.38h),4.03(s,0.62h)],[3.79(s,1.86h),3.78(s, 1.14h)],[1.03(s,5.58h),1.00(s,3.42h),0.95(s,5.58h),0.70(s,3.42h)].
13
c nmr(126mhz,cdcl3)δ213.2,212.4,196.5,195.8,157.98,157.96,138.8, 138.7,134.0,133.9,131.2,131.1(1),131.0(9),130.9,128.7,128.5,127.5, 127.4,112.8,112.7,112.3,112.2,108.4,108.1,55.1(3),55.1(2), 51.8,51.2,36.1,34.9,33.6,33.2,29.5,29.1,28.4,28.3.hrms(esi)[m h]
: calculated for c
26h33
o2:377.2481,found 377.2486.
[0047]
实施例三:
[0048]
s1:往反应管中放入磁子,加入乙二醇二甲醚溴化镍(6.2mg,0.02mmol, 0.1equiv),2-苯甲酰基-1,3-烯炔(63.7mg,0.2mmol,1.0equiv),锌粉(39mg, 0.6mmol,3.0equiv),2,2
’‑
联吡啶(4.7mg,0.03mmol,0.15equiv)。称完后将反应管进行抽真空-放氮气循环3次,随后在氮气下向反应管中加入干燥的n,n-二甲基乙酰胺(2ml)和高苄基溴代物(85.2mg,0.4mmol),用封口膜将橡胶塞封紧。;
[0049]
s2:反应管置于室温搅拌反应24h后,停止反应;
[0050]
s3:反应液加入6ml的饱和氯化铵溶液搅拌30min,分层后的水相用乙酸乙酯(4
×
10ml)萃取,合并有机相用mgso4干燥15min,过滤,滤液旋蒸除去溶剂;
[0051]
s4:然后用石油醚与乙酸乙酯的混合液(v
石油醚
:v
乙酸乙酯
=25:1)快速柱层析,柱层析分离中硅胶柱的长度为20cm,得目标联烯73.3mg,测得收率为81%(dr=38:62)。。
[0052]
上述步骤s2处理的反应式如下:
[0053][0054]
分析数据如下:
[0055]1h nmr(500mhz,cdcl3)δ7.67-7.54(m,2h),7.46-7.31(m,5h), 7.27-7.17(m,3h),7.12-7.09(m,2h),6.86-6.83(m,2h),[5.50(s,0.62h),5.48 (d,j=1.0hz,0.38h)],[4.23(s,0.62h),4.19(s,0.38h)],3.81(s,3h),2.81-2.65 (m,2h),[1.01-0.91(m,9.42h),0.76(s,5.58h)].
13
c nmr(126mhz,cdcl3)δ 213.3,212.5,196.4,195.7,158.1(0),158.0(9),139.1,139.0,138.7,138.6,133.4, 133.3,131.6,131.5,131.2,130.9(5),130.9(0),130.8(8),128.7,128.5,127.6, 127.5,127.4,125.7,112.9(5),112.8(7),112.1,111.9,108.5,108.3,55.1(5), 55.1(3),52.3,51.7,46.4,46.1,39.7,38.6,33.6,33.3,29.6,29.1,24.7,24.6,24.3, 23.9.hrms(esi)[m h]
:calculated for c
32h37
o2:453.2794,found 453.2788.
[0056]
虽然本公开披露如上,但本公开的保护范围并非仅限于此。本领域技术人员,在不脱离本公开的精神和范围的前提下,可进行各种变更与修改,这些变更与修改均将落入本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。