1.本发明涉及药物合成技术领域,具体涉及种麦角甾醇或其衍生物的制备方法。
背景技术:
2.麦角甾醇是生产维生素d2的前体,也是生产激素类药物的中间体,在紫外线照射下可被转化为维生素d2。麦角甾醇是从真菌类酵母与麦角菌中发现的一种植物固醇,是微生物细胞膜的重要组成部分,对确保细胞膜的完整性、膜结合酶的火星、膜的流动性、细胞活力以及细胞物质运输等起着重要作用。有研究显示,麦角甾醇可能具有抗肿瘤特性。
3.目前生产麦角甾醇的生物制备方法是从培养的酵母内提取,通过培养酵母菌体,破碎后提取麦角甾醇,收率非常低,废水量大,而且经该方法提取的麦角甾醇含有其他同系物,提取分离相对困难,目前未有成熟合成的相关路线报道。
4.在化学合成方面,对于麦角甾醇侧链的构造,已知的有用wittig试剂进行亲核反应,但wittig试剂的制备为高温反应,制备过程中容易发生甲基异构,反应的转化率比较低,且产物难以纯化,导致反应整体收率偏低,亲核反应选择性也比较差。
技术实现要素:
5.本发明提供了种麦角甾醇或其衍生物的制备方法,用以解决目前现有麦角甾醇制备过程中亲核反应选择性差、反应整体收率低的技术问题,提供一种新的麦角甾醇的合成工艺。
6.为解决上述技术问题,本发明采用以下技术方案:
7.一种麦角甾醇或其衍生物的制备方法,包括以下步骤:
8.s1、将化合物3与亲核试剂反应获得化合物4;所述化合物3具有式3所示的结构式:所述化合物4具有式4所示的结构式:所述亲核试剂具有式a所示的结构式:其中,r1基团选自基团选自中的一种;
9.s2、将化合物4依次经酯化反应和还原反应转化为具有式6所示的结构式的所述麦角甾醇或其衍生物:
[0010][0011]
上述技术方案的设计思路在于,在麦角甾醇或其衍生物的制备工艺中,采用结构独特的亲核试剂与特定化合物反应可用于构造麦角甾醇的侧链,该条件下对麦角甾醇母核22位羰基的亲核反应具有较高的选择性,可大幅提高麦角甾醇或其衍生物的制备收率。
[0012]
作为上述技术方案的进一步优选,将化合物4转化为所述麦角甾醇或其衍生物的具体过程为:将所述化合物4经酯化反应获得烯醇酯类化合物5,所述化合物5具有式5所示的结构式:再将所述化合物5经过还原剂还原得到麦角甾醇或其衍生物。
[0013]
作为上述技术方案的进一步优选,s1中所述化合物3与亲核试剂在碱性条件下于溶剂中进行反应,所述碱性条件通过添加碱性物质实现,所述碱性物质包括正丁基锂、1,8-二氮杂双环[5.4.0]十一碳-7-烯、六甲基二硅基氨基锂、六甲基二硅基氨基钠和六甲基二硅基胺基钾中的至少一种,进一步优选为六甲基二硅基氨基钠。采用以上强碱性物质构建反应所需的碱性环境有利于反应获得期待的产品构型比例。如果碱性物质的碱性太弱,影响转化率和收率。
[0014]
作为上述技术方案的进一步优选,s1中所述化合物3与亲核试剂反应的过程中还添加有冠醚。冠醚与碱性物质中的金属正离子络合,同时把它相应的负离子裸露从而反应活性更高,能迅速反应,提高收率,同时,发明人意外发现,碱和溶剂的改变以及冠醚的添加可以改变产物构型比例(e/z)。
[0015]
作为上述技术方案的进一步优选,所述冠醚包括18-冠-6、12-冠-4和苯并-15-冠-5中的至少一种,进一步优选为苯并-15-冠-5。不同的冠醚对金属离子的结合能力相差较大,因此需要使用不同的冠醚配对不同的碱性物质。
[0016]
作为上述技术方案的进一步优选,所述溶剂包括四氢呋喃(thf)、甲苯和n,n-二甲基甲酰胺(dmf)中的一种。
[0017]
作为上述技术方案的进一步优选,s1中所述化合物3和亲核试剂的反应温度为-70~-80℃。
[0018]
作为上述技术方案的进一步优选,s2中所述化合物4经过酯化反应获得化合物5,所用酯化试剂包括醋酐、乙酰氯和粗酸异丙烯酯中的至少一种。
[0019]
作为上述技术方案的进一步优选,所述酯化反应在催化剂的催化作用下完成,所述催化剂包括pts、hcl、h2so4、hclo4和msoh中的至少一种。
[0020]
作为上述技术方案的进一步优选,所述酯化反应的反应温度为0~85℃,进一步优选为80℃。
[0021]
作为上述技术方案的进一步优选,s3中所述化合物5经过还原剂还原得到麦角甾醇或其衍生物,所述还原剂包括ca(bh4)2、nabh4和kbh4中的至少一种。
[0022]
作为上述技术方案的进一步优选,s3中所述还原在碱性条件下进行,碱性环境通过加入naoh、koh、naome、t-buok、吡啶、三乙胺和4-二甲氨基吡啶(dmap)中的至少一种来实现。
[0023]
作为上述技术方案的进一步优选,所述化合物5转化为麦角甾醇或其衍生物的反应过程中,反应温度为-20~60℃。
[0024]
作为上述技术方案的优选,所述化合物3由以下流程合成:首先将化合物1转化为化合物2,再将化合物2转化为化合物3;其中,化合物1具有如式1所示的结构式:化合物2具有如式2所示的结构式:
[0025]
作为上述方案的进一步优选,所述化合物1在naclo/tempo/nabr的氧化体系中氧化反应获得化合物2,所述氧化反应过程中ph控制在8~9。
[0026]
作为上述方案的进一步优选,所述化合物2经过脱氢反应得到化合物3,脱氢过程为将化合物2先醚化然后采用脱氢试剂脱氢,脱氢试剂包括二氯二氰基苯醌(ddq)和四氯苯醌中的至少一种,进一步优选为四氯苯醌。
[0027]
作为上述技术方案的进一步优选,s1中所述亲核试剂由以下制备方法制得:
[0028]
将化合物a0与化合物a1反应获得化合物a2;所述化合物a0具有式a0所示的结构式:所述化合物a1的结构式为r
1-oh;所述化合物a2具有式a2所示的结构式:将化合物a2转化为所述亲核试剂。本发明通过简单的流程即获得了对亲核反应具有良好选择性的亲核试剂,整体反应条件温和,且反应过程中不会产生异构体,可有效避免亲核试剂异构体对反应收率、转化率的不利影响。
[0029]
作为上述技术方案的进一步优选,s1中所述化合物a0和化合物a1在三苯基膦和偶氮二甲酸二异丙酯的作用下反应生成化合物a2,具体操作为:在所述化合物a0、化合物a1和三苯基膦的混合溶液中滴加偶氮二甲酸二异丙酯并反应至完全,得到中间产物,在所述中间产物中加入水进行淬灭后经浓缩、置换、过滤得到滤液,即为所述化合物a2。
[0030]
作为上述技术方案的进一步优选,所述偶氮二甲酸二丙酯的滴加过程中,温度控制在5℃以下;在所述偶氮二甲酸二丙酯滴加完成后,所述反应温度控制在0℃以下。
[0031]
作为上述技术方案的进一步优选,所述化合物a2在间氯过氧苯甲酸的作用下转化
为所述亲核试剂具体操作为:在所述化合物a2的溶液中分批加入间氯过氧苯甲酸,反应完全后加入亚硫酸钠淬灭,经洗涤、分液得到有机相,将有机相浓缩置换后抽滤得到的固体即为所述亲核试剂。
[0032]
作为上述技术方案的进一步优选,所述间氯过氧苯甲酸的添加过程中,温度控制在5℃以下,在所述间氯过氧苯甲酸添加完毕后,化合物a2和间氯过氧苯甲酸在室温下进行反应。
[0033]
与现有技术相比,本发明的优点在于:
[0034]
本发明提供了一种新的麦角甾醇或其衍生物的制备方法,简单易行,采用具备独特结构的亲核试剂对麦角甾醇母核22位羰基进行亲核反应,提高了反应的选择性,e/z比例高,可大幅提高麦角甾醇或其衍生物的制备收率;同时,通过对亲核反应中碱和溶剂的优化,添加冠醚,可进一步大幅提高e/z比例。
附图说明
[0035]
图1为实施例1的麦角甾醇的合成路线;
[0036]
图2为实施例1中亲核试剂的合成路线。
具体实施方式
[0037]
以下结合具体实施例对本发明作进一步详细说明。
[0038]
实施例1:
[0039]
本实施例的麦角甾醇的合成路线如图1所示,合成过程中,原料和各中间产物、产物(包括化合物1、化合物2、化合物3、化合物4、化合物5、亲核试剂和麦角甾醇等)的结构式均如图1所示,具体合成方法为:
[0040]
s1、化合物2的制备:在250ml的三口烧瓶里加30g化合物1和150ml二氯甲烷,搅拌下加1.5g tempo和溶解好的1.08g溴化钠和30ml5%的碳酸氢钠水溶液,氮气保护,降温至0~5℃,滴加次氯酸钠,控温小于15℃,反应0.5~1h。待tlc监测反应完全后,使用硫代硫酸钠溶液淬灭,搅拌10分钟后分液,获得的有机相用食盐水洗涤一次,在50℃以下浓缩,并使用石油醚置换,保留3-5v石油醚。将反应液降温到0℃冷析2h,过滤,滤饼用冰石油醚淋洗,烘干即得28g化合物2,上述反应摩尔收率约92%。
[0041]
s2、化合物3的制备:室温下,搅拌下向反应瓶中加入50g化合物2、无水甲醇250ml、2.5g pts、40ml原乙酸三甲酯,保持30℃,反应大约3h,待tlc监测原料反应完毕后,加入200ml丙酮,、5ml水、40g四氯苯醌,搅拌下缓慢升温至40℃左右反应大约3~4h,tlc监测至反应完毕后,将反应体系倒入500ml水中以析出固体,过滤,所得固体加入200ml氯仿中加热至50℃溶解,趁热过滤,滤饼用50ml氯仿加热溶解,再次过滤,并合并两次过滤所得有机相。在有机相中加入饱和亚硫酸钠水溶液(含25g亚硫酸钠)搅拌1h,静置分层,所得有机相减压浓缩以除去大部分溶剂,加入甲醇并继续浓缩(该操作进行3次),保留约50ml甲醇,降温至0℃析晶1h,抽滤,所得固体使用甲醇淋洗,并于45~50℃烘干,即得化合物3,上述反应摩尔收率约90%,纯度大于93%。
[0042]
s3、化合物4的制备:在反应瓶中加入280g本实施例的亲核试剂和26g苯并-15-冠-5,并添加2l的四氢呋喃使其溶解,降温到-78℃,于1h内滴加1m的nahmds/thf溶液100ml,滴
加完后保温搅拌1h得到反应液。将160g化合物3溶于500ml四氢呋喃里,于1h内滴加到上述反应液中。在-78℃下保温搅拌4h后逐步升温到-15℃。待tlc监测反应完全后,在反应液中加入1m的稀盐酸淬灭反应,分液,得到的水相用乙酸乙酯萃取,合并有机相,水洗后在45~50℃下浓缩,并用甲醇置换至小体积,降温至0℃析晶1h,抽滤,所得固体采用甲醇淋洗,并于45-50℃下烘干得即化合物4,上述反应摩尔收率约80%,纯度大于90%。
[0043]
s4、化合物5的制备:室温下,向反应瓶中加入50g化合物4、250ml醋酐、100ml乙酰氯,避光升温至回流反应,约6-8h后tlc监测,待原料剩余小于5%时,将反应液在75℃左右减压浓缩至干,降温至室温,并滴加25ml甲醇淬灭剩余醋酐,加入50ml丙酮,减压浓缩以除去大部分溶剂,加入100ml丙酮并继续浓缩,浓缩至保留约50ml丙酮,降温至0℃析晶1h,过滤,所得固体采用冰丙酮淋洗,并于45~50℃烘干,即得化合物5,上述反应摩尔收率约85%,纯度大于95%。
[0044]
s5、麦角甾醇的制备:室温下,向反应瓶中加入3.5g无水氯化钙、20g吡啶、200ml甲醇、200ml thf,搅拌溶解;而后降温至-10~-15℃,分4批加入硼氢化钠,每批2g间隔10min,全部加完后,加入50g化合物5,加完后保持体系温度-5~-10℃反应,大约8~10h反应完毕,待tlc监测无原料剩余后,将反应液缓慢倒入500ml冰水中,边加边搅拌,待固体析出完毕搅拌20min,向体系中缓慢滴加10ml冰醋酸,抽滤,所得固体采用水淋洗后,用150ml dcm溶解,分去水层,得到的有机相减压浓缩以除去大部分溶剂,加入甲醇并继续浓缩(该操作进行3次),浓缩至保留甲醇约50ml,降温至0℃析晶1h,抽滤,所得固体采用冰甲醇淋洗,得粗品。向粗品添加400ml无水乙醇和0.5g活性炭,于30~35℃下搅拌脱色2h,过滤,所得滤液于30~35℃下浓缩至小体积,搅拌降温至0~5℃,析晶1小时,过滤,所得固体在30~35℃下真空干燥,即得麦角甾醇产品(白色晶体),上述反应摩尔收率约80%,纯度大于99%。对所制得的麦角甾醇产品进行核磁共振分析。
[0045]
经检测:1h nmr(400mhz,cdcl3)δ5.56(dd,j=10.6,7.2hz,1h),5.37(dd,j=14.1,11.3hz,1h),5.26
–
5.04(m,2h),3.71
–
3.50(m,1h),2.45(dt,j=30.1,15.1hz,1h),2.26(dd,j=25.2,12.7hz,1h),2.11
–
1.18(m,19h),1.02(t,j=7.4hz,3h),0.96
–
0.88(m,6h),0.82(dd,j=13.1,6.7hz,6h),0.63(s,3h).
[0046]
13cnmr(101mhz,cdcl3)δ141.35,139.77,135.56,131.98,119.59,116.28,70.47,55.74,54.56,46.26,42.83,40.79,40.41,39.09,38.38,37.04,33.09,31.99,28.28,23.00,21.11,19.95,19.64,17.60,16.28,12.05。
[0047]
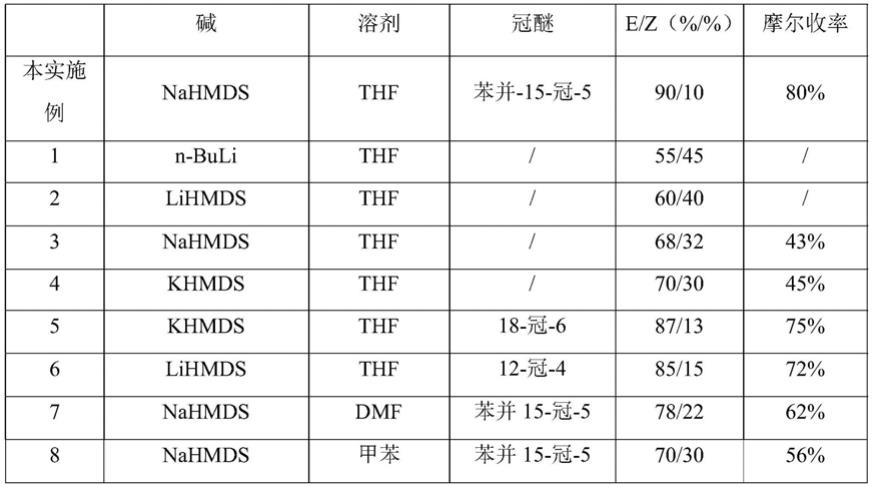
在s3步骤中,发明人对所选用的碱、冠醚及溶剂设计了对比实验,分别采用不同的碱种类、溶剂种类以及是否添加络合物、络合物种类进行了实验,测试不同条件下所合成的化合物4的纯度(编号1-5的实验中改变了制备过程所添加的碱、冠醚以及所使用的溶剂,其他工艺和参数均与本实施例保持一致),结果如下表1所示:
[0048]
表1.s3步骤中不同反应条件下化合物4的合成情况对比
[0049][0050]
从表1可得,不同的碱的e/z选择性有差异,优选khmds或nahmds;不同溶剂选择性也有差异,优选thf;合适的添加剂(冠醚)可以增强选择性和收率,优选苯并-15-冠-5,。可以看出采用本实施例的溶剂、碱以及冠醚的组合时具有最佳的产品构型比例以及产品摩尔收率。
[0051]
本实施例中所用的亲核试剂,具有式a所示的结构式:其合成路线如图2所示,合成过程中,原料和各中间产物、产物(包括化合物a0、化合物a1和化合物a2等)的结构式均如图2所示,具体合成方法为:
[0052]
s1、化合物a2的制备:在反应瓶中加入5.00g化合物a0,3.06g化合物a1和8.45g三苯基磷,溶于60ml四氢呋喃中,降温至0~3℃,缓慢滴加6.67g diad(偶氮二甲酸二异丙酯),控温小于5℃,滴加完成后,在0℃左右反应2h,自然回温到室温,反应过夜。tlc监测反应化合物a0反应完全,缓慢加水淬灭,减压浓缩四氢呋喃,浓缩至反应液呈稠状,加入100ml石油醚,搅拌半小时,过滤,滤饼为三苯基氧磷,将滤液浓缩至干,得粗品油状液体,即为化合物a2,可用于下一步反应,上述反应摩尔收率约90%;对所制得的化合物a2采用核磁共振分析,结果如下所示;
[0053]
1h nmr(400mhz,cdcl3)δ7.83(dd,j=55.4,8.0hz,2h),7.51
–
7.20(m,2h),3.51(dd,j=12.6,4.9hz,1h),3.18(dd,j=12.6,8.0hz,1h),1.92
–
1.73(m,2h),1.20
–
0.82(m,9h).
[0054]
13c nmr(101mhz,cdcl3)δ167.61(s),153.25(s),135.03(s),125.85(s),123.95(s),121.31(s),120.77(s),77.32(s),77.00(s),76.68(s),38.71(d,j=9.5hz),31.50(s),20.23(s),17.84(s),15.16(s).
[0055]
s2、亲核试剂的制备:反应瓶中,加入5.02g化合物a2,溶于二氯甲烷中,降温至0-3℃,分批加入12.2g m-cpba,控温小于5℃。加完后缓慢升至室温,反应过夜。tlc监测反应完
全,加入亚硫酸钠淬灭,饱和碳酸氢钠溶液洗涤,分液,有机相加压浓缩,并使用石油醚置换出料后抽滤,所得固体在45~50℃下烘干即得亲核试剂,上述反应摩尔收率约85%;对所制得的亲核试剂采用核磁共振分析,结果如下所示;
[0056]
1h nmr(400mhz,cdcl3)δ8.22(d,j=8.0hz,1h),8.02(d,j=8.0hz,1h),7.74
–
7.51(m,2h),3.58(dd,j=14.3,3.5hz,1h),3.29(dd,j=14.3,9.0hz,1h),2.36
–
2.13(m,1h),1.84
–
1.68(m,1h),1.09(d,j=6.9hz,3h),0.86(dd,j=14.4,6.8hz,6h).
[0057]
13c nmr(101mhz,cdcl3)δ166.67(s),152.67(s),136.71(s),127.95(s),127.60(s),125.40(s),122.33(s),77.32(s),77.00(s),76.68(s),58.81(s),33.66(s),32.44(s),19.19(s),17.85(s),15.89(s).
[0058]
以上所述仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例。对于本技术领域的技术人员来说,在不脱离本发明技术构思前提下所得到的改进和变换也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
