一种抗pd-l1/vegf/tgf-β
多特异性抗体及其用途
技术领域
1.本发明属于生物医药领域,具体涉及一种抗pd-l1/vegf/tgf-β多特异性抗体及其用途。
背景技术:
2.程序性死亡因子1配体1(programmed death 1 ligand 1,pd-l1)又称cd274,为b7家族成员,是pd-1的配体。pd-l1属于i型跨膜蛋白,共290个氨基酸,包含1个igv样区、1个igc样区、1个跨膜疏水区和1个由30个氨基酸组成的胞内区。与其他b7家族分子不同的是,pd-l1具有负向调节免疫应答的作用。研究发现,pd-l1主要表达于活化的t细胞、b细胞、巨噬细胞和树突状细胞等,除淋巴细胞外,pd-l1也表达于其他多种组织如胸腺、心脏、胎盘等的内皮细胞,以及各类非淋巴系如黑色素瘤、肝癌、胃癌、肾细胞癌、卵巢癌、结肠癌、乳腺癌、食道癌、头颈癌等。pd-l1在调节自身反应性t、b细胞和免疫耐受方面具有一定广泛性,并且在外周组织t和b细胞应答起作用。pd-l1在肿瘤细胞上的高表达与癌症患者的不良预后相关。
3.血管内皮生长因子又称血管通透因子(vascular permeability factor,vpf)或血管调理素(vasculotropin),最先从肿瘤细胞分离出来,是一种能与肝素结合的二聚体糖蛋白分子,并能特异性地作用于血管内皮细胞,是血管内皮细胞特异的有丝分裂素。具有增加微静脉、小静脉通透性,促进血管内皮细胞分裂、增殖以及诱导血管形成等作用。vegf参与许多血管生成依赖性疾病的发病及其进展,包括癌症、某些炎性疾病以及糖尿病视网膜病变等。因此,在抗肿瘤药物研究中,vegf是一个重要的靶点。
4.tgf-β主要由免疫系统表达并分泌(包括tgf-β1/2/3),与受体tgf-βr(包括ri/rii/riii)结合后,可调节细胞生长、增殖、分化、迁移和凋亡,影响胚胎器官发育、机体免疫等,具有重要的生理功能。tgf-β1、tgf-β2和tgf-β3三个亚型均可以结合细胞表面的受体。tgf-βri不直接结合tgf-β,riii可结合tgf-β,但其糖修饰过于复杂。tgf-βrii对tgf-β1/3具有极高亲和力(约5pm),对tgf-β2具有较低亲和力(约6nm)。tgf-β在肿瘤发生和发展中扮演着非常重要而且双重的角色,tgf-β在肿瘤早期可以调控几种凋亡基因的表达从而诱导肿瘤细胞的凋亡;而在肿瘤后期,大多数肿瘤细胞分泌大量tgf-β,一旦tgf-β水平过高,则转变成一个肿瘤促进因子:可抑制t和nk细胞、促进调节性t细胞、促进肿瘤血管生成、促进上皮细胞向间充质细胞转化等,从而促进肿瘤转移和发展。已有报道,tgf-β信号通路相关基因的异常调控是pd-1抗体耐药的原因之一,因此,tgf-β靶向药也成为抗癌药研发的重要方向。
5.目前上市在售的抗体药物多为单克隆抗体,治疗性单克隆抗体已被用于治疗癌症、自身免疫病、炎症和其他疾病,多数是针对一个靶标的特异性。然而,病人接受单克隆抗体治疗可能产生耐药性或无应答。并且有些疾病在体内的影响因素是多方面的,包括不同的信号通路、不同的细胞因子和受体的调节机制等,单一靶点的免疫疗法似乎并不足以摧毁癌细胞。因此,需要通过组合不同的药物,或是使用多特异性抗体的多重靶向策略来实
现。
6.靶向多个靶点的多功能抗体虽然是抗体药物研发的方向,但面临诸多挑战,比如临床前评价模型、表达量低、稳定性差、工艺复杂、质控差异性大等问题,因此一直以来多特异性抗体的研发困难重重。
7.因此,本领域迫切需要开发一种特异性佳、疗效好且易于制备的抗肿瘤多特异性抗体。
技术实现要素:
8.本发明的目的就是提供一种特异性佳、疗效好且易于制备的抗pd-l1/vegf/tgf-β多特异性抗体。
9.在本发明的第一方面,提供了一种多特异性抗体,所述多特异性抗体包括:
10.(a)抗pd-l1单域抗体;
11.(b)抗vegf的抗体元件;和
12.(c)tgf-βrii胞外结构域。
13.在另一优选例中,所述的多特异性抗体包括1-3个抗pd-l1单域抗体,较佳地,包括1个或2个抗pd-l1单域抗体。
14.在另一优选例中,所述的pd-l1单域抗体可以阻断pd-1和pd-l1的相互作用。
15.在另一优选例中,所述抗pd-l1单域抗体的氨基酸序列如seq id no:2所示,或与seq id no:2所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性。
16.在另一优选例中,所述的多特异性抗体包括1-3个抗vegf的抗体元件,较佳地,包括1个或2个抗vegf的抗体元件。
17.在另一优选例中,所述的抗vegf的抗体元件能够结合vegf并阻断其活性。
18.在另一优选例中,所述抗vegf的抗体元件的氨基酸序列如seq id no:4所示,或与seq id no:4所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性。
19.在另一优选例中,所述的多特异性抗体包括1-3个tgf-βrii胞外结构域,较佳地,包括1个或2个tgf-βrii胞外结构域。
20.在另一优选例中,所述的tgf-βrii胞外结构域能够与tfg-β配体结合并阻断其下游信号通路。
21.在另一优选例中,所述tgf-βrii胞外结构域的氨基酸序列如seq id no:6所示,或与seq id no:6所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性。
22.在另一优选例中,所述的多特异性抗体还包含源自人免疫球蛋白的fc区。
23.在另一优选例中,所述的人免疫球蛋白选自下组:igg1、igg2、igg3、igg4,或其组合;优选地为igg1。
24.在另一优选例中,所述多特异性抗体的fc区选自下组:ch1 cl1结构域、人igg结构域或其组合。
25.在另一优选例中,所述fc区是经过改造的突变型;优选地为lala突变型;更加优选地为lala突变型并且含有knob-in-hole突变型。
26.在另一优选例中,所述的多特异性抗体包含肽链i,所述的肽链i中包含以下元件:抗pd-l1纳米抗体vhh链、人免疫球蛋白的fc区、抗vegf的抗体元件、tgf-βrii胞外结构域,
和任选的连接上述元件的连接元件;
27.其中,各元件可以以不同的顺序自肽链i的n端到c端排列;
28.并且,所述的多特异性抗体是由肽链i通过所述fc区的二硫键作用形成的同源二聚体。
29.在另一优选例中,所述连接元件的序列为(g4s)n,其中,n为正整数(例如1、2、3、4、5或6),优选地,n为2或4。
30.在另一优选例中,所述连接元件的氨基酸序列如seq id no:6所示,或与seq id no:6所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性。
31.在另一优选例中,所述的肽链i自n端到c端分别为:抗pd-l1纳米抗体vhh链、人免疫球蛋白的fc区、连接元件、抗vegf的抗体元件、连接元件,和tgf-βrii胞外结构域。
32.在另一优选例中,所述的肽链i的氨基酸序列如seq id no:1所示,或与seq id no:1所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性。(即pm8003e-1)
33.在另一优选例中,所述的肽链i自n端到c端分别为:抗pd-l1纳米抗体vhh链、人免疫球蛋白的fc区、连接元件、tgf-βrii胞外结构域、连接元件,和抗vegf的抗体元件。
34.在另一优选例中,所述的肽链i的氨基酸序列如seq id no:7所示,或与seq id no:7所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性。(即pm8003e-2)
35.在另一优选例中,所述的肽链i自n端到c端分别为:抗pd-l1纳米抗体vhh链、连接元件、tgf-βrii胞外结构域、连接元件、人免疫球蛋白的fc区、连接元件,和抗vegf的抗体元件。
36.在另一优选例中,所述的肽链i的氨基酸序列如seq id no:9所示,或与seq id no:9所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性。(即pm8003e-3)
37.在另一优选例中,所述的肽链i自n端到c端分别为:抗pd-l1纳米抗体vhh链、连接元件、抗vegf的抗体元件、连接元件、人免疫球蛋白的fc区、连接元件,和tgf-βrii胞外结构域。
38.在另一优选例中,所述的肽链i的氨基酸序列如seq id no:10所示,或与seq id no:10所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性。(即pm8003e-4)
39.在另一优选例中,所述的多特异性抗体是由肽链iia和肽链iib构成的异源二聚体,所述的肽链iia和iib中各自独立地包括以下元件:抗pd-l1纳米抗体vhh链、人igg1knob突变或hole突变序列、抗vegf的抗体元件、tgf-βrii胞外结构域,和任选的连接上述元件的连接元件;
40.其中,各元件可以以不同的顺序自肽链iia或肽链iib的n端到c端排列;
41.并且,所述的肽链iia中包括人igg1knob突变序列;所述的肽链iib中包括人igg1hole突变序列;并且,所述的多特异性抗体是由肽链iia和肽链iib通过所述人igg恒定区的二硫键作用及杵-进入-臼结构(knob
–
in-hole)而形成的异源二聚体。
42.在另一优选例中,所述人igg1knob突变的氨基酸序列中,基于seq id no:12所示的氨基酸序列的第132位具有s132c突变,并且第144位具有t144w突变。
43.在另一优选例中,所述人igg1hole突变的氨基酸序列中,基于seq id no:14所示的氨基酸序列的第127位具有y127c突变、第144位具有t144s突变,并且第146位具有l146a突变。
44.在另一优选例中,所述的肽链iia自n端到c端分别为:抗pd-l1纳米抗体vhh链、人igg1knob突变序列、连接元件、tgf-βrii胞外结构域、连接元件,和tgf-βrii胞外结构域;并且所述的肽链iib自n端到c端分别为:抗pd-l1纳米抗体vhh链、人igg1hole突变序列、连接元件,和抗vegf的抗体元件。
45.在另一优选例中,所述肽链iia的氨基酸序列如seq id no:11所示,或与seq id no:11所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性;并且所述肽链iib的氨基酸序列如seq id no:13所示,或与seq id no:13所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性。(即pm8003e-5)
46.在另一优选例中,所述的多特异性抗体中包括肽链iiia和肽链iiib;
47.其中,所述肽链iiia中包括以下元件:抗vegf抗体的vh序列、人igg1重链恒定区序列;所述肽链iiib中包括以下元件:抗vegf抗体的vl序列、人κ轻链恒定区序列;
48.并且,所述的多特异性抗体是由肽链iiia和肽链iiib之间、以及肽链iiib之间通过二硫键作用形成的异源四聚体。
49.在另一优选例中,所述的人igg1重链恒定区序列具有lala突变。
50.在另一优选例中,所述的肽链iiia自n端到c端分别为:抗pd-l1纳米抗体vhh链、连接元件、抗vegf抗体的vh序列、具有lala突变的人igg1重链恒定区、连接元件、tgf-βrii胞外结构域;并且所述的肽链iiib自n端到c端分别为:抗vegf抗体的vl序列、人κ轻链恒定区序列。
51.在另一优选例中,所述肽链iiia的氨基酸序列如seq id no:15所示,或与seq id no:15所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性;并且所述肽链iiib的氨基酸序列如seq id no:18所示,或与seq id no:18所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性。(即pm8003a-1)
52.在另一优选例中,所述的肽链iiia自n端到c端分别为:抗vegf抗体的vh序列、具有lala突变的人igg1重链恒定区、连接元件、tgf-βrii胞外结构域;并且所述的肽链iiib自n端到c端分别为:抗pd-l1纳米抗体vhh链、连接元件、抗vegf抗体的vl序列,和人κ轻链恒定区序列。
53.在另一优选例中,所述肽链iiia的氨基酸序列如seq id no:21所示,或与seq id no:21所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性;并且所述肽链iiib的氨基酸序列如seq id no:22所示,或与seq id no:22所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性。(即pm8003a-2)
54.在另一优选例中,所述的肽链iiia自n端到c端分别为:抗vegf抗体的vh序列、具有lala突变的人igg1重链恒定区、连接元件、抗pd-l1纳米抗体vhh链;并且所述的肽链iiib自n端到c端分别为:tgf-βrii胞外结构域、连接元件、抗vegf抗体的vl序列,和人κ轻链恒定区序列。
55.在另一优选例中,所述肽链iiia的氨基酸序列如seq id no:23所示,或与seq id no:23所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性;并且所述肽链iiib的氨基酸序列如seq id no:24所示,或与seq id no:24所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性。(即pm8003a-3)
56.在另一优选例中,所述的肽链iiia自n端到c端分别为:抗vegf抗体的vh序列、具有
lala突变的人igg1重链恒定区、连接元件、抗pd-l1纳米抗体vhh链;并且所述的肽链iiib自n端到c端分别为:抗vegf抗体的vl序列、人κ轻链恒定区序列、连接元件、tgf-βrii胞外结构域。
57.在另一优选例中,所述肽链iiia的氨基酸序列如seq id no:23所示,或与seq id no:23所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性;并且所述肽链iiib的氨基酸序列如seq id no:25所示,或与seq id no:25所示序列具有≥85%(优选地90%,更优选地95%)的序列同一性。(即pm8003a-4)
58.在本发明的第二方面,提供了一种分离的多核苷酸,所述多核苷酸编码如本发明第一方面所述的多特异性抗体。
59.在另一优选例中,当所述多特异性抗体为异二聚体时,所述多核苷酸中,分别编码所述的两条肽链的多核苷酸的比例为1:1。
60.在本发明的第三方面,提供了一种载体,所述载体含有如本发明第二方面所述的多核苷酸。
61.在另一优选例中,所述的载体选自下组:dna、rna、病毒载体、质粒、转座子、其他基因转移系统、或其组合;优选地,所述表达载体包括病毒载体,如慢病毒、腺病毒、aav病毒、逆转录病毒、或其组合。
62.在本发明的第四方面,提供了一种宿主细胞,所述宿主细胞含有如本发明第三方面所述的载体,或其基因组中整合有如本发明第二方面所述的多核苷酸;
63.或者,所述的宿主细胞表达如本发明第一方面所述的多特异性抗体。
64.在另一优选例中,所述的宿主细胞包括原核细胞或真核细胞。
65.在另一优选例中,所述的宿主细胞选自下组:大肠杆菌、酵母细胞、哺乳动物细胞。
66.在本发明的第五方面,提供了一种产生如本发明第一方面所述多特异性抗体的方法,包括步骤:
67.(a)在合适的条件下,培养如本发明第四方面所述的宿主细胞,从而获得含所述多特异性抗体的培养物;和
68.(b)对步骤(a)中得到的培养物进行纯化和/或分离,获得所述的多特异性抗体。
69.在另一优选例中,所述纯化可以通过蛋白a亲和柱纯化分离获得目标抗体。
70.在另一优选例中,所述经过纯化分离后的目标抗体纯度大于95%,大于96%、大于97%、大于98%、大于99%,优选为100%。
71.在本发明的第六方面,提供了一种免疫偶联物,所述免疫偶联物含有:
72.(a)如本发明第一方面所述的多特异性抗体;和
73.(b)选自下组的偶联部分:可检测标记物、药物、毒素、细胞因子、放射性核素、或酶、金纳米颗粒/纳米棒、纳米磁粒、病毒外壳蛋白或vlp、或其组合。
74.在另一优选例中,所述的放射性核素包括:
75.(i)诊断用同位素,所述的诊断用同位素选自下组:tc-99m、ga-68、f-18、i-123、i-125、i-131、in-111、ga-67、cu-64、zr-89、c-11、lu-177、re-188、或其组合;和/或
76.(ii)治疗用同位素,所述的治疗用同位素选自下组:lu-177、y-90、ac-225、as-211、bi-212、bi-213、cs-137、cr-51、co-60、dy-165、er-169、fm-255、au-198、ho-166、i-125、i-131、ir-192、fe-59、pb-212、mo-99、pd-103、p-32、k-42、re-186、re-188、sm-153、
ra223、ru-106、na24、sr89、tb-149、th-227、xe-133yb-169、yb-177、或其组合。
77.在另一优选例中,所述偶联部分为药物或毒素。
78.在另一优选例中,所述的药物为细胞毒性药物。
79.在另一优选例中,所述的细胞毒性药物选自下组:抗微管蛋白药物、dna小沟结合试剂、dna复制抑制剂、烷化试剂、抗生素、叶酸拮抗物、抗代谢药物、化疗增敏剂、拓扑异构酶抑制剂、长春花生物碱、或其组合。
80.特别有用的细胞毒性药物类的例子包括,例如,dna小沟结合试剂、dna烷基化试剂、和微管蛋白抑制剂、典型的细胞毒性药物包括、例如奥瑞他汀(auristatins)、喜树碱(camptothecins)、多卡霉素/倍癌霉素(duocarmycins)、依托泊甙(etoposides)、美登木素(maytansines)和美登素类化合物(maytansinoids)(例如dm1和dm4)、紫杉烷(taxanes)、苯二氮卓类(benzodiazepines)或者含有苯二氮卓的药物(benzodiazepine containing drugs)(例如吡咯并[1,4]苯二氮卓类(pbds),吲哚啉苯并二氮卓类(indolinobenzodiazepines)和噁唑烷并苯并二氮卓类(oxazolidinobenzodiazepines))、长春花生物碱(vinca alkaloids)、或其组合。
[0081]
在另一优选例中,所述的毒素选自下组:
[0082]
耳他汀类(例如,耳他汀e、耳他汀f、mmae和mmaf)、金霉素、类美坦西醇、篦麻毒素、篦麻毒素a-链、考布他汀、多卡米星、多拉司他汀、阿霉素、柔红霉素、紫杉醇、顺铂、cc1065、溴化乙锭、丝裂霉素、依托泊甙、替诺泊甙(tenoposide)、长春新碱、长春碱、秋水仙素、二羟基炭疽菌素二酮、放线菌素、白喉毒素、假单胞菌外毒素(pe)a、pe40、相思豆毒素、相思豆毒素a链、蒴莲根毒素a链、α-八叠球菌、白树毒素、迈托毒素(mitogellin)、局限曲菌素(retstrictocin)、酚霉素、依诺霉素、麻疯树毒蛋白(curicin)、巴豆毒素、卡奇霉素、肥皂草(sapaonaria officinalis)抑制剂、糖皮质激素、或其组合。
[0083]
在另一优选例中,所述偶联部分为可检测标记物。
[0084]
在另一优选例中,所述偶联物选自:荧光或发光标记物、放射性标记物、mri(磁共振成像)或ct(电子计算机x射线断层扫描技术)造影剂、或能够产生可检测产物的酶、放射性核素、生物毒素、细胞因子(如il-2)、抗体、抗体fc片段、抗体scfv片段、金纳米颗粒/纳米棒、病毒颗粒、脂质体、纳米磁粒、前药激活酶(如dt-心肌黄酶(dtd)或联苯基水解酶-样蛋白质(bphl))、化疗剂(如顺铂)。
[0085]
在另一优选例中,所述免疫偶联物含有:多价(如二价)的如本发明第一方面所述的多特异性抗体。
[0086]
在另一优选例中,所述多价是指在所述免疫偶联物的氨基酸序列中包含多个重复的如本发明第一方面所述的多特异性抗体。
[0087]
在本发明的第七方面,提供了如本发明第一方面所述的多特异性抗体,或如本发明第六方面所述的免疫偶联物的用途,用于制备药剂、试剂、检测板或试剂盒;
[0088]
其中,所述试剂、检测板或试剂盒用于:检测样品中pd-l1、vegf和/或tgf-β;其中,所述药剂用于治疗或预防表达pd-l1(即pd-l1阳性)的肿瘤、表达vegf的肿瘤,和/或表达tgf-β的肿瘤。
[0089]
在另一优选例中,所述的免疫偶联物的偶联部分为诊断用同位素。
[0090]
在另一优选例中,所述的试剂为选自下组的一种或多种试剂:同位素示踪剂、造影
剂、流式检测试剂、细胞免疫荧光检测试剂、纳米磁粒和显像剂。
[0091]
在另一优选例中,所述检测样品中pd-l1、vegf和/或tgf-β的试剂为(体内)检测pd-l1、vegf和/或tgf-β分子的造影剂。
[0092]
在另一优选例中,所述的检测为体内检测或体外检测。
[0093]
在另一优选例中,所述的检测包括流式检测、细胞免疫荧光检测。
[0094]
在另一优选例中,所述的药剂用于阻断pd-1和pd-l1的相互作用,同时通过结合vegf从而阻断其活性,并且能够与tfg-β配体结合并阻断其下游信号通路。
[0095]
在另一优选例中,所述的肿瘤包括但不限于:急性髓细胞白血病、慢性粒细胞性白血病、多发性骨髓病、非霍奇金淋巴瘤、结直肠癌、乳腺癌、大肠癌、胃癌、肝癌、白血病、肾脏肿瘤、肺癌、小肠癌、骨癌、前列腺癌、前列腺癌、宫颈癌、淋巴癌、肾上腺肿瘤、膀胱肿瘤,或其组合。
[0096]
在本发明的第八方面,提供了一种药物组合物,所述药物组合物含有:
[0097]
(i)如本发明第一方面所述的多特异性抗体,或如本发明第六方面所述的免疫偶联物;和
[0098]
(ii)药学上可接受的载体。
[0099]
在另一优选例中,所述的免疫偶联物的偶联部分为药物、毒素、和/或治疗用同位素。
[0100]
在另一优选例中,所述的药物组合物中还含有治疗肿瘤的其他药物,如细胞毒性药物。
[0101]
在另一优选例中,所述的治疗肿瘤的其他药物包括紫杉醇、多柔比星、环磷酰胺、阿西替尼、乐伐替尼、派姆单抗。
[0102]
在另一优选例中,所述的药物组合物用于治疗表达pd-l1蛋白(即pd-l1阳性)的肿瘤。
[0103]
在另一优选例中,所述的药物组合物为注射剂型。
[0104]
在另一优选例中,所述的药物组合物用于制备防治肿瘤的药物。
[0105]
在本发明的第九方面,提供了如本发明第一方面所述的多特异性抗体的一种或多种选自下组的用途,包括:
[0106]
(i)用于检测人pd-l1、vegf和/或tgf-β分子;(ii)用于流式检测;(iii)用于细胞免疫荧光检测;(iv)用于治疗肿瘤;(v)用于肿瘤诊断;(vi)用于阻断pd-1和pd-l1的相互作用;(vii)用于通过结合vegf从而阻断其活性;和(viii)用于与tfg-β配体结合并阻断其下游信号通路。
[0107]
在另一优选例中,所述的肿瘤为表达pd-l1蛋白(即pd-l1阳性)的肿瘤。
[0108]
在另一优选例中,所述用途为非诊断的和非治疗的。
[0109]
在本发明的第十方面,提供了一种重组蛋白,所述的重组蛋白具有:(i)如本发明第一方面所述的多特异性抗体;以及(ii)任选的协助表达和/或纯化的标签序列。
[0110]
在另一优选例中,所述的标签序列包括6his标签、ha标签和fc标签。
[0111]
在另一优选例中,所述的重组蛋白特异性结合于pd-l1、vegf和/或tgf-β分子。
[0112]
在本发明的第十一方面,提供了一种检测样品中pd-l1、vegf和/或tgf-β分子的方法,所述方法包括步骤:(1)将样品与如本发明第一方面所述的多特异性抗体接触;(2)检测
是否形成抗原-抗体复合物,其中形成复合物就表示样品中存在pd-l1、vegf和/或tgf-β分子。
[0113]
在本发明的第十二方面,提供了一种治疗疾病的方法,所述方法包括:给需要的对象施用如本发明第一方面所述的多特异性抗体、如本发明第六方面所述的免疫偶联物,或如本发明第八方面所述的药物组合物。
[0114]
在另一优选例中,所述的对象包括哺乳动物,优选地是人。
[0115]
在本发明的第十三方面,提供了一种pd-l1、vegf和/或tgf-β分子检测试剂,所述的检测试剂包含如本发明第六方面所述的免疫偶联物和检测学上可接受的载体。
[0116]
在另一优选例中,所述的免疫偶联物的偶联部分为诊断用同位素。
[0117]
在另一优选例中,所述的检测学上可接受的载体为无毒的、惰性的水性载体介质。
[0118]
在另一优选例中,所述的检测试剂为选自下组的一种或多种试剂:同位素示踪剂、造影剂、流式检测试剂、细胞免疫荧光检测试剂、纳米磁粒和显像剂。
[0119]
在另一优选例中,所述的检测试剂用于体内检测。
[0120]
在另一优选例中,所述的检测试剂的剂型为液态或粉状(如水剂,针剂,冻干粉,片剂,含服剂,吸雾剂)。
[0121]
在本发明的第十四方面,提供了一种检测pd-l1、vegf和/或tgf-β分子的试剂盒,所述试剂盒含有如本发明第六方面所述的免疫偶联物或如本发明第十三方面所述的检测试剂,以及说明书。
[0122]
在另一优选例中,所述的说明书记载,所述的试剂盒用于非侵入性地检测待测对象的pd-l1、vegf和/或tgf-β分子表达。
[0123]
在另一优选例中,所述的试剂盒用于表达pd-l1蛋白(即pd-l1阳性)的肿瘤的检测。
[0124]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0125]
图1显示了多特异性抗体pm8003e结构示意图。
[0126]
图2显示了多特异性抗体pm8003a结构示意图。
[0127]
图3显示了本发明的多特异性抗体可和细胞表面的人pd-l1蛋白结合。
[0128]
图4显示了本发明的多特异性抗体可阻断vegf蛋白和vegfr蛋白的结合。
[0129]
图5显示了本发明的多特异性抗体可和tgf-β家族成员蛋白结合。
[0130]
图6显示了本发明的多特异性抗体可同时结合人pd-l1,vegf,tgf-β1蛋白。
[0131]
图7显示了本发明的多特异性抗体可阻断pd-1/pd-l1信号通路。
[0132]
图8显示了本发明的多特异性抗体可阻断tgf-β信号通路。
[0133]
图9显示了本发明的多特异性抗体可阻断vegf信号通路。
[0134]
图10显示了本发明的多特异性抗体可以有效的抑制肿瘤(mda-mb-231)在小鼠体内的生长。
[0135]
图11显示了本发明的多特异性抗体可以有效的抑制肿瘤(nci-h1975)在小鼠体内
的生长。
具体实施方式
[0136]
本发明人经过广泛而深入的研究,经过大量的筛选,首次开发了一种抗pd-l1/vegf/tgf-β多特异性抗体。实验结果表明,本发明的多特异性抗体能够在抑制pd-1/pd-l1通路的基础上中和肿瘤微环境的tgf-β以及vegf、恢复t细胞活性、增强免疫应答、阻断肿瘤血管生成,从而更有效地提高抑制肿瘤发生和发展的效果。在此基础上完成了本发明。
[0137]
术语
[0138]
为了可以更容易地理解本公开,首先定义某些术语。如本技术中所使用的,除非本文另有明确规定,否则以下术语中的每一个应具有下面给出的含义。在整个申请中阐述了其它定义。
[0139]
多特异性抗体
[0140]
如本文所用,术语“本发明的多特异性抗体”、“本发明的多抗”、“抗pd-l1/vegf/tgf-β多特异性抗体”具有相同的含义,均指特异性识别和结合pd-l1、vegf和tgf-β的多特异性抗体。
[0141]
本发明提供了一种抗pd-l1/vegf/tgf-β多特异性抗体,其包括:抗pd-l1单域抗体、抗vegf的抗体元件和tgf-βrii胞外结构域。
[0142]
在一个实施方式中,本发明的抗pd-l1/vegf/tgf-β多特异性抗体包含肽链i,所述的肽链i中包含以下元件:抗pd-l1纳米抗体vhh链、人免疫球蛋白的fc区、抗vegf的抗体元件、tgf-βrii胞外结构域,和任选的连接上述元件的连接元件;
[0143]
其中,各元件可以以不同的顺序自肽链i的n端到c端排列;
[0144]
并且,所述的多特异性抗体是由肽链i通过所述fc区的二硫键作用形成的同源二聚体。
[0145]
在另一个实施方式中,本发明的抗pd-l1/vegf/tgf-β多特异性抗体是由肽链iia和肽链iib构成的异源二聚体,所述的肽链iia和iib中各自独立地包括以下元件:抗pd-l1纳米抗体vhh链、人igg1knob突变或hole突变序列、抗vegf的抗体元件、tgf-βrii胞外结构域,和任选的连接上述元件的连接元件;
[0146]
其中,各元件可以以不同的顺序自肽链iia或肽链iib的n端到c端排列;
[0147]
并且,所述的肽链iia中包括人igg1knob突变序列;所述的肽链iib中包括人igg1hole突变序列;并且,所述的多特异性抗体是由肽链iia和肽链iib通过所述人igg恒定区的二硫键作用及杵-进入-臼结构(knob
–
in-hole)而形成的异源二聚体。
[0148]
在另一个实施方式中,本发明的抗pd-l1/vegf/tgf-β多特异性抗体包括肽链iiia和肽链iiib;
[0149]
其中,所述肽链iiia中包括以下元件:抗vegf抗体的vh序列、人igg1重链恒定区序列;所述肽链iiib中包括以下元件:抗vegf抗体的vl序列、人κ轻链恒定区序列;
[0150]
并且,所述的多特异性抗体是由肽链iiia和肽链iiib之间、以及肽链iiib之间通过二硫键作用形成的异源四聚体。
[0151]
如本文所用,术语“单域抗体”、“纳米抗体vhh”、“纳米抗体”具有相同的含义,指克隆抗体重链的可变区,构建仅由一个重链可变区组成的纳米抗体(vhh),它是具有完整功能
的最小的抗原结合片段。通常先获得天然缺失轻链和重链恒定区1(ch1)的抗体后,再克隆抗体重链的可变区,构建仅由一个重链可变区组成的纳米抗体(vhh)。
[0152]
如本文所用,术语“可变”表示抗体中可变区的某些部分在序列上有所不同,它形成了各种特定抗体对其特定抗原的结合和特异性。然而,可变性并不均匀地分布在整个抗体可变区中。它集中于轻链和重链可变区中称为互补决定区(cdr)或超变区中的三个片段中。可变区中较保守的部分称为构架区(fr)。天然重链和轻链的可变区中各自包含四个fr区,它们大致上呈-折叠构型,由形成连接环的三个cdr相连,在某些情况下可形成部分折叠结构。每条链中的cdr通过fr区紧密地靠在一起并与另一链的cdr一起形成了抗体的抗原结合部位(参见kabat等,nih publ.no.91-3242,卷i,647-669页(1991))。恒定区不直接参与抗体与抗原的结合,但是它们表现出不同的效应功能,例如参与抗体的依赖于抗体的细胞毒性。
[0153]
如本文所用,术语“框架区”(fr)指插入cdr间的氨基酸序列,即指在单一物种中不同的免疫球蛋白间相对保守的免疫球蛋白的轻链和重链可变区的那些部分。免疫球蛋白的轻链和重链各具有四个fr,分别称为fr1-l、fr2-l、fr3-l、fr4-l和fr1-h、fr2-h、fr3-h、fr4-h。相应地,轻链可变结构域可因此称作(fr1-l)-(cdr1-l)-(fr2-l)-(cdr2-l)-(fr3-l)-(cdr3-l)-(fr4-l)且重链可变结构域可因此表示为(fr1-h)-(cdr1-h)-(fr2-h)-(cdr2-h)-(fr3-h)-(cdr3-h)-(fr4-h)。优选地,本发明的fr是人抗体fr或其衍生物,所述人抗体fr的衍生物与天然存在的人抗体fr基本相同,即序列同一性达到85%、90%、95%、96%、97%、98%或99%。
[0154]
获知cdr的氨基酸序列,本领域的技术人员可轻易确定框架区fr1-l、fr2-l、fr3-l、fr4-l和/或fr1-h、fr2-h、fr3-h、fr4-h。
[0155]
如本文所用,术语
″
人框架区
″
是与天然存在的人抗体的框架区基本相同的(约85%或更多,具体地90%、95%、97%、99%或100%)框架区。
[0156]
如本文所用,术语“亲和力”理论上通过完整抗体和抗原间的平衡缔合来定义。本发明多抗的亲和力可以通过kd值(解离常数)(或其它测定方式)进行评估或测定,例如生物膜层干涉技术(bio-layer interferometry bli),使用fortebiored96仪器测量确定。
[0157]
如本文所用,术语“接头”是指插入免疫球蛋白结构域中为轻链和重链的结构域提供足够的可动性以折叠成交换双重可变区免疫球蛋白的一个或多个氨基酸残基。
[0158]
如本领域技术人员所知,免疫偶联物及融合表达产物包括:药物、毒素、细胞因子(cytokine)、放射性核素、酶和其他诊断或治疗分子与本发明的抗体或其片段结合而形成的偶联物。本发明还包括与所述的pd-l1/vegf多特异性抗体或其片段结合的细胞表面标记物或抗原。
[0159]
如本文所用,术语“可变区”与“互补决定区(complementarity determining region,cdr)”可互换使用。
[0160]
在本发明的一个优选的实施方式中,所述抗体的重链可变区包括三个互补决定区cdr1、cdr2、和cdr3。
[0161]
在本发明的一个优选的实施方式中,所述抗体的重链包括上述重链可变区和重链恒定区。
[0162]
在本发明中,术语“本发明抗体”、“本发明蛋白”、或“本发明多肽”可互换使用,都
指特异性结合pd-l1、vegf和/或tgf-β蛋白的多肽,例如具有重链可变区的蛋白或多肽。它们可含有或不含起始甲硫氨酸。
[0163]
本发明还提供了具有本发明抗体的其他蛋白质或融合表达产物。具体地,本发明包括具有含可变区的重链的任何蛋白质或蛋白质偶联物及融合表达产物(即免疫偶联物及融合表达产物),只要该可变区与本发明抗体的重链可变区相同或至少90%同源性,较佳地至少95%同源性。
[0164]
一般,抗体的抗原结合特性可由位于重链可变区的3个特定的区域来描述,称为可变区域(cdr),将该段间隔成4个框架区域(fr),4个fr的氨基酸序列相对比较保守,不直接参与结合反应。这些cdr形成环状结构,通过其间的fr形成的β折叠在空间结构上相互靠近,重链上的cdr和相应轻链上的cdr构成了抗体的抗原结合位点。可以通过比较同类型的抗体的氨基酸序列来确定是哪些氨基酸构成了fr或cdr区域。
[0165]
本发明抗体的重链的可变区特别令人感兴趣,因为它们中至少部分涉及结合抗原。因此,本发明包括那些具有带cdr的抗体重链可变区的分子,只要其cdr与此处鉴定的cdr具有90%以上(较佳地95%以上,最佳地98%以上)的同源性。
[0166]
本发明不仅包括完整的抗体,还包括具有免疫活性的抗体的片段或抗体与其他序列形成的融合蛋白。因此,本发明还包括所述抗体的片段、衍生物和类似物。
[0167]
如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持本发明抗体相同的生物学功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的,或(ii)在一个或多个氨基酸残基中具有取代基团的多肽,或(iii)成熟多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽,或(iv)附加的氨基酸序列融合到此多肽序列而形成的多肽(如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列,或与6his标签形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。
[0168]
本发明抗体指具有pd-l1、vegf和/或tgf-β蛋白结合活性的多抗。该术语还包括具有与本发明抗体相同功能的、包含相同cdr区的多肽的变异形式。这些变异形式包括(但并不限于):一个或多个(通常为1-50个,较佳地1-30个,更佳地1-20个,最佳地1-10个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在c末端和/或n末端添加一个或数个氨基酸通常也不会改变蛋白质的功能。该术语还包括本发明抗体的活性片段和活性衍生物。
[0169]
该多肽的变异形式包括:同源序列、保守性变异体、等位变异体、天然突变体、诱导突变体、在高或低的严紧度条件下能与本发明抗体的编码dna杂交的dna所编码的蛋白、以及利用抗本发明抗体的抗血清获得的多肽或蛋白。
[0170]
本发明还提供了其他多肽,如包含单域抗体或其片段的融合蛋白。除了几乎全长的多肽外,本发明还包括了本发明单域抗体的片段。通常,该片段具有本发明抗体的至少约50个连续氨基酸,较佳地至少约50个连续氨基酸,更佳地至少约80个连续氨基酸,最佳地至少约100个连续氨基酸。
[0171]
在本发明中,“本发明抗体的保守性变异体”指与本发明抗体的氨基酸序列相比,
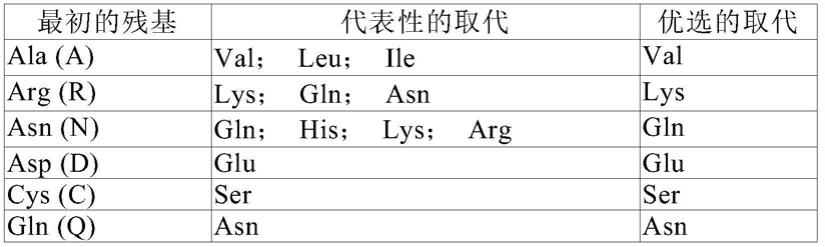
有至多10个,较佳地至多8个,更佳地至多5个,最佳地至多3个氨基酸被性质相似或相近的氨基酸所替换而形成多肽。这些保守性变异多肽最好根据表a进行氨基酸替换而产生。
[0172]
表a
[0173][0174][0175]
本发明还提供了编码上述抗体或其片段或其融合蛋白的多核苷酸分子。本发明的多核苷酸可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的。dna可以是编码链或非编码链。
[0176]
编码本发明的成熟多肽的多核苷酸包括:只编码成熟多肽的编码序列;成熟多肽的编码序列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。
[0177]
术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
[0178]
本发明还涉及与上述的序列杂交且两个序列之间具有至少50%,较佳地至少70%,更佳地至少80%相同性的多核苷酸。本发明特别涉及在严格条件下与本发明所述多核苷酸可杂交的多核苷酸。在本发明中,“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2
×
ssc,0.1%sds,60℃;或(2)杂交时加有变性剂,如50%(v/v)甲酰胺,0.1%小牛血清/0.1%ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。并且,可杂交的多核苷酸编码的多肽与成熟多肽有相同的生物学功能和活性。
[0179]
本发明的抗体的核苷酸全长序列或其片段通常可以用pcr扩增法、重组法或人工合成的方法获得。一种可行的方法是用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。此外,还可将重链的编码序列和表达标签(如6his)融合在一起,形成融合蛋白。
[0180]
一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。本发明所涉及的生物分子(核酸、蛋白等)包括以分离的形式存在的生物分子。
[0181]
目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。
[0182]
本发明还涉及包含上述的适当dna序列以及适当启动子或者控制序列的载体。这些载体可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
[0183]
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属;鼠伤寒沙门氏菌的细菌细胞;真菌细胞如酵母;果蝇s2或sf9的昆虫细胞;cho、cos7、293细胞的动物细胞等。
[0184]
用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔,脂质体包装等。
[0185]
获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
[0186]
在上面的方法中的重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
[0187]
本发明的抗体可以单独使用,也可与可检测标记物(为诊断目的)、治疗剂、pk(蛋白激酶)修饰部分或任何以上这些物质的组合结合或偶联。
[0188]
用于诊断目的可检测标记物包括但不限于:荧光或发光标记物、放射性标记物、mri(磁共振成像)或ct(电子计算机x射线断层扫描技术)造影剂、或能够产生可检测产物的酶。
[0189]
可与本发明抗体结合或偶联的治疗剂包括但不限于:1.放射性核素;2.生物毒;3.细胞因子如il-2等;4.金纳米颗粒/纳米棒;5.病毒颗粒;6.脂质体;7.纳米磁粒;8.前药激活酶(例如,dt-心肌黄酶(dtd)或联苯基水解酶-样蛋白质(bphl));10.化疗剂(例如,顺铂)或任何形式的纳米颗粒等。
[0190]
药物组合物
[0191]
本发明还提供了一种组合物。优选地,所述的组合物是药物组合物,它含有上述的抗体或其活性片段或其融合蛋白,以及药学上可接受的载体。通常,可将这些物质配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中ph通常约为5-8,较佳地ph约为6-8,尽管ph值可随被配制物质的性质以及待治疗的病症而有所变化。配制好的药物组合物可以通过常规途径进行给药,其中包括(但并不限于):瘤内、腹膜内、静脉内、或局部给药。
[0192]
本发明的药物组合物可直接用于结合pd-l1、vegf和/或tgf-β蛋白分子,因而可用于治疗肿瘤。此外,还可同时使用其他治疗剂。
[0193]
本发明的药物组合物含有安全有效量(如0.001-99wt%,较佳地0.01-90wt%,更佳地0.1-80wt%)的本发明上述的单域抗体(或其偶联物)以及药学上可接受的载体或赋形剂。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。药物制剂应与给药方式相匹配。本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。药物组合物如针剂、溶液宜在无菌条件下制造。活性成分的给药量是治疗有效量,例如每天约10微克/千克体重-约50毫克/千克体重。此外,本发明的多肽还可与其他治疗剂一起使用。
[0194]
使用药物组合物时,是将安全有效量的免疫偶联物施用于哺乳动物,其中该安全有效量通常至少约10微克/千克体重,而且在大多数情况下不超过约50毫克/千克体重,较佳地该剂量是约10微克/千克体重-约10毫克/千克体重。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
[0195]
标记的抗体
[0196]
在本发明的一个优选例中,所述抗体带有可检测标记物。更佳地,所述的标记物选自下组:同位素、胶体金标记物、有色标记物或荧光标记物。
[0197]
胶体金标记可采用本领域技术人员已知的方法进行。在本发明的一个优选的方案中,pd-l1/vegf/tgf-β多特异性抗体可以用胶体金标记,得到胶体金标记的抗体。
[0198]
检测方法
[0199]
本发明还涉及检测pd-l1、vegf和/或tgf-β蛋白的方法。该方法步骤大致如下:获得细胞和/或组织样本;将样本溶解在介质中;检测在所述溶解的样本中pd-l1、vegf和/或tgf-β蛋白的水平。
[0200]
在本发明的检测方法中,所使用的样本没有特别限制,代表性的例子是存在于细胞保存液中的含细胞的样本。
[0201]
试剂盒
[0202]
本发明还提供了一种含有本发明的抗体(或其片段)或检测板的试剂盒,在本发明的一个优选例中,所述的试剂盒还包括容器、使用说明书、缓冲剂等。
[0203]
本发明还提供了用于检测pd-l1、vegf和/或tgf-β水平的检测试剂盒,该试剂盒包括识别pd-l1、vegf和/或tgf-β蛋白的抗体,用于溶解样本的裂解介质,检测所需的通用试剂和缓冲液,如各种缓冲液、检测标记、检测底物等。该检测试剂盒可以是体外诊断装置。
[0204]
应用
[0205]
如上所述,本发明的单域抗体有广泛生物应用价值和临床应用价值,其应用涉及到与pd-l1、vegf和/或tgf-β相关的疾病的诊断和治疗、基础医学研究、生物学研究等多个领域。一个优选的应用是用于针对pd-l1、vegf和/或tgf-β的临床诊断和靶向治疗,如肿瘤
治疗。
[0206]
本发明的主要优点包括:
[0207]
1)本发明多特异性抗体高特异性针对人的具有正确空间结构的pd-l1蛋白。
[0208]
2)本发明多特异性抗体的亲和力强。
[0209]
3)本发明多特异性抗体的生产简便。
[0210]
4)在抑制pd-1/pd-l1通路的基础上中和肿瘤微环境的tgf-β以及vegf,恢复t细胞活性,增强免疫应答,阻断肿瘤血管生成,从而更有效地提高抑制肿瘤发生和发展的效果。
[0211]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
[0212]
本发明序列总结
[0213]
表b 本发明抗体相关序列
[0214]
[0215]
[0216]
[0217]
[0218][0219]
实施例1:抗pd-l1
×
vegf
×
tgf-β多特异性抗体的克隆和表达
[0220]
在本实施例中,构建了9种抗pd-l1
×
vegf
×
tgf-β多特异性抗体,分别为:
[0221]
pm8003e-1:由1条多肽链组成,其结构示意图如图1a所示,肽链具有seq id no:1所示的氨基酸序列,其包含抗pd-l1的纳米抗体c-ye-18-5(专利申请号:2019108631090)的pd-l1结合区域(seq id no:2)以及人igg1fc氨基酸序列(引入lala突变以降低fc功能,seq id no:3)。将抗vegf融合蛋白aflibercept(专利号:us7070959)的vegf结合区域氨基酸序列(seq id no:4)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接于fc的c端。再将tgf-βrii(p37173)胞外结构域(seq id no:6)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接于抗vegf融合蛋白aflibercept的c端。
[0222]
pm8003e-2:由1条多肽链组成,其结构示意图如图1b所示,肽链具有seq id no:7所示的氨基酸序列,其包含抗pd-l1的纳米抗体c-ye-18-5(专利申请号:2019108631090)的pd-l1结合区域(seq id no:2)以及人igg1fc氨基酸序列(引入lala突变以降低fc功能,seq id no:3)。将tgf-βrii(p37173)胞外结构域(seq id no:6)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接于fc的c端。再将抗vegf融合蛋白aflibercept(专利号:us7070959)的vegf结合区域氨基酸序列(seq id no:4)的n端通过11个氨基酸残基(g4s)2g(seq id no:8)的柔性肽连接于tgf-βrii(p37173)胞外结构域(seq id no:6)的c端。
[0223]
pm8003e-3:由1条多肽链组成,其结构示意图如图1c所示,肽链具有seq id no:9所示的氨基酸序列,其包含抗pd-l1的纳米抗体c-ye-18-5(专利申请号:2019108631090)的pd-l1结合区域(seq id no:2)。将tgf-βrii(p37173)胞外结构域(seq id no:6)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接于抗pd-l1的纳米抗体的c端,并在其c端通过11个氨基酸残基(g4s)2g(seq id no:7)的柔性肽连接人igg1fc氨基酸序列(引入lala突变以降低fc功能,seq id no:3)。再将抗vegf融合蛋白aflibercept(专利号:us7070959)的vegf结合区域氨基酸序列(seq id no:4)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接于fc的c端。
[0224]
pm8003e-4:由1条多肽链组成,其结构示意图如图1d所示,肽链具有seq id no:10所示的氨基酸序列,其包含抗pd-l1的纳米抗体c-ye-18-5(专利申请号:2019108631090)的
pd-l1结合区域(seq id no:2)。将抗vegf融合蛋白aflibercept(专利号:us7070959)的vegf结合区域氨基酸序列(seq id no:4)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接于抗pd-l1的纳米抗体的c端,并在其c端通过11个氨基酸残基(g4s)2g(seq id no:7)的柔性肽连接连接人igg1fc氨基酸序列(引入lala突变以降低fc功能,seq id no:3)。再将tgf-βrii(p37173)胞外结构域(seq id no:6)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接于fc的c端。
[0225]
pm8003e-5:由2条多肽链组成,其结构示意图如图1e所示,肽链#1具有seq id no:11所示的氨基酸序列,其包含抗pd-l1的纳米抗体c-ye-18-5(专利申请号:2019108631090)的pd-l1结合区域(seq id no:2)以及人igg1knob突变氨基酸序列(引入lala突变以降低fc功能,seq id no:12)。将tgf-βrii(p37173)胞外结构域(seq id no:6)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接于fc的c端。再将另一个tgf-βrii(p37173)胞外结构域(seq id no:6)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接于上一个tgf-βrii的c端。肽链#2具有seq id no:13所示的氨基酸序列,其包含抗pd-l1的纳米抗体c-ye-18-5(专利申请号:2019108631090)的pd-l1结合区域(seq id no:2)以及人igg1hole突变氨基酸序列(引入lala突变以降低fc功能,seq id no:14)。将抗vegf融合蛋白aflibercept(专利号:us7070959)的vegf结合区域氨基酸序列(seq id no:4)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接于fc的c端。
[0226]
pm8003a-1:由2条多肽链组成,其结构示意图如图2a所示,肽链#1具有seq id no:15所示的氨基酸序列,其包含抗pd-l1的纳米抗体c-ye-18-5(专利申请号:2019108631090)的pd-l1结合区域(seq id no:2)。将衍生自抗vegf抗体贝伐单抗(bevacizumab)(专利号:wo1998045332)的vh氨基酸序列(seq id no:16)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接于抗pd-l1的纳米抗体的c端,并在所述vh氨基酸序列c端直接连接衍生自人igg1氨基酸序列(引入lala突变以降低fc功能,seq id no:17)。再将tgf-βrii(p37173)胞外结构域(seq id no:6)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接fc的c端。肽链#2具有seq id no:18所示的氨基酸序列,其包含衍生自抗vegf抗体bevacizumab的vl氨基酸序列(seq id no:19),以及在所述vl氨基酸序列c端的人κ轻链恒定区(cl)氨基酸序列(seq id no:20)。
[0227]
pm8003a-2:由2条多肽链组成,其结构示意图如图2b所示,肽链#1具有seq id no:21所示的氨基酸序列,其包衍生自抗vegf抗体bevacizumab(专利号:wo1998045332)的vh氨基酸序列(seq id no:16),并在所述vh氨基酸序列c端直接连接衍生自人igg1氨基酸序列(引入lala突变以降低fc功能,seq id no:17)。再将tgf-βrii(p37173)胞外结构域(seq id no:6)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接fc的c端。肽链#2具有seq id no:22所示的氨基酸序列,其包含抗pd-l1的纳米抗体c-ye-18-5(专利申请号:2019108631090)的pd-l1结合区域(seq id no:2)。将衍生自抗vegf抗体bevacizumab的vl氨基酸序列(seq idno 19)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接于抗pd-l1的纳米抗体的c端,并在所述vl氨基酸序列c端直接连接人κ轻链恒定区(cl)氨基酸序列(seq id no:20)。
[0228]
pm8003a-3:由2条多肽链组成,其结构示意图如图2c所示,肽链#1具有seq id no:23所示的氨基酸序列,其包衍生自抗vegf抗体bevacizumab(专利号:wo1998045332)的vh氨
基酸序列(seq id no:16),并在所述vh氨基酸序列c端直接连接衍生自人igg1氨基酸序列(引入lala突变以降低fc功能,seq id no:17)。再将抗pd-l1的纳米抗体c-ye-18-5(专利申请号:2019108631090)的pd-l1结合区域(seq id no:2)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接fc的c端。肽链#2具有seq id no:24所示的氨基酸序列,其包含tgf-βrii(p37173)胞外结构域(seq id no:6)。将衍生自抗vegf抗体bevacizumab的vl氨基酸序列(seq idno 19)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接于tgf-βrii的c端,并在所述vl氨基酸序列c端直接连接人κ轻链恒定区(cl)氨基酸序列(seq id no:20)。
[0229]
pm8003a-4:由2条多肽链组成,其结构示意图如图2d所示,肽链#1具有seq id no:23所示的氨基酸序列,其包衍生自抗vegf抗体bevacizumab(专利号:wo1998045332)的vh氨基酸序列(seq id no:16),并在所述vh氨基酸序列c端直接连接衍生自人igg1氨基酸序列(引入lala突变以降低fc功能,seq id no:17)。再将抗pd-l1的纳米抗体c-ye-18-5(专利申请号:2019108631090)的pd-l1结合区域(seq id no:2)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接fc的c端。肽链#2具有seq id no:25所示的氨基酸序列,其包含衍生自抗vegf抗体bevacizumab的vl氨基酸序列(seq id no:19),以及在所述vl氨基酸序列c端的人κ轻链恒定区(cl)氨基酸序列(seq id no:20)。将tgf-βrii(p37173)胞外结构域(seq id no:6)的n端通过21个氨基酸残基(g4s)4g(seq id no:5)的柔性肽连接于cl的c端。
[0230]
实施例2:多特异性抗体抗体与pd-l1结合
[0231]
通过转染克隆到mcs的人pd-l1cdna(购自sino biological)的pcho1.0载体(购自invitrogen)产生过表达人pd-l1的cho-s细胞(cho-s-hpd-l1细胞)。将扩大培养的cho-s-hpd-l1细胞调整细胞密度至2
×
106细胞/ml,100μl/孔加入96孔流式板,离心备用。将多特异性抗体用pbs稀释,100nm开始2倍或3倍稀释,将上述稀释好的样品100μl/孔加入上述带有细胞的96孔流式板中,4℃孵育60min,pbs清洗两次。100μl/孔加入用pbs稀释100倍的羊抗人igg-fc(pe)(购自abcam),4℃孵育30min,pbs清洗两次。100μl/孔加入pbs重悬细胞,在cytoflex(beckman)流式细胞仪上进行检测并计算对应的mfi。
[0232]
在如上方法的测定实验中,实验结果如图3a、3b所示,本发明所有的多特异性抗体和cho-hpd-l1细胞均有结合活性。
[0233]
实施例3:elisa检测多特异性抗体抗阻断vegf/vegfr蛋白水平结合
[0234]
用elisa包被液将人vegfr蛋白稀释至合适浓度,加入elisa板,4℃包被过夜。5%bsa室温封闭1小时。将待测样品梯度稀释并与生物素化标记的人vegf蛋白室温共孵育1小时。将孵育好的样品加入封闭好的elisa板,室温反应2小时。pbs-t(1:2000tween)洗液洗涤3次,加入稀释好的链霉亲和素(hrp)室温反应30分钟,pbs-t洗液洗涤3次,加入elisa tmb显色液,室温放置3min,加入elisa终止液,读取450nm处吸光度数值。
[0235]
结果如图4a和4b所示,所有分子均可以完全阻断vegf和vegfr蛋白的相互作用。
[0236]
实施例4:elisa检测多特异性抗体抗与人tgf-β蛋白结合
[0237]
用elisa包被液将人tgf-β蛋白稀释至合适浓度,加入elisa板,4℃包被过夜。5%bsa室温封闭1小时。将待测样品梯度稀释后加入封闭好的elisa板,室温反应2小时。pbs-t(1:2000tween)洗液洗涤3次,加入稀释好的羊抗人igg fc(hrp)二抗室温孵育1小时。pbs-t
洗液洗涤3次,加入elisa tmb显色液,室温放置3min,加入elisa终止液,读取450nm处吸光度数值。
[0238]
结果如图5a和5b所示,所有分子均具有tgf-β结合活性。
[0239]
实施例5:多特异性抗体同时结合pd-l1,vegf以及tgf-β验证
[0240]
fortebio检测抗体和抗原结合按照现有的方法(estep,p等人,基于高通量解决方案的抗体-抗原亲和力和表位结合的测量(high throughput solution based measurement of antibody-antigen affinity and epitope binning.mabs),2013.5(2):p.270-8)进行。简言之,传感器在分析缓冲液中线下平衡30min,然后线上检测60s建立基线,将多特异性抗体加载至ahc传感器上或者是将生物素化的人pd-l1蛋白加载至sa传感器上。再将传感器放入100nm的pd-l1抗原或是100nm的多特异性抗体溶液中作用,之后将传感器转移至pbs中解离。再将传感器放入100nm的人tgf-β1溶液中作用,之后将传感器转移至pbs中解离。最后将传感器放入100nm的人vegf溶液中作用,之后将传感器转移至pbs中解离。
[0241]
结果如图6a和6b所示,所有分子均可同时结合pd-l1,vegf以及tgf-β三种抗原。
[0242]
实施例6:多特异性抗体阻断pd-1/pd-l1信号通路
[0243]
将靶细胞pd-l1aapc/cho-k1按照4
×
104个/孔接种至96孔细胞培养白底板中,过夜培养16h。第二天,将5
×
104个/孔的效应细胞pd-1nfat-re luciferase/jurkat与梯度稀释后的多特异性抗体混合,并加入到靶细胞中共孵育6小时。使用bio-glo luciferase assay system(promega g7940)试剂盒显色后用酶标仪收集化学发光信号。
[0244]
结果如图7a和7b所示,所有分子均很好的阻断pd-1/pd-l1信号通路。
[0245]
实施例7:多特异性抗体阻断tgf-β信号通路
[0246]
将tgf-β-smad luciferase/hek293效应细胞按照4
×
104个/孔接种至96孔细胞培养板白底中,培养8h。将梯度稀释后的多特异性抗体与最终浓度为0.5ng/ml tgf-β1混合,室温孵育30min中后加入效应细胞继续孵育18小时。使用bio-glo luciferase assay system(promega g7940)试剂盒显色后用酶标仪收集化学发光信号。结果如图8a和8b所示,所有分子均很好的阻断tgf-β信号通路。
[0247]
实施例8:多特异性抗体阻断vegf信号通路
[0248]
将vegfrii luciferase/hek293效应细胞按照1
×
105个/孔接种至96孔细胞培养板白底中。将梯度稀释后的多特异性抗体与最终浓度为100ng/ml vegf-165混合,室温孵育30min中后加入到效应细胞中继续孵育6h。使用bio-glo luciferase assay system(promega g7940)试剂盒显色后用酶标仪收集化学发光信号。
[0249]
结果如图9a和9b所示,所有分子均很好的阻断vegf信号通路。
[0250]
实施例9:多特异性抗体的热稳定性
[0251]
利用dsc(differential scanning calorimetry,差示扫描量热法)检测不同抗体的热稳定性。样品用pbs稀释到1mg/ml;将5000
×
荧光显色剂cypro orange(购于bio-rad)用超纯水稀释50倍得到100
×
荧光显色剂sypro orange。取50μl1mg/ml的样品加入10μl 100
×
荧光显色剂sypro orange、40μl超纯水,混匀后,取30μl加入到96孔pcr板中,每个样品做3个复孔,放入pcr仪中,设置升温程序为:25℃恒温5min,以0.5℃/min的速度升温至99℃。程序结束后在“melt curve”图中读取曲线的最低点的温度值,即为样品的tm值。具体结
果如下表1和表2所示
[0252]
表1.pm8003e多特异性抗体的tm值
[0253]
编号tm1(℃)pm8003e-155.3pm8003e-255.8pm8003e-354.6pm8003e-459pm8003e-5n.d.
[0254]
表2.pm8003e多特异性抗体的tm值
[0255]
编号tm1(℃)pm8003a-168.5pm8003a-268.1pm8003a-368.1pm8003a-468.5阳性对照69.0
[0256]
实施例10:多特异性抗体的加速稳定性实验测定
[0257]
本实验通过检测多特异性抗体在40℃放置30天之后的纯度及生物学活性的变化,从而评价该抗体的长期热稳定性。
[0258]
使用sec的方法测定了目的抗体在40℃放置0、7及14天后的纯度。实验结果如表3所示,除多特异性抗体pm8003a-1,pm8003a-3和pm8003a-4的纯度没有明显变化。
[0259]
表3:加速稳定性样品单体比例
[0260]
样品名0天7天14天pm8003a-198.5%98.0%96.5%pm8003a-295.9%91.8%84.3%pm8003a-397.5%94.8%92.3%pm8003a-485.7%85.6%80.3%
[0261]
实施例11:pm8003e药代动力学评价
[0262]
本实验检测了多特异性抗体在大鼠体内的药代动力学性质,每个药物6只sd大鼠(雌雄各3只,12/12小时光/暗调节,温度24
±
2℃,湿度40-70%,自由进水饮食)购自浙江维通利华实验技术有限公司。实验当天对sd大鼠单次尾静脉注射pm8003e-1或pm8003e-4分子,注射剂量为10mg/kg。
[0263]
取血时间点:给药后5min、15min、0.5小时、2小时、6小时、24小时、48小时、96小时、168小时、336小时、504小时于大鼠颈静脉采血。全血样品2-8℃放置30min,12000rpm离心5min收集血清,所得血清再于2-8℃,12000rpm离心5min,-80℃保存elisa检测血清中游离pm8003e-1或pm8003e-4分子。
[0264]
结果如表4所示,本发明pm8003e-1游离状态分子在sd大鼠体内半衰期约为110.6小时,pm8003e-4游离状态分子在sd大鼠体内半衰期约为86.9小时。
[0265]
表4 多特异性抗体在sd大鼠中的t1/2
[0266]
受试药物给药方式t1/2pm8003e-1iv110.6小时pm8003e-4iv86.9小时
[0267]
实施例12:pm8003a药代动力学评价
[0268]
实验检测了多特异性抗体在小鼠体内的药代动力学性质,每个药物6只sd大鼠(雌雄各3只,12/12小时光/暗调节,温度24
±
2℃,湿度40-70%,自由进水饮食)购自浙江维通利华实验技术有限公司。实验当天对sd大鼠单次尾静脉注射pm8003a-1或pm8003a-4分子,注射剂量为10mg/kg。
[0269]
取血时间点:给药后5min、0.5小时、2小时、6小时、24小时、48小时、96小时、168小时、336小时、504小时于大鼠颈静脉采血。全血样品2-8℃放置30min,12000rpm离心5min收集血清,所得血清再于2-8℃,12000rpm离心5min,-80℃保存,elisa检测血清中游离pm8003a-1或pm8003a-4分子。结果如表5所示,本发明pm8003a-1游离状态分子在小鼠体内半衰期约为62.4小时,pm8003a-4游离状态分子在小鼠体内半衰期约为48.8小时。
[0270]
表5 三异性抗体在小鼠中的t1/2
[0271][0272][0273]
实施例13:多特异性抗体的肿瘤抑制活性研究(mda-mb-231)
[0274]
本实验采用人乳腺癌mda-md-231细胞/nsg小鼠注射人pbmc模型测定多特异性抗体的抗肿瘤作用。体外培养扩增足够的mda-md-231细胞(购自addexbio),胰酶消化后收集细胞,用pbs清洗3遍后计数,按7
×
106细胞/小鼠的量接种到雌性8周龄的nsg重度免疫缺陷小鼠(购自上海南方模式生物科技股份有限公司)右侧腹部皮下。每日观察细胞在nsg小鼠皮下成瘤情况,接种20天后每只小鼠尾静脉注射4
×
106的pbmc。注射完pbmc过3天后,使用游标卡尺测量每只动物右侧腹部皮下肿瘤的最大宽轴w和最大长轴l,使用电子天平称量每只小鼠的体重。
[0275]
按肿瘤体积t=1/2
×w×w×
l计算每只小鼠右侧腹部皮下肿瘤体积。剔除瘤体积过大和过小的小鼠,按平均瘤体积将nsg小鼠平均分为3组,每组6只。按表6分组给药方案分组并注射相应剂量的pm8003。
[0276]
表6 pm8003肿瘤抑制活性实验方案
[0277]
组别给药类别给药剂量给药频率group 1pbs—每周2次共8次group 2pm800328mg/kg每周2次共8次group 3pm80032.8mg/kg每周2次共8次
[0278]
每周2次测量小鼠肿瘤体积与小鼠体重。于接种肿瘤细胞34天后最后一次测量小鼠体重与肿瘤体积,对小鼠执行安乐死;与pbs组相比,pm8003a-1能剂量依赖性地抑制肿瘤的生长,2.8mg/kg和28mg/kg剂量下的tgi分别为76%和88%;且肿瘤体积与pbs组相比具有显著性差异。肿瘤平均重量的结果,以及肿瘤生长抑制率与肿瘤体积的趋势基本一致(图
10a,10b与表7)。
[0279]
表7 各处理组对nsg小鼠皮下接种的mda-mb-231肿瘤体积和tgi的影响
[0280][0281][0282]
注:与pbs组相比,“***”p《0.001;“**”p《0.01。
[0283]
每日观察各组小鼠状态未发现异常;每周两次称量小鼠体重,各组小鼠体重未发生明显降低,实验结束时各剂量组小鼠平均体重相比刚开始给药治疗时的体重,未发生下降(见图10c);试验结束时各组小鼠解剖观察肝脏、肾脏、肺脏等主要脏器亦未见明显病变,表明各组药物在本试验所采用的给药剂量下对小鼠未见明显毒性。
[0284]
综上,pm8003可剂量依赖性地抑制mda-mb-231皮下移植瘤的生长,起效剂量为2.8mg/kg;2个给药剂量下(2.8mg/kg和28mg/kg)对小鼠未见明显毒性。
[0285]
实施例14:多特异性抗体的肿瘤抑制活性研究(nci-h1975)
[0286]
本实验采用人肺癌nci-h1975细胞/nsg小鼠注射人pbmc模型测定多特异性抗体的抗肿瘤作用。体外培养扩增足够的nci-h1975细胞(购自addexbio),胰酶消化后收集细胞,用pbs清洗3遍后计数,按4
×
106细胞/小鼠的量接种到雌性8周龄的nsg重度免疫缺陷小鼠(购自北京维通利华实验动物技术有限公司)右侧腹部皮下。每日观察细胞在nsg小鼠皮下成瘤情况,接种7天后每只小鼠尾静脉注射5
×
106pbmc。注射完pbmc过4天后,使用游标卡尺测量每只动物右侧腹部皮下肿瘤的最大宽轴w和最大长轴l,使用电子天平称量每只小鼠的体重。
[0287]
按肿瘤体积t=1/2
×w×w×
l计算每只小鼠右侧腹部皮下肿瘤体积。剔除瘤体积过大和过小的小鼠,按平均瘤体积将nsg小鼠平均分为3组,每组6只。按表8分组给药方案分组并注射相应剂量的阿特珠单抗(atezolizumab)或pm8003。
[0288]
表8 pm8003肿瘤抑制活性实验方案
[0289]
组别给药类别给药剂量给药频率group 1pbs—每周3次共8次group 2阿特珠单抗10mg/kg每周3次共8次group 3pm800314mg/kg每周3次共8次
[0290]
每周3次测量小鼠肿瘤体积与小鼠体重。于接种肿瘤细胞20天后最后一次测量小鼠体重与肿瘤体积,对小鼠执行安乐死;10mg/kg的阿特珠单抗或14mg/kg的pm8003的tgi分别为67%和90%;且肿瘤体积与pbs组相比具有显著性差异。与阿特珠单抗组相比,pm8003组显示出了更好的抗肿瘤药效,且具有统计学意义。肿瘤平均重量的结果,以及肿瘤生长抑制率与肿瘤体积的趋势基本一致(图11a,11b与表9)。
[0291]
表9 各处理组对nsg小鼠皮下接种的nci-h1975肿瘤体积和tgi的影响
[0292][0293]
注1:与pbs组相比,“***”p《0.001;“**”p《0.01。
[0294]
注2:与阿特珠单抗组相比,“###”p《0.001;“##”p《0.01。
[0295]
每日观察各组小鼠状态未发现异常;每周两次称量小鼠体重,各组小鼠体重未发生明显降低,实验结束时各剂量组小鼠体重相比刚开始给药治疗时的体重,未发生下降(见图10c);试验结束时各组小鼠解剖观察肝脏、肾脏、肺脏等主要脏器亦未见明显病变,表明各组药物在本试验所采用的给药剂量下对小鼠未见明显毒性。
[0296]
综上,pm8003可有效地抑制nci-h1975皮下移植瘤的生长,且明显优于同摩尔浓度下的阿特珠单抗;在14mg/ml药剂量下pm8003对小鼠未见明显毒性。
[0297]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。