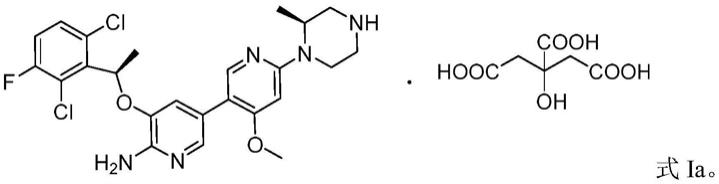
1.本发明属于药物化学领域,涉及2-氨基吡啶衍生物的晶型及制备方法,具体涉及5-((r)-1-(2,6-二氯-3-氟苯基)乙氧基)-4'-甲氧基-6'-((s)-2-甲基哌嗪-1-基)-3,3'联吡啶-6-胺的柠檬酸盐结晶及其制备方法。
背景技术:
2.蛋白激酶(pks)代表了一大类在细胞功能的控制和各种细胞病变的调控中起重要作用的蛋白质,可以分成两类:蛋白酪氨酸激酶(ptks)和丝氨酸-苏氨酸激酶(stks)。蛋白酪氨酸激酶(protein tyrosine kinases,ptks)是一类将磷酸基团从atp催化转移到蛋白质底物上的酪氨酸残基的酶,其在正常细胞生长中起作用。研究发现酪氨酸激酶作用的细胞信号转导通路在肿瘤的形成和发展中也起着极其重要的作用,抑制酪氨酸激酶的活性,能降低细胞信号转导通路的激活,从而抑制肿瘤细胞诱导生存和增殖,达到治疗肿瘤的效果。
3.间变性淋巴瘤激酶(alk)是一种受体酪氨酸激酶,属于胰岛素受体超家族中的一员,它在肿瘤细胞生长和发展过程中起着重要作用。alk基因可以与多种蛋白基因发生融合,表达产生alk蛋白,也可产生突变、扩增等变异。2007年首次报道alk基因可通过与eml4基因形成融合基因来编码产生alk,从而促进肺癌细胞生长。eml4-alk融合由2号染色体短臂插入引起,迄今已发现多种变异类型。经检测,所有这些融合基因均有生物学功能,其表达产物为一种嵌合酪氨酸激酶,于2007年开始逐渐见诸于非小细胞肺癌(nsclc)的相关研究报道。
4.eml4-alk融合基因的发现及alk抑制剂在其亚组人群中显示的独特效使得nsclc根据分子发病机制的不同,可分为不同的亚型如egfr突变型、kras突变型、eml4-alk基因融合型等。在一般的非小细胞肺癌患者中,eml4-alk融合基因阳性率较低,约为3%~7%左右。eml4-alk融合基因主要见于不吸烟肺腺癌,且与egfr突变和kras突变相互排斥。2010年报告的一项研究显示,在中国肺腺癌患者中,eml4-alk融合基因阳性率明显高于欧美患者,为16.13%;非吸烟肺腺癌中,其阳性率为19.23%;缺乏egfr和kras突变的肺腺癌中,其突变率高达42.8%。
技术实现要素:
5.本发明提供了式ia化合物新的结晶形式及其制备方法,式i化合物化学名为5-((r)-1-(2,6-二氯-3-氟苯基)乙氧基)-4'-甲氧基-6'-((s)-2-甲基哌嗪-1-基)-3,3'-联吡啶-6-胺,具体结构如下:
6.式ia化合物为式i化合物的柠檬酸盐(1:1),具体结构如下:
[0007][0008]
一方面,本技术提供了式ia化合物的三种新结晶形式,即式ia化合物的h型结晶、式ia化合物的nh型结晶和式ia化合物的d型结晶。
[0009]
本发明提供了式ia化合物的h型结晶,其为水合物,其中,使用cu kα辐射,其x-射线粉末衍射图谱中,以2θ角度表示在约5.32、7.73、8.85、14.53、19.23度处有衍射峰,进一步在约5.32、6.33、7.73、8.85、11.66、14.53、15.51、17.80、19.23、25.30和25.77度处有衍射峰,进一步在约5.32、6.33、7.73、8.85、10.66、11.66、12.78、14.53、14.84、15.20、15.51、15.66、17.80、19.23、20.40、20.69、25.30、25.77和27.21度处有衍射峰,进一步在约5.32、6.33、7.73、8.85、10.66、11.66、12.78、13.17、14.53、14.84、15.20、15.51、15.66、16.55、17.80、19.23、20.40、20.69、21.45、22.78、23.25、23.69、24.55、25.30、25.77、26.82、27.21、31.22和36.06度处有衍射峰,更进一步在约5.32、6.33、7.73、8.85、10.66、11.66、12.40、12.78、13.17、14.53、14.84、15.20、15.51、15.66、16.55、17.80、18.08、19.23、19.79、20.40、20.69、21.45、22.32、22.78、23.25、23.69、24.55、25.30、25.77、26.82、27.21、27.86、28.51、28.98、29.78、30.34、30.71、31.22、32.00、32.50、33.31、33.96、34.66、35.14、36.06、36.48、和37.56度处有衍射峰。
[0010]
进一步的,本发明的式ia化合物的h型结晶,使用cu kα辐射,其x-射线粉末衍射图谱中的衍射峰具有如下特征:
[0011][0012]
在一具体实施方案中,本发明的式ia化合物的h型结晶基本上具有如图1所示的x-射线粉末衍射图。
[0013]
非限制性地,本发明的式ia化合物的h型结晶的差示扫描量热(dsc)在约108.41℃和195.66℃处有吸收峰,具体而言,基本上具有如图4所示的差示扫描量热(dsc)图。
[0014]
非限制性地,本发明的式ia化合物的h型结晶具有如图7所示的热重分析(tga)图谱。
[0015]
在本发明一些实施方案中,式ia化合物的h型结晶,其含水量为2.5%~9.5%,优
选8%~9%。在本发明一具体实施方案中,式ia化合物的h型结晶以3.5水合物的形式存在。
[0016]
非限制性地,本发明的式ia化合物的h型结晶的红外吸收光谱(ir)在约3394.10cm-1
、3081.49cm-1
、1728.10cm-1
、1683.82cm-1
、1603.08cm-1
、1378.71cm-1
和1202.01cm-1
处有吸收峰,进一步在约3394.10cm-1
、3081.49cm-1
、1728.10cm-1
、1683.82cm-1
、1603.08cm-1
、1574.24cm-1
、1495.83cm-1
、1447.00cm-1
、1411.81cm-1
、1343.83cm-1
、1378.71cm-1
和1202.01cm-1
处有吸收峰,更进一步在约3394.10cm-1
、3081.49cm-1
、1728.10cm-1
、1683.82cm-1
、1603.08cm-1
、1574.24cm-1
、1495.83cm-1
、1447.00cm-1
、1411.81cm-1
、1378.71cm-1
、1343.83cm-1
、1245.11cm-1
、1202.01cm-1
、1178.20cm-1
、1146.78cm-1
、1071.61cm-1
、1049.88cm-1
、1027.28cm-1
、992.71cm-1
和807.06cm-1
处有吸收峰,具体而言,基本上具有如图8所示的红外吸收光谱(ir)图。
[0017]
本发明提供了式ia化合物的nh型结晶,使用cu kα辐射,其x-射线粉末衍射图谱中,以2θ角度表示在约6.96、13.92、18.17、和18.56度处有衍射峰,进一步在约6.46、6.96、12.92、13.37、13.92、18.17、18.56和、21.03度处有衍射峰,进一步在约6.46、6.96、12.05、12.92、13.37、13.92、17.61、18.17、18.56、20.56、21.03、24.55、和25.46度处有衍射峰,进一步在约6.46、6.96、11.68、12.05、12.92、13.37、13.92、15.89、16.97、17.61、18.17、18.56、19.40、20.56、21.03、22.45、23.86、24.55、25.46、28.19、28.74、和30.73度处有衍射峰,更进一步在约6.46、6.96、11.19、11.68、12.05、12.92、13.37、13.92、14.91、15.89、16.97、17.61、18.17、18.56、19.40、20.56、21.03、21.60、22.45、23.86、24.55、25.46、25.91、28.19、28.74、30.73、32.15、32.55、35.28、和36.82度处有衍射峰。
[0018]
进一步的,本发明的式ia化合物的nh型结晶的使用cu kα辐射的粉末x-射线衍射图谱具有如下特征:
[0019][0020]
在一具体实施方案中,本发明的式ia化合物的nh型结晶基本上具有如图2所示的x-射线粉末衍射图。
[0021]
非限制性地,本发明的式ia化合物的nh型结晶的差示扫描量热(dsc)图谱在约198.59℃处有吸收峰,具体而言,基本上具有如图5所示的差示扫描量热(dsc)图谱。
[0022]
在本发明一实施方案中,式ia化合物的nh型结晶为无水结晶,tga图谱未显示明显的失水峰。
[0023]
非限制性地,本发明的式ia化合物的nh型结晶的红外吸收光谱(ir)在约3489.53cm-1
、2992.73cm-1
、1731.23cm-1
、1676.76cm-1
、1599.85cm-1
、1379.25cm-1
、1200.89cm-1
处有吸收峰,进一步在约3489.53cm-1
、2992.73cm-1
、1731.23cm-1
、1676.76cm-1
、1599.85cm-1
、1488.60cm-1
、1450.29cm-1
、1403.98cm-1
、1379.25cm-1
、1343.37cm-1
、1200.89cm-1
处有吸收峰,更进一步在约3489.53cm-1
、2992.73cm-1
、1731.23cm-1
、1676.76cm-1
、1599.85cm-1
、1488.60cm-1
、1450.29cm-1
、1403.98cm-1
、1379.25cm-1
、1343.37cm-1
、1270.25cm-1
、1249.37cm-1
、1200.89cm-1
、1160.83cm-1
、1148.38cm-1
、1078.37cm-1
、1050.15cm-1
、1032.35cm-1
、995.44cm-1
、825.18cm-1
处有吸收峰,具体而言,基本上具有如图9所示的红外吸收光谱(ir)图。
[0024]
本发明提供了式ia化合物的d型结晶,使用cu kα辐射,其x-射线粉末衍射图谱中,以2θ角度表示在约5.46、6.28、12.73、19.89、和25.14度处有衍射峰,进一步在约5.46、6.28、11.44、12.73、13.86、15.63、19.53、19.89、22.20、22.78、23.48、和25.14度处有衍射
峰,进一步在约5.46、6.28、11.44、11.65、12.73、13.86、14.56、15.63、16.20、16.82、19.14、19.53、19.89、22.20、22.78、23.48、24.18、24.59、25.14、26.02、和28.19度处有衍射峰,更进一步在约5.46、6.28、10.99、11.44、11.65、12.73、13.86、14.56、15.63、16.20、16.82、17.14、17.72、19.14、19.53、19.89、20.82、22.20、22.78、23.48、24.18、24.59、25.14、26.02、28.19、30.05、31.54、和34.03度处有衍射峰。
[0025]
进一步的,本发明的式ia化合物的d型结晶,使用cu kα辐射粉末,其x-射线衍射图谱中的衍射峰具有如下特征:
[0026][0027][0028]
在一具体实施方案中,本发明的式ia化合物的d型结晶基本上具有如图3所示的x-射线粉末衍射图。
[0029]
非限制性地,本发明的式ia化合物的d型结晶的差示扫描量热(dsc)图在约189.18℃处有吸热峰,另外,在一些实施方案中,dsc图谱中在155.12℃处的微弱的吸热峰,为d型结晶表面吸附的溶剂失去所致。在一些实施方案中,基本上具有如图6所示的差示扫描量热(dsc)图。
[0030]
在本发明一实施方案中,式ia化合物的d型结晶为无水结晶,tga图谱未显示明显的失水峰。
[0031]
非限制性地,本发明的式ia化合物的d型结晶的红外吸收光谱(ir)在约3491.75cm-1
、2988.21cm-1
、1728.41cm-1
、1676.52cm-1
、1601.17cm-1
、1407.34cm-1
、1201.44cm-1
处有吸收峰,进一步在约3491.75cm-1
、2988.21cm-1
、1728.41cm-1
、1676.52cm-1
、
1601.17cm-1
、1569.37cm-1
、1488.47cm-1
、1448.56cm-1
、1407.34cm-1
、1201.44cm-1
处有吸收峰,更进一步在约3491.75cm-1
、2988.21cm-1
、1728.41cm-1
、1676.52cm-1
、1601.17cm-1
、1569.37cm-1
、1488.47cm-1
、1448.56cm-1
、1407.34cm-1
、1271.90cm-1
、1250.97cm-1
、1201.44cm-1
、1147.63cm-1
、1079.61cm-1
、1050.93cm-1
、1028.54cm-1
、994.44cm-1
、820.75cm-1
处有吸收峰,具体而言,基本上具有如图10所示的红外吸收光谱(ir)图。
[0032]
本发明中,x-射线粉末衍射光谱测定的仪器型号为bmker d2x射线衍射仪,条件及方法:30kv l0ma,狭缝:0.6/3/ni/8,time[s]:0.1,步长:0.02
°
。
[0033]
本发明中,dsc光谱测定的仪器型号为mettler toledo dsc1。
[0034]
本发明中,图7的tga光谱测定的仪器型号为netzsch sta 449f3sta449f3a-1547-m热分析仪,条件:40-310℃范围内10℃/min升温。
[0035]
本发明中,ir光谱测定的仪器型号为perkm elmer spectrum 100型红外光谱仪,条件及方法:kbr压片法,具体方法为将光谱纯溴化钾研磨成粉末,红外干燥箱干燥;取光谱纯溴化钾粉末约70mg,压力20mpa,2mm,压成空白溴化钾片,450-4000cm-1
,扫描背景;取样品约1.5mg,与约200mg溴化钾粉末,研磨混合均匀后,取约70mg混合粉末,压力20mpa,2min,压成样品片,450-4000cm-1
扫描样品。
[0036]
本发明中,含水量可通过本领域常用的方法和仪器测定,例如凯氏水分测定仪或干燥失重法等。
[0037]
需要说明的是,在xrd中,由结晶化合物得到的衍射谱图对于特定的晶型往往是特征性的,其中谱带(尤其是在低角度)的相对强度可能会因为结晶条件、粒径和其它测定条件的差异而产生的优势取向效果而变化。因此,衍射峰的相对强度对所针对的晶型并非是特征性的,判断是否与已知的晶型相同时,更应该注意的是峰的相对位置而不是它们的相对强度。在xrd图谱中通常用2θ角或晶面距d表示峰位置,由于2θ角与入射x射线的波长有关,因此用晶面距d表示更具有代表性。两者之间具有简单的换算关系:d=λ/2sinθ,其中d代表晶面距,λ代表入射x射线的波长(对于cu-ka,),θ为衍射角。对于同种化合物的同种晶型,其xrd谱图在整体上具有相似性,表征峰位置的d值误差一般在
±
2%之内,大部分误差不超过
±
1%;2θ值的测量误差约为
±
0.2度;相对强度误差可较大,但变化趋势一致。另外,判断晶型是否一样时应注意保持整体观念,因为并不是一条衍射线代表一个物相,而是一套特定的“d-i/i1”数据才代表某一物相。还应指出的是,在混合物的鉴定中,由于含量下降等因素会造成部分衍射线的缺失,此时,无需依赖高纯试样中观察到的全部谱带,甚至几条谱带也可能对给定的结晶是特征性的。
[0038]
dsc测定当结晶由于其结晶结构发生变化或结晶熔融而吸收或释放热时的转变温度。对于同种化合物的同种晶型,在连续的分析中,热转变温度和熔点误差在约5℃之内,通常在约3℃之内,当我们说一个化合物具有一给定的dsc峰或熔点时,这是指该dsc峰或熔点
±
5℃。dsc提供了一种辨别不同晶型的辅助方法。不同的结晶形态可根据其不同的转变温度特征而加以识别。需要指出的是对于混合物而言,其dsc峰或熔点可能会在更大的范围内变动。此外,由于在物质熔化的过程中伴有分解,因此熔化温度与升温速率相关。
[0039]
ir测定分子中对应于光而振动的基团相关的特定化学键引起的红外吸收。由于不同晶型分子内共价键的电环境不一样,共价键强度也会有变化,共价键强度的改变必然会导致不同晶型ir光谱的不同。
[0040]
再一方面,本发明提供了式ia化合物的三种结晶形式的制备方法,包括h型结晶、nh型结晶、d型结晶。
[0041]
本发明提供了式ia化合物的h型结晶的制备方法,所述方法包括如下步骤:
[0042]
(1)将式ia化合物在溶剂中悬浮;
[0043]
(2)室温搅拌后过滤;
[0044]
(3)收集滤饼,干燥。
[0045]
其中,步骤(1)中的所述溶剂选自1,4-二氧六环、丙酮、硝基甲烷、乙腈、二甲基甲酰胺、甲醇、乙醇、丙醇、异丙醇、正丁醇、异丁醇、叔丁醇、水中的一种或多种,优选硝基甲烷、乙腈、水中的一种或多种。较优选为硝基甲烷和水的混合溶剂、或乙腈和水的混合溶剂,最优选为乙腈和水的混合溶剂。
[0046]
在本发明一些具体实施方案中,步骤(1)中的溶剂为硝基甲烷和水的混合溶剂,硝基甲烷和水的体积比为1:(1-20),优选为1:(5-15),最优选为1:9。
[0047]
在本发明另一些具体实施方案中,步骤(1)中的溶剂为乙腈和水的混合溶剂,乙腈和水的体积比(0.1-10):1,优选为(1-5):1,最优选为5:1。
[0048]
在一些实施方案中,步骤(2)中室温搅拌时间约为12-36h;在一些实施方案中,为20-30h;在一些实施方案中,为24h。
[0049]
其中,步骤(3)中的干燥方法为常压干燥,优选为鼓风干燥。
[0050]
在本发明一些具体实施方案中,步骤(3)为在45-60℃下鼓风干燥2-7h,优选在50-55℃下鼓风干燥约2-3h。
[0051]
本发明提供了式ia化合物的nh型结晶的制备方法,所述方法包括如下步骤:
[0052]
(1)将式ia化合物在溶剂中悬浮;
[0053]
(2)室温搅拌后过滤;
[0054]
(3)收集滤饼,干燥。
[0055]
其中,步骤(1)中的所述溶剂选自1,4-二氧六环、丙酮、硝基甲烷、乙腈、二甲基甲酰胺、甲醇、乙醇、丙醇、异丙醇、正丁醇、异丁醇、叔丁醇、水中的一种或多种,优选硝基甲烷、乙腈、水中的一种或多种。较优选为硝基甲烷和水的混合溶剂、或乙腈和水的混合溶剂,最优选为乙腈和水的混合溶剂。
[0056]
在本发明一些具体实施方案中,步骤(1)中的溶剂为硝基甲烷和水的混合溶剂,硝基甲烷和水的体积比为1:(0.1-20),优选为1:(0.1-1),最优选为3:2。
[0057]
在本发明另一些具体实施方案中,步骤(1)中的溶剂为乙腈和水的混合溶剂,乙腈和水的体积比为(0.1-10):1,优选为(1-5):1,最优选为5:1。
[0058]
在一些实施方案中,步骤(2)中室温搅拌时间约为12-36h;在一些实施方案中,为20-30h;在一些实施方案中,为24h。
[0059]
其中,步骤(3)中的干燥方法为减压干燥或真空干燥,优选为真空干燥。
[0060]
在本发明一些具体实施方案中,步骤(3)为在40-70℃下真空干燥1-6h,优选在60-70℃下真空干燥约5h。
[0061]
本技术提供了式ia化合物的d型结晶的制备方法。在一些实施方案中,将式ia化合物的溶液(例如接近饱和的溶液)在挥发性溶剂存在的环境下,静置一段时间,析出式ia化合物的结晶,分离即得式ia化合物的d型结晶。
[0062]
本发明提供了式ia化合物的d型结晶的制备方法,所述方法包括如下步骤:
[0063]
(1)于第一容器中,获得式ia化合物在第一溶剂中的溶液;
[0064]
(2)于第二容器中,加入适量的第二溶剂;
[0065]
(3)将敞口的第一容器放置于第二容器中,且密封第二容器;
[0066]
(4)室温静置,至第一容器中析出固体;
[0067]
(5)取出第一容器,过滤;
[0068]
(6)收集滤饼,干燥。
[0069]
其中,步骤(1)中第一溶剂选自二甲基甲酰胺、二甲基乙酰胺、n-甲基甲酰胺、二甲基亚砜、1,3-二甲基-2-咪唑啉酮中的一种或多种,优选二甲基甲酰胺。
[0070]
其中,步骤(2)中所述第二溶剂选自甲醇、乙醇、四氢呋喃、甲基叔丁醚、丙酮、正己烷、甲乙酮、四氯化碳、丁酮、甲苯、正庚烷、环己烷、异丙醇、乙酸乙酯、二氯甲烷中的一种或多种,优选丙酮。
[0071]
其中,步骤(4)中室温放置时间为至少3天,优选为3-30天,最优选7天。
[0072]
其中,步骤(6)中的干燥方法为常压干燥、减压干燥或真空干燥,优选为真空干燥。
[0073]
另一方面,本发明提供了含式ia化合物结晶的结晶组合物;在本发明一些实施方案中,所述式ia化合物结晶占结晶组合物重量的50%以上,优选80%以上,更优选90%以上,最优选95%以上,其中所述式ia化合物结晶为式ia化合物的h型结晶、式ia化合物的nh型结晶、或式ia化合物的d型结晶。
[0074]
再一方面,本发明提供了包含式ia化合物的结晶、或其结晶组合物的药物组合物,其中所述式ia化合物结晶为式ia化合物的h型结晶、式ia化合物的nh型结晶、或式ia化合物的d型结晶,以及药学上可接受的辅料。
[0075]
所述"药学上可接受的辅料"是指与活性成份一同给药的、有利于活性成份给药的惰性物质,包括但不限于国家食品药品监督管理局许可的可接受的用于人或动物(例如家畜)的任何助流剂、增甜剂、稀释剂、防腐剂、染料/着色剂、矫味增强剂、表面活性剂、润湿剂、分散剂、崩解剂、助悬剂、稳定剂、等渗剂、溶剂和乳化剂。在一些实施方案中,所述辅料的非限制性实例包括碳酸钙、磷酸钙、各种糖和各类淀粉、纤维素衍生物、明胶、植物油和聚乙二醇。
[0076]
本发明的药物组合物可配制成固态、半固态、液态或气态制剂,如片剂、丸剂、胶囊剂、粉剂、颗粒剂、膏剂、乳剂、悬浮剂、溶液剂、栓剂、注射剂、吸入剂、凝胶剂、微球及气溶胶等等。
[0077]
给予本发明的药物组合物的典型途径包括但不限于口服、直肠、透黏膜、经肠给药,或者局部、经皮、吸入、肠胃外、舌下、阴道内、鼻内、眼内、腹膜内、肌内、皮下、静脉内给药。优选的给药途径是口服给药。
[0078]
又一方面,本发明提供了包含式ia化合物结晶、或其结晶组合物、或其药物组合物的联用药物组合,其中所述联用药物组合进一步包括一种或多种其他治疗剂,其中所述式ia化合物结晶为式ia化合物的h型结晶、式ia化合物的nh型结晶、或式ia化合物的d型结晶。
[0079]
再一方面,本发明提供一种调节蛋白激酶活性的方法,其中包括将所述蛋白激酶与式ia化合物结晶接触,其中所述式ia化合物结晶为式ia化合物的h型结晶、式ia化合物的nh型结晶、或式ia化合物的d型结晶。优选地,所述蛋白激酶选自alk。此外,所述蛋白激酶包
括突变的激酶,其中突变激酶选自突变的alk激酶。
[0080]
还一方面,本发明提供了式ia化合物结晶、或其结晶组合物、或其药物组合物、或其联用药物组合在制备用于治疗和/或预防疾病的药物中的用途,其中所述式ia化合物结晶为式ia化合物的h型结晶、式ia化合物的nh型结晶、或式ia化合物的d型结晶,其中所述疾病是与蛋白激酶(例如alk)活性相关的疾病,例如异常细胞增殖,其中异常细胞增殖包括癌症。所述的癌症包括但不限于alk突变的癌症。
[0081]
又一方面,本发明提供了式ia化合物结晶、或其结晶组合物、或其药物组合物、或其联用药物组合在制备用于治疗和/或预防由alk介导的疾病的药物中的用途,其中所述式ia化合物结晶为式ia化合物的h型结晶、式ia化合物的nh型结晶、或式ia化合物的d型结晶。
[0082]
所述的alk介导的疾病包括alk阳性的非小细胞肺癌、间变性大细胞淋巴瘤、炎性肌纤维母细胞瘤、鼻咽癌、乳腺癌、结直肠癌、弥漫大b细胞淋巴瘤、全身组织细胞增生症和神经母细胞瘤等,优选地包括alk阳性的非小细胞肺癌,更优选地包括alk阳性的原发性或转移性非小细胞肺癌。
[0083]
另外,本发明还提供一种治疗和/或预防哺乳动物(例如人)疾病的方法,其中所述疾病是与蛋白激酶(例如alk)活性相关的,该方法包括向哺乳动物(例如人)给予治疗有效量的式ia化合物结晶、或其结晶组合物、或其药物组合物、或其联用药物组合,其中所述式ia化合物结晶为式ia化合物的h型结晶、式ia化合物的nh型结晶、或式ia化合物的d型结晶。优选地,所述蛋白激酶选自alk。此外,所述蛋白激酶包括突变的激酶,其中突变激酶选自突变的alk激酶。
[0084]
通过本发明提供的制备方法,分别得到了纯度较高的式ia化合物h型结晶、nh型结晶和d型结晶,制备方法简单,并且与现有技术相比,本发明提供的新晶型(h型结晶、nh型结晶和d型结晶)具有如下所述的一种或者多种优势:
[0085]
1)具有更好的热稳定性,和/或高的水溶解度;
[0086]
2)具有较好的化学稳定性,和/或更快的水溶解速率;
[0087]
3)具有较好的机械特性,例如更好的硬度、可压实性、压力稳定性、易于过滤、或具有更好的流动性,利于制备、后处理、存储等;
[0088]
4)无或几乎无引湿性,对药品包装和贮存条件要求较低;
[0089]
5)具有较好的制剂稳定性,与常规辅料具有更好的相容性;和/或
[0090]
6)具有良好的生物利用度。
附图说明
[0091]
为了更好地理解本发明,下面借助于附图对本发明予以详细阐述。附图中:
[0092]
图1显示的是式ia化合物的h型结晶的x-射线粉末衍射(xrd)图;
[0093]
图2显示的是式ia化合物的nh型结晶的x-射线粉末衍射(xrd)图;
[0094]
图3显示的是式ia化合物的d型结晶的x-射线粉末衍射(xrd)图;
[0095]
图4显示的是式ia化合物的h型结晶的差示扫描量热(dsc)图;
[0096]
图5显示的是式ia化合物的nh型结晶的差示扫描量热(dsc)图;
[0097]
图6显示的是式ia化合物的d型结晶的差示扫描量热(dsc)图;
[0098]
图7显示的是式ia化合物的h型结晶的热重分析(tga)图;
[0099]
图8显示的是式ia化合物的h型结晶的红外吸收光谱(ir)图;
[0100]
图9显示的是式ia化合物的nh型结晶的红外吸收光谱(ir)图;
[0101]
图10显示的是式ia化合物的d型结晶的红外吸收光谱(ir)图;
[0102]
图11显示的是实施例1中式ia化合物结晶的x-射线粉末衍射(xrd)图。
具体实施方式
[0103]
以下结合附图及实施例详细说明本发明的技术方案,但本发明的保护范围包括但是不限于此。
[0104]
实施例1式ia化合物的制备
[0105]
取0.0lmol的式i化合物溶于90ml甲醇中,回流搅拌下加入配置好的浓度为l.lmol/l柠檬酸-甲醇溶液10ml,反应1小时后,反应液析出固体,继续回流小时,过滤,将分离的固体在乙醇中回流搅拌小时,过滤,将分离的固体用85℃常压鼓风干燥,得到式ia化合物结晶,使用cuka辐射的x-射线粉末衍图,显示为wo2017016514的a型结晶,如图11所示,其x-射线衍射图谱中的衍射峰具有如下特征:
[0106]
[0107][0108]1h-nmr(500mhz,dmso-d6):δ=7.83(s,1h),7.57(t,j=4.95hz,1h),7.55(d,j=1.45hz,1h),7.46(t,j=8.7hz,1h),6.81(d,j=1.2hz,1h),6.38(s,1h),5.98(q,j=6.7hz,1h),5.73(brs,2h),4.79(brs,1h),4.26(d,j=13.5hz,1h),3.70(s,3h),3.33(d,j=11.9hz,1h),3.25(d,j=12.6hz,1h),3.17(m,2h),2.96(m,1h),2.58(q,4h),1.78(d,j=6.6hz,3h),1.22(d,j=6.85hz,3h)。
[0109]
实施例2式ia化合物的h型结晶的制备
[0110]
称取250mg实施例1中获得的式ia化合物于50ml单口烧瓶中,加入40ml乙腈-水混合溶剂(乙腈:水(v/v)=0.25:1)得到悬浮液,然后室温搅拌24小时,过滤,分离到的固体50℃鼓风干燥2小时,得到式ia化合物的h型结晶。
[0111]1h-nmr(500mhz,dmso-d6):δ=7.81(s,1h),7.58(dd,j=9.0,4.9hz,1h),7.53(d,j
=1.8hz,1h),7.47(t,j=8.7hz,1h),6.78(d,j=1.9hz,1h),6.37(s,1h),5.97(q,j=6.7hz,1h),5.75(s,2h),4.78(d,j=6.3hz,1h),4.30
–
4.19(m,1h),3.69(s,3h),3.30(d,j=12.2hz,1h),3.23(d,j=12.6hz,1h),3.18
–
3.08(m,2h),2.95(td,j=12.4,3.8hz,1h),2.58(d,j=15.1hz,2h),2.51(d,j=15.1hz,2h),1.77(d,j=6.6hz,3h),1.20(d,j=6.9hz,3h)。
[0112]
实施例3式ia化合物的h型结晶的制备
[0113]
称取250mg实施例1中获得的式ia化合物于50ml单口烧瓶中,加入40ml乙腈-水混合溶剂(乙腈:水(v/v)=9:1)得到悬浮液,然后室温搅拌24小时,过滤,分离到的固体50℃鼓风干燥2小时,得到式ia化合物的h型结晶。
[0114]
实施例4式ia化合物的h型结晶的制备
[0115]
称取45mg实施例1中获得的式ia化合物于20ml玻璃瓶中,加入10ml硝基甲烷-水混合溶剂(硝基甲烷:水(v/v)=1:9)得到悬浮液,然后室温搅拌24小时,过滤,分离到的固体50℃鼓风干燥2小时,得到式ia化合物的h型结晶。
[0116]
实施例5式ia化合物的nh型结晶的制备
[0117]
称取45mg实施例1中获得的式ia化合物于20ml玻璃瓶中,加入6ml硝基甲烷和4ml水,得到悬浮液,然后室温搅拌24小时,过滤,分离到的固体于50℃真空干燥,得到式ia化合物的nh型结晶。
[0118]1h nmr(500mhz,dmso-d6):δ=7.81(s,1h),7.58(dd,j=9.0,4.9hz,1h),7.53(d,j=1.8hz,1h),7.47(t,j=8.7hz,1h),6.78(d,j=1.9hz,1h),6.37(s,1h),5.97(q,j=6.7hz,1h),5.75(s,2h),4.78(t,j=6.6hz,1h),4.31
–
4.19(m,1h),3.69(s,3h),3.30(d,j=12.2hz,1h),3.24(d,j=12.6hz,1h),3.18
–
3.08(m,2h),2.95(td,j=12.5,3.8hz,1h),2.59(d,j=15.1hz,2h),2.52(d,j=15.0hz,2h),1.77(d,j=6.6hz,3h),1.21(d,j=6.9hz,3h)。
[0119]
实施例6式ia化合物的nh型结晶的制备
[0120]
称取80mg实施例2、3或4中得到的式ia化合物的h型结晶,置于玻璃培养皿中,于60~70℃真空干燥箱中干燥5小时,得到式ia化合物的nh型结晶。
[0121]
实施例7式ia化合物的d型结晶的制备
[0122]
称取1g实施例1中获得的式ia化合物于20ml玻璃瓶中,加入10mldmf,于45℃水浴中搅拌至溶清。将得到的溶液过滤,滤液转移至干净的20ml玻璃瓶中,然后将该20ml玻璃瓶套在装有20ml丙酮的100ml大玻璃瓶中,大玻璃瓶用封口膜密封,室温下放置一周。将析出的固体过滤,滤饼于100℃真空干燥,得到式ia化合物的d型结晶。
[0123]1h nmr(500mhz,dmso-d6):δ=7.81(s,1h),7.58(dd,j=9.0,4.9hz,1h),7.53(d,j=1.8hz,1h),7.48(t,j=8.7hz,1h),6.78(d,j=1.9hz,1h),6.37(s,1h),5.97(q,j=6.6hz,1h),5.75(s,2h),4.77(d,j=6.5hz,1h),4.30
–
4.19(m,1h),3.69(s,3h),3.29(d,j=12.2hz,1h),3.23(d,j=12.6hz,1h),3.12(ddt,j=13.0,8.3,3.5hz,2h),2.94(td,j=12.4,3.8hz,1h),2.58(d,j=15.1hz,2h),2.51(d,j=15.1hz,2h),1.78(d,j=6.6hz,3h),1.20(d,j=6.9hz,3h)。
[0124]
实施例8引湿性试验
[0125]
将式ia化合物的h型结晶、nh型结晶,按照中国药典2015版第四部通则的9103药物
引湿性试验指导原则进行试验,分别计算样品引湿增重百分率,结果如表1所示。
[0126]
表1引湿性试验结果
[0127]
晶型引湿增重(%)h型结晶0.02nh型结晶0.01
[0128]
试验结果表明,式ia化合物的h型结晶、式ia化合物的nh型结晶引湿增重远小于0.2%,无或几乎无引湿性,对药品包装和贮存条件要求不高。
[0129]
实施例9稳定性实验
[0130]
参考《中华人民共和国药典》2015版9001原料药物与制剂稳定性试验指导原则,考察式ia化合物的h型结晶、式ia化合物的nh型结晶,分别在60℃、相对湿度92.5%(25℃)或者光照(5000lx
±
500lx)条件下,进行10天的稳定性考察。分别在第0天和第10天取样,采用hplc测试纯度。
[0131]
hplc检测条件如下:
[0132]
色谱柱:waters xbridge c18(5μm,4.6
×
150mm)
[0133]
流动相a:0.01m甲酸铵水溶液,加入0.1%甲酸,三乙胺调节ph7.4
[0134]
流动相b:乙腈
[0135]
线性梯度洗脱,程序如下:
[0136][0137]
检测波长:二极管阵列检测器(280nm)
[0138]
流速:1.0ml/min
[0139]
柱温:40℃
[0140]
进样量:10μl
[0141]
溶剂:乙腈-水(1:1)
[0142]
供试品溶液的配制:取本品,精密称取适量,加溶剂溶解并稀释制成每1ml中含1mg的溶液,作为供试品溶液。
[0143]
[0144][0145]
试验结果表明,式ia化合物的h型结晶和式ia化合物的nh型结晶均具有较好的化学稳定性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
