一种制备(r)-2,3-二芳基取代的丙酸甲酯类化合物的方法
技术领域
1.本发明属于有机合成技术领域,具体涉及一种制备(r)-2,3-二芳基取代的丙酸甲酯类化合物的方法。
背景技术:
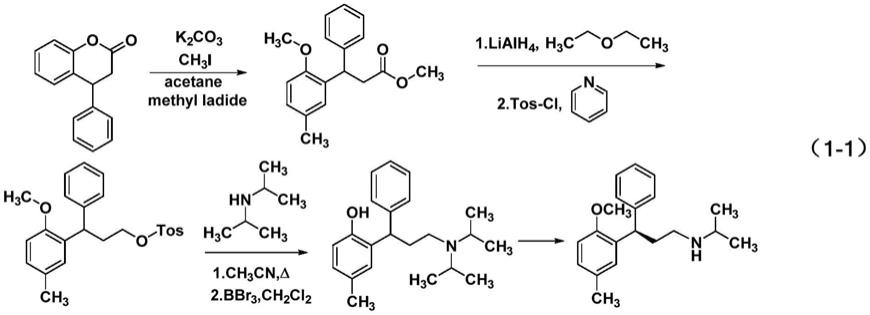
2.2,3二芳基取代的丙酸酯类是一些重要药物的关键中间体,如治疗膀胱过度活动症(oab)的主导药物托特罗定(tolterodine)。在欧美国家,oab被广泛关注和重视,治疗oab药物品种主要包括索利那新、托特罗定、非索罗定和丙哌维林,它们的销售额为27.24亿美元,约占所有治疗泌尿系统疾病药物总销售额的25%,其中托特罗定16.90亿美元占主导地位。托特罗定分子及其对映异构体的一般合成流程如式(1-1)所示。
[0003][0004]
如式(1-1),托特罗定分子结构中含有1个手性中心,传统的合成路线,需要进行手性拆分才能得到光学纯的托特罗定药物,而且在产业化中,手性拆分合成药物的理论收率只有50%,实际生产远小于50%的收率。因此,不对称合成其关键中间体,实现其高收率及高立体选择控制合成药物就有着非常重要的科学意义与实际价值。
[0005]
近年来,铑催化的苯硼酸对α,β-不饱和酮类化合物的不对称加成反应的报道可以用于托特罗定关键中间体-2,3二芳基取代的酮类和丙酸酯类合成。但昂贵的铑催化剂限制了该方法的应用。而廉价铜催化的2,3二芳基取代的丙酸酯类合成缺少相关的报道。
技术实现要素:
[0006]
针对上述现有技术,本发明提供一种制备(r)-2,3-二芳基取代的丙酸甲酯类化合物的方法,以解决催化剂昂贵以及手性拆分困难的问题。
[0007]
为了达到上述目的,本发明所采用的技术方案是:提供一种制备(r)-2,3-二芳基取代的丙酸甲酯类化合物的方法。制备方法包括以下步骤:
[0008]
将2-甲氧基-4-甲基-肉桂酸甲酯与苯硼酸类化合物共溶于有机溶剂中,再加入催化剂和p,n-型手性配体,混匀后于40~100℃下反应1~4h,即得;
[0009]
苯硼酸类化合物的结构式如式(i)所示,
[0010][0011]
p,n-型手性配体的结构式如式(ii)所示,
[0012][0013]
其中,r为氯原子、氟原子、氰基、三氟甲基、氧三氟甲基、芳基、杂芳基或碳原子数为1~12的饱和烷基;r1为饱和的烷基、取代的苯基、氯原子、氟原子或杂芳基;r2为苯基或取代的苯基;(r)-2,3-二芳基取代的丙酸甲酯类化合物的结构式如式(iii)所示,
[0014][0015]
本发明中化合物的制备反应方程式如下:
[0016][0017]
在上述技术方案的基础上,本发明还可以做如下改进。
[0018]
进一步,有机溶剂为四氢呋喃、氯苯、甲苯、二甲苯、均三甲苯或乙酸乙酯。
[0019]
进一步,2-甲氧基-4-甲基-肉桂酸甲酯与苯硼酸类化合物的摩尔比为1:1~1:3;催化剂与2-甲氧基-4-甲基-肉桂酸甲酯的摩尔比为0.005~0.1:1。
[0020]
进一步,催化剂为铜催化剂。
[0021]
进一步,催化剂为氯化亚铜、溴化亚铜、醋酸铜或三氟甲烷磺酸铜。
[0022]
进一步,芳基为苯基或者萘基;杂芳基为呋喃基或者噻吩基。
[0023]
本发明的有益效果是:
[0024]
本发明方法以一种利用廉价铜催化剂及p,n-型手性配体的催化下一步合成(r)-2,3-二芳基取代的丙酸甲酯类化合物,原料易得,制备方法简单且产率和对映选择性良好。同时,催化剂用量少,可大大降低成本。本发明方法可用于合成一系列2,3二芳基取代的丙酸酯类化合物,合成的产物具有生物活性。
具体实施方式
[0025]
下面结合实施例对本发明的具体实施方式做详细的说明。
[0026]
实施例1
[0027]
(r)-2,3-二芳基取代的丙酸甲酯类化合物的制备方法,具体包括以下步骤:
[0028]
在干燥的15ml耐压反应管中,加入103mg的2-甲氧基-4-甲基-肉桂酸甲酯(cas:86761-35-5)、78mg苯硼酸、2.0mg的氯化亚铜,7.8mg p,n-型手性配体,138mg碳酸钾和2.5ml的四氢呋喃。在氮气下,50℃搅拌反应2小时。反应结束冷却至室温,直接过硅胶柱(石油醚与乙酸乙酯的体积比为15:1),得到产物108mg,产率76%,ee 89%,反应过程如下式所示:
[0029][0030]
对本实施例制备得到的产物进行核磁共振及质谱分析:
[0031]1h nmr(400mhz,cdcl3):δ=7.40(t,j=7.6hz,2h),7.29(d,j=7.6hz,2h),7.27(d,j=7.6hz,1h),7.05(s,1h),6.94(d,j=7.2hz,1h),6.82(d,j=7.2hz,1h),4.69(dd,j=3.2,1.2hz,1h),3.83(s,3h),3.68(s,3h),3.00(dd,j=3.2,1.2hz,1h),2.75(dd,j=3.2,1.2hz,1h),2.34(s,3h).
[0032]
13
c nmr(400mhz,cdcl3):δ=174.3,161.8,142.7,131.4,128.9,127.7,127.3,112.4,57.9,53.0,44.8,38.1,21.6.
[0033]
hrms:分子式为c
18h21
o3,计算值为285.1491,检测值为285.1489.
[0034]
实施例2
[0035]
(r)-2,3-二芳基取代的丙酸甲酯类化合物的制备方法,具体包括以下步骤:
[0036]
在干燥的15ml耐压反应管中,加入103mg的2-甲氧基-4-甲基-肉桂酸甲酯(cas:86761-35-5)、97mg苯硼酸、2.0mg的氯化亚铜,7.8mgp,n-型手性配体,138mg碳酸钾和2.5ml的四氢呋喃。在氮气下,50℃搅拌反应2小时。反应结束冷却至室温,直接过硅胶柱(石油醚与乙酸乙酯的体积比为15:1),得到产物114mg,产率73%,ee 91%,反应过程如下式所示:
[0037][0038]
对本实施例制备得到的产物进行核磁共振及质谱分析:
[0039]1h nmr(400mhz,cdcl3):δ=7.38(t,j=7.6hz,2h),7.31(d,j=7.6hz,2h),7.23(d,j=7.6hz,1h),7.10(s,1h),6.77(d,j=7.2hz,1h),4.59(dd,j=3.2,1.2hz,1h),3.81(s,3h),3.66(s,3h),3.07(dd,j=3.2,1.2hz,1h),2.75(dd,j=3.2,1.2hz,1h),2.62(q,j=7.6hz,2h),2.34(s,3h),1.25(t,j=7.6hz,3h).
[0040]
13
c nmr(400mhz,cdcl3):δ=175.1,161.7,141.9,132.2,128.5,127.3,127.1,112.1,58.2,53.1,44.5,38.2,28.2,21.6,14.5.
[0041]
hrms:分子式为c
20h25
o3,计算值为313.1804,检测值为313.1806.
[0042]
实施例3
[0043]
(r)-2,3-二芳基取代的丙酸甲酯类化合物的制备方法,具体包括以下步骤:
[0044]
在干燥的15ml耐压反应管中,加入103mg的2-甲氧基-4-甲基-肉桂酸甲酯(cas:86761-35-5)、93mg 4-氟苯硼酸、2.0mg的氯化亚铜,7.8mg p,n-型手性配体,138mg碳酸钾和2.5ml的四氢呋喃。在氮气下,50℃搅拌反应2小时。反应结束冷却至室温,直接过硅胶柱(石油醚与乙酸乙酯的体积比为15:1),得到产物106mg,产率70%,ee 89%,反应过程如下式所示:
[0045][0046]
对本实施例制备得到的产物进行核磁共振及质谱分析:
[0047]1h nmr(400mhz,cdcl3):δ=7.43(t,j=7.6hz,2h),7.37(d,j=7.6hz,2h),7.27(d,j=7.6hz,1h),7.14(s,1h),6.82(d,j=7.2hz,1h),4.63(dd,j=3.2,1.2hz,1h),3.85(s,3h),3.70(s,3h),3.09(dd,j=3.2,1.2hz,1h),2.75(dd,j=3.2,1.2hz,1h),2.38(s,3h).
[0048]
13
c nmr(400mhz,cdcl3):δ=176.1,162.4,141.7,131.9,128.9,127.4,127.2,113.0,58.6,53.8,44.7,38.1,21.6.
[0049]
hrms:分子式为c
18h20
fo3,计算值为303.1396,检测值为303.1395.
[0050]
实施例4
[0051]
(r)-2,3-二芳基取代的丙酸甲酯类化合物的制备方法,具体包括以下步骤:
[0052]
在干燥的15ml耐压反应管中,加入103mg的2-甲氧基-4-甲基-肉桂酸甲酯(cas:86761-35-5)、97mg 4-氰基苯硼酸、2.0mg的氯化亚铜,7.8mg p,n-型手性配体,38mg碳酸钾和2.5ml的四氢呋喃。在氮气下,60℃搅拌反应2小时。反应结束冷却至室温,直接过硅胶柱
(石油醚与乙酸乙酯的体积比为10:1),得到产物110mg,产率71%,ee 90%,反应过程如下式所示:
[0053][0054]
对本实施例制备得到的产物进行核磁共振及质谱分析:
[0055]1h nmr(400mhz,cdcl3):δ=7.45(t,j=7.6hz,2h),7.35(d,j=7.6hz,2h),7.29(d,j=7.6hz,1h),6.82(d,j=7.2hz,1h),7.15(s,1h),4.63(dd,j=3.2,1.2hz,1h),3.87(s,3h),3.71(s,3h),3.10(dd,j=3.2,1.2hz,1h),2.70(dd,j=3.2,1.2hz,1h),2.38(s,3h).
[0056]
13
c nmr(400mhz,cdcl3):δ=176.3,162.3,156.4,141.4,131.8,127.9,127.1,126.2,114.1,58.8,53.8,44.9,38.2,21.6.
[0057]
hrms:分子式为c
19h20
no3,计算值为310.1443,检测值为310.1446.
[0058]
实施例5
[0059]
(r)-2,3-二芳基取代的丙酸甲酯类化合物的制备方法,具体包括以下步骤:
[0060]
在干燥的15ml耐压反应管中,加入103mg的2-甲氧基-4-甲基-肉桂酸甲酯(cas:86761-35-5)、117mg 4-苯基苯硼酸、2.0mg的氯化亚铜,7.8mg p,n-型手性配体,138mg碳酸钾和2.5ml的四氢呋喃。在氮气下,60℃搅拌反应3小时。反应结束冷却至室温,直接过硅胶柱(石油醚与乙酸乙酯的体积比为10:1),得到产物132mg,产率68%,ee 86%,反应过程如下式所示:
[0061][0062]
对本实施例制备得到的产物进行核磁共振及质谱分析:
[0063]1h nmr(400mhz,cdcl3):δ=7.52(d,j=7.6hz,2h),7.50(t,j=7.6hz,2h),7.41(d,j=7.6hz,1h),7.40(d,j=7.6hz,2h),7.35(d,j=7.6hz,2h),7.05(s,1h),6.94(d,j=7.2hz,1h),6.82(d,j=7.2hz,1h),4.69(dd,j=3.2,1.2hz,1h),3.84(s,3h),3.70(s,3h),3.05(dd,j=3.2,1.2hz,1h),2.77(dd,j=3.2,1.2hz,1h),2.35(s,3h).
[0064]
13
c nmr(400mhz,cdcl3):δ=173.3,160.6,141.9,140.8,138.3,131.4,131.2,131.1,129.2,128.7,128.4,127.9,127.6,127.5,112.2,56.1,51.9,38.6,21.6.
[0065]
hrms:分子式为c
24h25
o3,计算值为361.1804,检测值为361.1803.
[0066]
实施例6
[0067]
(r)-2,3-二芳基取代的丙酸甲酯类化合物的制备方法,具体包括以下步骤:
[0068]
在干燥的15ml耐压反应管中,加入103mg的2-甲氧基-4-甲基-肉桂酸甲酯(cas:
86761-35-5)、97mg4-氰基苯硼酸、2.0mg的氯化亚铜,7.8mg p,n-型手性配体,138mg碳酸钾和2.5ml的四氢呋喃。在氮气下,50℃搅拌反应2小时。反应结束冷却至室温,直接过硅胶柱(石油醚与乙酸乙酯的体积比为10:1),得到产物110mg,产率71%,ee 90%,反应过程如下式所示:
[0069][0070]
对本实施例制备得到的产物进行核磁共振及质谱分析:
[0071]1h nmr(400mhz,cdcl3):δ=7.86(d,j=7.6hz,1h),7.74(d,j=8.0hz,2h),7.35(d,j=8.0hz,2h),7.07(d,j=7.6hz,1h),7.05(s,1h),6.94(d,j=7.6hz,1h),6.82(d,j=7.6hz,1h),6.68(dd,j=7.6hz,1h),4.69(dd,j=3.2,1.2hz,1h),3.83(s,3h),3.68(s,3h),3.02(dd,j=3.2,1.2hz,1h),2.75(dd,j=3.2,1.2hz,1h),2.34(s,3h).
[0072]
13
c nmr(400mhz,cdcl3):δ=173.1,160.6,154.0,143.0,142.9,131.8,131.2,131.1,128.7,127.8,127.5,125.5,112.2,122.0,112.1,56.8,51.8,38.9,21.6.
[0073]
hrms:分子式为c
22h23
o4,计算值为351.1596,检测值为351.1596.
[0074]
实施例7
[0075]
(r)-2,3-二芳基取代的丙酸甲酯类化合物的制备方法,具体包括以下步骤:
[0076]
在干燥的15ml耐压反应管中,加入103mg的2-甲氧基-4-甲基-肉桂酸甲酯(cas:86761-35-5)、78mg苯硼酸、2.0mg的氯化亚铜,8.9mg p,n-型手性配体,138mg碳酸钾和2.5ml的四氢呋喃。在氮气下,50℃搅拌反应2小时。反应结束冷却至室温,直接过硅胶柱(石油醚与乙酸乙酯的体积比为15:1),得到产物114mg,产率73%,ee 88%,反应过程如下式所示:
[0077][0078]
对本实施例制备得到的产物进行核磁共振及质谱分析:
[0079]1h nmr(400mhz,cdcl3):δ=7.40(t,j=7.6hz,2h),7.29(d,j=7.6hz,2h),7.27(d,j=7.6hz,1h),6.94(d,j=7.2hz,1h),6.82(d,j=7.2hz,1h),7.05(s,1h),4.69(dd,j=3.2,1.2hz,1h),3.83(s,3h),3.68(s,3h),3.00(dd,j=3.2,1.2hz,1h),2.75(dd,j=3.2,1.2hz,1h),2.34(s,3h).
[0080]
13
c nmr(400mhz,cdcl3):δ=174.3,161.8,142.7,131.4,128.9,127.7,127.3,
112.4,57.9,53.0,44.8,38.1,21.6.
[0081]
hrms:分子式为c
18h21
o3,计算值为285.1491,检测值为285.1489.
[0082]
实施例8
[0083]
(r)-2,3-二芳基取代的丙酸甲酯类化合物的制备方法,具体包括以下步骤:
[0084]
在干燥的15ml耐压反应管中,加入103mg的2-甲氧基-4-甲基-肉桂酸甲酯(cas:86761-35-5)、78mg苯硼酸、2.0mg的氯化亚铜,10.4mg p,n-型手性配体,138mg碳酸钾和2.5ml的四氢呋喃。在氮气下,50℃搅拌反应2小时。反应结束冷却至室温,直接过硅胶柱(石油醚与乙酸乙酯的体积比为15:1),得到产物117mg,产率75%,ee 86%,反应过程如下式所示:
[0085][0086]
对本实施例制备得到的产物进行核磁共振及质谱分析:
[0087]1h nmr(400mhz,cdcl3):δ=7.40(t,j=7.6hz,2h),7.29(d,j=7.6hz,2h),7.27(d,j=7.6hz,1h),6.94(d,j=7.2hz,1h),6.82(d,j=7.2hz,1h),7.05(s,1h),4.69(dd,j=3.2,1.2hz,1h),3.83(s,3h),3.68(s,3h),3.00(dd,j=3.2,1.2hz,1h),2.75(dd,j=3.2,1.2hz,1h),2.34(s,3h).
[0088]
13
c nmr(400mhz,cdcl3):δ=174.3,161.8,142.7,131.4,128.9,127.7,127.3,112.4,57.9,53.0,44.8,38.1,21.6.
[0089]
hrms:分子式为c
18h21
o3,计算值为285.1491,检测值为285.1489.
[0090]
实施例9
[0091]
(r)-2,3-二芳基取代的丙酸甲酯类化合物的制备方法,具体包括以下步骤:
[0092]
在干燥的15ml耐压反应管中,加入103mg的2-甲氧基-4-甲基-肉桂酸甲酯(cas:86761-35-5)、78mg苯硼酸、2.0mg的氯化亚铜,8.3mg p,n-型手性配体,138mg碳酸钾和2.5ml的四氢呋喃。在氮气下,50℃搅拌反应2小时。反应结束冷却至室温,直接过硅胶柱(石油醚与乙酸乙酯的体积比为15:1),得到产物109mg,产率70%,ee 87%,反应过程如下式所示:
[0093][0094]
对本实施例制备得到的产物进行核磁共振及质谱分析:
[0095]1h nmr(400mhz,cdcl3):δ=7.40(t,j=7.6hz,2h),7.29(d,j=7.6hz,2h),7.27
(d,j=7.6hz,1h),6.94(d,j=7.2hz,1h),6.82(d,j=7.2hz,1h),7.05(s,1h),4.69(dd,j=3.2,1.2hz,1h),3.83(s,3h),3.68(s,3h),3.00(dd,j=3.2,1.2hz,1h),2.75(dd,j=3.2,1.2hz,1h),2.34(s,3h).
[0096]
13
c nmr(400mhz,cdcl3):δ=174.3,161.8,142.7,131.4,128.9,127.7,127.3,112.4,57.9,53.0,44.8,38.1,21.6.
[0097]
hrms:分子式为c
18h21
o3,计算值为285.1491,检测值为285.1489.
[0098]
虽然结合实施例对本发明的具体实施方式进行了详细地描述,但不应理解为对本专利的保护范围的限定。在权利要求书所描述的范围内,本领域技术人员不经创造性劳动即可作出的各种修改和变形仍属本专利的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
