tnf-α
与lps联用在构建肠道氧化应激细胞模型中的应用
技术领域
1.本发明属于生物医药技术领域。更具体地,涉及tnf-α与lps联用在构建肠道氧化应激细胞模型中的应用。
背景技术:
2.健康状态的肠道细胞在代谢过程中,会产生许多自由基,这些自由基通常不会导致肠道细胞的损伤,因为肠道细胞通过自身的抗氧化防御体系可保持体内活性氧(ros)、血红素加氧酶-1(ho-1)和醌氧化还原酶1(nqo-1)之间的平衡状态,避免自由基对细胞造成损伤。但当生物体处在病理状态或受到环境中不良因素的刺激时,其肠道细胞内的活性氧(ros)很可能会显著增多,导致细胞内产生的自由基水平高于细胞自身的抗氧化防御能力,使其氧化还原状态发生失衡,进而诱发氧化应激。氧化应激会导致肠道细胞发生死亡和不可修复的氧化损伤,肠道细胞发生氧化应激后,肠道的屏障功能会发生恶化,可能会使有害物质或病原进入血液,导致消化系统的疾病。然而时至今日,研究者们对肠道细胞氧化刺激发生发展的机制了解得仍不充分,临床上也缺乏对肠道细胞氧化刺激的有效防治策略和治疗措施。
3.应用模型模拟疾病,寻找潜在的分子机制和治疗靶点,为疾病的研究提供了极大的便利。目前肠道细胞氧化应激研究模型主要有动物模型和细胞模型,而仅利用动物模型进行肠道细胞氧化应激方面的研究往往存在一些不便与局限:(1)在日益关注动物福利的当今科学界,大量使用动物试验不符合国际舆论趋势;(2)肠道环境异常复杂,构建的动物模型无法准确判断是氧化应激直接影响的肠道细胞还是通过肠道菌群转化后产物间接影响的肠道细胞;(3)动物模型为了获得稳定的统计数据,往往要求样本大,且试验周期长,采样需要大量熟练操作者,其试验成本之高,是一些研究者难以负担的;(4)目前许多氧化应激模型是全身性的氧化应激造模,对肠道细胞的针对性不强等。基于此,构建合适的细胞模型作为动物模型的补充显得十分必要,细胞模型不仅具有研究对象直接、稳定性好、可重复性强、试验成本相对较低等一些体外培养共有的优点,更是在建立快速的营养物质跨膜运输能力评定、研究肠道菌群和肠壁的直接作用、实时观测肠道细胞在应激状态下表现等方面具有体内研究无法替代的优势。
4.鲍明隆等公开了脂多糖(lps)会诱导构建小鼠肠道产生过量的活性氧(ros),诱发氧化应激(鲍明隆,孙心怡,梁梅,巨向红,雍艳红,马兴斌,于志超,郭依莹,刘晓曦.黄芩苷通过抑制核因子-κb和激活核因子-e2相关因子2信号通路缓解脂多糖诱导的小鼠空肠炎症和氧化应激[j/ol].动物营养学报:1-13[2022-01-20].http://kns.cnki.net/kcms/detail/11.5461.s.20211221.0910.004.html.),即脂多糖可用于构建肠道氧化应激的动物模型,但动物模型与细胞模型并不能简单转用,且目前构建肠道氧化应激细胞模型的相关研究仍十分匮乏。
技术实现要素:
[0005]
本发明针对现有技术的不足,旨在提供一种单用lps,或tnf-α与lps联用在构建肠道氧化应激细胞模型中的应用,为肠道细胞氧化应激疾病提供复制和研究的工具。
[0006]
本发明的首要目的是提供lps在构建肠道氧化应激细胞模型中的应用。
[0007]
本发明的另一目的是提供tnf-α与lps联用在构建肠道氧化应激细胞模型中的应用。
[0008]
本发明的又一目的是提供一种肠道氧化应激细胞模型的构建方法。
[0009]
本发明上述目的通过以下技术方案实现:
[0010]
本发明通过采用lps对肠道细胞进行处理,发现肠道细胞中的活性氧、ho-1和nqo-1均显著提高,说明lps可成功构建肠道氧化应激细胞模型,因此,lps在构建肠道氧化应激细胞模型中的应用应在本发明的保护范围之内。
[0011]
此外,本发明还将tnf-α与lps联用对肠道细胞进行处理,发现肠道细胞中的活性氧、ho-1和nqo-1相比于单独lps处理获得进一步的提升,表明tnf-α与lps联用能更快构建得到氧化应激模型,是更优选的肠道氧化应激细胞模型刺激物,为肠道细胞氧化应激疾病提供了一种新型、快速的复制和研究工具,因此,tnf-α与lps联用在构建肠道氧化应激细胞模型中的应用也应在本发明的保护范围内。
[0012]
本发明还提供了一种肠道氧化应激细胞模型的构建方法,该方法具体是:在肠道细胞培养过程中加入lps进行处理,或者加入tnf-α和lps进行处理。
[0013]
优选地,所述肠道细胞包括大鼠肠道细胞、小鼠肠道细胞、牛肠道细胞、人肠道细胞、豚鼠肠道细胞、兔肠道细胞、羊肠道细胞、马肠道细胞、鸡肠道细胞、鸭肠道细胞、鹅肠道细胞、鱼肠道细胞、虾肠道细胞中的一种或几种。
[0014]
优选地,所述肠道细胞包括肠上皮细胞和/或肠道内皮细胞。
[0015]
最优选地,所述肠道细胞为小鼠肠上皮细胞。
[0016]
优选地,所述tnf-α的添加量为2500~10000iu/ml
培养基
。
[0017]
最优选地,所述tnf-α的添加量为5000iu/ml
培养基
。
[0018]
优选地,所述lps的添加量为20~80μg/ml
培养基
。
[0019]
最优选地,所述lps的添加量为40μg/ml
培养基
。
[0020]
优选地,所述肠道细胞培养为采用含有8~12%胎牛血清、45~55iu/ml青霉素和45~55mg/ml链霉素的培养基进行培养。
[0021]
进一步优选地,所述培养基为dmem培养基或dmem/f12培养基。
[0022]
最优选地,所述肠道细胞培养为采用含有10%胎牛血清、50iu/ml青霉素和50mg/ml链霉素的培养基进行培养
[0023]
优选地,所述处理为处理至所述肠道细胞的活性氧含量相比正常肠道细胞的活性氧含量至少升高30%。当待测肠道细胞中的活性氧含量相比正常肠道细胞中的活性氧含量至少升高30%时,说明肠道氧化应激细胞模型构建成功。
[0024]
本发明具有以下有益效果:
[0025]
本发明通过采用lps对肠道细胞进行处理,发现肠道细胞中的活性氧、ho-1和nqo-1均显著提高,说明lps可成功构建肠道氧化应激细胞模型;此外,本发明还将tnf-α与lps联用对肠道细胞进行处理,发现肠道细胞中的活性氧、ho-1和nqo-1相比于单独lps处理均获
得进一步的提升,表明tnf-α与lps联用能更快构建得到氧化应激模型,为肠道细胞氧化应激疾病提供了一种新型、快速的复制和研究工具。
附图说明
[0026]
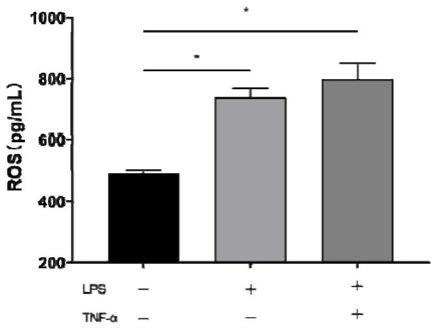
图1是三组肠上皮细胞中活性氧(ros)含量的统计图。
[0027]
图2是三组肠上皮细胞中血红素加氧酶-1(ho-1)mrna表达量的统计图。
[0028]
图3是三组肠上皮细胞中醌氧化还原酶1(nqo-1)mrna表达量的统计图。
[0029]
图4是三组肠上皮细胞中血红素加氧酶-1(ho-1)的蛋白免疫印迹结果及其统计图。
[0030]
其中,*表示两组在统计学上具有显著差异(p<0.05);图1~4的第一列均为空白组(不添加lps,也不添加thf-α),第二列均为lps单用组(只添加lps,不添加thf-α),第三列均为tnf-α和lps(同时添加tnf-α和lps)。
具体实施方式
[0031]
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
[0032]
除非特别说明,以下实施例所用试剂和材料均为市购。
[0033]
dmem培养基(dmem basic(1x),c11995500bt,gibco,usa):10%胎牛血清(fetal bovine serum,fbs,z7186fbs,zeta,france)、50iu/ml青霉素、50mg/ml链霉素(penicillin-streptomycin,15140-122,gibco,usa)。
[0034]
肠上皮细胞:来自扬州大学。
[0035]
脂多糖(lps):购自sigma公司(l2880)。
[0036]
肿瘤坏死因子(tnf-α):购自peprotech.公司(300-01a-50)。
[0037]
elisa试剂盒:购自江苏酶免实业有限公司(mm-0132m2)。
[0038]
trizol:购自invitrgen公司(15596-026)。
[0039]
反转录试剂盒:购自北京全式金生物技术有限公司(ae311)。
[0040]
rt-pcr试剂盒:购自北京全式金生物技术有限公司(aq101)。
[0041]
ripa裂解液(细胞裂解液):购自上海碧云天生物技术有限公司(p0013b)。
[0042]
实施例1肠道氧化应激细胞模型的构建
[0043]
一、模型构建方法
[0044]
在37℃、5%co2、dmem培养基中培养小鼠的肠上皮细胞,培养48小时后更换成新的dmem培养基,再进行饥饿培养,培养至所有肠上皮细胞均处于g0期后,将肠上皮细胞分为三组,分别为空白组、lps单用组、tnf-α和lps联用组。
[0045]
其中,空白组:在dmem培养基中继续培养;
[0046]
lps单用组:在dmem培养基中加入lps进行处理,使其在培养基中的浓度为40μg/ml;
[0047]
tnf-α和lps联用组:在dmem培养基中加入tnf-α和lps进行处理,使lps在培养基中的浓度为40μg/ml,tnf-α在培养基中的浓度为5000iu/ml。
[0048]
三组分别培养1小时。
[0049]
二、模型构建结果
[0050]
培养结束后,根据试剂盒厂商说明书中的方法用elisa试剂盒分别对三组培养基中活性氧(ros)的含量进行测定,结果如图1所示。由图1可知,lps单用组、tnf-α和lps联用组的ros含量均比空白组高了30%以上,表明lps单用组、tnf-α和lps联用组的肠上皮细胞发生了氧化应激反应,即肠道氧化应激细胞模型构建成功,说明将lps单用于肠道细胞、将tnf-α和lps联用于肠道细胞,均可作为肠道氧化应激细胞模型的刺激物,诱导构建得到肠道氧化应激细胞模型。
[0051]
实施例2肠道氧化应激细胞模型的构建
[0052]
一、模型构建方法
[0053]
在37℃、5%co2、dmem培养基中培养小鼠的肠上皮细胞,培养48小时后更换成新的dmem培养基,再进行饥饿培养,培养至所有肠上皮细胞均处于g0期后,将肠上皮细胞分为三组,分别为空白组、lps单用组、tnf-α和lps联用组。
[0054]
其中,空白组:在dmem培养基中继续培养;
[0055]
lps单用组:在dmem培养基中加入lps进行处理,使其在培养基中的浓度为20μg/ml;
[0056]
tnf-α和lps联用组:在dmem培养基中加入tnf-α和lps进行处理,使lps在培养基中的浓度为20μg/ml,tnf-α在培养基中的浓度为10000iu/ml。
[0057]
三组分别培养1小时。
[0058]
二、模型构建结果
[0059]
培养结束后,去掉三组的培养基,用磷酸盐缓冲盐溶液(pbs)清洗肠上皮细胞后,加入trizol,根据trizol说明书,抽提得到肠上皮细胞的rna;根据反转录试剂盒的说明书,使用反转录试剂盒将肠上皮细胞的rna反转录为cdna;再根据rt-pcr试剂盒的说明书,使用rt-pcr试剂盒在cdna中加入特异性ho-1和nqo-1的上下游引物,在rt-pcr仪中进行扩增(pcr程序:94℃30s;94℃5s、55℃15s、72℃10s,共45个循环;65℃5s;95℃5s),利用qpcr法检测血红素加氧酶-1(ho-1)和醌氧化还原酶1(nqo-1)中mrna的表达量,结果如图2~3所示。
[0060]
ho-1和nqo-1作为肠道细胞中重要的抗氧化酶,其活性对于维持肠道细胞内的氧化平衡状态有着重要意义,而由图2~3可知,lps单用组、tnf-α和lps联用组中ho-1mrna和nqo-1mrna表达量均显著高于空白组,说明lps单用组、tnf-α和lps联用组肠上皮细胞中的氧化平衡状态被破坏,发生了氧化应激反应,即肠道氧化应激细胞模型构建成功,进一步说明将lps单用于肠道细胞、将tnf-α和lps联用于肠道细胞,均可作为优异的刺激物,诱导构建得到肠道氧化应激细胞模型。
[0061]
此外,tnf-α和lps联用组中ho-1mrna和nqo-1mrna的表达量显著高于lps单用组的ho-1和nqo-1含量,说明tnf-α与lps联用能更快构建得到氧化应激模型,是更优选的肠道氧化应激细胞模型刺激物。
[0062]
实施例3肠道氧化应激细胞模型的构建
[0063]
一、模型构建方法
[0064]
在37℃、5%co2、dmem培养基中培养小鼠的肠上皮细胞,培养48小时后更换成新的
dmem培养基,再进行饥饿培养,培养至所有肠上皮细胞均处于g0期后,将肠上皮细胞分为三组,分别为空白组、lps单用组、tnf-α和lps联用组。
[0065]
其中,空白组:在dmem培养基中继续培养;
[0066]
lps单用组:在dmem培养基中加入lps进行处理,使其在培养基中的浓度为80μg/ml;
[0067]
tnf-α和lps联用组:在dmem培养基中加入tnf-α和lps进行处理,使lps在培养基中的浓度为80μg/ml,tnf-α在培养基中的浓度为2500iu/ml。
[0068]
三组分别培养1小时。
[0069]
二、模型构建结果
[0070]
培养结束后,去掉三组的培养基,用细胞刮刮下肠上皮细胞收集到离心管中,加入ripa裂解液,提取肠上皮细胞的全蛋白;通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)分离蛋白,经转膜仪转移至0.22μm聚偏氟乙烯(pvdf)膜上后,用快速封闭液封闭;再用封闭液稀释ho-1抗体(abcam公司,ep1391y;ho-1抗体:封闭液=1:1000)与膜孵育;并在t-bst中洗涤,用封闭液稀释辣根过氧化物酶(hrp;辣根过氧化物酶:封闭液=1:1000)标记二抗与膜孵育,用ecl检测系统显现印迹,并使用chemidocxrs 图像分析仪定量目的蛋白ho-1蛋白的表达量,得到的蛋白免疫印迹结果及其统计图如图4所示。
[0071]
由图4可知,lps单用组、tnf-α和lps联用组的ho-1蛋白表达量均显著高于空白组,表明lps单用组、tnf-α和lps联用组的肠上皮细胞发生了氧化应激反应,即肠道氧化应激细胞模型构建成功,说明将lps单用于肠道细胞、将tnf-α和lps联用于肠道细胞,均可作为肠道氧化应激细胞模型的刺激物,诱导构建得到肠道氧化应激细胞模型。
[0072]
此外,tnf-α和lps联用组的ho-1蛋白表达量显著高于lps单用组的ho-1蛋白表达量,说明tnf-α与lps联用能更快构建得到氧化应激模型,是更优选的肠道氧化应激细胞模型刺激物。
[0073]
综上,本发明通过采用lps对肠道细胞进行处理,发现肠道细胞中的活性氧、ho-1和nqo-1均显著提高,说明lps可成功构建肠道氧化应激细胞模型,此外,本发明还将tnf-α与lps联用对肠道细胞进行处理,发现肠道细胞中的活性氧、ho-1和nqo-1相比于单独lps处理获得进一步的提升,表明tnf-α与lps联用能更快构建得到氧化应激模型,是更优选的肠道氧化应激细胞模型刺激物。
[0074]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。