cytometry.j immunol methods.2020dec;487:112899.doi:10.1016/j.jim.2020.112899.epub 2020oct 15.pmid:33068606.)。对肿瘤细胞转染荧光蛋白,在保证没有放射性毒性的同时,用显微成像和高内涵、高通量分析工具自动成像肿瘤靶细胞,从而实现共培养中肿瘤细胞的可视化,并可视化检测共培养中免疫细胞的杀伤作用。
5.综上所述,研究一种通量高、可重复性好,且能模拟肿瘤微环境的快速筛选可视化系统显得尤为必要,并且,筛选得到具有提高机体免疫功能作用的化合物对免疫低下患者显得刻不容缓。
技术实现要素:
6.为了克服现有技术存在的不足,本发明的目的是提供mc38-n4/ot-i共培养系统筛选方法及其筛选的多糖组方与多糖组合物的应用。该多糖组合物可以促进免疫细胞杀伤肿瘤细胞、提高cd8
t细胞的活率和细胞活力和促进cd8
cd6l记忆性t细胞的生长,可用于制备改善机体免疫功能的产品。
7.为实现上述目的,本发明采用的技术方案如下:
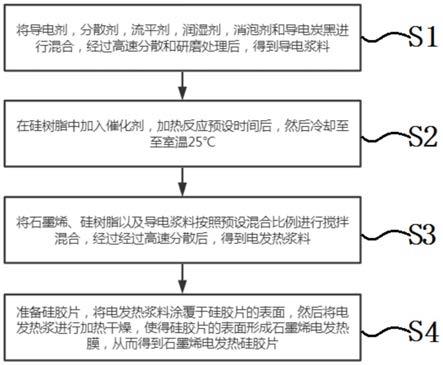
8.本发明提供的一种高通量、快速、可重复的筛选免疫调节活性物质的mc38-n4/ot-i共培养系统筛选方法,包括以下步骤:
9.mc38-n4/ot-i共培养系统筛选方法,所述mc38-n4/ot-i共培养系统筛选方法包括如下步骤:
10.(1)获得含特异性抗原和荧光蛋白的肿瘤靶细胞(target,t):将含特异性抗原及荧光蛋白的重组质粒的病毒上清感染肿瘤靶细胞,病毒感染后加入抗生素筛选,持续药筛后,荧光显微镜下观察荧光蛋白表达的情况,经过单克隆扩培、流式细胞筛选,得到表达特异性抗原的可视化肿瘤靶细胞。
11.(2)分离免疫效应细胞(effector,e):断颈处死小鼠,无菌操作取小鼠免疫脏器组织,分离小鼠免疫脏器组织,轻轻研磨得单细胞悬液,细胞过滤器过滤后,离心处理并裂解红细胞,洗涤后重悬得免疫效应细胞的单细胞悬液。
12.(3)共培养肿瘤靶细胞与免疫效应细胞:肿瘤靶细胞铺板,过夜贴壁后,弃去培养基,按照一定比例加入免疫效应细胞,同时加入待筛选实施例所得组合物,共培养一段时间后,检测肿瘤靶细胞的死亡率。
13.进一步地,步骤(1)中,所述含特异性抗原及荧光蛋白的重组质粒为plvx-ires-tdtomato-n4重组质粒;所述肿瘤靶细胞包括:llc小鼠肺癌细胞、mc38小鼠结肠癌细胞、b16小鼠黑色素瘤细胞或gl261小鼠胶质母细胞瘤细胞中的一种以上;所述抗生素包括嘌呤霉素、青霉素或链霉素中的一种以上;所述抗生素的浓度为1-10μg/ml;所述药筛的时间为4-15天。
14.进一步地,步骤(2)中,所述小鼠包括ot-i或ot-ii小鼠,ot-i小鼠的cd8
t细胞对siinfekl的n4肽具有识别的特异性,ot-ii小鼠的cd4
t细胞对siinfekl的n4肽具有识别的特异性。
15.进一步地,步骤(2)所述脏器包括脾脏、胸腺或淋巴结中的一种以上;所述免疫效应细胞为ot-i全脾脏免疫效应细胞。
16.进一步地,步骤(3)所述免疫效应细胞与肿瘤靶细胞的细胞个数比例为(100-1):
1,步骤(3)所述共培养的时间为12-96h。
17.本发明提供所述所述mc38-n4/ot-i共培养系统筛选方法筛选的多糖组方,所述组方组成原料包括有:姬松茸、灰树花、陈皮、桑黄、灵芝、茯苓、当归和枸杞中的一种以上,所述组方为姬松茸多糖、灰树花多糖、陈皮多糖、桑黄多糖、灵芝多糖、茯苓多糖、当归多糖和枸杞多糖中的一种以上,所述多糖组方的免疫调节功能筛选评价包括:(1)肿瘤细胞与免疫细胞共培养后,将细胞上清吸出,磷酸缓冲盐溶液(pbs)洗细胞两遍,胰酶消化,混合细胞收集于流式管中,离心后式染色缓冲液(facs缓冲液)重悬细胞,用流式细胞分析仪检测肿瘤靶细胞的数量,根据肿瘤靶细胞的死亡率筛选得到多糖组合物;(2)使用cytation7高通量活细胞成像系统对共培养细胞进行高通量荧光成像筛选,根据肿瘤细胞荧光数量的变化筛选得到多糖组合物。
18.进一步地,所述姬松茸多糖、灰树花多糖、陈皮多糖和桑黄多糖的质量份数比为(1-125)份:(1-125)份:(1-25)份:(0-25)份。
19.进一步地,所述使用cytation7高通量活细胞成像系统对共培养细胞进行高通量荧光成像筛选,用于筛选和评价具有免疫调节活性的物质;所述检测通过荧光成像可视化。
20.本发明还提供所述多糖组合物的应用,所述多糖组合物在制备增强cd8
t细胞抗肿瘤免疫记忆作用、增强机体免疫活性以及促进抗肿瘤功效的药物中的应用。
21.进一步地,所述增强机体免疫活性主要在于提高cd8
t细胞的存活率以及cd8
cd62l的比例。
22.进一步地,所述促进抗肿瘤功效主要在于提高免疫细胞对含特异性抗原的肿瘤细胞的杀伤效果。
23.本发明所述组合物中姬松茸、灰树花和陈皮,各组分相互配合,产生协同作用,显著改善机体免疫功能的效果,是一种具有免疫调节活性的组合物。
24.与现有技术相比,本发明技术方案的有益效果是:
25.1、本发明提供的共培养免疫调节活性的快速筛选方法包括肿瘤靶细胞的构建、免疫效应细胞分离、肿瘤靶细胞-免疫效应细胞共培养、免疫调节功能评价四个步骤,该方法可模拟肿瘤微环境中不同类型的细胞相互作用,而且对比于
51
cr的检测方法,此模型检测过程无放射性产生且具有肿瘤靶细胞可视化的优点。
26.2、本发明提供的mc38-n4/ot-i肿瘤细胞与免疫细胞共培养系统筛选方法应用范围广,可以用于筛选各种食源性活性物质,简单高效,有利于免疫调节功能性食品的快速研发与推广应用。
27.3、本发明提供的mc38-n4/ot-i共培养系统是一个多功能的体外评价平台,可用于评估cd8
t细胞对肿瘤细胞的杀伤作用;还可用于高通量筛选用于体内模型的免疫调节剂。该方法可缩短实验周期,并有助于探究免疫治疗药物的分子机制和作用靶点等。
28.4、本发明提供的多糖组合物具有提高机体免疫功能的作用,该组合物各组分相互配合,显著促进免疫细胞对肿瘤细胞的杀伤作用,显著提高cd8
t细胞的存活率和细胞活力,促进cd8
cd62l记忆性t细胞的生长,能用于制备改善机体免疫功能的产品。
附图说明
29.图1为本发明的mc38-n4/ot-i的共培养快速筛选方法示意图。
30.图2为mc38-tdtomato-n4细胞在荧光显微镜下明场和红色荧光场的图。
31.图3为单种原料对mc38-n4细胞的增殖毒性的影响柱状图。
32.图4为基于共培养评价实施例1-3与对比例1-7提升免疫功能活性的柱状图。
33.图5为实施例1多糖组合物对免疫细胞的圈门图。
34.图6为实施例1多糖组合物和对照组对免疫效应细胞存活率、cd8
t细胞的大小、cd8
t细胞的比例、cd8
cd62l的比例的影响柱状图。
具体实施方式
35.本发明提供了组合物及其在制备增强机体免疫功能的产品中的应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
36.本发明的具体实施方式中,若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用的材料、试剂等均为市售商品。
37.为验证本发明提供的mc38-n4/ot-i共培养免疫调节活性的快速筛选方法的可行性,特列举实施例1-3和对比例1-7,分别采用姬松茸、灰树花、陈皮、桑黄、灵芝、茯苓、当归和枸杞这几种提取物,按照不同配比组成不同组方,分别加入共培养系统进行干预处理,然后检测mc38-n4细胞的凋亡率并进行统计分析,进而筛选和评价不同多糖组方的免疫调节活性,具体实验方法和检测结果如下:
38.不同原料提取物制备方法包括:
39.1、姬松茸多糖提取物的制备方法
40.烘干姬松茸至恒重,干燥的原料磨成粉末,过200目筛。按照料液比1:20(m/m)的比例加入蒸馏水,55℃浸提2h,浸提次数为2次,合并两次浸提液,4 000r/min离心浸提液10min,收集上清液,55℃下旋转蒸发减压浓缩。加入浓缩液3倍体积的无水乙醇,4℃静置24h,4 000r/min离心15min,收集沉淀,真空冷冻干燥得到姬松茸粗多糖。
41.2、灰树花多糖提取物的制备方法
42.烘干灰树花至恒重,干燥的原料磨成粉末,过200目筛。按照料液比1:20(m/m)的比例加入蒸馏水,55℃浸提2h,浸提次数为2次,合并两次浸提液,4 000r/min离心浸提液10min,上清液55℃下旋转蒸发减压浓缩。加入浓缩液3倍体积的无水乙醇,4℃静置24h,4 000r/min离心15min,收集沉淀,真空冷冻干燥得到灰树花粗多糖。
43.3、陈皮多糖提取物的制备方法
44.烘干姬松茸至恒重,干燥的原料磨成粉末,过200目筛。按照料液比1:20(m/m)的比例加入蒸馏水,55℃浸提2h,浸提次数为2次,合并两次浸提液,4 000r/min离心浸提液10min,收集上清液55℃下旋转蒸发减压浓缩。粗多糖溶液中加入3倍体积的无水乙醇,4℃静置24h,4 000r/min离心15min,收集沉淀,真空冷冻干燥得到陈皮粗多糖。
45.4、桑黄多糖提取物的制备方法
46.烘干桑黄至恒重,干燥的原料磨成粉末,过200目筛。按照料液比1:20的比例加入蒸馏水,55℃浸提2h,浸提次数为2次,合并两次浸提液,4 000r/min离心浸提液10min,上清液55℃下旋转蒸发减压浓缩。粗多糖溶液中加入3倍体积的无水乙醇,4℃静置24h,4 000r/
min离心15min,收集沉淀,真空冷冻干燥得到粗多糖。
47.5、灵芝、茯苓、当归和枸杞提取物的制备方法
48.灵芝、茯苓、当归和枸杞烘干至恒重,分别将1质量份的原料加入40质量份的体积百分比浓度为70%的乙醇中,45℃水浴锅浓缩提取,抽滤,真空冷冻干燥,分别制得各提取物。
49.按照配方将姬松茸多糖提取物、灰树花多糖提取物、陈皮多糖提取物以及桑黄多糖提取物混合,制得多糖组合物。
50.实施例1
51.按照如下配比制备多糖组合物:姬松茸多糖、灰树花多糖、陈皮多糖和桑黄多糖的质量份数比为125份:1份:1份:0份。
52.实施例2(对比例6)
53.按照如下配比制备多糖组合物:姬松茸多糖、灰树花多糖、桑黄多糖和陈皮多糖的质量份数比为1份:1份:5份:1份。
54.实施例3(对比例7)
55.按照如下配比制备多糖组合物:姬松茸多糖、灰树花多糖、桑黄多糖和陈皮多糖的质量份数比为25份:125份:25份:125份。
56.对比例1-7
57.1、按照表1组方制备混合物:
58.表1组合物组方(质量份)
[0059][0060]
按照配方表1将姬松茸、灰树花、桑黄、陈皮、灵芝、茯苓、当归以及枸杞各自的提取物,制得对比例1-7。
[0061]
功效验证
[0062]
图1为本发明的mc38-n4/ot-i的共培养快速筛选方法示意图。由图1可知,ot-i小鼠脾脏中分离出免疫效应细胞后,与转染特异性抗原和荧光蛋白的肿瘤靶细胞共培养48h。共培养过程中,免疫效应细胞通过t细胞受体(tcr)识别肿瘤细胞的特异性抗原肽n4,识别后效应细胞会释放炎症因子,从而促进肿瘤细胞的凋亡,通过流式细胞仪和荧光显微镜可反映肿瘤靶细胞的凋亡情况。
[0063]
基于共培养系统检测本发明所述实施例1-3的多糖组合物和对比例1-7的多糖组
合物提高机体免疫功能的活性。
[0064]
1、实验动物
[0065]
动物实验对象为ot-i转基因小鼠,spf(无特定病原体)级条件下饲养,环境温度23
±
2℃、相对空气湿度60%,每天循环光照及黑暗各12h。解剖取脾脏组织前,剪脚趾裂解dna鉴定基因型。
[0066]
ot-i小鼠基因型确认后,进行后续小鼠解剖操作,操作过程在冰上进行。首先脱颈椎处死小鼠,小鼠完全浸泡于体积百分比浓度为75%的酒精中进行消毒后,迅速取出脾脏组织,并置于预冷的rpmi 1640完全培养基中。将70μm孔径的尼龙筛放置在50ml离心管上,培养基中取出脾脏组织放于70μm的尼龙膜上,用注射器的活塞平面轻轻研磨脾脏组织,期间用完全培养基润洗脾脏组织,使研磨脾脏的单细胞悬浮液通过70μm的细胞过滤器过滤。离心,弃上清液得细胞沉淀。沉淀用1x红细胞裂解液重悬,混匀细胞,室温静置5min裂解红细胞,随后用10ml预冷的facs缓冲液(流式染色缓冲液)终止裂解,颠倒混匀后,离心得沉淀,rpmi 1640完全培养基重悬,使重悬细胞浓度为30万/ml,所得细胞即为ot-i脾脏免疫效应细胞。
[0067]
2、获得含特异性抗原和荧光蛋白的肿瘤靶细胞
[0068]
转染前一天将0.5
×
106个状态良好的mc38肿瘤靶细胞接种到6孔板中,每个孔中添加3ml培养基并混匀,二氧化碳培养箱培养。分别向500μl opti-mem培养基中加入4μg plvx-ires-tdtomato-n4重组质粒;4μg逆转录病毒包装质粒;充分混匀。向500μlopti-mem培养基中加入20μl lipo 2000(lipofectamine
tm 2000),充分混匀。分别室温孵育5min。将lipo 2000的预混物加入到dna预混物中,混匀,室温下孵育20min。弃去原培养基,加入转染试剂混合物。5h后弃去原培养基,加入新鲜的完全培养基。转染24h之后加入1.2μg/ml的嘌呤霉素。根据细胞生长密度选择进行传代或者更换培养基。持续药筛7天后,荧光显微镜下观察红色荧光蛋白的表达情况;经过单克隆扩培、流式细胞分选,得到可表达特异性抗原的可视化肿瘤靶细胞。荧光显微镜下的观察结果如图2所示,明场下细胞生长状态良好,同时观察到mc38细胞均有表达tdtomato红色荧光蛋白,且表达量较高,表明质粒转染成功。
[0069]
3、共培养肿瘤靶细胞与免疫效应细胞
[0070]
mc38-n4细胞以6 000个/孔的细胞铺板于96孔板中,过夜贴壁后,弃去培养基,按照免疫效应细胞与肿瘤靶细胞的细胞个数比(e:t)5:1的比例加入100μl的上述浓度的ot-i脾脏免疫效应细胞。同时加入100μl两倍浓度的待筛选物,共培养48h,检测带红色荧光蛋白的mc38-n4细胞的死亡率。
[0071]
4、免疫调节功能评价
[0072]
共培养过程中,mc38-n4靶细胞可被ot-i脾脏中cd8
t效应细胞靶向杀伤,通过统计mc38-n4红色荧光细胞的数量反映共培养的杀伤效果。评价方法有两种:a)直接使用cytation7高通量活细胞成像系统对96孔板进行孔板荧光成像,通过gen5软件(biotek)统计荧光细胞个数;b)将细胞上清吸出,pbs洗细胞两遍,胰酶消化,细胞收集于流式管中,离心后用含10μg/ml的dapi溶液重悬细胞,用流式细胞分析仪facs lsrii(bd facsverse)检测mc38-n4红色荧光细胞的数量。
[0073]
5、mtt法确定提取物对mc38-n4细胞的无明显毒性的浓度范围
[0074]
共培养体系中mc38-n4细胞的死亡一方面可来自于ot-i细胞的杀伤作用,另一方
面也可能来自于提取物对mc38-n4细胞的直接毒性作用。为排除提取物在共培养系统中对mc38-n4细胞直接毒性作用,因此需确定各提取物对mc38-n4细胞无明显毒性作用的剂量范围。
[0075]
将处于对数增长期的mc38-n4细胞进行消化、重悬和计数后,以6
×
104个/ml密度接种于96孔板,每孔100μl。培养箱中培养贴壁后,空白对照组加入200μl的新鲜完全培养基,实验组分别加入姬松茸多糖、灰树花多糖、陈皮多糖和桑黄多糖四种粗提物,每种多糖分别加入10μg/ml、50μg/ml、250μg/ml、1250μg/ml到相应完全培养基。37℃恒温培养箱中培养48h后,每孔加入20μl 5mg/ml的mtt溶液,继续培养4h后,吸去上清培养液,每孔加入150μl dmso溶液以溶解甲瓒结晶,振板摇匀后采用全功能微孔板检测酶标仪于490nm处检测吸光度值。实验组吸光度值与空白对照组吸光度值的比值即为mc38-n4细胞的存活率。
[0076]
6、基于mc38-n4共培养系统筛选各不同配比的组方
[0077]
根据mtt实验结果,确定提取物对mc38-n4的无明显毒性剂量浓度范围后,按照表1的组方配比设计了9个不同对比例。mc38-n4细胞以6 000个/孔的细胞铺板于96孔板中,过夜贴壁后,弃去培养基,按照效应细胞:靶细胞(5:1)的数量比例,加入100μl的上述浓度的效应细胞。同时加入100μl两倍浓度的待筛选物,共培养48h。
[0078]
共培养后,将细胞上清吸出,pbs洗细胞两遍,胰酶消化,细胞收集于流式管中。离心后用200μl含10μg/ml的dapi溶液重悬细胞,用流式细胞分析仪facs lsrii(bd facsverse)检测mc38-n4红色荧光细胞的数量。
[0079]
7、实施例1多糖组合物脾脏细胞的体外刺激实验
[0080]
脱颈处死小鼠,解剖ot-i小鼠取完整脾脏,研磨制成单细胞悬液。离心,弃上清得细胞沉淀。沉淀用1ml的1x红细胞裂解液重悬细胞,室温静置5min裂解红细胞,随后用10ml预冷的facs缓冲液终止裂解,混匀后,离心得沉淀,用含1nm的n4(siinfekl,ova257-264抗原多肽片段)肽的k medium重悬至2million/ml,铺到6孔板中,每孔1ml即2million/孔。未加多糖组合物的对照组和实验组均添加100iu/ml的il-2(白细胞介素-2),实验组添加两倍浓度的实施例1多糖组合物,对照组用培养基补全体积到2ml。培养48h后,收集细胞于流式管中,每管加入1ml的facs缓冲液,离心弃上清。fc受体阻断剂用facs缓冲液稀释,每管加入50μl,振荡混匀,冰上避光静置15min。染胞外标志物:anti-cd8,anti-tcrβ,anti-cd62l;抗体用facs缓冲液稀释后,稀释比例为1:150(v/v),每管加入50μl进行染色,振荡均匀,冰上避光30min。染色完成后每管加入1ml的facs缓冲液,洗一遍,离心弃上清。每管加入200μl的facs缓冲液,涡旋混匀细胞后,流式细胞分析仪检测。
[0081]
实验结果分析
[0082]
1、姬松茸多糖、灰树花多糖、陈皮多糖和桑黄多糖四种多糖提取物对mc38-n4的mtt实验结果分析
[0083]
为排除提取物在共培养系统中对mc38-n4细胞的直接毒性作用,因此需确定各提取物对mc38-n4细胞的无明显毒性作用的剂量范围。如图3所示,灰树花在10-250μg/ml的浓度范围内对mc38-n4细胞无明显的细胞毒性作用,姬松茸在10-1250μg/ml的浓度范围内对mc38-n4细胞无明显的细胞毒性作用,陈皮在10-1250μg/ml的浓度范围内对mc38-n4细胞无明显的细胞毒性作用,桑黄在50-250μg/ml的浓度范围内对mc38-n4细胞无明显的细胞毒性作用。因此,选择无明显剂量毒性的浓度进行下一步共培养实验。
[0084]
2、共培养实验结果分析
[0085]
根据原料无明显毒性的剂量,按照表1设计不同的对比例。通过流式细胞分析仪检测ot-i脾脏免疫细胞对mc38-n4细胞的杀伤作用,结果如图4所示,与未加免疫效应细胞的对照组(e:t=5:0)相比,添加免疫效应细胞的对照组(e:t=5:1)明显促进肿瘤靶细胞的死亡。与对照组(e:t=5:1)相比,实施例1多糖组合物显著的促进共培养系统中ot-i免疫细胞的活性,活性提高了22%。该组方可促进免疫细胞发挥更好的肿瘤杀伤功能,用于制备增强机体免疫活性以及促进抗肿瘤功效的药物中。
[0086]
3、实施例1多糖组合物体外促进cd8
t细胞的增殖与活化结果分析
[0087]
为进一步明确实施例1多糖组合物对免疫增强作用的调节方式,检测实施例1多糖组合物对免疫细胞增殖和活化的影响。图5显示的是实施例1多糖组合物对ot-i脾脏免疫细胞的圈门示意图,由图5可知,从所有细胞中圈出淋巴细胞,去除黏连细胞后圈出单淋巴细胞,然后从活的单淋巴细胞中分群圈出t细胞,最后圈出cd62l 阳性细胞群。流式数据统计结果如图6所示,结果表明,与未加多糖组合物的对照组(e:t=5:1)的脾脏免疫细胞存活率为16.13%
±
0.41%相比,加入实施例1多糖组合物的脾脏免疫细胞存活率为32.33%
±
0.33%,实施例1多糖组合物可显著增强脾脏免疫细胞的活率;与未加多糖组合物的对照组(e:t=5:1)的cd8
t细胞的比例(19.87%
±
0.75%)相比,加入实施例1多糖组合物的cd8
t细胞的比例为33.03%
±
1.64%,实施例1多糖组合物还可显著提高cd8
t细胞的比例。同时,实施例1多糖组合物还可促进cd8
t的细胞的激活,与未加多糖组合物的对照组(e:t=5:1)的cd8
t细胞相对体积为100.00%
±
0.10%相比,加入实施例1多糖组合物的cd8
t细胞相对体积为102.40%
±
0.08%,实施例1多糖组合物导致cd8
t细胞相对体积显著变大2%;通过进一步检测实施例1多糖组合物对cd8
中央记忆型t细胞的影响,与未加多糖组合物的对照组(e:t=5:1)的cd8
cd62l t细胞的比例为83.07%
±
2.62%相比,结果发现加入实施例1多糖组合物的cd8
cd62l t细胞的比例为95.40%
±
0.23%,实施例1多糖组合物显著增加cd8
cd62l t细胞的比例,促进cd8
t细胞的抗肿瘤作用,提示实施例1多糖组合物可用于免疫治疗中提高cd8
t免疫细胞的抗肿瘤活性,以及该组方可用于过继t细胞介导的肿瘤治疗中。
[0088]
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。