基于半导体聚合物点的高灵敏度microrna荧光原位杂交定量标记探针及其制备方法
技术领域
1.本发明属于microrna定量标记检测技术领域,具体涉及一种基于半导体聚合物点的高灵敏度microrna荧光原位杂交定量标记探针及其制备方法,该荧光探针适用于医学基础实验(包括细胞涂片、细胞染色、定量标记)和临床实验室检查(例如组织切片、鼻咽拭子和外分泌液)的检测。
背景技术:
2.micrornas是一类小的非编码rna,涉及几乎所有的遗传中心法则过程和人类生物学行为,也在多种疾病的病理活动中发挥着重要作用,如基因转录、蛋白质翻译、外泌体分泌等。疾病或癌症特异性microrna的表达水平往往随着病情的进展呈现出规律性的变化趋势,因而在细胞或组织中设计和准确定位具有良好特异性和识别度的microrna敏感性纳米荧光探针对癌症患者的早期诊断、个体化治疗、预后评估等都具有重大意义。
3.常用的microrna检测技术主要可分为两个大类:核酸扩增法和原位标记法,在微量microrna领域基于pcr(聚合酶链反应)的核酸扩增法应用更为广泛。前者又可被细分为:初代pcr、基因组cdna文库扩增技术、逆转录pcr(reverse transcription pcr,rt-pcr)、real-time pcr、实时荧光定量pcr(quantitative real-time pcr,qrt-pcr)等。基本过程可概括为:利用rna与逆转录酶发生作用以制备与该rna互补的dna;然后,对靶标序列采用特异性的成对扩增引物进行指数倍扩增,在经历多次变性、退火、延伸的扩增循环后,得出靶标序列的定量分析结果。标记法则可被细分为:核酸杂交技术、原位杂交技术、单/多标记碱基(报告分子标记)替换技术等;标记位点包含核苷酸骨架内、单核苷酸碱基侧链、核苷酸链间扦插等;标记标签囊括小分子染料、生物自发荧光蛋白、同位素、生物素等。这些标记物同时也作为生物医学成像的主要载体工具,已广泛应用于基础科研、临床实验室检查以及用于疾病的判读诊断和预后评估等方面。时至今日,在诸多临床实验室检查手段中,依旧没有一种便捷的方法可以实现直接原位标记和定量检测组织或细胞中的microrna的定量成像手段。即使是标准的microrna检测技术,如pcr和基因表型测序等,也只能在对样品来源的microrna进行提取、纯化后,才能进行后续的检测分析。因此,向半导体聚合物点引入靶标microrna特异性反义互补序列并施加特定激发信号以激发报告分子的比例成像分析,利用普通荧光显微镜或共聚焦显微镜对产生的色谱图像信号进行放大、多标记下的组合重叠处理、数据的分析后处理,将微观的microrna表达水平转化为的具有光学可视化的图像信息无疑是最具发展潜能的检测技术之一。由于半导体聚合物点自身具有良好的生物相容性、灵敏度高、特异性强、可操作性好、理化性质稳定等特点,这一技术也可以用于生物检测领域,对蛋白分子、(脱氧)核糖核苷酸、免疫分子以及其他生物小分子均具有很好的检测效果。
4.rna荧光原位杂交(fluorescence in situ hybridization(fish))是一种rna原位标记定位的重要非放射性技术,通常是利用报告分子(如生物素、同位素等)用作标记探
针,然后将侨联有特异性(脱氧)核糖核苷酸序列的探针与遗传物质或目的dna/rna杂交,若两者同源互补(碱基互补配对),即可形成靶dna/rna与核酸探针的杂交体。此时可利用该报告分子与荧光素标记的特异亲和素之间的免疫化学反应对报告分子的信号进行放大,经荧光检测体系在镜下对dna/rna进行定性、定量或细胞组织内亚细胞相对定位分析。但此种方法依旧存在一些不足之处,利用单独的报告分子进行检测时,需利用酶联免疫吸附反应对信号进行级联放大,操作繁复、对实验室环境和实验者的技术要求较高。其次,常规报告分子受自身理化性质限制,当长时间暴露于室温或日光照条件下,自身化学结果容易发生改变,易于发生猝灭、化学键断裂等;多报告分子标记时,容易发生荧光信号干涉和干扰,在一定程度上阻碍了该类报告分子的临床实验室检查大规模普及和常规应用。
5.基于半导体聚合物点的rna荧光原位杂交标记技术其自身具有以下优势:第一点是优异的敏感性和特异性,i.此法可以检测microrna(检测极限浓度在am级别,并可实现snp-单碱基突变的检测);ii.报告分子稳定性高(室温条件下可存放数小时),定位准确(可实现超分辨率成像),能迅速得到结果;iii.多重标记时,可同时标记多个靶标核苷酸序列(优于pcr的单一检测模式);iv.样本标记固定后,交叉污染可能性极低,适宜条件下可存放数年且不发生自身信号的过度衰减;v.操作简便、制备难度低、易于存放、可重复性好。第二点是可实现三维立体成像和超分辨率成像的现代医学生物成像、标记需求,借助数字化处理软件和空间建模技术,利用该类探针作为追踪点,可满足多种实验技术成像的需求。第三点是对操作者的相关技术背景要求较低(无需设计嵌合引物和修饰核酸外/内切酶),操作人员的前期培训简易,对实验室的要求也不高。常规成像仅需普通荧光显微镜即可,且该类探针具有近红外域的成像潜质,仅需添加适当的激发光源和替换适当的报告分子即可实现深度成像(成像深度:1-3mm)。第四点价格低廉、材料易于获取、存放方便。因此开发一种具有高敏感性、高特异性、高成像分辨率、生物相容性好、rna敏感的的荧光探针,建立microrna原位定量定性检测的新型标记模式,是实现疾病或者肿瘤标志性microrna快速、便捷、灵敏的标记检测和生物成像的一个重要的途径。
技术实现要素:
6.本发明的目的是提供一种基于半导体聚合物点的高灵敏度microrna荧光原位杂交定量标记探针及其制备方法,该探针可以在疾病或者肿瘤标志性microrna标记检测中得到广泛应用,其主要解决了现有rna荧光原位杂交定量标记探针的理化稳定性不理想、制备流程繁复、操作繁琐的问题。本发明所述探针的制备方法简便易行、理化性质稳定、生物相容性好、低生物毒性,探针的粒径可以方便的通过投料的比例来进行调节,且具有近红外域的成像潜质,仅需添加适当的近红外染料即可实现近红外域的成像需求。
7.本发明所述的microrna荧光原位杂交定量标记探针,由半导体聚合物点和靶标microrna特异性反义互补序列构成;其中,半导体聚合物点是采用半导体聚合物和功能聚合物通过纳米沉淀法在水中制备得到。功能聚合物在这里是为了调整半导体聚合物点的尺寸和表面电位,并可以用来防止半导体聚合物点在高浓度下的聚集。常见的功能聚合物有聚苯乙烯马来酸酐poly(styrene-co-maleic anhydride)(psma)及羧基封端的聚乙二醇接枝在聚苯乙烯骨架上的双亲性聚合物polystyrene graft ethylene oxide functionalized with carboxy(ps-peg-cooh);功能聚合物在半导体聚合物点中质量含量
较低,一般为15%~25%,其余为半导体聚合物;半导体聚合物点的尺寸为20~30nm。靶标microrna特异性反义互补序列可以根据不同的应用选择不同的特异性序列,可以通过偶联反应直接连接在半导体聚合物点的表面。
8.本发明所述的一种基于半导体聚合物点的microrna荧光原位杂交定量标记探针的制备方法,其步骤如下:
9.(1)将半导体聚合物和功能聚合物溶于3~5ml四氢呋喃中,其中半导体聚合物的浓度为40~50μg/ml,功能聚合物的浓度为8~12μg/ml;然后用220nm的有机系滤头进行过滤,再在超声的情况下,将过滤后得到的混合溶液快速注射到10~20ml无核苷酸酶水(depc水)中并且继续超声1~5分钟;
10.(2)在惰性气体(氮气、氩气、氦气等)的保护下,将步骤(1)得到的溶液加热至85~95℃保持2~6小时除去四氢呋喃,冷却至室温后用220nm的水系滤头进行过滤除去大的颗粒,得到半导体聚合物点水溶液;通过调整初始溶液的浓度和注射体积,使制得的半导体聚合物点的尺寸为20nm~30nm;
11.(3)将步骤(2)制得的半导体聚合物点水溶液用无核苷酸酶水(depc水)将半导体聚合物点的浓度稀释至30~40ppm,取1ml稀释后的半导体聚合物点水溶液,依次加入1m的4-羟乙基哌嗪乙磺酸(hepes)水溶液(ph=6.5)20~40μl、5%质量分数的聚乙二醇水溶液20~40μl、100μm的靶标microrna特异性反义互补序列水溶液50μl、5mg/ml的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)水溶液20μl~40μl,室温下搅拌4~6小时,使得microrna特异性反义互补序列与半导体聚合物点发生偶联反应;其中edc用于活化羧基使半导体聚合物点与microrna特异性反义互补序列有效结合,hepes作为氢离子缓冲剂用来维持溶液的ph值;之后将上述溶液盛于截留分子量100kda的透析袋中,透析处理48~72小时,然后将透析袋中的溶液用20mm的hepes水溶液定容至1ml,即得到本发明所述的基于半导体聚合物点的microrna荧光原位杂交定量标记探针。
12.本发明中所述的半导体聚合物包括但不局限于含苯并噻唑的聚芴衍生物、聚对苯撑乙烯及其衍生物、聚烷基芴、含二噻吩苯并噻唑的聚芴衍生物或聚对苯撑乙炔及其衍生物。通过选择不同的聚合物材料,制备得到不同半导体聚合物点。其中具有近红外发光的半导体聚合物点,可以采用掺杂近红外染料的方式,通过能量转移的方式来实现近红外发射和(近)红外域的信号激发。比如将nir 775掺杂到相应的半导体聚合物和功能聚合物的四氢呋喃溶液中,通常掺杂所使用的近红外染料浓度为0.1~0.5μg/ml。
13.经过反复比较和优化选择,在实施例中选取的聚芴衍生物和聚对苯撑乙烯衍生物poly(9,9-dioctylfluorene)(pfo)、poly[(9,9-dioctylfluoreny1-2,7-diyl)-co(1,4-benzo-{2,1',3}-thiadazole)](pfbt)、poly[(9,9-dioctylfluorenyl-2,7-diyl)-co-(1,4-benzo-[2,1’,3]-thiadazole)](pdfdbt)、poly(2,5-di(hexyloxy)cyanoterephthalylidene)(cn-ppv)作为半导体聚合物来制备半导体聚合物点,其结构式如下所示:
[0014]
[0015][0016]
经过反复比较和优化选择,在实施例中选取的近红外染料nir 775的结构式如下:
[0017][0018]
常见的功能聚合物如双亲聚合物聚苯乙烯马来酸酐poly(styrene-co-maleicanhydride)(psma)的结构式如下式所示:
[0019][0020]
n、m为正整数,表示重复单元的数量;
[0021]
本发明所述microrna荧光原位杂交定量标记探针都是在无核苷酸酶水(depc水)溶液体系中制备的,制备方法采用的设备简单、条件温和、所用化学试剂廉价易得。制备得到探针的粒径20~30nm,探针核心呈球形。本发明制备的microrna荧光原位杂交定量标记探针在可见光和近红外区展现了优异的信号发射强度,可以很好的利用常规荧光显微镜或共聚焦显微镜的激发光源进行成像。实验结果表明本类探针具有优良的生物相容性、成像分辨度和稳定性,展现了稳定高效的靶标rna标记能力以及检测的敏感性及特异性。与现有常规的核酸扩增法(如pcr技术)和荧光素、生物素、同位素标记技术相比,以半导体聚合物点作为报告分子的标记探针具有无毒且生物相容性好的特点,适用于微量浓度背景下的靶标microrna的标记和定量定性检测。在敏感性和特异性测试中,利用能量传递的原理激发检测基团cy3dt,绘制该类探针的激发峰拟合曲线后得知fm是其检测极限,体外设计的单碱基突变靶标microrna检测结果表明该类探针可实现snp(单核苷酸多态性)的检测。基于聚合物点为报告分子的标记探针可以灵活的改变报告分子的成分、理化结构、核心纳米颗粒粒径和激发/发射域的分布,并通过调节报告分子的光学特性,可实现深度成像(1~3mm)和超分辨率成像(50nm)的现代医疗生物成像的技术要求。本发明所述microrna荧光原位杂交定量标记探针制备方法简单、可重复性好、可放大量生产,在microrna标记检测领域有良好的应用前景和发展潜能,可实现细胞或组织内低微量microrna的定量定性标记及检测。
附图说明
[0022]
图1:实施例1中microrna荧光原位杂交定量标记探针修饰反义互补序列前后的透射电镜照片;a)修饰前的半导体聚合物点,b)修饰后探针的透射电镜照片;
[0023]
图2:实施例1中microrna荧光原位杂交定量标记探针粒径及表面电位分布图;以基于半导体聚合物点pfo pdots合成的标记探针为例,a)修饰后的标记探针粒径分布图,b)修饰后的标记探针表面电位分布图;
[0024]
图3:实施例1中4种microrna荧光原位杂交定量标记探针修饰前的吸收和发射光谱图;a)修饰前的吸收光谱图,b)修饰前的激发光谱图;
[0025]
图4:实施例1中4种microrna荧光原位杂交定量标记探针修饰后的吸收和发射光谱;图a)修饰后的吸收光谱图,b)修饰后的激发光谱图;。
[0026]
图5:实施例1中使用4种microrna荧光原位杂交定量标记探针分别对肝癌细胞hepg2的染色照片。
[0027]
图6:实施例1中使用4种不含有microrna特异性反义互补序列的半导体聚合物点分别对肝癌细胞hepg2的染色照片。
[0028]
图7:实施例2中microrna荧光原位杂交定量标记探针在紫外灯下的显色照片。其顺序依次为:(a)pfo pdots(左:修饰前;右:修饰后),(b)pfbt pdots(左:修饰前;右:修饰后),(c)pfdtbt pdots(左:修饰前;右:修饰后)、(d)nir pdots(左:修饰前;右:修饰后);
[0029]
图8:实施例2中microrna荧光原位杂交定量标记探针粒径及电位分布图顺序依次为:(a)黑色
‑‑
pfo pdots(左:修饰前;右:修饰后),(b))深灰色
‑‑
pfbt pdots(左:修饰前;右:修饰后),(c)浅灰色
‑‑
pfdtbt pdots(左:修饰前;右:修饰后)、(d)白色
‑‑
nir pdots(左:修饰前;右:修饰后);;
[0030]
图9:实施例2中,基于三种人肝源性细胞系的microrna荧光原位杂交定量标记探针四重标记的共聚焦显微镜成像图,a)肝正常细胞系l-02(亮橙色),b)肝癌细胞系smmc 7721(紫黄色),c)肝癌细胞系hepg2(蓝紫色)。
[0031]
图10:实施例3中基于半导体聚合物点(pfo pdots)的microrna荧光原位杂交定量标记探针检测靶标microrna(hsa-microrna-1292-5p)的特异性、敏感性测试荧光光谱图。
[0032]
图11:实施例3中基于图10中443nm处峰值与靶标microrna浓度间的拟合线性方程图。
[0033]
图12:实施例3中基于图10中570nm处峰值与靶标microrna浓度间的拟合线性方程图。
[0034]
图13:实施例4中肝细胞肝癌组织超薄切片的共聚焦显微镜成像示意图,细胞来源为病理分级i级,肿瘤特异性microrna标记半导体聚合物点(pfo pdots、pfbt pdots)标记数量较少,正常细胞特异性microrna标记半导体聚合物点(pfdtbt pdots、nir pdots)标记数量多。
[0035]
图14:实施例4中肝细胞肝癌组织超薄切片的共聚焦显微镜成像示意图,细胞来源为病理分级ii级,肿瘤特异性microrna标记半导体聚合物点(pfo pdots、pfbt pdots)标记数量较中等,正常细胞特异性microrna标记半导体聚合物点(pfdtbt pdots、nir pdots)标记数量中等。
[0036]
图15:实施例4中肝细胞肝癌组织超薄切片的共聚焦显微镜成像示意图,细胞来源
为病理分级iii级,肿瘤特异性microrna标记半导体聚合物点(pfo pdots、pfbt pdots)标记数量较较多,正常细胞特异性microrna标记半导体聚合物点(pfdtbt pdots、nir pdots)标记数量较少。
[0037]
图16:实施例4中肝细胞肝癌组织超薄切片的共聚焦显微镜成像图,a)病理分级i级,b)病理分级ii级,c)病理分级iii级。
具体实施方式
[0038]
下面以具体实施例对本发明的技术方案做更详细的说明,但所述实例不构成对本发明的限制。
[0039]
实施例1
[0040]
(1)分别配制pfo、pfbt、pfdtbt和cn-ppv半导体聚合物和功能聚合物(聚苯乙烯马来酸酐(psma))的3ml四氢呋喃溶液,半导体聚合物和psma的浓度分别为40μg/ml和10μg/ml。在cn-ppv的四氢呋喃溶液中还掺杂了近红外染料nir 775,其浓度是0.5μg/ml;然后用220nm的有机系滤头进行过滤,再在超声的情况下,将过滤后得到的半导体聚合物和psma的混合溶液分别快速注入4份10ml depc水中并且继续超声2分钟;
[0041]
(2)在氮气保护下,将步骤(1)得到的溶液在加热台上(85℃)加热4小时以除去四氢呋喃溶剂,冷却至室温后经220nm水系滤头过滤除去大的颗粒,得到了粒径20~30nm的半导体聚合物点depc水溶液,这些半导体聚合物点分别命名为pfo pdots、pfbt pdots、pfdtbt pdots和nir pdots(cn-ppv掺杂nir775染料的半导体聚合物点)。
[0042]
(3)将步骤(2)制得的四种不同的半导体聚合物点depc水溶液再次使用depc水分别稀释至40ppm。随后,分别取1ml稀释后的半导体聚合物点depc水溶液,依次加入1m的hepes水溶液(ph=6.5)20μl、5%质量分数的聚乙二醇水溶液20μl、100μm/l的rna特异性反义互补序列水溶液50μl(pfo pdos标定hsa-microrna-1292-5p、pfbt pdos标定hsa-microrna-1301-3p、pfdtbt pdos标定hsa-microrna-3614-5p和cn-ppv pdos标定hsa-microrna-5589-3p)、5mg/ml的edc水溶液20μl,置于混匀仪中室温下搅拌4小时,使得microrna特异性反义互补序列与半导体聚合物点发生偶联反应;其中edc用于活化羧基使半导体聚合物点分别与各自标定的microrna特异性反义互补序列有效结合;hepes作为氢离子缓冲剂用来维持溶液的ph值。将得到的microrna荧光原位杂交定量标记探针无核苷酸酶水溶液盛于截留分子量为100kda的透析袋中,透析处理48小时后,用20mm的hepes水溶液将透析袋内的溶液定容至1ml。最终得到4种(pfo pdots、pfbt pdots、pfdtbt pdots和nir pdots)基于半导体聚合物点的microrna荧光原位杂交定量标记探针。
[0043]
实施例1性能测试
[0044]
采用透射电子显微镜(tem)、动态光散射(dls)、紫外可见吸收光谱(uv-vis)和荧光光谱(fl)对得到的microrna荧光原位杂交定量标记探针进行详细表征。
[0045]
将microrna荧光原位杂交定量标记探针与共聚焦显微镜共同使用,利用碱基互补配对原则来进行靶标microrna的标定检测。取直径1.5cm的4片细胞涂片(使用肝癌细胞系hepg2,待细胞长满整个涂片面积的80%后,使用体积分数为4%的多聚甲醛固定液固定30分钟,再使用体积分数为0.1%的透化剂triton x-100透化15分钟,全部过程在冰浴条件下进行),取制备步骤(3)中制备得到的四种不同的标记探针各100μl,将4种microrna荧光原
位杂交定量标记探针分别滴在细胞涂片之上,滴加标记探针后需在37℃避光条件下孵育30分钟后,随后使用流动的0.01m的pbs溶液分别漂洗细胞涂片以除去未相连的标记探针(本步骤pbs溶液不能重复使用),漂洗后用中性树脂封固细胞涂片。随后将得到的细胞涂片用共聚焦显微镜观察,激发光源波段选择378nm,456nm,541nm和460nm商用染料波段进行激发,使用四种不同的microrna荧光原位杂交定量标记探针单独标记检测细胞涂片中的靶标microrna。
[0046]
附图1是microrna荧光原位杂交定量标记探针修饰前后的透射电镜照片。a)修饰前的半导体聚合物点,b)修饰后探针的透射电镜照片;如图所示,探针形貌都呈现出球形,探针的直径为20-30nm。
[0047]
附图2是microrna荧光原位杂交定量标记探针的动态光散射(dls)粒径分布及电位分布图。a)修饰靶标microrna特异性反义互补序列后的pfo pdots探针粒径分布图,b)修饰靶标microrna特异性反义互补序列后的pfo pdots探针表面电位分布图。如图所示,所制备的纳米标记探针的直径分布在20nm到30nm的范围内,其中直径为25nm的分布比例最大。探针的直径具有一定的分布是与半导体聚合物的分子量的具有一定分布相关的。每个半导体聚合物点是半导体聚合物链在亲水的环境中卷曲形成的,当半导体聚合物链长不一致的时候,链长较长和链长较短的部分,形成的纳米粒子的直径是具有一定分布的。探针的电位为-28mv,证明探针具有良好的水相稳定性。
[0048]
附图3和附图4是四种基于半导体聚合物点的microrna荧光原位杂交定量标记探针的吸收、发射光谱图。如图所示,本发明实施例中所使用的4种聚合物量子点的发射光谱,对于pfo、pfbt、pfdtbt和nir pdots,它们各自的吸收峰分别为378nm,456nm,541nm和460nm。当microrna荧光原位杂交定量标记探针激发后,采用共聚焦显微镜接收443nm、550nm、702nm和775nm发射强度信号比值,或在双光子共聚焦显微镜和数字图像处理应用下蓝黄红绿通道发射强度比来准确测量四种不同的特异性mirna的表达水平。
[0049]
附图5是四种探针分别对肝癌细胞系hepg2的染色照片。图6是不含有mirna反义序列的pdots分别对hepg2细胞的染色照片。可见没有修饰mirna反义序列的pdots是不能对hepg2染色的。
[0050]
实施例2:
[0051]
参照实施例1的制备方法得到4种(pfo pdos标定hsa-microrna-1292-5p、pfbt pdos标定hsa-microrna-1301-3p、pfdtbt pdos标定hsa-microrna-3614-5p和nir pdos标定hsa-microrna-5589-3p)基于半导体聚合物点的microrna荧光原位杂交定量标记探针。多重靶标microrna标记时,应尽量使不同种类的半导体聚合物点的粒径分布和表面电位处于近似的水平。我们在制备4种半导体聚合物点时,要保持制备条件一致,包括半导体聚合物和功能聚合物的四氢呋喃溶液的浓度和体积,注入depc水的体积,超声时间,加热去除四氢呋喃时温度和时间等。这样得到的半导体聚合物点的粒径分布和表面电位可以处于近似水平。以下再经历与实施例1步骤相同的靶标rna特异性反义互补序列修饰的过程,得到microrna荧光原位杂交定量标记探针。
[0052]
实施例2性能测试
[0053]
对于实施例2采用了与实施例1相同的测试方法。不同的是在标记检测成像时选用四种(pfo pdots、pfbt pdots、pfdtbt pdots和nir pdots)microrna荧光原位杂交定量标
transfer,fret)模型。首先,基于实施例1的制备流程,我们制备了针对靶标microrna(hsa-mir-1292-5p)敏感的标记探针(pfo pdots-anti)。然后,根据hsa-mir-1292-5p的参考序列,我们将microrna序列中的所有u碱基替换为t碱基,并直接使用商业化碱基侧链标记染料cy3dt标记的t碱基在体外合成靶标microrna(hsa-mir-1292-5p)参考序列。同时,进一步测试本发明所设计的microrna荧光原位杂交定量标记探针的特异性。我们设计了一组针对靶标microrna(hsa-mir-1292-5p)参考序列的突变序列,具体设计如下:每五个碱基突变一次,突变碱基位点无法与靶标microrna特异性反义互补序列中的相应碱基配对。t碱基侧链上的标记染料cy3dt的光学特性遵循最大激发波长552nm;最大发射波长为570nm。基于互补碱基配对的原理,如果cy3dt标记的碱基序列可以与标记探针上的特定反义序列结合,半导体聚合物点(pfo pdots)的激发能量可以传递给cy3dt,反之则不行。随后,我们对443nm和570nm的荧光强度峰进行了靶标microrna浓度相关拟合(拟合线性方程图),以测试本发明中所设计的标记纳米探针的灵敏度和特异性。
[0063]
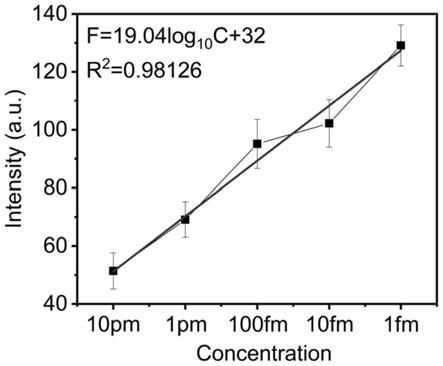
图10:实施例3中基于半导体聚合物点(pfo pdots)的microrna荧光原位杂交定量标记探针靶标microrna(hsa-microrna-1292-5p)敏感性测试荧光光谱图。基于互补碱基配对原理,cy3dt标记的靶标microrna参考序列可以与pfo pdots上的特定反义序列结合,可由半导体聚合物点(pfo pdots)-特异性反义互补序列-cy3dt标记的参考序列形成三明治结构,半导体聚合物点(pfo pdots)和cy3dt的毗邻可使得共振能量从前者到后者进行有效的传递。半导体聚合物点(pfo pdots)在443nm处的峰值表明荧光强度逐渐降低,而cy3dt荧光强度在570nm处增加。总体趋势呈现出cy3dt标记靶标microrna参考序列的浓度依赖性,表明本发明所设计的microrna荧光原位杂交定量标记探针具有优异的靶标microrna特异性,且检测极限在1fm。
[0064]
图11和图12:实施例3中基于图10中半导体聚合物点(pfo pdots)443nm和570nm处峰值与靶标microrna浓度间的拟合线性方程图。结果表明本发明所设计的microrna荧光原位杂交定量标记探针标对靶标microrna(hsa-micror-1292-5p)具有良好的线性相关性,回归方程为(443nm):f=19.04log
10
c 32(r2=0.98126)(图11)和570nm:f=-2.59log
10 c 17.32(r2=0.98449)(图12)。图11中的“c”代表cy3dt标记的参考序列浓度,“f”代表半导体聚合物点(pfo pdots)的荧光强度;图12中的“c”代表cy3dt标记的参考序列浓度,“f”代表cy3dt的荧光强度。
[0065]
实施例4:
[0066]
如同实施例2的各步操作,不同的是细胞涂片更换为来源于肝细胞肝癌的超薄组织切片(厚度为5μm/片,组织切片尺寸约为2cm*2cm),将制得的半导体聚合物点depc水溶液再次用depc水稀释至50ppm。将修饰有microrna特异性反义互补序列的pfo pdots(靶标mircorna:hsa-micror-1292-5p)、pfbt pdots(靶标mircorna:hsa-micror-1301-3p)、pfdtb pdots(靶标mircorna:hsa-micror-3614-5p)和nir pdots(靶标mircorna:hsa-micror-5589-3p)的荧光标记探针各取100μl,共计400μl,置于摇床(300转/分钟)4℃条件下混合0.5小时。随后使用上述步骤制备得到的microrna荧光原位杂交定量标记探针混悬液对肝细胞肝癌超薄组织切片(需经过体积分数4%多聚甲醛固定30分钟,后经体积分数0.1%透化剂透化15分钟,以上全部过程在冰浴条件下进行)进行标记。37℃条件下避光孵育30分钟后,用流动的0.01m的pbs溶液小心漂洗以除去未相连的探针,漂洗后用中性树脂
封固组织涂片。利用共聚焦显微镜进行图像信息采集(信号接收探头接收波段选定为:pfo pdots:400-500nm、pfbt pdots:501-600nm、pfbt pdots:601-720nm和nir pdots:721-780nm),经处理后将得到的靶标microrna的定量标记信息。
[0067]
实施例4性能测试
[0068]
对于实施例4采用了与实施例1和实施例2相同的测试方法。不同的是在标记检测成像时选用肝细胞肝癌超薄组织切片作为标记底物,采用四种不同的microrna荧光原位杂交定量标记探针(修饰不同的靶标microrna特异性反义互补序列的microrna荧光原位杂交定量标记探针)共同标记检测。
[0069]
例如肝细胞肝癌病理分级特异性rna进行标记,其中靶标mircorna:hsa-microrna-1292-5p和hsa-microrna-1301-3p为高病理分级特异性,而靶标mircorna:hsa-microrna-3614-5p和hsa-microrna-5589-3p为低病理分级特异性,下表1提供了这四种不同的靶标mircorna的参考序列,本实施例中半导体聚合物点上所修饰的特异性反义互补序列均参考下表进行体外合成。
[0070]
表1:四种不同的靶标mircorna的参考序列
[0071]
microrna名称核苷酸序列hsa-microrna-1292-5p5'-uggga acggg uuccg gcaga cgcug-3'hsa-microrna-1301-3p5'-uugca gcugc cuggg aguga cuuc-3'hsa-microrna-3614-5p5'-ccacu uggau cugaa ggcug ccc-3'hsa-microrna-5589-3p5'-ugcac auggc aaccu agcuc cca-3'
[0072]
图13:实施例4中肝细胞肝癌组织超薄切片的共聚焦显微镜成像示意图,细胞来源为病理分级i级,肿瘤特异性microrna标记半导体聚合物点(pfo pdots、pfbt pdots)标记数量较少,正常细胞特异性microrna标记半导体聚合物点(pfdtbt pdots、nir pdots)标记数量多。
[0073]
图14:实施例4中肝细胞肝癌组织超薄切片的共聚焦显微镜成像示意图,细胞来源为病理分级ii级,肿瘤特异性microrna标记半导体聚合物点(pfo pdots、pfbt pdots)标记数量较中等,正常细胞特异性microrna标记半导体聚合物点(pfdtbt pdots、nir pdots)标记数量中等。
[0074]
图15:实施例4中肝细胞肝癌组织超薄切片的共聚焦显微镜成像示意图,细胞来源为病理分级iii级,肿瘤特异性microrna标记半导体聚合物点(pfo pdots、pfbt pdots)标记数量较较多,正常细胞特异性microrna标记半导体聚合物点(pfdtbt pdots、nir pdots s)标记数量较少。
[0075]
图16:实施例4中肝细胞肝癌组织超薄切片的共聚焦显微镜成像图,a)病理分级i级-亮橙色,b)病理分级ii级-浅紫色,c)病理分级iii级-蓝紫色。当采用四种探针共同标记时,四种探针是具有靶标microrna特异性的,其标记数量与其对应的靶标microrna的数量是一致的。由于不同病理分级背景下的肝细胞肝癌组织内各种靶标microrna的表达的数量是不同的,所以得到的成像照片会展示出不同的颜色。结果表明本发明所设计的microrna荧光原位杂交定量标记探针具有优异的成像分辨率,具有广泛的生物医学成像潜质,和临床检测应用价值。
[0076]
实施例5:
[0077]
如同实施例4的各步操作,不同的是将肝细胞肝癌的超薄组织切片更换为来源为胃腺癌的超薄组织切片(厚度为5μm/片,组织切片尺寸约为4cm*4cm cm,因胃腺癌起源于腺体-结缔组织,染色时需充分延展):将制得的半导体聚合物点水溶液用depc水稀释至50ppm。参照实施例4,取100μl稀释后的半导体聚合物点pfo pdots的epc水溶液,对其修饰hsa-mir-3923特异性反义互补序列,得到特异性的microrna荧光原位杂交定量标记探针。随后使用上述步骤制备得到的microrna荧光原位杂交定量标记探针悬液对胃腺癌的超薄组织切片(需经过体积分数4%多聚甲醛固定30分钟,后经体积分数0.1%透化剂triton x100透化15分钟,全部过程在冰浴条件下进行孵育)进行标记。组织切片尺寸约为4cm*4cm(消化道黏膜皱襞需完全延展),37℃下孵育30分钟后(消化道黏膜皱襞染色后会发生卷曲,染色后需再次使用平镊使其完全延展),再用流动的0.01m的pbs溶液小心漂洗以除去未相连的探针。利用共聚焦显微镜接收图像信息,经处理后将得到的靶标rna的定量标记信息。结合实施例4和实施例5的结果表明本发明所设计的microrna荧光原位杂交定量标记探针不仅可以对实体组织(例如肝脏等)具有良好的靶标microrna的标记检测和成像能力,还可以对结缔组织、间充质、组织间液等其内含有靶标microrna的生物样本,具有良好的标记检测能力。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。