生产2
’-
岩藻糖基乳糖的重组枯草芽孢杆菌及其构建方法和应用
技术领域
1.本发明属于枯草芽孢杆菌重组菌株构建技术领域,具体涉及一种生产2
’-
岩藻糖基乳糖的重组枯草芽孢杆菌及其构建方法和应用。
背景技术:
2.母乳对于婴幼儿的生长发育和健康至关重要,而母乳中的母乳寡糖(human milk oligosaccharides,hmos)在其中起到关键的作用,它们的生理功能包括抑制病原菌生长,促进益生菌生长,促进婴幼儿免疫系统的发育,促进婴幼儿大脑发育,保护呼吸系统及泌尿系统,预防过敏性疾病,等等。2
’-
岩藻糖基乳糖(2
’-
fucosyllactose,2
’-
fl)是其中含量最为丰富的一种三糖分子,可用于添加到母乳替代品中缩小其与母乳的功能差距,兼具医学和营养学价值。
[0003]2’-
fl可以通过在人乳中分离出来,也可以通过化学手段合成,但这两种方法成本较高。近年来有文献报道可以通过代谢工程和发酵工程技术,利用微生物生产2
’-
fl,极具工业化的潜力。在生物体内,2
’-
fl可以以gdp-l-岩藻糖和乳糖为底物,在α1,2-岩藻糖基转移酶(α1,2-fucosyltransferase)的催化下合成。所以,代谢工程的工作集中在构建或优化gdp-l-岩藻糖的合成途径,乳糖转运途径的优化及消耗途径的敲除,以及筛选表达特异高效的α1,2-岩藻糖基转移酶基因。其中,在微生物体内gdp-l-岩藻糖的合成可以通过两种途径实现,一种是从头合成途径,主要包括果糖-6-磷酸经由5个酶促反应催化生成gdp-l-岩藻糖,这个途径在培养基中添加廉价的碳源,如甘油、葡萄糖等。另一种是补救合成途径,可以由岩藻糖经2个酶促反应催化生成gdp-l-岩藻糖,这个途径需要往培养基中添加相对昂贵的岩藻糖作为底物。
[0004]
目前,在大肠杆菌、酿酒酵母和谷氨酸棒状杆菌中已成功实现2
’-
fl的合成。作为gras(generally regarded as safe)菌种,枯草芽孢杆菌不产致热源、内毒素,无毒副作用,可以减轻后续的分离纯化成本,天然适合用来表达生产人乳寡糖。目前还没有实现利用枯草芽孢杆菌进行2
’-
fl从头合成的技术或报道。
技术实现要素:
[0005]
本发明的目的是,提供一种生产2
’-
岩藻糖基乳糖的重组枯草芽孢杆菌及其构建方法和应用;提供一种利用枯草芽孢杆菌进行2
’-
fl从头合成的技术方案。
[0006]
本发明为实现上述目的所采用的技术方案如下:
[0007]
生产2
’-
岩藻糖基乳糖的重组枯草芽孢杆菌为:重组枯草芽孢杆菌164fl、重组枯草芽孢杆菌164fl-fcoa2、重组枯草芽孢杆菌164fl-fcoa1;
[0008]
所述重组枯草芽孢杆菌164fl通过在枯草芽孢杆菌的mana位点整合编码果糖6-磷酸异构酶、磷酸甘露糖变位酶、甘露糖-1-磷酸鸟苷基转移酶的融合基因片段,以及在xyla-xylb位点整合编码gdp-甘露糖脱水酶、gdp-l-岩藻糖合成酶、α-1,2岩藻糖基转移酶的融合
基因片段获得;
[0009]
所述重组枯草芽孢杆菌164fl-fcoa2通过在重组枯草芽孢杆菌164fl的fcoa2位点整合编码乳糖渗透酶的基因片段获得;
[0010]
所述重组枯草芽孢杆菌164fl-fcoa1通过在重组枯草芽孢杆菌164fl的fcoa1位点整合编码乳糖渗透酶的基因片段获得。
[0011]
作为优选实施方案,所述编码果糖6-磷酸异构酶、磷酸甘露糖变位酶、甘露糖-1-磷酸鸟苷基转移酶的融合基因片段是seq id no:1所示的序列,或者是与seq id no:1具有85%以上同源性且具有相同功能的序列;所述编码gdp-甘露糖脱水酶、gdp-l-岩藻糖合成酶、α-1,2岩藻糖基转移酶的融合基因片段是seq id no:2所示的序列,或者是与seq id no:2具有85%以上同源性且具有相同功能的序列。
[0012]
作为优选实施方案,所述在重组枯草芽孢杆菌164fl的fcoa2位点整合的编码乳糖渗透酶的基因片段是seq id no:3所示的序列或者与seq id no:3具有85%以上同源性且具有相同功能的序列;在重组枯草芽孢杆菌164fl的fcoa1位点整合的编码乳糖渗透酶的基因片段是seq id no:4所示的序列或者与seq id no:4具有85%以上同源性且具有相同功能的序列。
[0013]
作为优选实施方案,所述枯草芽孢杆菌为枯草芽孢杆菌atcc 6051a。
[0014]
本发明还提供生产2
’-
岩藻糖基乳糖的重组枯草芽孢杆菌的构建方法,包括如下步骤:
[0015]
步骤1,在枯草芽孢杆菌的基因组mana位点整合编码果糖6-磷酸异构酶、磷酸甘露糖变位酶、甘露糖-1-磷酸鸟苷基转移酶的基因序列;消除抗性基因后,在xyla-xylb位点整合编码gdp-甘露糖脱水酶、gdp-l-岩藻糖合成酶、α-1,2岩藻糖基转移酶的基因序列,得到重组枯草芽孢杆菌164fl;
[0016]
步骤2,将编码大肠杆菌bl21乳糖渗透酶的lacy基因整合到重组枯草芽孢杆菌164fl的fcoa2位点上,得到重组枯草芽孢杆菌为164fl-fcoa2;
[0017]
步骤3,将编码大肠杆菌bl21乳糖渗透酶的lacy基因整合到重组枯草芽孢杆菌164fl的fcoa1位点上,得到重组枯草芽孢杆菌为164fl-fcoa1。
[0018]
作为优选实施方案,所述步骤1中的枯草芽孢杆菌为枯草芽孢杆菌atcc6051a;所述编码果糖6-磷酸异构酶、磷酸甘露糖变位酶、甘露糖-1-磷酸鸟苷基转移酶的基因序列如seq id no:1所示,所述编码gdp-甘露糖脱水酶、gdp-l-岩藻糖合成酶、α-1,2岩藻糖基转移酶的基因序列如seq id no:2所示。
[0019]
作为优选实施方案,所述步骤2中编码乳糖渗透酶的lacy基因序列如seq id no:3所示;所述步骤3中编码乳糖渗透酶的lacy基因序列如seq id no:4所示。
[0020]
本发明还提供了所述生产2
’-
岩藻糖基乳糖的重组枯草芽孢杆菌的应用,使用所述重组枯草芽孢杆菌164fl、164fl-fcoa2、164fl-fcoa1发酵生成2
’-
岩藻糖基乳糖。
[0021]
作为优选实施方案,所述重组枯草芽孢杆菌164fl、164fl-fcoa2、164fl-fcoa1发酵生成2
’-
岩藻糖基乳糖的碳源选自甘油、葡萄糖、蔗糖、甘蔗糖蜜或果糖。
[0022]
作为优选实施方案,所述重组枯草芽孢杆菌164fl、164fl-fcoa2、164fl-fcoa1发酵生成2
’-
岩藻糖基乳糖的培养基中包含18-22g/l的乳糖和24-26g/l的甘油。
[0023]
与现有的技术相比,本发明的有益效果为:
[0024]
1,本发明技术方案通过培养重组枯草芽孢杆菌,利用比较廉价的碳源生产2
’-
fl,能够减轻后续的分离纯化成本。
[0025]
2,在摇瓶发酵实验中,2
’-
fl发酵产量达到5.5g/l,补料发酵2
’-
fl产量达到27.8g/l。该技术在人乳寡糖的生产、食品药物开发等方面具有非常好的应用前景。
[0026]
3,与国外2
’-
fl的主流生产菌株大肠杆菌相比,本发明的生产菌株枯草芽孢杆菌为食品安全菌株,产品不会受内毒素污染,更适合奶粉配方原料的生产。
附图说明
[0027]
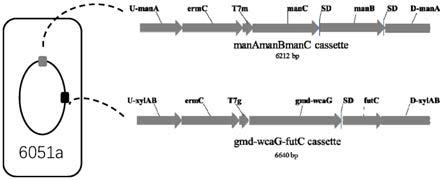
图1为本发明实施例1中重组枯草芽孢杆菌164fl的构建示意图。
[0028]
图2为本发明实施例4中重组枯草芽孢杆菌164fl、164fl-fcoa2、164fl-fcoa1摇瓶发酵生产2
’-
fl的结果示意图。
[0029]
图3为本发明实施例4中重组枯草芽孢杆菌164fl-fcoa1补料发酵生产2
’-
fl时产物随时间变化的结果示意图。
具体实施方式
[0030]
下面结合实施例对本发明的技术方案进行详细说明。实施例中未注明具体条件的操作,按照常规条件或制造商建议的条件进行。以下采用的试剂和生物材料如未特别说明,均为商业化产品。
[0031]
以下各实施例中使用的生物材料来源如下:
[0032]
枯草芽孢杆菌atcc 6051a为美国模式培养物收藏库(american type culture collection)的模式菌株,6051a为其收藏号,可从美国atcc保藏中心购买获得。
[0033]
大肠杆菌bl21(de3)为常用大肠杆菌实验菌株,可直接购买获得。
[0034]
puc57-futc为生工生物工程(上海)股份有限公司合成的futc片段连接在puc57载体上。
[0035]
各实施例中使用的2
×
phanta master mix(货号p511-01)购自南京诺唯赞生物科技有限公司;限制性内切酶quickcut
tm dpn i(货号1609)购自takara;红霉素(货号e808819)、氯霉素(货号c804169)和d-木糖(货号d856756)购自上海麦克林生化科技有限公司,2
’-
fl标准品购自上海惠诚生物科技有限公司。
[0036]
实施例中的缩写符号说明:
[0037]
mana:果糖6-磷酸异构酶
[0038]
manb:磷酸甘露糖变位酶
[0039]
manc:甘露糖-1-磷酸鸟苷基转移酶
[0040]
gmd:gdp-甘露糖脱水酶
[0041]
wcag:gdp-l-岩藻糖合成酶
[0042]
futc:α-1,2岩藻糖基转移酶
[0043]
实施例1:重组枯草芽孢杆菌164fl的构建
[0044]
重组枯草芽孢杆菌164fl是在枯草芽孢杆菌atcc 6051a的基因组上整合了两段dna序列,即在mana位点整合了mana-manb-manc cassette(seq id no:1),消除红霉素抗性基因后,在xyla-xylb位点整合了gmd-wcag-futc cassette(seq id no:2),参见图1,为重
组枯草芽孢杆菌164fl的构建示意图。重组枯草芽孢杆菌164fl的具体构建方法如下:
[0045]
首先制备线性dna片断mana-manb-manc,由6个片段经过融合pcr获得,这6个片段分别是u-mana、ermc、t7m、manb、manc和d-mana。以枯草芽孢杆菌atcc 6061a基因组为模板,扩增u-mana和d-mana;以大肠杆菌bl21(de3)为模板,扩增manb和manc;以合成的抗性基因dna片断ermc为模板,扩增ermc;以通过的大肠杆菌表达质粒pet28a为模板,扩增t7m。其中,扩增u-mana的f端引物序列(seq id no:5):5
’-
gcgacgtttttgaaaaagaaaattcag-3’;扩增u-mana的r端引物序列(seq id no:6):5
’-
cctgcttctttttaggatccaggaaaatcccccgctttattcgttc-3’;扩增ermc的f端引物序列(seq id no:7):5
’-
gaaatcgaataaagcgggattttcctgcagggcctaaaaagaagcagg-3’;扩增ermc的r端引物序列(seq id no:8):5
’-
ccgatggggaagatccgccacgaattcggtacccccgcatatgtac-3’;扩增t7m的f端引物序列(seq id no:9):5
’-
gtacatatgcccggggccgaattcgtgggcccgatcttccccatcgg-3’;扩增t7m的r端引物序列(seq id no:10):5
’-
ctggatagagtttcgactgcatggtatatctcctttcttaaagttaaac-3’;扩增manc的f端引物序列(seq id no:11):5
’-
gtttaactttaagaaaggaggataatggccagtcgaaactctatccag-3’;扩增manc的r端引物序列(seq id no:12):5
’-
ttaaagcaggttaattttttcatagtagttcctccttaccgtagcgatccgc-3’;扩增manb的f端引物序列(seq id no:13):5
’-
gcggatcgctacggacgggtgtaaggactatgaaaaaattaacctgctttaa-3’;扩增manb的r端引物序列(seq id no:14):5
’-
aaaaagttcagtcgtcatagtagttcctccttgttccaacgtcagcag-3’;扩增d-mana的f端引物序列(seq id no:15):5
’-
ctgctgacgttgctgaacgagtaagactactatgacgacccgttattttt-3’;扩增d-mana的r端引物序列(seq id no:16):5
’-
ttacgggagacgatacattctgc-3’。
[0046]
使用2
×
phanta master mix扩增上述6个dna片段,pcr配置体系为25μl 2
×
phanta master mix,2.5μl f端引物(10μm),2.5μl r端引物(10μm),0.5μl模板,19.5μl ddh2o。pcr反应条件为预变性95℃5min,然后变性95℃15s,退火55℃15s,延伸72℃x min(因为酶的延伸效率为2kb/min,所以x为所扩增片段长度kb除以2),循环数30。上述pcr产物使用quickcut
tm dpn i进行消模板处理,操作方法参照商品说明书,然后用axyprep pcr清洁试剂盒进行纯化回收,回收方法按说明书操作,使用nanodrop测定dna片段的浓度。
[0047]
使用融合pcr的方法将上述6个片段融合,融合pcr的方法如下:
[0048]
pcr反应配置体系为10μl 2
×
phanta master mix,6个片段各200ng,添加ddh2o至体系为20μl。进行第一轮pcr反应,pcr反应条件为预变性95℃5min,然后变性95℃15s,退火60℃15s,延伸72℃3min,循环数10;再进行二轮融合pcr,反应配置体系为25μl 2
×
phanta master mix,2.5μl u-mana的f端引物(10μm),2.5μl d-mana的r端引物(10μm),1μl第一轮pcr反应产物,19μl ddh2o。pcr反应条件为预变性95℃5min,然后变性95℃15s,退火55℃15s,延伸72℃3min,循环数30,从而获得融合片段mana-manb-manc。
[0049]
再将获得的mana-manb-manc转化到枯草芽孢杆菌atcc 6051a中,并均匀涂在含有10μg/ml红霉素抗性平板上,置于37℃恒温箱培养过夜。通过菌落pcr鉴定所长出的转化子,阳性转化子为mana-manb-manc cassette整合到枯草芽孢杆菌atcc 6051a的基因组上的菌落。以所挑取的阳性转化子菌株为模板,用2
×
phanta master mix扩增整合的片段,pcr产物送到生工生物工程(上海)股份有限公司测序。对测序结果经比对无误的转化子命名为枯草芽孢杆菌164m。
[0050]
然后再进行线性片断gmd-wcag-futc的制备,它主要由6个片段经过融合pcr获得,
分别是u-xylab、ermc、t7g、gmd-wcag、futc和d-xylab。分别以枯草芽孢杆菌atcc 6061a基因组为模板,扩增u-xylab和d-xylab;以大肠杆菌bl21(de3)为模板,扩增gmd-wcag;以人工合成的dna片断为模板,扩增ermc;以常用质粒pet28a为模板,扩增t7g,以futc的人工合成dna片断为模板,扩增futc。pcr扩增的引物序列如下:扩增u-xylab的f端引物序列(seq id no:17):5
’-
gcatcctcggtttccgcaactgcatttagg-3’;扩增u-xylab的r端引物序列(seq id no:18):5
’-
cctgcttctttttaggatccctgcaggtttcccccttaaaaataaattc-3’;扩增ermc的f端引物序列(seq id no:19):5
’-
gaatttatttttaagggaaatcacctgcagtcctaaaaagaagcagg-3’;扩增ermc的r端引物序列(seq id no:20):5
’-
ccgatggggtcgggctcgccacgaattcggtacccccgggcatatgtac-3’;扩增t7g的f端引物序列(seq id no:21):5
’-
gtacatatgccgggtaccgttcgtggcgagcccgatcttccccatcgg-3’;扩增t7g的r端引物序列(seq id no:22):5
’-
ccggtatgagagcgacttttgggtatatcctcctttcttaaagttaaac-3’;扩增gmd-wcag的f端引物序列(seq id no:23):5
’-
gtttaacttaaaggaggatataccatgtcaaaagtcgctctcatcaccgg-3’;扩增gmd-wcag的r端引物序列(seq id no:24):5
’-
ctttgaaagccatagttcctccttacccccgaaagcggtcttgattc-3’;扩增futc的f端引物序列(seq id no:25):5
’-
gaatcaagaccgctttcggggtaggaactactatggctttcaaag-3’;扩增futc的r端引物序列(seq id no:26):5
’-
gttcttcggttgatctccagacaataacatcaagcgttgtatttctgagatttaac-3’;扩增d-xylab的f端引物序列(seq id no:27):5
’-
gttaaatctcagaaatacaacgcttaatgatgttatctggagatcaaccgaagaac-3’;扩增d-xb的r端引物序列(seq id no:28):5
’-
gtatgatcgcatttaagtattac-3’。使用2
×
phanta master mix扩增上述6个dna片段,pcr配置体系为25μl 2
×
phanta master mix,2.5μl f端引物(10μm),2.5μl r端引物(10μm),0.5μl模板,19.5μl ddh2o。pcr反应条件为预变性95℃5min,然后变性95℃15s,退火55℃15s,延伸72℃x min(因为酶的延伸效率为2kb/min,所以x为所扩增片段长度kb除以2),循环数30。上述pcr产物使用quickcut
tm dpn i进行消模板处理,操作方法参照商品说明书,然后用axyprep pcr清洁试剂盒进行纯化回收,回收方法按说明书操作,使用nanodrop测定dna片段的浓度。再利用融合pcr的方法将上述6个片段融合,融合pcr的方法如下:首轮pcr反应配置体系为10μl 2
×
phanta master mix,6个片段各200ng,添加ddh2o至体系为20μl。进行第一轮pcr反应,pcr反应条件为预变性95℃5min,然后变性95℃15s,退火60℃15s,延伸72℃3min,循环数10。二轮pcr中,反应配置体系为25μl 2
×
phanta master mix,2.5μl u-xylab的f端引物(10μm),2.5μl d-xylab的r端引物(10μm),1μl第一轮pcr反应产物,19μl ddh2o。pcr反应条件为预变性95℃5min,然后变性95℃15s,退火55℃15s,延伸72℃3min,循环数30,从而获得融合片段gmd-wcag-futc。
[0051]
获得的gmd-wcag-futc转化到164m后,即可完成枯草芽孢杆菌164fl的构建,主要步骤如下:将gmd-wcag-futc转化164m中,均匀涂在含有10μg/ml红霉素抗性平板上,置于37℃恒温箱培养过夜;通过菌落pcr鉴定所长出的转化子;以所挑取的阳性转化子菌株为模板,用2
×
phanta master mix扩增整合的片段,pcr产物送到生工生物工程(上海)股份有限公司测序。对测序结果经比对无误的菌株命名为重组枯草芽孢杆菌164fl。
[0052]
实施例2:重组枯草芽孢杆菌164fl-fcoa2的构建
[0053]
重组枯草芽孢杆菌164fl-fcoa2是在枯草芽孢杆菌164fl的基础上,将编码大肠杆菌bl21(de3)乳糖渗透酶的lacy(seq id no:3)整合到164fl的fcoa2位点。重组枯草芽孢杆菌164fl-fcoa2的构建的具体操作如下:
[0054]
首先构建fcoa2-pxyla-lacy,它由5个片断(u-fcoa2、cmg、pxyla、lacyg和d-fcoa2)构成。u-fcoa2和d-fcoa2分别以枯草芽孢杆菌atcc6061a基因组为模板扩增而来;lacyg以大肠杆菌bl21(de3)为模板;pxyla和cmg由人工合成片断为模板扩增。其中,pcr扩增的引物序列如下:扩增u-fcoa2的f端引物序列(seq id no:29):5
’-
gtatttccatgcccaccatc-3’;扩增u-fcoa2的r端引物序列(seq id no:30):5
’-
caactttttttattgtctttgtgaaagctgatgctccgctcgatatgggcg-3’;扩增cmg的f端引物序列(seq id no:31):5
’-
cgcccatatcgagcgcatcagctttcacaaactatgacaataaaaaaagttg-3’;扩增cmg的r端引物序列(seq id no:32):5
’-
gttataatattagattctagtcttcttcaactaacggggcaggttag-3’;扩增pxyla的f端引物序列(seq id no:33):5
’-
ctaacctgccccgttagttgaagaagaattctatctaatattataac-3’;扩增pxyla的r端引物序列(seq id no:34):5
’-
agtttgtgttttttaaatagtatttttattcctccttgtcgggttgatttaag-3’;扩增lacyg的f端引物序列(seq id no:35):5
’-
cttaaatcaacccgggaacaaggaggaataaaaattatttaaaaaacacaaact-3’;扩增lacyg的r端引物序列(seq id no:36):5
’-
gctaagagaacaaggaggagaatgtgttacttcattcacctgacgac-3’;扩增d-fcoa2的f端引物序列(seq id no:37):5
’-
gtcgtcaaatgaagtcgcttaacacattctcctccttgttctcttagc-3’;扩增d-fcoa2的r端引物序列(seq id no:38):5
’-
gatttataaattgacaatgtccagc-3’。分别使用2
×
phanta master mix扩增上述5个dna片段,pcr配置体系为25μl 2
×
phanta master mix,2.5μl f端引物(10μm),2.5μl r端引物(10μm),0.5μl模板,19.5μl ddh2o。pcr反应条件为预变性95℃5min,然后变性95℃15s,退火55℃15s,延伸72℃x min(因为酶的延伸效率为2kb/min,所以x为所扩增片段长度kb除以2),循环数30。上述pcr产物使用quickcut
tm dpn i进行消模板处理,操作方法参照商品说明书,然后用axyprep pcr清洁试剂盒进行纯化回收,回收方法按说明书操作,使用nanodrop测定dna片段的浓度。
[0055]
再使用融合pcr的方法将上述5个片段融合,融合pcr的方法如下:首先运行首轮pcr,配置体系为10μl 2
×
phanta master mix,6个片段各200ng,添加ddh2o至体系为20μl。进行第一轮pcr反应,pcr反应条件为预变性95℃5min,然后变性95℃15s,退火60℃15s,延伸72℃2.5min,循环数10。再进行第二轮pcr反应,配置体系为25μl2
×
phanta master mix,2.5μl u-fcoa2的f端引物(10μm),2.5μl d-fcoa2的r端引物(10μm),1μl第一轮pcr反应产物,19μl ddh2o。pcr反应条件为预变性95℃5min,然后变性95℃15s,退火55℃15s,延伸72℃2.5min,循环数30。获得融合片段fcoa2-pxyla-lacy。
[0056]
得到的fcoa2-pxyla-lacy转化至164fl,过程如下:将pcr产物fcoa2-pxyla-lacy转化到实施例1构建的枯草芽孢杆菌164fl中,均匀涂在含有10μg/ml氯霉素抗性平板上,置于37℃恒温箱培养过夜。通过菌落pcr鉴定所长出的转化子,阳性转化子为fcoa2-pxyla-lacy cassette整合到枯草芽孢杆菌164fl的基因组上的菌落。以所挑取的阳性转化子菌株为模板,用2
×
phanta master mix扩增整合的片段,pcr产物送到生工生物工程(上海)股份有限公司测序。对测序结果经比对无误的菌株命名为重组枯草芽孢杆菌164fl-fcoa2。
[0057]
实施例3:重组枯草芽孢杆菌164fl-fcoa1的构建
[0058]
重组枯草芽孢杆菌164fl-fcoa1将乳糖渗透酶lacy整合到枯草芽孢杆菌164fl上,将一个dna片断(seq id no:4)整合到164fl的fcoa1位点。首先是制备线性dna fcoa1-pxyla-lacy,它是由5个片段经过融合pcr获得,这5个片段分别是u-fcoa1、cmy、pxyla、
lacyy和d-fcoa1。其中,u-fcoa1和d-fcoa1以枯草芽孢杆菌atcc 6061a基因组为模板扩增;lacyy以大肠杆菌bl21(de3)为模板;pxyla和cmy以人工合成的dna片断为模板。pcr扩增的引物序列如下。扩增u-fcoa1的f端引物序列(seq id no:39):5
’-
ctatacaacaatctcacccgcc-3’;扩增u-fcoa1的r端引物序列(seq id no:40):5
’-
ctttttttattgtcatagtttgtgaaacctttgatgatcgattctgtc-3’;扩增cmy的f端引物序列(seq id no:41):5
’-
gacagaatcgatcatcaaagaaaggtttcacaaactatgacaaaaaaag-3’;扩增cmy的r端引物序列(同cmg的r端引物seq id no:32):5
’-
gttataatattagattctagaattcttcttcaactaacggcaggttag-3’;扩增pxyla的f端引物序列(seq id no:33):5
’-
ctaacctgccccgttagttgaagaagaattctagaatctaatattataac-3’;扩增pxyla的r端引物序列(seq id no:34):5
’-
agtttgtgttaaatagtacattttttattcctccttgttcccgggttgatttaag-3’;扩增lacyy的f端引物序列(seq id no:35):5
’-
cttaaatccgggaacaaggaggaataaaaaatgtactatttaaaaaacacaaact-3’;扩增lacyy的r端引物序列(seq id no:42):5
’-
gaaatgattcgatacaaagaatcattaagcgacttcattcacctgacga-3’;扩增d-fcoa1的f端引物序列(seq id no:43):5
’-
tcgtcagatgaagtcgcttaatgattctttgtatcgaatcagcttttttc-3’;扩增d-fcoa1的r端引物序列(seq id no:44):5
’-
cttttccggtccgttgacaggctg-3’。再使用2
×
phanta master mix扩增上述5个dna片段,pcr配置体系为25μl 2
×
phanta master mix,2.5μl f端引物(10μm),2.5μl r端引物(10μm),0.5μl模板,19.5μl ddh2o。pcr反应条件为预变性95℃5min,然后变性95℃15s,退火55℃15s,延伸72℃x min(因为酶的延伸效率为2kb/min,x为所扩增片段长度kb除以2),循环数30。上述pcr产物使用quickcut
tm dpn i进行消模板处理,操作方法参照商品说明书,然后用axyprep pcr清洁试剂盒进行纯化回收,回收方法按说明书操作,使用nanodrop测定dna片段的浓度。再使用融合pcr的方法将上述5个片段融合,先进行首轮pcr反应,配置体系为10μl 2
×
phanta master mix,6个片段各200ng,添加ddh2o至体系为20μl。进行第一轮pcr反应,pcr反应条件为预变性95℃5min,然后变性95℃15s,退火60℃15s,延伸72℃2.5min,循环数10。再进行第二轮pcr反应,配置体系为25μl 2
×
phanta master mix,2.5μl u-fcoa1的f端引物(10μm),2.5μl d-fcoa1的r端引物(10μm),1μl第一轮pcr反应产物,19μl ddh2o。pcr反应条件为预变性95℃5min,然后变性95℃15s,退火55℃15s,延伸72℃2.5min,循环数30,从而得到融合片段fcoa1-pxyla-lacy。
[0059]
得到的fcoa1-pxyla-lacy片段转化至重组枯草芽孢杆菌164fl后,得到重组枯草芽孢杆菌164fl-fcoa1。过程如下:先将fcoa1-pxyla-lacy转化到实施例1构建的枯草芽孢杆菌164fl中,并均匀涂在含有10μg/ml氯霉素抗性平板上,置于37℃恒温箱培养过夜。通过菌落pcr鉴定所长出的转化子,以所挑取的阳性转化子菌株为模板,用2
×
phanta master mix扩增整合的片段,pcr产物送到生工生物工程(上海)股份有限公司测序。对测序结果经比对无误的菌株命名为重组枯草芽孢杆菌164fl-fcoa1。
[0060]
实施例4:重组枯草芽孢杆菌摇瓶发酵产2
’-
fl
[0061]
发酵培养基选择为lb培养基,组分为10g/l蛋白胨,5g/l酵母粉和10g/l nacl。将制备的重组枯草芽孢杆菌164fl、164fl-fcoa2或164fl-fcoa1分别在lb固体板上划线活化,然后挑取单菌落培养在装有3ml lb的试管,在37℃恒温振荡培养箱中200rpm过夜培养。取过夜培养物0.5ml接种到装有50ml新鲜lb培养基的500ml摇瓶中,继续在37℃恒温振荡培养箱中200rpm培养。待细胞长到od600 0.8~1.0(4h左右),添加终浓度1%(m/v)的木糖诱导。
在细胞生长12h后,添加不同浓度的乳糖和碳源(甘油、葡萄糖、蔗糖、甘蔗糖蜜或果糖等)。然后每隔12h取样检测细胞生长状况,同时通过液相检测2
’-
fl生产情况。方法如下:使用岛津hplc设备,型号为20avp,使用aminex hpx-87h column(300
×
7.8mm)(bio-rad,usa)柱子,流动相5mm h2so4,流速控制为0.6ml/min,柱子温度控制为65℃,为开启视差检测器(型号rid-10a)进行检测。
[0062]
摇瓶发酵结果显示,以甘油为碳源时164fl能生产2
’-
fl,产量为120mg/l。在fcoa2位点敲入lacy,所构建的164fl-fcoa2可以使产量提高26.06倍,而在fcoa1位点敲入lacy,所构建的164fl-fcoa1可以使产量提高40.35倍。参见图2,为重组枯草芽孢杆菌164fl、164fl-fcoa2、164fl-fcoa1摇瓶发酵生产2
’-
fl的结果示意图。菌种164fl-fcoa1的碳源实验结果显示:使用甘油、葡萄糖、蔗糖、甘蔗糖蜜或果糖等都能产生2
’-
fl,甘油为最佳碳源。乳糖浓度实验确定乳糖最佳添加量为20g/l。摇瓶发酵实验结果,当使用碳源为甘油浓度为25g/l,乳糖浓度为20g/l时,164fl-fcoa1达到最大产量,为5.56g/l。
[0063]
实施例5:重组枯草芽孢杆菌补料发酵产2
’-
fl
[0064]
以164fl-fcoa1菌种为例补料发酵产2
’-
fl。首先是制备发酵的种子培养液。过程如下:首先将制备的重组枯草芽孢杆菌164fl-fcoa1在lb固体板上划线活化,然后挑取单菌落培养在装有3ml lb的试管,在37℃恒温振荡培养箱中200rpm过夜培养。取过夜培养物0.5ml接种到装有50ml新鲜lb培养基的500ml摇瓶中,继续在37℃恒温振荡培养箱中200rpm培养8h。将种子培养物接种到发酵培养基中,接种量为7.5%。发酵培养基的组分为:甘油25g/l、酵母粉5g/l、乳糖20g/l、蛋白胨30g/l、磷酸二氢钾12g/l、硫酸铵14g/l、六水合氯化镁3g/l、玉米浆10g/l以及消泡剂1g/l。5l发酵罐的装液量为3l,115℃灭菌20min使用。发酵初始ph为6.5。发酵控制参数为:通气量控制在5l/min,转速为700rpm,温度控制在37℃,发酵3h后加入终浓度1%的木糖;流加甘油和氨水控制发酵罐的ph在6.5左右。发酵过程中甘油控制》20%,乳糖控制》10%。定时取样,通过液相测定所生成2
’-
fl产量以及检测甘油和乳糖消耗情况。液相检测方法与实施例4中一致。参见图3,为重组枯草芽孢杆菌164fl-fcoa1补料发酵生产2
’-
fl时产物随时间变化的结果示意图。补料发酵结果显示,在培养过程中2
’-
fl产量一直在积累,并在发酵的144h达到最高产量,为27.8g/l。
[0065]
上述仅为本发明的部分优选实施例,本发明并不仅限于实施例的内容。对于本领域中的技术人员来说,在本发明技术方案的构思范围内可以有各种变化和更改,所作的任何变化和更改,均在本发明保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。