1.本发明涉及一种利用酒糟处理液培养裂殖壶菌的方法,属于微生物发酵生产领域。
背景技术:
2.白酒酒糟是白酒生产过程中的副产物,在白酒生产过程中主要消耗的是粮食中的淀粉,剩下的蛋白质和脂肪以及参与发酵的菌体蛋白都留在酒糟中,因此,酒糟中的粗蛋白和粗脂肪含量较高。直接将酒糟丢弃不仅是一种资源的浪费,而且也会造成环境污染。目前国内对白酒酒糟最普遍的处理方式是作为饲料原料,但因需对其进行干燥处理,不仅会造成效益低下等问题,还会消耗大量能源。
3.多不饱和脂肪酸(polyunsaturated fatty acid,pufa)是维持人体生理代谢的重要物质。其中dha一直以来就有“脑黄金”的美誉,是人体必不可缺的一种不饱和脂肪酸,对人体的神经系统发育、心血管维护、抗癌、抗炎等方面均有十分重要的功效。dha可促进婴儿大脑的发育和视网膜感光细胞的成熟;dha缺乏会导致新生儿智力发育的延滞和中枢神经系统代谢的紊乱。由于人体自身无法合成dha,孕妇需多食用富含dha的食物以满足婴幼儿大脑和中枢神经系统发育的需求。
4.传统上,dha多是从深海鱼油中获得。但会受到季节、气温等因素的影响,生产出的dha藻油品质不稳定;其次鱼油有难闻的鱼腥味,不容易接受。再次鱼油中易出现有害的有机物和重金属的积累。随着渔业资源的日益紧张,传统的dha资源已无法满足日益增长的市场需求。因此,开发dha的新生资源已成为新的研究热点。
5.裂殖壶菌(schizochytrium.sp),又称裂壶藻,是一种海洋真菌,属于网粘菌门、网粘菌纲、破囊壶菌目、破囊弧菌科、裂殖壶菌属、裂殖壶菌。裂殖壶菌菌体含油量极高,可达到干菌体的50%以上,且脂肪酸组成较为简单,其中dha可达到总脂肪酸35%以上。目前,裂殖壶菌发酵一般是以胰蛋白胨、酵母粉作为主要氮源,葡萄糖等糖类物质作为碳源,生产成本较高。例如,公开于蒋晓燕,裂殖壶菌schizochytrium sp.20888产dha培养条件优化论文当中,采用胰蛋白胨和酵母粉为氮源,制备得到的dha含量为总油脂含量的33.68%,但是胰蛋白胨和酵母粉作为氮源的成本较高,在工业生产中无法实现大规模应用。
6.因此,寻求一种高产量、低成本的裂殖壶菌的工业化发酵生产新工艺是本发明所面临的新课题。
技术实现要素:
7.为了解决现有技术当中存在的采用裂殖壶菌生产dha的成本高的问题,本发明提供了一种低成本、高产量的裂殖壶菌发酵生产dha的方法。
8.本发明提供了一种利用酒糟处理液培养裂殖壶菌的方法,以酒糟处理液替代胰蛋白胨作为低成本氮源发酵培养裂殖壶菌生产dha藻油,所述培养基为:将碳源50~100g/l,海水晶15~25g/l,谷氨酸钠10~30g/l,磷酸二氢钾1.5~5g/l,硫酸镁5~8g/l,硫酸钠8~
15g/l,氯化钙0.2~0.8g/l,vb
1 0.05~0.2g/l,vb
6 0.05~0.2g/l,vb
12 0.001~0.003g/l添加至含有酒糟处理液的水溶液中制备得到;
9.所述酒糟处理液的制备方法为:将白酒酒糟在水中浸泡后煮沸,过滤,制备得到酒糟处理液;所述碳源为葡萄糖、果糖、麦芽糖、木糖、甘油中的一种或多种。
10.在本发明的一种实施方式中,所述酒糟处理液在水溶液当中的比例为:40%~100%。
11.在本发明的一种实施方式中,所述酒糟处理液的制备方法为:
12.(1)除去新鲜酒糟水分,使其含水量为8~18%;
13.(2)向将步骤(1)得到的酒糟中添加水浸泡4~8h,得到酒糟溶液;其中酒糟和水的质量比为:(1:5)~(1:10);
14.(3)将步骤(2)得到的酒糟溶液加热至煮沸,并维持1~5min后进行过滤,得到滤液,将滤液离心后收集上清液,即为酒糟处理液。
15.在本发明的一种实施方式中,步骤(2)中,酒糟和水的质量比为1:10。
16.在本发明的一种实施方式中,步骤(2)中,向除去水分的酒糟中按照质量比为1:10的比例添加水,浸泡4小时,每一小时搅拌一次,然后倒入锅中加热并不断搅拌直至煮沸。
17.在本发明的一种实施方式中,步骤(3)中,将煮沸后的酒糟溶液用200目筛滤去残渣后,用离心机5000rpm离心3分钟,快速滤纸过滤制备得到酒糟处理液。
18.在本发明的一种实施方式中,所述酒糟,为酱香型白酒酒糟,是采用高粱与高温大曲以及谷壳经过九次蒸煮、八次发酵、七次取酒后留下来的固体废弃糟醅为原料进行米酿酒后剩余的残渣。
19.在本发明的一种实施方式中,维生素配成溶液后0.22μm膜过滤,使用时添加;葡萄糖配成500g/l母液单独灭菌,使用时添加。
20.本发明还提供了一种培养裂殖壶菌的方法,所述方法包括以下步骤:
21.(1)将活化后的单菌落接种至种子培养基中进行培养,制备得到种子液;
22.(2)将上述培养基的ph调节至5.5~8.0,制备得到发酵培养基,将步骤(1)制备得到的种子液添加至发酵培养基中进行发酵。
23.在本发明的一种实施方式中,所述种子液在发酵培养基中的添加量为:5%~15%(v/v)。
24.在本发明的一种实施方式中,所述菌株活化步骤为:吸取500μl保藏于-80℃冰箱的甘油管菌种于种子培养基中,28℃,200r
·
min-1
条件下培养2d,得到培养液;
25.将培养液稀释至od
540
为0.6~0.7,取100μl涂布于790by 固体培养基上,28℃培养箱培养4d,挑取长出的单菌落转接至斜面固体培养基上28℃培养箱培养4d。
26.在本发明的一种实施方式中,所述种子培养基为:葡萄糖30g/l,胰蛋白胨10g/l,酵母粉5g/l,海水晶15g/l,vb10.05g/l,vb60.05g/l,vb
12
0.0005g/l,115℃灭菌20min。
27.在本发明的一种实施方式中,所述斜面培养基与790by 固体培养基配方相同。
28.在本发明的一种实施方式中,所述裂殖壶菌为裂殖壶菌atcc20888,属于网粘菌门、网粘菌纲、破囊壶菌目、破囊壶菌科的一类单细胞海洋真菌。
29.在本发明的一种实施方式中,所述种子液的制备方法为:
30.(1)将菌种斜面制备菌悬液后接入种子培养基中,在28℃,200rpm培养48h,得到一
级种子液;
31.取一级种子液按照10%(v/v)的接种量接种至种子培养基中,在28℃,200rpm培养48h,得到二级种子液;
32.取二级种子液按照10%(v/v)的接种量接种至种子培养基中,在28℃,200rpm培养48h,得到种子液。
33.本发明还提供了一种低成本制备含有dha的藻油的方法,所述方法为:
34.(1)将上述培养基的ph调节至5.5~8.0,制备得到发酵培养基,所述培养基采用低成本的酒糟处理液代替传统培养基氮源胰蛋白胨,其成本经核算仅为以胰蛋白胨为氮源的传统培养基的1/3~1/2;
35.(2)将裂殖壶菌种子液添加至所述发酵培养基中进行发酵;
36.(3)采用有机溶剂对发酵结束之后的裂殖壶菌菌体进行萃取,制备得到藻油。
37.在本发明的一种实施方式中,裂殖壶菌干粉所提取的藻油中含有丰富的多不饱和脂肪酸,特别是dha的含量非常高。
38.dha,二十二碳六烯酸,俗称脑黄金,是一种对人体非常重要的多不饱和脂肪酸,属于omega-3不饱和脂肪酸家族中的重要成员。
39.在本发明的一种实施方式中,所述裂殖壶菌为裂殖壶菌atcc20888。
40.在本发明的一种实施方式中,所述裂殖壶菌种子液的制备方法如上所述。
41.在本发明的一种实施方式中,发酵培养基用1mol/l naoh调节ph至7.0,分装至500ml摇瓶中,每瓶100ml,发酵条件为28℃,200rpm,接种量10%(v/v),发酵培养5天。
42.在本发明的一种实施方式中,将发酵结束后的裂殖壶菌发酵液用离心机进行分离,放入冰箱冷冻24h,再经冷冻干燥机干燥后获得的干粉,即为裂殖壶菌干粉。
43.在本发明的一种实施方式中,藻油的制备:采用酸热破壁与正己烷提取,所述方法为:将冷冻干燥后的菌体1g转移到50ml离心管中,分别加入10ml浓盐酸和5ml去离子水,在70-80℃条件下水浴1h,期间隔10min震荡一次;冷却后加4ml无水乙醇与10ml正己烷,充分摇匀,在3000r
·
min-1
条件下离心2min,萃取油脂,收集上层正己烷层,并置于已知重量旋转瓶中,重复3次,65℃真空水浴旋转蒸发10min至正己烷完全蒸发,即得到藻油。
44.本发明还提供了一种采用上述方法制备得到的含有dha的藻油。
45.本发明还提供了上述培养基,或上述制备含有dha的藻油的方法,或上述藻油,或上述方法在制备dha或含有dha的产品中的应用。
46.在本发明的一种实施方式中,所述产品为食品、药品或保健品。
47.有益效果
48.(1)本发明的利用酒糟处理液培养裂殖壶菌的方法,以酒糟处理液为主要氮源进行发酵生产,经酒糟的浸泡、煮沸、过滤、离心、发酵培养基的配置、发酵条件的设定、裂殖壶菌收集和干燥制得裂殖壶菌干粉以及藻油的提取。
49.(2)本发明是以酒糟处理液作为主要氮源的裂殖壶菌发酵生产全新工艺,无需酶解等复杂预处理步骤,用酒糟处理液代替传统培养基中价格昂贵的胰蛋白胨和酵母粉,降低了发酵生产的成本,促进了裂殖壶菌的生长和dha积累,同时有效的解决了白酒厂废弃酒糟堆砌所导致的环境问题;很好的解决现有技术工艺所存在的高生产成本问题,实现了酒糟的高值化利用。
50.(3)本发明采用低成本的替代培养基,实现了采用裂殖壶菌高产dha的同时还进行了酒糟的资源化利用,减少环境污染,低成本高值化生产dha;所述替代培养基采用低成本的酒糟处理液代替传统培养基氮源胰蛋白胨,其成本经核算仅为以胰蛋白胨为氮源的传统培养基的1/3~1/2。
具体实施方式
51.下述实施例中所涉及的裂殖壶菌schizochytrium sp.31购于美国模式培养物集存库(american type culture collection,atcc),菌种编号atcc20888,保存于生物发酵与分离实验室。所述海水晶购自海水晶购买自浙江蓝海星盐制品有限公司,所述快速滤纸购自国药集团化学试剂公司。
52.下述实施例中所涉及的培养基如下:
53.790by 固体培养基:葡萄糖5g/l,胰蛋白胨1g/l,酵母粉1g/l,琼脂20g/l,海水晶17.5g/l,121℃灭菌20min。
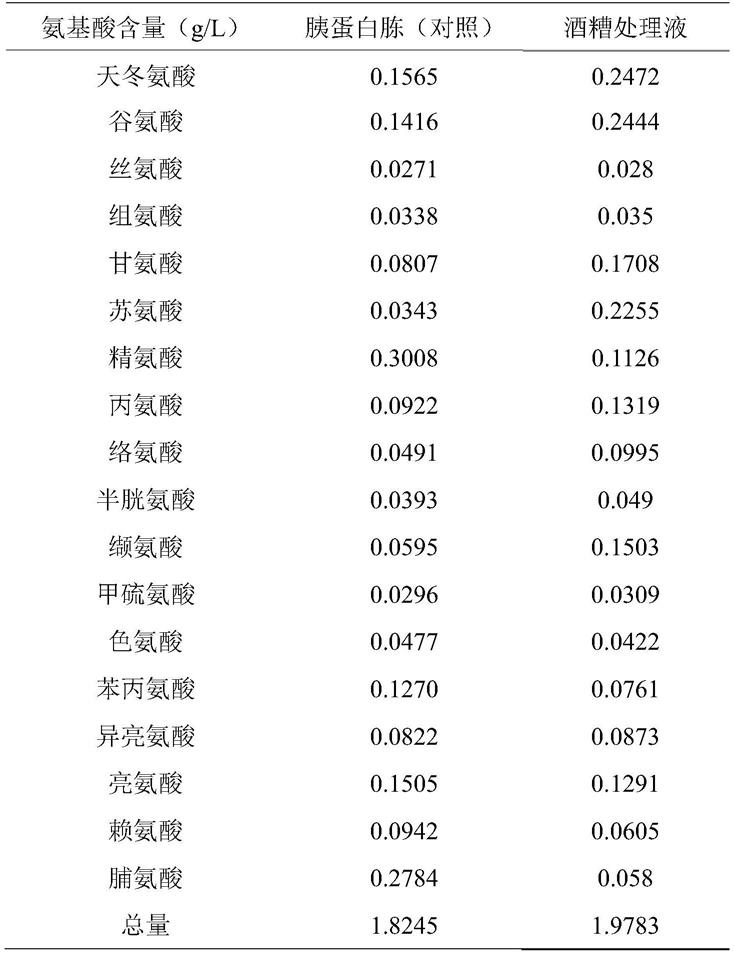
54.本发明采用酱香型白酒酒糟作为本技术的基础物料,该酒糟具有以下性质:粗蛋白含量约为20~40%,粗脂肪含量约为4~9%,游离脂肪酸含量为1.7~2.5g/l。
55.本实施例中所采用的裂殖壶菌为保藏编号atcc20888的裂殖壶菌;当然,本发明并不依赖于该保藏的特定菌种,其他裂殖壶菌亦是可适用的,选用该保藏菌种是为使实验结果可重复。
56.下述实施例中所涉及的检测方法如下:
57.菌株的生物量和dha含量的检测及计算方法:
58.生物量测定:dcw=冻干粉质量m(g)
×
1000/发酵液体积v(ml)
59.dha含量测定:气相色谱采用安捷伦hp-innowax色谱柱,柱长30m,内径0.25mm,膜厚0.25μm;程序升温起始温度为130℃,温度2min后以10℃
·
min-1
的速度升至180℃,再以4℃min-1
的速度升至240℃保持10min;气化室温度为250℃,检测器温度为250℃;设定氮气流量为30ml
·
min-1
,氢气流量为40ml
·
min-1,
,空气流量为400ml
·
min-1
。进样量为1μl,采用不分流进样。
60.氨基酸的含量的检测
61.用10%三氯乙酸将发酵液等体积稀释,使溶液体系中tca浓度为5%,双层滤纸过滤,15000rpm离心30min,将上清液用0.22μm水膜过滤后用游离氨基酸分析专用高效液相色谱仪(agilent 1100,安捷伦,美国)进行测定。
62.实施例1:酒糟处理液的制备
63.具体步骤如下:
64.1、制备酒糟处理液
65.(1)将新鲜白酒酒糟晾干,使其含水量为13%;
66.(2)向将步骤(1)得到的酒糟中添加水浸泡4h,得到酒糟溶液;其中酒糟和水的质量比为1:10;
67.(3)将步骤(2)得到的酒糟溶液加热至煮沸,并维持1~5min后,采用200目筛过滤,得到滤液,将滤液用离心机5000rpm离心3分钟后,将上清液采用快速滤纸过滤得酒糟液即为酒糟处理液。
68.2、酒糟处理液的检测:
69.通过dns分光光度法检测酒糟处理液中的可溶性糖的含量,结果几乎为0;可见:酒糟处理液不可作为碳源直接被裂殖壶菌所利用。
70.3、配置胰蛋白胨溶液:取胰蛋白胨加水配置成5.6g/l的胰蛋白胨溶液。
71.分别检测上述制备得到的酒糟处理液与5.6g/l胰蛋白胨溶液中的游离氨基酸成分,结果如表1所示。
72.表1胰蛋白胨与酒糟处理液氨基酸成分及含量对比
[0073][0074]
结果显示:酒糟处理液与胰蛋白胨溶液游离氨基酸成分相近,且天冬氨酸、谷氨酸、甘氨酸、苏氨酸等氨基酸含量均大于胰蛋白胨。所以酒糟处理液应适于作为裂殖壶菌发酵氮源。而酒糟处理液的成本远低于胰蛋白胨,大大减少了成本。
[0075]
实施例2:含有酒糟处理液的发酵培养基的制备
[0076]
具体步骤如下:
[0077]
将实施例1制备得到的酒槽处理液和去离子水按照7:3的比例配制成混合溶液,向
混合溶液中添加终浓度分别为:70g/l的葡萄糖,17.5g/l海水晶,20g/l的l-谷氨酸钠,一水,2.5g/l的磷酸二氢钾,7.2g/l的硫酸镁,12.8g/l的硫酸钠,0.4g/l的氯化钙,0.1g/l的vb1,0.1g/l的vb6,0.001g/l的vb
12
,制备得到发酵培养基。
[0078]
实施例3:采用裂殖壶菌发酵制备藻油
[0079]
利用酒糟处理液培养裂殖壶菌的方法,其是利用酒糟处理液制备的培养基发酵生产裂殖壶菌的工艺,以酒糟处理液作为氮源的来源进行发酵生产,包括以下步骤:
[0080]
下述实验所涉及到的种子培养基:
[0081]
葡萄糖30g/l,胰蛋白胨10g/l,酵母粉5g/l,海水晶15g/l,vb
1 0.05g/l,vb
6 0.05g/l,vb
12 0.0005g/l。115℃灭菌20min。
[0082]
(1)菌体活化
[0083]
将保藏于-80℃冰箱的甘油管菌种裂殖壶菌atcc20888,吸取500μl于种子培养基中,28℃,200r
·
min-1
条件下培养2d,得到培养液。将培养液采用水稀释至od
540
为0.6-0.7,取100μl涂布于790by 固体平板培养基上,28℃培养箱培养4d,挑取长出的单菌落转接至斜面培养基(790by 固体平板培养基)上28℃培养箱培养4d。
[0084]
(2)制备种子液
[0085]
将步骤(1)得到的菌种斜面制备菌悬液后,转接至种子培养基中,在28℃,200rpm培养48h,得到一级种子液;取一级种子液按照10%(v/v)的接种量接种至新的种子培养基中,在28℃,200rpm培养48h,得到二级种子液;取二级种子液按照10%(v/v)的接种量接种至新的种子培养基中,在28℃,200rpm培养48h,得到三级种子液。
[0086]
(3)发酵培养基的制备
[0087]
按照实施例1~2的方法制备酵培养基,成分为:葡萄糖70g/l,酒糟处理液70%(v/v),去离子水30%(v/v),海水晶17.5g/l,l-谷氨酸钠,一水20g/l,磷酸二氢钾2.5g/l,硫酸镁7.2g/l,硫酸钠12.8g/l,氯化钙0.4g/l,vb10.1 g/l,vb
6 0.1g/l,vb
12
0.001 g/l,115℃灭菌20min。
[0088]
其中,将维生素配成溶液后,0.22μm膜过滤,使用时添加;葡萄糖配成500g/l母液单独灭菌,使用时添加。
[0089]
将上述发酵培养基用1mol/l naoh调节ph至7.0,备用。
[0090]
(4)菌株的发酵
[0091]
将步骤(3)制备得到发酵培养基分装至500ml摇瓶中,每瓶100ml,将步骤(2)制备得到的裂殖壶菌atcc20888三级种子液按照10%(v/v)的接种量分别接种到含有100ml的发酵培养基的摇瓶中,进行发酵培养;发酵条件为28℃,200rpm,发酵培养5天,分别制备得到发酵液。
[0092]
(5)裂殖壶菌atcc20888干粉的制备方法
[0093]
分别将裂殖壶菌atcc20888发酵液用离心机进行分离,条件为:8000rpm,离心15min;过滤取沉淀,并用去离子水洗涤离心两次,制备得到裂殖壶菌atcc20888菌体;将菌体放入冰箱冷冻24h,再经冷冻干燥机干燥后获得的干粉,即为裂殖壶菌atcc20888干粉。
[0094]
(6)藻油提取
[0095]
藻油的提取是采用酸热破壁与正己烷提取法提取,具体步骤如下:
[0096]
将裂殖壶菌atcc20888干粉1g转移到50ml离心管中,分别加入10ml浓盐酸和5ml去
离子水,在70~80℃条件下水浴1h,期间隔10min震荡一次;水浴结束后将其冷却,并加入4ml无水乙醇与10ml正己烷,充分摇匀后在3000r
·
min-1
条件下离心2min,萃取油脂,收集上层正己烷层,并将其置于已知重量旋转瓶中,重复3次,65℃真空水浴旋转蒸发10min至正己烷完全蒸发,制备得到藻油,并计算重量差。
[0097]
所述重量差:藻油旋转蒸发之后在旋转瓶中,藻油和旋转瓶的总重量与已知旋转瓶的重量差就是藻油的重量。
[0098]
实施例4:采用裂殖壶菌发酵制备藻油
[0099]
具体实施方式同实施例1~3,区别在于,调整实施例3中的发酵培养基中酒糟处理液与去离子水的比例不同,具体培养基如下:
[0100]
发酵培养基中除了酒糟处理液与去离子水,其他物质的组分如下:葡萄糖70g/l,海水晶17.5g/l,l-谷氨酸钠,一水20g/l,磷酸二氢钾2.5g/l,硫酸镁7.2g/l,硫酸钠12.8g/l,氯化钙0.4g/l,vb
1 0.1g/l,vb
6 0.1g/l,vb
12
0.001 g/l;115℃灭菌20min;
[0101]
将酒糟处理液与水按照如下比例,分别配制得到发酵培养基:
[0102]
酒糟处理液40%,去离子水60%;
[0103]
酒糟处理液50%,去离子水50%;
[0104]
酒糟处理液60%,去离子水40%;
[0105]
酒糟处理液70%,去离子水30%;
[0106]
酒糟处理液80%,去离子水20%;
[0107]
酒糟处理液90%,去离子水10%;
[0108]
酒糟处理液100%,去离子水0%。
[0109]
按照实施例1~3的方法,检测发酵结束之后的生物量及生产的dha的含量,实验结果见表2所示,其中,总脂含量(%干菌)是指总脂含量占生物量的百分数。
[0110]
表2:酒糟液与水不同置换比对裂殖壶菌生长的影响
[0111][0112][0113]
结果显示,由表2可知,根据摇瓶培养实验结果,当酒糟处理液与水比为70%:30%时,生物量可达到20.67
±
0.22g/l,油脂含量8.07
±
0.15g/l,dha含量可达到2.56
±
0.12g/l,dha含量2.56
±
0.12g/l;因此;最优的酒糟处理液与水比为70%:30%。
[0114]
实施例5:采用裂殖壶菌发酵制备藻油
[0115]
具体实施方式同实施例1~3,区别在于,调整实施例2的步骤(3)中的发酵培养基的ph,分别配置了ph分别为5.5、6、6.5、7、7.5、8的发酵培养基;按照实施例2的方法将裂殖壶菌进行摇瓶培养120小时,以确定不同ph值酒糟处理液培养基对裂殖壶菌生物量和dha含
量的影响,实验结果见表3所示,其中,总脂含量(%干菌)是指总脂含量占生物量的百分数。
[0116]
表3:不同ph值酒糟处理液培养基对裂殖壶菌生物量和dha含量的影响
[0117][0118]
由表3可知,当发酵培养基的ph为7.0时效果最佳,可以确定发酵培养基的较佳配置为:葡萄糖70g/l,酒糟处理液70%,去离子水30%,l-谷氨酸钠,一水20g/l,磷酸二氢钾2.5g/l,硫酸镁7.2g/l,硫酸钠12.8g/l,氯化钙0.4g/l,海水晶17.5g/l,vb
1 0.1g/l,vb
6 0.1g/l,vb
12 0.001g/l,115℃灭菌20min。维生素配成溶液后0.22μm膜过滤,使用时添加;葡萄糖配成500g/l母液单独灭菌,使用时添加;发酵培养基用1mol/l naoh调节ph至7.0。
[0119]
当采用酒糟处理液70%,去离子水30%时的培养基时,本发明的结果为:生物量22.14g/l,总脂含量为干菌重的40.11%,总脂含量为:8.88g/l,dha含量占总脂的32.08%;
[0120]
可见,采用本发明的替代培养基,可以基本达到采用昂贵培养基的技术效果,并且,本发明还进行了酒糟的资源化利用,减少环境污染,低成本高值化生产dha。
[0121]
实施例6:采用酒糟处理液作为氮源制备海藻油
[0122]
1、具体实施方式同实施例3,按照实施例3中(1)~(4)的方法,进行裂殖壶菌atcc20888菌株的发酵;区别在于:
[0123]
设置实验组和对照组:
[0124]
对照组:采用胰蛋白胨为氮源;即,将发酵培养基调整为:葡萄糖70g/l,胰蛋白胨5.6g/l,海水晶17.5g/l,l-谷氨酸钠,一水20g/l,磷酸二氢钾2.5g/l,硫酸镁7.2g/l,硫酸钠12.8g/l,氯化钙0.4g/l,vb10.1 g/l,vb
6 0.1g/l,vb
12
0.001 g/l;115℃灭菌20min;进行裂殖壶菌atcc20888菌株的发酵。
[0125]
实验组:完全按照实施例3的方法进行裂殖壶菌atcc20888菌株的发酵。
[0126]
分别检测实验组和对照组在发酵前后发酵液游离氨基酸含量对比,结果如表4所示。
[0127]
表4酒糟液培养裂殖壶菌发酵前后发酵液游离氨基酸含量对比
[0128][0129][0130]
结果显示:酒糟处理液培养基与胰蛋白胨对照组培养基发酵前后氨基酸消耗情况大致相近,再次说明了酒糟处理液作为培养基氮源发酵培养裂殖壶菌的可行性。
[0131]
2、采用裂殖壶菌发酵制备藻油的成本核算
[0132]
目前oxoid胰蛋白胨的单价是470元/kg,假设酒糟运输路程为200公里,运输成本0.15元/(km
·
t),考虑酒糟处理液的制作成本包括水费3元/t、电费1元/(kw
·
h)、仪器损耗50元/d及劳动力费用约160元/kg,其成本经核算只有通常普通培养基(含大量葡萄糖、胰蛋白胨等的传统培养基)的1/3~1/2,在成本上具有巨大的优势。
[0133]
综上所述,本发明所采用的酒糟处理液价格低廉,酒糟处理所需成本低,生产工艺简单。
[0134]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。